-
 "시신경척수염 신약, 건강보험 급여화 절실하다"김지은 교수. [데일리팜=어윤호 기자] 오프라벨(Off lable). 의악품을 식약처가 허가한 용도 외 적응증에 처방하는 행위를 말한다. 일반적으로 약의 쓰임새를 보건당국이 정해 놓았는데, 왜 오프라벨이 필요한지 의문이 생길 수 있다.하지만 이 같은 오프라벨 처방에 보험급여까지 적용되는 질환 영역이 있다. 바로 시신경척수염스펙트럼장애(NMOSD, Neuromyelitis Optica Spectrum Disorder Aggravate)다. 현재 시신경척수염에는 1차 유지치료에 면역억제제 '아자치오프린'을 쓰고, 아자치오프린 치료 실패 뒤 2차 치료제로 '마이코페놀레이트'나 '맙테라(리툭시맙)'을 급여 처방하고 있는데, 마이코페놀레이트와 리툭시맙은 시신경척수염 적응증이 없는 오프라벨 약제다.원인은 간단하다. 이들 약제는 시신경척수염에 대한 임상 연구를 통해 정식으로 적응증을 획득하진 못했지만, 기전상 추측되는 효능과 오랜 기간 축적된 처방 경험을 통해 유효성이 확인됐다고 인정된 것이다.그런데, 시신경척수염 영역에는 더 기이한 상황이 존재한다. 3상 임상을 통해 그 유효성을 확인하고 정식 허가된 신약들은 급여가 인정되지 않고 있다. 오프라벨 약제는 급여, 온라벨 약제는 비급여인 셈이다.김지은 대한신경면역학회 보험이사(이대서울병원 신경과 교수)를 만나, 시신경척수염의 현 치료환경과 신약의 필요성에 대해 들어 봤다.-시신경척수염 범주질환 치료에 사용되는 약제는 오프라벨 약제로 알고 있다. 이들 약제 사용에 부작용은 없는지, 어떤 특징이 있는지 궁금하다.=물론 필요한 약들인 것은 틀림없다. 다만 체계화 한 임상연구를 바탕으로 해당 질환에서의 효과와 안전성이 입증된 약제가 아닌 만큼, 부작용이나 효과 면에서 우려가 있다.특히 1차 치료제인 아자티오프린은 골수 억제, 간 수치 상승, 장기 사용 시 암 발병률 상승 등의 부작용 위험과 함께 재발을 막는 효과가 타 약제와 비교할 때 낮다는 보고가 많다. 실제로 아자티오프린을 사용한 환자 약 50%가 치료 시작 18개월만에 부작용으로 인해 치료를 중단했고 이 중 15%는 재발 등 효과 부족, 62%는 약 부작용 때문인 것으로 나타났다.현 국내 급여 기준을 따를 때, 1차, 2차 약제에서도 재발을 겪는 경우에는 리툭시맙을 3차 약제로 사용한다. 리툭시맙의 경우 오프라벨이지만 다른 약제에 비해 재발 방지 효과가 좋고, 효과와 안전성 면에서 우수하여 중증도가 심한 일부 환자에서는 1,2차 약제를 건너뛰고 바로 투여하는 경우가 점점 늘고 있다. 해외 일부 국가에서는 리툭시맙을 1차 치료제로 사용 가능한 곳도 있다.-리툭시맙의 효과가 나쁘지 않은 상황인데, 그럼에도 신약이 필요한 것인가?=기존 약제 대비해 우수하다는 것이지 리툭시맙을 사용했음에도 여전히 재발을 겪는 환자들이 있어 이들을 위한 신약은 필요하다. 약 10%의 환자가 리툭시맙을 사용했음에도 재발을 겪는 것으로 보고되고 있는데, 신약의 접근성이 떨어지다 보니 이 환자들은 재발을 겪어도 기존 치료를 유지할 수밖에 없는 상황이다.신약으로는 시신경척수염 병리의 주요 염증 면역 반응 표적에 직접적으로 작용하는 단클론항체인 '솔리리스(에쿨리주맙), '엔스프링(사트랄리주맙)', '업리즈나(이네빌리주맙)' 등이 있다. 이중 일부는 현재 급여 적용을 위한 절차를 밟고 있다.에쿨리주맙은 보체억제제, 사트랄리주맙은 인터루킨-6수용체억제제로 다른 기전을 갖고 있어 기존 약제에서 재발이 생기는 환자들이 소외되지 않고 치료의 기회를 가질 수 있는 약제다. 특히 이 신약들은 기존 약제 대비 효과가 매우 우수한데, 에쿨리주맙의 경우, 재발 위험을 94%까지 낮춘 것을 확인했다.이 같은 신약이 등장한 지 수년이 지났고, 해외에서는 이미 활발히 처방되고 있지만 국내는 여전히 급여 논의 중에 있어 관련 전문가, 학회 뿐만 아니라 실제 임상에서 환자들도 신약이 최대한 빠르게 임상에서 도입될 수 있기를 바라고 있다.-언급한 약들 중 솔리리스와 엔스프링이 급여 절차를 밟고 있다. 하지만 급여 기준을 놓고 제약사와 정부 간 이견이 있어, 논의가 쉽지 않은 것으로 안다. 현재 쓸 수 있는 약들을 모두 처방한 후 가장 뒷 단(4차 이상)에 한해 급여를 인정하는 방향이다.=의료진 입장에서 간절한 것은 먼저 치료 옵션이 없는 환자에게 새로운 치료 옵션을 제공하는 것이고, 그 다음은 비가역적인 재발을 막을 수 있는 최선의 치료 옵션이 마련되는 것이다. 다만 신약들이 다소 비용이 높아, 사회적 비용을 고려했을 때, 리툭시맙 치료에 실패한 환자들에게라도 시급한 급여 적용이 필요하다고 생각한다.-약이 고가고 비급여 상태가 지속되면서, 해당 약물들의 시판후조사(PMS) 만료기간도 점점 다가오고 있다. 규정상 PMS를 완료하지 못하면 허가가 취하된다.=이 신약들은 들어와도 그만, 안 들어와도 그만인 약이 아니다. 이전에는 진단이 안되던 병이었으나 항 아쿠아포린-4 항체 검사 등을 통해 진단이 가능해지면서, 약제를 통해 장애를 줄일 수 있는 치료가 가능해졌다. 하루빨리 약제의 접근성이 개선되어 필요한 환자들이 치료받을 수 있길 바란다.-학회 차원에서 정부에 의견을 내신 적이 있는가?=학회에서도 신속하게 대안 옵션이 마련될 수 있도록 여러 차례 신약에 대한 의견서를 제출했고 지속적으로 관심을 갖고 있다.적은 수의 환자라도 꼭 필요한 환자들에게 치료 옵션을 제공할 수 있도록 급여가 빠르게 이뤄졌으면 좋겠다. 또한 이 질환 자체가 환자의 삶에 미치는 영향이 매우 크다. 또한 환자에 맞는 맞춤형 진료가 가능한 환경이 조성될 수 있도록 다양한 기전을 타깃으로 하는 다양한 신약들이 조속히 임상에서 사용 가능해지기를 바란다.2023-09-19 06:00:14어윤호
"시신경척수염 신약, 건강보험 급여화 절실하다"김지은 교수. [데일리팜=어윤호 기자] 오프라벨(Off lable). 의악품을 식약처가 허가한 용도 외 적응증에 처방하는 행위를 말한다. 일반적으로 약의 쓰임새를 보건당국이 정해 놓았는데, 왜 오프라벨이 필요한지 의문이 생길 수 있다.하지만 이 같은 오프라벨 처방에 보험급여까지 적용되는 질환 영역이 있다. 바로 시신경척수염스펙트럼장애(NMOSD, Neuromyelitis Optica Spectrum Disorder Aggravate)다. 현재 시신경척수염에는 1차 유지치료에 면역억제제 '아자치오프린'을 쓰고, 아자치오프린 치료 실패 뒤 2차 치료제로 '마이코페놀레이트'나 '맙테라(리툭시맙)'을 급여 처방하고 있는데, 마이코페놀레이트와 리툭시맙은 시신경척수염 적응증이 없는 오프라벨 약제다.원인은 간단하다. 이들 약제는 시신경척수염에 대한 임상 연구를 통해 정식으로 적응증을 획득하진 못했지만, 기전상 추측되는 효능과 오랜 기간 축적된 처방 경험을 통해 유효성이 확인됐다고 인정된 것이다.그런데, 시신경척수염 영역에는 더 기이한 상황이 존재한다. 3상 임상을 통해 그 유효성을 확인하고 정식 허가된 신약들은 급여가 인정되지 않고 있다. 오프라벨 약제는 급여, 온라벨 약제는 비급여인 셈이다.김지은 대한신경면역학회 보험이사(이대서울병원 신경과 교수)를 만나, 시신경척수염의 현 치료환경과 신약의 필요성에 대해 들어 봤다.-시신경척수염 범주질환 치료에 사용되는 약제는 오프라벨 약제로 알고 있다. 이들 약제 사용에 부작용은 없는지, 어떤 특징이 있는지 궁금하다.=물론 필요한 약들인 것은 틀림없다. 다만 체계화 한 임상연구를 바탕으로 해당 질환에서의 효과와 안전성이 입증된 약제가 아닌 만큼, 부작용이나 효과 면에서 우려가 있다.특히 1차 치료제인 아자티오프린은 골수 억제, 간 수치 상승, 장기 사용 시 암 발병률 상승 등의 부작용 위험과 함께 재발을 막는 효과가 타 약제와 비교할 때 낮다는 보고가 많다. 실제로 아자티오프린을 사용한 환자 약 50%가 치료 시작 18개월만에 부작용으로 인해 치료를 중단했고 이 중 15%는 재발 등 효과 부족, 62%는 약 부작용 때문인 것으로 나타났다.현 국내 급여 기준을 따를 때, 1차, 2차 약제에서도 재발을 겪는 경우에는 리툭시맙을 3차 약제로 사용한다. 리툭시맙의 경우 오프라벨이지만 다른 약제에 비해 재발 방지 효과가 좋고, 효과와 안전성 면에서 우수하여 중증도가 심한 일부 환자에서는 1,2차 약제를 건너뛰고 바로 투여하는 경우가 점점 늘고 있다. 해외 일부 국가에서는 리툭시맙을 1차 치료제로 사용 가능한 곳도 있다.-리툭시맙의 효과가 나쁘지 않은 상황인데, 그럼에도 신약이 필요한 것인가?=기존 약제 대비해 우수하다는 것이지 리툭시맙을 사용했음에도 여전히 재발을 겪는 환자들이 있어 이들을 위한 신약은 필요하다. 약 10%의 환자가 리툭시맙을 사용했음에도 재발을 겪는 것으로 보고되고 있는데, 신약의 접근성이 떨어지다 보니 이 환자들은 재발을 겪어도 기존 치료를 유지할 수밖에 없는 상황이다.신약으로는 시신경척수염 병리의 주요 염증 면역 반응 표적에 직접적으로 작용하는 단클론항체인 '솔리리스(에쿨리주맙), '엔스프링(사트랄리주맙)', '업리즈나(이네빌리주맙)' 등이 있다. 이중 일부는 현재 급여 적용을 위한 절차를 밟고 있다.에쿨리주맙은 보체억제제, 사트랄리주맙은 인터루킨-6수용체억제제로 다른 기전을 갖고 있어 기존 약제에서 재발이 생기는 환자들이 소외되지 않고 치료의 기회를 가질 수 있는 약제다. 특히 이 신약들은 기존 약제 대비 효과가 매우 우수한데, 에쿨리주맙의 경우, 재발 위험을 94%까지 낮춘 것을 확인했다.이 같은 신약이 등장한 지 수년이 지났고, 해외에서는 이미 활발히 처방되고 있지만 국내는 여전히 급여 논의 중에 있어 관련 전문가, 학회 뿐만 아니라 실제 임상에서 환자들도 신약이 최대한 빠르게 임상에서 도입될 수 있기를 바라고 있다.-언급한 약들 중 솔리리스와 엔스프링이 급여 절차를 밟고 있다. 하지만 급여 기준을 놓고 제약사와 정부 간 이견이 있어, 논의가 쉽지 않은 것으로 안다. 현재 쓸 수 있는 약들을 모두 처방한 후 가장 뒷 단(4차 이상)에 한해 급여를 인정하는 방향이다.=의료진 입장에서 간절한 것은 먼저 치료 옵션이 없는 환자에게 새로운 치료 옵션을 제공하는 것이고, 그 다음은 비가역적인 재발을 막을 수 있는 최선의 치료 옵션이 마련되는 것이다. 다만 신약들이 다소 비용이 높아, 사회적 비용을 고려했을 때, 리툭시맙 치료에 실패한 환자들에게라도 시급한 급여 적용이 필요하다고 생각한다.-약이 고가고 비급여 상태가 지속되면서, 해당 약물들의 시판후조사(PMS) 만료기간도 점점 다가오고 있다. 규정상 PMS를 완료하지 못하면 허가가 취하된다.=이 신약들은 들어와도 그만, 안 들어와도 그만인 약이 아니다. 이전에는 진단이 안되던 병이었으나 항 아쿠아포린-4 항체 검사 등을 통해 진단이 가능해지면서, 약제를 통해 장애를 줄일 수 있는 치료가 가능해졌다. 하루빨리 약제의 접근성이 개선되어 필요한 환자들이 치료받을 수 있길 바란다.-학회 차원에서 정부에 의견을 내신 적이 있는가?=학회에서도 신속하게 대안 옵션이 마련될 수 있도록 여러 차례 신약에 대한 의견서를 제출했고 지속적으로 관심을 갖고 있다.적은 수의 환자라도 꼭 필요한 환자들에게 치료 옵션을 제공할 수 있도록 급여가 빠르게 이뤄졌으면 좋겠다. 또한 이 질환 자체가 환자의 삶에 미치는 영향이 매우 크다. 또한 환자에 맞는 맞춤형 진료가 가능한 환경이 조성될 수 있도록 다양한 기전을 타깃으로 하는 다양한 신약들이 조속히 임상에서 사용 가능해지기를 바란다.2023-09-19 06:00:14어윤호 -
 시믹-넥셀, 日서 iPS 세포 관련 심포지엄…최신 기술 공유[데일리팜=이탁순 기자] 시믹코리아는 인간유도만능줄기세포(hiPSC) 유래 2D 및 오가노이드 전문 기업 넥셀이 지난 6일 시믹홀딩스(이하 시믹) 본사에서 iPS 세포에 관한 심포지엄을 개최했다고 11일 밝혔다.시믹과 넥셀은 지난달 29일 전략적 투자 및 사업 제휴 계약을 체결한 바 있다. 시믹은 일본 최대 임상시험수탁회사(CRO)다.시믹은 일본 시장에서 넥셀의 hiPSC 유래 각종 사업을 지원하고 신약개발도 협력해 나가기로 했다. 또 iPS 세포 기술에 대해 국내외에서 보다 깊게 논의할 필요성이 있음을 인식해 향후 양사가 주최하는 공동 심포지엄을 교차 개최하기로 했다는 설명이다.6일 개최된 심포지엄에서는 'iPS 세포: 기술과 치료의 최전선'이라는 주제로 iPS 세포 기술의 최신 동향과 윤리 및 hiPSC 활용 가이드 라인과 표준화의 두 가지 세션으로 구성해 양사가 추천한 해당 분야 전문가들이 발표를 진행했다.교토 대학 iPS 세포 연구소의 에토 히로유키 교수와 후지타 미사오 교수, 영국 글래스고 대학의 갓프리 스미스 교수, 일본 국립 의약품 식품 위생 연구소의 이사다 야스나리 교수가 발표장에 나섰다. 나카무라 카즈오 시믹 CEO와 한충성 넥셀 대표이사도 참석해 경청했다.넥셀 측은 시믹과의 제휴로 hiPSC 종주국인 일본 시장에서 적극적인 사업 및 매출 상승이 기대된다며 hiPSC 유래 2D 및 오가노이드 기술력의 지속적인 발전을 도모하겠다고 밝혔다. 넥셀은 지난 8월 코스닥 사장을 위한 기술성 평가를 신청한 국내 바이오벤처 회사다.2023-09-18 09:09:39이탁순
시믹-넥셀, 日서 iPS 세포 관련 심포지엄…최신 기술 공유[데일리팜=이탁순 기자] 시믹코리아는 인간유도만능줄기세포(hiPSC) 유래 2D 및 오가노이드 전문 기업 넥셀이 지난 6일 시믹홀딩스(이하 시믹) 본사에서 iPS 세포에 관한 심포지엄을 개최했다고 11일 밝혔다.시믹과 넥셀은 지난달 29일 전략적 투자 및 사업 제휴 계약을 체결한 바 있다. 시믹은 일본 최대 임상시험수탁회사(CRO)다.시믹은 일본 시장에서 넥셀의 hiPSC 유래 각종 사업을 지원하고 신약개발도 협력해 나가기로 했다. 또 iPS 세포 기술에 대해 국내외에서 보다 깊게 논의할 필요성이 있음을 인식해 향후 양사가 주최하는 공동 심포지엄을 교차 개최하기로 했다는 설명이다.6일 개최된 심포지엄에서는 'iPS 세포: 기술과 치료의 최전선'이라는 주제로 iPS 세포 기술의 최신 동향과 윤리 및 hiPSC 활용 가이드 라인과 표준화의 두 가지 세션으로 구성해 양사가 추천한 해당 분야 전문가들이 발표를 진행했다.교토 대학 iPS 세포 연구소의 에토 히로유키 교수와 후지타 미사오 교수, 영국 글래스고 대학의 갓프리 스미스 교수, 일본 국립 의약품 식품 위생 연구소의 이사다 야스나리 교수가 발표장에 나섰다. 나카무라 카즈오 시믹 CEO와 한충성 넥셀 대표이사도 참석해 경청했다.넥셀 측은 시믹과의 제휴로 hiPSC 종주국인 일본 시장에서 적극적인 사업 및 매출 상승이 기대된다며 hiPSC 유래 2D 및 오가노이드 기술력의 지속적인 발전을 도모하겠다고 밝혔다. 넥셀은 지난 8월 코스닥 사장을 위한 기술성 평가를 신청한 국내 바이오벤처 회사다.2023-09-18 09:09:39이탁순 -
 습성 황반변성치료제 '바비스모' 10월 급여 등재 유력[데일리팜=어윤호 기자] 황반변성치료제 '바비스모'의 10월부 보험급여 등재가 예상된다.관련 업계에 따르면 한국로슈의 이중특이항체(Bispecific antibody) 약물 바비스모(파리시맙)가 국민건강보험공단과 약가협상을 최근 타결했다. 건강보험정책심의위원회만 통과하게 되면 바로 급여 적용이 가능한 상황이다.올해 1월 국내 승인된 바비스모는 7월 건강보험심사평가원 약제급여평가위원회를 통과했으며 곧바로 약가협상에 돌입, 허가 약 8개월 만에 급여 절차를 사실상 마무리했다.습성 연령관련 황반변성(nAMD, neovascular or wet age-related macular degeneration) 치료 및 당뇨병성 황반부종(DME, Diabetic macular edema)에 의한 시력 손상 치료제로 허가된 바비스모는 주요 질환 발병 경로인 혈관내피성장인자-A(VEGF-A)와 안지오포이에틴-2(Ang-2)를 모두 표적하는 차별화된 기전의 신약이다.또한 새로운 기전을 토대로 허가 임상연구를 통해 4개월(16주) 간격의 투여를 가능하게 한 최초의 안구 내 주사제로 적은 횟수의 주사 투여로 환자의 치료 부담을 줄여줄 수 있다.바비스모는 권장 용량 6mg(0.05ml)을 첫 4회 투여 시 매월(4주) 1회 유리체 내 주사 투여한다. 이후 질병 활성이 없는 신생혈관성(습성) 연령관련 황반변성(nAMD) 환자는 4개월(16주)마다 1회씩 투여한다. 당뇨병성 황반부종(DME) 환자에서는 의료진의 판단에 따라 투여 간격을 4주 단위로 증가하여 최대 4개월(16주)까지 연장할 수 있다.이 약은 습성 연령관련 황반변성(nAMD) 치료 관련 임상연구 TENAYA 및 LUCERNE와 당뇨병성 황반부종(DME) 치료 관련 임상연구 YOSEMITE, RHINE 연구 등 총 4건의 3상 연구를 통해 유효성을 입증했다.이중 TENAYA와 LUCERNE 연구는 습성 연령관련 황반변성(nAMD) 치료에서 바비스모와 '아일리아(애플리버셉트)'와 비교한 비열등성 임상이다. 연구 결과, 치료 1년 차에 최대 4개월(16주) 간격의 바비스모 치료는 2개월(8주) 간격의 아일리아와 치료와 비열등한 수준의 시력개선 효과를 보였다.특히 치료 1년 차에 바비스모 투여군의 약 80%가 3개월(12주) 이상의 투여 간격을 유지했다. 최근 발표된 치료 2년 차 결과에서는 60% 이상의 환자들이 4개월(16주)의 투여 간격을 유지한 것으로 나타나, 환자들에게 지속적인 임상 혜택을 제공할 것으로 기대를 모았다. 한편 습성 연령관련 황반변성 및 당뇨병성 황반부종은 전 세계적으로 4000만 명 이상이 앓고 있는 시력 저하의 주요한 원인 질환이다. 습성 연령관련 황반변성 및 당뇨병성 황반부종 환자에게 혈관 누출이 발생해 황반에 축적되면, 안구 뒤쪽에 부종이 생기면서 시력 손상 등이 발생할 수 있다.2023-09-16 06:32:59어윤호
습성 황반변성치료제 '바비스모' 10월 급여 등재 유력[데일리팜=어윤호 기자] 황반변성치료제 '바비스모'의 10월부 보험급여 등재가 예상된다.관련 업계에 따르면 한국로슈의 이중특이항체(Bispecific antibody) 약물 바비스모(파리시맙)가 국민건강보험공단과 약가협상을 최근 타결했다. 건강보험정책심의위원회만 통과하게 되면 바로 급여 적용이 가능한 상황이다.올해 1월 국내 승인된 바비스모는 7월 건강보험심사평가원 약제급여평가위원회를 통과했으며 곧바로 약가협상에 돌입, 허가 약 8개월 만에 급여 절차를 사실상 마무리했다.습성 연령관련 황반변성(nAMD, neovascular or wet age-related macular degeneration) 치료 및 당뇨병성 황반부종(DME, Diabetic macular edema)에 의한 시력 손상 치료제로 허가된 바비스모는 주요 질환 발병 경로인 혈관내피성장인자-A(VEGF-A)와 안지오포이에틴-2(Ang-2)를 모두 표적하는 차별화된 기전의 신약이다.또한 새로운 기전을 토대로 허가 임상연구를 통해 4개월(16주) 간격의 투여를 가능하게 한 최초의 안구 내 주사제로 적은 횟수의 주사 투여로 환자의 치료 부담을 줄여줄 수 있다.바비스모는 권장 용량 6mg(0.05ml)을 첫 4회 투여 시 매월(4주) 1회 유리체 내 주사 투여한다. 이후 질병 활성이 없는 신생혈관성(습성) 연령관련 황반변성(nAMD) 환자는 4개월(16주)마다 1회씩 투여한다. 당뇨병성 황반부종(DME) 환자에서는 의료진의 판단에 따라 투여 간격을 4주 단위로 증가하여 최대 4개월(16주)까지 연장할 수 있다.이 약은 습성 연령관련 황반변성(nAMD) 치료 관련 임상연구 TENAYA 및 LUCERNE와 당뇨병성 황반부종(DME) 치료 관련 임상연구 YOSEMITE, RHINE 연구 등 총 4건의 3상 연구를 통해 유효성을 입증했다.이중 TENAYA와 LUCERNE 연구는 습성 연령관련 황반변성(nAMD) 치료에서 바비스모와 '아일리아(애플리버셉트)'와 비교한 비열등성 임상이다. 연구 결과, 치료 1년 차에 최대 4개월(16주) 간격의 바비스모 치료는 2개월(8주) 간격의 아일리아와 치료와 비열등한 수준의 시력개선 효과를 보였다.특히 치료 1년 차에 바비스모 투여군의 약 80%가 3개월(12주) 이상의 투여 간격을 유지했다. 최근 발표된 치료 2년 차 결과에서는 60% 이상의 환자들이 4개월(16주)의 투여 간격을 유지한 것으로 나타나, 환자들에게 지속적인 임상 혜택을 제공할 것으로 기대를 모았다. 한편 습성 연령관련 황반변성 및 당뇨병성 황반부종은 전 세계적으로 4000만 명 이상이 앓고 있는 시력 저하의 주요한 원인 질환이다. 습성 연령관련 황반변성 및 당뇨병성 황반부종 환자에게 혈관 누출이 발생해 황반에 축적되면, 안구 뒤쪽에 부종이 생기면서 시력 손상 등이 발생할 수 있다.2023-09-16 06:32:59어윤호 -
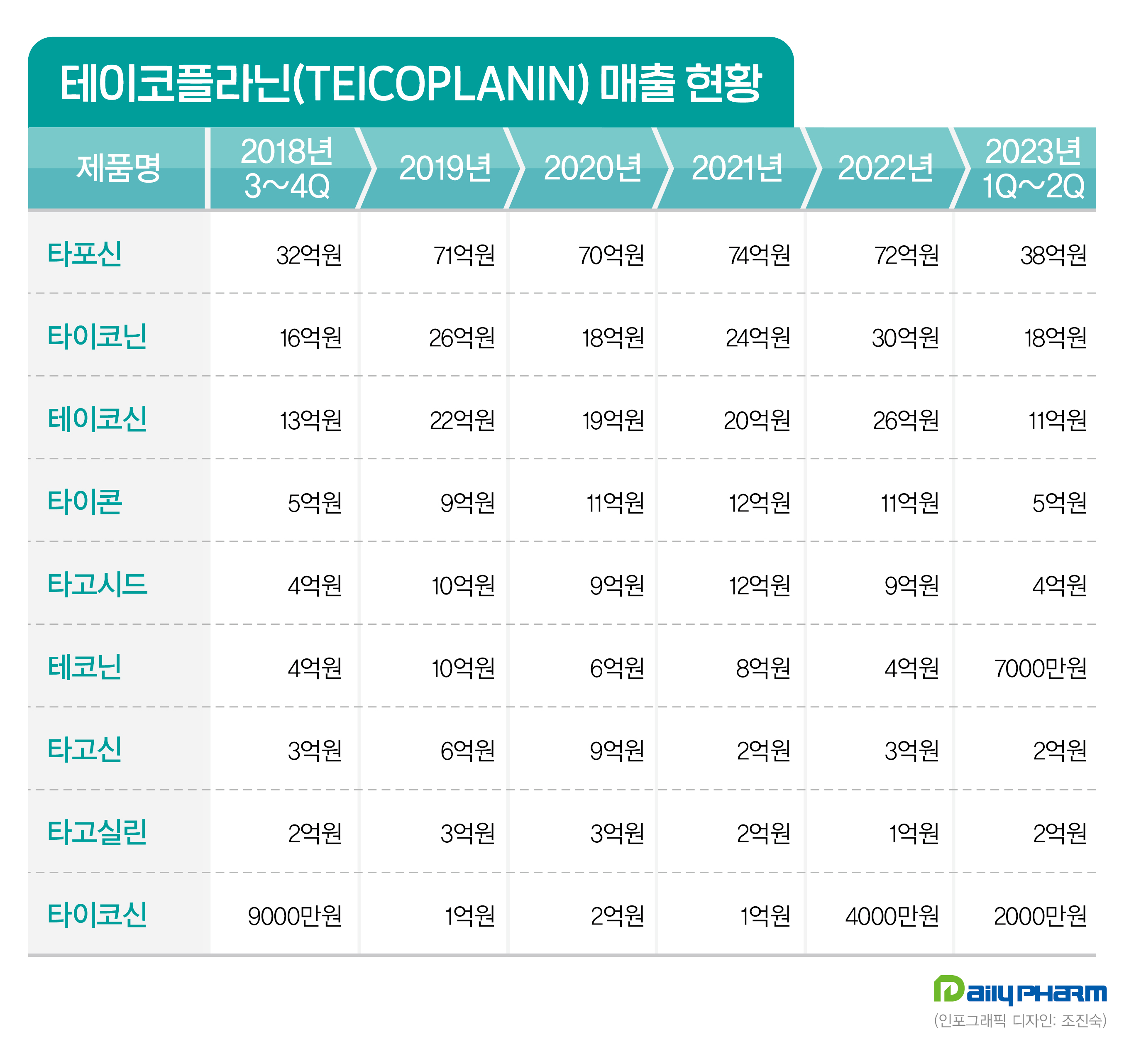 그람양성 항생제 500억 매출 기대...이노엔, 시장 리딩[데일리팜=노병철 기자] HK이노엔이 380억원 외형을 형성하고 있는 그람양성 항생제 시장에서 부동의 1위를 달리고 있다.의약품 유통 실적 기준, 그람양성 항생제 시장 양대산맥을 형성하고 있는 성분은 테이코플라닌·반코마이신으로 지난해 각각 156억·223억원 상당의 매출을 기록했다.올해 상반기까지 실적은 80억·112억원으로 500억원대 돌파가 유력시 된다.2022년 기준 테이코플라닌 성분 1·2·3위 제품은 HK이노엔 타포신주·이연제약 타이코닌주·일동제약 테이코닌주로 각각 72억·29억·25억원을 달성했다.같은 기간 동안 동국제약 타이콘주·사노피아벤티스 타고시드주·명문제약 테코닌주는 11억·9억·4억의 매출을 올렸다.성장률 측면에서는 1위인 타이포신과 2위 제품인 이연제약 타이코닌 모두 안정적 우상향 곡선을 띠고 있다.타포신의 2019·2020·2021·2022년 실적은 71억·70억·74억·72억원을, 타이코닌은 25억·17억·23억·29억원을 기록했다.올해 상반기 2개 제품의 실적은 38억·18억원으로 지난해 대비 10% 안팎의 성장이 기대된다. 반코마이신 성분 항생제 제품 1·2·3위는 HK이노엔 이노엔반코마이신주·펜믹스 반코신시피주·한국유나이티드제약 반코진캡슐로 지난해 61억·58억·44억원의 외형을 올렸다.올 상반기 실적은 각각 34억·21억·27억원 정도를 형성하고 있다.삼진제약 하노마이신·유케이케미팜 반코키트주·비씨월드제약 비씨반코마이신주의 2022년 매출은 23억·14억·7억4000만원으로 4·5·6위에 랭크됐다.에이트로젠 반코트린주·삼성제약 삼성반코마이신주의 2019·2020·2021·2022년 매출은 각각 '1억7000만원·1억5000만원·1억5000만원·1억5000만원' '2억1000만원·1억5000만원·1억6000만원·400만원'으로 하위권 실적을 보였다.이중 삼성제약 삼성반코마이신주는 올해 상반기부터 실적이 잡히지 않고 있다.테이코플라닌제제 유효균종은 그람양성균 중 황색포도구균·코리네박테리아·노르카디아 아스트로이드 등이다.적응증은 피부 감염증·폐렴·복합요로감염·심내막염·복막염 등에 사용되며, 메르스 코로나바이러스와 코로나19 감염 시 단독 또는 병용처방이 인정되는 약제다.반코마이신염산염 유효균종은 연쇄구균·포도구균·디프테로이드균·클로스트리듐 등이 대표적이다.이 성분은 페니실린계·세팔로스포린계 항생물질로 치료가 되지 않는 중증 감염증에 사용되며 심내막염·골수염·복막염·폐렴·패혈증·표재성 2차 감염증 등에 효능을 발현한다.2023-09-14 06:20:02노병철
그람양성 항생제 500억 매출 기대...이노엔, 시장 리딩[데일리팜=노병철 기자] HK이노엔이 380억원 외형을 형성하고 있는 그람양성 항생제 시장에서 부동의 1위를 달리고 있다.의약품 유통 실적 기준, 그람양성 항생제 시장 양대산맥을 형성하고 있는 성분은 테이코플라닌·반코마이신으로 지난해 각각 156억·223억원 상당의 매출을 기록했다.올해 상반기까지 실적은 80억·112억원으로 500억원대 돌파가 유력시 된다.2022년 기준 테이코플라닌 성분 1·2·3위 제품은 HK이노엔 타포신주·이연제약 타이코닌주·일동제약 테이코닌주로 각각 72억·29억·25억원을 달성했다.같은 기간 동안 동국제약 타이콘주·사노피아벤티스 타고시드주·명문제약 테코닌주는 11억·9억·4억의 매출을 올렸다.성장률 측면에서는 1위인 타이포신과 2위 제품인 이연제약 타이코닌 모두 안정적 우상향 곡선을 띠고 있다.타포신의 2019·2020·2021·2022년 실적은 71억·70억·74억·72억원을, 타이코닌은 25억·17억·23억·29억원을 기록했다.올해 상반기 2개 제품의 실적은 38억·18억원으로 지난해 대비 10% 안팎의 성장이 기대된다. 반코마이신 성분 항생제 제품 1·2·3위는 HK이노엔 이노엔반코마이신주·펜믹스 반코신시피주·한국유나이티드제약 반코진캡슐로 지난해 61억·58억·44억원의 외형을 올렸다.올 상반기 실적은 각각 34억·21억·27억원 정도를 형성하고 있다.삼진제약 하노마이신·유케이케미팜 반코키트주·비씨월드제약 비씨반코마이신주의 2022년 매출은 23억·14억·7억4000만원으로 4·5·6위에 랭크됐다.에이트로젠 반코트린주·삼성제약 삼성반코마이신주의 2019·2020·2021·2022년 매출은 각각 '1억7000만원·1억5000만원·1억5000만원·1억5000만원' '2억1000만원·1억5000만원·1억6000만원·400만원'으로 하위권 실적을 보였다.이중 삼성제약 삼성반코마이신주는 올해 상반기부터 실적이 잡히지 않고 있다.테이코플라닌제제 유효균종은 그람양성균 중 황색포도구균·코리네박테리아·노르카디아 아스트로이드 등이다.적응증은 피부 감염증·폐렴·복합요로감염·심내막염·복막염 등에 사용되며, 메르스 코로나바이러스와 코로나19 감염 시 단독 또는 병용처방이 인정되는 약제다.반코마이신염산염 유효균종은 연쇄구균·포도구균·디프테로이드균·클로스트리듐 등이 대표적이다.이 성분은 페니실린계·세팔로스포린계 항생물질로 치료가 되지 않는 중증 감염증에 사용되며 심내막염·골수염·복막염·폐렴·패혈증·표재성 2차 감염증 등에 효능을 발현한다.2023-09-14 06:20:02노병철 -
 SMA치료제 '스핀라자·에브리스디' 약가협상 동시 타결[데일리팜=어윤호 기자] 척수성근위축증치료제(SMA, Spinal Muscular Atrophy) '스핀라자'와 '에브리스디'가 보험급여 적용 마지막 관문을 넘어섰다.관련 업계에 따르면 바이오젠코리아 스핀라자(뉴시너센)와 한국로슈 에브리스디(리스디플람)가 최근 국민건강보험공단과 약가협상을 최종 타결했다. 스핀라자는 급여 확대, 에브리스디는 신규 등재다.이로써 두 약물은 이변이 없는 이상, 내달(10월)부터 보장성이 확대될 것으로 예상된다.스핀라자의 현 급여기준은 ▲5q SMN-1 유전자의 결손 또는 변이의 유전자적 진단 ▲만 3세 이하에 SMA 관련 임상 증상과 징후 발현 ▲영구적 인공 호흡기를 사용하고 있지 않는 경우 등을 모두 만족하는 5q 척수성 근위축증 환자다.즉 3세 이하에 징후가 발견돼야 급여 처방이 가능했던 것인데, 이번에 논의된 스핀라자의 급여 확대 기준은 '18세 이하'로 그 대상을 확대하는 것이다.에브리스디의 경우 경구제 옵션으로 스핀라자의 급여기준과 동일하게 급여목록에 이름을 올리게 된다.한편 애초 SMA치료제의 급여 및 급여 확대 논의는 스핀라자의 급여 중단 기준 폐지를 촉구하는 움직임이 거세지면서 급물살을 타는 듯 했지만 특정 단체에서 정부와 제약사의 예측보다 더 큰 범위의 급여 적용이 촉구되면서 되레 논의가 길어졌다.당시 정부는 스핀라자의 급여 확대 기준에 대한 합의 이후 에브리스디의 등재 논의도 진행하겠다고 의사를 밝혔고 천신만고 끝에 두 약제 모두 최종 협상에 돌입했으며 한차례 협상 지연 결정이 내려진 바 있다.2023-09-14 06:00:00어윤호
SMA치료제 '스핀라자·에브리스디' 약가협상 동시 타결[데일리팜=어윤호 기자] 척수성근위축증치료제(SMA, Spinal Muscular Atrophy) '스핀라자'와 '에브리스디'가 보험급여 적용 마지막 관문을 넘어섰다.관련 업계에 따르면 바이오젠코리아 스핀라자(뉴시너센)와 한국로슈 에브리스디(리스디플람)가 최근 국민건강보험공단과 약가협상을 최종 타결했다. 스핀라자는 급여 확대, 에브리스디는 신규 등재다.이로써 두 약물은 이변이 없는 이상, 내달(10월)부터 보장성이 확대될 것으로 예상된다.스핀라자의 현 급여기준은 ▲5q SMN-1 유전자의 결손 또는 변이의 유전자적 진단 ▲만 3세 이하에 SMA 관련 임상 증상과 징후 발현 ▲영구적 인공 호흡기를 사용하고 있지 않는 경우 등을 모두 만족하는 5q 척수성 근위축증 환자다.즉 3세 이하에 징후가 발견돼야 급여 처방이 가능했던 것인데, 이번에 논의된 스핀라자의 급여 확대 기준은 '18세 이하'로 그 대상을 확대하는 것이다.에브리스디의 경우 경구제 옵션으로 스핀라자의 급여기준과 동일하게 급여목록에 이름을 올리게 된다.한편 애초 SMA치료제의 급여 및 급여 확대 논의는 스핀라자의 급여 중단 기준 폐지를 촉구하는 움직임이 거세지면서 급물살을 타는 듯 했지만 특정 단체에서 정부와 제약사의 예측보다 더 큰 범위의 급여 적용이 촉구되면서 되레 논의가 길어졌다.당시 정부는 스핀라자의 급여 확대 기준에 대한 합의 이후 에브리스디의 등재 논의도 진행하겠다고 의사를 밝혔고 천신만고 끝에 두 약제 모두 최종 협상에 돌입했으며 한차례 협상 지연 결정이 내려진 바 있다.2023-09-14 06:00:00어윤호 -
 JW중외 리바로, HIV 감염자 심혈관 사건 억제 효과[데일리팜=노병철 기자] JW중외제약은 인체면역결핍바이러스(HIV) 감염자를 대상으로 한 리바로(피타바스타틴) 임상에서 심혈관 사건(MACE) 발생 억제를 확인했다고 13일 밝혔다.이번 임상은 HIV 감염자 대상 피타바스타틴 제제의 약효를 검증한 첫 연구로 국제학술지 ‘뉴 잉글랜드 저널 오브 메디신(NEJM)’ 8월호에 게재됐다.미국 하버드의대 스티븐 그린스푼(Steven K. Grinspoon) 교수 연구팀은 12개국 7769명의 HIV 감염자를 대상으로 2015년 3월부터 2019년 7월까지 임상을 진행했다.연구팀은 환자를 2개 그룹으로 나눠 3,888명에게 하루 4㎎의 피타바스타틴을 투여하고 대조군인 3881명에게는 위약을 처방했다.임상 결과 피타바스타틴 복용군의 심혈관 사건 위험이 위약군보다 35% 유의하게 낮았다. 위약군에서는 총 136명에게 심혈관 사건이 발생했으나 피타바스타틴 복용군에서는 89명에 그쳤다.또 심혈관 사건 또는 기타 원인에 의한 사망 발생은 피타바스타틴 복용군에서 170명을 기록해 위약군 216명보다 낮았다.JW중외제약 관계자는 “HIV 감염자는 심혈관질환 발생 가능성이 높고 심혈관질환 예방 또는 치료 시 약물상호작용을 고려해야 한다”며 “이번 연구결과가 HIV 감염자의 심혈관질환 예방을 위해 피타바스타틴 병용 가능성을 시사했다는 점에 의의가 있다”고 말했다.2023-09-13 13:24:04노병철
JW중외 리바로, HIV 감염자 심혈관 사건 억제 효과[데일리팜=노병철 기자] JW중외제약은 인체면역결핍바이러스(HIV) 감염자를 대상으로 한 리바로(피타바스타틴) 임상에서 심혈관 사건(MACE) 발생 억제를 확인했다고 13일 밝혔다.이번 임상은 HIV 감염자 대상 피타바스타틴 제제의 약효를 검증한 첫 연구로 국제학술지 ‘뉴 잉글랜드 저널 오브 메디신(NEJM)’ 8월호에 게재됐다.미국 하버드의대 스티븐 그린스푼(Steven K. Grinspoon) 교수 연구팀은 12개국 7769명의 HIV 감염자를 대상으로 2015년 3월부터 2019년 7월까지 임상을 진행했다.연구팀은 환자를 2개 그룹으로 나눠 3,888명에게 하루 4㎎의 피타바스타틴을 투여하고 대조군인 3881명에게는 위약을 처방했다.임상 결과 피타바스타틴 복용군의 심혈관 사건 위험이 위약군보다 35% 유의하게 낮았다. 위약군에서는 총 136명에게 심혈관 사건이 발생했으나 피타바스타틴 복용군에서는 89명에 그쳤다.또 심혈관 사건 또는 기타 원인에 의한 사망 발생은 피타바스타틴 복용군에서 170명을 기록해 위약군 216명보다 낮았다.JW중외제약 관계자는 “HIV 감염자는 심혈관질환 발생 가능성이 높고 심혈관질환 예방 또는 치료 시 약물상호작용을 고려해야 한다”며 “이번 연구결과가 HIV 감염자의 심혈관질환 예방을 위해 피타바스타틴 병용 가능성을 시사했다는 점에 의의가 있다”고 말했다.2023-09-13 13:24:04노병철 -
 클립스비엔씨, 정부 주도 '백신기업 협의체' 합류[데일리팜=이탁순 기자] 클립스비엔씨(대표 지준환)는 정부와 국내 다수의 제약·바이오 기업들로 구성된 백신기업 협의체의 백신 개발분과 및 백신생산 소부장 분과에 합류했다고 12일 밝혔다.백신기업 협의체는 국내 백신 생산역량을 최대한 활용해 전 세계 백신 공급을 확대하고 글로벌 백신 허브로 도약하기 위해 정부를 중심으로 기업들이 의기투합한 것이다. 현재 SK바이오사이언스, GC녹십자, 셀트리온, 한미약품, 삼성바이오로직스 등 63개 제약·바이오 기업, 5개의 관련 협회, 한국보건산업진흥원 등으로 구성돼 있다.클립스비엔씨는 글로벌 마켓의 미 충족 수요가 큰 프리미엄 백신인 ▲항생제(메티실린) 내성 포도상구균(Methicillin-resistant Staphylococcus aureus; MRSA)을 예방할 수 있는 MRSA 백신 ▲호흡기세포융합바이러스(Respiratory syncytial virus, RSV) 감염증 예방을 위한 RSV 백신을 주요 파이프라인으로 개발하고 있다.또한 백신 개발에 기반이 되는 pMyong2 Shuttle Vector 플랫폼 기술과 베타글루칸 면역증강제 기술도 함께 보유하고 있다. 이외 신종 감염병을 대비한 니파바이러스 백신과 항암백신, 성인 결핵 백신(재조합 결핵백신), HIV 백신 등을 개발하고 있다.지준환 클립스비엔씨 대표는 "백신기업 협의체의 일원이 되어 매우 기쁘게 생각한다"면서 "협의체의 일원으로서 사명감을 갖고 세계적으로 많은 수요를 요하지만, 아직 개발되지 않은 미 충족 프리미엄 백신 개발에 더욱 매진할 것"이라고 밝혔다.2023-09-12 17:57:14이탁순
클립스비엔씨, 정부 주도 '백신기업 협의체' 합류[데일리팜=이탁순 기자] 클립스비엔씨(대표 지준환)는 정부와 국내 다수의 제약·바이오 기업들로 구성된 백신기업 협의체의 백신 개발분과 및 백신생산 소부장 분과에 합류했다고 12일 밝혔다.백신기업 협의체는 국내 백신 생산역량을 최대한 활용해 전 세계 백신 공급을 확대하고 글로벌 백신 허브로 도약하기 위해 정부를 중심으로 기업들이 의기투합한 것이다. 현재 SK바이오사이언스, GC녹십자, 셀트리온, 한미약품, 삼성바이오로직스 등 63개 제약·바이오 기업, 5개의 관련 협회, 한국보건산업진흥원 등으로 구성돼 있다.클립스비엔씨는 글로벌 마켓의 미 충족 수요가 큰 프리미엄 백신인 ▲항생제(메티실린) 내성 포도상구균(Methicillin-resistant Staphylococcus aureus; MRSA)을 예방할 수 있는 MRSA 백신 ▲호흡기세포융합바이러스(Respiratory syncytial virus, RSV) 감염증 예방을 위한 RSV 백신을 주요 파이프라인으로 개발하고 있다.또한 백신 개발에 기반이 되는 pMyong2 Shuttle Vector 플랫폼 기술과 베타글루칸 면역증강제 기술도 함께 보유하고 있다. 이외 신종 감염병을 대비한 니파바이러스 백신과 항암백신, 성인 결핵 백신(재조합 결핵백신), HIV 백신 등을 개발하고 있다.지준환 클립스비엔씨 대표는 "백신기업 협의체의 일원이 되어 매우 기쁘게 생각한다"면서 "협의체의 일원으로서 사명감을 갖고 세계적으로 많은 수요를 요하지만, 아직 개발되지 않은 미 충족 프리미엄 백신 개발에 더욱 매진할 것"이라고 밝혔다.2023-09-12 17:57:14이탁순 -
 4세대 이어 2세대 추가…CML 신약 보장성 확대 활발[데일리팜=어윤호 기자] 만성골수성백혈병 영역에 보험급여 처방 옵션 확대 움직임이 활발하다.관련 업계에 따르면 지난 7월 한국노바티스의 4세대 만성골수성백혈병 (CML, Chronic Myelogenous Leukemia) 치료제 '셈블릭스(애시미닙)'가 급여 목록에 등재된 후 최근 한국화이자의 2세대 약물인 '보술리프(보수티닙)'이 건강보험심사평가원 약제급여평가위원회를 조건부 통과했다.해당 클래스에 늦깎이 진입 약물이기도 한 만큼, 약평위 평가금액 수용에는 큰 무리가 없을 것으로 예상된다.차세대 신약인 셈블릭스는 예상과 달리, 급여 신청 1년 이내 등재 절차를 마무리해 이목을 끌었다.이 약은 4세대 약물이지만 3세대 약물인 한국오츠카제약의 '아이클루시그(포나티닙)'과 비슷한 수준의 예상 비용을 산출하고 대체약제 가중평균가(WAP)의 100% 이하 금액을 수용하고 약가협상 없이 등재에 성공했다.보술리프의 속도도 느린 편은 아니다. 지난 1월 국내 허가된 이 약은 2012년 미국 FDA 승인 이후 다소 늦게 상용화가 이뤄졌지만 곧바로 급여 신청을 제출, 약평위 상정까지 무리 없는 행보를 밟았다.보술리프는 한국노바티스 '타시그나(닐로티닙)' 한국BMS '스프라이셀(다사티닙)' 일양약품 '슈펙트(라도티닙)' 등과 같은 2세대 표적항암제로, 선진입 약물이 있는 만큼, 약평위 결과를 수용한다면 최종 등재까지 수월한 행보가 예상된다.한편 셈블릭스는 최소 두 가지 이상의 TKI 치료를 받은 만성기의 필라델피아 염색체 양성 만성골수성백혈병 환자에서 임상적 유용성과 안전성 프로파일을 확인한 ASCEMBL 3상 연구를 통해 유효성을 입증했다.연구 결과, 셈블릭스는 대조군인 보수티닙 투여군 대비 24주차 MMR 비율을 약 2배 개선한 것으로 나타났으며 이상 반응으로 인한 투여 중단 비율에서도 셈블릭스군은 5.8%로 대조군의 21.1% 대비 약 1/4 수준으로 감소시키며 안전성 프로파일까지 확인했다.보술리프는 새로 진단된 CML 환자를 대상으로 진행한 3상 NCT02130557 연구를 통해 효능과 안전성을 검증 받았다.1차 평가지표는 12개월 기준 주요분자학적반응(MMR)이다. 연구 결과, 보술리프는 MMR 47%를 나타냈다. 비교 약제인 1세대 약물 글리벡(이매티닙)은 36%였다. 60개월 기준 MMR은 보술리프 74%, 글리벡 66%다. 60개월 추적관찰 후 반응자의 MMR까지 시간중앙값은 보술리프 9.0개월 글리벡 11.9개월이다.2023-09-11 06:00:02어윤호
4세대 이어 2세대 추가…CML 신약 보장성 확대 활발[데일리팜=어윤호 기자] 만성골수성백혈병 영역에 보험급여 처방 옵션 확대 움직임이 활발하다.관련 업계에 따르면 지난 7월 한국노바티스의 4세대 만성골수성백혈병 (CML, Chronic Myelogenous Leukemia) 치료제 '셈블릭스(애시미닙)'가 급여 목록에 등재된 후 최근 한국화이자의 2세대 약물인 '보술리프(보수티닙)'이 건강보험심사평가원 약제급여평가위원회를 조건부 통과했다.해당 클래스에 늦깎이 진입 약물이기도 한 만큼, 약평위 평가금액 수용에는 큰 무리가 없을 것으로 예상된다.차세대 신약인 셈블릭스는 예상과 달리, 급여 신청 1년 이내 등재 절차를 마무리해 이목을 끌었다.이 약은 4세대 약물이지만 3세대 약물인 한국오츠카제약의 '아이클루시그(포나티닙)'과 비슷한 수준의 예상 비용을 산출하고 대체약제 가중평균가(WAP)의 100% 이하 금액을 수용하고 약가협상 없이 등재에 성공했다.보술리프의 속도도 느린 편은 아니다. 지난 1월 국내 허가된 이 약은 2012년 미국 FDA 승인 이후 다소 늦게 상용화가 이뤄졌지만 곧바로 급여 신청을 제출, 약평위 상정까지 무리 없는 행보를 밟았다.보술리프는 한국노바티스 '타시그나(닐로티닙)' 한국BMS '스프라이셀(다사티닙)' 일양약품 '슈펙트(라도티닙)' 등과 같은 2세대 표적항암제로, 선진입 약물이 있는 만큼, 약평위 결과를 수용한다면 최종 등재까지 수월한 행보가 예상된다.한편 셈블릭스는 최소 두 가지 이상의 TKI 치료를 받은 만성기의 필라델피아 염색체 양성 만성골수성백혈병 환자에서 임상적 유용성과 안전성 프로파일을 확인한 ASCEMBL 3상 연구를 통해 유효성을 입증했다.연구 결과, 셈블릭스는 대조군인 보수티닙 투여군 대비 24주차 MMR 비율을 약 2배 개선한 것으로 나타났으며 이상 반응으로 인한 투여 중단 비율에서도 셈블릭스군은 5.8%로 대조군의 21.1% 대비 약 1/4 수준으로 감소시키며 안전성 프로파일까지 확인했다.보술리프는 새로 진단된 CML 환자를 대상으로 진행한 3상 NCT02130557 연구를 통해 효능과 안전성을 검증 받았다.1차 평가지표는 12개월 기준 주요분자학적반응(MMR)이다. 연구 결과, 보술리프는 MMR 47%를 나타냈다. 비교 약제인 1세대 약물 글리벡(이매티닙)은 36%였다. 60개월 기준 MMR은 보술리프 74%, 글리벡 66%다. 60개월 추적관찰 후 반응자의 MMR까지 시간중앙값은 보술리프 9.0개월 글리벡 11.9개월이다.2023-09-11 06:00:02어윤호 -
 동시에 출발한 천식 신약 3종의 각기 다른 행보[데일리팜=어윤호 기자] 천식 항체의약품 3종의 가는 길이 또 한번 갈렸다. RSA를 노리는 두 약물에 대한 보험급여 평가조차 상이한 결과가 도출됐다.관련업계에 따르면 7일 열린 건강보험심사평가원 약제급여평가위원회에서 한국GSK의 '누칼라(메폴리주맙)'는 급여 적정성 판정을, 한국아스트라제네카의 '파센라(벤라리주맙)'는 비급여 판정을 받았다.이들 약제는 인터루킨(IL)-5 길항제로, 동일 기전인 한독테바의 '싱케어(레슬리주맙)' 만이 지난 7월 약평위를 통과하고 현재 국민건강보험공단과 약가협상을 진행 중이다.싱케어가 앞서 나갈 수 있었던 이유는 일반등재 트랙을 밟았기 때문이다. 반면 누칼라와 파센라는 위험분담계약제(RSA, Risk Sharing Agreement) 등재 절차를 진행해 급여 논의에 난항이 예상됐는데, 이번에 누칼라가 약평위를 통과하게 된 것.그렇다면 RSA 적용을 원한 두 약물의 결과 차이는 역시 재정, 약가에서 비롯된 것으로 판단된다.아직 싱케어가 최종 등재된 상황이 아니기 때문에 RSA 자체가 불가능한 상황은 아닌 만큼, 누칼라의 향후 행보에 관심이 모아진다.누칼라는 3상 DREAM, MENSA, SIRIUS 연구를 통해 유효성을 입증했다. 이중 MENSA는 이 약을 대표하는 연구로 2014년 NEJM에 실렸다.이 연구는 고용량 흡입 코르티코스테로이드(ICS)를 포함, 여러 조절제를 사용했음에도 악화가 발생하는 중증 천식 환자를 대상으로 진행한 것으로, 특히 최초 선별검사에서 호산구가 150cells/㎕ 이상(1년 전에는 300cells/㎕ 이상) 증가한 환자를 모집했다. 이들에게 메폴리주맙과 위약을 투여하고 연간 악화 발생률을 관찰했다.그 결과, 32주째 메폴리주맙 75mg 정맥주사 치료군의 연간 악화 발생률은 위약군 대비 47% 감소했고, 메폴리주맙 100mg 피하주사 치료군 또한 53% 감소했다. 뿐만 아니라 삶의 질도 개선됐으며 천식 조절 만족도도 위약보다 더 높았다.한편 중증 천식은 2020년 한국노바티스의 '졸레어(오말리주맙)'의 급여권 진입 이후 등재된 약물이 없는 상황이다.'천식'이라는 질환 영역으로 보면 동일해 보이지만 3종의 약제와 졸레어는 알레르기성 천식에 처방된다. 적응증의 디테일에서 차이가 있는 셈이다. 하지만 정부의 기준에서 졸레어는 비교 대상이 됐고 그 약가는 바이오신약 3종이 감내하기 어려웠는지, 급여등재 절차는 중단됐다가 최근 다시 논의가 진행됐다.2023-09-09 06:00:01어윤호
동시에 출발한 천식 신약 3종의 각기 다른 행보[데일리팜=어윤호 기자] 천식 항체의약품 3종의 가는 길이 또 한번 갈렸다. RSA를 노리는 두 약물에 대한 보험급여 평가조차 상이한 결과가 도출됐다.관련업계에 따르면 7일 열린 건강보험심사평가원 약제급여평가위원회에서 한국GSK의 '누칼라(메폴리주맙)'는 급여 적정성 판정을, 한국아스트라제네카의 '파센라(벤라리주맙)'는 비급여 판정을 받았다.이들 약제는 인터루킨(IL)-5 길항제로, 동일 기전인 한독테바의 '싱케어(레슬리주맙)' 만이 지난 7월 약평위를 통과하고 현재 국민건강보험공단과 약가협상을 진행 중이다.싱케어가 앞서 나갈 수 있었던 이유는 일반등재 트랙을 밟았기 때문이다. 반면 누칼라와 파센라는 위험분담계약제(RSA, Risk Sharing Agreement) 등재 절차를 진행해 급여 논의에 난항이 예상됐는데, 이번에 누칼라가 약평위를 통과하게 된 것.그렇다면 RSA 적용을 원한 두 약물의 결과 차이는 역시 재정, 약가에서 비롯된 것으로 판단된다.아직 싱케어가 최종 등재된 상황이 아니기 때문에 RSA 자체가 불가능한 상황은 아닌 만큼, 누칼라의 향후 행보에 관심이 모아진다.누칼라는 3상 DREAM, MENSA, SIRIUS 연구를 통해 유효성을 입증했다. 이중 MENSA는 이 약을 대표하는 연구로 2014년 NEJM에 실렸다.이 연구는 고용량 흡입 코르티코스테로이드(ICS)를 포함, 여러 조절제를 사용했음에도 악화가 발생하는 중증 천식 환자를 대상으로 진행한 것으로, 특히 최초 선별검사에서 호산구가 150cells/㎕ 이상(1년 전에는 300cells/㎕ 이상) 증가한 환자를 모집했다. 이들에게 메폴리주맙과 위약을 투여하고 연간 악화 발생률을 관찰했다.그 결과, 32주째 메폴리주맙 75mg 정맥주사 치료군의 연간 악화 발생률은 위약군 대비 47% 감소했고, 메폴리주맙 100mg 피하주사 치료군 또한 53% 감소했다. 뿐만 아니라 삶의 질도 개선됐으며 천식 조절 만족도도 위약보다 더 높았다.한편 중증 천식은 2020년 한국노바티스의 '졸레어(오말리주맙)'의 급여권 진입 이후 등재된 약물이 없는 상황이다.'천식'이라는 질환 영역으로 보면 동일해 보이지만 3종의 약제와 졸레어는 알레르기성 천식에 처방된다. 적응증의 디테일에서 차이가 있는 셈이다. 하지만 정부의 기준에서 졸레어는 비교 대상이 됐고 그 약가는 바이오신약 3종이 감내하기 어려웠는지, 급여등재 절차는 중단됐다가 최근 다시 논의가 진행됐다.2023-09-09 06:00:01어윤호 -
 지엘팜텍 안구건조증 신약, 점안제 조성물 특허 등록[데일리팜=노병철 기자] 지엘팜텍(대표 왕훈식)은 안구건조증 치료제 신약 레코플라본(recoflavone, GLH8NDE/AJU-S56) 함유 점안제 조성물에 대한 두 번째 특허가 국내 특허청으로부터 등록 확정됐다고 8일 밝혔다.이번 특허는 안구에서의 약물 투과도가 개선된 안구건조증 치료용 점안제 조성물 및 제조방법에 관한 내용으로서 기존 등록 특허와 함께 더욱 폭넓은 특허권리를 확보하게 됐다.또한, 해당 특허들은 PCT 출원을 완료하고, 미국, 유럽, 중국 등의 국가에 출원을 진행 중에 있다.지엘팜텍은 아주약품(대표 김태훈) 및 오큐라바이오사이언스(대표 박종집)와 함께 인구건조증 치료 신약인 레코플라본 점안제를 개발 중에 있다.지난 7월 임상 3상 IND 승인을 완료하고, 연세대 의대 세브란스병원을 포함한 국내 32개 임상시험 기관에서 임상3상을 진행 중에 있다.지엘팜텍 박준상 부사장은 “아주약품과 긴밀한 협업으로 임상3상을 순조롭게 진행하고 있다. 이번에 확보된 특허권리를 기반으로 국내 뿐만 아니라 해외에서의 상업화를 위한 라이선스 아웃 계약 체결 등에 노력할 것”이라고 덧붙였다.2023-09-08 13:57:44노병철
지엘팜텍 안구건조증 신약, 점안제 조성물 특허 등록[데일리팜=노병철 기자] 지엘팜텍(대표 왕훈식)은 안구건조증 치료제 신약 레코플라본(recoflavone, GLH8NDE/AJU-S56) 함유 점안제 조성물에 대한 두 번째 특허가 국내 특허청으로부터 등록 확정됐다고 8일 밝혔다.이번 특허는 안구에서의 약물 투과도가 개선된 안구건조증 치료용 점안제 조성물 및 제조방법에 관한 내용으로서 기존 등록 특허와 함께 더욱 폭넓은 특허권리를 확보하게 됐다.또한, 해당 특허들은 PCT 출원을 완료하고, 미국, 유럽, 중국 등의 국가에 출원을 진행 중에 있다.지엘팜텍은 아주약품(대표 김태훈) 및 오큐라바이오사이언스(대표 박종집)와 함께 인구건조증 치료 신약인 레코플라본 점안제를 개발 중에 있다.지난 7월 임상 3상 IND 승인을 완료하고, 연세대 의대 세브란스병원을 포함한 국내 32개 임상시험 기관에서 임상3상을 진행 중에 있다.지엘팜텍 박준상 부사장은 “아주약품과 긴밀한 협업으로 임상3상을 순조롭게 진행하고 있다. 이번에 확보된 특허권리를 기반으로 국내 뿐만 아니라 해외에서의 상업화를 위한 라이선스 아웃 계약 체결 등에 노력할 것”이라고 덧붙였다.2023-09-08 13:57:44노병철
오늘의 TOP 10
- 1"약가인하, 산업 붕괴 초래"...제약업계 설득·호소 통할까
- 2"사전 제공은 됐지만"…달랐던 약가인하 파일, 현장은 혼란
- 3"약국, 주문 서둘러야겠네"...연말 제약사, 셧다운 공지
- 4파마리서치, 약국과 상생 시대 연다…리쥬비-에스 출시
- 5비대면진료 의료법, 정부 공포 초읽기…내년 12월 시행
- 6면역항암제 '키트루다' 급여 적응증 확대에 담긴 의미는?
- 7셀트리온, '옴리클로' 펜 제형 추가…졸레어와 본격 경쟁
- 8"수당인상은 마중물" 약사회 공직약사 처우개선 나선다
- 9수천만원 리브말리액 등재에 투여 후 5년 장기추적 돌입
- 10톡신 논쟁 초점 왜 '균주'에 머물렀나…현실과 괴리감















