첫 킬로미크론혈증 증후군 ASO 치료제 '올레자르센'
- 최병철 박사
- 2025-11-06 21:18:18
-
가
- 가
- 가
- 가
- 가
- 가
- 최병철 박사의 노벨드럭 인사이트
- FCS 환자 유일한 치료 옵션...피하주사 단순용법도 강점
- 장기적 안전성과 비용효과성은 해결 과제
- PR
- 전국 지역별 의원·약국 매출&상권&입지를 무료로 검색하세요!!
- 데일리팜맵 바로가기

가족성 킬로미크론혈증 증후군(FCS)은 지단백분해효소(Lipoprotein Lipase, LPL) 또는 그 조절 인자의 결함으로 인해 소장에서 유래한 중성지방(TG) 풍부 지단백인 킬로미크론(chylomicron)이 적절히 분해되지 못하고 혈중에 병리적으로 축적되는 질환이다. 이로 인해 급성 췌장염(acute Pancreatitis)과 같은 심각하고 치명적인 합병증이 발생할 수 있다.
올레자르센은 antisense RNA 기술을 활용해 간세포 내 APOC3 mRNA를 선택적으로 억제함으로써 apoC-III 단백질 생성량을 감소시키는 제제이다.
그 결과 중성지방 분해를 저해하던 apoC-III 수준이 낮아지면서 LPL 매개 지질분해와 킬로미크론 제거가 촉진되고, 궁극적으로 중성지방 대사가 정상화된다. 즉, LPL 기능 저하로 TG가 축적되는 FCS 환자에서 apoC-III 감소를 통해 TG 제거 경로를 간접적으로 활성화하는 기전을 갖는다.
이 약제의 허가는 3상 BALANCE 임상시험에서 확인된 유의한 효과와 안전성 결과를 근거로 이뤄졌다. 해당 연구 결과는 New England Journal of Medicine(NEJM)에 게재됐다.
임상시험에서는 유전적으로 확진된 FCS 환자 66명을 대상으로 위약군 및 올레자르센 50mg, 80mg 피하 투여군(4주 간격)으로 무작위 배정하였다.
그 결과, 6개월 시점에서 80mg군은 위약 대비 혈청 TG를 평균 42.5% 감소(P=0.0084)시켰으며, 급성 췌장염 발생 위험은 약 90% 감소했다. 또한 apoC-III 수치는 유의하게 감소했고, LDL-C는 용량 의존적으로 증가, apoB는 유의한 변화가 없었다.
주요 이상반응으로는 주사 부위 반응, 혈소판 감소, 관절통, 경미한 혈당 및 간 효소 상승 등이 보고됐다.
가족성 킬로미크론혈증 증후군(Familial Chylomicronemia Syndrome, FCS)은 무슨 질환인가?
가족성 킬로미크론혈증 증후군(FCS)은 지단백분해효소(lipoprotein lipase, LPL) 또는 그 조절 단백의 유전적 결함으로 인해 발생하는 상염색체 열성 희귀 유전질환이다. 이로 인해 소장에서 흡수된 중성지방(triglyceride, TG)이 풍부한 킬로미크론(chylomicron, CM)이 적절히 분해되지 못하고 혈중에 병적으로 축적된다.
정상 상태에서는 식후 림프계를 통해 혈중으로 유입된 CM이 LPL에 의해 TG가 유리지방산(non-esterified fatty acids)과 글리세롤(glycerol)로 가수분해되며, 약 3~4시간 내에 대부분 제거된다. 반면 FCS에서는 기능성 LPL이 거의 존재하지 않아, 공복 12시간 이상 경과해도 CM이 혈중에 잔류한다. 잔존 LPL의 미미한 활성이나 기타 혈장 리파아제의 보조 작용으로는 이를 보상할 수 없어, 지속적이며 중증의 고중성지방혈증이 발생한다.
생화학적으로 FCS는 킬로미크론의 과도한 축적과 VLDL·LDL·HDL의 현저한 감소라는 독특한 지질 프로파일을 보인다. 외인성 TG 대사의 차단으로 CM 잔여입자 생성이 억제되고, 간에서 VLDL 합성에 필요한 지질 기질이 감소해 VLDL 및 LDL 수치가 낮거나 정상 수준에 머무른다. 또한 HDL은 CETP(cholesteryl ester transfer protein) 매개 지질 교환 증가와 불충분한 지질분해(lipolysis)로 인해 감소한다.
FCS의 가장 심각한 합병증은 급성 췌장염(acute pancreatitis)으로, 혈중 TG가 1,000 mg/dL 이상에서 위험이 급격히 상승하며, FCS 환자에서는 보통 2,000–5,000 mg/dL 이상으로 유지되어 재발성 또는 만성 췌장염으로 진행할 수 있다. 병태생리적으로는 순환 중 CM이 췌장 모세혈관을 기계적으로 폐쇄하고, 제한적 LPL 작용으로 생성된 유리지방산(FFA)이 국소적으로 축적되어 세포 독성, 염증, 부종, 괴사를 유발한다.
임상적으로는 극심한 상복부 통증, 구토, 발열, 혈청 아밀라아제·리파아제 상승이 특징이며, 반복적 염증은 췌장 섬유화와 외분비기능부전(exocrine insufficiency)으로 이어질 수 있다.
또한, 간비대(hepatomegaly) 및 지방간(hepatic steatosis)이 흔히 동반된다. 이는 CM 및 TG의 만성 축적으로 인한 간세포 내 지방 침착이 원인으로, 장기간 지속 시 비알코올성 지방간염(NASH)으로 진행할 수 있으며, 이에 따른 간기능 저하 및 대사 합병증 위험도 보고되고 있다.
더불어 혈중 지질입자 과잉은 비장비대(splenomegaly)와 다양한 조직 내 지질 침착(lipid deposition)을 초래할 수 있다. 특히 간, 비장, 망막, 피부 등에서 거품세포(foam cell) 형태의 축적이 관찰되며, 드물게 황색종(xanthomas) 등의 피부 병변으로 나타나기도 한다.
킬로미크론(Chylomicrons. CM)이란 어떤 물질인가?
음식을 통해 지방을 섭취하면, 소장에서 흡수된 지방은 장세포로 들어가 다시 중성지방(TG) 형태로 재합성된다. 이렇게 만들어진 TG는 일부는 세포 내에 저장되고, 일부는 킬로미크론(CM)이라는 지방 운반 입자를 형성하는 데 사용된다.
CM은 처음에 아주 작은 씨앗 같은 형태의 전구체(pre-CM)로 만들어지며, 이때 핵심이 되는 구조 단백질이 바로 apoB-48이다. 이 apoB-48을 중심으로 TG가 차곡차곡 결합하면서 입자가 점차 커지고, 여기에 여러 지단백 관련 단백질이 더해지면 CM의 기본 골격이 완성된다.
형성 초기의 CM은 골지체로 이동해 최종 가공을 거친다. 이 과정에서 필요한 단백질이 추가되고 구조가 정돈되며, 완성된 CM이 형성된다.
완성된 CM은 장세포 밖으로 바로 혈액으로 들어가는 것이 아니라, 먼저 림프관으로 배출된다. 이후 림프 순환을 따라 이동해 흉관을 거쳐 쇄골하정맥(subclavian vein)으로 유입되면서 비로소 전신 혈액순환에 합류하게 된다.
혈액 속으로 들어온 CM은 신체 여러 조직으로 이동해 지방을 전달한다. 근육에서는 에너지원으로 사용되고, 지방조직에서는 저장용으로 축적된다. 이 과정에서 CM 내 TG가 점점 빠져나가면서 입자는 작아지고, 결국 킬로미크론 잔여입자(CM remnant)라는 형태로 변한다.
최종적으로 CM 잔여입자는 간으로 운반되어 제거된다. 간세포는 잔여입자 표면에 부착된 단백질 신호를 통해 이를 인식해 세포 내로 흡수하고, 분해하여 처리한다. 이 과정은 체내 지방의 운반과 분배가 효율적으로 이루어지도록 하는 중요한 생리적 단계다.
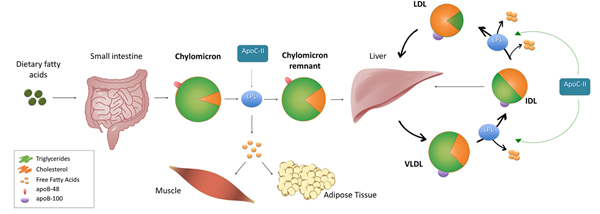
이 과정에서 방출된 유리지방산은 근육세포에서는 에너지원으로 산화되고, 지방조직에서는 다시 TG로 재합성되어 저장된다. TG가 제거되면서 입자는 점차 작아져 킬로미크론 잔여입자(CM remnant)가 되며, 이후 간세포 표면 수용체에 의해 인식되어 내재화(endocytosis)되고 분해됨으로써 순환계에서 제거된다.
한편, TG는 간에서도 합성되며, 아포지질단백질 B-100(apoB-100)과 결합해 초저밀도지단백(VLDL, very low-density lipoprotein)을 형성한 뒤 혈액으로 분비된다. VLDL 역시 LPL의 작용을 받아 TG를 잃어가면서 중간밀도지단백(IDL, intermediate-density lipoprotein)로 전환되고, 이 과정에서도 유리지방산이 방출된다.
생성된 IDL은 두 가지 경로를 따른다. 일부는 간에서 직접 제거되며, 나머지는 추가적인 LPL 및 hepatic lipase의 효소 작용을 통해 저밀도지단백(LDL, low-density lipoprotein)로 전환된다. LDL은 콜레스테롤이 풍부한 지단백으로, 말초 조직에 콜레스테롤을 공급하거나, 간으로 되돌아가 LDL 수용체에 의해 제거되는 등 체내 콜레스테롤 운반과 항상성 유지에 핵심적 역할을 한다.
APOC3란 무엇인가
APOC3는 간과 장에서 발현되는 유전자로, 이 유전자로부터 생성되는 단백질이 ApoC-III이다. 합성된 ApoC-III는 혈중 중성지방이 풍부한 지단백질(triglyceride-rich lipoproteins, TRLs)의 표면에 결합하여 지질 대사의 핵심 조절자로 기능한다.
ApoC-III는 지단백분해효소(lipoprotein lipase, LPL)와 간 리파아제(hepatic lipase)의 활성을 억제하여 TRL의 분해(lipolysis)를 방해하고, 동시에 TRL 및 그 잔여입자의 간섭취(hepatic clearance)를 저해한다. 이러한 작용은 혈중 중성지방 상승과 TRL 잔여입자 축적을 초래하여, 죽상경화 발생 위험을 높이는 병태생리적 기반이 된다.
유전역학적 연구는 APOC3/ApoC-III 축이 중성지방 대사 및 심혈관질환 위험에 인과적(causal) 역할을 한다는 명확한 근거를 제시한다. APOC3의 기능상실(loss-of-function, LOF) 변이를 보유한 개인은 ApoC-III 발현이 감소하여 혈중 중성지방 수치가 현저히 낮고, 관상동맥질환(ASCVD) 위험 또한 감소하는 것으로 보고된다.
반대로 기능증가(gain-of-function, GOF) 변이나 APOC3의 과발현은 고중성지방혈증과 ASCVD 위험 증가와 밀접하게 연관되어 있다. 이러한 증거들은 APOC3가 단순한 지질 표지자를 넘어, 중성지방 대사를 조절하고 질환의 병태생리를 매개하는 핵심 인자임을 보여준다.
APOC3는 주로 간세포(hepatocytes)에서 발현되며, 소장 상피세포(enterocytes)에서도 소량 발현된다. 이 유전자는 79개의 아미노산으로 구성된 소형 아포지단백질인 ApoC-III를 암호화한다.
이러한 근거를 바탕으로 APOC3/ApoC-III 축은 고중성지방혈증, 죽상경화, TRL-관련 급성췌장염 등 다양한 대사·심혈관질환의 주요 치료 표적으로 부상하고 있다. 특히 기존 피브레이트나 오메가-3 지방산으로 조절되지 않는 난치성 고중성지방혈증 또는 가족성 킬로미크론혈증(FCS) 환자에서 APOC3 억제는 혈중 중성지방 및 ApoC-III 수치를 효과적으로 감소시키고, 췌장염 위험을 줄이는 잠재력을 보여주고 있다.
Antisense oligonucleotide(ASO)는 무엇인가?
ASO는 질병 관련 유전자의 발현을 RNA 단계에서 정밀하게 조절하도록 설계된 합성 핵산 치료제로, 표적 mRNA를 직접 억제함으로써 병태생리의 근본 원인을 교정하는 혁신적 치료 플랫폼이다.
ASO는 일반적으로 뉴클레오타이드 15~25개로 구성되며, 표적 RNA와 상보적으로 결합하여 RNA 안정성, 스플라이싱, 번역 효율 등에 영향을 미친다. 이를 통해 단백질 생산 과정을 원천적으로 조절할 수 있다. 체내 투여된 ASO는 주로 간, 근육, 중추신경계 등 특정 장기에 분포한 뒤 세포 내로 유입되어 세포질과 핵에서 작용한다.
ASO의 가장 대표적인 작용 기전은 RNase H1 매개 mRNA 절단(gene silencing)이다. ASO가 mRNA와 결합해 RNA–DNA hybrid를 형성하면 RNase H1이 이를 인식해 표적 mRNA를 절단하고, 절단된 mRNA는 신속히 분해된다. 그 결과 해당 단백질의 번역이 억제되며, 이는 과발현된 병적 단백질을 직접 감소시키는 데 매우 효과적이다(Figure 2). 이러한 기전은 대사질환, 염증질환, 신경·근육계 유전질환, 희귀질환 등 다양한 영역에서 임상적 효능이 입증되고 있다.
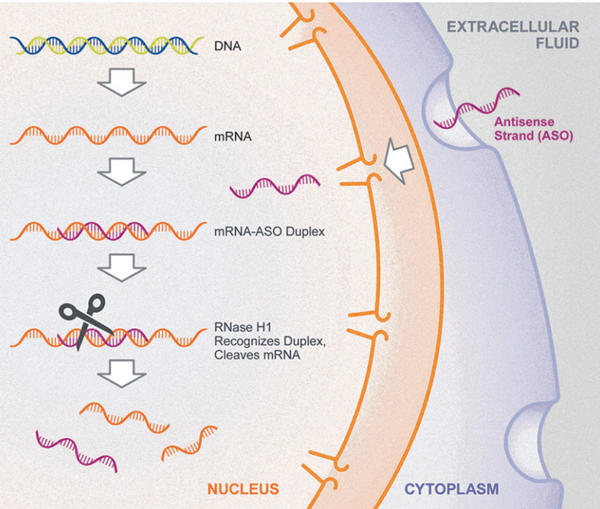
ASO는 스플라이싱 조절(splice modulation)을 통해 질환 원인 돌연변이를 교정하거나 기능적 단백질 아이소폼의 생성을 유도할 수도 있다. ASO가 pre-mRNA의 스플라이싱 조절 부위(exonic/intronic splicing enhancer 또는 silencer 등)에 결합하면, 스플라이싱 machinery의 접근 또는 조립을 선택적으로 억제·촉진하여 특정 엑손의 포함 또는 배제를 유도한다. 대표적 성공 사례로는 척수성 근위축증(SMA) 치료제 누시넨센(nusinersen, SpinrazaⓇ) 이 있다.
이 외에도 ASO는 번역 억제, miRNA 기능 차단(antagomir-like effect), RNA 구조 변형을 통한 안정성 조절 등 다양한 분자적 경로로 작용한다. 이러한 약리 기전의 다양성은 ASO가 단일 기전에 국한되지 않고, RNA 수준에서 작동하는 정밀 유전자 조절 치료제임을 의미한다.
ASO 기술 발전의 핵심은 화학적 구조 최적화였다. 초기에는 phosphorothioate(PS) 골격 변형을 통해 체내 안정성과 반감기를 연장했고, 이후 2’-O-methyl(2’-O-Me), 2’-O-methoxyethyl(2’-MOE) 및 locked nucleic acid(LNA) 등 2·3세대 핵산 변형 기술이 도입되어 결합 친화력, 선택성, 면역반응 감소, 독성 개선이 크게 진전됐다.
최근에는 N-acetylgalactosamine(GalNAc) 결합 플랫폼의 도입으로 ASGPR 수용체를 통한 간세포 특이적 전달이 가능해지며, 효능 증대와 전신 부작용 최소화라는 중요한 기술적 도약이 이루어졌다.
따라서 ASO는 DNA-단백질 축 사이의 핵심 매개 단계인 RNA를 직접 조절함으로써 유전자 발현을 분자 수준에서 교정하는 정밀 치료 전략이며, 기존의 단백질 표적 기반 치료제 또는 유전자 치료제와 차별화되는 혁신적 RNA 약물 플랫폼으로 자리매김하고 있다.
가족성 킬로미크론혈증증후군(FCS) 기존 치료제에는 어떤 약제들이 있는가?
FCS에서 약물치료로 시도되어 온 기존 약제에는 피브레이트, 오메가-3 지방산, 니아신 등이 있다. 그러나 이들 약제는 모두 LPL 의존적 경로를 기반으로 작용하기 때문에, LPL 또는 조절 단백의 유전적 결함을 특징으로 하는 FCS에서는 치료 효과가 제한적이다.
피브레이트(fibrates)는 가장 오래된 고중성지방혈증 치료제로, 대표 약제로는 fenofibrate, gemfibrozil, bezafibrate 등이 있다.
피브레이트는 PPAR-α(peroxisome proliferator–activated receptor-α)를 활성화하여 LPL 발현 증가, ApoC-III 발현 억제, 지방산 산화 촉진을 통해 TG를 감소시킨다. 이차성 고중성지방혈증에서는 의미 있는 TG 감소 효과가 있으나, FCS에서는 LPL 자체가 결핍되어 있어 치료 반응이 거의 나타나지 않는다. 또한 간효소 상승, 근육통, 신기능 저하 등의 부작용 가능성도 고려해야 한다.
오메가-3 지방산(omega-3 fatty acids)은 EPA(eicosapentaenoic acid) 및 DHA(docosahexaenoic acid)를 기반으로 한 제제로, 간 내 TG 합성 억제 및 VLDL 분비 감소를 통해 TG 저하 효과를 보인다. 일반 고중성지방혈증에서는 20~30%의 TG 감소가 가능하나, 킬로미크론 축적이 근본 문제인 FCS에서는 LPL 비의존적 기전의 한계로 효과가 매우 제한적이며, 대개 10–20% 수준의 감소에 그친다. 이러한 수준의 감소는 급성 췌장염 위험 감소에는 불충분하다.
니아신(niacin; 비타민 B3)은 과거 TG 감소와 HDL 상승 목적으로 사용되었으나, 혈당 상승, 간독성, 안면홍조(flushing) 등의 부작용으로 인해 현재는 임상적 사용이 거의 중단되었다. 특히 FCS 환자에서는 TG 감소 효과가 미미하고 안전성 문제가 커 실제 임상적 적용이 사실상 배제된 상태다.
종합하면, 피브레이트, 오메가-3 지방산, 니아신 등 기존 약제들은 LPL 기능 강화 또는 지방 합성 억제에 의존하는 간접적 기전이므로, LPL 결핍이라는 FCS의 근본 병태를 해결하지 못한다. 이 때문에 FCS 치료의 핵심은 여전히 극단적 저지방 식이(< 20g/일)에 의존하고 있으며, 중증 환자에서는 충분한 예방 효과가 보장되지 않는다.
최근 들어 ApoC-III 또는 ANGPTL3를 표적하는 RNA 기반 신약이 LPL 비의존적 기전을 통해 직접 병태생리를 교정하는 혁신적 치료 전략(mechanistic innovation)으로 주목받고 있다.
APOC3 억제제는 어떤 약제인가?
Apolipoprotein C-III(APOC3)는 단순한 지질 표지자를 넘어 중성지방(TG) 대사의 핵심 조절자로, 지단백 분해 억제, TRL 잔여입자 축적, 인슐린 저항성 및 염증 유도 등 다양한 병태생리 기전에 관여한다.
특히 유전학적 근거에 따르면, APOC3 유전자의 기능 상실(loss-of-function) 변이 보유자는 중성지방 수치가 현저히 낮고, ASCVD 발생률 및 TRL-연관 급성 췌장염 위험이 감소하는 것으로 보고되었다. 이러한 결과는 APOC3가 질환의 병태생리에 직접적 역할을 한다는 점을 뒷받침하며, 유효한 치료 표적(targetable driver) 으로 확립되는 근거가 되었다.
이러한 근거를 바탕으로, APOC3 발현을 선택적으로 억제하는 RNA 기반 치료제 개발이 활발히 진행되고 있다. 대표적인 플랫폼은 antisense oligonucleotide(ASO) 와 small interfering RNA(siRNA) 로, 모두 APOC3 mRNA를 직접 표적하여 ApoC-III 단백질 합성을 감소시키는 정밀 RNA치료 전략이다.
초기 ASO 제제인 volanesorsen은 FCS 환자를 대상으로 ApoC-III와 중성지방 수치를 현저히 감소시키며 치료 잠재력을 입증했으나, 혈소판감소증(thrombocytopenia) 등 안전성 문제가 임상적 활용의 제약 요인으로 작용했다. 이러한 한계를 보완하기 위해 간 표적 GalNAc 결합 기술이 적용된 2세대 ASO인 olezarsen이 개발되었으며, 보다 우수한 안전성 프로파일과 강력한 TG 감소 효과가 관찰되고 있다.
동시에 siRNA 플랫폼 기반의 plozasiran(ARO-APOC3) 역시 간세포 내 APOC3 발현을 억제하는 기전으로 개발 중이다.
이 차세대 APOC3 억제제들은 기존 치료에 반응이 미흡한 난치성·중증 고중성지방혈증 환자군에게 새로운 치료 대안을 제공할 뿐 아니라, TRL-잔여 위험(residual risk) 감소를 통한 심혈관질환 예방 측면에서도 잠재적 가치를 보여주고 있다. 특히 TG 감소 외에도 간·췌장 합병증 개선 가능성, 심혈관 위험 지표 개선, 대사염증 경감 효과 등이 탐색되고 있어 적용 범위가 확장될 전망이다.
결론적으로, APOC3 억제제는 중성지방 대사의 근본 조절축을 정밀하게 표적하는 혁신적 RNA 기반 치료 전략으로, 고중성지방혈증, 죽상경화성 심혈관질환, TRL-연관 급성 췌장염 등 다양한 대사 및 심혈관질환 영역에서 새로운 치료 패러다임을 제시하고 있다.
올레자르센의 약리적 기전은 어떠한가?
올레자르센은 표적 mRNA와 상보적으로 결합하여 RNA–DNA hybrid를 형성하고, RNase H1을 활성화해 APOC3 mRNA를 절단·분해한다. 이로써 apoC-III 단백질 발현이 감소하고, LPL 활성이 회복되며, 간으로의 TRL 잔여입자 제거가 촉진되어 혈중 중성지방 농도가 유의하게 감소한다.
간세포 선택성을 강화하기 위해 5’ 말단에는 삼지형(triantennary) N-아세틸갈락토사민(GalNAc) 리간드가 결합되어 있다. 이를 통해 asialoglycoprotein receptor(ASGPR)를 매개로 한 간세포 특이적 흡수가 가능해지며, 세포내섭취(endocytosis)를 거쳐 간세포 내로 이동한 후 표적 mRNA를 분해한다.
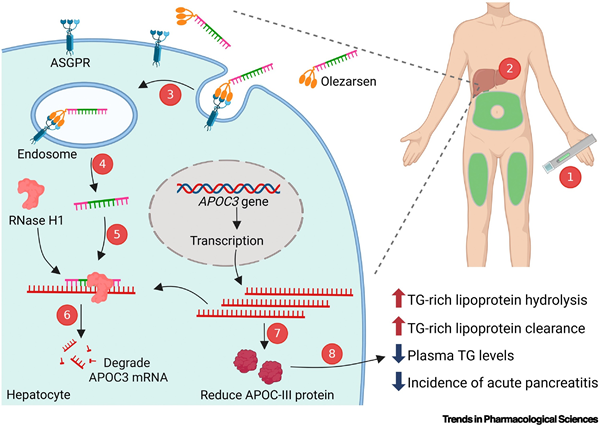
APOC3 억제를 통한 기전은 크게 세 가지로 정리된다. 첫째, 잔존 LPL 활성(residual LPL activity)을 강화하여 중성지방 분해를 촉진하고, 둘째, 중성지방이 풍부한 지단백(TG-rich lipoprotein)의 생성과 분비를 억제하며, 셋째, LPL 비의존적 대사 경로(alternative catabolic pathways)를 활성화하여 추가적인 중성지방 감소를 유도한다.
올레자르센은 5–10–5 gapmer 구조로 설계되었으며, 2’-O-methoxyethyl(2’-MOE) 수식 염기와 phosphorothioate 골격을 적용해 안정성과 결합 친화도를 높였다. 내부 DNA 서열은 RNase H1 유도를 위한 구조적 요건을 유지하며, 5-methylcytosine과 5-methyluridine의 도입은 염기쌍 안정성과 표적 결합력을 강화한다.
결과적으로, 올레자르센은 APOC3 mRNA 발현을 선택적으로 억제함으로써 혈중 중성지방을 효과적으로 감소시키는 정밀 RNA 기반 치료제로, 고중성지방혈증 및 가족성 킬로미크론혈증(FCS)의 병태생리를 표적하는 혁신적 치료 옵션으로서 임상적 의의가 크다.
올레잘센(TRYNGOLZA)의 허가 임상 결과는 어떠한가?
TRYNGOLZA의 효능은 유전적으로 FCS이 확인된 성인 환자 중, 공복 중성지방(TG) 수치가 880mg/dL 이상인 환자를 대상으로 실시된 무작위 배정, 위약 대조, 이중맹검 임상시험(Trial 1)을 통해 입증되었다.
시험에 앞서 모든 환자는 1일 지방 섭취량을 20g 이하로 제한하는 저지방 식이요법을 최소 4주 이상 유지하는 준비(run-in) 기간을 거쳤다. 이후 환자들은 무작위로 배정되어, TRYNGOLZA 80mg(n=22) 또는 동일 용량의 위약(placebo, n=23)을 피하 주사 형태로 4주 간격으로 53주간 투여받았다.
환자 인구학적 및 기저 특성은 두 치료군 간 전반적으로 유사하였다 등록 시 당뇨병을 동반한 환자 비율은 TRYNGOLZA 80mg 군 32%, 위약군 26%였다.
연구 시작 시 TRYNGOLZA 80mg 군과 위약군 모두에서 스타틴(27%), 오메가-3 지방산(42%), 피브레이트(49%), 또는 기타 지질강하제(13%)가 병용 사용되었다.
두 군을 합쳐 71%의 환자가 과거 10년 이내에 급성 췌장염(acute pancreatitis) 병력이 있었다. 기저 시점의 공복 중성지방 평균(SD) 수치는 2,604(1,364)mg/dL, 중앙값은 2,303mg/dL이었으며, 범위는 334–6,898mg/dL이었다.
1차 평가변수(primary endpoint)는 기저치 대비 6개월차(23, 25, 27주차 평균)의 공복 중성지방 변화율(%)로, 위약군과 비교하여 분석되었다.
그 결과, TRYNGOLZA 80mg 투여군은 위약군 대비 공복 중성지방 변화율이 -42.5%로 유의하게 감소하였다(95% 신뢰구간: -74.1% ~ -10.9%; p = 0.0084). 추가 결과는 Table 2를 참조.
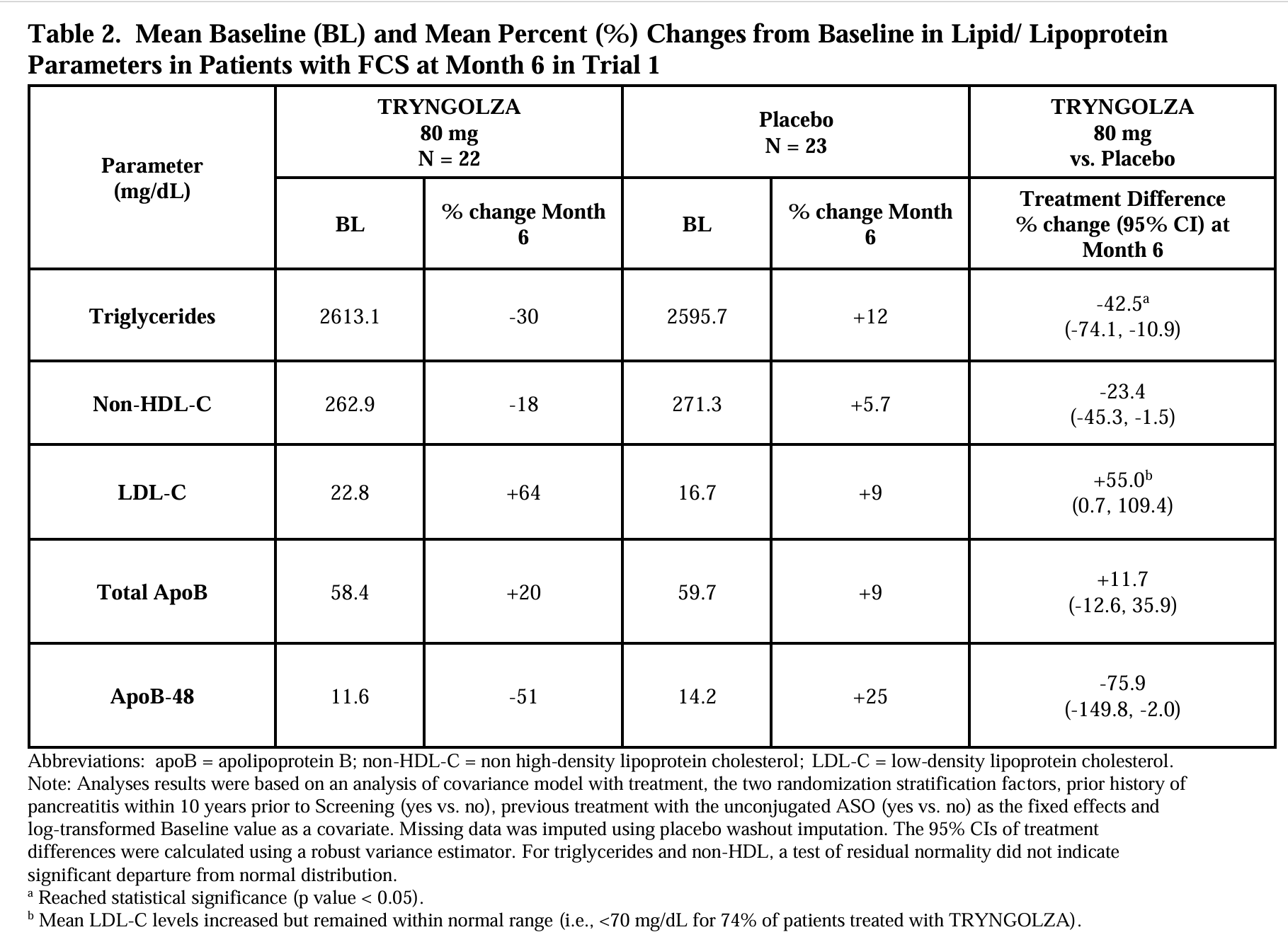
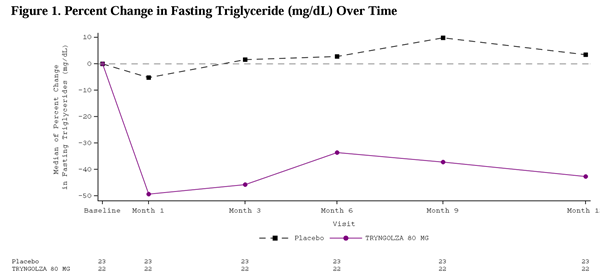
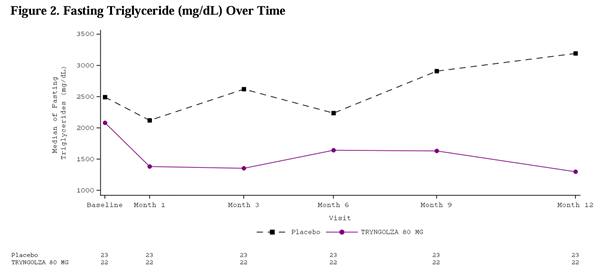
12개월의 치료 기간 동안, TRYNGOLZA 80mg을 투여받은 환자군에서 급성 췌장염(acute pancreatitis)의 발생률은 위약군보다 낮았다.
TRYNGOLZA 80mg 투여군에서는 1명(5%), 위약군에서는 7명(30%의 환자에서 급성 췌장염이 보고되었다. 이들 모든 환자는 시험 등록 10년 이내에 췌장염 병력을 가지고 있었다.
올레잘센의 쟁점이 될 수 있는 부분은?
올레잘센은 FCS 최초이자 유일한 치료 옵션으로, 성인 FCS 환자에서 식이요법의 보조요법으로 중성지방(TG)을 유의하게 감소시킨다. 월 1회 80 mg 피하주사라는 단순한 용법 또한 장점으로 꼽힌다. 유사 기전 약물인 volanesorsen과 plozasiran은 아직 미국 FDA 승인을 받지 못했다.
올레잘센의 허가 임상은 FCS 및 중증 고중성지방혈증 환자에서 유의미한 TG 감소 효과를 입증하며 치료적 진전을 보여주었으나, 해석 시 고려해야 할 중요한 한계가 존재한다.
첫째, 대부분의 임상이 소수의 환자를 대상으로 수행되어 결과의 일반화 가능성에 제약이 있다. 희귀질환 특성상 환자 모집이 어렵지만, 연구 참여자의 인종적·임상적 다양성이 충분히 확보되지 않아 실제 진료 현장에 완전히 적용하기에는 한계가 있다. 또한 평가 기간이 주로 6~12개월에 그쳐 장기 투여 시 효과 지속성 및 누적 부작용에 대한 근거가 부족하다.
둘째, 유효성 평가지표로 사용된 TG 감소는 대리결과(surrogate endpoint)에 해당한다. 급성 췌장염 발생 감소, 심혈관 사건 예방, 생존율 향상과 같은 최종 임상결과(hard outcomes)에 대한 근거는 충분히 축적되지 않았다. 이는 약물의 장기적 임상적 가치 평가 측면에서 중요한 한계다.
셋째, 희귀질환 치료제 특성상 높은 치료비용과 접근성 제약 문제는 실제 임상 적용과 보건의료 자원 배분에서 중요한 고려 요소로 남아 있다.
종합하면, 올레잘센은 고중성지방혈증 치료 영역에서 치료적 가치를 지닌 유망한 옵션으로 부상하고 있으나, 장기 안전성, 하드엔드포인트 근거, 비용-효과성 등 해결해야 할 과제가 여전히 존재한다. 향후 충분한 규모와 이질적 환자군을 포함한 장기 추적 연구가 수행되어, 실제 진료 환경에서의 임상적 유용성과 안전성이 확립되기를 기대한다.
참고문헌 1. Erica Gianazza et al. “Proteomic studies on apoB‐containing lipoprotein in cardiovascular research: A comprehensive review” Mass Spec Rev. 2023;42:1397–1423. 2. Anne V. Smith1 and Sarah J. Tabrizi “Therapeutic Antisense Targeting of Huntingtin” DNA AND CELL BIOLOGYVolume 39, Number 2, 2020). 3. Fiza Javed et al. “Familial chylomicronemia syndrome: An expert clinical review from the National Lipid Association” Journal of Clinical Lipidology, Vol 19, No 3, May/June 2025 4. Kexin Wang et al. “Remnant cholesterol and atherosclerotic cardiovascular disease: Metabolism, mechanism, evidence, and treatment” Front. Cardiovasc. Med. 9:913869. 5. Erik S. et al “Olezarsen, Acute Pancreatitis, and Familial Chylomicronemia Syndrome” N Engl J Med 2024;390:1781-1792. 6. Jan Borén et al. “The Roles of ApoC-III on the Metabolism of Triglyceride-Rich Lipoproteins in Humans“ Humans. Front. Endocrinol. 11:474 2020. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).
관련기사
-
세계 첫 항체 무관 혈우병 A·B 치료제 '피투시란'
2025-10-24 05:54:17
-
국내 희귀약 지정 RNAi 기반 PH1 치료제 '네도시란'
2025-10-10 05:55:17
-
첫 RNA 기반 ATTR-CM 치료제 '암부트라'
2025-09-19 05:56:02
-
소간섭 RNA 기반 LDL 콜레스테롤 저하제 '렉비오'
2025-09-05 12:00:14
-
세 번째 RNAi 치료제...원발성옥살산뇨증 치료 '옥슬루모'
2025-08-22 05:56:44
-
최초의 RNAi 치료제 '기블라리'...국내 희귀약 지정
2025-08-08 06:10:01
-
차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼에 대해
2025-07-25 08:33:37
-
화이자 비강분무제 급성 편두통 치료제 '자브즈프렛'
2025-07-11 05:56:54
-
PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대
2025-06-27 05:56:46
-
세계 첫 텔로머레이스 억제제 '라이텔로'...국내 도입 예상
2025-06-13 05:56:02
- 댓글 0
- 최신순
- 찬성순
- 반대순
-
등록된 댓글이 없습니다.
첫 댓글을 남겨주세요.
오늘의 TOP 10
- 1"웰컴"...K-약국, 해외관광객 소비건수 1년새 67% 증가
- 2메드트로닉, 포트폴리오 확장 가속…차세대 치료 축 본격 가동
- 3[2025 결산] 급여재평가 희비...건보재정 적자터널 진입
- 4고환율에 복잡한 약가인하...사업계획 엄두 못내는 제약사들
- 5완강한 약무정책과장..."플랫폼 도매 허용 동의 힘들어"
- 6상장 바이오 추정 순이익 '껑충'...비교군 한미약품 '최다'
- 7[기자의 눈] ‘깜깜이’ 약가인하 혼란, 언제까지 반복할까
- 8수두백신 2회 접종 개발 본격화…SK바이오, 임상3상 승인
- 9사노피 '듀피젠트', 아토피피부염 넘어 천식 공략 눈앞
- 10"대통령, 중대사고 엄벌 주문…제약업계도 대비해야"




























![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)



