⑪ 소간섭 RNA 기반 LDL 콜레스테롤 저하제 '렉비오'
- 최병철 박사
- 2025-09-05 12:00:14
-
가
- 가
- 가
- 가
- 가
- 가
- 최병철 박사의 노벨드럭 인사이트
- 지난해 국내 승인...기존 지질강화제와 차별화
- 주요 심혈관 사건 감소 여부에 대한 직접적 근거 미확보 '쟁점'
- PR
- 전국 지역별 의원·약국 매출&상권&입지를 무료로 검색하세요!!
- 데일리팜맵 바로가기

③ 최초 소간섭 RNA(siRNA) 기반 LDL 콜레스테롤 저하제, '렉비오(Inclisiran)'
렉비오(Leqvio®, leck-vee-oh, 성분명: 인클리시란, Inclisiran, 노바티스)는 소간섭 RNA(small interfering RNA, siRNA)기반의 저밀도지단백 콜레스테롤(LDL-C) 저하제로, PCSK9(proprotein convertase subtilisin/kexin type 9) mRNA를 표적으로 하여 작용한다.
이 약제는 2020년 유럽의약청(EMA), 2021년 미국 식품의약국(FDA)으로부터 승인을 받았으며, 2024년 국내에서도 승인되었다. 국내 승인 적응증은 식이요법의 보조요법으로 사용되는 경우로, 다음과 같은 성인 환자를 대상으로 한다:
- 최대 내약 용량의 스타틴 치료에도 불구하고 LDL-C 조절이 불충분한 원발성 고콜레스테롤혈증(이형접합 가족형 및 비가족형)또는 혼합형 이상지질혈증 환자 - 스타틴 불내성또는 스타틴 금기 환자
렉비오(inclisiran)는 저밀도지단백 콜레스테롤(LDL-C) 저하를 목표로 개발된 소간섭 RNA(small interfering RNA, siRNA) 기반 치료제로, 기존 지질강하제와 차별화되는 새로운 치료 전략을 제시한다. 본 제제의 가장 큰 특징은 연 2회 투여 요법으로, 최초 투여 후 3개월 뒤 1회 추가 투여를 시행하고 이후에는 6개월 간격으로 피하 주사하는 방식이다. 이러한 투여 간격은 환자의 복약 순응도를 현저히 개선시키고, 장기간에 걸친 지속적 LDL-C 조절 효과를 제공한다는 점에서 임상적 차별성이 있다.
작용 기전은 간세포 내에서 PCSK9 단백질 합성에 관여하는 mRNA를 표적 분해하는 것으로, 결과적으로 PCSK9의 발현을 억제한다. 이로 인해 LDL 수용체의 분해가 억제되고 수용체의 재활용이 촉진되어 혈중 LDL-C 농도가 유의하게 감소한다. 이러한 분자 기전은 단순한 단백질 억제제가 아닌, 전사 단계에서부터 표적을 차단하는 혁신적 접근을 반영한다.
렉비오의 임상적 유효성과 안전성은 ORION-9, ORION-10, ORION-11 등 다수의 3상 임상시험을 통해 평가되었다. 총 3456명의 환자를 대상으로 평균 17개월간 추적 관찰한 결과, 렉비오 투여군은 위약군에 비해 LDL-C 수치가 최대 52%까지 지속적으로 감소하였다.
전반적인 내약성은 양호하였으며, 안전성 프로파일 또한 위약군과 유사하였다. 보고된 이상반응은 대부분 경도에서 중등도 수준으로, 주사 부위 반응(통증, 발적, 발진), 관절통, 요로감염, 설사, 기침, 사지통증, 호흡곤란 등이 있으나 임상적으로 중대한 안전성 문제는 확인되지 않았다.
이러한 근거를 바탕으로 렉비오는 죽상경화성 심혈관질환(ASCVD) 또는 이형접합 가족형 고콜레스테롤혈증(HeFH) 환자에서, 기존 요법으로 충분한 LDL-C 강하가 이루어지지 않는 경우 사용 가능한 약제로 임상적 의의를 가진다. 특히, 장기간의 안정적인 LDL-C 감소 효과와 간편한 투여 스케줄은 실제 진료 현장에서 환자 관리의 효율성을 높인다.
원발성 고콜레스테롤혈증(Primary hyperlipidemia)는 어떤 질환인가? 고콜레스테롤혈증은 혈중 저밀도지단백 콜레스테롤(low-density lipoprotein cholesterol, LDL-C) 수치가 비정상적으로 증가된 상태를 의미하며, 이는 죽상경화성 심혈관질환(atherosclerotic cardiovascular disease, ASCVD)의 발병 위험을 크게 높이는 대사적 이상 중 하나이다.
원발성 고콜레스테롤혈증은 주로 유전적 요인에 의해 발생하며, 대표적으로 가족성 고콜레스테롤혈증(familial hypercholesterolemia, FH)이 포함된다. 이러한 유전성 이상지질혈증은 소아기 또는 청소년기부터 지속적인 LDL-C 상승이 나타나며, 적절한 치료가 이루어지지 않으면 조기 동맥경화증이 진행되고, 심근경색이나 뇌졸중과 같은 중증 심혈관질환으로 이어질 수 있다.
원발성 고콜레스테롤혈증은 크게 FH와 비가족성(다유전자성) 고콜레스테롤혈증으로 구분된다. FH는 단일 유전자의 병적 변이에 의해 발생하는 모노제닉(monogenic) 질환으로, 주로 LDL 수용체(LDLR), 아포지단백 B(APOB), 또는 PCSK9 유전자의 기능 이상이 원인이다. 이로 인해 간세포에서 LDL 입자의 제거가 저해되고, 결과적으로 혈중 LDL-C가 병적으로 상승한다.
FH는 다시 이형접합형(heterozygous FH, HeFH)과 동형접합형(homozygous FH, HoFH)으로 나뉜다. 이형접합형은 대립유전자 한 쌍 중 하나에 변이가 존재하는 경우로 약 500명 중 1명꼴로 비교적 흔하게 발생한다. 이들 환자는 출생 시부터 LDL-C 수치가 상승되어 있으며, 치료가 이루어지지 않으면 성인 초기(30~50대)에 관상동맥질환(coronary artery disease, CAD) 발생 위험이 크게 증가한다.
반면, 동형접합형은 양쪽 대립유전자 모두에 변이가 존재하는 경우로 약 100만 명 중 1명꼴로 매우 드물다. 이 경우 출생 직후부터 LDL-C 수치가 극단적으로 상승하며, 10세 이전에 심근경색이나 대동맥 협착과 같은 심각한 심혈관질환이 발생할 수 있다. 동형접합 환자는 일반적인 스타틴 치료에 대한 반응이 낮아, LDL 성분 제거술(apheresis)이나 PCSK9 억제제, siRNA 기반 치료제 등 고강도 치료 전략이 요구된다.
비가족성 고콜레스테롤혈증은 FH와 달리 단일 유전자 변이가 확인되지 않으며, 다수의 유전적 요인에 더해 식습관, 운동 부족, 대사 이상과 같은 환경적 요인이 복합적으로 작용하여 LDL-C가 상승하는 형태이다. 이 경우 뚜렷한 가족력이 없는 경우가 많으며, 임상적으로는 FH와 유사한 소견을 보이지만 병적 변이를 유전자 검사로 확인하기 어려운 경우가 많다.
한편, 혼합형 이상지질혈증(mixed dyslipidemia 또는 familial combined hyperlipidemia, FCH)은 LDL-C와 중성지방(triglyceride)의 동반 상승을 특징으로 하며, 경우에 따라 고밀도지단백 콜레스테롤(high-density lipoprotein cholesterol, HDL-C)이 감소하기도 한다. 이는 강한 유전적 소인을 가지며, 조기 ASCVD 발생 위험이 높아 조기 진단과 적극적인 치료가 필수적이다.
죽상동맥경화성 심혈관질환(Atherosclerotic cardiovascular disease, ASCVD)은 무엇인가?
죽상경화증(Atherosclerosis)은 전 세계적으로 가장 중요한 만성 혈관 질환 중 하나로, 대형 탄성 동맥(elastic artery)과 근육형 동맥(muscular artery)의 내막(intima)에 지질, 염증세포, 평활근세포, 그리고 섬유성 기질이 비정상적으로 축적되는 병리학적 과정을 의미한다. 이러한 변화는 초기에는 무증상 상태에서 수십 년간 서서히 진행되며, 동맥 내강의 협착이나 혈류 장애를 즉각적으로 유발하지 않을 수 있다.
병리학적으로는 지방선조(fatty streak)의 형성에서 시작하여, 섬유성 플라크(fibrous plaque)와 복합 병변(complicated lesion)으로 점진적으로 진행한다. 이 과정에는 내피세포 기능장애(endothelial dysfunction), 산화 변성된 저밀도지단백(oxidized LDL)의 침착, 염증 반응, 평활근세포 증식 및 기질 침착, 그리고 플라크의 파열 또는 미란에 따른 혈전 형성이 연속적으로 관여한다.
죽상경화성 심혈관질환(Atherosclerotic cardiovascular disease, ASCVD)은 이러한 죽상경화증이 임상적으로 발현된 상태를 포괄하는 개념이다. ASCVD에는 관상동맥질환(coronary heart disease, CHD), 허혈성 뇌졸중(ischemic stroke)과 일과성 허혈발작(transient ischemic attack, TIA), 그리고 말초동맥질환(peripheral arterial disease, PAD) 등이 포함된다. 즉, 죽상경화증이 혈관벽 내부에서 일어나는 병리학적 변화를 지칭한다면, ASCVD는 이러한 변화가 특정 혈관의 혈류를 현저히 방해하거나 혈전을 유발함으로써 발생하는 임상적 결과를 의미한다.
ASCVD의 발생은 죽상경화증의 진행과 직결되어 있으며, 특히 저밀도지단백 콜레스테롤(LDL-C)의 장기간 상승이 핵심적 병인 인자로 확립되어 있다. LDL-C 상승은 죽상경화증을 유발하는 필수적 요인으로, 기초과학 연구, 전향적 코호트 연구, 무작위 대조 임상시험 모두에서 LDL-C와 ASCVD 위험 간의 명확한 인과관계가 확인되었다.
그러나 LDL-C 강하 치료가 ASCVD 발생 위험을 감소시킨다는 방대한 근거가 축적되어 있음에도 불구하고, 전 세계적으로 고위험군 및 초고위험군 환자 중 상당수는 여전히 LDL-C 목표치에 도달하지 못하고 있으며, 지난 수십 년간 이 비율의 뚜렷한 개선은 관찰되지 않았다.
PCSK9(Proprotein convertase subtilisin kexin type 9)이란 무엇인가?
혈장 내 저밀도지단백 콜레스테롤(LDL-C)은 주로 간세포 표면에 존재하는 LDL 수용체(LDL receptor, LDLR)를 통해 제거된다. LDL이 LDLR에 결합하면 이 복합체는 클라트린-피복 소낭(clathrin-coated vesicle)을 통해 세포 내로 내재화되어 엔도솜(endosome)으로 이동한다. 이 과정에서 LDL은 수용체로부터 분리된 후 리소좀(lysosome)에서 분해되고, LDLR은 재활용되어 다시 세포 표면으로 이동함으로써 추가적인 LDL 제거에 활용된다.
PCSK9(Proprotein Convertase Subtilisin/Kexin Type 9)은 이러한 LDLR 재활용 과정을 억제하고, LDLR의 리소좀 분해를 촉진하는 역할을 한다(Figure 1). 순환 중인 PCSK9은 특히 간세포 표면의 헤파란 황산 프로테오글리칸(heparan sulfate proteoglycans, HSPG)과 결합하여 세포 내로 유입되며, LDLR의 분해를 선택적으로 강화한다. 실제로 PCSK9 유전자 결손 생쥐에서는 간 내 LDLR 발현이 증가하고 혈장 LDL-C가 감소하며, 스타틴 치료에 대한 반응성이 향상되는 것이 확인되었다.
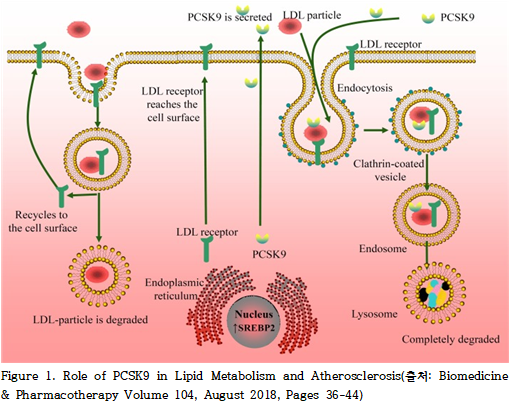
LDL은 간에서 분비되는 중성지방 풍부 리포단백질인 초저밀도지단백(very low-density lipoprotein, VLDL)의 대사 산물이다. VLDL은 혈관 내에서 지방단백질 리파아제(lipoprotein lipase)에 의해 중성지방이 가수분해되어 중간밀도지단백(intermediate-density lipoprotein, IDL)으로 전환되며, 이후 다시 LDL로 변환된다. PCSK9은 VLDL의 주요 구조 단백질인 아포지단백 B100(apolipoprotein B100, apoB100)과 직접 결합하여 그 분해를 억제하고, 결과적으로 VLDL의 분비를 촉진할 수 있다.
실제로 PCSK9 유전자 결손 생쥐에서는 간 내 apoB 분비와 혈장 LDL-C가 감소하는 반면, 기능획득 변이를 가진 PCSK9은 간암 세포주에서 apoB100의 분비를 증가시킨 바 있다. 이러한 결과는 PCSK9이 간세포 표면의 LDLR 수를 감소시키는 것뿐 아니라, VLDL 분비를 증가시켜 LDL 생성에도 기여할 수 있음을 시사한다. 다만 간세포는 일반적으로 apoB100을 과량 생산하며, VLDL 분비의 병목 단계는 apoB100의 지질화(lipidation) 과정이므로, PCSK9 매개 VLDL 분비 증가의 생리적 중요성은 제한적일 수 있다.
PCSK9은 간 이외에도 다양한 조직에서 발현되며, 혈관 평활근세포(vascular smooth muscle cell, VSMC), 대식세포, 내피세포뿐 아니라 췌장, 신장, 장, 중추신경계 등에서도 확인된다. 특히 혈류 전단 응력이 낮은 대동맥이나 대퇴동맥의 분지부와 같이 죽상경화증 호발 부위에서 혈관벽의 PCSK9 발현이 높게 관찰된다. 배양된 VSMC는 내피세포보다 훨씬 더 많은 PCSK9을 생성하며, 이로 인해 VSMC 및 대식세포 내 LDLR 수준이 감소할 수 있다. 이러한 변화는 LDL 제거 능력을 저해하고, LDL이 혈관벽에 잔류하여 죽상경화증 진행을 촉진하는 병리적 기전으로 작용할 가능성이 제기되고 있다.
PSCK 억제제에는 어떤 약제가 있는가?
혈중 LDL-C을 효과적으로 감소시키는 것은 ASCVD의 예방과 치료에서 핵심 전략으로 자리잡고 있다. 스타틴(statin)은 HMG-CoA 환원효소를 억제하여 간에서의 콜레스테롤 생합성을 감소시키고, LDL 수용체(LDL receptor, LDLR) 발현을 증가시킴으로써 LDL-C를 저하시킨다.
이러한 기전으로 인해 스타틴은 1차 치료제로 널리 사용되어 왔으나, 일부 환자에서는 고용량 스타틴 또는 에제티미브 병용에도 불구하고 목표 LDL-C 수치에 도달하지 못하거나, 약물 관련 부작용으로 장기 치료 지속이 어려운 한계가 존재한다.
이러한 한계를 극복하기 위해 새로운 지질강하제들이 개발되었으며, 그중에서도 PCSK9을 표적하는 치료제들이 주목받고 있다. PCSK9은 간세포 표면의 LDLR을 리소좀으로 유도하여 분해를 촉진함으로써 LDLR의 재활용을 억제하고, 결과적으로 혈중 LDL-C 제거를 감소시키는 단백질이다. 따라서 PCSK9 활성을 억제하면 간세포 표면의 LDLR 수가 증가하고, 이를 통해 혈중 LDL-C를 효과적으로 저하시킬 수 있다.
현재 임상적으로 사용되는 PCSK9 억제제는 크게 두 계열로 구분된다. 첫째, 인간 단일클론 항체(monoclonal antibody) 계열로, 순환 중 PCSK9과 직접 결합하여 LDLR과의 상호작용을 차단한다. 대표적으로 에볼로쿠맙(Evolocumab, 상품명 Repatha)과 알리로쿠맙(alirocumab, 상품명 Praluent)이 있으며, 이들 약제는 2주 또는 4주 간격의 피하 주사제로 투여된다. 대규모 임상연구인 FOURIER 및 ODYSSEY Outcomes를 통해 이들 약제가 LDL-C를 유의하게 감소시킬 뿐만 아니라 주요 심혈관 사건 발생을 줄이는 효과가 입증되었다.
둘째, 소간섭 RNA(small interfering RNA, siRNA) 기반 치료제가 있다. 대표적으로 인클리시란(inclisiran)은 간세포 내에서 PCSK9 mRNA를 선택적으로 분해하여 PCSK9 단백질 발현 자체를 억제한다. 이 약제는 연 2회의 피하 투여만으로도 지속적인 LDL-C 강하 효과를 유도할 수 있으며, 복약 순응도 측면에서 뚜렷한 장점을 제공한다.
인클리시란(렉비오)는 어떤 약제인가?
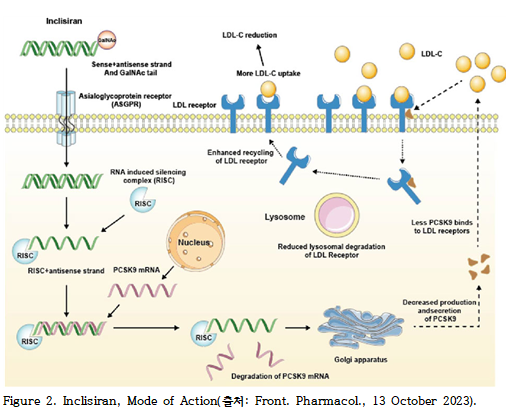
인클리시란은 이중가닥 소간섭 리보핵산(siRNA)으로, 센스 가닥(sense strand)에 삼분지 구조의 N-아세틸갈락토사민(triantennary N-acetylgalactosamine, GalNAc)이 결합되어 있다. 이 구조는 아실로당 수용체(asialoglycoprotein receptor, ASGPR)를 통한 간세포(hepatocyte)로의 선택적 흡수를 촉진한다. 세포 내로 유입된 인클리시란은 RNA 간섭(RNA interference) 경로를 통해 PCSK9 mRNA를 선택적으로 분해함으로써 단백질 발현을 억제한다.
이 과정의 결과로 PCSK9 단백질의 생성이 감소하고, LDL 수용체(LDL receptor, LDLR)의 재활용과 세포 표면 발현이 증가한다. 발현이 증가한 LDLR은 혈액 내 저밀도지단백 콜레스테롤(low-density lipoprotein cholesterol, LDL-C)을 보다 효율적으로 흡수하게 되며, 이를 통해 혈중 LDL-C 농도가 유의하게 저하된다.
인클리시란의 약리 기전은?
인클리시란(inclisiran)은 간세포막에 존재하는 ASGPR에 선택적으로 결합함으로써 세포 내로 흡수된다. 이 과정에서 삼분지 구조의 GalNAc이 핵심적인 역할을 하며, GalNAc는 당 분자로서 인클리시란이 ASGPR에 대해 높은 친화도와 선택성을 가지도록 돕는다. ASGPR은 간세포에서 당단백질의 엔도시토시스(endocytosis)를 매개하는 수용체로, 인클리시란은 이 경로를 통해 효율적으로 간세포 내로 유입된다.
세포 내로 진입한 인클리시란은 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 결합한다. RISC는 siRNA의 가이드 가닥을 이용하여 표적 mRNA를 인식하고 절단하는 단백질 복합체이다. 이 과정에서 인클리시란의 안티센스(antisense) 가닥이 PCSK9 단백질을 암호화하는 mRNA에 결합하여, 해당 mRNA를 선택적으로 절단하고 분해한다. 결과적으로 PCSK9 단백질의 합성이 억제된다(Figure 2).
PCSK9은 간세포 표면의 LDL 수용체(LDL receptor, LDLR) 발현을 조절하는 핵심 단백질로, LDLR에 결합하여 이를 리소좀으로 유도하고 분해시킴으로써 혈중 LDL 콜레스테롤(LDL-C) 제거 능력을 저하시킨다. 따라서 인클리시란은 PCSK9 생성을 억제하여 간세포 표면의 LDLR 발현을 증가시키며, 이로써 혈중 LDL-C를 효율적으로 감소시키는 효과를 나타낸다.
렉비오의 임상 결과는 어떠한가?
LEQVIO(렉비오)의 유효성은 총 3건의 무작위, 이중눈가림, 위약대조 임상시험을 통해 평가되었다. 이들 연구는 이형접합 가족성 고콜레스테롤혈증(HeFH), 임상적으로 확인된 죽상경화성 심혈관질환(ASCVD), 또는 ASCVD 고위험군에 해당하는 성인 총 3,660명을 대상으로 하였다.
이들은 모두 최대 내약 용량의 스타틴 치료를 받고 있음에도 불구하고 추가적인 LDL-C 저하가 필요한 환자들이었다. 세 임상시험 모두에서 치료군 간의 인구학적 특성 및 기저 질환 특성은 균형 있게 분포되어 있었다.
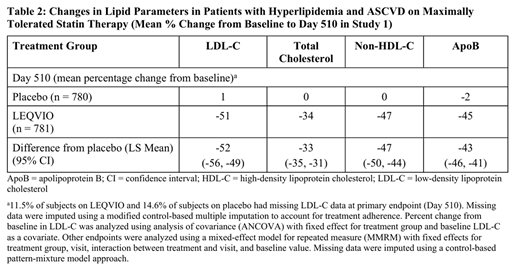
임상 연구 1(ORION-10)은 다기관, 이중눈가림, 무작위 배정, 위약대조 방식으로 수행된 18개월간의 임상시험으로, 죽상경화성 심혈관질환(ASCVD)을 가진 1,561명의 환자가 등록되었다. 이들은 LEQVIO 284mg 피하주사 또는 위약을 1:1 비율로 배정받아 1일차, 90일차, 270일차, 450일차에 각각 투여되었다.
모든 참가자는 최대 내약 용량의 스타틴 치료를 받고 있었으며, 추가적인 LDL 콜레스테롤(LDL-C) 저하가 필요한 상태였다. 스타틴 또는 기타 지질 저하 치료제의 사용 여부에 따라 환자들은 층화 배정되었으며, PCSK9 억제제를 복용 중인 환자는 연구에서 제외되었다.
등록 당시 평균 연령은 66세(범위: 35~90세)였으며, 전체의 60%가 65세 이상, 31%는 여성, 86%는 백인, 13%는 흑인 또는 아프리카계 미국인, 1%는 아시아인, 그리고 14%는 히스패닉 또는 라틴계로 자가 보고하였다. 또한 45%의 환자는 당뇨병을 동반하고 있었으며, 기저 LDL-C 평균치는 105mg/dL이었다. 무작위 배정 시점에서 89%의 환자가 스타틴 치료를 받고 있었고, 그 중 69%는 고강도 스타틴 치료를 받고 있었다.
연구 결과, 1차 유효성 평가 변수는 기저 시점 대비 510일차까지의 LDL-C 수치 변화율이었다. 그 결과, LEQVIO군과 위약군 간 평균 LDL-C 변화율의 차이는 -52%였으며, 95% 신뢰구간은 -56%에서 -49%, 통계적으로 유의미한 차이가 나타났다(Table 2).
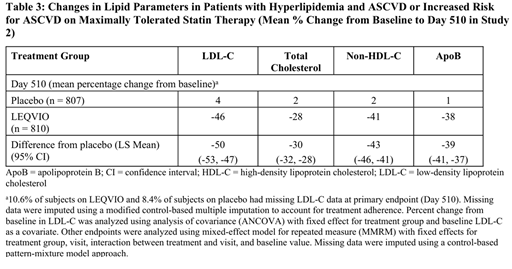
임상 연구 2(ORION-11)은 다기관, 이중눈가림, 무작위 배정, 위약대조 방식으로 수행된 18개월 임상시험으로, 죽상경화성 심혈관질환(ASCVD) 또는 ASCVD 고위험군에 해당하는 성인 1,617명을 대상으로 하였다. 피험자들은 LEQVIO 284mg 피하주사(n = 810) 또는 위약(n = 807)을 1일차, 90일차, 270일차, 450일차에 각각 투여받도록 1:1 비율로 무작위 배정되었다.
참가자는 모두 최대 내약 용량의 스타틴 치료를 받고 있었으며, 경우에 따라 기타 지질저하 치료제를 병용하고 있었고, 추가적인 LDL 콜레스테롤(LDL-C) 감소가 필요한 상태였다. 환자들은 국가 및 스타틴/기타 지질저하제 사용 여부에 따라 층화 배정되었으며, PCSK9 억제제를 복용 중인 환자는 연구에서 제외되었다.
기저 시점에서 평균 연령은 65세(범위: 20~88세)였으며, 55%가 65세 이상, 28%는 여성, 98%는 백인, 1%는 흑인 또는 아프리카계 미국인, 1% 미만은 아시아인, 1% 미만이 히스패닉 또는 라틴계로 자가 보고하였다. 또한 35%의 환자가 당뇨병을 동반하고 있었으며, 기저 LDL-C 평균치는 105 mg/dL이었다. 무작위 배정 시점에서 95%는 스타틴 치료를 받고 있었고, 이 중 78%는 고강도 스타틴 치료 중이었다.
이 연구의 1차 유효성 평가 변수는 기저 시점 대비 510일차까지의 LDL-C 변화율이었다. 그 결과, LEQVIO군과 위약군 간 평균 LDL-C 변화율 차이는 -50%였으며, 95% 신뢰구간은 -53%에서 -47%, 통계적으로 유의한 차이가 확인되었다(Table 3).
연구 1과 연구 2의 통합 분석 결과, 치료 효과는 성별, 연령, 인종, 질환 특성, 지역, 당뇨병 유무, 체질량지수(BMI), 기저 LDL-C 수치, 스타틴 치료 강도 등 사전에 정의된 하위 그룹 전반에서 일관되게 유사하게 나타났다.
임상 연구 3(ORION-9)은 다기관, 이중눈가림, 무작위 배정, 위약대조 방식으로 수행된 18개월 임상시험으로, 이형접합 가족성 고콜레스테롤혈증(HeFH)을 가진 482명의 환자가 등록되었다.
피험자들은 LEQVIO 284mg 피하주사(n = 242) 또는 위약(n = 240)을 1일차, 90일차, 270일차, 450일차에 각각 투여받도록 1:1 비율로 무작위 배정되었다.
모든 환자는 최대 내약 용량의 스타틴 치료를 받고 있었으며, 경우에 따라 기타 지질저하 치료제를 병용 중이었고, 추가적인 LDL 콜레스테롤 감소가 필요한 상태였다. HeFH 진단은 유전자 검사(genotyping) 또는 임상 진단 기준(Simon Broome 기준 또는 WHO/네덜란드 이상지질혈증 네트워크 기준)에 따라 이루어졌다. 환자들은 국가 및 스타틴/기타 지질저하제 사용 여부에 따라 층화 배정되었으며, PCSK9 억제제 사용자는 제외되었다.
기저 시점에서 평균 연령은 55세(범위: 21~80세)였으며, 22%는 65세 이상, 53%는 여성, 94%는 백인, 3%는 흑인 또는 아프리카계 미국인, 3%는 아시아인, 3%는 히스패닉 또는 라틴계로 자가 보고하였다. 10%는 당뇨병을 동반, 기저 LDL-C 수치는 평균 153 mg/dL이었다. 무작위 배정 시점에서 90%는 스타틴 치료, 74%는 고강도 스타틴 치료, 52%는 에제티미브 병용 치료를 받고 있었다. 가장 흔히 사용된 스타틴은 아토르바스타틴과 로수바스타틴이었다.
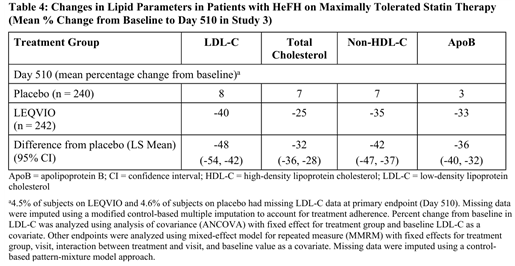
이 연구의 1차 유효성 평가 변수는 기저 시점 대비 510일차까지의 LDL-C 변화율이었다. 그 결과, LEQVIO군과 위약군 간 평균 LDL-C 변화율의 차이는 -48%, 95% 신뢰구간은 -54%에서 -42%, 통계적으로 매우 유의한 차이가 확인되었다(Table 4).
인클리시란의 어떤 쟁점이 예상되는가?
인클리시란은 갈낙(GalNAc) 결합체를 이용해 간세포 특이적 전달을 구현하였으며, 반감기가 길어 초기 투여 후 3개월 시점에서 1회 추가 투여를 한 뒤에는 매 6개월 간격의 피하주사만으로 치료 효과를 유지할 수 있다. 이러한 간헐적 투여 방식은 기존의 PCSK9 단클론항체(mAb)와 비교해 환자 순응도 측면에서 분명한 이점을 제공하며, 임상 현장에서의 장기 관리 전략에 변화를 가져올 잠재력을 지닌다.
3상 임상시험인 ORION-9, ORION-10, ORION-11에서 인클리시란은 18개월 동안 위약 대비 평균 약 50%의 LDL-C 지속 감소 효과를 입증하였으며, 효과 변동 폭이 적어(peak-trough variation 최소화) 일정한 치료 곡선을 유지하였다. 이러한 특징은 LDL-C의 지속적 억제가 중요한 죽상경화성 심혈관질환(ASCVD) 고위험군 환자에서 임상적으로 유리할 수 있다. 또한 약물의 전신적 부작용 발생률은 위약군과 유사하였으며, 가장 흔한 이상반응은 주사 부위 반응으로, 대부분 경미하고 일시적이었다.
그러나 인클리시란의 임상적 가치에는 여전히 한계가 존재한다. 현재까지 보고된 자료는 LDL-C 감소라는 대리 지표(surrogate endpoint)에 기반하고 있으며, 심근경색, 뇌졸중, 심혈관 사망 등 주요 심혈관 사건을 감소시키는지에 대한 직접적 근거는 확보되지 않았다. 이를 검증하기 위한 대규모 무작위 대조시험 결과는 아직 발표되지 않았으며, 이는 약물의 장기적 위치를 결정하는 핵심 변수로 작용할 것이다. 또한 인클리시란은 투여 후 효과 발현까지 수 주에서 수개월이 소요되므로, 급성 관상동맥증후군(ACS) 직후와 같이 LDL-C의 신속한 강하가 필요한 상황에서는 mAb에 비해 제한적일 수 있다.
더불어, siRNA 기반 치료제의 장기 안전성 자료는 제한적이며, 10년 이상 장기간 투여 시 면역 반응이나 비표적(off-target) 효과 가능성은 배제할 수 없으므로 지속적인 추적 관찰이 필요하다. 결과적으로 인클리시란은 PCSK9 억제제 영역에서 투여 편의성과 장기간 지속 효과라는 혁신적 특성을 바탕으로 차별화된 치료 옵션을 제공한다. 그러나 하드 아웃컴 자료의 부재, 효과 발현 속도의 한계, 경제성 논란, 장기 안전성 불확실성 등은 현 시점에서 광범위한 초기 사용을 제약하는 요소로 작용한다. 향후 심혈관 사건 감소에 대한 결정적 임상 근거가 확보되고 비용-효과성이 입증될 경우, 인클리시란은 고위험 ASCVD 환자의 2차 예방 및 장기 관리 전략에서 핵심적 역할을 차지할 잠재력이 크다.
참고 문헌 1. Xiao-Long Lin et al. “Role of PCSK9 in Lipid Metabolism and Atherosclerosis” Biomedicine & Pharmacotherapy Volume 104, August 2018, Pages 36-44) 2. Yanzhen Zhang et al. “Inclisiran: a new generation of lipid-lowering siRNA therapeutic“ Front. Pharmacol., 13 October 2023. 3. Xiao-dan Xia et al. “Regulation of PCSK9 Expression and Function: Mechanisms and Therapeutic Implications” Front. Cardiovasc. Med. 8:764038, 2021. 4. 기타 인터넷 자료(보도 자료, 제품 설명서 등).
관련기사
-
⑩세 번째 RNAi 치료제...원발성옥살산뇨증 치료 '옥슬루모'
2025-08-22 06:02
-
⑨ 최초의 RNAi 치료제 '기블라리'...국내 희귀약 지정
2025-08-08 06:10
-
⑧ 차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼에 대해
2025-07-25 06:33
-
⑦ 화이자 비강분무제 급성 편두통 치료제 '자브즈프렛'
2025-07-11 06:47
-
⑥ PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대
2025-06-27 06:00
-
⑤ 세계 첫 텔로머레이스 억제제 '라이텔로'...국내 도입 예상
2025-06-13 06:24
-
④ 원형탈모 치료제 '렉셀비', 세 번째 경구 JAK 억제제
2025-05-30 06:40
- 익명 댓글
- 실명 댓글
- 댓글 0
- 최신순
- 찬성순
- 반대순
오늘의 TOP 10
- 1강남구약, 첫 회원 스크린 골프대회…나호성·오선숙 약사 우승
- 2서울시약, 전국여약사대회 앞두고 역대 여약사부회장 간담회
- 3SK바이오팜, 미 항암 자회사에 512억 수혈…TPD 개발 지원
- 4복지부, 미국 제약사 릴리와 7500억원 국내투자 MOU
- 5서울시약, 창고형약국 면허대여 불법 제안 급증에 강력 경고
- 6김영진 서울시약 부회장, '올해의 서울여성상' 수상
- 7메쥬, 영업이익률 67% 목표…상급종합병원 절반 도입
- 8"약가제도, 이제는 알아야 할 때" 건약, 설명회 연다
- 9서방형 약물 전달재 등 의료기기 4개 품목 신설
- 10휴베이스 밸포이, 출시 18개월 만에 판매 100만병 돌파




























































![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)

![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202602/1770888420842.png)
![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/partner/products/3f39593e-6318-4dd9-a778-c008c868b5c8.png)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
![[레비온] PDRN+EGF, 레비온RX PDRN EGF 크림](https://i.baropharm.com/products/202512/1765949426601.png)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)



