⑨ 최초의 RNAi 치료제 '기블라리'...국내 희귀약 지정
- 최병철 박사
- 2025-08-08 06:10:01
-
가
- 가
- 가
- 가
- 가
- 가
- 최병철 박사의 노벨드럭 인사이트
- 급성 간성 포르피린증 치료제...피하주사 월 1회 투여 가능
- PR
- 잘 나가는 약국은 매달 보는 신제품 정보 ‘팜노트’
- 팜스타클럽

차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼 ①기블라리
기블라리(Givlaari®, giv-lah'-ree, 성분명: 기보시란, Givosiran, Alnylam)은 아미노레불린산 합성효소 1(aminolevulinate synthase 1, ALAS1)을 표적으로 하는 소간섭 RNA(small interfering RNA, siRNA) 치료제로, 2019년 미국 FDA, 2020년 유럽 EMA에서 ‘급성 간성 포르피린증(Acute Hepatic Porphyria, AHP)’ 치료제로 승인되었다. 국내에서는 2024년 GIFT(Global Innovative products on Fast Track)로 지정된 후, 희귀의약품으로 등록되었다.
급성 간성 포르피린증(AHP)은 간에서 헴(heme) 생합성에 관여하는 특정 효소의 유전적 결함으로 인해 독성 전구체인 포르피린이 축적되어 발생하는 매우 드문 질환이다. 환자는 심한 복통, 구토, 발작 등 쇠약하게 만드는 급성 증상뿐 아니라, 통증을 포함한 만성 증상도 동반할 수 있다.
Heme은 산소 운반, 에너지 생성, 해독 대사, 산화 스트레스 조절 등 생명 유지에 필수적인 다양한 생리적 경로에 관여한다. 따라서 heme 생합성의 이상이나 전구체 공급의 장애, 또는 특정 조직에서의 heme 이용률 감소는 조직 산소 공급 저하로 이어져 피로, 운동 시 호흡곤란, 심계항진 등의 전신 증상을 유발한다. 또한 heme은 미토콘드리아 전자전달계의 핵심 구성 요소로 ATP 생성에 관여하므로, 결핍 시 에너지 대사 장애로 인해 신경세포 및 근육세포 기능 저하가 나타날 수 있다.
기보시란은 GalNAc(GalNAc-conjugated delivery system)을 이용한 간세포 특이적 이중가닥 siRNA로, 간세포 내 ALAS1 mRNA를 선택적으로 분해함으로써 이 유전자 발현을 감소시킨다. 결과적으로 신경독성을 유발하는 중간대사산물인 아미노레불린산(ALA)과 포르포빌리노겐(PBG)의 혈중 농도가 낮아지고, 이는 AHP의 급성 발작 빈도와 증상 악화를 유발하는 병태생리적 기전을 억제하는 효과를 나타낸다.
기보시란의 유효성은 다국가 무작위 이중맹검 위약대조 3상 임상시험인 ENVISION 연구를 통해 입증되었다. 이 연구에서 기보시란은 위약에 비해 연간 AHP 발작률을 74% 감소시켰으며, 이는 통계적으로 유의한 차이를 보였다. 해당 연구 결과는 2020년 6월 11일자 The New England Journal of Medicine(NEJM)에 게재되었다.
6개월 치료 기간 동안 전혀 발작을 경험하지 않은 환자의 비율은 기보시란 치료군에서 50%, 위약군에서는 16.3%로 보고되어, 기보시란의 임상적 유용성을 뒷받침한다.
급성 간성 포르피린증(Acute Hepatic Porphyria, AHP)은 어떤 질환인가? 포르피리아(Porphyria)는 그리스어 porphura(보라색 염료)에서 유래한 명칭으로, 일부 환자의 소변이나 피부가 햇빛(자외선)에 노출될 때 붉거나 보라색으로 변색되는 현상에서 비롯되었다. 포르피리아는 헴(heme) 생합성 경로의 8단계 중 하나를 촉매하는 효소에 유전적 또는 후천적으로 이상이 생겨 발생하는 질환군을 말한다.
각 효소에 결함이 생기면 해당 단계 이전의 전구체 물질이 체내에 축적되거나 소변 등을 통해 과도하게 배출되며, 이로 인해 다양한 임상 증상이 나타난다. 포르피리아의 유병률은 질환의 아형, 국가 및 지역에 따라 다양하게 보고된다.
포르피리아는 간성(hepatic)과 조혈성(erythropoietic)으로 분류되며, 이 중 급성 간성 포르피린증(Acute Hepatic Porphyria, AHP)은 간에서 헴 생합성에 관여하는 특정 효소의 유전적 결함으로 인해 발생하는 드물고 만성적인 다기관 질환군이다. AHP는 다시 급성 간헐성 포르피린증(acute intermittent porphyria, AIP), 이형성 포르피린증(variegate porphyria, VP), 유전성 코프로포르피린증(hereditary coproporphyria, HCP), 델타-아미노레불린산 탈수소효소 결핍 포르피린증(delta-aminolevulinic acid dehydratase-deficiency porphyria, ALAD deficiency porphyria)으로 구분한다.
이 중 AIP가 가장 흔한 형태로 보고된다. 각 아형은 간 내 특정 heme 생합성 효소의 기능적 결핍을 초래하며, 이로 인해 자유 heme의 간내 농도가 감소한다. 이에 대한 보상 작용으로 헴 생합성 경로의 속도 조절 효소인 ALA 합성효소 1(ALAS1)의 발현이 유도된다.
그러나 ALAS1의 과발현은 독성 중간대사산물인 아미노레불린산(5-aminolevulinic acid, ALA)과 포르포빌리노겐(porphobilinogen, PBG)의 과도한 생성 및 축적을 초래한다. 이들 대사산물은 신경계, 간, 신장 등 여러 장기에 손상을 유발하는 병태생리학적 핵심 인자로 작용하며, 특히 ALA와 PBG는 강한 신경독성 물질로 알려져 있다. 이로 인해 AHP는 주로 신경학적 증상을 동반하는 급성 발작을 특징으로 한다.
AHP의 진단은 임상적 의심에 기반하여 시행되는 생화학적 검사로 확립할 수 있으며, 특히 소변 내 PBG 농도가 정상 상한치의 3배 이상으로 상승한 경우 AHP를 강력히 시사한다. 이러한 수준의 PBG 상승은 AIP, VP, HCP에서만 관찰되며, 이는 AHP 진단의 특이성과 조기 인지에 중요한 근거가 된다.
AHP는 임상적으로 급성 발작과 만성 증상이 혼재된 형태로 나타난다. 급성 발작은 심한 복통, 오심, 구토, 빈맥, 고혈압, 저나트륨혈증, 의식 변화, 근력 저하 등으로 나타나며, 치료가 지연될 경우 생명을 위협할 수 있다. 많은 환자들이 발작 간에도 지속적인 통증, 피로, 오심 등 만성 증상을 경험하며, 이는 삶의 질을 현저히 저하시킨다. 일부 환자는 반복되는 통증으로 인해 진통제, 특히 오피오이드(opioid)의 사용이 필요하게 되며, 이에 따른 약물 의존의 위험성 또한 고려되어야 한다.
아미노레불린산 합성효소 1(5-Aminolevulinate synthase 1, ALAS1)는 무엇인가?
아미노레불린산 합성효소 1(ALAS1)은 간을 비롯한 대부분의 비조혈성(non-erythroid) 조직에서 발현되는 heme 생합성 경로의 속도 조절(rate-limiting) 효소이다. ALAS1은 미토콘드리아 내에서 glycine과 succinyl-CoA를 기질로 사용하여 아미노레불린산(5-aminolevulinic acid, ALA)을 생성하며, 이는 heme 생합성의 첫 번째이자 핵심적인 반응이다.
ALAS1의 발현은 간세포 내 자유 heme 농도에 의해 주로 음성 되먹임 조절(negative feedback regulation)을 받는다. 즉, 자유 heme이 충분할 경우 ALAS1의 전사(transcription)와 번역(translation)이 억제되며, 반대로 자유 heme이 고갈되면 ALAS1의 발현이 유도되어 heme 합성이 촉진된다. 이러한 조절 기전은 간세포의 대사 요구에 따른 heme 농도 유지에 필수적이다(Figure 1).
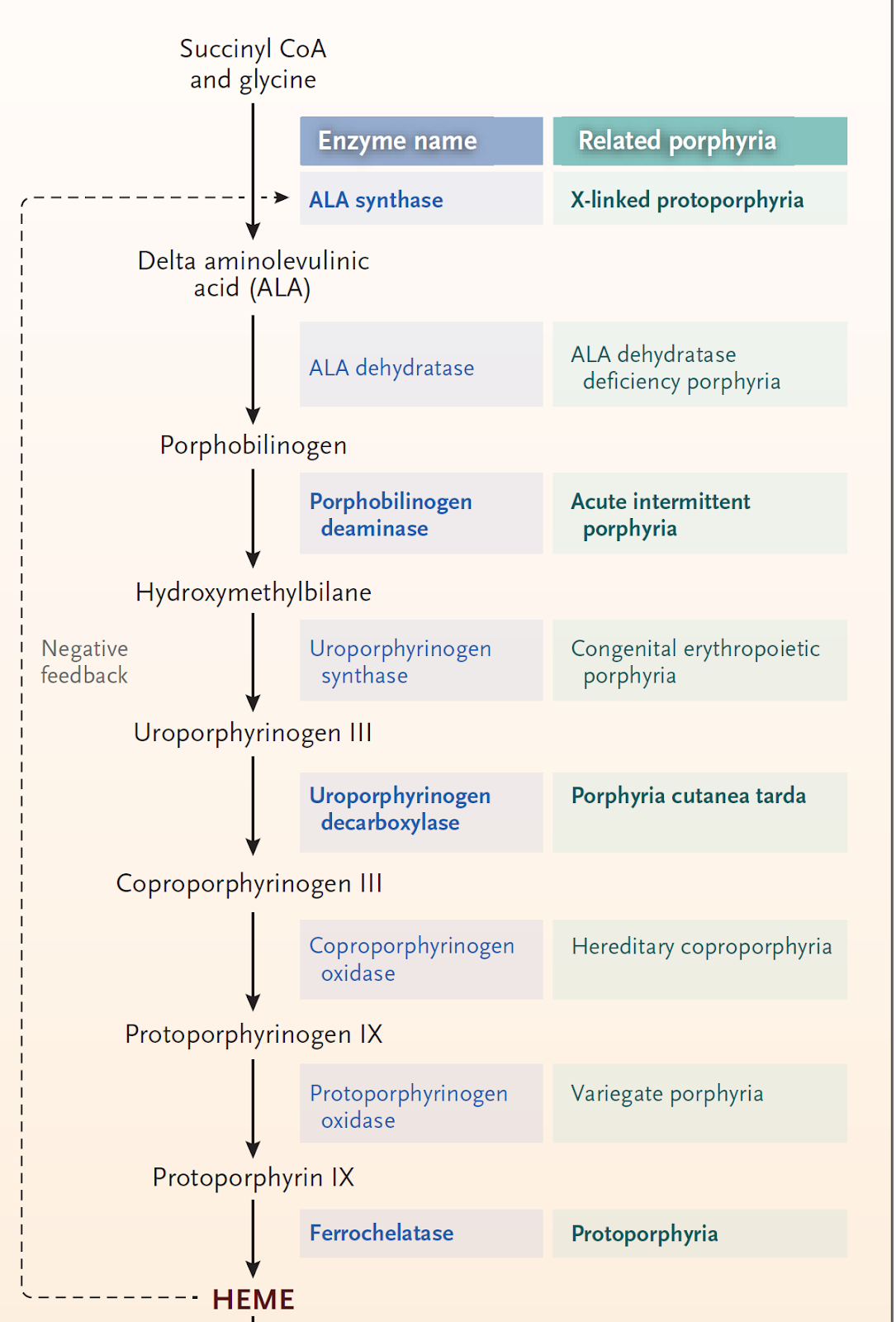
급성 간성 포르피린증(AHP)과 같은 질환에서는 heme 생합성 경로의 하위 효소 중 하나에 결함이 존재하여 heme의 생합성이 차단된다. 그 결과, 간 내 자유 heme 농도가 감소하고, 이에 대한 보상 기전으로 ALAS1의 발현이 과도하게 증가한다. 그러나 하위 효소의 기능 장애로 인해 생성된 ALA는 정상적으로 대사되지 못하고 축적되며, 이는 중추 및 말초 신경계에 독성을 유발하는 주된 병태생리적 원인으로 작용한다.
따라서 ALAS1은 heme 생합성 경로의 대사 항상성 유지에 핵심적인 역할을 하며, 병리적인 상황에서는 질병의 발현과 직접적으로 연관되는 주요 분자 표적이 된다. 최근에는 ALAS1의 발현을 억제함으로써 ALA 및 포르포빌리노겐(PBG)의 축적을 방지하고 급성 발작을 예방하는 치료 전략이 개발되고 있으며, 이는 AHP 치료의 새로운 전기를 마련하고 있다.
헴(Heme)은 어떤 물질인가?
Heme은 철(Fe²& 8314;) 이온을 중심으로 하는 테트라피롤 고리 구조(tetrapyrrole ring structure)를 갖는 필수적인 생리적 보조인자로, 주로 헤모글로빈, 미오글로빈, 시토크롬, 카탈라아제 및 다양한 산화효소의 구성 성분으로 작용한다. 이러한 heme은 단순한 구조적 단백질 구성 요소 외에도 산소 운반, 전자 전달, 산화 환원 반응 및 약물 대사 등 광범위한 생물학적 반응에서 핵심적 역할을 수행한다.
Heme의 생합성은 진핵세포에서 고도로 보존된 경로를 통해 이루어지며, 총 8단계의 효소 반응을 거친다. 이 과정은 glycine과 succinyl-CoA로부터 시작되며, 최초 반응은 미토콘드리아 내에서 ALA synthase(ALAS)에 의해 촉매된다.
이후 생성된 5-aminolevulinic acid(ALA)는 세포질로 이동하여 일련의 효소 반응을 거친 후, 다시 미토콘드리아로 들어가 최종적으로 ferrochelatase에 의해 protoporphyrin IX에 철 이온이 삽입되면서 heme이 완성된다. 이처럼 heme 합성은 미토콘드리아와 세포질 사이를 오가는 복합적인 과정을 통해 정교하게 조절된다.
생성된 heme은 조직에 따라 다양한 단백질 복합체에 삽입되어 기능을 수행한 후, 노화된 적혈구의 파괴 등을 통해 대식세포에 의해 분해된다. 이 과정에서 heme oxygenase는 heme을 biliverdin, 일산화탄소(CO), 자유 철 이온으로 분해하며, biliverdin은 biliverdin reductase에 의해 bilirubin으로 환원된다.
비포합형 bilirubin은 간세포로 운반된 후 UDP-glucuronosyltransferase에 의해 포합형으로 전환되어 담즙을 통해 장관으로 배설된다. 장내에서는 포합형 bilirubin이 대사되어 stercobilin 및 urobilin 등의 색소로 전환되며 각각 대변 및 소변을 통해 배설된다.
Heme 생합성과 대사 경로의 교란은 다양한 임상 질환과 밀접히 연관되어 있다. 예를 들어, 생합성 효소 중 특정 단계에 결함이 발생할 경우 전구체의 병적 축적이 일어나며, 이는 포르피리아와 같은 희귀 유전 대사 질환의 원인이 된다. 반면, 분해 단계의 이상은 고빌리루빈혈증 및 황달로 이어질 수 있으며, 이들 물질의 색 변화는 임상 진단에서 중요한 지표로 활용된다. 따라서 heme의 생합성부터 대사, 배설에 이르는 전 과정은 생리적 항상성과 병태생리 모두에서 중추적인 역할을 담당한다.
기보시란은 어떤 약제인가?
기보시란(Givosiran, 제품명: 기블라리, Givlaari)은 ALAS1을 표적으로 하는 소간섭 RNA(siRNA)이다. 이 약제는 간세포 내 ALAS1 mRNA를 선택적으로 분해하여 ALA 및 PBG의 생성을 억제함으로써 AHP의 급성 발작 빈도를 현저히 줄이는 것으로 나타났다.
기보시란은 siRNA로 설계되어 있으며, N-아세틸갈락토사민(GalNAc) 접합체를 이용하여 간세포 특이적으로 전달된다. 이 기술은 Alnylam Pharmaceuticals의 플랫폼인 ESC(Enhanced Stabilization Chemistry) GalNAc-siRNA 기술에 기반하고 있다.
AHP의 치료는 발작 시 hemin 정맥주사 또는 증상 완화에 초점을 두고 있었으나, 근본적인 기전을 직접적으로 조절하는 치료법은 부재하였다. 이러한 한계를 극복하기 위해 개발된 기보시란은 다기관 무작위 이중맹검 위약대조 임상시험인 ENVISION 연구에서는 기보시란 투여군에서 연간 발작 빈도가 위약군에 비해 약 74% 감소하였으며, 통증 감소 및 삶의 질 향상 등 유의한 임상적 개선이 보고되었다.
따라서 기보시란은 RNAi 기술을 활용하여 간세포 내 병적 대사 경로를 조절하는 최초의 siRNA 기반 치료제로, 기존의 대증요법 중심 치료 패러다임을 넘어서는 질병 수정형(disease-modifying) 치료 전략이라고 할 수 있다.
기보시란의 약리학적 기전은?
ALAS1 염기 서열을 가진 합성 이중가닥 RNA(Synthetic double-stranded RNA with ALAS1 sequence)는 GalNAc와 결합하여 간세포에만 대부분 발현되는 galactose 수용체의 일종인 ASGPR(asialoglycoprotein receptor)를 표적으로 결합하여 약물이 선택적으로 간세포에 도달하도록 하며, 간세포 내로 진입한 siRNA는 세포 내 효소인 다이서(Dicer)에 의해 약 20 염기쌍(bp) 조각으로 처리된 후 단일 가닥으로 분리된다.
ALAS1에 상보적인 가닥(가이드 가닥)은 세포 내 ALAS1 mRNA에 결합하고 RNA 유도 침묵 복합체(RISC)에 탑재된다. 이후 가이드 가닥은 ALAS1 mRNA와 염기서열 상 완전한 상보성을 이루어 결합하며, 해당 mRNA는 절단되어 분해된다. 그 결과, ALA1 단백질의 수치가 감소하고 ALA의 생성이 줄어들면서 단백질 번역을 차단된다(Figure 1).
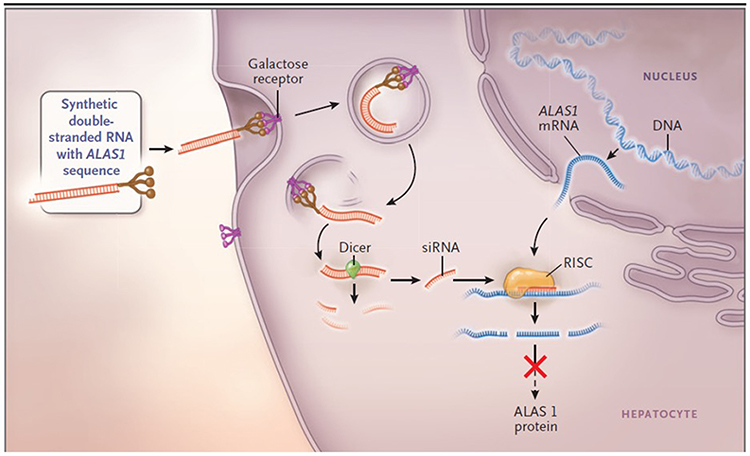
기보시란은 간에 대한 높은 특이성을 가지기 때문에, 약동학 및 흡수, 분포, 대사, 배설(ADME) 프로파일이 쥐 실험에서 모두 우수하게 나타났다. 해당 약동학 연구에 따르면 기보시란의 간 내 농도는 신장보다 11배 높게 나타났다. 기보시란은 심장, 폐, 부신 등 여러 장기에서도 발견되었으나, 간에서의 농도보다 훨씬 낮은 수준으로 검출되었다. 뇌에서는 기보시란이 검출되지 않았으며, 분해된 RNA 조각은 소변으로 배출되었다.
기보시란의 투여 용량에 따라 혈청 내 ALAS1 mRNA 및 소변 내 δ-ALA, PBG 수치가 빠르고 지속적으로, 그리고 용량 의존적으로 감소했다.
ASGPR 수용체가 말초 단핵세포, 복막 대식세포, 자궁내막 세포, 신장 세뇨관 세포 등에서도 발현되기는 하지만, 기보시란은 간에 대한 선택적 표적성을 보여 오프 타깃 효과 가능성이 낮다.
하지만 신장에서의 일부 축적 가능성과 관련하여, 임상시험 및 최근 연구에서는 기보시란 사용 시 혈청 크레아티닌(Cr) 상승과 추정 사구체 여과율(eGFR) 감소가 보고된 바 있으며, 장기적인 신장 기능에 대한 부작용 가능성을 완전히 배제할 수는 없다.
기보시란(GIVLAARI)의 허가 임상 결과는 어떠한가?
기보시란의 급성 간성 포르피린증(AHP) 환자에 대한 유효성은 무작위배정, 이중눈가림, 위약대조, 다국가 임상시험인 ENVISION 연구를 통해 평가되었다.
ENVISION 연구에는 총 94명의 AHP 환자가 등록되었으며, 이 중 89명은 급성 간성 포르피린증(AIP), 2명은 다형 포르피린증(VP), 1명은 유전성 코프로포르피린증(HCP), 2명은 유전자 변이가 확인되지 않은 환자였다. 이들 94명 중 48명은 GIVLAARI군, 46명은 위약군으로 무작위 배정되었다.
해당 환자들은 등록 전 6개월 동안 입원, 응급 진료 방문, 또는 가정에서의 정맥주사용 hemin 투여가 필요한 포르피린 발작을 최소 2회 경험한 경우에만 포함되었으며, 이들을 대상으로 GIVLAARI 2.5mg/kg 또는 위약을 월 1회 피하주사하는 방식으로 1:1 무작위 배정하여 6개월간 치료하였다.
6개월의 이중눈가림 기간이 종료된 후, 93명의 환자가 최대 30개월 동안의 공개연장(open-label extension) 연구에 등록되었다. 연구 기간 중 포르피린 급성 발작의 치료를 위한 hemin 사용은 허용되었다.
연구 대상 환자의 중앙 연령은 37.5세(범위: 19~65세)였으며, 89%는 여성, 78%는 백인이었다. GIVLAARI군과 위약군은 포르피린 발작의 과거 발생 빈도, 이전 hemin 예방요법 사용 여부, 아편유사제(opioid) 복용 여부, 발작 사이 통증에 대한 환자 보고 척도 등에서 유사한 특성을 보였다.
주요 평가 지표는 AHP의 가장 흔한 아형인 AIP 환자에서의 연간 환산 복합 포르피린 발작률이었다. 복합 포르피린 발작은 입원, 응급 의료기관 방문, 또는 자가 투여한 정맥 내 hemin 투여로 정의되었다.
주요 이차 평가 지표는 ALA 및 PBG 수치, 전체 AHP 환자의 연간 발작률, 그리고 급성 간헐성 포르피린증 환자에서의 헴 사용량 및 하루 중 가장 심한 통증 점수였다.
AIP 환자에서 6개월 동안의 연간 환산 복합 포르피린 발작률은 GIVLAARI군에서 평균 3.2회(95% CI, 2.3-4.6), 위약군에서 평균 12.5회(95% CI, 9.4-16.8)로, GIVLAARI군에서 74% 낮은 발작률을 보였다.
AIP 환자들 중에서, GIVLAARI 투여는 요중 ALA 및 PBG 수치 감소, hemin 사용 일수 감소, 그리고 하루 중 가장 심한 통증 점수 개선에 있어 위약보다 더 우수한 효과를 보였다.
GIVLAARI군에서 더 자주 나타난 주요 이상 반응으로는 혈청 아미노트랜스퍼레이스 수치 상승, 혈청 크레아티닌 수치 및 추정 사구체여과율(eGFR)의 변화, 그리고 주사 부위 반응이 있었다.
기보시란의 예상되는 쟁점은 무엇인가?
기보시란은 GalNAc-siRNA 플랫폼을 활용하여 간세포 특이적으로 작용함으로써 높은 치료 효율성을 나타내며, 간세포 표면의 ASGPR 수용체를 이용한 특이적 전달을 통해 오프타깃(off-target) 효과를 최소화하였다. 피하 주사로 월 1회 투여가 가능하며, 실제 임상시험에서 발작 빈도 감소, 통증 완화, 삶의 질 향상 등 유의미한 임상 혜택이 입증되었다.
대표적인 pivotal study인 ENVISION 임상시험은 기보시란의 임상적 유효성과 안전성을 입증하며 미국 FDA 및 EMA의 승인을 획득하는 데 기여하였다. 그러나 ENVISION 연구는 치료 효과와 관련하여 여러 측면에서 제한점이 존재함이 보고되고 있으며, 이는 실제 임상 적용 및 후속 연구 설계에 있어 중요한 고려사항이 된다.
첫째, 연구에 포함된 환자 수가 94명으로 제한적이며, 이 중 대부분이 AIP(acute intermittent porphyria) 환자로 구성되어 AHP 전체 스펙트럼에 대한 일반화에 제약이 있다.
둘째, 이중눈가림 기간은 6개월로 설정되어 있어 장기적 효능 지속성과 안전성 평가에는 부족한 측면이 있다. 특히 연장 연구는 비통제 환경에서 수행되었기에 객관적 유효성 판단에 한계가 있다.
또한 기보시란은 대부분 여성(89%)에게 투여되었기 때문에 성별 간 반응 차이를 평가하기 어렵고, 주요 평가 변수가 급성 발작 빈도 감소에 집중되어 있어 삶의 질, 통증 완화, 기능 회복 등 임상적으로 중요한 지표들은 충분히 반영되지 못하였다. 더불어 일부 환자에서 간 효소 상승, 신기능 변화, 피로 등의 이상반응이 관찰되었으며, 장기간 투여에 따른 누적 독성 가능성은 추후 연구가 요구된다.
뿐만 아니라, 고가의 희귀질환 치료제로서 경제성 평가 역시 중요한 쟁점으로 대두되고 있으며, 특히 발작 빈도가 낮은 환자군에서는 비용 대비 임상적 이득이 불분명하다는 지적이 제기되고 있다.
따라서 기보시란은 RNAi 기반 정기 투여 치료제 중 최초로 승인된 사례로, RNAi 기술의 상업화 가능성을 입증한 전례로도 의의가 깊다. 나아가 희귀 유전질환을 대상으로 한 차세대 치료제 개발의 가능성을 제시함과 동시에, 간 특이적 전달 기술의 실제 적용 가능성 또한 입증하였다. 또한 AHP 환자에게 새로운 치료 옵션을 제공할 것으로 기대된다.
참고문헌 1. Lei Zhang et al. “The therapeutic prospects of N-acetylgalactosamine-siRNA conjugates“ Front. Pharmacol., 14 December 2022. 2 Chaudry Nasir Majeed et al. “Spotlight on Givosiran as a Treatment Option for Adults with Acute Hepatic Porphyria: Design, Development, and Place in Therapy” Drug Design,Developmentand Therapy 2022:16. 3. M. Balwani et al. “Phase 3 Trial of RNAi Therapeutic Givosiran for Acute Intermittent Porphyria” N Engl J Med 2020;382:2289-301. 4. 기타 인터넷 자료(보도 자료, 제품 설명서 등).
관련기사
-
⑧ 차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼에 대해
2025-07-25 06:33
-
⑦ 화이자 비강분무제 급성 편두통 치료제 '자브즈프렛'
2025-07-11 06:47
-
⑥ PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대
2025-06-27 06:00
- 익명 댓글
- 실명 댓글
- 댓글 0
- 최신순
- 찬성순
- 반대순
오늘의 TOP 10
- 1SK바이오팜, 미 항암 자회사에 512억 수혈…TPD 개발 지원
- 2복지부, 미국 제약사 릴리와 7500억원 국내투자 MOU
- 3서울시약, 창고형약국 면허대여 불법 제안 급증에 강력 경고
- 4메쥬, 영업이익률 67% 목표…상급종합병원 절반 도입
- 5"약가제도, 이제는 알아야 할 때" 건약, 설명회 연다
- 6휴베이스 밸포이, 출시 18개월 만에 판매 100만병 돌파
- 7동대문구 통합돌봄 발대식…약사회 협력 약속
- 8환자안전약물관리원 "일반약 부작용·안전사고 보고 활성화를”
- 9공단-성남시약, 어르신 안심복약 지원 위한 후원물품 기증
- 10경기 여약사위원회, 사회공헌활동 역량 집중

























































![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)

![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202602/1770888420842.png)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)
![[레비온] PDRN+EGF, 레비온RX PDRN EGF 크림](https://i.baropharm.com/products/202512/1765949426601.png)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/partner/products/3f39593e-6318-4dd9-a778-c008c868b5c8.png)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)



