⑤ 세계 첫 텔로머레이스 억제제 '라이텔로'...국내 도입 예상
- 최병철 박사
- 2025-06-13 06:24:02
-
가
- 가
- 가
- 가
- 가
- 가
- 최병철 박사의 노벨드럭 인사이트
- 텔로머레이스, 세포 수명 연장...불사성 유도 높아
- 조혈계 악성질환 정밀의학적 치료 전략으로 가능성 보여줘
- PR
- 전국 지역별 의원·약국 매출&상권&입지를 무료로 검색하세요!!
- 데일리팜맵 바로가기

5편: First-in-class 텔로머레이스 억제제, 골수이형성증후군 치료제 '라이텔로(Imetelstat)'
라이텔로(Rytelo& 9415;, 성분명: 이메텔스타트, Imetelstat, Geron)는 세계 최초의 올리고뉴클레오타이드 텔로머레이스 억제제(Oligonucleotide telomerase inhibitor)로 2024년 6월 미국 FDA와 2025년 3월 유럽 EMA에서 '적혈구 자극제(ESA)에 반응하지 않거나 효과가 소실되었거나 투여가 불가능한, 수혈 의존성 빈혈이 있으며 8주 동안 적어도 4단위 이상의 적혈구 수혈이 필요한 저위험에서 중간 1단계 위험군의 성인 골수이형성증후군(low-to intermediate-1 risk myelodysplastic syndromes, MDS) 환자 치료'에 승인되었다.
대부분의 암세포 및 암 전구세포(cancer progenitor cells)는 높은 텔로머레이스 활성과 텔로미어 유지 능력을 통해 세포가 정상적인 복제 제한 없이 무한히 분열할 수 있는 능력(세포 불사성, cellular immortality)을 가지게 되므로, 텔로머레이스는 암 치료의 유망한 표적 중 하나가 된다
이러한 기전에 기반하여 개발된 이메텔스타트는 텔로머레이스를 표적으로 하는 13개 염기 서열의 올리고뉴클레오타이드로, 인간 텔로머레이스 RNA(human telomerase RNA, hTR)의 주형(template) 영역에 선택적으로 결합하여 텔로머레이스 활성을 경쟁적으로 억제함으로써 암세포를 사멸한다.
이메텔스타트의 약동학(PK), 약력학(PD), 용량-반응 관계(dose-response relationship), 유효성 및 안전성은 고형암 및 혈액암을 포함한 다양한 종양 모델에서 in vitro, in vivo, 그리고 임상시험을 통해 평가되었다. 특히, 저위험 골수형성이상증후군(LR-MDS) 및 골수증식성 종양을 포함한 혈액질환을 대상으로 한 연구가 집중적으로 수행되었다.
핵심 3상 임상시험인 IMerge 연구에 따르면, 이메텔스타트 투여군은 위약군 대비 8주 및 24주 이상에서 적혈구 수혈 비의존성(red blood cell-transfusion independence, RBC-TI)에 도달한 환자의 비율이 통계적으로 유의하게 높았으며, 주요 이상반응으로는 일시적이며 조절 가능한 호중구감소증(neutropenia) 및 혈소판감소증(thrombocytopenia)이 관찰되어, 전반적으로 관리 가능한 안전성 프로파일을 보였다.
저위험에서 중간 1단계 위험군의 성인 골수이형성증후군(Low-to intermediate-1 risk myelodysplastic syndromes, MDS)은 무엇인가?
골수이형성증후군(MDS)은 혈액 생성 줄기세포의 클론성 이상으로 인해 발생하는 혈액 종양 질환군으로, 골수 내 이형성(dysplasia)과 비효율적인 조혈(hematopoiesis)을 특징으로 한다. 이 질환은 빈혈, 백혈구 감소증, 혈소판 감소증 등의 다양한 혈구감소증(cytopenia)이 나타날 수 있다.
일부 MDS 환자는 급성 골수성 백혈병(AML)으로 진행되기도 하여, 임상 경과를 더욱 복잡하게 만든다. MDS 환자의 예후는 매우 다양하며, 염색체 이상 및 혈구감소증의 중증도와 같은 요인에 따라 영향을 받는다. 따라서, MDS 환자의 임상 경과와 치료 반응은 매우 다양하므로, 정확한 예후 분류는 치료 전략 수립 및 예후 예측에 있어 필수적이다.
가장 널리 사용되는 예후 평가 시스템은 1997년 제시된 국제 예후 점수 시스템( International Prognostic Scoring System, IPSS)이며, 골수 내 아세포(blast) 비율, 세포유전학적 이상(cytogenetics), 혈구감소증의 수 등 세 가지 지표를 기반으로 환자를 위험(Low), 중간-1위험(Intermediate-1), 중간-2위험(Intermediate-2), 고위험(High)의 네 군으로 분류한다.
이 중 저위험에서 중간-1위험군(low-to intermediate-1 risk)은 IPSS 점수 기준으로 0~1.0점에 해당하며, 비교적 안정된 임상 경과를 보이고, 적혈구 자극제(ESA)나 보존적 치료 등의 저강도 요법이 우선적으로 고려된다.
2012년에는 기존 IPSS의 한계를 보완하기 위해 개정된 국제 예후 점수 시스템(IPSS-R)이 제안되었다. IPSS-R은 세포유전학적 이상을 5단계로 세분화하고, 골수 아세포 비율, 혈색소 농도, 혈소판 수, 절대 호중구 수 등 보다 정량적인 지표를 반영함으로써 환자를 매우 저위험(very low), 저위험(low), 중간위험(intermediate), 고위험(high), 매우 고위험(very high)의 5단계로 분류한다. 이 중 IPSS-R의 저위험 및 중간위험군은 대체로 기존 IPSS의 저위험 및 중간-1위험군과 대응된다.
저위험~중간-1위험군 MDS 환자는 일반적으로 생존 기간이 길고, 급성 골수성 백혈병(AML)으로의 진행 위험이 낮은 편이나, 수혈 의존성 빈혈, 증상성 혈구감소증, 분자 유전학적 이상 유무에 따라 치료 방법의 세분화가 필요하다. 최근에는 유전자 변이 기반의 위험도 분류가 병용되며, 보다 정밀한 예후 예측과 치료 맞춤화에 기여하고 있다.
이러한 MDS는 텔로미어(telomere) 단축과 관련된 조혈 줄기세포 기능 저하와 병적 클론의 형성을 특징으로 하며, 일부 클론은 텔로머레이스(telomerase)를 재활성화하여 불사성(immortality)을 획득하고 질환의 진행에 관여한다. 텔로머레이스는 이러한 병태생리적 역할로 인해 MDS에서 유망한 치료 표적이 된다.
텔로미어(Telomere)는 어떤 물질인가? 2009년 노벨 생리의학상은 엘리자베스 블랙번(Elizabeth Blackburn), 캐럴 그라이더(Carol Greider), 잭 쇼스택(Jack Szostak)에게 수여되었다. 이들은 염색체 말단에 위치한 특수한 반복 서열 구조인 텔로미어(telomere)와 그 유지에 관여하는 효소인 텔로머레이스(telomerase)를 규명함으로써, 세포 분열 과정에서 유전 정보가 어떻게 안정적으로 보존되는지를 설명하는 데 기여하였다.
노벨위원회는 "이들 세 명의 연구는 염색체가 세포 분열 과정 중 퇴화를 방지하고, 완전하게 복제될 수 있는지를 둘러싼 오랜 생물학적 의문에 대한 해답을 제공하였다"고 평가하였다.
텔로미어에는 세포의 염색체 말단에 반복적인 DNA 서열이 존재하며, 이는 유전물질의 손상을 방지하고 염색체의 구조적 안정성을 유지하는 역할을 수행한다. 그러나 체세포는 분열을 반복할수록 텔로미어 길이(telomere length)가 '모래시계'처럼 점진적으로 짧아지며, 일정 임계점에 도달하면 세포는 증식을 멈추고 세포 노화(senescence)나 세포자멸사사(apoptosis)를 유도하게 된다(Figure 1).
이때 텔로머레이스는 텔로미어의 말단을 연장할 수 있는 효소로 세포의 수명을 연장시키고, 이론적으로는 세포의 불사성(immortality)를 유도할 가능성을 지닌다.
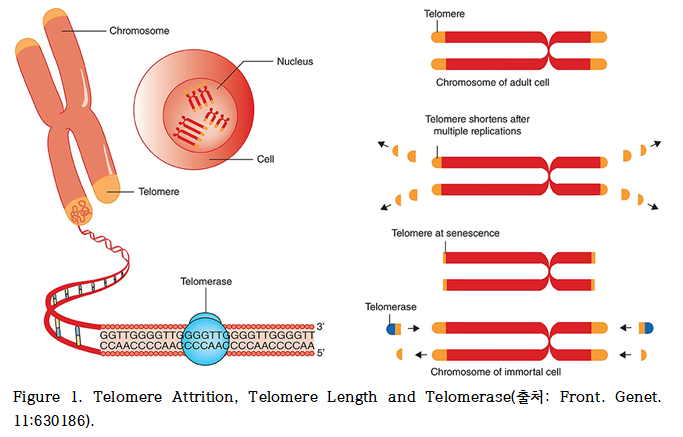
이러한 텔로미어는 생물체의 노화 과정과 직접적으로 연관되어 있고, 또한 대부분의 암세포는 텔로머레이스의 활성을 통해 텔로미어 길이를 유지하거나 연장함으로써 무한 증식 능력을 가지게 된다. 즉, 텔로미어 단축은 세포 노화를 유도하는 반면, 텔로미어 보존은 암세포의 지속적 증식을 가능하게 한다. 따라서, 텔로미어 기능의 조절은 노화 억제 혹은 암 치료를 위한 잠재적 전략으로 제시되고 있다.
텔로머레이스(Telomerase)란 무엇인가? 텔로머레이스(Telomerase)는 염색체 말단에 있는 3' 말단 돌출부(3' overhang)에 반복적인 염기서열을 추가하는 기능을 가진 리보핵단백질 복합체(ribonucleoprotein complex)로, 역전사효소(reverse transcriptase) 활성을 갖는다. 3' 말단 돌출부는 이중가닥 DNA 말단에서 한 가닥이 다른 가닥보다 더 길어 돌출된 형태로, 텔로미어 구조에서 텔로머레이스가 인식하고 작용하는 주요 부위이다.
텔로머레이스는 자체의 RNA 구성요소인 TERC(telomerase RNA component)를 주형(template)으로 삼아, TERT(telomerase reverse transcriptase)의 역전사 효소 활성을 통해 반복적인 TTAGGG 염기서열을 합성함으로써 염색체 말단의 텔로미어를 연장한다(Figure 2).
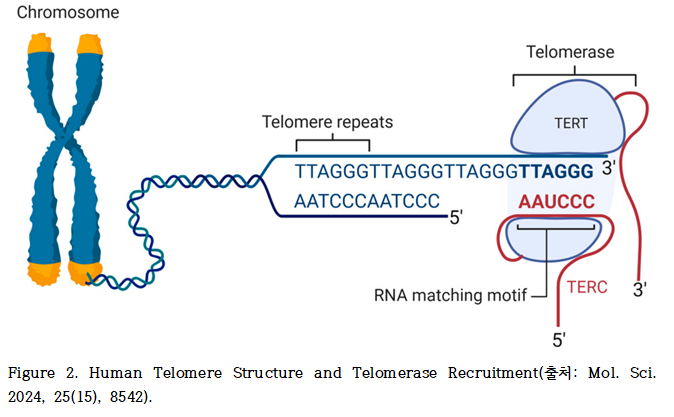
인간의 경우, 텔로머레이스는 인간 텔로머레이스 역전사효소(human telomerase reverse transcriptase, hTERT) 유전자에 의해 암호화되는 촉매 소단위(catalytic subunit)와 인간 텔로머레이스 RNA(human telomerase RNA, hTR) 유전자 산물인 RNA 주형(template)을 중심으로 구성된 복합체이다. 여기에 dyskerin, NHP2, NOP10, GAR1 등 다양한 보조 단백질들이 결합하여, 효소 복합체의 구조적 안정성과 기능적 활성을 조절한다.
텔로머레이스를 ‘자동차’ 전체에 비유한다면, TERT는 실제로 DNA를 합성하는 역할을 수행하는 ‘엔진’에 해당하며, hTR(또는 TERC)는 어떤 염기서열을 합성할지를 지시하는 ‘설계도’에 해당하는 RNA 주형으로 볼 수 있다.
인체 내 약 120여 종의 세포 중 대부분은 텔로미어를 합성하는 효소인 텔로머레이스의 활성을 갖지 않으며, 이로 인해 세포는 분열이 반복될수록 텔로미어가 점진적으로 단축되고, 결국 복제에 따른 세포 노화(replicative senescence)에 도달하게 된다. 반면, 일부 높은 분열 능력을 가진 조직의 세포들은 예외적으로 텔로머레이스 활성을 유지한다.
이러한 세포에는 모낭(hair follicle), 구강 편평상피(squamous epithelium), 피부 표피의 기저층(basal layer of epidermis), 제2형 폐포상피세포(type 2 alveolar epithelial cells), 간세포(hepatocytes), 장의 장선(intestinal crypts), 정원세포(spermatogonia) 등이 있다. 이들 세포에서 텔로머레이스 활성이 결여될 경우, 조직의 항상성 유지 및 생식 기능에 중대한 장애가 초래된다.
특히, 정자 형성에 관여하는 정원세포(spermatogonia)에서 텔로머레이스 활성이 결여되면, 정자의 텔로미어 길이가 충분히 유지되지 못하고 단축된 상태로 전달된다. 이로 인해 형성된 배아는 텔로미어 단축에 기인한 세포 노화가 조기에 시작되며, 조기 노화(progeria)와 유사한 양상을 보일 수 있다. 실제로 이는 복제 양 돌리(Dolly) 사례에서 관찰된 바 있으며, 단축된 텔로미어가 수명 감소와 밀접하게 연관됨을 시사한다.
이는 일반적인 체세포에서는 텔로머레이스 활성이 매우 낮은 수준으로 유지하지만, 생식세포와 줄기세포에서는 해당 효소가 구성효소(constitutive enzyme)로서 지속적으로 발현된다. 구성효소는 소화효소와 같이 항상 일정 수준으로 활성화되어 있는 효소이다.
이에 반해 유도효소(inducible enzyme)는 특정 자극(예: 약물, 독성물질 등)에 의해 후천적으로 유도되는 효소이다. 이러한 분류 기준에 따라 텔로머레이스는 생식세포 및 줄기세포에서 구성효소로 기능하며, 암세포에서는 구성효소 및 유도효소적 특성을 보이는 이중적 성격을 가진다고 볼 수 있다.
줄기세포 중에서도 배아줄기세포(embryonic stem cells) 및 유도만능줄기세포(induced pluripotent stem cells)는 고도로 안정된 텔로머레이스 활성을 보이며, 이로 인해 세포 분열에 따른 텔로미어의 단축이 거의 발생하지 않고, 복제에 따른 세포 노화에도 이르지 않는다.
반면, 중간엽줄기세포(mesenchymal stem cells), 신경줄기세포(neural stem cells), 조혈모세포(hematopoietic stem cells) 등 성체 유래 줄기세포에서는 텔로머레이스 활성이 상대적으로 낮으며, 이로 인해 제한적인 텔로미어 단축이 관찰된다.
TERT(Telomerase reverse transcriptase)란 무엇인가? 대부분의 체세포는 약 60~80회의 분열(population doublings) 이후 텔로미어가 임계 길이에 도달하게 되며, 이 시점에서 이중가닥 DNA 절단(double-strand break) 신호가 유도되어 복제에 따른 노화로 전환된다.
이러한 현상은 체세포 내에서 텔로머레이스 활성이 거의 존재하지 않기 때문에 발생하는데, 이는 텔로머레이스의 RNA 구성 요소인 TERC(hTR)가 존재하더라도, 촉매 활성을 담당하는 TERT 유전자의 전사가 억제되어 있기 때문이다. 따라서, TERT 발현의 억제는 체세포에서 텔로머레이스 활성이 결핍되는 주요 원인이며, 텔로미어 단축의 분자적 기전으로 작용한다.
뿐만 아니라, TERT는 단순한 텔로미어 연장 기능 외에도 텔로미어 말단의 캡핑(capping)과 전체 구조 유지에도 중요한 역할을 한다. 이는 다양한 암종의 약 80~90%에서는 TERT 발현이 재활성화되어 텔로머레이스 활성이 증가되어 있으며, 암세포의 불사화와 밀접하게 연관되어 있다.
결과적으로, TERT 발현은 텔로미어 연장과 세포 노화 회피를 통해 암세포 특성이 획득되는 초기 단계에서 결정적인 분자 표지자로 작용한다. 이러한 TERT 발현 유도는 다양한 내& 8226;외부 요인 중 유전자 불안정성과 돌연변이가 가장 대표적인 기전으로 제시되고 있다.
암의 발생 과정에서 텔로미어 길이의 보존이 빈번히 동반되며, 이는 주로 인간 텔로머레이스 역전사효소(hTERT)의 발현 증가에 따른 텔로머레이스 활성의 재개로 설명된다. 따라서 TERT의 발현 조절 기전은 텔로머레이스 기반 항암 치료법의 핵심 표적으로 주목받고 있으며, 암세포 특이적 바이오마커로서의 임상적 활용 가능성 또한 높다.
텔로머레이스와 암과의 관계는 어떠한가? 텔로머레이스의 비정상적인 재활성화는 암세포에서 흔히 관찰되는데, 이는 텔로미어 단축으로 유도되는 세포자멸사를 회피하고 무한 증식 능력을 획득하는 데 핵심적인 기전으로 작용한다. 실제로, 전체 고형암 및 혈액암의 약 90% 이상에서 텔로머레이스 활성이 현저히 증가되어 있음이 관찰된다.
여러 암 조직 생검에서 텔로머레이스 활성의 증가가 종양의 병기 및 악성도와 유의한 상관관계를 보이는 반면, 대부분의 정상 성인 조직에서는 텔로머레이스 활성이 거의 검출되지 않으며, 일부 조혈모세포나 면역세포에서만 일시적으로 나타나는 것으로 알려져 있다.
이는 암세포 및 암전구세포에서 공통적으로 관찰되는 높은 수준의 텔로머레이스 발현과 텔로미어 유지 현상을 억제하여 암세포의 증식을 제한하는 치료 방법이 된다.
특히, RNA 기반 치료법은 텔로머레이스의 RNA 구성요소인 hTR 또는 hTERT mRNA를 표적으로 하여 효소 활성을 간접적으로 억제하는 방식으로 주목받고 있다. 이 중 안티센스 올리고뉴클레오타이드(antisense oligonucleotides, ASO) 및 RNA 간섭(small interfering RNA, siRNA) 기술은 텔로머레이스 기능을 선택적으로 차단할 수 있는 새로운 접근법이다.
대표적 예로는 이멜스타트(Imetelstat)가 있으며, 이는 인간 텔로머레이스 RNA(hTR)의 주형 영역에 상보적으로 결합하는 리간드 결합형 ASO로 설계되어, 텔로미어 연장 과정을 억제함으로써 암세포의 증식 억제를 유도한다. 이와 같은 RNA 기반 접근은 텔로머레이스 억제를 통한 항암 치료의 새로운 패러다임을 제시하며, 표적 치료제 개발에 있어 중요한 진전을 이끌고 있다.
텔로머레이스 억제를 통한 항암 치료 전략은? 텔로머레이스를 표적으로 한 항암제 개발은 다양한 작용기전을 바탕으로 다방면에서 진행되고 있으며, 크게 RNA 기반 억제제, 전사 억제 화합물, G-사중나선 안정화제, 그리고 면역치료 백신 전략으로 구분할 수 있다.
1. RNA 기반 억제제 가장 활발히 연구되고 있는 접근은 안티센스 올리고뉴클레오타이드(ASO) 또는 RNA 간섭(siRNA) 기술을 활용하여 텔로머레이스 RNA 구성요소(hTR 또는 TERC)를 표적으로 하는 전략이다. 이들 억제제는 텔로머레이스 복합체 내의 RNA 주형에 상보적으로 결합함으로써 효소 활성을 억제하거나, RNase H 의존적 분해를 유도하여 텔로머레이스 기능을 근본적으로 차단한다.
대표적 약제인 이멜스타트(Imetelstat)는 티오포스포라마이드(thio-phosphoramidate) 변형을 적용한 ASO로, hTR의 템플릿 영역에 결합하여 텔로미어 연장을 저해한다.
2. hTERT 전사 억제 저분자 화합물 이 저분자 화합물은 텔로머레이스의 촉매 소단위인 hTERT 유전자의 전사를 직접 억제하는 방식으로, 프로모터 영역 조절 또는 후성유전학적 메커니즘을 통해 유전자 발현 자체를 낮춘다. 일부 저분자 화합물은 hTERT 단백질에 직접 결합하여 효소 활성을 차단한다. 식물 유래 플라보노이드(예: genistein)가 TERT 전사를 억제하는 기능이 보고된 바 있으나 낮은 선택성과 잠재적인 세포독성으로 인해 임상 적용에는 제한이 있다.
3. G-사중나선(G-quadruplex) 안정화제 이 안정화제는 텔로미어 말단에서 형성되는 G-사중나선 구조를 안정화시켜 텔로머레이스의 접근을 물리적으로 차단하는 방식이다. 해당 구조는 G-rich 반복 서열에서 자연적으로 형성되며, 일부 저분자 화합물은 이 구조에 특이적으로 결합하여 G-quadruplex 형태의 유지 및 안정화를 유도한다.
이 방법은 효소가 아닌 기질을 표적으로 한다는 점에서 기존 억제제와 구별되며, 비교적 빠른 약효 발현이 가능하다. 그러나 G-rich 서열이 텔로미어 외에도 다양한 유전자의 조절부위에 존재하기 때문에, 표적 특이성 확보가 주요 과제로 남아 있다.
4. 텔로머레이스를 항원으로 활용한 면역치료 텔로머레이스를 면역계의 표적으로 활용하는 전략도 개발되고 있다. 이는 hTERT 유래 펩타이드를 기반으로 하는 항암 백신을 통해, 텔로머레이스를 발현하는 종양세포를 면역세포가 인식하고 제거하도록 유도한다. 비소세포폐암(NSCLC), 췌장암 등 다양한 고형암에서 임상시험이 진행되고 있으며, 면역기억 반응을 통한 재발 억제 효과가 기대된다. 다만, 환자의 HLA 유형 및 종양미세환경(TME)에 따라 치료 반응의 편차가 존재하여, 정밀한 환자 선별 전략이 병행되어야 한다.
이와 같이 텔로머레이스 억제 전략은 암세포 특이성이 높고 장기적인 종양 억제 효과를 유도할 수 있다는 점에서 유망한 접근이다. 그러나 기전상 텔로미어 길이의 점진적 단축을 필요로 하므로, 치료 효과 발현까지 수 주에서 수 개월이 소요되는 경향이 있다. 또한, 일부 암에서는 텔로머레이스 비의존적인 대체적 길이 조절(ALT, alternative lengthening of telomeres) 경로가 활성화되어 있어 단독요법으로는 제한적일 수 있다.
이러한 한계를 극복하기 위해, 최근에는 DNA 손상 유도제, 면역관문억제제(PD-1/PD-L1 억제제), PARP 억제제 등과의 병용요법이 시도되고 있다. 또한 텔로머레이스 발현 수준, 텔로미어 길이 상태, ALT 경로 활성 여부 등을 고려한 환자 맞춤형 정밀의학적 접근이 병행됨으로써, 텔로머레이스 억제제의 임상적 유용성은 점차 확대되고 있다.
뉴클레오타이드(Nucleotide)와 합성 올리고뉴클레오타이드의 차이는? 뉴클레오타이드는 모든 생명체에 보편적으로 존재하는 저분자 유기 화합물로, DNA와 RNA와 같은 핵산의 기본 단위이며 에너지 전달(ATP, GTP), 세포 신호전달(cAMP, cGMP), 효소 보조인자(NAD& 8314;, FAD) 등의 생리적 기능에 필수적인 역할을 수행한다. 이러한 분자는 세포 내에서 de novo 합성 경로 또는 재활용 경로(salvage pathway)를 통해 지속적으로 생성되며, 생명 유지에 핵심적인 역할을 한다.
이에 반해, 올리고뉴클레오타이드는 일반적으로 몇 개에서 수십 개의 뉴클레오타이드가 공유결합으로 연결된 짧은 핵산 서열로, 인공적으로 합성된 생체분자이다. 자연적으로는 microRNA나 small nuclear RNA와 같은 일부 예외적인 경우를 제외하면 생체 내에서 잘 합성되지 않으며, 주로 화학적으로 합성되어 특정 유전 서열의 인식이나 분자 기능의 조절을 목적으로 활용된다.
합성 올리고뉴클레오타이드는 분자생물학, 진단, 치료, 유전자 조작 등 다양한 분야에서 핵심 도구로 활용되고 있으며, 기능, 표적, 화학적 변형에 따라 , 다음과 같이 분류된다.
첫째, 기능적 측면에서 ▲ mRNA 또는 pre-mRNA에 결합하여 유전자 발현을 억제하거나 RNA 스플라이싱을 조절하는 안티센스 올리고뉴클레오타이드(antisense oligonucleotide, ASO), ▲ RNA 간섭(RNAi)을 유도하여 표적 mRNA의 분해를 유도하는 소간섭 RNA(siRNA) 또는 마이크로 RNA(miRNA) 유사체, ▲ 고특이적으로 단백질에 결합하여 기능을 저해하거나 조절하는 압타머(aptamer), ▲ CRISPR 시스템에서 유전자 편집을 유도하는 가이드 RNA(guide RNA, gRNA), ▲ 전사인자와 결합하여 표적 유전자 조절을 간섭하는 디코이(decoy), ▲ PCR, qPCR, 유전자 탐지 등 핵산 분석 기술에 사용하는 프라이머(primer) / 프로브(probe) 등으로 분류된다.
둘째, 표적 및 작용기전에 따라 ▲ DNA, ▲ mRNA, ▲ pre-mRNA, 또는 단백질 등 다양한 분자에 작용할 수 있으며, 그 기전은 전사 억제, 번역 차단, RNA 스플라이싱 조절, 단백질-핵산 상호작용 차단 등으로 확장된다.
셋째, 화학 구조적 변형 측면에서 천연형(natural-type) 외에도 약물 안정성 및 효율성을 개선하기 위한 다양한 화학적 변형이 도입된다. 대표적으로 ▲ 인산기 산소를 황으로 치환하여 핵산분해효소 내성 증가를 위한 phosphorothioate(PS), ▲ 리보스의 2′ 위치에 화학기 추가로 결합력과 안정성 증가를 위한 2′-O-methyl RNA 및 2′-fluoro RNA, ▲ 리보스 고정을 통해 고결합 친화성 및 특이성 확보한 locked nucleic acid(LNA), ▲ 간세포 타깃팅 또는 세포 내 전달력 향상을 위한 GalNAc 또는 지질을 접합시킨 conjugated oligonucleotide 등이 있으며, 이는 체내 안정성, 표적 결합력, 약물 전달 효율성을 향상시키는 데 기여한다.
요약하면, 뉴클레오타이드는 생명체 내에서 합성되는 주요 생리활성 분자인 반면, 올리고뉴클레오타이드는 외부에서 합성되어 생체 내 특정 유전자나 분자 기전을 정교하게 조절하기 위한 인공 핵산 서열이라는 점에서, 양자는 생성 방식과 생리적 존재 양상에서 본질적으로 다르다. 그럼에도 불구하고, 올리고뉴클레오타이드는 자연계 핵산의 기능을 모방하거나 확장함으로써 차세대 핵산 기반 치료제 및 진단 기술의 핵심 플랫폼으로 부상하고 있다.
ASO(Antisense Oligonucleotide, 안티센스 올리고뉴클레오타이드)란? ASO는 mRNA를 표적으로 설계된 짧은 합성 단일가닥 DNA 분자로, 특정 mRNA 서열과 상보적으로 결합함으로써 유전자 발현을 억제하거나 조절하는 기능을 수행한다(Figure. 3).
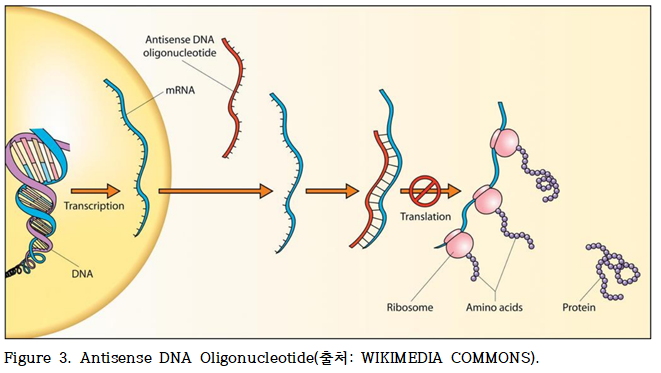
ASO는 비교적 간단한 화학 구조를 기반으로 하면서도, 전사체의 분해 유도, RNA 스플라이싱 (splicing) 조절, 번역 억제 등 다양한 작용기전을 통해 유전 정보의 흐름을 정교하게 제어할 수 있는 장점을 가진다.
ASO의 작용기전은 화학적 변형 방식과 결합 표적에 따라 다양하게 구분된다. 대표적으로 RNase H 매개 분해는 ASO가 표적 mRNA와 이중가닥을 형성한 후, 세포 내 RNase H 효소에 의해 해당 mRNA가 분해되어 단백질 생성을 원천적으로 차단하는 기전이다.
또한, 스플라이싱 조절용 ASO는 pre-mRNA의 엑손/인트론 경계부에 결합하여, 엑손 스키핑(skipping) 또는 보존을 유도함으로써 단백질의 구조와 기능을 변형시킬 수 있다. 이 외에도 번역 개시 억제, mRNA 안정성 저해 등 다양한 방식으로 작용이 가능하다.
이러한 특성을 바탕으로, ASO는 기존 소분자 화합물이나 단백질 기반 치료제와 달리 기능 상실(loss-of-function) 혹은 기능 획득(gain-of-function) 유전자 돌연변이 모두를 정교하게 조절할 수 있다.
그러나 ASO 치료제는 면역반응 유발, 비표적 결합(off-target effect), 체내 약물 전달 효율 등의 한계를 지니고 있으며, 이를 극복하기 위해 phosphorothioate 치환, 2′-O-methyl 및 LNA 변형, GalNAc 결합을 통한 간세포 표적화, 지질 나노입자 기반 전달체 등 다양한 기술적 발전이 이루어지고 있다.
이러한 발전은 ASO의 치료적 효능을 향상시키는 데 핵심적인 기여를 하고 있으며, ASO 기반 핵산 치료제가 차세대 정밀의학 기반의 분자표적 치료제로 자리매김할 수 있는 가능성을 높이고 있다.
텔로머레이스 표적 올리고뉴클레오타이드(Telomerase-targeted oligonucleotide, TTO)란? TTO는 표적 핵산 서열에 상보적으로 결합하는 구조를 가지면서도, 기존의 ASO와는 본질적으로 다른 작용기전을 가진다. 즉 일반적인 ASO는 mRNA의 분해(RNase H 의존적 경로) 또는 스플라이싱 조절을 통해 단백질 생성을 억제하지만, TTO는 hTR의 템플릿 서열에 직접 결합함으로써 텔로머레이스 효소 복합체의 활성 부위를 차단한다. 이는 효소의 기질 인식 및 촉매 반응 자체를 방해하는 비정형(non-canonical) ASO로 분류된다.
이러한 TTO는 효소 작용 자체의 차단을 통해 효소 기능 차단(enzyme activity inhibition)이라는 새로운 패러다임을 제공한다. 특히 텔로머레이스 활성이 높은 암세포에서 선택적으로 작용함으로써, 정상세포에 대한 영향을 최소화하면서 암 특이적 억제 효과를 유도할 수 있다.
대표적인 TTO로는 이메텔스타트(Imetelstat)가 있으며, 이는 hTR의 템플릿 영역에 상보적으로 결합하는 티오인산화(thio-phosphoramidate) 올리고뉴클레오타이드로 설계되었다.
이메텔스타트는 어떤 약제인가? 이메텔스타트(Imetelstat, 제품명: 라이텔로 정맥주사, Rytelo®)는 텔로머레이스를 직접 표적으로 하는 최초의 올리고뉴클레오타이드 기반 치료제로, 2024년 미국 FDA로부터 승인받은 이후 골수이형성증후군(MDS) 치료 영역에서 새로운 치료 축으로 부상하고 있다. 이 약제의 승인 적응증은 "8주간 4단위 이상의 적혈구 수혈이 필요한 수혈 의존성 빈혈을 가진 저위험~중간-1 위험군 MDS 성인 환자 중, 적혈구생성자극제(ESA)에 반응하지 않거나 반응이 소실되었거나, 투여가 불가능한 경우"이다.
이메텔스타트는 기존의 ASO와는 구별되는 비정형 ASO로 분류되며, 비정상적인 텔로머레이스 활성을 보이는 악성 조혈모세포(HSCs) 및 전구세포(HPCs)를 선택적으로 억제함으로써 병적 클론의 제거와 정상 조혈 기능의 회복을 유도하는 질환 수정형(disease-modifying) 치료 제이다.
분자 구조적으로, 이메텔스타트는 13개의 뉴클레오타이드로 구성된 단일가닥 DNA 서열이며, 티오인산화(thio-phosphoramidate) 변형을 통해 핵산분해효소(nuclease) 저항성, 수용성, 대사적 안정성 등의 약물학적 특성이 향상되었다. 또한 5′ 말단에 팔미토일기(palmitoyl group)가 결합되어 소수성을 증가시켜 세포막 투과성 및 세포 내 유지성을 강화하며, 별도의 형질전환 과정 없이도 세포 내 작용이 가능하도록 설계되었다.
전임상 연구에서는 이메텔스타트의 약물 노출과 텔로머레이스 억제 간의 명확한 약력학적 상관성이 확인되었고, 텔로머레이스 활성을 50% 이상 억제하는 수준의 약리 효과가 임상적으로 확보 가능한 범위 내에 있음이 입증되었다. 또한, 골수증식성 질환 모델(예: 본태성 혈소판증, 골수섬유증, 급성 골수성 백혈병 등)에서는 시험관 내(in vitro) 및 생체 내(in vivo) 실험 모두에서 강력한 항종양 활성을 나타냈다.
특히 저위험 MDS 환자에서 이메텔스타트는 텔로미어 단축, hTERT 과발현, 분화 억제 등으로 특징지어지는 병적 조혈모세포 및 전구세포를 선택적으로 제거함으로써, 정상 조혈의 회복과 함께 적혈구 수혈 비의존 기간(RBC-TI)의 연장, 혈색소 수치의 향상, 염색체 이상 클론 및 돌연변이 부담의 감소를 유도하였다.
아울러, 이메텔스타트는 면역회피 특성을 가진 악성 클론에서도 항암 활성을 유지함으로써, 기존 면역항암제 또는 세포독성 항암제에 비해 임상적 적용 가능성이 높다. 현재 진행 중인 다수의 임상시험 결과에 따라, MDS뿐 아니라 골수섬유증(myelofibrosis), 기타 혈액암 영역으로의 적응증 확장 가능성도 제시되고 있다.
이메텔스타트의 약리 기전은? 이메텔스타트는 TERT-targeting telomerase complex inhibtor 또는 RNA-template targeting telomerase inhibitor로, 인간 텔로머라제의 RNA 구성 요소(hTR)의 주형 영역에 상보적으로 결합하여 텔로머레이스 복합체의 활성 부위에서 기질 결합 및 연장을 직접 차단한다. 즉 hTR의 주형 서열(3′-CAAUCCCAAUC-5′)에 상보적인 염기서열(5′-palmitate-TAGGGTTAGACAA-NH₂-3′)이 결합함으로써, 텔로머레이스 효소의 활성을 억제하여 텔로미어 말단에 반복 서열을 추가하는 기능을 경쟁적으로 차단한다. 이로 인해 암세포 내에서의 텔로미어 길이가 점진적으로 짧아지며, 결국 세포 노화 또는 세포자멸사를 유도하게 된다(Figure 4).
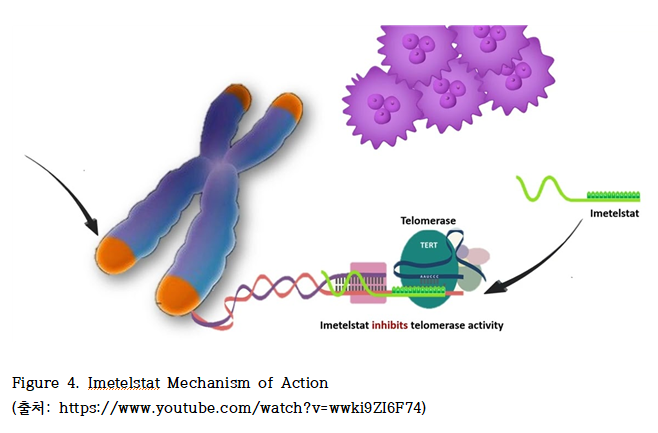
골수이형성증후군(MDS) 및 악성 줄기세포 및 전구세포에서 텔로머레이스 활성 및 인간 텔로머레이스 역전사효소(hTERT) RNA 발현이 증가한 것으로 보고되었다. 이에 여러 연구에서 이메텔스타트 치료가 텔로미어 길이 감소, 악성 줄기세포 및 전구세포의 증식 감소, 그리고 세포자멸사를 유도함으로써 세포 증식 억제 및 수명 단축 효과를 나타낸 것으로 보고되었다.
또한, 이 약제는 텔로머레이스의 촉매 소단위인 hTERT의 발현을 억제함으로써 효소 활성을 이중적으로 저해하는데, 이 hTERT는 텔로머레이스 활성을 조절하는 주요 속도 제한 인자(rate-limiting component)로 알려져 있다.
이러한 이멜스타트의 작용 기전은 항원-항체 반응이나 면역세포 활성화를 기반으로 하는 기존 면역항암제와는 달리, 종양 세포의 분열 및 생존을 유지하는 내재적 기전인 텔로머레이스 의존성을 직접 차단한다는 점에서 근본적인 차별성을 갖는다.
이멜스타트(RYTELO& 9415;) 3상 임상은 어떻게 진행되었나? 이메텔스타트의 임상적 유효성은 IMerge 3상 연구를 통해 입증되었다. 본 연구는 무작위배정, 이중눈가림, 위약대조, 다기관 임상시험으로 설계되었으며, 저위험 또는 중간-1위험군 골수이형성증후군(MDS) 환자 중 수혈 의존성을 보이는 성인 178명을 대상으로 시행되었다. 환자 등록 기준은 무작위배정 16주 전의 8주간 기간 동안 적어도 4단위 이상의 적혈구 수혈 필요 이력이 있는 경우로 정의되었다.
등록 환자들은 모두 적혈구생성자극제(ESA)에 반응이 없었거나 반응이 소실되었거나, ESA 투여가 적절하지 않다고 판단된 경우였다. 주요 포함 기준에는 절대 호중구 수치 ≥ 1.5 × 10& 8313;/L, 혈소판 수 ≥ 75 × 10& 8313;/L이 포함되었으며, del(5q) 염색체 이상 보유자, 레날리도마이드(Lenalidomide) 또는 아자시티딘(Azacitidine)과 데시타빈(Decitabine) 같은 저메틸화제(hypomethylating agents, HMA) 치료 이력이 있는 환자는 제외되었다.
무작위배정은 2:1 비율로 수행되어, RYTELO 7.1 mg/kg 정맥주사군(n=118) 또는 위약군(n=60)에 배정되었으며, 28일 주기(cycle)로 반복 투여되었다. 치료는 질병 진행, 용인할 수 없는 독성, 또는 환자의 자의적 중단 시점까지 지속되었다. 무작위배정은 기존 RBC 수혈 부담 및 IPSS 위험군 등급을 기준으로 계층화되었다. 모든 환자에게는 필요 시 적혈구 수혈을 포함한 지지요법(supportive care)이 병행 제공되었다.
평가 기간은 RYTELO 투여군에서 중앙 추적기간 19.5개월(범위: 1.4& 8211;36.2개월), 위약군에서 17.5개월(범위: 0.7& 8211;34.3개월)이었으며, 주요 유효성 평가 변수는 적혈구 수혈 독립(RBC transfusion independence, RBC-TI) 달성 비율이었다. 이는 무작위배정 이후부터 차기 항암 치료 개시 전까지의 기간 중 연속된 8주(≥56일) 또는 연속된 24주(≥168일) 동안 적혈구 수혈이 전혀 이루어지지 않은 경우로 정의되었다.
그 결과, 8주 이상 RBC-TI 도달률은 RYTELO 군에서 39.8%(95% CI: 30.9& 8211;49.3)로, 위약군의 15.0%(95% CI: 7.1& 8211;26.6) 대비 통계적으로 유의하게 높았다(p < 0.001). 또한 24주 이상 RBC-TI 도달률 역시 RYTELO 군에서 28.0% (95% CI: 20.1& 8211;37.0)로, 위약군 3.3% (95% CI: 0.4& 8211;11.5)와 비교하여 유의한 차이를 보였다(p < 0.001).
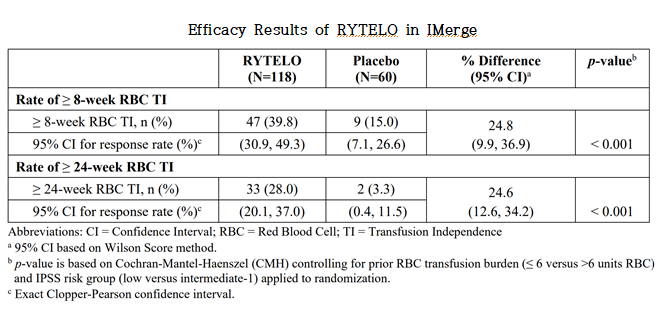
이러한 결과는 RYTELO가 ESA 불응 또는 부적합 환자군에서 수혈 의존성을 유의하게 줄이고, 적혈구계 조혈 회복을 유도할 수 있는 잠재력을 입증하는 것으로 해석된다.
안전성 측면은 RYTELO 군에서 위약군 대비 ≥10% 이상, ≥5% 차이를 보인 주요 이상반응은 혈소판 감소, 백혈구 감소, 호중구 감소, AST/ALT/ALP 상승, 피로, 부분 트롬보플라스틴 시간 연장, 관절/근육통, COVID-19 감염, 두통 등이었다.
따라서, RYTELO는 저위험 MDS 환자에서 임상적으로 의미 있는 수혈 독립 향상을 유도하였으며, 전반적으로 관리 가능한 안전성 프로파일을 보였다. 권장 투여 용량은 7.1 mg/kg이며, 4주마다 2시간에 걸쳐 정맥 투여한다. 이멜스타트의 앞으로의 예상은? 골수이형성증후군(MDS)은 조혈모세포의 분화 및 성숙에 결함이 생겨 비정상적 조혈과 말초 혈구감소증을 유발하는 이질적인 클론성 조혈장애이다. 특히 저위험군 MDS 환자에서는 만성적인 적혈구 수혈 의존성 빈혈이 주요 임상 양상으로 나타나며, 삶의 질 저하 및 철분 과부하에 의한 이차적 장기 손상이 주요 합병증으로 작용한다.
현재까지 이들 환자에서 사용 가능한 치료제로는 적혈구생성자극제(ESA) 및 저메틸화제(HMA) 등이 있으나, 반응률의 한계와 장기 치료 효과에 대한 의문이 지속적으로 제기되고 있다.
텔로머레이스는 텔로미어 길이를 유지하여 세포의 분열 한계를 극복하게 하는 핵심 효소로, 대부분의 암세포 및 악성 조혈모세포에서 비정상적으로 활성이 증가되어 있는 것이 특징이다. 이러한 활성을 선택적으로 억제함으로써 병적 조혈세포의 증식을 제한하고 정상 조혈을 회복시키는 접근은 질환의 근본 기전을 타겟으로 하는 질환 수정형(disease-modifying) 치료전략으로 주목받고 있다.
이메텔스타트(Imetelstat)는 인간 텔로머레이스 복합체(hTERT/hTR)에 직접 결합하여 활성을 경쟁적으로 억제하는 first-in-class 올리고뉴클레오타이드 기반 치료제로, 텔로미어 유지 능력을 상실하게 하여 세포 자멸사 및 증식 억제를 유도한다. 특히 병적 조혈모세포(HSCs/HPCs)와 백혈병 줄기세포(LSCs)에 선택적으로 작용하며, 정상 조혈세포에 대한 영향은 제한적으로 보고되고 있다.
IMerge 3상 임상시험에서 이메텔스타트는 ESA에 반응하지 않거나 부적합한 저위험~중간-1 위험군 MDS 환자를 대상으로 통계적으로 유의한 적혈구 수혈 독립 효과를 입증하였다. 8주 이상 수혈 독립률(RBC-TI)은 이메텔스타트군에서 39.8%, 위약군에서 15.0%로 나타났으며, 24주 이상 수혈 독립률도 각각 17.8%와 1.6%로 유의한 차이를 보였다. 이는 기존 치료옵션에 반응하지 않는 환자 집단에 있어 새로운 치료 패러다임을 제시한 근거로 평가된다.
다만, 현재 이메텔스타트는 저위험 MDS + ESA 실패 + 수혈 의존성 빈혈이라는 제한된 적응증으로 승인되어 있으며, TP53 돌연변이나 고위험군 MDS는 제외 대상에 해당된다. 또한 치료 효과 발현까지 수 주에서 수개월이 소요되며, 호중구감소증(72%) 및 혈소판감소증(65%) 등 고빈도의 혈액학적 이상반응이 동반될 수 있다는 점은 임상적 고려가 필요하다.
그럼에도 불구하고, 텔로머레이스라는 근원적 분자 표적을 겨냥한 이메텔스타트는 기존 화학요법 및 면역조절제와는 차별화된 기전을 통해 조혈계 악성질환에 있어 정밀의학적 치료 전략으로서의 가능성을 보여주고 있다. 이미 미국 및 유럽에서 승인된 약제로서, 향후 국내 도입과 더불어 적응증 확대, 병용요법, 고위험 환자군에서의 임상적 검토가 필요할 것으로 예상한다.
참고문헌 1. Alexander Vaiserman, Dmytro Krasnienkov “Telomere Length as a Marker of Biological Age: State-of-the-Art, Open Issues, and Future Perspectives” Front. Genet. 11:630186(2021). 2. Virginia Boccardi “Aging, Cancer, and Inflammation: The Telomerase Connection” J. Mol. Sci. 2024, 25(15), 8542. 3. Virginia Boccardi, and Luigi Marano “Aging, Cancer, and Inflammation: The Telomerase Connection” Int. J. Mol. Sci. 2024, 25, 8542. 4. Zachary Schrank, Nabiha Khan, Chike Osude, Sanjana Singh et al. “Oligonucleotides Targeting Telomeres and Telomerase in Cancer” Molecules 2018, 23, 2267. 5. Ashley L. Lennoxm, Fei Huang, Melissa Kelly Behrs, Mario Gonz& 225;lez-Sales et al. “Imetelstat, a novel, first-in-class telomerase inhibitor:Mechanism of action” Clin Transl Sci. 2024;17:e70076 6. 기타 인터넷 자료(보도 자료, 제품 설명서 등)
관련기사
-
④ 원형탈모 치료제 '렉셀비', 세 번째 경구 JAK 억제제
2025-05-30 06:40
-
③ PNH 치료제 '피아스키', 최초의 월 1회 피하주사제
2025-05-13 18:10
-
② 국내 허가 앞둔 폐동맥 고혈압 항체치료제 '윈레브에어'
2025-04-21 11:18
-
① 알츠하이머 두번째 항-Aβ 단클론 항체, '키순라' 운명은
2025-04-17 13:20
- 익명 댓글
- 실명 댓글
- 댓글 0
- 최신순
- 찬성순
- 반대순
오늘의 TOP 10
- 1혁신형제약 기등재 약가인하 유예 만지작...막판 조율 촉각
- 2CSO 영업소 소재지 입증 의무화 추진…리베이트 근절 목표
- 3GMP 취소 처분 완화 예고에도 동일 위반 중복 처벌은 여전
- 4품절약 성분명 처방 의무화법 법안 심사 개시...여당 속도전
- 5대웅바이오, 10년새 매출·영업익 4배↑…쑥쑥 크는 완제약
- 6세계 최초 허가 줄기세포치료제 효능·효과 변경
- 7담즙성 담관염 신약 '리브델지', 국내 상용화 예고
- 8[기자의 눈] 질환보다 약이 먼저 알려지는 시대
- 9불응성 소세포폐암 신약 '임델트라, 급여 문턱 다시 넘을까
- 10경기 여약사위원회, 사회공헌활동 역량 집중



























































![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)

![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202602/1770888420842.png)
![[레비온] PDRN+EGF, 레비온RX PDRN EGF 크림](https://i.baropharm.com/products/202512/1765949426601.png)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/partner/products/3f39593e-6318-4dd9-a778-c008c868b5c8.png)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)



