알츠하이머 두번째 항-Aβ 단클론 항체, '키순라' 운명은
- 최병철 박사
- 2025-04-17 13:20:30
-
가
- 가
- 가
- 가
- 가
- 가
- 최병철 박사의 노벨드럭 인사이트
- 미 FDA, 지난해 7월 허가…9월 일본, 12월 중국 시판 승인
- 올해 3월 유럽 EMA 승인 '거절'….잠재적이고 치명적인 부작용 지적
- PR
- 전국 지역별 의원·약국 매출&상권&입지를 무료로 검색하세요!!
- 데일리팜맵 바로가기

미 FDA는 2011년부터 신약 승인 시 'NEW DRUG APPROVAL' 대신 'NOVEL DRUG APPROVAL'이라는 용어를 공식적으로 사용하고 있습니다. FDA는 매년 40~60개 안팎의 'NOVEL DRUG'을 승인하고 있으며, 이 중 일부는 국내에도 도입되어 의료현장에서 활용되고 있습니다. 이러한 혁신 신약들은 기존 치료 지침과 패턴을 변화시키며, 의료진과 환자들에게 새로운 치료 옵션을 제공하고 있습니다. 따라서 변화하는 치료 환경 속에서 신약에 대한 깊이 있는 이해와 환자에게 전달하는 정확하고 균형 잡힌 정보의 중요성이 그 어느 때보다 커지고 있습니다. 'NOVEL DRUG INSIGHT'에서는 신약의 개발 배경부터 허가 사항, 약리기전, 임상시험 결과를 통한 안전성과 유효성, 그리고 기존 치료제들과 비교 분석까지 폭넓고 깊이 있게 다룰 예정입니다. 집필할 신약은 필자의 관심 분야를 중심으로 선정될 예정이며, 실제 임상적 적용은 향후 변화할 수 있으므로 본문에 담긴 내용 역시 최신 지견에 따라 달라질 수 있음을 밝힙니다.
노벨 드럭 인사이트(NOVEL DRUG INSIGHT)를 시작하며...
1편: 새로운 알츠하이머 치료제 '키순라'
일라이 릴리(Eli Lilly)의 '키순라(KisunlaⓇ, Donanemab-azbt)'는 초기 증상의 알츠하이머병(Alzheimer's disease, AD)을 앓고 있는 성인 환자를 대상으로 개발된 질병 조절 치료제로, 뇌 내 아밀로이드 플라크(amyloid) plaque)가 존재하고 알츠하이머병으로 인한 경도 인지 장애(mild cognitive impairment, MCI) 또는 경증 치매(mild dementia)가 확인된 환자에서 질병의 진행을 늦추는 것을 목표로 한다.
이 약제는 병리적 Aβ 플라크를 표적으로 하여 이를 효과적으로 제거하는 기전을 기반으로 한다. 특히, 치료 시 아밀로이드 플라크가 감소하면 정맥 주입을 중단할 수 있도록 설계돼 있어, 장기적인 관점에서 치료 비용과 주입 횟수를 줄이는 이점이 있다.
미국 FDA는 2024년 7월 키순라를 승인했다. 신속 심사(Fast Track designation), 우선 심사(Priority Review) 및 혁신치료제 지정(Breakthrough Therapy designation)을 통해 심사 기간을 단축했다. 이어 2024년 9월 일본, 2024년 12월 중국에서도 각각 시판 승인을 획득했지만 국내에서는 아직 소개되지 않았다.
반면 2025년 3월 28일, 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)는 키순라의 시판 허가에 대해 거절 의견을 표명하였다. CHMP는 키순라가 보여준 치료적 이점이 아밀로이드 관련 영상 이상(amyloid-related imaging abnormalities, ARIA)으로 인한 잠재적이고 치명적인 부작용의 위험성을 능가하지 못한다고 판단했다. 이는 키순라의 임상시험에서 확인된 ARIA 발생률 및 관련 중증 이상반응 사례에 근거한 것으로, EMA의 최종 승인 결정에 중요한 영향을 미친 것으로 보인다.
알츠하이머병(AD)의 병태생리에서 아밀로이드 플라크 축적의 의미는?
아밀로이드(Amyloid)는 비정상적으로 응집된 단백질 복합체로 AD의 주요 병리적 특징 중 하나이다. 아밀로이드는 막관통 단백질인 아밀로이드 전구체 단백질(amyloid precursor protein, APP)이 프로테아제인 β-secretase(BACE1)와 γ-secretase에 의한 연속적인 절단 경로를 통해 생성된 Aβ(amyloid beta) 펩타이드로서 다양한 단백질, 금속 이온, 세포 파편 등과 함께 아밀로이드 플라크를 형성한다.
아밀로이드 플라크의 생성 및 축적은 신경세포 간 시냅스 전달을 방해하며, 인지 기능 저하를 포함한 다양한 신경학적 증상을 유발한다. 이에는 시냅스 가소성(synaptic plasticity) 저해, 칼슘 항상성(calcium homeostasis) 파괴, 활성산소종(reactive oxygen species, ROS) 생성 증가, 그리고 염증 반응 활성화 등이 있다. 이러한 병리적 변화들은 궁극적으로 타우 단백질(tau protein) 과인산화 및 응집을 유발하여 신경섬유 엉킴(neurofibrillary tangles) 형성을 촉진한다.
따라서, 현재 받아들여지고 있는 아밀로이드 연쇄반응 가설에 따르면, Aβ의 과도한 축적이 AD 병태생리의 초기 원인으로 작용하여 일련의 신경 퇴행성 변화를 유발하는 것으로 이해되고 있다.
APP의 절단 경로는 크게 비-아밀로이드 생성 경로(non-amyloidogenic pathway)와 아밀로이드 생성 경로(amyloidogenic pathway)로 구분된다.
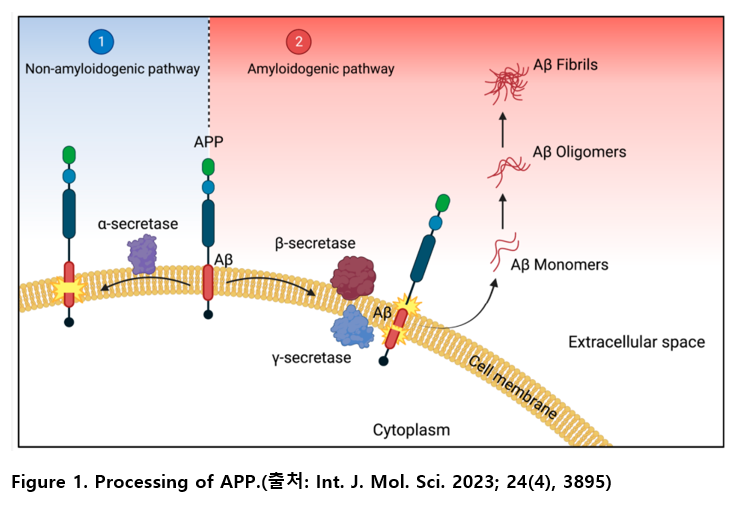
반면, 아밀로이드 생성 경로에서는 APP가 우선 β-secretase에 의해 절단되고, 이후 γ-secretase에 의해 추가 절단되면서 독성 형태의 Aβ 펩타이드를 생성하게 된다. 생성된 Aβ 펩타이드는 세포 외로 분비된 후 독성 올리고머(cytotoxic oligomers) 및 불용성 Aβ 섬유(Aβ fibrils)로 응집되어 최종적으로 플라크를 형성한다.
알츠하이머병(AD)에서 면역치료 전략은?
AD의 면역치료(immunotherapy)는 병리적 Aβ 축적을 억제하거나 제거하는 것을 목표로 개발되어 왔으며, 주요 전략으로는 능동적(active) 및 수동적(passive) 면역치료가 있다. 그러나 지금까지 다수의 임상시험은 제한된 치료 효과 또는 안전성 문제로 인해 중도에 중단되거나 실패를 경험한 바 있다.
능동 면역치료는 환자의 면역계를 자극하여 표적 항원에 대한 내인성 항체 생성을 유도하는 접근법이다. AD에서는 Aβ peptide 또는 타우 단백질을 표적으로 한 백신이 연구되어, 병태생리학적 핵심 병리인 단백질 축적에 대한 면역반응을 유도하는 것을 목표로 한다. 능동 면역치료는 상대적으로 비용 효율성, 투여 편의성, 그리고 장기적 효과 가능성이라는 장점을 가지지만, 면역 과민반응 유발 위험성, 고령 환자에서의 낮은 면역반응 유도율, 그리고 질병 진행 단계에 따른 효과 제한성 등의 단점이 존재한다. 특히 고령층에서 백신에 대한 면역반응이 미약할 수 있어, 치료 효과의 일관성을 확보하는 데 어려움이 있다.
이에 비해 수동 면역치료, 즉 항-Aβ 단클론 항체(monoclonal antibodies, mAbs)를 활용한 전략은 이미 형성된 병리적 Aβ 응집체를 직접적으로 제거하거나 응집을 억제하는 기전을 기반으로 한다.
그러나 수동 면역치료는 두 가지 주요한 생물학적 장벽에 직면해 있다.
첫째, 혈액-뇌 장벽(blood–brain barrier, BBB)은 항체가 치료 표적 부위인 뇌 실질로의 접근을 제한하는 주요 요인이다. 따라서, BBB를 효과적으로 통과할 수 있는 최적의 항체 농도 및 투여 방법을 설정하는 것이 임상적으로 중요한 과제이다.
둘째, 뇌 내 면역 반응, 특히 미세아교세포(microglia)의 과활성화에 의한 신경 염증 반응이 문제가 된다. 일부 임상시험에서는 항체 투여 후 아밀로이드 관련 영상 이상(amyloid-related imaging abnormalities, ARIA)과 같은 이상 반응이 보고되었으며, 이는 치료의 안전성 확보에 있어 신중한 접근이 필요하다.
그럼에도 불구하고, 차세대 항-Aβ 단클론 항체는 Aβ 단량체로부터 섬유성 응집체인 아밀로이드 플라그로의 전환을 억제하는 기전을 바탕으로 개발되고 있으며, 시험관 내(in vitro) 및 생체 내(in vivo) 연구에서 그 효능이 입증되고 있다. 실제로, 여러 항-Aβ 항체들이 동물 모델 및 인간 대상 임상시험에서 아밀로이드 병리(amyloid pathology) 감소 효과를 보인 바 있으며, 이는 항-Aβ 면역치료의 임상적 가능성을 뒷받침하는 중요한 근거로 평가된다.
더 나아가, 최근에는 Aβ 외에도 타우 단백질을 표적으로 한 능동 면역 백신이 활발히 개발되고 있으며, 이러한 새로운 면역치료 전략들은 향후 병용 요법(combination therapy)의 형태로도 적용 가능성이 연구되고 있다. Aβ와 타우를 동시 표적으로 하는 병용 면역치료는 AD 병리의 다중 경로를 효과적으로 차단하는 보다 포괄적인 치료 전략으로 기대된다.
항-Aβ 단클론 항체 개발 및 치료적 진화는 어떻게 진행되었나?
1980년대 후반부터 1990년대 초까지 AD 환자의 뇌에서 아밀로이드 플라크가 축적된다는 사실이 규명되면서, Aβ가 AD의 주요 병리 인자로 인식되기 시작했다.
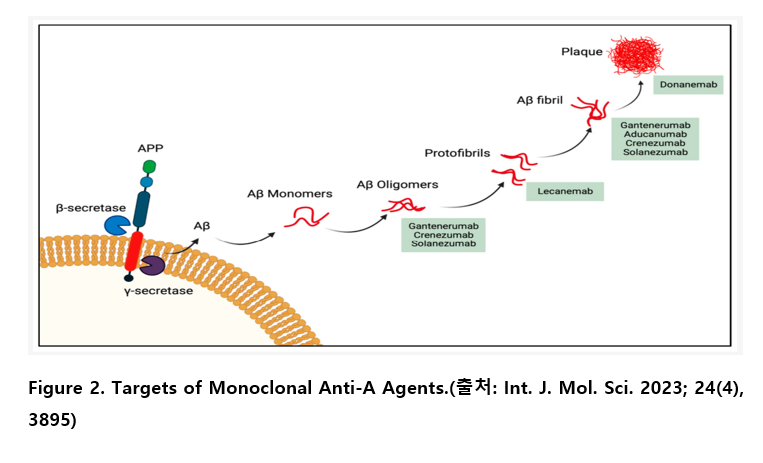
대표적인 항-Aβ 단클론 항체 중 하나인 아두카누맙(Aducanumab, AduhelmⓇ, Biogen)은 Aβ 펩타이드의 N-말단(3–7)을 표적으로 하는 인간화 IgG1 항체로, 주로 응집된 Aβ에 선택적으로 결합하는 특징을 갖는다. 2021년 6월 미국 FDA로부터 경도에서 중등도 AD 환자에 대한 치료제로 가속 승인되었다. 그러나 플라크 제거 효과와는 별개로, 인지 기능 개선에 대한 임상적 유의성이 논란의 대상이 되었다. 결국 Biogen은 2022년 말, 아두카누맙에 대한 상업적 마케팅 및 판매를 단계적으로 중단한다고 발표하였다.
간테네루맙(Gantenerumab), 크레네주맙(Crenezumab 그리고 솔라네주맙(Solanezumab)은 Aβ 올리고머 및 섬유 모두를 표적으로 하는 항체가 개발되었지만 2상 또는 3상 임상에서 임상적 효능을 입증하지 못하였거나 제한적이었기 때문에 현재 모두 개발이 중단된 상태다.
한편, 레카네맙(Lecanemab, 레켐비, LeqembiⓇ, 에자이)은 Aβ 올리고머 및 섬유를 표적으로 하는 인간화 IgG1 단클론 항체로, 특히 Aβ 응집체의 초기 형태에 대한 높은 선택성을 보인다. 레카네맙은 아밀로이드 병리의 초기 단계에 개입하여 질병의 진행을 억제하는 것을 목표로 하며, 3상 CLARITY AD 임상에서 조기 AD 환자군(경도 인지장애 및 경증 치매 단계)을 대상으로 유효성과 안전성이 평가되었다.
CLARITY AD 임상을 근거로 미국 FDA는 레카네맙을 2023년 1월 가속 승인하였으며, 2023년 7월에 정식 승인(full approval))하였다, 국내에서도 2024년 2월 ‘알츠하이머병으로 인한 경도 인지 장애 또는 경증의 알츠하이머병 성인 환자의 치료’에 승인하였으면 현재 비급여로 사용하고 있다.
도나네맙(Donanemab, 키순라, Kisunla, 릴리)은 뇌 내 축적된 피로글루탐산화 Aβ(pE3–Aβ, N-terminal pyroglutamate-modified Aβ) 를 특이적으로 표적으로 하는 인간화 IgG1 단클론 항체이다. 미국 FDA는 글로벌 데이터 TRAILBLAZER-ALZ 2를 근거로 2024년 7월에 ‘mild cognitive impairment or mild dementia stage of disease’에 승인하였다. 이는 아두카누맙, 레카네맙에 이어 세 번째 미국 FDA 승인이지만 아두카누맙 상황을 고려한다면 두 번째 항-Aβ 항체라고 할 수 있다.
이 약제는 성숙된 형태의 병리적 Aβ 플라크에 대한 높은 친화성을 가진다. 또한, 미세아교세포를 통한 식작용을 유도하여 병리적 플라크를 제거하는 직접적인 기전을 가지며, Aβ의 병리적 변형 형태를 선택적으로 인식함으로써 정상 생리적 단량체에 대한 영향은 최소화될 가능성이 있는 것으로 평가된다.
항-Aβ 항체의 작용 기전 및 병태생리학적 의미는?
항-Aβ 항체는 Aβ 단량체, Aβ 올리고머, Aβ 섬유, 및 플라크를 포함한 다양한 형태의 Aβ와 상호작용함으로써, Aβ 연쇄반응의 여러 병태생리적 단계를 차단할 수 있다.
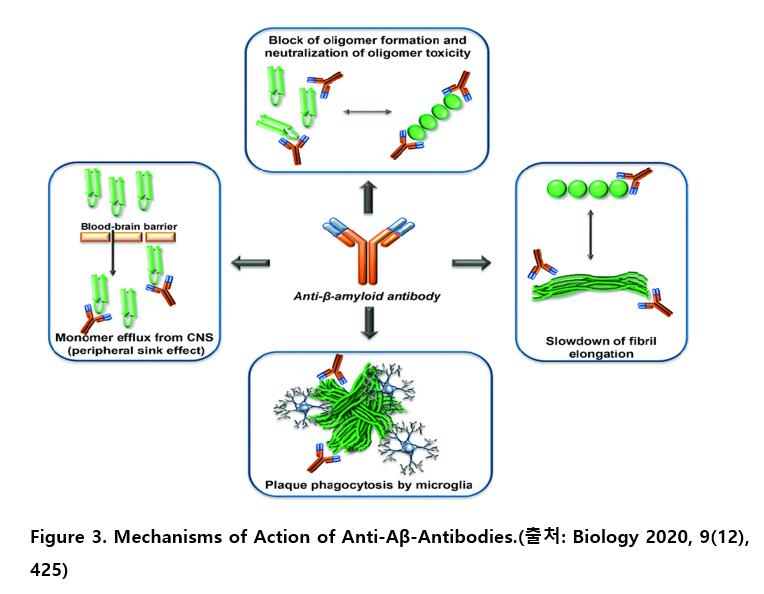
특히, 항체의 에피토프 특이성(epitope specificity)과 투여 농도(concentration)는 그 작용 기전을 결정하는 중요한 요소로 작용한다. 일부 항체는 플라크에 직접 결합하여 미세아교세포(microglia)를 활성화시키고, 이를 통해 식작용(phagocytosis)을 유도하여 플라크의 제거를 촉진하는 것으로 보고되었다. 이러한 면역 매개 플라크 제거 과정은 효과적인 Aβ 축적 감소를 가능하게 하지만, 동시에 염증 반응 및 아밀로이드 관련 영상 이상(ARIA)과 같은 이상 반응 발생과도 밀접한 관련이 있는 것으로 알려져 있다.
또한, 말초 싱크 효과(peripheral sink effect)는 항-Aβ 항체의 또 다른 중요한 기전으로 제시된다. 이는 항체가 말초 순환계 내 Aβ와 결합하여 혈중 Aβ 농도를 감소시키고, 농도 구배에 따라 뇌 내 Aβ가 혈중으로 이동하면서 결과적으로 뇌 내 Aβ 축적이 감소하는 현상이다. 비록 초기에는 이 가설의 타당성에 대해 논란이 존재하였으나, 최근 전임상 및 임상 연구를 통해 점차 그 병태생리학적 기반이 입증되고 있다.
이러한 다면적인 작용 기전은 항체의 표적 선택성 및 투여 전략에 따라 치료 효능과 이상 반응 및 부작용을 결정짓는 핵심 요소로 작용하며, 향후 보다 정밀한 치료제 개발을 위한 기초를 제공하고 있다.
항-Aβ 항체 치료에서 아밀로이드 관련 영상 이상(ARIA)는 어떠한 의미를 가지는가?
2010년 항아밀로이드(anti-amyloid) 치료제 개발 과정에서 반복적으로 관찰된 영상학적 이상 소견의 표준화와 평가 체계 마련을 위해 전문가 워크그룹이 구성되었다. 이들은 아밀로이드 관련 영상 이상(amyloid-related imaging abnormalities, ARIA)이라는 용어를 처음으로 사용하였고 이에 대한 분류 체계를 확립하였다. ARIA는 크게 ARIA-E(edema/exudate, 부종 또는 삼출 관련)와 ARIA-H(hemorrhage/hemosiderin deposition, 미세출혈 및 헤모시데린 침착 관련)로 세분화된다.
ARIA는 주로 영상 소견을 기반으로 진단되나, 그 병태생리학적 기전은 완전히 규명되지 않았다. AD 진행 과정에서 뇌혈관 구조는 정상 상태에서 뇌 아밀로이드 혈관병증(cerebral amyloid angiopathy, CAA)으로 변화하며, 이 과정에서 혈관 내 Aβ 침착, 혈관벽 무결성 손상, 그리고 혈관 주위 청소 경로(perivascular clearance pathway)의 장애가 동반되는 것으로 추정된다. 고령과 APOE ε4 대립유전자 보유는 이러한 혈관 병리의 형성을 촉진하는 주요 위험인자로 작용한다.
항-Aβ 항체 시 투여된 항체는 뇌 실질 및 혈관벽에 축적된 Aβ와 결합하면서 항체-Aβ 면역복합체를가 형성한다. 이는 복합체의 이동과 혈관 주위 염증 반응을 유발하며, 플라크 청소 과에서 대량의 Aβ가 혈관 주위로 이동하면서 급성 동맥염과 혈관벽 손상, 투과성 증가가 발생하게 된다. 결과적으로 단백질성 삼출액(ARIA-E) 또는 혈액 분해산물(ARIA-H)이 뇌 실질로 유출되는 병태가 초래된다.
실제 임상에서도 이러한 병리적 기전이 관찰된다. 예를 들어, 레카네맙 치료 중 발생한 치명적 ARIA 사례의 부검 결과, 급성 동맥염 소견과 더불어 광범위한 혈관 주위 염증, 세동맥 변성, 그리고 뇌 실질 및 연질뇌막(leptomeninges) 내 광범위한 미세출혈이 확인되었다.
메타분석 결과에 따르면, 항-Aβ 항체 치료를 받은 환자에서 ARIA-E와 ARIA-H의 발생률은 각각 6.5%와 7.8%로 보고되었으며, 항체의 종류, 표적 Aβ 형태, 투여 용량 및 빈도, 그리고 APOE ε4 유전자 보유 여부에 따라 ARIA 발생 위험이 유의하게 달라지는 것으로 나타났다.
레카네맙의 3상 CLARITY AD 시험에서는 ARIA-E 12.6%, ARIA-H 17.3%, 전체 ARIA 발생률 21.5%가 보고되었으며, 이는 APOE ε4 보유자 및 비보유자를 포함한 수치이다.
반면, 도나네맙의 3상 TRAILBLAZER-ALZ 2 임상에서는 보다 높은 ARIA-E 24.0%, ARIA-H 31.4%, 전체 ARIA 36.8%의 발생률이 관찰되었다. 특히 APOE ε4 보유자에서 ARIA 발생 위험이 더 높게 나타났으며, 이는 유전형 기반 선별 및 모니터링 전략의 필요성을 시사한다.
도나네맙은 어떤 약제인가?
도나네맙(Donanemab-azbt, KisunlaⓇ, 릴리)은 미국 FDA으로부터 세 번째로 승인된 항-Aβ 헝채 기반 AD 치료제로, 아밀로이드 병리가 확인된 경도 인지장애(MCI) 및 경증 치매 단계의 AD 성인 환자를 대상으로 사용이 승인되었다. 이 약제는 최초로 AD 진행의 핵심 병리인 불용성 N3pG Aβ(N-말단 3번 위치에서 피로글루탐산으로 변형된 아밀로이드-베타) 플라크를 특이적으로 표적하는 인간화 IgG1 서브클래스의 단클론 항체로 개발되었다.
도나네맙의 유효성은 3상 임상인 TRAILBLAZER-ALZ 2를 통해 입증되었다. 해당 연구에서 도나네맙 치료군은 위약군 대비 뇌 내 아밀로이드 플라크의 유의미한 감소를 보였으며, 이는 도나네맙이 AD 병리의 핵심인 아밀로이드 축적을 효과적으로 억제하거나 제거할 수 있음을 시사하는 결과였다. 또한 안전성에 대해서는 치료군에서 ARIA-E 및 ARIA-H 발생이 보고되었으나, 전체적인 위험-편익(risk-benefit) 프로파일이 긍정적으로 평가되었다.
도나네맙의 약리학적 작용 기전 및 치료적 의의는?
도나네맙은 N3pG Aβ(N-terminal pyroglutamate-modified amyloid-beta) 또는 pE3–Aβ(pyroglutamate-modified amyloid-beta at position 3) 플라크의 특이적 에피토프에 결합하여 뇌 내 아밀로이드 플라크를 효과적으로 제거하는 작용을 한다.
N3pG Aβ는 일반적인 Aβ 펩타이드에 비해 응집성이 높고, 분해 저항성이 강하며, 신경 독성이 증가된 병리적 형태로, 플라크 형성을 가속화하고 신경 손상을 유발하는 주요 인자로 알려져 있다.
이를 제거하는 과정은 미세아교세포를 활성화하여 플라크를 포식하고, 신경세포 주변에서 병리적 침착물을 제거하는 면역 매개 메커니즘을 통해 이루어진다. 결과적으로 뇌 조직 내 아밀로이드 축적이 감소되며, AD의 진행 속도를 늦추는 데 기여한다. 이는 분자적 관점에서는 시냅스 손상의 주요 병인을 차단함으로써, 신경 가소성 감소와 인지 기능 저하로 이어지는 병태생리적 경과를 완화할 수 있다.
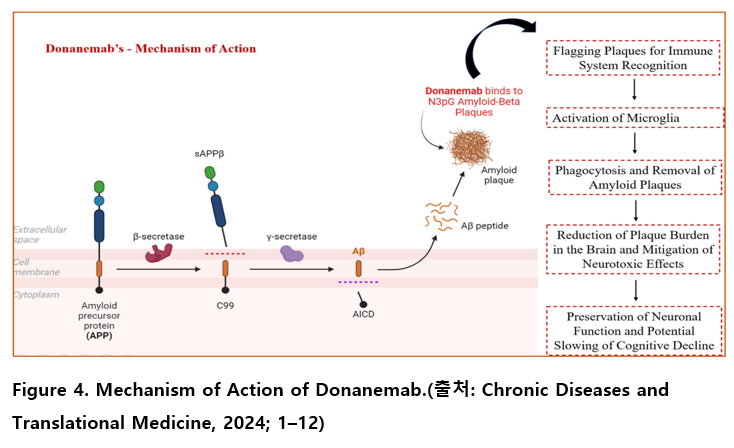
더 나아가 뇌 내 아밀로이드 농도의 감소는 아밀로이드 독성에 의해 유발되는 신경 염증 반응을 감소시키고, 신경세포의 손상을 예방하는 효과를 통해 시냅스 기능의 안정화 및 향상을 도모할 수 있다. 궁극적으로 이러한 기전은 인지 기능 악화의 진행을 지연시키거나 억제하며, 초기 AD 환자에서의 임상적 개선으로 이어질 가능성이 있다.
이 약제는 주로 경도인지장애(MCI) 또는 경증 치매 단계의 초기 AD 환자군을 대상으로 개발되었으며, 해당 환자군을 중심으로 안전성과 유효성이 검토되었다. 따라서 표적 치료의 전략은 AD의 조기 병기에서 병태생리를 근본적으로 수정하여 질병의 진행을 완화하는 효과를 기대할 수 있다는 점에서 임상적 의미가 크다.
도나네맙의 안전성과 유효성 평가는?
TRAILBLAZER-ALZ 2는 도나네맙의 안전성과 유효성을 평가한 3상 임상시험으로, AD로 인한 경도인지장애(MCI) 또는 경도 치매를 겪고 있으며, 병리학적으로 AD 신경병리가 확인된 초기 증상 환자를 대상으로 하였다.
다국적, 무작위배정, 이중눈가림, 위약 대조 방식으로 설계된 본 시험에는 총 1,736명의 환자가 참여하였으며, 참가자들은 인지기능 평가와 AD 병리 증거에 기반하여 선정되었다. 시험은 8개국에서 시행되었으며, 환자들은 매 4주 간격으로 초기 3회 700mg, 이후에는 1,400mg도나네맙을 투여받는 군과 위약군으로 무작위 배정되어 최대 72주간 치료를 받았다.
치료 중단 여부는 특정 시점(24주, 52주, 76주)의 아밀로이드 PET 스캔 결과를 바탕으로 결정되었다. PET 검사에서 아밀로이드 플라크 수치가 11 센틸로이드 미만이거나, 두 차례 연속 검사에서 11 이상 25 미만의 수치를 보인 경우에는 치료 중단 및 위약 전환이 고려되었다. 이러한 설계는 치료 종료 후에도 지속적인 효과를 평가할 수 있도록 고안되었다.
아밀로이드 PET 결과에 따르면, 도나네맙 투여 환자의 17%가 투여 시작 후 6개월 만에 치료를 완료했으며, 47%는 1년 이내, 69%는 18개월 이내에 치료를 완료하였다. 치료 종료 후 1년까지도 인지 저하 속도는 지속적으로 느려지는 경향을 보였다.
본 시험의 주요 유효성 평가 지표는 76주 시점의 통합 알츠하이머병 평가지수(iADRS) 변화였다. iADRS는 ADAS-Cog13(인지기능 평가)과 ADCS-iADL(일상생활 기능 평가)을 통합한 척도로, 점수 감소는 인지 및 기능 저하를 의미한다.
도나네맙 투여군은 위약군 대비 76주 시점에서 iADRS 점수 저하 속도가 유의하게 느려졌으며, 최대 18개월 동안 인지 및 기능 저하 속도가 최대 35%까지 감소하였다. 또한, 질병 진행에 따른 임상 단계 악화 위험이 최대 39%까지 감소하였다. 아밀로이드 플라크의 경우, 평균적으로 18개월 시점에서 84%까지 감소하였다.
PET 영상 분석 결과, 1년간 인지기능 유지율은 도나네맙 투여군이 47%로 위약군의 27% 대비 높았다. 특히, 치료 중 아밀로이드 플라크 제거가 확인될 경우 약물 투여를 중단할 수 있도록 설계된 점이 본 임상시험의 중요한 특징 중 하나였다.
안전성 분석에서는, 자기공명영상(MRI)을 통해 감지된 아밀로이드 관련 영상 이상(ARIA)과 두통이 주요 이상 반응으로 보고되었다. 특히 ARIA는 도나네맙의 대표적인 부작용으로, 임상적 모니터링이 필요한 부분으로 지적되었다.
이러한 결과는 도나네맙이 초기 AD 환자에서 아밀로이드 플라크를 효과적으로 제거하고 인지 및 기능 저하 속도를 의미 있게 늦출 수 있음을 보여준다. 다만, ARIA를 비롯한 이상 반응 관리가 여전히 과제로 남아 있으며, 장기적 효과 및 안전성에 대한 추가 연구가 필요하다.
도나네맙의 승인 과정과 주요 쟁점은?
도나네맙의 개발 및 승인 과정에서 가장 큰 안전성 문제로 지적된 것은 ARIA의 높은 발생률이었다. 미국 FDA는 초기 임상 2상 데이터를 기반으로 제출된 가속 승인 신청에 대해 충분한 임상적 혜택을 입증하는 근거가 부족하다고 판단하여 심사를 보류한 적이 있다. 그러나 이후 TRAILBLAZER-ALZ 2로 명명된 3상 임상시험 결과가 발표되면서 도나네맙의 유효성이 긍정적으로 입증되어 FDA의 정식 승인을 받기에 이르렀다.
반면, 유럽 EMA의 CHMP는 2025년 3월, 도나네맙의 시판허가(Marketing Authorisation) 신청을 부정적 권고(negative opinion)와 함께 기각하였다. 그 근거는 첫째, 도나네맙 투여군에서 높은 빈도의 ARIA가 관찰되었으며, 그 중 일부는 임상적으로 중대한 신경학적 이상 또는 치명적인 사례로 이어졌다. 전체 도나네맙 투여 환자의 약 36.8%에서 ARIA가 발생하였고, 이 중 상당수는 ARIA-E 및 ARIA-H을 동반하였다. 이는 위약군(14.9%)에 비해 현저히 높은 수치이다. 두 번째, ApoE ε4 유전자를 보유하지 않은 하위집단에서도 ARIA 발생률은 24.7%에 달하였으며, 이는 동일 하위집단의 위약군(12.0%) 대비 두 배 이상 높은 수치이다. 이로 인해 ARIA 위험이 특정 유전자형에 국한되지 않음을 시사한다.
세 번째, 주된 유효성 평가 변수였던 iADRS 변화량에서 도나네맙군은 위약 대비 통계적으로 유의한 차이를 보였으나, 그 절대적 개선 폭은 작았다(도나네맙군 -10점 vs 위약군 -13점). 이는 치료적 유익성의 임상적 중요성이 제한적일 수 있음을 시사한다. 마지막으로 ApoE ε4 비보유자 하위집단에 대한 장기 추적자료가 부족하여, 지속적인 임상적 혜택과 안전성 프로파일을 확증할 수 없었다. 결론적으로, CHMP는 도나네맙의 제한적인 임상 효능이 ARIA로 인한 심각하고 잠재적으로 치명적인 이상반응의 위험을 상쇄하지 못한다고 판단하였다.
도나네맙는 치료 비용과 주입 횟수를 줄일 수 있다는 점에서 먼저 승인된 레카네맙 대비 치료 효율성과 편의성에서 우위를 가진다. 다만, 2021년 11월부터 경도인지장애(MCI) 예방을 목표로 한 글로벌 임상시험이 진행되고 있고, 유럽 EMA에서 재검토를 요청한 상태에 있다. 따라서 도나네맙이 국내에서도 임상이 이루어지고 있는 만큼, 향후 국내 승인 여부와 최종 시장 진입 결과가 주목된다.
참고문헌 1. Anne-Cathrine S. Vogt, Gary T. Jennings, Mona O. Mohsen, et al. “Alzheimer’s Disease: A Brief History of Immunotherapies Targeting Amyloid β.” Int. J. Mol. Sci. 2023; 24(4), 3895. 2. Francesca Mantile, Antonella Prisco, “Vaccination against β-Amyloid as a Strategy for the Prevention of Alzheimer’s Disease.” Biology 2020;9(12), 425. 3. Nandhini Jayaprakash, Karthikeyan Elumalai, “Translational Medicine in Alzheimer's Disease: The Journey of Donanemab From Discovery to Clinical Application” Chronic Diseases and Translational Medicine, 2024;1–12. 4. John R. Sims, Jennifer A. Zimmer, Cynthia D. Evans, et al. “Donanemab in Early Symptomatic Alzheimer Disease The TRAILBLAZER-ALZ2 Randomized Clinical Trial.” JAMA. 2023;330(6):512-527. 5. Thomas A. “Pyroglutamate Aβ cascade as drug target in Alzheimer’s disease” Molecular Psychiatry 2022;27:1880–1885. 6. EMA, "Questions and Answers on the refusal of the marketing authorisation for Kisunla (donanemab)", March 2025. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)
관련기사
-
뉴로핏, 알츠하이머병-파킨슨병 국제학회 참가
2025-03-31 09:07:32
-
'레켐비' 작년 매출 3200억…알츠하이머 신약 시장 기지개
2025-03-14 05:45:49
-
'알츠하이머 신약 개척'…투여 편의성 업그레이드 속도
2025-02-05 12:05:11
- 댓글 0
- 최신순
- 찬성순
- 반대순
-
등록된 댓글이 없습니다.
첫 댓글을 남겨주세요.
오늘의 TOP 10
- 1이 대통령 "탈모약·비만약 건보급여 가능성 검토하라"
- 2이 대통령 "건보공단 특사경 40명, 비서실이 챙겨 지정하라"
- 3"플랫폼 도매겸영 혁신 아냐" 피켓 든 보건의료시민단체
- 4복지부 "의대정원·지역의사제·공공의대 기반 지필공의료 강화"
- 5식약처 "신약·바이오시밀러 허가기간 240일로 단축"
- 6대전시약, 장철민 의원 간담회서 닥터나우 방지법 논의
- 7휴메딕스, 턱밑 지방 개선 주사제 ‘올리핏’ 라인업 확대
- 8서울 시민 10명 중 9명 “약사 전문 상담 서비스 필요”
- 9울산시약, 경찰청과 '탈북주민 의료사각지대 해소' 맞손
- 10대화제약, 강원 수출의 날 '1천만불 수출의 탑’ 수상



























![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)



