-
 한미약품 오락솔 美 파트너사, 파산보호 신청한미약품 연구원이 신약 후보물질 연구를 하고 있다.(사진 한미약품) [데일리팜=황진중 기자] 한미약품의 경구용 항암제 '오락솔'의 미국 파트너사 아테넥스가 파산보호를 신청했다. 오락솔 미국 시판허가와 관련해 보완요구서한(CRL)을 받은 여파로 보인다.아테넥스는 서한을 받은 후에도 오락솔 개발을 지속했다. 세포치료제 분야로 사업을 재편했지만 자금 압박 등에 따라 자산을 매각할 예정이다. 파산보호 신청에 앞서 나스닥 상장 유지 시가총액 기준을 지키지 못해 상장 폐지 경고서한을 수령했다.16일 업계에 따르면 아테넥스는 미국 텍사스 남부지방 파산법원에 미국 파산법 챕터 11을 신청했다.아테넥스는 항암제와 세포치료제 개발 전문 미국 제약바이오기업이다. 2011년 한미약품으로부터 항암제 오락솔을 기술도입했다. 오락솔은 항암 주사제인 파클리탁셀을 경구용으로 바꾼 신약 후보물질이다. 오락솔에는 한미약품의 플랫폼 기술인 오라스커버리가 적용됐다.파산법 챕터 11은 파산법원 감독 하에 일부 자산 매각과 구조조정 절차 등을 진행해 기업회생을 모색하는 제도다. 국내 법정관리와 유사한 것으로 볼 수 있다. 파산법원은 부채의 일부나 전액을 탕감해주거나 상환을 유예하는 수단으로 기업을 정상화 하는 것이 청산하는 것보다 경제적으로 더 이익이라고 판단할 시 챕터11 신청을 승인한다.아테넥스는 자산의 신속한 매각을 진행하기 위해 대출 기관과 합의했다. 이번 파산법 챕터 11 신청은 매각 절차를 원활하게 진행하기 위한 방안이다. 주요 자산인 아테넥스 제약 사업부(APD)와 오락솔, 세포치료제를 매각할 계획이다. 뉴욕 클래런스에 있는 공장과 아테네 약국 솔루션(APS)은 티르바니불린 연고의 상업적 공급을 제공하기 위해 앞으로 90일 간 운영을 지속할 예정이다.아테넥스의 파산보호 신청은 FDA로부터 오락솔 시판허가를 받지 못한 것이 영향을 준 것으로 보인다.아테넥스는 2021년 3월 FDA로부터 전이성 유방암 적응증을 대상으로 개발하던 오락솔에 대한 CRL을 수령했다. 이후 FDA와 오락솔 신약 시판허가신청(NDA)을 위해 신규 임상 디자인과 허가 절차 등을 논의하는 타입 A 미팅을 진행했다. 논의 후에는 오락솔을 전이성 유방암 적응증 외에 다른 적응증을 타깃으로 개발하는 연구에 집중하고 세포치료제 분야로 사업을 확장했다.존슨 라우 아테넥스 최고경영자(CEO)는 "불행히도 우리는 오락솔과 관련해 FDA로부터 CRL을 받았다"면서 "CRL은 어려운 경제 환경과 함께 아테넥스의 자금 등에 엄청난 압력을 가했다"고 말했다.존슨 라우 아테넥스 CEO는 이어 "지난 2년 동안 아테넥스는 세포치료제를 중심으로 사업을 재집중하고 비핵심자산을 현금화 해 1억800만 달러(약 1443억원)의 부채를 상환했다"면서 "파산보호 신청을 피하기 위해 가능한 모든 방법을 모색했지만 현재로서는 자산 매각이 최선의 방법이다"고 설명했다.아테넥스는 파산보호 신청에 앞서 지난달 27일 나스닥 상장 기준 중 하나인 시가총액 1500만달러(약 200억원) 이상을 유지하지 못해 나스닥으로부터 상장 폐지 경고서한을 수령했다. 파산보호 신청 발표 후 아테넥스 주가는 12일(현지시간) 1.20달러(약 1603원)에서 15일 0.47달러(약 628원)로 60% 하락했다. 아테넥스 시가총액은 388만 달러(약 52억원)다. 지난해 말 기준 아테넥스가 보유한 현금성자산은 3560만 달러(약 476억원)다.2023-05-16 12:00:42황진중
한미약품 오락솔 美 파트너사, 파산보호 신청한미약품 연구원이 신약 후보물질 연구를 하고 있다.(사진 한미약품) [데일리팜=황진중 기자] 한미약품의 경구용 항암제 '오락솔'의 미국 파트너사 아테넥스가 파산보호를 신청했다. 오락솔 미국 시판허가와 관련해 보완요구서한(CRL)을 받은 여파로 보인다.아테넥스는 서한을 받은 후에도 오락솔 개발을 지속했다. 세포치료제 분야로 사업을 재편했지만 자금 압박 등에 따라 자산을 매각할 예정이다. 파산보호 신청에 앞서 나스닥 상장 유지 시가총액 기준을 지키지 못해 상장 폐지 경고서한을 수령했다.16일 업계에 따르면 아테넥스는 미국 텍사스 남부지방 파산법원에 미국 파산법 챕터 11을 신청했다.아테넥스는 항암제와 세포치료제 개발 전문 미국 제약바이오기업이다. 2011년 한미약품으로부터 항암제 오락솔을 기술도입했다. 오락솔은 항암 주사제인 파클리탁셀을 경구용으로 바꾼 신약 후보물질이다. 오락솔에는 한미약품의 플랫폼 기술인 오라스커버리가 적용됐다.파산법 챕터 11은 파산법원 감독 하에 일부 자산 매각과 구조조정 절차 등을 진행해 기업회생을 모색하는 제도다. 국내 법정관리와 유사한 것으로 볼 수 있다. 파산법원은 부채의 일부나 전액을 탕감해주거나 상환을 유예하는 수단으로 기업을 정상화 하는 것이 청산하는 것보다 경제적으로 더 이익이라고 판단할 시 챕터11 신청을 승인한다.아테넥스는 자산의 신속한 매각을 진행하기 위해 대출 기관과 합의했다. 이번 파산법 챕터 11 신청은 매각 절차를 원활하게 진행하기 위한 방안이다. 주요 자산인 아테넥스 제약 사업부(APD)와 오락솔, 세포치료제를 매각할 계획이다. 뉴욕 클래런스에 있는 공장과 아테네 약국 솔루션(APS)은 티르바니불린 연고의 상업적 공급을 제공하기 위해 앞으로 90일 간 운영을 지속할 예정이다.아테넥스의 파산보호 신청은 FDA로부터 오락솔 시판허가를 받지 못한 것이 영향을 준 것으로 보인다.아테넥스는 2021년 3월 FDA로부터 전이성 유방암 적응증을 대상으로 개발하던 오락솔에 대한 CRL을 수령했다. 이후 FDA와 오락솔 신약 시판허가신청(NDA)을 위해 신규 임상 디자인과 허가 절차 등을 논의하는 타입 A 미팅을 진행했다. 논의 후에는 오락솔을 전이성 유방암 적응증 외에 다른 적응증을 타깃으로 개발하는 연구에 집중하고 세포치료제 분야로 사업을 확장했다.존슨 라우 아테넥스 최고경영자(CEO)는 "불행히도 우리는 오락솔과 관련해 FDA로부터 CRL을 받았다"면서 "CRL은 어려운 경제 환경과 함께 아테넥스의 자금 등에 엄청난 압력을 가했다"고 말했다.존슨 라우 아테넥스 CEO는 이어 "지난 2년 동안 아테넥스는 세포치료제를 중심으로 사업을 재집중하고 비핵심자산을 현금화 해 1억800만 달러(약 1443억원)의 부채를 상환했다"면서 "파산보호 신청을 피하기 위해 가능한 모든 방법을 모색했지만 현재로서는 자산 매각이 최선의 방법이다"고 설명했다.아테넥스는 파산보호 신청에 앞서 지난달 27일 나스닥 상장 기준 중 하나인 시가총액 1500만달러(약 200억원) 이상을 유지하지 못해 나스닥으로부터 상장 폐지 경고서한을 수령했다. 파산보호 신청 발표 후 아테넥스 주가는 12일(현지시간) 1.20달러(약 1603원)에서 15일 0.47달러(약 628원)로 60% 하락했다. 아테넥스 시가총액은 388만 달러(약 52억원)다. 지난해 말 기준 아테넥스가 보유한 현금성자산은 3560만 달러(약 476억원)다.2023-05-16 12:00:42황진중 -
 디엑스앤브이엑스, 이용구 대표·권규찬 사장 신규 선임이용구 신임 대표이사(좌), 권규찬 신임 사장 [데일리팜=김진구 기자] 디엑스앤브이엑스(DXVX)는 한미약품 출신 이용구 대표이사와 권규찬 사장을 선임한다고 16일 밝혔다.디엑스앤브이엑스는 16일 이사회를 통해 이용구 대표이사를 선임한다고 밝혔다.이용구 신임 대표이사는 한양대를 졸업하고 한미약품에 입사해 영업·마케팅전략실 팀장으로 활동하며 한미약품의 당뇨·심혈관질환을 담당했다.이어 북경한미약품 경영기획실 총감, 북경룬메이캉 헬스케어사업부 대표, 코리(COREE) 그룹 부사장을 역임했다. 2006년부터 북경한미약품과 코리그룹의 중국 의약품·헬스케어사업을 개척한 글로벌 영업전략통으로 알려졌다.2022년에는 디엑스앤브이엑스의 바이오헬스케어 사업의 성장을 주도하여 거래재개의 기틀을 마련했으며, 최근 항생제 유통 사업과 마이크로바이옴 기반 12종 제품 출시를 기획하는 등 회사 성장동력 확보에 대한 기여도가 높게 평가됐다.이와 함께 권규찬 한미약품 글로벌사업본부장을 영입해 사장으로 선임했다고도 밝혔다. 권규찬 신임 사장은 향후 주주총회를 거쳐 사내이사로 선임될 예정이다.권규찬 신임 사장은 서울대 응용생물화학 학사·석사, 고려대 기술경영 공학박사를 취득했다. LG화학 바이오텍 연구소와 LG생명과학 RA팀을 거쳐, 한미약품에서 글로벌사업본부장으로 해외 RA, 해외사업개발, 해외영업, 신약임상, 라이센싱 등을 총괄했다.LG 생명과학 근무 시 4가 백신과 5가 백신, 뇌수막염백신 등의 해외허가 경험을 쌓았다. 한미약품에선 국내 최초 항암분야 바이오 신약 '롤베돈'의 미국 FDA 허가를 취득하는 데 주도적인 역할을 했다.이밖에 히알루마와 에소메졸의 미국 식품의약국(FDA) 허가, 트리약손과 피도글 등 20여건의 유럽 허가, 탐수로신의 일본 허가 등 100여건이 넘는 전 세계 글로벌 의약품 시판허가와 해외영업을 담당했다.디엑스앤브이엑스는 30년 넘는 영업 베테랑을 중심으로 글로벌 유통조직 개편 및 신제품 출시와 더불어 보유 파이프라인의 글로벌 신약허가 역량 강화 등을 적극적으로 추진해 나간다는 계획이다. 디엑스앤브이엑스 관계자는 "이용구 신임 대표이사는 국내외 영업조직 강화와 지속적인 글로벌 신제품 출시를 통해 회사의 고속 성장을 견인할 예정"이라며 "권규찬 신임 사장은 국내 최고의 글로벌 제약 전문가로 신약개발과 글로벌 신약 허가, 빅파마와의 전략적 제휴 등 파이프라인 가치 제고를 가속화할 계획"이라고 말했다.기존에 회사를 이끌던 박상태 전 대표이사는 에빅스젠 사내이사로 내정돼 신약 파이프라인 고도화와 북미시장 진출을 담당할 예정이다.2023-05-16 10:36:59김진구
디엑스앤브이엑스, 이용구 대표·권규찬 사장 신규 선임이용구 신임 대표이사(좌), 권규찬 신임 사장 [데일리팜=김진구 기자] 디엑스앤브이엑스(DXVX)는 한미약품 출신 이용구 대표이사와 권규찬 사장을 선임한다고 16일 밝혔다.디엑스앤브이엑스는 16일 이사회를 통해 이용구 대표이사를 선임한다고 밝혔다.이용구 신임 대표이사는 한양대를 졸업하고 한미약품에 입사해 영업·마케팅전략실 팀장으로 활동하며 한미약품의 당뇨·심혈관질환을 담당했다.이어 북경한미약품 경영기획실 총감, 북경룬메이캉 헬스케어사업부 대표, 코리(COREE) 그룹 부사장을 역임했다. 2006년부터 북경한미약품과 코리그룹의 중국 의약품·헬스케어사업을 개척한 글로벌 영업전략통으로 알려졌다.2022년에는 디엑스앤브이엑스의 바이오헬스케어 사업의 성장을 주도하여 거래재개의 기틀을 마련했으며, 최근 항생제 유통 사업과 마이크로바이옴 기반 12종 제품 출시를 기획하는 등 회사 성장동력 확보에 대한 기여도가 높게 평가됐다.이와 함께 권규찬 한미약품 글로벌사업본부장을 영입해 사장으로 선임했다고도 밝혔다. 권규찬 신임 사장은 향후 주주총회를 거쳐 사내이사로 선임될 예정이다.권규찬 신임 사장은 서울대 응용생물화학 학사·석사, 고려대 기술경영 공학박사를 취득했다. LG화학 바이오텍 연구소와 LG생명과학 RA팀을 거쳐, 한미약품에서 글로벌사업본부장으로 해외 RA, 해외사업개발, 해외영업, 신약임상, 라이센싱 등을 총괄했다.LG 생명과학 근무 시 4가 백신과 5가 백신, 뇌수막염백신 등의 해외허가 경험을 쌓았다. 한미약품에선 국내 최초 항암분야 바이오 신약 '롤베돈'의 미국 FDA 허가를 취득하는 데 주도적인 역할을 했다.이밖에 히알루마와 에소메졸의 미국 식품의약국(FDA) 허가, 트리약손과 피도글 등 20여건의 유럽 허가, 탐수로신의 일본 허가 등 100여건이 넘는 전 세계 글로벌 의약품 시판허가와 해외영업을 담당했다.디엑스앤브이엑스는 30년 넘는 영업 베테랑을 중심으로 글로벌 유통조직 개편 및 신제품 출시와 더불어 보유 파이프라인의 글로벌 신약허가 역량 강화 등을 적극적으로 추진해 나간다는 계획이다. 디엑스앤브이엑스 관계자는 "이용구 신임 대표이사는 국내외 영업조직 강화와 지속적인 글로벌 신제품 출시를 통해 회사의 고속 성장을 견인할 예정"이라며 "권규찬 신임 사장은 국내 최고의 글로벌 제약 전문가로 신약개발과 글로벌 신약 허가, 빅파마와의 전략적 제휴 등 파이프라인 가치 제고를 가속화할 계획"이라고 말했다.기존에 회사를 이끌던 박상태 전 대표이사는 에빅스젠 사내이사로 내정돼 신약 파이프라인 고도화와 북미시장 진출을 담당할 예정이다.2023-05-16 10:36:59김진구 -
 인벤티지랩·유바이오 "LNP CDMO 공동 사업화 계약 체결"(왼쪽부터) 인벤티지랩 김완주 상무, 전찬희 전무, 김주희 대표이사, 유바이오로직스 백영옥 대표이사, 민경호 부사장, 김석규 이사 [데일리팜=김진구 기자] 인벤티지랩은 유바이오로직스와 LNP 생산을 위한 위탁개발생산(CDMO) 공동사업화 계약을 체결했다고 16일 밝혔다.LNP는 mRNA와 유전자치료제 등의 불안정한 유전 물질을 안정적으로 보호하면서 세포 내부로 효과적으로 전달하는 약물전달시스템이다. 코로나19 백신을 통해 유효성이 대규모로 검증된 바 있고, 백신은 물론 세포·유전자치료제 개발 분야로 확장되는 추세다.전 세계 2000개 이상의 LNP 관련 신약 파이프라인이 개발 단계에 있는 것으로 알려졌다. 향후 임상 시험약 생산·상업용 양산을 위한 위탁생산의 수요가 폭발적으로 증가할 것으로 전망된다. 이번 계약을 통해 양사는 효율적으로 역할을 나누어 CDMO 사업을 공동으로 추진한다.인벤티지랩은 마이크로플루이딕스(Microfluidics·미세유체공학) 기반의 'IVL-GeneFluidic' 기술을 통해 제형개발 및 비임상 시험약 생산을 담당한다. 임상 시험약·상업용 생산을 위해 LNP·리포솜 제형과 제조공정 프로세스를 구현하는 장비와 시스템을 유바이오로직스에 제공한다. 유바이오로직스는 자체 GMP 시설에서 임상 단계의 LNP 시험약을 생산하는 역할을 수행한다. 이번 공동사업화를 통해 회사는 국내외에서 빠르게 성장하고 있는 LNP 치료제의 비임상·임상 시험약 위탁생산 시장에 진입할 수 있을 것으로 기대하고 있다. 김주희 인벤티지랩 대표는 "선진국 기준 GMP 시설·운영 실적을 확보한 유바이오로직스와 LNP·리포솜 등에 대한 CDMO 공동사업화 프로젝트를 시작하게 돼 기대가 크다"며 "그간 국가 R&D 과제를 수행하면서 기술적 성과를 쌓아왔고 이제 본격적인 사업적 목표 달성을 추진하는 가운데, 양사가 긴밀한 협업을 통해 기술·경험을 축적하고 성공적인 사업화를 통해 동반 성장하겠다"라고 말했다. 백영옥 유바이오로직스 대표는 "LNP는 최근 시장에서 각광받고 있는 유용한 기술로 시장성과 성장잠재력이 매우 큰 것으로 알고 있다"며 "독자적인 LNP 제조기술을 가지고 있는 인벤티지랩의 기술력에 당사의 GMP 시설과 CMO 경험을 바탕으로 향후 국내외의 많은 고객을 유치할 것으로 기대한다"고 말했다.2023-05-16 09:48:03김진구
인벤티지랩·유바이오 "LNP CDMO 공동 사업화 계약 체결"(왼쪽부터) 인벤티지랩 김완주 상무, 전찬희 전무, 김주희 대표이사, 유바이오로직스 백영옥 대표이사, 민경호 부사장, 김석규 이사 [데일리팜=김진구 기자] 인벤티지랩은 유바이오로직스와 LNP 생산을 위한 위탁개발생산(CDMO) 공동사업화 계약을 체결했다고 16일 밝혔다.LNP는 mRNA와 유전자치료제 등의 불안정한 유전 물질을 안정적으로 보호하면서 세포 내부로 효과적으로 전달하는 약물전달시스템이다. 코로나19 백신을 통해 유효성이 대규모로 검증된 바 있고, 백신은 물론 세포·유전자치료제 개발 분야로 확장되는 추세다.전 세계 2000개 이상의 LNP 관련 신약 파이프라인이 개발 단계에 있는 것으로 알려졌다. 향후 임상 시험약 생산·상업용 양산을 위한 위탁생산의 수요가 폭발적으로 증가할 것으로 전망된다. 이번 계약을 통해 양사는 효율적으로 역할을 나누어 CDMO 사업을 공동으로 추진한다.인벤티지랩은 마이크로플루이딕스(Microfluidics·미세유체공학) 기반의 'IVL-GeneFluidic' 기술을 통해 제형개발 및 비임상 시험약 생산을 담당한다. 임상 시험약·상업용 생산을 위해 LNP·리포솜 제형과 제조공정 프로세스를 구현하는 장비와 시스템을 유바이오로직스에 제공한다. 유바이오로직스는 자체 GMP 시설에서 임상 단계의 LNP 시험약을 생산하는 역할을 수행한다. 이번 공동사업화를 통해 회사는 국내외에서 빠르게 성장하고 있는 LNP 치료제의 비임상·임상 시험약 위탁생산 시장에 진입할 수 있을 것으로 기대하고 있다. 김주희 인벤티지랩 대표는 "선진국 기준 GMP 시설·운영 실적을 확보한 유바이오로직스와 LNP·리포솜 등에 대한 CDMO 공동사업화 프로젝트를 시작하게 돼 기대가 크다"며 "그간 국가 R&D 과제를 수행하면서 기술적 성과를 쌓아왔고 이제 본격적인 사업적 목표 달성을 추진하는 가운데, 양사가 긴밀한 협업을 통해 기술·경험을 축적하고 성공적인 사업화를 통해 동반 성장하겠다"라고 말했다. 백영옥 유바이오로직스 대표는 "LNP는 최근 시장에서 각광받고 있는 유용한 기술로 시장성과 성장잠재력이 매우 큰 것으로 알고 있다"며 "독자적인 LNP 제조기술을 가지고 있는 인벤티지랩의 기술력에 당사의 GMP 시설과 CMO 경험을 바탕으로 향후 국내외의 많은 고객을 유치할 것으로 기대한다"고 말했다.2023-05-16 09:48:03김진구 -
 '36조 정조준'...K-제약바이오, NASH 신약개발에 속도한미약품이 비만을 동반한 비알코올성지방간(NAFLD) 환자 대상 임상 1상시험에서 자기공명영상-양자밀도 지방비율 검사로 확인한 랩스 트리플 아고니스트의 지방 감소 효과(사진 한미약품). [데일리팜=황진중 기자] 국내 제약바이오기업들이 진행 중인 비알코올성지방간염(NASH) 임상시험이 순항하고 있다. NASH는 아직 상용화된 치료제가 없어 의료 미충족 수요가 높은 질환 중 하나다. NASH 치료제 시장은 오는 2029년 36조원 시장을 형성할 것으로 예상되는 블루오션 시장이다.16일 업계에 따르면 독립적데이터모니터링위원회(IDMC)는 한미약품이 독자 개발 중인 NASH 신약 후보물질 '랩스 트리플 아고니스트'의 글로벌 임상 2상시험을 계획 변경 없이 계속 진행하라고 15일 권고했다.NASH는 간에 지방이 축적되는 지방간과 달리 간에서 염증과 섬유화가 나타나는 것이 특징인 질환이다. NASH 환자 중에서 20%가량이 간경화를 앓은 후 간암까지 겪는 것으로 알려졌다.IDMC의 평가 목적은 랩스 트리플 아고니스트 NASH 대상 임상 2상에서 평가 중인 3개 용량 중 유효성이 부족하다고 판단되는 용량군을 제외하는 것이었다. IDMC는 중간결과를 보고 무용성 기준에 포함되는 용량군이 없어 특정 용량군을 제외하지 말고 임상을 계속 진행할 것을 제안했다.IDMC는 진행 중인 임상에서 환자의 안전과 약물 효능 등을 독립적으로 모니터링하는 전문가 그룹이다. 무작위, 이중맹검 등으로 이뤄지는 임상에서 안전성과 과학적 타당성 등을 확보하기 위한 목적으로 운영된다. 객관성을 보유한 독립위원회로 임상 지속, 환자 모집 연기, 임상 디자인 수정, 임상 중단 등을 임상 주체에 권고한다.랩스 트리플 아고니스트는 체내 에너지 대사량을 증가시키는 글루카곤, 인슐린 분비, 식욕 억제를 돕는 GLP-1, 인슐린 분비 촉진과 항염증 작용을 하는 GIP 수용체를 동시에 활성화하는 삼중작용 바이오 신약 후보물질이다. 한미약품의 바이오의약품 플랫폼 기술인 '랩스커버리'가 적용된 신약 후보물질이다.랩스 트리플 아고니스트는 지난 2020년 비알코올성지방간(NAFLD) 환자 대상 임상 1상을 통해 3개월 이내 30% 이상 지방간이 감소한다는 효과가 확인됐다. NAFLD는 간에 지방이 축적되는 상태로 심해지면 NASH로 발전할 수 있다.랩스 트리플 아고니스트는 지난해 7월 미국 식품의약국(FDA)으로부터 NASH 치료를 위한 패스트트랙 개발 의약품으로 지정됐다. 원발 담즙성 담관염(PCB)와 원발 경화성 담관염(PSC), 특발성 폐섬유증(IPF) 치료를 위한 희귀의약품 목록에도 이름을 올린 후보물질이다.한미약품은 또 2020년 8월 글로벌 제약사 MSD에 1조원 규모로 기술이전한 '랩스 듀얼 아고니스트'도 NASH 치료제로 개발하고 있다. MSD는 최근 랩스 듀얼 아고니스트의 글로벌 2a상을 종료했다. 내달 6월 열리는 유럽간학회(EASL)에서 해당 임상 연구 결과를 발표할 예정이다. 동아에스티, 유한양행, LG화학, HK이노엔, 일동제약 등 주요 제약사와 올릭스, 디엔디파마텍, JD바이오사이언스 등 바이오기업들이 NASH 신약 후보물질을 개발하고 있다.동아에스티는 미국 자회사 뉴로보 파마슈티컬스를 통해 NASH 신약 후보물질 'DA-1241'을 개발 중이다. 최근 FDA로부터 임상 2상시험계획을 승인받았다. DA-1241은 GPR119 작용제다. 동아에스티는 전임상에서 DA-1241 투여 후 간경화, 염증, 섬유화, 지질대사·포도당 조절 등의 개선 효과를 확인했다. 뉴로보는 DA-1241 미국 임상을 올해 3분기 내 개시할 예정이다. 예상 연구 종료일은 2024년 하반기다.동아에스티는 또 비만·NASH 치료제로 개발 중인 'DA-1726'의 임상 1상시험계획을 올해 하반기에 신청할 예정이다. DA-1726은 GLP-1 수용체와 글루카곤 수용체에 동시에 작용해 식욕을 억제하면서 기초대사량을 늘리는 후보물질이다.유한양행은 2019년 글로벌 제약사 베링거인겔하임과 길리어드에 각각 NASH 신약 후보물질을 기술이전했다. 베링거인겔하임으로 이전된 후보물질 'YH25724'는 유럽에서 임상 1상이 진행되고 있다. YH25724는 유한양행이 자체 개발한 후보물질이다. 바이오기업 제넥신의 항체 융합 단백질 플랫폼 기술 '하이브리드 FC'(Hybrid FC·Hy Fc)를 접목한 융합단백질이다. 길리어드에 이전된 후보물질은 2종이다. 유한양행과 길리어드가 전임상연구를 공동으로 진행하고, 길리어드가 글로벌 임상을 진행할 예정이다.LG화학은 'LG303174'과 'LG203003'을 개발하고 있다. LG303174는 임상 1상 마무리 단계를 밟고 있다. 미국 보스턴에 있는 LG화학생명과학혁신센터를 통해서는 LG203003을 개발하고 있다. LG203003은 지난해 3월 FDA로부터 임상 1상시험 계획을 승인받았다. 같은 해 7월 건강한 성인과 NASH 환자 88명을 대상으로 안전성과 내약성, 약동학, 약력학, 간 내 지방량 변화 등을 관찰하는 1상을 개시했다.HK이노엔은 바이오기업 퓨처메디신으로부터 NASH 신약 후보물질 'FM101(IN-A010)'을 도입해 공동개발하고 있다. 퓨처메디신은 2021년 유럽의약품청(EMA)으로부터 NASH를 대상으로 임상 2상시험계획을 승인받았다. 올해 2월에는 식품의약품안전처로부터 임상 2상시험 계획을 허가받았다.일동제약은 지난해 7월 FDA로부터 NASH 신약 후보물질 'ID119031166M' 임상 1상시험계획을 승인받았다. LA지역에서 임상 1상에 착수했다. ID119031166M은 파네소이드 X 수용체(FXR)에 작용해 간 지방 축적을 예방할 것으로 기대되는 후보물질이다. 염증과 섬유화 등을 유발하는 것으로 알려진 담즙산의 대사도 조절한다.일동제약의 R&D 자회사 아이리드비엠에스가 지난해 11월 미국간학회(AASLD)에서 발표한 전임상 결과에 따르면 ID119031166M은 시험관연구(in vitro) 등에서 효력과 표적 선택성이 우수하게 나타났다.JD바이오사이언스는 지난해부터 호주에서 NASH 적응증 대상 'GM-60106' 임상 1상을 진행 중이다. 건강한 성인과 NASH 지표가 높은 성인 총 96명을 대상으로 안전성과 내약성, 약동학 등을 관찰하고 있다. 예상 연구 완료일은 올해 6월이다.올릭스는 NASH 신약 후보물질 'OLX702A'를 전임상 단계에서 개발하고 있다. NASH 마우스 모델에서 간 지방 함량과 섬유화를 감소시키는 효능을 확인했다. NASH 영장류 모델에서도 간 지방함량이 정상수준으로 회복되는 것을 확인했다. 올릭스는 OLX702A를 올해 임상에 진입시킬 계획이다.주요 제약바이오기업들이 NASH 치료제를 개발하는 이유로는 의료 미충족수요가 높다는 점과 성장성이 높은 시장이라는 점이 제기된다. 전세계에서 아직 상용화된 NASH 치료제는 없다. 미국 마드리갈 파마슈티컬스가 지난해 12월 NASH 신약 후보물질 '레스메티롬'의 임상 3상(MAESTRO-NASH·NCT03900429)에서 긍정적인 탑 라인 결과를 확인해 개발에 속도를 내고 있다.아직 치료제가 출시되지 않은 만큼 앞으로 치료제 시장 성장성도 클 것으로 전망된다. 시장조사기관 글로벌데이터에 따르면 NASH 치료제 시장은 2019년 1억4440만 달러에서 오는 2029년 272억 달러로 연평균 68.8% 성장할 것으로 내다봤다.2023-05-16 06:18:24황진중
'36조 정조준'...K-제약바이오, NASH 신약개발에 속도한미약품이 비만을 동반한 비알코올성지방간(NAFLD) 환자 대상 임상 1상시험에서 자기공명영상-양자밀도 지방비율 검사로 확인한 랩스 트리플 아고니스트의 지방 감소 효과(사진 한미약품). [데일리팜=황진중 기자] 국내 제약바이오기업들이 진행 중인 비알코올성지방간염(NASH) 임상시험이 순항하고 있다. NASH는 아직 상용화된 치료제가 없어 의료 미충족 수요가 높은 질환 중 하나다. NASH 치료제 시장은 오는 2029년 36조원 시장을 형성할 것으로 예상되는 블루오션 시장이다.16일 업계에 따르면 독립적데이터모니터링위원회(IDMC)는 한미약품이 독자 개발 중인 NASH 신약 후보물질 '랩스 트리플 아고니스트'의 글로벌 임상 2상시험을 계획 변경 없이 계속 진행하라고 15일 권고했다.NASH는 간에 지방이 축적되는 지방간과 달리 간에서 염증과 섬유화가 나타나는 것이 특징인 질환이다. NASH 환자 중에서 20%가량이 간경화를 앓은 후 간암까지 겪는 것으로 알려졌다.IDMC의 평가 목적은 랩스 트리플 아고니스트 NASH 대상 임상 2상에서 평가 중인 3개 용량 중 유효성이 부족하다고 판단되는 용량군을 제외하는 것이었다. IDMC는 중간결과를 보고 무용성 기준에 포함되는 용량군이 없어 특정 용량군을 제외하지 말고 임상을 계속 진행할 것을 제안했다.IDMC는 진행 중인 임상에서 환자의 안전과 약물 효능 등을 독립적으로 모니터링하는 전문가 그룹이다. 무작위, 이중맹검 등으로 이뤄지는 임상에서 안전성과 과학적 타당성 등을 확보하기 위한 목적으로 운영된다. 객관성을 보유한 독립위원회로 임상 지속, 환자 모집 연기, 임상 디자인 수정, 임상 중단 등을 임상 주체에 권고한다.랩스 트리플 아고니스트는 체내 에너지 대사량을 증가시키는 글루카곤, 인슐린 분비, 식욕 억제를 돕는 GLP-1, 인슐린 분비 촉진과 항염증 작용을 하는 GIP 수용체를 동시에 활성화하는 삼중작용 바이오 신약 후보물질이다. 한미약품의 바이오의약품 플랫폼 기술인 '랩스커버리'가 적용된 신약 후보물질이다.랩스 트리플 아고니스트는 지난 2020년 비알코올성지방간(NAFLD) 환자 대상 임상 1상을 통해 3개월 이내 30% 이상 지방간이 감소한다는 효과가 확인됐다. NAFLD는 간에 지방이 축적되는 상태로 심해지면 NASH로 발전할 수 있다.랩스 트리플 아고니스트는 지난해 7월 미국 식품의약국(FDA)으로부터 NASH 치료를 위한 패스트트랙 개발 의약품으로 지정됐다. 원발 담즙성 담관염(PCB)와 원발 경화성 담관염(PSC), 특발성 폐섬유증(IPF) 치료를 위한 희귀의약품 목록에도 이름을 올린 후보물질이다.한미약품은 또 2020년 8월 글로벌 제약사 MSD에 1조원 규모로 기술이전한 '랩스 듀얼 아고니스트'도 NASH 치료제로 개발하고 있다. MSD는 최근 랩스 듀얼 아고니스트의 글로벌 2a상을 종료했다. 내달 6월 열리는 유럽간학회(EASL)에서 해당 임상 연구 결과를 발표할 예정이다. 동아에스티, 유한양행, LG화학, HK이노엔, 일동제약 등 주요 제약사와 올릭스, 디엔디파마텍, JD바이오사이언스 등 바이오기업들이 NASH 신약 후보물질을 개발하고 있다.동아에스티는 미국 자회사 뉴로보 파마슈티컬스를 통해 NASH 신약 후보물질 'DA-1241'을 개발 중이다. 최근 FDA로부터 임상 2상시험계획을 승인받았다. DA-1241은 GPR119 작용제다. 동아에스티는 전임상에서 DA-1241 투여 후 간경화, 염증, 섬유화, 지질대사·포도당 조절 등의 개선 효과를 확인했다. 뉴로보는 DA-1241 미국 임상을 올해 3분기 내 개시할 예정이다. 예상 연구 종료일은 2024년 하반기다.동아에스티는 또 비만·NASH 치료제로 개발 중인 'DA-1726'의 임상 1상시험계획을 올해 하반기에 신청할 예정이다. DA-1726은 GLP-1 수용체와 글루카곤 수용체에 동시에 작용해 식욕을 억제하면서 기초대사량을 늘리는 후보물질이다.유한양행은 2019년 글로벌 제약사 베링거인겔하임과 길리어드에 각각 NASH 신약 후보물질을 기술이전했다. 베링거인겔하임으로 이전된 후보물질 'YH25724'는 유럽에서 임상 1상이 진행되고 있다. YH25724는 유한양행이 자체 개발한 후보물질이다. 바이오기업 제넥신의 항체 융합 단백질 플랫폼 기술 '하이브리드 FC'(Hybrid FC·Hy Fc)를 접목한 융합단백질이다. 길리어드에 이전된 후보물질은 2종이다. 유한양행과 길리어드가 전임상연구를 공동으로 진행하고, 길리어드가 글로벌 임상을 진행할 예정이다.LG화학은 'LG303174'과 'LG203003'을 개발하고 있다. LG303174는 임상 1상 마무리 단계를 밟고 있다. 미국 보스턴에 있는 LG화학생명과학혁신센터를 통해서는 LG203003을 개발하고 있다. LG203003은 지난해 3월 FDA로부터 임상 1상시험 계획을 승인받았다. 같은 해 7월 건강한 성인과 NASH 환자 88명을 대상으로 안전성과 내약성, 약동학, 약력학, 간 내 지방량 변화 등을 관찰하는 1상을 개시했다.HK이노엔은 바이오기업 퓨처메디신으로부터 NASH 신약 후보물질 'FM101(IN-A010)'을 도입해 공동개발하고 있다. 퓨처메디신은 2021년 유럽의약품청(EMA)으로부터 NASH를 대상으로 임상 2상시험계획을 승인받았다. 올해 2월에는 식품의약품안전처로부터 임상 2상시험 계획을 허가받았다.일동제약은 지난해 7월 FDA로부터 NASH 신약 후보물질 'ID119031166M' 임상 1상시험계획을 승인받았다. LA지역에서 임상 1상에 착수했다. ID119031166M은 파네소이드 X 수용체(FXR)에 작용해 간 지방 축적을 예방할 것으로 기대되는 후보물질이다. 염증과 섬유화 등을 유발하는 것으로 알려진 담즙산의 대사도 조절한다.일동제약의 R&D 자회사 아이리드비엠에스가 지난해 11월 미국간학회(AASLD)에서 발표한 전임상 결과에 따르면 ID119031166M은 시험관연구(in vitro) 등에서 효력과 표적 선택성이 우수하게 나타났다.JD바이오사이언스는 지난해부터 호주에서 NASH 적응증 대상 'GM-60106' 임상 1상을 진행 중이다. 건강한 성인과 NASH 지표가 높은 성인 총 96명을 대상으로 안전성과 내약성, 약동학 등을 관찰하고 있다. 예상 연구 완료일은 올해 6월이다.올릭스는 NASH 신약 후보물질 'OLX702A'를 전임상 단계에서 개발하고 있다. NASH 마우스 모델에서 간 지방 함량과 섬유화를 감소시키는 효능을 확인했다. NASH 영장류 모델에서도 간 지방함량이 정상수준으로 회복되는 것을 확인했다. 올릭스는 OLX702A를 올해 임상에 진입시킬 계획이다.주요 제약바이오기업들이 NASH 치료제를 개발하는 이유로는 의료 미충족수요가 높다는 점과 성장성이 높은 시장이라는 점이 제기된다. 전세계에서 아직 상용화된 NASH 치료제는 없다. 미국 마드리갈 파마슈티컬스가 지난해 12월 NASH 신약 후보물질 '레스메티롬'의 임상 3상(MAESTRO-NASH·NCT03900429)에서 긍정적인 탑 라인 결과를 확인해 개발에 속도를 내고 있다.아직 치료제가 출시되지 않은 만큼 앞으로 치료제 시장 성장성도 클 것으로 전망된다. 시장조사기관 글로벌데이터에 따르면 NASH 치료제 시장은 2019년 1억4440만 달러에서 오는 2029년 272억 달러로 연평균 68.8% 성장할 것으로 내다봤다.2023-05-16 06:18:24황진중 -
메디톡스, 1Q 영업익 전년비 68%↓...지급수수료 증가[데일리팜=천승현 기자] 메디톡스는 지난 1분기 영업이익이 18억원으로 전년동기대비 67.7% 감소했다고 15일 공시했다. 매출액은 427억원으로 전년보다 7.3% 증가했다.1분기 판매관리비가 225억원으로 전년동기 192억원보다 17.2% 늘었다.회사 측은 “보툴리눔독소제제 ‘MT10109L’의 미국 허가 신청을 위한 생산설비 준비, 더마코스메틱 등 신규 진출 사업의 마케팅이 증가했다”라고 설명했다.균주와 제조공정 도용 관련 1심 승소로 발생한 일회성 지급수수료의 영향으로 수익성이 악화했다. 메디톡스의 1분기 지급수수료는 70억원으로 작년 같은 기간 27억원보다 162.1% 확대됐다.매출은 주력 사업 중 하나인 필러 부문이 전년 동기 대비 국내와 해외 모두 20% 이상 성장했다. 보툴리눔독소제제 ‘코어톡스’가 꾸준한 성장세를 나타냈다.2023-05-15 14:50:55천승현
-
 "한미약품 NASH 후보물질 임상 2상 지속 권고"[데일리팜=황진중 기자] 한미약품은 15일 독자 개발 중인 비알코올성지방간염(NASH) 신약 후보물질 '랩스 트리플 아고니스트'에 대해 독립적데이터모니터링위원회(IDMC)가 글로벌 임상 2상시험을 계획 변경없이 지속 진행하라고 권고했다고 밝혔다.IDMC의 이번 권고는 안전성 프로파일을 토대로 결정한 지난 3차례 권고에서 한 걸음 더 나아간 권고다. 한미약품이 진행 중인 글로벌 임상 2상의 유효성을 추가로 평가한 중간 분석 결과를 바탕으로 이뤄졌다.IDMC의 권고는 당초 안전성 평가에 더해 임상을 진행 중인 3개 용량 중 유효성 측면에서 무용하다고 판단될 수 있는 용량군을 제외하는 것이 목적이었다. 중간 결과 무용성 기준에 들어가는 용량군이 없는 것으로 확인됐다. IDMC는 특정 용량군을 제외하지 않고 임상을 계속 진행하는 것을 권고했다.한미약품 관계자는 "세부적인 데이터는 해당 임상이 이중맹검 디자인으로 진행되고 있어 확인이 어렵다"면서도 "IDMC 권고는 약물의 유효성과 안전성 측면에서 기대 수준을 충족하고 있다는 점을 뜻한다"고 설명했다.다만 한미약품 관계자는 "이번 중간분석 결과가 최종적인 결과를 보장하는 것은 아니다"면서 "최종 임상 시험 결과가 발표되기 전까지는 확정적 결론을 내릴 수 없다"고 덧붙였다.IDMC는 진행 중인 임상에서 환자의 안전과 약물 효능 등을 독립적으로 모니터링하는 전문가 그룹이다. 무작위, 이중맹검 등으로 이뤄지는 임상에서 안전성과 과학적 타당성 등을 확보하기 위한 목적으로 운영된다. 객관성을 보유한 독립위원회로 임상 지속, 환자모집 연기, 임상 디자인 수정, 임상 중단 등을 임상 주체에 권고한다.랩스 트리플 아고니스트는 체내 에너지 대사량을 증가시키는 글루카곤, 인슐린 분비, 식욕 억제를 돕는 GLP-1, 인슐린 분비 촉진과 항염증 작용을 하는 GIP 수용체를 동시에 활성화하는 삼중작용 바이오 신약 후보물질이다.미국 식품의약국(FDA)은 지난해 7월 랩스트리플 아고니스트를 NASH 치료를 위한 패스트트랙 개발 의약품으로 지정했다. 랩스트리플 아고니스트는 원발 담즙성 담관염(PCB)와 원발 경화성 담관염(PSC), 특발성 폐섬유증(IPF) 치료를 위한 희귀의약품 목록에도 이름을 올렸다.한미약품은 섬유증을 동반하고 간 생검으로 확증된 NASH 환자들을 대상 임상 2상을 미국과 한국에서 진행하고 있다.한편 한미약품은 이외에도 지난 2020년 8월 글로벌 제약사 MSD에 1조원 규모로 기술이전한 '랩스 듀얼 아고니스트'도 NASH 치료제로 개발하고 있다. MSD는 최근 랩스 듀얼 아고니스트의 글로벌 2a상을 종료했다. 내달 6월 열리는 유럽간학회(EASL)에서 해당 임상 연구 결과가 발표될 예정이다.2023-05-15 11:11:41황진중
"한미약품 NASH 후보물질 임상 2상 지속 권고"[데일리팜=황진중 기자] 한미약품은 15일 독자 개발 중인 비알코올성지방간염(NASH) 신약 후보물질 '랩스 트리플 아고니스트'에 대해 독립적데이터모니터링위원회(IDMC)가 글로벌 임상 2상시험을 계획 변경없이 지속 진행하라고 권고했다고 밝혔다.IDMC의 이번 권고는 안전성 프로파일을 토대로 결정한 지난 3차례 권고에서 한 걸음 더 나아간 권고다. 한미약품이 진행 중인 글로벌 임상 2상의 유효성을 추가로 평가한 중간 분석 결과를 바탕으로 이뤄졌다.IDMC의 권고는 당초 안전성 평가에 더해 임상을 진행 중인 3개 용량 중 유효성 측면에서 무용하다고 판단될 수 있는 용량군을 제외하는 것이 목적이었다. 중간 결과 무용성 기준에 들어가는 용량군이 없는 것으로 확인됐다. IDMC는 특정 용량군을 제외하지 않고 임상을 계속 진행하는 것을 권고했다.한미약품 관계자는 "세부적인 데이터는 해당 임상이 이중맹검 디자인으로 진행되고 있어 확인이 어렵다"면서도 "IDMC 권고는 약물의 유효성과 안전성 측면에서 기대 수준을 충족하고 있다는 점을 뜻한다"고 설명했다.다만 한미약품 관계자는 "이번 중간분석 결과가 최종적인 결과를 보장하는 것은 아니다"면서 "최종 임상 시험 결과가 발표되기 전까지는 확정적 결론을 내릴 수 없다"고 덧붙였다.IDMC는 진행 중인 임상에서 환자의 안전과 약물 효능 등을 독립적으로 모니터링하는 전문가 그룹이다. 무작위, 이중맹검 등으로 이뤄지는 임상에서 안전성과 과학적 타당성 등을 확보하기 위한 목적으로 운영된다. 객관성을 보유한 독립위원회로 임상 지속, 환자모집 연기, 임상 디자인 수정, 임상 중단 등을 임상 주체에 권고한다.랩스 트리플 아고니스트는 체내 에너지 대사량을 증가시키는 글루카곤, 인슐린 분비, 식욕 억제를 돕는 GLP-1, 인슐린 분비 촉진과 항염증 작용을 하는 GIP 수용체를 동시에 활성화하는 삼중작용 바이오 신약 후보물질이다.미국 식품의약국(FDA)은 지난해 7월 랩스트리플 아고니스트를 NASH 치료를 위한 패스트트랙 개발 의약품으로 지정했다. 랩스트리플 아고니스트는 원발 담즙성 담관염(PCB)와 원발 경화성 담관염(PSC), 특발성 폐섬유증(IPF) 치료를 위한 희귀의약품 목록에도 이름을 올렸다.한미약품은 섬유증을 동반하고 간 생검으로 확증된 NASH 환자들을 대상 임상 2상을 미국과 한국에서 진행하고 있다.한편 한미약품은 이외에도 지난 2020년 8월 글로벌 제약사 MSD에 1조원 규모로 기술이전한 '랩스 듀얼 아고니스트'도 NASH 치료제로 개발하고 있다. MSD는 최근 랩스 듀얼 아고니스트의 글로벌 2a상을 종료했다. 내달 6월 열리는 유럽간학회(EASL)에서 해당 임상 연구 결과가 발표될 예정이다.2023-05-15 11:11:41황진중 -
 대웅제약·입셀, 인체유래 '인공 적혈구' 공동개발 개시주지현 입셀 대표(왼쪽)와 이창재 대웅제약 대표가 인공적혈구 개발을 위한 업무협약 체결식에서 기념 촬영을 하고 있다.(사진 대웅제약) [데일리팜=황진중 기자] 대웅제약은 지난 12일 국내 유도만능줄기세포 연구기업 입셀과 '인공 적혈구' 개발을 위한 공동연구 협약을 맺었다고 15일 밝혔다.인공 적혈구는 혈액 내에서 세포에 산소를 배달하는 역할을 하는 적혈구의 기능을 대체할 수 있는 물질이다.대웅제약과 입셀은 이번 협약을 통해 인공 적혈구 세포주와 공정 개발을 위한 협력체계를 구축해 나간다는 계획이다. 두 기업은 '인간 유도만능줄기세포(hiPSC)'를 이용해 인공 적혈구 개발에 대한 원천기술 확보와 생산기술 고도화를 위한 공동연구를 진행할 예정이다. hiPSC는 인체 기관 중 원하는 모든 신체 조직과 장기 등으로 분화가 가능한 세포다.입셀은 주지현 서울성모병원 류마티스내과 교수가 지난 2017년 설립했다. 임상면역학과 줄기세포를 기반으로 hiPSC 연구와 치료제 개발을 진행하고 있다.2023-05-15 10:24:11황진중
대웅제약·입셀, 인체유래 '인공 적혈구' 공동개발 개시주지현 입셀 대표(왼쪽)와 이창재 대웅제약 대표가 인공적혈구 개발을 위한 업무협약 체결식에서 기념 촬영을 하고 있다.(사진 대웅제약) [데일리팜=황진중 기자] 대웅제약은 지난 12일 국내 유도만능줄기세포 연구기업 입셀과 '인공 적혈구' 개발을 위한 공동연구 협약을 맺었다고 15일 밝혔다.인공 적혈구는 혈액 내에서 세포에 산소를 배달하는 역할을 하는 적혈구의 기능을 대체할 수 있는 물질이다.대웅제약과 입셀은 이번 협약을 통해 인공 적혈구 세포주와 공정 개발을 위한 협력체계를 구축해 나간다는 계획이다. 두 기업은 '인간 유도만능줄기세포(hiPSC)'를 이용해 인공 적혈구 개발에 대한 원천기술 확보와 생산기술 고도화를 위한 공동연구를 진행할 예정이다. hiPSC는 인체 기관 중 원하는 모든 신체 조직과 장기 등으로 분화가 가능한 세포다.입셀은 주지현 서울성모병원 류마티스내과 교수가 지난 2017년 설립했다. 임상면역학과 줄기세포를 기반으로 hiPSC 연구와 치료제 개발을 진행하고 있다.2023-05-15 10:24:11황진중 -
 삼일제약, 다국적사 잇단 러브콜…산도스 제품도 품었다[데일리팜=이석준 기자] 삼일제약이 다국적사로부터 잇단 러브콜을 받고 있다. 이번에는 CNS(중추신경계) 등 산도스 전 품목을 독점 유통·판매하기로 했다. 2021년부터 신설된 CNS 사업부는 사업 확장에 탄력을 받게 됐다.삼일제약의 파트너 확대는 영업, 마케팅 등에서 글로벌 스탠다드를 충족했기 때문이라는 평가를 받는다. 회사는 산도스 이전에도 GSK, 애보트, 애브비, 먼디파마, 비아트리스 등 글로벌 제약사와 파트너를 맺고 있다. 삼성바이오에피스 등 국내사와도 제휴 관계다. 삼일제약이 산도스 CNS(중추신경계) 등 전 품목을 독점 유통 및 판매한다. 양 사는 최근 이 같은 계약을 체결했다. 산도스는 한국 비즈니스를 100% 제3자 유통 모델로 변경하기로 했다. 산도스는 노바티스의 제네릭·바이오시밀러 사업 자회사다.삼일제약은 산도스 제품을 품으면서 최근 확장하고 있는 CNS 분야를 강화하겠다는 계획이다.회사는 2021년 CNS 분야 라인업 확장을 위해 기존 신경과 팀과 정신과 계열 제품 영업을 위한 CNS사업부를 신설했다.그해 비아트리스의 자낙스(항불안제), 젤독스(항조현병제), 졸로푸트(항우울제)의 한국 시장 내 독점 유통 및 판매 계약 체결도 맺었다.회사 관계자는 "삼일제약은 산도스 의약품 유통 판매를 통해 강력한 중추신경계 질환 라인업을 한층 강화해 국내 환자들을 위한 최상의 치료 옵션을 제공할 것"이라고 자신했다.산도스는 현재 40여 품목을 보유 중이다. CNS 외에도 ‘하이캄틴주’, ‘조프란주’ 등 항암, 항구토 제품도 다루고 있다. 이 역시 삼일제약이 독점 유통·판매한다.삼일제약의 외형 확장이 기대되는 대목이다. 회사의 지난해 매출은 1797억원이다. 올해 2000억원 돌파가 점쳐진다.잇단 러브콜…기업 가치 증명삼일제약은 산도스 외에도 다국적사로부터 잇단 러브콜을 받고 있다.산도스 이전에도 GSK, 애보트, 애브비, 먼디파마, 비아트리스 등 글로벌 제약사와 파트너를 맺고 있다. 삼성바이오에피스 등 국내사도 있다.영업, 마케팅, 유통 등에서 글로벌 스탠다드를 충족했기 때문이라는 평가가 나온다.한국산도스도 삼일제약과의 파트너십 결정을 ▲기업 규모 ▲안과, 간 위장, 근골격계, CNS 분야 의약품 공급에서의 전문성 ▲다수의 글로벌 기업과의 오랜 협업 경험과 역량을 보유한 점을 고려했다고 설명했다.삼일제약 베트남 공장. 삼일제약은 수년 간 글로벌 회사로 성장하기 위해 노력을 기울이고 있다.▲2018년 베트남 법인 설립 ▲2022년 베트남 점안제 CDMO 플랜트 준공 ▲2022년 캐나다 북미법인 설립 ▲아람콜(비알코올성지방간염치료제), 로어시비빈트(골관절염치료제) 등 글로벌 임상 3상 단계의 신약후보물질 기술도입 계약 체결을 통한 미래 성장 동력 확보 ▲우수 해외의약품 국내 도입 등이다.특히 지난해 11월 준공식을 가진 베트남 글로벌 점안제 CDMO 공장은 글로벌 진출 발판이 될 전망이다.해당 공장은 연간 약 3억3000만개 점안제를 생산할 수 있다. 이르면 연말 베트남 DAV와 한국 MFDS GMP 승인을 목표로 하고 있다. 이후 2~3년 내 미국 FDA cGMP, 유럽 EMA EU GMP, Health Canada GMP 승인을 통해 글로벌 시장에 양질의 의약품을 공급할 계획이다.시장 관계자는 "다국적사의 의약품 유통 및 판매를 위한 국내 파트너 선정 기준은 무엇보다 글로벌 스탠다드 충족이다. 어떤 회사와 올바른 영업방식으로 시너지 극대화를 창출할 수 있느냐를 본다. 삼일제약이 최근 다국적사로부터 잇단 러브콜을 받으며 글로벌 스탠다드를 입증했다. 향후 이들과의 유통·판매 제휴가 생산 등으로 확대될 수 있는 발판도 마련했다"고 말했다.2023-05-15 06:00:50이석준
삼일제약, 다국적사 잇단 러브콜…산도스 제품도 품었다[데일리팜=이석준 기자] 삼일제약이 다국적사로부터 잇단 러브콜을 받고 있다. 이번에는 CNS(중추신경계) 등 산도스 전 품목을 독점 유통·판매하기로 했다. 2021년부터 신설된 CNS 사업부는 사업 확장에 탄력을 받게 됐다.삼일제약의 파트너 확대는 영업, 마케팅 등에서 글로벌 스탠다드를 충족했기 때문이라는 평가를 받는다. 회사는 산도스 이전에도 GSK, 애보트, 애브비, 먼디파마, 비아트리스 등 글로벌 제약사와 파트너를 맺고 있다. 삼성바이오에피스 등 국내사와도 제휴 관계다. 삼일제약이 산도스 CNS(중추신경계) 등 전 품목을 독점 유통 및 판매한다. 양 사는 최근 이 같은 계약을 체결했다. 산도스는 한국 비즈니스를 100% 제3자 유통 모델로 변경하기로 했다. 산도스는 노바티스의 제네릭·바이오시밀러 사업 자회사다.삼일제약은 산도스 제품을 품으면서 최근 확장하고 있는 CNS 분야를 강화하겠다는 계획이다.회사는 2021년 CNS 분야 라인업 확장을 위해 기존 신경과 팀과 정신과 계열 제품 영업을 위한 CNS사업부를 신설했다.그해 비아트리스의 자낙스(항불안제), 젤독스(항조현병제), 졸로푸트(항우울제)의 한국 시장 내 독점 유통 및 판매 계약 체결도 맺었다.회사 관계자는 "삼일제약은 산도스 의약품 유통 판매를 통해 강력한 중추신경계 질환 라인업을 한층 강화해 국내 환자들을 위한 최상의 치료 옵션을 제공할 것"이라고 자신했다.산도스는 현재 40여 품목을 보유 중이다. CNS 외에도 ‘하이캄틴주’, ‘조프란주’ 등 항암, 항구토 제품도 다루고 있다. 이 역시 삼일제약이 독점 유통·판매한다.삼일제약의 외형 확장이 기대되는 대목이다. 회사의 지난해 매출은 1797억원이다. 올해 2000억원 돌파가 점쳐진다.잇단 러브콜…기업 가치 증명삼일제약은 산도스 외에도 다국적사로부터 잇단 러브콜을 받고 있다.산도스 이전에도 GSK, 애보트, 애브비, 먼디파마, 비아트리스 등 글로벌 제약사와 파트너를 맺고 있다. 삼성바이오에피스 등 국내사도 있다.영업, 마케팅, 유통 등에서 글로벌 스탠다드를 충족했기 때문이라는 평가가 나온다.한국산도스도 삼일제약과의 파트너십 결정을 ▲기업 규모 ▲안과, 간 위장, 근골격계, CNS 분야 의약품 공급에서의 전문성 ▲다수의 글로벌 기업과의 오랜 협업 경험과 역량을 보유한 점을 고려했다고 설명했다.삼일제약 베트남 공장. 삼일제약은 수년 간 글로벌 회사로 성장하기 위해 노력을 기울이고 있다.▲2018년 베트남 법인 설립 ▲2022년 베트남 점안제 CDMO 플랜트 준공 ▲2022년 캐나다 북미법인 설립 ▲아람콜(비알코올성지방간염치료제), 로어시비빈트(골관절염치료제) 등 글로벌 임상 3상 단계의 신약후보물질 기술도입 계약 체결을 통한 미래 성장 동력 확보 ▲우수 해외의약품 국내 도입 등이다.특히 지난해 11월 준공식을 가진 베트남 글로벌 점안제 CDMO 공장은 글로벌 진출 발판이 될 전망이다.해당 공장은 연간 약 3억3000만개 점안제를 생산할 수 있다. 이르면 연말 베트남 DAV와 한국 MFDS GMP 승인을 목표로 하고 있다. 이후 2~3년 내 미국 FDA cGMP, 유럽 EMA EU GMP, Health Canada GMP 승인을 통해 글로벌 시장에 양질의 의약품을 공급할 계획이다.시장 관계자는 "다국적사의 의약품 유통 및 판매를 위한 국내 파트너 선정 기준은 무엇보다 글로벌 스탠다드 충족이다. 어떤 회사와 올바른 영업방식으로 시너지 극대화를 창출할 수 있느냐를 본다. 삼일제약이 최근 다국적사로부터 잇단 러브콜을 받으며 글로벌 스탠다드를 입증했다. 향후 이들과의 유통·판매 제휴가 생산 등으로 확대될 수 있는 발판도 마련했다"고 말했다.2023-05-15 06:00:50이석준 -
 아스트라제네카, 타그리소·리브리반트 병용임상 개시[데일리팜=황진중 기자] 아스트라제네카가 3세대 비소세포폐암 신약 '타그리소(오시머티닙)'와 얀센의 이중항체 항암제 '리브리반트(아미반타맙)' 병용 임상 2상시험을 개시한다. 리브리반트는 타그리소 경쟁 약물로 꼽히는 유한양행의 폐암신약 '렉라자(레이저티닙)'와 병용요법 임상 3상이 진행 중인 의약품이다. 얀센은 렉라자·리브리반트 병용 임상 개발에 속도를 내고 있다.타그리소(오시머티닙).(사진 아스트라제네카)13일 식품의약품안전처는 지난 11일 한국파렉셀이 의뢰한 타그리소·리브리반트 글로벌 임상 2상시험(OSTARA·NCT05801029) 계획을 승인했다. 이 임상은 표피성장인자수용체(EGFR) 변이 양성, 국소 진행성 또는 전이성 비소세포폐암 환자를 대상으로 타그리소·리브리반트 병용요법의 1차 치료제 가능성을 확인하는 연구다.국내 타그리소·리브리반트 병용요법 임상 2상은 화순전남대병원, 부산대병원, 고려대구로병원, 건국대병원, 충남대병원 등 다기관에서 라벨 공개, 단일군을 대상으로 진행된다.미국 임상시험정보사이트 클리티컬트라이얼즈에 따르면 아스트라제네카는 타그리소·리브리반트 병용 임상 2상을 오는 6월30일 환자 80명을 대상으로 시작할 예정이다. 목표 연구 완료일은 2027년 10월7일이다. 임상 파트너사는 글로벌 임상시험위탁기관(CRO) 파렉셀이다.타그리소·리브리반트 병용 임상 2상의 1차평가지표는 부작용이 있는 참가자 수다. 타그리소·리브리반트의 안전성과 내약성을 평가한다. 다른 1차평가지표는 무진행생존기간(PFS)이다. 2차평가지표는 전체생존기간(OS), 객관적반응률(ORR) 등이다.타그리소는 3세대 티로신 키나제 저해제(EGFR-TKI)다. 지난 2018년 4월 미국식품의약국(FDA)으로부터 비소세포폐암 1차 치료제로 허가 받았다. 1차 치료제 승인은 비소세포폐암 환자 556명을 대상으로 실시한 글로벌 임상 3상(FLAURA·NCT02296125)에 기반을 두고 이뤄졌다. 타그리소는 이 임상 3상에서 기존 표준치료군 대비 긍정적인 PFS 중앙값을 나타냈다. 임상 결과에 따르면 타그리소군 PFS 중앙값은 18.9개월, 표준치료군은 10.2개월이다.타그리소는 글로벌 곳곳에서 비소세포폐암 1차 치료제로 활용되고 있는 약물이다. 국내에서도 지난 2018년 12월 1차 치료제로 적응증을 추가했다. 지난해 글로벌 매출 54억4400만 달러(약 7조2623억원)를 기록한 블록버스터 의약품이다.리브리반트는 얀센이 개발한 EGFR 엑손 20 삽입 변이가 있는 국소 진행성 또는 전이성 비소세포폐암 치료제다. EGFR 엑손 20 삽입 변이 비소세포폐암은 폐암 중에서도 치명률이 높고 희귀한 암으로 알려졌다. 지난 2021년 FDA로부터 환자 81명을 대상으로 진행한 임상 3상(CHRYSALIS·NCT02609776)을 기반으로 승인 받았다. 리브리반트는 이 임상 3상에서 ORR 40%, 반응지속기간(DOR) 중앙값 11.1개월을 나타냈다.아스트라제네카 관계자는 "EGFR 변이 비소세포폐암 환자에게 더 최적의 치료 옵션을 전달할 수 있도록 타그리소·리브리반트 임상을 진행한다"고 말했다.렉라자(레이저티닙).(사진 유한양행)일각에서 아스트라제네카가 타그리소·리브리반트 병용요법 임상을 진행하는 이유로 렉라자·리브리반트 병용요법에 대응하기 위한 전략이라는 의견이 제기된다.렉라자·리브리반트 병용요법의 시장성이 확인될 시 타그리소도 리브리반트와 병용요법이 가능하다는 점을 내세우기 위해 과학적 근거를 쌓는 연구를 진행하는 것으로 보인다.얀센은 렉라자·리브리반트 병용요법과 타그리소를 비교하는 임상 3상(MARIPOSA·NCT04487080)에 속도를 내고 있다. 렉라자는 유한양행이 지난 2015년 오스코텍으로부터 기술을 도입해 2018년 얀센에 이전 했다.렉라자는 지난 2021년 1월 식약처로부터 EGFR 변이 양성 2차 치료제로 허가를 받은 신약이다. 유한양행은 지난해 12월 1차 치료제로 적응증 확대를 위해 진행한 임상 3상 결과(LASER301·NCT04248829)를 발표했다. 1차평가지표는 PFS다. 렉라자 투여군 20.6개월, 대조약 투여군 9.7개월을 나타냈다. 유한양행은 지난 3월 식약처에 1차 치료제로 품목허가 변경을 신청했다.얀센의 모회사 존슨앤드존슨(J&J)은 1분기 컨퍼런스콜을 통해 "환자 모집이 예상보다 빠르다"면서 "렉라자·리브리반트 병용 임상 마리포사 결과 발표를 올해 안에 할 수 있을 것"이라고 발표했다.2023-05-13 06:17:48황진중
아스트라제네카, 타그리소·리브리반트 병용임상 개시[데일리팜=황진중 기자] 아스트라제네카가 3세대 비소세포폐암 신약 '타그리소(오시머티닙)'와 얀센의 이중항체 항암제 '리브리반트(아미반타맙)' 병용 임상 2상시험을 개시한다. 리브리반트는 타그리소 경쟁 약물로 꼽히는 유한양행의 폐암신약 '렉라자(레이저티닙)'와 병용요법 임상 3상이 진행 중인 의약품이다. 얀센은 렉라자·리브리반트 병용 임상 개발에 속도를 내고 있다.타그리소(오시머티닙).(사진 아스트라제네카)13일 식품의약품안전처는 지난 11일 한국파렉셀이 의뢰한 타그리소·리브리반트 글로벌 임상 2상시험(OSTARA·NCT05801029) 계획을 승인했다. 이 임상은 표피성장인자수용체(EGFR) 변이 양성, 국소 진행성 또는 전이성 비소세포폐암 환자를 대상으로 타그리소·리브리반트 병용요법의 1차 치료제 가능성을 확인하는 연구다.국내 타그리소·리브리반트 병용요법 임상 2상은 화순전남대병원, 부산대병원, 고려대구로병원, 건국대병원, 충남대병원 등 다기관에서 라벨 공개, 단일군을 대상으로 진행된다.미국 임상시험정보사이트 클리티컬트라이얼즈에 따르면 아스트라제네카는 타그리소·리브리반트 병용 임상 2상을 오는 6월30일 환자 80명을 대상으로 시작할 예정이다. 목표 연구 완료일은 2027년 10월7일이다. 임상 파트너사는 글로벌 임상시험위탁기관(CRO) 파렉셀이다.타그리소·리브리반트 병용 임상 2상의 1차평가지표는 부작용이 있는 참가자 수다. 타그리소·리브리반트의 안전성과 내약성을 평가한다. 다른 1차평가지표는 무진행생존기간(PFS)이다. 2차평가지표는 전체생존기간(OS), 객관적반응률(ORR) 등이다.타그리소는 3세대 티로신 키나제 저해제(EGFR-TKI)다. 지난 2018년 4월 미국식품의약국(FDA)으로부터 비소세포폐암 1차 치료제로 허가 받았다. 1차 치료제 승인은 비소세포폐암 환자 556명을 대상으로 실시한 글로벌 임상 3상(FLAURA·NCT02296125)에 기반을 두고 이뤄졌다. 타그리소는 이 임상 3상에서 기존 표준치료군 대비 긍정적인 PFS 중앙값을 나타냈다. 임상 결과에 따르면 타그리소군 PFS 중앙값은 18.9개월, 표준치료군은 10.2개월이다.타그리소는 글로벌 곳곳에서 비소세포폐암 1차 치료제로 활용되고 있는 약물이다. 국내에서도 지난 2018년 12월 1차 치료제로 적응증을 추가했다. 지난해 글로벌 매출 54억4400만 달러(약 7조2623억원)를 기록한 블록버스터 의약품이다.리브리반트는 얀센이 개발한 EGFR 엑손 20 삽입 변이가 있는 국소 진행성 또는 전이성 비소세포폐암 치료제다. EGFR 엑손 20 삽입 변이 비소세포폐암은 폐암 중에서도 치명률이 높고 희귀한 암으로 알려졌다. 지난 2021년 FDA로부터 환자 81명을 대상으로 진행한 임상 3상(CHRYSALIS·NCT02609776)을 기반으로 승인 받았다. 리브리반트는 이 임상 3상에서 ORR 40%, 반응지속기간(DOR) 중앙값 11.1개월을 나타냈다.아스트라제네카 관계자는 "EGFR 변이 비소세포폐암 환자에게 더 최적의 치료 옵션을 전달할 수 있도록 타그리소·리브리반트 임상을 진행한다"고 말했다.렉라자(레이저티닙).(사진 유한양행)일각에서 아스트라제네카가 타그리소·리브리반트 병용요법 임상을 진행하는 이유로 렉라자·리브리반트 병용요법에 대응하기 위한 전략이라는 의견이 제기된다.렉라자·리브리반트 병용요법의 시장성이 확인될 시 타그리소도 리브리반트와 병용요법이 가능하다는 점을 내세우기 위해 과학적 근거를 쌓는 연구를 진행하는 것으로 보인다.얀센은 렉라자·리브리반트 병용요법과 타그리소를 비교하는 임상 3상(MARIPOSA·NCT04487080)에 속도를 내고 있다. 렉라자는 유한양행이 지난 2015년 오스코텍으로부터 기술을 도입해 2018년 얀센에 이전 했다.렉라자는 지난 2021년 1월 식약처로부터 EGFR 변이 양성 2차 치료제로 허가를 받은 신약이다. 유한양행은 지난해 12월 1차 치료제로 적응증 확대를 위해 진행한 임상 3상 결과(LASER301·NCT04248829)를 발표했다. 1차평가지표는 PFS다. 렉라자 투여군 20.6개월, 대조약 투여군 9.7개월을 나타냈다. 유한양행은 지난 3월 식약처에 1차 치료제로 품목허가 변경을 신청했다.얀센의 모회사 존슨앤드존슨(J&J)은 1분기 컨퍼런스콜을 통해 "환자 모집이 예상보다 빠르다"면서 "렉라자·리브리반트 병용 임상 마리포사 결과 발표를 올해 안에 할 수 있을 것"이라고 발표했다.2023-05-13 06:17:48황진중 -
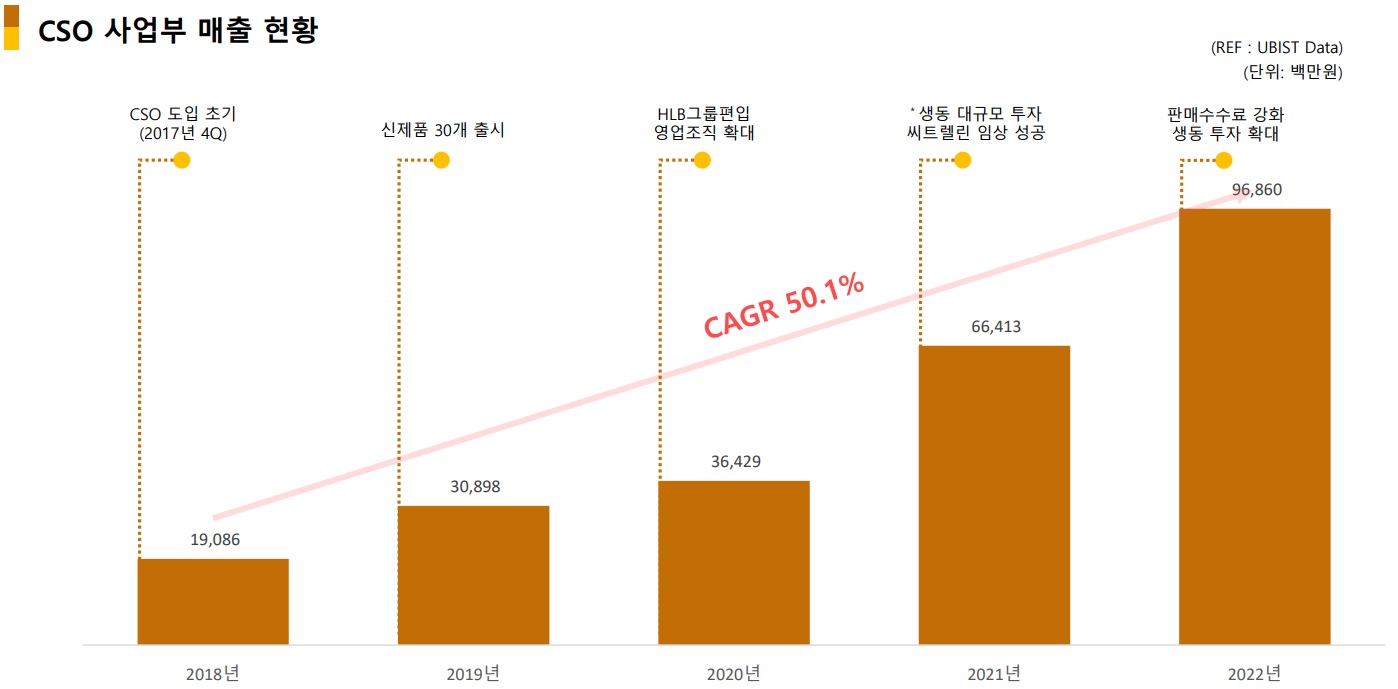 '의약품·컨슈머·R&D' 3박자 성과…HLB제약의 청사진[데일리팜=이석준 기자] HLB제약이 의약품, 컨슈머, R&D 부문에서 3박자 성과를 내고 있다. 의약품 부문은 올해 CSO 사업부만 1000억원을 넘길 것으로 전망된다. 자사 생산 제품 비율은 올해 60% 이상으로 확대되면서 원가 절감 및 가격 경쟁력도 확보한다.컨슈머 부문은 관절 특화 브랜드 콴첼을 런칭했다. 업계 최초 한국인관절연구센터 개설로 제품 포트폴리오를 확대할 계획이다. R&D 부문은 척수소뇌변성증치료제 '씨트렐린' 허가에 드라이브를 건다. HLB제약은 최근 기업설명회를 열고 이 같은 청사진을 공유했다. 회사에 따르면 HLB제약 사업부는 크게 ▲의약품 생산 ▲컨슈머 헬스케어 ▲신약 개발로 나뉜다.의약품 사업은 CSO(판매대행)과 CMO(수탁생산)으로 구분된다. 최근 5년 5배 가까운 매출 성장을 일으켰다. 2018년 205억원에서 2022년 1075억원이다. 지난해 매출 중 CSO는 937억원을 차지했다.올해는 CSO만 1000억원을 넘길 것으로 보인다. 공격적인 신제품 출시(2018년 56개→2020년 131개)와 2022년 판매수수료 인상 전략이 상승세를 이끌 것으로 보인다 .자사생산 제품 비중 확대로 수익성 개선도 노린다.HLB제약은 생물학적 동등성 임상 17건에 50억원 이상을 투입했다. 그 결과 주요 매출 품목 보험가 방어에 성공했다.회사는 자사 생산 제품 비율을 올해까지 25% 수준에서 60% 이상으로 확대한다는 계획이다. 이는 원가 절감 및 가격 경쟁력 확보로 이어질 수 있다. 컨슈머 부문도 드라이브를 걸고 있다.최근 관절 전문 건기식 '콴첼' 브랜드를 런칭했다. 관절 건강 분야 카테코리 킬러 전략으로 런칭 초기에 압도적인 인지도 확대를 위해서다.회사는 대중 매체 광고 후 홈쇼핑과 온라인 채널에 균형 있는 영업활동을 진행할 계획이다.얼마전에는 업계 최초 한국인관절연구센터를 개소했다. 수장은 HLB제약 컨슈머헬스케어본부에서 콴첼 제품 연구개발을 총괄하는 홍준기 센터장이 맡았다.한국인관절연구센터는 좌식 습관 등으로 관절 건강에 취약한 한국인의 관절 건강 문제를 해결하고 관절 건강 관리의 패러다임을 치료에서 예방으로 확대한다는 계획이다. R&D 성과 도출도 기대된다.대표 사례는 허가 절차를 밟고 있는 척수소뇌변성증 치료제 '씨트렐린 구강붕해정'이다. 국내 최초 대규모 비교 4상에서 안전성과 운동실조 개선효과에 대한 유효성을 확인했다.회사는 ▲올 2, 3분기 논문 발표 후 ▲4분기부터 내년 2분기까지 급여 신청 및 협상 ▲3분기에는 급여 적용을 목표로 하고 있다. 관련 시장은 300억원(유사질환 포함) 규모로 독점적 시장 확보가 가능할 것으로 보고 있다.리보세라닙 상업화 준비도 진행 중이다. FDA 허가 후 향남공장을 생산 기지로 활용할 예정이다. 리보세라닙 생산을 위한 리모델링도 진행하게 된다. 리보세라닙은 5월 20일께 FDA 허가신청을 할 계획이다.시장 관계자는 "HLB제약이 2020년 9월 HLB생명과학에 인수된 후 외형이 확대되고 있다. 올해도 의약품, 건기식, R&D 부문 청사진을 내놓으며 기업 가치 상승을 노리고 있다"고 진단했다.2023-05-13 06:00:59이석준
'의약품·컨슈머·R&D' 3박자 성과…HLB제약의 청사진[데일리팜=이석준 기자] HLB제약이 의약품, 컨슈머, R&D 부문에서 3박자 성과를 내고 있다. 의약품 부문은 올해 CSO 사업부만 1000억원을 넘길 것으로 전망된다. 자사 생산 제품 비율은 올해 60% 이상으로 확대되면서 원가 절감 및 가격 경쟁력도 확보한다.컨슈머 부문은 관절 특화 브랜드 콴첼을 런칭했다. 업계 최초 한국인관절연구센터 개설로 제품 포트폴리오를 확대할 계획이다. R&D 부문은 척수소뇌변성증치료제 '씨트렐린' 허가에 드라이브를 건다. HLB제약은 최근 기업설명회를 열고 이 같은 청사진을 공유했다. 회사에 따르면 HLB제약 사업부는 크게 ▲의약품 생산 ▲컨슈머 헬스케어 ▲신약 개발로 나뉜다.의약품 사업은 CSO(판매대행)과 CMO(수탁생산)으로 구분된다. 최근 5년 5배 가까운 매출 성장을 일으켰다. 2018년 205억원에서 2022년 1075억원이다. 지난해 매출 중 CSO는 937억원을 차지했다.올해는 CSO만 1000억원을 넘길 것으로 보인다. 공격적인 신제품 출시(2018년 56개→2020년 131개)와 2022년 판매수수료 인상 전략이 상승세를 이끌 것으로 보인다 .자사생산 제품 비중 확대로 수익성 개선도 노린다.HLB제약은 생물학적 동등성 임상 17건에 50억원 이상을 투입했다. 그 결과 주요 매출 품목 보험가 방어에 성공했다.회사는 자사 생산 제품 비율을 올해까지 25% 수준에서 60% 이상으로 확대한다는 계획이다. 이는 원가 절감 및 가격 경쟁력 확보로 이어질 수 있다. 컨슈머 부문도 드라이브를 걸고 있다.최근 관절 전문 건기식 '콴첼' 브랜드를 런칭했다. 관절 건강 분야 카테코리 킬러 전략으로 런칭 초기에 압도적인 인지도 확대를 위해서다.회사는 대중 매체 광고 후 홈쇼핑과 온라인 채널에 균형 있는 영업활동을 진행할 계획이다.얼마전에는 업계 최초 한국인관절연구센터를 개소했다. 수장은 HLB제약 컨슈머헬스케어본부에서 콴첼 제품 연구개발을 총괄하는 홍준기 센터장이 맡았다.한국인관절연구센터는 좌식 습관 등으로 관절 건강에 취약한 한국인의 관절 건강 문제를 해결하고 관절 건강 관리의 패러다임을 치료에서 예방으로 확대한다는 계획이다. R&D 성과 도출도 기대된다.대표 사례는 허가 절차를 밟고 있는 척수소뇌변성증 치료제 '씨트렐린 구강붕해정'이다. 국내 최초 대규모 비교 4상에서 안전성과 운동실조 개선효과에 대한 유효성을 확인했다.회사는 ▲올 2, 3분기 논문 발표 후 ▲4분기부터 내년 2분기까지 급여 신청 및 협상 ▲3분기에는 급여 적용을 목표로 하고 있다. 관련 시장은 300억원(유사질환 포함) 규모로 독점적 시장 확보가 가능할 것으로 보고 있다.리보세라닙 상업화 준비도 진행 중이다. FDA 허가 후 향남공장을 생산 기지로 활용할 예정이다. 리보세라닙 생산을 위한 리모델링도 진행하게 된다. 리보세라닙은 5월 20일께 FDA 허가신청을 할 계획이다.시장 관계자는 "HLB제약이 2020년 9월 HLB생명과학에 인수된 후 외형이 확대되고 있다. 올해도 의약품, 건기식, R&D 부문 청사진을 내놓으며 기업 가치 상승을 노리고 있다"고 진단했다.2023-05-13 06:00:59이석준















