총 118건
-
 휴메딕스, PN·HA 복합 필러 '밸피엔' 내년 출시[데일리팜=이석준 기자] 휴온스그룹 휴메딕스가 폴리뉴클레오티드나트륨(PN)과 히알루론산(HA)을 결합한 복합 필러 상용화에 나섰다.휴온스그룹 휴메딕스(대표 강민종)는 PN·HA복합 필러 ‘밸피엔’의 확증 임상을 마쳤다고 19일 밝혔다.휴메딕스는 지난해 2월 식품의약품안전처로부터 확증임상 시험계획(IND) 승인을 받은 뒤 중앙대학교병원에서 임상 시험을 진행했다.임상은 눈꼬리(Crow’s feet) 주름의 개선이 필요한 성인을 대상으로 진행했다. 휴메딕스는 임상 결과를 바탕으로 내년 상반기에 식약처 품목 허가를 신청할 계획이다. 출시 목표 시점은 내년 하반기다.PN은 연어 정소로부터 추출한 디옥시리보핵산(DNA) 물질로 우수한 생체적합성과 탁월한 피부 재생효과를 가진 물질이다. 벨피엔은 PN에 휴메딕스의 생체 고분자 응용 바이오 기술로 생산하는 고순도 HA와 무균화기술을 적용했다. 또한 국소 마취 성분인 리도카인을 더해 기존 PN필러 대비 통증이 적은 필러로 개발하겠다는 방침이다.휴메딕스는 HA기반의 필러 ‘엘라비에’와 스킨부스터 ‘엘라비에 리투오’ 등의 제품을 통해 국내 에스테틱 시장에 탄탄한 입지를 다지고 있다. 벨피엔 출시를 기점으로 시장 점유율을 크게 확대하겠다는 전략이다.강민종 휴메딕스 대표는 “벨피엔은 향후 국내는 물론 글로벌 시장 진출 계획도 수립 중이다. 특히 HA 엘라비에 필러가 수출되고 있는 중국, 남미뿐 아니라 유럽 인증(CE)을 획득해 시장을 확대해 나갈 계획”이라고 밝혔다.한편, 휴메딕스는 신제품 출시와 중장기 판매 계획에 선제적 대응을 위해 총 83억원 규모의 생산라인 증설을 계획하고 있다. 필러 중심의 에스테틱 제품의 내수 및 글로벌 공급능력 확대를 위한 사전충전형주사제(PFS) 충전설비 증설에 61억원, 신규 위탁생산(CMO) 주사제 수주 대응을 위한 주사용기(바이알) 동결건조 설비 증설에 22억원을 각각 투자할 계획이다.2025-12-19 10:30:09이석준 기자
휴메딕스, PN·HA 복합 필러 '밸피엔' 내년 출시[데일리팜=이석준 기자] 휴온스그룹 휴메딕스가 폴리뉴클레오티드나트륨(PN)과 히알루론산(HA)을 결합한 복합 필러 상용화에 나섰다.휴온스그룹 휴메딕스(대표 강민종)는 PN·HA복합 필러 ‘밸피엔’의 확증 임상을 마쳤다고 19일 밝혔다.휴메딕스는 지난해 2월 식품의약품안전처로부터 확증임상 시험계획(IND) 승인을 받은 뒤 중앙대학교병원에서 임상 시험을 진행했다.임상은 눈꼬리(Crow’s feet) 주름의 개선이 필요한 성인을 대상으로 진행했다. 휴메딕스는 임상 결과를 바탕으로 내년 상반기에 식약처 품목 허가를 신청할 계획이다. 출시 목표 시점은 내년 하반기다.PN은 연어 정소로부터 추출한 디옥시리보핵산(DNA) 물질로 우수한 생체적합성과 탁월한 피부 재생효과를 가진 물질이다. 벨피엔은 PN에 휴메딕스의 생체 고분자 응용 바이오 기술로 생산하는 고순도 HA와 무균화기술을 적용했다. 또한 국소 마취 성분인 리도카인을 더해 기존 PN필러 대비 통증이 적은 필러로 개발하겠다는 방침이다.휴메딕스는 HA기반의 필러 ‘엘라비에’와 스킨부스터 ‘엘라비에 리투오’ 등의 제품을 통해 국내 에스테틱 시장에 탄탄한 입지를 다지고 있다. 벨피엔 출시를 기점으로 시장 점유율을 크게 확대하겠다는 전략이다.강민종 휴메딕스 대표는 “벨피엔은 향후 국내는 물론 글로벌 시장 진출 계획도 수립 중이다. 특히 HA 엘라비에 필러가 수출되고 있는 중국, 남미뿐 아니라 유럽 인증(CE)을 획득해 시장을 확대해 나갈 계획”이라고 밝혔다.한편, 휴메딕스는 신제품 출시와 중장기 판매 계획에 선제적 대응을 위해 총 83억원 규모의 생산라인 증설을 계획하고 있다. 필러 중심의 에스테틱 제품의 내수 및 글로벌 공급능력 확대를 위한 사전충전형주사제(PFS) 충전설비 증설에 61억원, 신규 위탁생산(CMO) 주사제 수주 대응을 위한 주사용기(바이알) 동결건조 설비 증설에 22억원을 각각 투자할 계획이다.2025-12-19 10:30:09이석준 기자 -
 믿을건 임상 성공 뿐?...콜린알포 사수 벼랑 끝 총력전[데일리팜=천승현 기자] 제약사들이 콜린알포세레이트(콜린제제)의 환수 저지를 위해 꺼낸 비장의 카드가 차질이 빚어지는 모습이다. 제약사 30여곳이 환수협상 계약 자체가 무효라는 소송전네 나섰지만 나란히 1심에서 고배를 들었다. 콜린제제 재평가 임상시험에서 성공해야만 초유의 수천억원 규모 환수를 저지할 수 있다는 절박함이 확산하고 있다. 아세틸엘카르니틴, 옥시라세탐 등 뇌질환 치료제의 임상재평가 실패 사례로 콜린제제도 임상 성공이 쉽지 않다는 위기감이 크다. 임상시험 실패시 보건당국의 환수 움직임을 대비해 소송 전략을 미리 가동해야한다는 지적도 제기된다. 16일 업계에 따르면 서울행정법원은 지난 12일 대웅바이오외 12인이 국민건강보험공단을 상대로 청구한 계약 무효 확인 청구 소송에서 기각 판결을 내렸다. 제약사들은 콜린제제 환수협상 계약은 무효라는 내용의 행정소송을 지난 2월 청구했지만 10개월 만에 패소 판결을 받았다. 콜린제제는 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사 57곳이 임상시험을 진행 중이다. 지난 2020년 12월 보건복지부는 건보공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 제약사들의 콜린제제 환수협상 계약 무효 소송은 2개 그룹으로 나눠 진행됐다. 법무법인 세종이 종근당 등 24곳의 사건을 맡았고 법무법인 광장이 대웅바이오 등의 소송을 대리했다. 종근당 등은 지난 9월 패소했고 현재 항소심이 전개 중이다. 환수협상 계약무효소송은 제약사들이 꺼내든 회심의 카드다. 제약사들은 건보공단과 체결한 환수협상 계약이 적법하지 않다는 논리로 기존에 체결한 계약을 무력화하겠다는 전략을 세웠다. 콜린제제의 임상재평가 실패로 품목허가 취소를 받게 되더라도 처분의 효력은 장래를 향해 발생하기 때문에 요양급여지급 처분에 영향을 미치지 않는다는 논리다. 임상재평가 결과와 무관하게 제약사들이 지급받은 요양급여 비용은 적법하기 때문에 부당이익이라고 볼 수 없고 반환의무도 발생하지 않는다는 견해다. 제약사들은 콜린제제의 환수에 대한 근거가 명확하지 않다는 주장도 제기했다. 국민건강보험법상 이 사건 환수조항의 법률상의 근거가 될 수 있는 다른 규정이 존재하지 않는다는 논리가 이 소송의 배경으로 제시됐다. 하지만 2개 그룹 모두 1심 재판에서 패소하면서 제약사들의 소송전 반전 전략은 동력이 약해지게 됐다. 제약사들은 향후 항소심 등에서 역전의 기회가 남았지만 현실적으로 소송 패소 이후 전략을 모색해야 하는 처지다. 이미 제약사들은 보건당국의 환수협상 명령을 무력화하기 위한 소송에서 최종적으로 고배를 들었다.복지부의 환수협상 명령 이후 제약사들은 일제히 행정소송을 제기했다. 소송은 2개 그룹으로 나눠 제기됐다. 법무법인 광장은 대웅바이오 등 28개사의 소송을 대리했고 법무법인 세종이 종근당 등 28개사의 소송을 맡았다. 환수협상 명령 행정소송에서는 2개 그룹 모두 지난 2022년 1심에서 각하 판결이 나왔다. 종근당 그룹은 지난해 5월 항소심에서 기각 판결을 받았고 작년 10월 대법원도 심리불속행 기각 판결을 내렸다. 제약사들이 협상을 거부하자 복지부는 2021년 6월 2차 협상 명령을 내렸다. 이에 종근당 등 26개사와 대웅바이오 등 27개사로 나눠 취소소송을 제기했다. 지난해 3월 종근당 등이 제기한 환수협상 2차명령 취소 소송에서 각하 판결을 내렸다. 지난 5월 항소심에서도 제약사들은 패소했고 대법원은 지난 25일 심리불속행 기각 결정을 내렸다. 대웅바이오 그룹은 27곳 중 씨엠지제약과 환인제약을 제외한 25곳이 이탈한 가운데 2022년 2월 각하 판결이 나왔고 항소심은 제기되지 않았다. 제약사들의 가장 좋은 시나리오는 콜린제제 임상재평가를 성공적으로 수행하면서 시장 잔류와 환수 리스크를 소멸하는 것이다. 콜린제제의 임상재평가는 종근당과 대웅바이오의 주도로 진행 중이다. 종근당이 퇴행성 경도인지장애와 혈관성 경도인지장애 임상시험을 각각 수행하고, 대웅바이오가 치매 환자 대상 임상시험을 진행하는 방식이다. 종근당이 진행하는 경도인지장애 환자 대상 임상시험의 경우 종료시한이 3년 9개월로 설정됐다. 대웅바이오의 알츠하이머 환자 대상 임상시험의 경우 4년 6개월 이내에 마무리해야 한다. 식약처는 지난해 12월 콜린제제 임상재평가를 진행 중인 제약사들에 결과 제출 보고기한을 최대 2년 연장해달라는 건의를 받아들였다. 식약처는 혈관성 경도인지장애의 임상시험 결과보고서 자료 제출 기한을 1년 3개월 연장했다. 퇴행성 경도인지장애와 알츠하이머 임상재평가는 각각 2년 연장됐다. 당초 종근당의 혈관성 경도인지장애의 재평가 임상시험은 올해 3월 종료가 예정됐는데 내년 6월로 결과보고서 제출기한이 연장됐다. 퇴행성 경도인지장애 재평가 임상의 경우 2027년 3월로 종료 시기가 연장됐다. 대웅바이오의 알츠하이머 임상시험은 2027년 10월이 종료 기한으로 지정됐다. 콜린제제의 지난해 콜린제제의 외래 처방금액은 6123억원으로 집계됐다. 올해 3분기 누적 처방 시장 규모는 4419억원으로 나타났다. 최근 시장 성장세는 주춤했지만 여전히 3개월 처방액이 1500억원에 육박하는 초대형 시장을 형성했다. 만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 계산이 나온다. 이 경우 제약사들의 환수 금액은 5000억원 이상으로 추산된다. 제약사 입장에선 실적 손실을 감수하면서도 콜린제제의 수익금 일부를 미리 반영하면서 최악의 상황을 대비할 수 밖에 없는 처지다. 제약사들은 콜린제제의 임상재평가가 끝나지 않았는데도 이미 임상 실패를 가정한 부채를 인식한 상황이다. 콜린제제의 임상시험 실패시 발생할 수 있는 최악의 시나리오를 대비해 사전 대책 마련 움직임이다. 수익의 일부를 부채로 인식하면서 추후 일시적으로 발생할 수 있는 거액의 환수에 따른 피해를 최소화하겠다는 의도다. 일부 실적 공백을 감수하면서 임상 실패를 대비한 막대한 손실을 분산시키겠다는 고육책이다.종근당은 지난 3분기 말 기준 비유동부채 항목에 환불부채 520억원을 인식했다. 회사 측은 “콜린알포세레이트제제의 유효성 입증을 위한 임상재평가 실패시 건강보험공단에 납부할 추정금액을 환불부채로 인식했다”라고 설명했다. 콜린제제 판매로 발생한 수익의 일부를 추후 환불할 것으로 예상되는 부채로 미리 인식했다는 의미다. 대웅바이오는 콜린제제 임상재평가 실패시 납부할 금액 추정치를 장기선수금으로 인식한다. 선수금은 상품이나 서비스를 제공하기 전에 미리 받은 금액 부채에 해당한다. 지난해 말 대웅바이오의 기타비유동부채 중 장기선수금은 666억원에 달했다. 동구바이오제약은 비유동부채 중 기타 비유동부채 항목에 콜린제제 환수액을 사전에 인식했다. 3분기 말 동구바이오제약의 기타 비유동부채는 139억원으로 설정됐다. 알리코제약은 비유동부채 중 장기 환불부채에 콜린제제 환수금액 추정치를 선반영하고 있다. 알리코제약은 지난 9월 말 기준 비유동부채 장기환불부채 113억원을 인식했다. 한미약품은 지난 상반기 말 기준 비유동부채 항목 중 계약부채 및 환불부채 35억원을 인식했다. 한미약품은 “콜리네이트연질캡슐 임상재평가 실패 시 국민건강보험공단으로 납부해야 할 금액 추정치에 해당한다”고 설명했다. 국제약품, 동광제약, 경동제약, 제뉴파마, 동국제약, 환인제약 등도 수십억원 규모의 콜린제제 환수금액을 사전에 부채 항목 등에 선인식했다. 최근 진행한 뇌질환 임상재평가에서 연이어 실패했다는 경험이 콜린제제의 환수를 대비하는 배경으로 지목된다. 지난 2023년 옥시라세탐 성분 의약품이 임상시험 재평가 결과 효과를 입증하지 못해 퇴출됐다. 옥시라세탐은 알츠하이머형 치매, 다발경색성 치매, 뇌기능부전으로 인한 기질성 뇌증후군 등으로 인한 인지장애의 개선 용도로 허가받았다. 인지장애는 기억력·주의력·집중력 감소, 언어·행동 장애, 정서불안, 의욕결핍 등이 포함된다. 식약처는 지난 2015년 3월 옥시라세탐의 임상재평가를 공고했다. 임상재평가 디자인에 따라 2019년 혈관성 인지 장애 개선으로 적응증이 조정됐다. 당초 옥시라세탐의 임상재평가 자료 제출 기한은 2019년 3월로 설정됐지만 2차례에 걸쳐 자료제출기한이 연장됐고 2022년 6월 최종적으로 마감됐다. 식약처는 임상시험 자료를 검토한 결과 효능 입증에 실패했다는 결론을 내리고 적응증 삭제와 시장 퇴출로 결론났다. 지난 2021년에는 아세틸-엘-카르니틴 성분 의약품이 임상재평가 실패로 퇴출됐다. 아세틸-엘-카르니틴제제는 ‘일차적 퇴행성 질환’ 또는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’에 사용하도록 허가 받았다. 지난 2013년 식약처는 아세틸-엘-카르니틴제제에 대한 임상재평가를 지시했다. 재평가 임상은 적응증에 따라 2개 그룹으로 나눠 진행됐다. 동아에스티가 주도적으로 ‘일차적 퇴행성 질환’ 임상시험을 실시했다. 한미약품은 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’ 임상시험을 담당했다. 임상시험 결과 지난 2019년 7월 일차적 퇴행성 질환을 입증하지 못해 해당 적응증이 삭제됐다. 2021년 8월에는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’도 유효성을 입증하지 못한 것으로 결론났다. 9년에 걸친 임상재평가 결과 모든 적응증을 입증하지 못해 퇴출 수순으로 이어졌다. 옥시라세탐과 아세틸-엘-카르니틴은 임상재평가 실패로 인한 처방액 환수 조항이 없어 시장 퇴출에서 마무리됐다. 제약사들은 콜린제제의 임상실패시 보건당국이 환수금액을 청구하더라도 또 다시 소송전이 펼쳐질 가능성이 높다. 제약사들은 콜린제제의 허가가 유효한 상황에서 재평가 임상시험 실패로 막대한 금액을 부담하는 것은 납득하기 어렵다는 인식이 팽배하다. 제약사 한 관계자는 “최악의 경우 콜린제제 임상시험에 실패하고 보건당국의 환수 청구가 진행됐을 때 초대형 소송전이 펼쳐질 수 밖에 없다”라면서 “현재로서는 임상실패를 가정해 전사적인 소송 전략도 본격적으로 모색해야 할 때다”라고 말했다.2025-12-16 06:00:57천승현 기자
믿을건 임상 성공 뿐?...콜린알포 사수 벼랑 끝 총력전[데일리팜=천승현 기자] 제약사들이 콜린알포세레이트(콜린제제)의 환수 저지를 위해 꺼낸 비장의 카드가 차질이 빚어지는 모습이다. 제약사 30여곳이 환수협상 계약 자체가 무효라는 소송전네 나섰지만 나란히 1심에서 고배를 들었다. 콜린제제 재평가 임상시험에서 성공해야만 초유의 수천억원 규모 환수를 저지할 수 있다는 절박함이 확산하고 있다. 아세틸엘카르니틴, 옥시라세탐 등 뇌질환 치료제의 임상재평가 실패 사례로 콜린제제도 임상 성공이 쉽지 않다는 위기감이 크다. 임상시험 실패시 보건당국의 환수 움직임을 대비해 소송 전략을 미리 가동해야한다는 지적도 제기된다. 16일 업계에 따르면 서울행정법원은 지난 12일 대웅바이오외 12인이 국민건강보험공단을 상대로 청구한 계약 무효 확인 청구 소송에서 기각 판결을 내렸다. 제약사들은 콜린제제 환수협상 계약은 무효라는 내용의 행정소송을 지난 2월 청구했지만 10개월 만에 패소 판결을 받았다. 콜린제제는 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사 57곳이 임상시험을 진행 중이다. 지난 2020년 12월 보건복지부는 건보공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 제약사들의 콜린제제 환수협상 계약 무효 소송은 2개 그룹으로 나눠 진행됐다. 법무법인 세종이 종근당 등 24곳의 사건을 맡았고 법무법인 광장이 대웅바이오 등의 소송을 대리했다. 종근당 등은 지난 9월 패소했고 현재 항소심이 전개 중이다. 환수협상 계약무효소송은 제약사들이 꺼내든 회심의 카드다. 제약사들은 건보공단과 체결한 환수협상 계약이 적법하지 않다는 논리로 기존에 체결한 계약을 무력화하겠다는 전략을 세웠다. 콜린제제의 임상재평가 실패로 품목허가 취소를 받게 되더라도 처분의 효력은 장래를 향해 발생하기 때문에 요양급여지급 처분에 영향을 미치지 않는다는 논리다. 임상재평가 결과와 무관하게 제약사들이 지급받은 요양급여 비용은 적법하기 때문에 부당이익이라고 볼 수 없고 반환의무도 발생하지 않는다는 견해다. 제약사들은 콜린제제의 환수에 대한 근거가 명확하지 않다는 주장도 제기했다. 국민건강보험법상 이 사건 환수조항의 법률상의 근거가 될 수 있는 다른 규정이 존재하지 않는다는 논리가 이 소송의 배경으로 제시됐다. 하지만 2개 그룹 모두 1심 재판에서 패소하면서 제약사들의 소송전 반전 전략은 동력이 약해지게 됐다. 제약사들은 향후 항소심 등에서 역전의 기회가 남았지만 현실적으로 소송 패소 이후 전략을 모색해야 하는 처지다. 이미 제약사들은 보건당국의 환수협상 명령을 무력화하기 위한 소송에서 최종적으로 고배를 들었다.복지부의 환수협상 명령 이후 제약사들은 일제히 행정소송을 제기했다. 소송은 2개 그룹으로 나눠 제기됐다. 법무법인 광장은 대웅바이오 등 28개사의 소송을 대리했고 법무법인 세종이 종근당 등 28개사의 소송을 맡았다. 환수협상 명령 행정소송에서는 2개 그룹 모두 지난 2022년 1심에서 각하 판결이 나왔다. 종근당 그룹은 지난해 5월 항소심에서 기각 판결을 받았고 작년 10월 대법원도 심리불속행 기각 판결을 내렸다. 제약사들이 협상을 거부하자 복지부는 2021년 6월 2차 협상 명령을 내렸다. 이에 종근당 등 26개사와 대웅바이오 등 27개사로 나눠 취소소송을 제기했다. 지난해 3월 종근당 등이 제기한 환수협상 2차명령 취소 소송에서 각하 판결을 내렸다. 지난 5월 항소심에서도 제약사들은 패소했고 대법원은 지난 25일 심리불속행 기각 결정을 내렸다. 대웅바이오 그룹은 27곳 중 씨엠지제약과 환인제약을 제외한 25곳이 이탈한 가운데 2022년 2월 각하 판결이 나왔고 항소심은 제기되지 않았다. 제약사들의 가장 좋은 시나리오는 콜린제제 임상재평가를 성공적으로 수행하면서 시장 잔류와 환수 리스크를 소멸하는 것이다. 콜린제제의 임상재평가는 종근당과 대웅바이오의 주도로 진행 중이다. 종근당이 퇴행성 경도인지장애와 혈관성 경도인지장애 임상시험을 각각 수행하고, 대웅바이오가 치매 환자 대상 임상시험을 진행하는 방식이다. 종근당이 진행하는 경도인지장애 환자 대상 임상시험의 경우 종료시한이 3년 9개월로 설정됐다. 대웅바이오의 알츠하이머 환자 대상 임상시험의 경우 4년 6개월 이내에 마무리해야 한다. 식약처는 지난해 12월 콜린제제 임상재평가를 진행 중인 제약사들에 결과 제출 보고기한을 최대 2년 연장해달라는 건의를 받아들였다. 식약처는 혈관성 경도인지장애의 임상시험 결과보고서 자료 제출 기한을 1년 3개월 연장했다. 퇴행성 경도인지장애와 알츠하이머 임상재평가는 각각 2년 연장됐다. 당초 종근당의 혈관성 경도인지장애의 재평가 임상시험은 올해 3월 종료가 예정됐는데 내년 6월로 결과보고서 제출기한이 연장됐다. 퇴행성 경도인지장애 재평가 임상의 경우 2027년 3월로 종료 시기가 연장됐다. 대웅바이오의 알츠하이머 임상시험은 2027년 10월이 종료 기한으로 지정됐다. 콜린제제의 지난해 콜린제제의 외래 처방금액은 6123억원으로 집계됐다. 올해 3분기 누적 처방 시장 규모는 4419억원으로 나타났다. 최근 시장 성장세는 주춤했지만 여전히 3개월 처방액이 1500억원에 육박하는 초대형 시장을 형성했다. 만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 계산이 나온다. 이 경우 제약사들의 환수 금액은 5000억원 이상으로 추산된다. 제약사 입장에선 실적 손실을 감수하면서도 콜린제제의 수익금 일부를 미리 반영하면서 최악의 상황을 대비할 수 밖에 없는 처지다. 제약사들은 콜린제제의 임상재평가가 끝나지 않았는데도 이미 임상 실패를 가정한 부채를 인식한 상황이다. 콜린제제의 임상시험 실패시 발생할 수 있는 최악의 시나리오를 대비해 사전 대책 마련 움직임이다. 수익의 일부를 부채로 인식하면서 추후 일시적으로 발생할 수 있는 거액의 환수에 따른 피해를 최소화하겠다는 의도다. 일부 실적 공백을 감수하면서 임상 실패를 대비한 막대한 손실을 분산시키겠다는 고육책이다.종근당은 지난 3분기 말 기준 비유동부채 항목에 환불부채 520억원을 인식했다. 회사 측은 “콜린알포세레이트제제의 유효성 입증을 위한 임상재평가 실패시 건강보험공단에 납부할 추정금액을 환불부채로 인식했다”라고 설명했다. 콜린제제 판매로 발생한 수익의 일부를 추후 환불할 것으로 예상되는 부채로 미리 인식했다는 의미다. 대웅바이오는 콜린제제 임상재평가 실패시 납부할 금액 추정치를 장기선수금으로 인식한다. 선수금은 상품이나 서비스를 제공하기 전에 미리 받은 금액 부채에 해당한다. 지난해 말 대웅바이오의 기타비유동부채 중 장기선수금은 666억원에 달했다. 동구바이오제약은 비유동부채 중 기타 비유동부채 항목에 콜린제제 환수액을 사전에 인식했다. 3분기 말 동구바이오제약의 기타 비유동부채는 139억원으로 설정됐다. 알리코제약은 비유동부채 중 장기 환불부채에 콜린제제 환수금액 추정치를 선반영하고 있다. 알리코제약은 지난 9월 말 기준 비유동부채 장기환불부채 113억원을 인식했다. 한미약품은 지난 상반기 말 기준 비유동부채 항목 중 계약부채 및 환불부채 35억원을 인식했다. 한미약품은 “콜리네이트연질캡슐 임상재평가 실패 시 국민건강보험공단으로 납부해야 할 금액 추정치에 해당한다”고 설명했다. 국제약품, 동광제약, 경동제약, 제뉴파마, 동국제약, 환인제약 등도 수십억원 규모의 콜린제제 환수금액을 사전에 부채 항목 등에 선인식했다. 최근 진행한 뇌질환 임상재평가에서 연이어 실패했다는 경험이 콜린제제의 환수를 대비하는 배경으로 지목된다. 지난 2023년 옥시라세탐 성분 의약품이 임상시험 재평가 결과 효과를 입증하지 못해 퇴출됐다. 옥시라세탐은 알츠하이머형 치매, 다발경색성 치매, 뇌기능부전으로 인한 기질성 뇌증후군 등으로 인한 인지장애의 개선 용도로 허가받았다. 인지장애는 기억력·주의력·집중력 감소, 언어·행동 장애, 정서불안, 의욕결핍 등이 포함된다. 식약처는 지난 2015년 3월 옥시라세탐의 임상재평가를 공고했다. 임상재평가 디자인에 따라 2019년 혈관성 인지 장애 개선으로 적응증이 조정됐다. 당초 옥시라세탐의 임상재평가 자료 제출 기한은 2019년 3월로 설정됐지만 2차례에 걸쳐 자료제출기한이 연장됐고 2022년 6월 최종적으로 마감됐다. 식약처는 임상시험 자료를 검토한 결과 효능 입증에 실패했다는 결론을 내리고 적응증 삭제와 시장 퇴출로 결론났다. 지난 2021년에는 아세틸-엘-카르니틴 성분 의약품이 임상재평가 실패로 퇴출됐다. 아세틸-엘-카르니틴제제는 ‘일차적 퇴행성 질환’ 또는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’에 사용하도록 허가 받았다. 지난 2013년 식약처는 아세틸-엘-카르니틴제제에 대한 임상재평가를 지시했다. 재평가 임상은 적응증에 따라 2개 그룹으로 나눠 진행됐다. 동아에스티가 주도적으로 ‘일차적 퇴행성 질환’ 임상시험을 실시했다. 한미약품은 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’ 임상시험을 담당했다. 임상시험 결과 지난 2019년 7월 일차적 퇴행성 질환을 입증하지 못해 해당 적응증이 삭제됐다. 2021년 8월에는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’도 유효성을 입증하지 못한 것으로 결론났다. 9년에 걸친 임상재평가 결과 모든 적응증을 입증하지 못해 퇴출 수순으로 이어졌다. 옥시라세탐과 아세틸-엘-카르니틴은 임상재평가 실패로 인한 처방액 환수 조항이 없어 시장 퇴출에서 마무리됐다. 제약사들은 콜린제제의 임상실패시 보건당국이 환수금액을 청구하더라도 또 다시 소송전이 펼쳐질 가능성이 높다. 제약사들은 콜린제제의 허가가 유효한 상황에서 재평가 임상시험 실패로 막대한 금액을 부담하는 것은 납득하기 어렵다는 인식이 팽배하다. 제약사 한 관계자는 “최악의 경우 콜린제제 임상시험에 실패하고 보건당국의 환수 청구가 진행됐을 때 초대형 소송전이 펼쳐질 수 밖에 없다”라면서 “현재로서는 임상실패를 가정해 전사적인 소송 전략도 본격적으로 모색해야 할 때다”라고 말했다.2025-12-16 06:00:57천승현 기자 -
 41호 국내 개발 신약 탄생…아로나민골드 라인업 확대[데일리팜=이탁순 기자] 국내 개발 신약이 41개까지 늘었습니다. 동아에스티가 뇌전증치료제 '엑스코프리정'를 허가받은 것입니다.국내 제약사가 개발한 복합 개량신약도 꾸준합니다. 이번엔 암로디핀과 발사르탄, 클로르탈리돈이 최초로 결합한 3제 고혈압치료제가 나왔습니다.일반약 가운데는 비타민 D 유사체인 '알파칼시톨' 성분이 인기를 끌고 있습니다. 최근 급여약으로 처방량이 급증하고 있기 때문입니다.일동제약은 스테디셀러 '아로나민골드'의 라인업 확대에 나섰습니다. 새로운 성분도 보강하고, 함량도 추가했습니다.지난 11월에는 전문의약품 69개, 일반의약품 53개가 허가를 받았습니다. ◆일반의약품 = 일반의약품은 자료제출의약품이 1개, 표준제조기준이 34개, 제네릭 18개가 허가를 받았습니다. 올해 초 표준제조기준 개정 확대로 새로운 조합의 복합제제 표제기 품목이 늘고 있는 모습입니다. 와이에스생명과학 와이에스알파정1마이크로그램(11월 7일 허가, 자료제출의약품)와이에스알파정1마이크로그램은 11월 허가(신고)된 일반의약품 가운데 유일한 자료제출의약품입니다. 이는 해당 동일 성분, 동일 함량 제제 가운데 유일한 정제이기 때문입니다.알파칼시톨은 비타민 D 유사체로 간에서 대사되어 활성형으로 바로 작용된다는 장점 때문에 신기능 환자에 유용하게 사용됩니다. 칼슘과 인의 흡수를 돕고 뼈 형성을 촉진하는데, 만성 신부전 등 환자에 많이 사용됩니다.최근 사용량이 급증하면서 제약사들의 허가 추진도 많아지고 있습니다.글로벌 의약품 시장조사기관 아이큐비아에 따르면, 국내 알파칼시돌 매출은 2021년 87억원, 2022년 108억원, 2023년 120억원, 2024년 190억원으로 지속적으로 증가 추세를 보이고 있습니다.와이에스알파정1마이크로그램은 고함량 정제 제형으로 개발돼 복용 횟수를 줄이고 순응도를 높였으며, 연질캡슐 대비 삼킴 부담이 적어 고령층 환자의 복용 편의성도 향상될 것으로 기대되고 있습니다.YS생명과학 관계자는 “정제형 알파칼시돌 제제화는 제형 안정성과 정밀 합성 기술이 동시에 요구되는 고난도 프로젝트로, 해외에서도 사례가 많지 않다”며 “이번 성과는 YS생명과학이 원료 중심 기업에서 완제의약품 전문기업으로 도약하는 전환점이 될 것”이라고 말했습니다. YS생명과학은 추후 0.5마이크로그램 함량 제품도 추가 출시할 계획입니다.동국제약 프리이지정(11월 6일 허가, 제네릭)동국제약 프리이지정은 소염진통 성분인 에텐자미드와 근윤이완 작용을 하는 클로르족사존이 함유된 근육이완 일반의약품입니다.최근 해당 성분 제품이 늘고 있습니다. 작년부터 최근까지 26개 품목이 허가를 받았습니다. 그 전까지는 2개 품목 뿐이었습니다.에텐자미드+클로르족사존 복합제가 늘고 있는 건 아세트아미노펜+클로르족사존 제품이 유효성 자료 제출 문제로 사라지면서 에텐자미드+클로르족사존 복합 이완제 시장으로 제약사들이 넘어왔기 때문입니다.아세트아미노펜+클로르족사존 제품은 유효성 자료 부족으로 식약처로부터 갱신이 불허되자 제약사 대부분이 제품 허가를 취하하거나 갱신하지 않았습니다.이에 40개 되던 제품이 한순간에 사라졌습니다. 하지만 근육이완 정제에 수요는 꾸준하다 보니 제약사들이 에텐자미드+클로르족사존 복합제를 만들기 시작한 것이죠.에텐자미드는 아세트아미노펜과 달리 진통뿐만 아니라 소염 효과도 존재하고, 간에 부담도 적다는 점이 특징입니다.이 성분의 오리지널의약품은 동아제약의 '스카풀라정'입니다. 일동제약 아로나민골드 원·액티브정(11월 5, 14일 허가, 표준제조기준)일동제약이 아로나민골드 제품군 허가를 늘려나가고 있습니다. 지난달에만 아로나민골드원과 아로나민골드액티브 2개의 제품을 허가받았습니다.아로나민골드원은 비타민B군을 보강하고, 비타민B12 종류인 메코발라민을 함유했다는 점이 기존 아로나민골드 제품군과 차별점입니다.메코발라민은 체내에서 별도 전환 과정 없이 바로 작용해 효과가 빠르다는 장점이 있습니다. 반면 히드록소코발라민이나 시아노코발라민은 안정성이 높지만, 추가적인 활성 단계를 거쳐야 한다는 단점이 있지요.아로나민골드액티브 역시 메코발라민이 함유됐습니다. 또한 면역력 강화, 세포 발달에 중요한 역할을 하는 필수 미네랄인 아연도 포함돼 있다는 점이 기존 제품과 달라진 점입니다.여기에 간세포 보호 기능이 있는 우르소데옥시콜산, 강력한 항산화 작용을 하는 셀레늄함유건조효모, 비타민B6 일종인 피리독신염산염이 아로나민 시리즈 가운데 처음으로 함유됐습니다.현재 아로나민골드 시리즈는 아로나민골드와 아로나민골드프리미엄이 판매되고 있습니다. 작년 아로나민류 매출액은 622억원에 달합니다.일동은 이번에 허가받은 제품을 통해 아로나민골드 라인업을 강화하면서 매출 극대화에 나설 것으로 보입니다.◆전문의약품 = 11월 전문의약품은 신약 4개, 자료제출의약품 21개, 제네릭 41개, 희귀의약품 2개가 허가를 받았습니다. 신약 중 국내 개발 신약이 포함돼 있습니다. 동아에스티 엑스코프리정(11월 3일 허가, 신약)SK바이오팜이 개발한 뇌전증치료제 '엑스코프리'가 동아에스티를 통해 국내 허가를 획득했습니다. 41번째 국내 개발신약입니다.엑스코프리는 성인 뇌전증 환자에서 2차성 전신발작을 동반하거나 동반하지 않는 부분발작 치료의 부가요법으로 허가됐습니다.기존 항뇌전증약 투여로 적절하게 조절되지 않는 뇌전증 환자에게 새로운 치료 기회를 제공할 전망입니다.이 약은 국내보다 미국에서 먼저 승인됐습니다. SK바이오팜이 초기 개발부터 진두지휘해 지난 2019년 11월 FDA 승인을 받았습니다. 2020년 5월부터는 SK바이오팜의 미국 현지 법인 SK라이프사이언스를 통해 직접 판매도 진행하고 있습니다.올해 상반기까지 엑스코프리의 미국 누적 매출만 1조2563억원에 달합니다.동아에스티는 지난해 1월 SK바이오팜과 라이선싱 계약을 맺고, 30개국의 허가·생산·판매 권리를 확보했습니다.식약처는 이 약을 '글로벌 혁신제품 신속심사 지원체계(GIFT)'로 지정한 후, 심사 역량을 최대한 집중한 신속 심사를 진행했고, 동아에스티는 기술이전 이후 1년 9개월만에 상업화 허가를 획득하는데 성공했습니다.한국파마 아크루퍼캡슐30mg(11월 5일 허가, 신약)한국파마(대표 박은희)가 수입·판매하는 철 결핍 치료제 '아크루퍼캡슐30mg(제이철말톨)'이 신약으로 국내 품목허가를 획득했습니다.이 약은 빈혈의 유무와 관계없이 철 결핍에 사용하는 유일한 치료제입니다.아크루퍼의 효능·효과는 성인에서 철 결핍증의 치료이며, 용법·용량은 1회 1캡슐(30mg), 1일 2회입니다.한국파마가 영국 쉴드 테라퓨틱스와 기술이전 계약을 체결해 국내 도입한 약으로, 작년 2월에는 국내 가교임상을 통해 미국·유럽 등 서양인과 동일한 효과와 안전성을 입증했습니다.이 약은 3가 철 이온과 말톨의 화합물로 위장관 내에서 이온화되지 않아 기존의 국내 철결핍성 빈혈 치료제 복용 시 나타날 수 있는 속쓰림, 변비 등 위장 장애를 개선한 제품으로, 세계에서 유일하게 빈혈의 유무와 관계없이 철 결핍에 사용하는 제품으로 FDA 및 유럽 EMA에서 승인받은 약으로 알려져 있습니다.임상시험에서도 철의 저용량 투여로 투여 4주 만에 현저한 빈혈의 개선 효과를 보였고, 64주간의 장기 투여 시에도 효과와 안전성을 입증했습니다. 한국파마는 급여 등재 절차를 거쳐 이 약을 국내 판매할 것으로 보입니다.경동제약 발디핀플러스정(11월 7일 허가, 자료제출의약품)경동제약 발디핀플러스정은 안지오텐신II 수용체 차단제(ARB) 계열의 발사르탄, 칼슘 채널 차단제(CCB) 암로디핀, 이뇨제 클로르탈리돈의 세 성분이 최초 결합한 고혈압 3제 복합제입니다.암로디핀과 발사르탄 복합요법으로 혈압이 충분히 조절되지 않는 본태성 고혈압 환자를 대상으로 하며, 1일 1회 1정 식사와 관계없이 섭취 가능하도록 복약 편의성을 높인 게 특징입니다.경동제약은 약물상호작용 및 동등성 평가를 포함한 임상 1상 2건과, 한국인을 포함한 임상 3상 치료적 확증 시험을 통해 발사르탄·암로디핀 복합제 대비 병용요법 시 유효성과 우월성을 입증했습니다.회사 측은 발디핀플러스정이 서로 다른 기전의 세 성분이 상호 보완적으로 작용해, 보다 강력한 혈압 강하 효과를 기대할 수 있다면서 고정용량 복합제의 선택 폭을 확대하고 처방의 단순화를 통해 환자의 복약 순응도 향상에 기여할 것이라고 전했습니다.발디핀플러스정 허가 이후 공동 개발을 추진한 동광제약과 HK이노엔도 허가를 받았습니다. 동광제약은 바로셋정, HK이노엔은 엑스원플러스정입니다. 처방 편의성을 위해 4개 용량으로 세분화해 제품이 출시됩니다.2025-12-08 06:00:56이탁순 기자
41호 국내 개발 신약 탄생…아로나민골드 라인업 확대[데일리팜=이탁순 기자] 국내 개발 신약이 41개까지 늘었습니다. 동아에스티가 뇌전증치료제 '엑스코프리정'를 허가받은 것입니다.국내 제약사가 개발한 복합 개량신약도 꾸준합니다. 이번엔 암로디핀과 발사르탄, 클로르탈리돈이 최초로 결합한 3제 고혈압치료제가 나왔습니다.일반약 가운데는 비타민 D 유사체인 '알파칼시톨' 성분이 인기를 끌고 있습니다. 최근 급여약으로 처방량이 급증하고 있기 때문입니다.일동제약은 스테디셀러 '아로나민골드'의 라인업 확대에 나섰습니다. 새로운 성분도 보강하고, 함량도 추가했습니다.지난 11월에는 전문의약품 69개, 일반의약품 53개가 허가를 받았습니다. ◆일반의약품 = 일반의약품은 자료제출의약품이 1개, 표준제조기준이 34개, 제네릭 18개가 허가를 받았습니다. 올해 초 표준제조기준 개정 확대로 새로운 조합의 복합제제 표제기 품목이 늘고 있는 모습입니다. 와이에스생명과학 와이에스알파정1마이크로그램(11월 7일 허가, 자료제출의약품)와이에스알파정1마이크로그램은 11월 허가(신고)된 일반의약품 가운데 유일한 자료제출의약품입니다. 이는 해당 동일 성분, 동일 함량 제제 가운데 유일한 정제이기 때문입니다.알파칼시톨은 비타민 D 유사체로 간에서 대사되어 활성형으로 바로 작용된다는 장점 때문에 신기능 환자에 유용하게 사용됩니다. 칼슘과 인의 흡수를 돕고 뼈 형성을 촉진하는데, 만성 신부전 등 환자에 많이 사용됩니다.최근 사용량이 급증하면서 제약사들의 허가 추진도 많아지고 있습니다.글로벌 의약품 시장조사기관 아이큐비아에 따르면, 국내 알파칼시돌 매출은 2021년 87억원, 2022년 108억원, 2023년 120억원, 2024년 190억원으로 지속적으로 증가 추세를 보이고 있습니다.와이에스알파정1마이크로그램은 고함량 정제 제형으로 개발돼 복용 횟수를 줄이고 순응도를 높였으며, 연질캡슐 대비 삼킴 부담이 적어 고령층 환자의 복용 편의성도 향상될 것으로 기대되고 있습니다.YS생명과학 관계자는 “정제형 알파칼시돌 제제화는 제형 안정성과 정밀 합성 기술이 동시에 요구되는 고난도 프로젝트로, 해외에서도 사례가 많지 않다”며 “이번 성과는 YS생명과학이 원료 중심 기업에서 완제의약품 전문기업으로 도약하는 전환점이 될 것”이라고 말했습니다. YS생명과학은 추후 0.5마이크로그램 함량 제품도 추가 출시할 계획입니다.동국제약 프리이지정(11월 6일 허가, 제네릭)동국제약 프리이지정은 소염진통 성분인 에텐자미드와 근윤이완 작용을 하는 클로르족사존이 함유된 근육이완 일반의약품입니다.최근 해당 성분 제품이 늘고 있습니다. 작년부터 최근까지 26개 품목이 허가를 받았습니다. 그 전까지는 2개 품목 뿐이었습니다.에텐자미드+클로르족사존 복합제가 늘고 있는 건 아세트아미노펜+클로르족사존 제품이 유효성 자료 제출 문제로 사라지면서 에텐자미드+클로르족사존 복합 이완제 시장으로 제약사들이 넘어왔기 때문입니다.아세트아미노펜+클로르족사존 제품은 유효성 자료 부족으로 식약처로부터 갱신이 불허되자 제약사 대부분이 제품 허가를 취하하거나 갱신하지 않았습니다.이에 40개 되던 제품이 한순간에 사라졌습니다. 하지만 근육이완 정제에 수요는 꾸준하다 보니 제약사들이 에텐자미드+클로르족사존 복합제를 만들기 시작한 것이죠.에텐자미드는 아세트아미노펜과 달리 진통뿐만 아니라 소염 효과도 존재하고, 간에 부담도 적다는 점이 특징입니다.이 성분의 오리지널의약품은 동아제약의 '스카풀라정'입니다. 일동제약 아로나민골드 원·액티브정(11월 5, 14일 허가, 표준제조기준)일동제약이 아로나민골드 제품군 허가를 늘려나가고 있습니다. 지난달에만 아로나민골드원과 아로나민골드액티브 2개의 제품을 허가받았습니다.아로나민골드원은 비타민B군을 보강하고, 비타민B12 종류인 메코발라민을 함유했다는 점이 기존 아로나민골드 제품군과 차별점입니다.메코발라민은 체내에서 별도 전환 과정 없이 바로 작용해 효과가 빠르다는 장점이 있습니다. 반면 히드록소코발라민이나 시아노코발라민은 안정성이 높지만, 추가적인 활성 단계를 거쳐야 한다는 단점이 있지요.아로나민골드액티브 역시 메코발라민이 함유됐습니다. 또한 면역력 강화, 세포 발달에 중요한 역할을 하는 필수 미네랄인 아연도 포함돼 있다는 점이 기존 제품과 달라진 점입니다.여기에 간세포 보호 기능이 있는 우르소데옥시콜산, 강력한 항산화 작용을 하는 셀레늄함유건조효모, 비타민B6 일종인 피리독신염산염이 아로나민 시리즈 가운데 처음으로 함유됐습니다.현재 아로나민골드 시리즈는 아로나민골드와 아로나민골드프리미엄이 판매되고 있습니다. 작년 아로나민류 매출액은 622억원에 달합니다.일동은 이번에 허가받은 제품을 통해 아로나민골드 라인업을 강화하면서 매출 극대화에 나설 것으로 보입니다.◆전문의약품 = 11월 전문의약품은 신약 4개, 자료제출의약품 21개, 제네릭 41개, 희귀의약품 2개가 허가를 받았습니다. 신약 중 국내 개발 신약이 포함돼 있습니다. 동아에스티 엑스코프리정(11월 3일 허가, 신약)SK바이오팜이 개발한 뇌전증치료제 '엑스코프리'가 동아에스티를 통해 국내 허가를 획득했습니다. 41번째 국내 개발신약입니다.엑스코프리는 성인 뇌전증 환자에서 2차성 전신발작을 동반하거나 동반하지 않는 부분발작 치료의 부가요법으로 허가됐습니다.기존 항뇌전증약 투여로 적절하게 조절되지 않는 뇌전증 환자에게 새로운 치료 기회를 제공할 전망입니다.이 약은 국내보다 미국에서 먼저 승인됐습니다. SK바이오팜이 초기 개발부터 진두지휘해 지난 2019년 11월 FDA 승인을 받았습니다. 2020년 5월부터는 SK바이오팜의 미국 현지 법인 SK라이프사이언스를 통해 직접 판매도 진행하고 있습니다.올해 상반기까지 엑스코프리의 미국 누적 매출만 1조2563억원에 달합니다.동아에스티는 지난해 1월 SK바이오팜과 라이선싱 계약을 맺고, 30개국의 허가·생산·판매 권리를 확보했습니다.식약처는 이 약을 '글로벌 혁신제품 신속심사 지원체계(GIFT)'로 지정한 후, 심사 역량을 최대한 집중한 신속 심사를 진행했고, 동아에스티는 기술이전 이후 1년 9개월만에 상업화 허가를 획득하는데 성공했습니다.한국파마 아크루퍼캡슐30mg(11월 5일 허가, 신약)한국파마(대표 박은희)가 수입·판매하는 철 결핍 치료제 '아크루퍼캡슐30mg(제이철말톨)'이 신약으로 국내 품목허가를 획득했습니다.이 약은 빈혈의 유무와 관계없이 철 결핍에 사용하는 유일한 치료제입니다.아크루퍼의 효능·효과는 성인에서 철 결핍증의 치료이며, 용법·용량은 1회 1캡슐(30mg), 1일 2회입니다.한국파마가 영국 쉴드 테라퓨틱스와 기술이전 계약을 체결해 국내 도입한 약으로, 작년 2월에는 국내 가교임상을 통해 미국·유럽 등 서양인과 동일한 효과와 안전성을 입증했습니다.이 약은 3가 철 이온과 말톨의 화합물로 위장관 내에서 이온화되지 않아 기존의 국내 철결핍성 빈혈 치료제 복용 시 나타날 수 있는 속쓰림, 변비 등 위장 장애를 개선한 제품으로, 세계에서 유일하게 빈혈의 유무와 관계없이 철 결핍에 사용하는 제품으로 FDA 및 유럽 EMA에서 승인받은 약으로 알려져 있습니다.임상시험에서도 철의 저용량 투여로 투여 4주 만에 현저한 빈혈의 개선 효과를 보였고, 64주간의 장기 투여 시에도 효과와 안전성을 입증했습니다. 한국파마는 급여 등재 절차를 거쳐 이 약을 국내 판매할 것으로 보입니다.경동제약 발디핀플러스정(11월 7일 허가, 자료제출의약품)경동제약 발디핀플러스정은 안지오텐신II 수용체 차단제(ARB) 계열의 발사르탄, 칼슘 채널 차단제(CCB) 암로디핀, 이뇨제 클로르탈리돈의 세 성분이 최초 결합한 고혈압 3제 복합제입니다.암로디핀과 발사르탄 복합요법으로 혈압이 충분히 조절되지 않는 본태성 고혈압 환자를 대상으로 하며, 1일 1회 1정 식사와 관계없이 섭취 가능하도록 복약 편의성을 높인 게 특징입니다.경동제약은 약물상호작용 및 동등성 평가를 포함한 임상 1상 2건과, 한국인을 포함한 임상 3상 치료적 확증 시험을 통해 발사르탄·암로디핀 복합제 대비 병용요법 시 유효성과 우월성을 입증했습니다.회사 측은 발디핀플러스정이 서로 다른 기전의 세 성분이 상호 보완적으로 작용해, 보다 강력한 혈압 강하 효과를 기대할 수 있다면서 고정용량 복합제의 선택 폭을 확대하고 처방의 단순화를 통해 환자의 복약 순응도 향상에 기여할 것이라고 전했습니다.발디핀플러스정 허가 이후 공동 개발을 추진한 동광제약과 HK이노엔도 허가를 받았습니다. 동광제약은 바로셋정, HK이노엔은 엑스원플러스정입니다. 처방 편의성을 위해 4개 용량으로 세분화해 제품이 출시됩니다.2025-12-08 06:00:56이탁순 기자 -
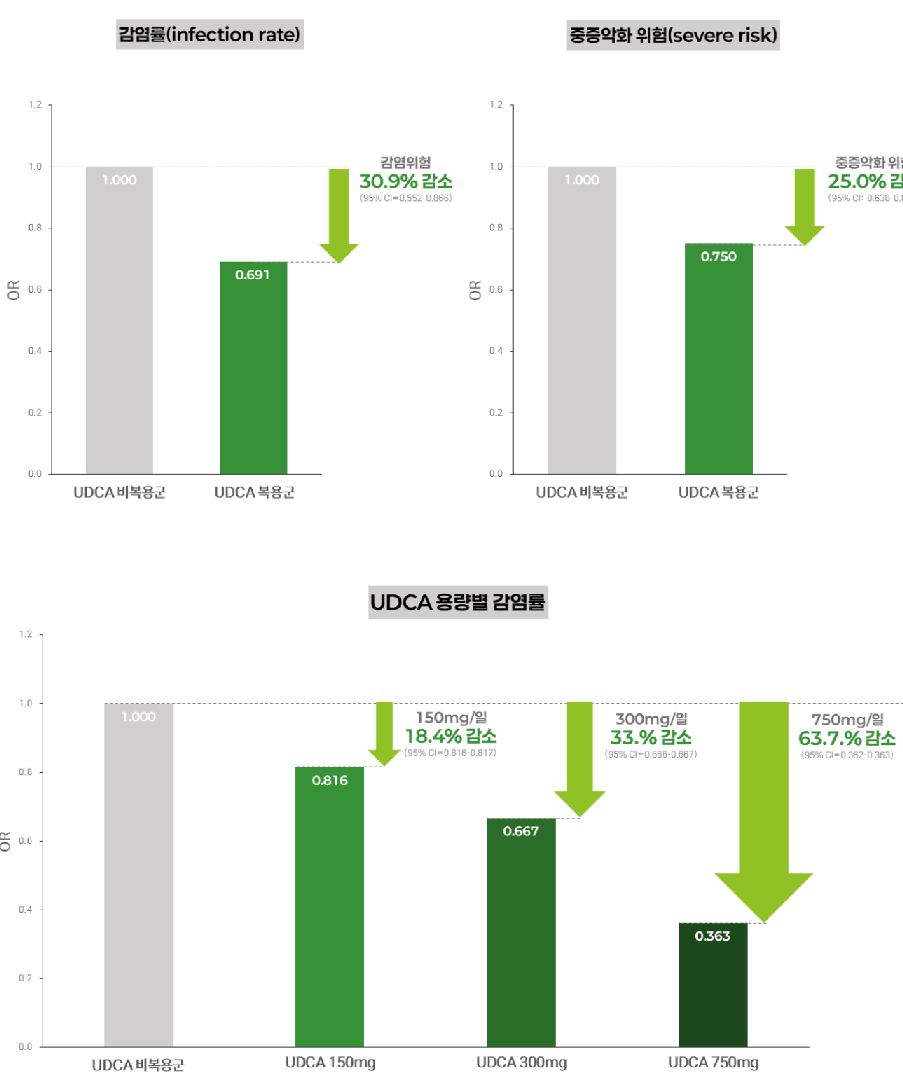 "우루사 주성분 UDCA, 코로나 감염 최대 64% 낮춘다"[데일리팜=이석준 기자] 국민 간장약 우루사의 주성분 UDCA의 코로나19 예방 효과가 ‘글로벌’에서도 입증됐다.대웅제약(대표 이창재∙박성수)은 UDCA(우르소데옥시콜산)의 코로나19 감염 및 중증 악화 위험을 유의하게 낮추는 효과가 확인된 글로벌 데이터 분석 결과가 ‘KDDW 2025(제9차 소화기연관학회 국제 소화기 학술대회)’에서 발표됐다고 4일 밝혔다.KDDW는 국내 8개 소화기학회가 공동 주최하는 아시아 대표 소화기학 국제학술대회로, 매년 전 세계 35개국 2000명 이상 전문가들이 참여하는 권위 있는 학술 행사다.글로벌 데이터 통합 분석해 입증한 최초 사례이번 연구는 한국을 포함한 미국, 중국, 일본, 프랑스, 이탈리아 등 총 6개국의 코호트(71만 명) 데이터를 통합 분석해 UDCA의 코로나19 감염 및 중증 악화 억제 효과를 정량적으로 입증한 최초의 대규모 분석이다. 다국가 데이터를 기반으로 복용량이 증가할수록 감염 위험이 단계적으로 감소하는 경향을 확인하며 UDCA의 예방 효과에 대한 임상적 근거를 한층 강화했다.이러한 대규모 통합 결과는 기존 연구들의 흐름과도 일치한다. 영국 케임브리지대 연구팀은 2022년 국제학술지 네이처(Nature)에서 UDCA의 코로나19 감염 차단 기전을 규명한 바 있으며, 국내에서는 2024년 전북대학교병원과 동아대학교병원 연구팀이 대규모 코호트 연구를 통해 UDCA의 코로나19 감염과 중증 진행을 예방하는 효과를 입증한 바 있다.이번 연구 결과는 우수포스터상(Excellent Poster Award)을 수상하며 학술적, 임상적 가치를 모두 인정받았다. 대규모 데이터를 기반으로 한 방법론적 완성도와 ‘용량-반응’ 분석을 통해 향후 임상적 논의에 활용될 수 있는 중요한 실마리를 제공했다는 점에서 높은 평가를 받았다. 이번 연구는 11월 6~7일 열린 대한감염학회 추계학술대회에서도 초록이 채택돼 포스터 발표로 소개됐다.코로나19 감염 31% 감소, 중증 악화·인공호흡기 사용 25% 감소 확인건양대학교병원 허규찬 교수(연구책임자) 연구팀이 주도한 이번 연구에서, UDCA 복용군은 비복용군 대비 ▲COVID-19 감염 위험 31% 감소, ▲중증 악화 위험 25% 감소, ▲인공호흡기 사용 위험 25% 감소하는 결과를 보였다. 이는 통계적 측면뿐 아니라 임상적으로도 매우 중대한 감소폭이다. UDCA를 복용한 사람들이 그렇지 않은 사람들에 비해 코로나19에 걸릴 확률 자체가 현저히 낮아지며, 감염되더라도 중환자실 치료가 필요한 심각한 상황으로 진행될 가능성이 4분의 1가량 줄어든다는 의미다.용량 증가할수록 예방 효과 뚜렷... 최대 63.7% 감염률 낮춰특히 이번 연구의 가장 큰 차별점은 '용량-반응 메타분석'을 수행했다는 점이다. 복용량이 늘수록 감염률이 단계적으로 낮아지는 용량-반응 관계를 통계적으로 확인했다.연구에 따르면 ▲150mg 복용 시 감염률 18% 감소, ▲300mg에선 33% 감소, ▲750mg에선 64% 감소하는 것으로 나타났다. 연구진은 코로나19 예방을 목표로 할 경우, 최소 하루 300mg 이상의 용량을 복용할 때 예방 효과가 더욱 뚜렷해진다는 유의미한 기초 근거를 확인했다.특히 UDCA는 바이러스 자체가 아니라 우리 몸의 수용체(ACE2)를 타깃으로 하는 작용 기전을 가지고 있어서 바이러스 변이에 상대적으로 영향을 덜 받는다. 연구진도 "UDCA는 코로나19 바이러스의 세포 침투 경로인 ACE2 수용체 발현을 감소시켜 바이러스의 침투를 억제할 수 있다"고 설명했다. 또한 “UDCA는 경구 복용이 가능하고, 비용이 저렴하며, 약국에서도 쉽게 구할 수 있어 백신 접근성이 낮은 국가나 면역저하 환자군에게 현실적인 예방 수단이 될 수 있다”고 덧붙였다. 대웅제약 관계자는 “이번 연구는 전 세계 6개국, 71만 명의 데이터를 통합해 UDCA의 코로나19 예방 가능성과 중증화 억제 효과를 대규모 메타분석을 통해 확인한 첫 글로벌 사례다. 효과와 안전성이 오랜 시간 검증된 UDCA가 감염병 대응의 새로운 솔루션으로 잠재력을 보여준 점이 주목할 만하다”고 전했다.2025-12-04 11:48:45이석준 기자
"우루사 주성분 UDCA, 코로나 감염 최대 64% 낮춘다"[데일리팜=이석준 기자] 국민 간장약 우루사의 주성분 UDCA의 코로나19 예방 효과가 ‘글로벌’에서도 입증됐다.대웅제약(대표 이창재∙박성수)은 UDCA(우르소데옥시콜산)의 코로나19 감염 및 중증 악화 위험을 유의하게 낮추는 효과가 확인된 글로벌 데이터 분석 결과가 ‘KDDW 2025(제9차 소화기연관학회 국제 소화기 학술대회)’에서 발표됐다고 4일 밝혔다.KDDW는 국내 8개 소화기학회가 공동 주최하는 아시아 대표 소화기학 국제학술대회로, 매년 전 세계 35개국 2000명 이상 전문가들이 참여하는 권위 있는 학술 행사다.글로벌 데이터 통합 분석해 입증한 최초 사례이번 연구는 한국을 포함한 미국, 중국, 일본, 프랑스, 이탈리아 등 총 6개국의 코호트(71만 명) 데이터를 통합 분석해 UDCA의 코로나19 감염 및 중증 악화 억제 효과를 정량적으로 입증한 최초의 대규모 분석이다. 다국가 데이터를 기반으로 복용량이 증가할수록 감염 위험이 단계적으로 감소하는 경향을 확인하며 UDCA의 예방 효과에 대한 임상적 근거를 한층 강화했다.이러한 대규모 통합 결과는 기존 연구들의 흐름과도 일치한다. 영국 케임브리지대 연구팀은 2022년 국제학술지 네이처(Nature)에서 UDCA의 코로나19 감염 차단 기전을 규명한 바 있으며, 국내에서는 2024년 전북대학교병원과 동아대학교병원 연구팀이 대규모 코호트 연구를 통해 UDCA의 코로나19 감염과 중증 진행을 예방하는 효과를 입증한 바 있다.이번 연구 결과는 우수포스터상(Excellent Poster Award)을 수상하며 학술적, 임상적 가치를 모두 인정받았다. 대규모 데이터를 기반으로 한 방법론적 완성도와 ‘용량-반응’ 분석을 통해 향후 임상적 논의에 활용될 수 있는 중요한 실마리를 제공했다는 점에서 높은 평가를 받았다. 이번 연구는 11월 6~7일 열린 대한감염학회 추계학술대회에서도 초록이 채택돼 포스터 발표로 소개됐다.코로나19 감염 31% 감소, 중증 악화·인공호흡기 사용 25% 감소 확인건양대학교병원 허규찬 교수(연구책임자) 연구팀이 주도한 이번 연구에서, UDCA 복용군은 비복용군 대비 ▲COVID-19 감염 위험 31% 감소, ▲중증 악화 위험 25% 감소, ▲인공호흡기 사용 위험 25% 감소하는 결과를 보였다. 이는 통계적 측면뿐 아니라 임상적으로도 매우 중대한 감소폭이다. UDCA를 복용한 사람들이 그렇지 않은 사람들에 비해 코로나19에 걸릴 확률 자체가 현저히 낮아지며, 감염되더라도 중환자실 치료가 필요한 심각한 상황으로 진행될 가능성이 4분의 1가량 줄어든다는 의미다.용량 증가할수록 예방 효과 뚜렷... 최대 63.7% 감염률 낮춰특히 이번 연구의 가장 큰 차별점은 '용량-반응 메타분석'을 수행했다는 점이다. 복용량이 늘수록 감염률이 단계적으로 낮아지는 용량-반응 관계를 통계적으로 확인했다.연구에 따르면 ▲150mg 복용 시 감염률 18% 감소, ▲300mg에선 33% 감소, ▲750mg에선 64% 감소하는 것으로 나타났다. 연구진은 코로나19 예방을 목표로 할 경우, 최소 하루 300mg 이상의 용량을 복용할 때 예방 효과가 더욱 뚜렷해진다는 유의미한 기초 근거를 확인했다.특히 UDCA는 바이러스 자체가 아니라 우리 몸의 수용체(ACE2)를 타깃으로 하는 작용 기전을 가지고 있어서 바이러스 변이에 상대적으로 영향을 덜 받는다. 연구진도 "UDCA는 코로나19 바이러스의 세포 침투 경로인 ACE2 수용체 발현을 감소시켜 바이러스의 침투를 억제할 수 있다"고 설명했다. 또한 “UDCA는 경구 복용이 가능하고, 비용이 저렴하며, 약국에서도 쉽게 구할 수 있어 백신 접근성이 낮은 국가나 면역저하 환자군에게 현실적인 예방 수단이 될 수 있다”고 덧붙였다. 대웅제약 관계자는 “이번 연구는 전 세계 6개국, 71만 명의 데이터를 통합해 UDCA의 코로나19 예방 가능성과 중증화 억제 효과를 대규모 메타분석을 통해 확인한 첫 글로벌 사례다. 효과와 안전성이 오랜 시간 검증된 UDCA가 감염병 대응의 새로운 솔루션으로 잠재력을 보여준 점이 주목할 만하다”고 전했다.2025-12-04 11:48:45이석준 기자 -
 2년 전 8천개 인하했는데...제약산업 발목잡는 약가 정책[데일리팜=천승현 기자] 제약사들은 정부의 반복된 약가인하 기조 정책이 산업 생태계를 위협하는 가장 큰 요인이라고 지적한다.제약사들은 5년 전 약가제도 전면 개편으로 수천개 의약품의 약가가 인하되면서 적잖은 손실을 감수했다. 뇌기능개선제 ‘콜린알포세레이트’ 임상재평가에 실패하면 기존 판매 금액도 환수한다는 압박에 많게는 수백억원 규모의 보이지 않는 부채를 떠안은 실정이다.정부의 급여재평가로 주력 캐시카우가 속속 퇴출되면서 지속적으로 예상치 못한 손실을 감수하는 현실이다. 최근에는 고환율로 원가 부담마저 커지면서 원가 압박이 커지는 상황에서 제네릭 약가가 또 다시 내려가면 기업 생존마저 위협받는다는 볼멘소리가 나온다.2020년 약가제도 개편 이후 8천여개 약가인하..."정부 정책, 지속적 손실 야기"제약사들이 정부의 약가제도 개편 움직임에 강한 저항을 갖는다. 정부 정책이 약가인하와 급여 삭제를 집중적으로 겨냥하면서 지속적으로 제약사들의 손실을 가중시킨다는 이유에서다.5년 전 제네릭 약가제도가 전면 개편되면서 2023년 9월과 지난해 3월 두 차례에 걸쳐 제네릭 8000여개 품목의 약가가 인하됐다.2023년 9월 5일부터 제네릭 7355개 품목의 약가가 최대 28.6% 인하됐다. 지난 2020년부터 추진한 제네릭 약가재평가의 1차 결과다. 지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 올해 2월말까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다.제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 개편 약가제도에서 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다. 한 가지 요건이 충족되지 않을 때마다 상한가는 15%씩 내려간다. 2개 요건 모두 충족하지 못하면 27.75% 인하되는 구조다. 당시 일부 제품은 기준 요건 2가지 미충족에 사용량 약가연동제에 따른 약가인하가 중복되면서 인하율이 27.75%를 초과했다.이때 총 179개 업체가 약가인하로 손실이 불가피했다. 한국휴텍스제약이 154개 품목이 약가인하 대상에 포함됐다. 하나제약과 대웅바이오가 각각 122개, 104개 품목이 약가가 내려갔고 일화는 101개 품목의 상한가가 인하됐다.2023년 9월 제네릭 약가재평가 결과 업체별 약가인하 품목 수(자료: 보건복지부)마더스제약, 셀트리온제약, 삼성제약, 한국글로벌제약, 이연제약, 메디카코리아, 보령바이오파마, 대한뉴팜, 동국제약, 아주약품, 건일바이오팜, 제일약품, 한국유니온제약, 동구바이오제약 등이 약가인하 제품이 80개가 넘었다.지난해 3월에는 제네릭 약가재평가의 두 번째 결과로 의약품 948개 품목의 약가가 최대 27.9% 떨어졌다. 제네릭 약가재평가 대상 중 주사제와 같은 무균제제 등 동등성시험 대상으로 새롭게 편입된 의약품에 대해 작년 3월 추가로 약가인하가 시행됐다.제네릭 약가재평가 2차 결과 제약사 156개 업체가 약가인하 의약품을 보유했다. 삼천당제약과 이연제약이 각각 23개 품목으로 가장 많았다. 국제약품과 신풍제약은 각각 21개 품목이 약가인하 대상에 포함됐다. 한국휴텍스제약은 19개 품목의 약가가 인하됐고 유니메드제약은 16개 품목이 인하 대상으로 분류됐다.2020년 7월 개편 약가인하가 시행됐고 기등재 의약품에도 새 약가제도로 적용하면서 4년 만에 총 8303개 품목의 약가가 떨어진 셈이다.업계 한 관계자는 “약가제도 개편으로 불과 2년 전에 수천개 품목의 약가가 인하됐는데 또 다시 제도를 개편하는 이유를 납득할 수 없다"라고 비판했다.4년간 급여재평가로 6개 성분 퇴출...제약사들, 캐시카우 상실로 실적 타격제약사들은 정부의 재평가 정책으로 지속적으로 수익성 하락 변수가 발생했다. 지난 2021년부터 4년 동안 진행한 급여 적정성 평가 결과 총 6개 품목이 건강보험 급여가 취소되면서 제약사들의 손실이 현실화했다.보건당국은 지난 2021년 급여재평가 결과 실리마린과 빌베리건조엑스는 급여적정성이 없는 것으로 결론 나면서 건강보험 급여 삭제가 결정됐다. 실리마린은 독성간질환, 간세포보호, 만성간염, 간경변 등에 사용되는 일반의약품이다. 빌베리건조엑스는 당뇨병에 의한 망막변성 및 눈의 혈관장애 개선에 사용되는 약물이다. 지난 2020년 기준 실리마린과 빌베리건조엑스는 각각 275억원, 287억원 규모의 외래 처방시장을 형성했다.지난 2022년부터 급여재평가 결과 스트렙토키나제·스트렙토도르나제(스트렙토제제), 옥시라세탐, 아세틸엘카르니틴 등의 성분에 대해 전 품목 급여 삭제가 결정됐다. 이중 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 식약처의 임상재평가를 통과하지 못하면서 처방 시장이 소멸했다. 지난 2020년 기준 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 총 732억원의 처방시장을 형성했다.지난해 급여재평가 결과 급여 삭제가 결정된 이토프리드도 처방 시장이 사라졌다. 이토프리드는 복부팽만, 상복부통, 식욕부진, 속쓰림, 구역, 구토 등 기능성소화불량으로 인한 소화기증상에 사용되는 의약품이다. 이토프리드는 지난해 221억원의 처방시장을 나타냈다. 매 분기 50억원대 처방시장을 형성했는데 올해 2월부터 소멸했다.제약사들은 록소프로펜의 급여 축소로 인한 손실도 감수한 상황이다. 록소프로펜은 ▲만성 류마티스관절염, 골관절염(퇴행관절염), 요통, 견관절주위염, 경견완증후군 등의 소염·진통 ▲수술 후, 외상 후 및 발치 후의 소염·진통 ▲급성 상기도염의 해열·진통 등에 사용되는 약물이다. 급성 상기도염의 해열·진통’ 적응증에 대해 급여 적정성이 없다고 결론 내리고 지난해부터 급여가 삭제됐다.록소프로펜은 지난 2021년 724억원의 처방시장을 형성했는데 2022년 1035억원으로 43.0% 치솟았고 2023년에는 1135억원으로 확대됐다. 지난해 록소프로펜 성분 외래 처방시장 규모는 총 833억원으로 전년대비 26.7% 감소하며 급여 축소 직격탄을 맞았다. 록소프로펜은 2023년 4분기 307억원의 처방액을 기록했는데 올해 들어 1분기 208억원, 2분기와 3분기에는 202억원, 204억원으로 쪼그라들었다.콜린알포 환수 대비 부채 인식...“정부 정책에 실적 손실 현실화”제약사들은 뇌기능개선제 ‘콜린알포세레이트’(콜린제제)의 임상재평가가 끝나지 않았는데도 이미 임상 실패를 가정한 부채를 인식한 상황이다. 정부 정책으로 가상 부채를 회계에 반영하는 이례적인 현상이다.금융감독원에 따르면 종근당, 대웅바이오, 한미약품, 알리코제약, 동구바이오제약, 국제약품, 동광약품, 경동제약, 제뉴파마, 동국제약, 환인제약 등이 콜린제제 임상실패를 대비한 환수 금액 추정치를 미리 부채 항목 등에 반영한 것으로 나타났다.콜린제제의 임상시험 실패시 발생할 수 있는 최악의 시나리오를 대비해 사전 대책 마련 움직임이다. 수익의 일부를 부채로 인식하면서 추후 일시적으로 발생할 수 있는 거액의 환수에 따른 피해를 최소화하겠다는 의도다. 일부 실적 공백을 감수하면서 임상 실패를 대비한 막대한 손실을 분산시키겠다는 고육책이다.콜린제제는 효능 논란이 불거지자 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사들은 재평가 임상시험에 착수했다.지난 2020년 복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 만약 제약사들의 콜린제제 재평가 임상시험이 실패로 결론나면 보건당국에 임상시험 기간 동안 올린 처방액 20%를 되돌려줘야 하는 상황이다.종근당은 지난 3분기 말 기준 비유동부채 항목에 환불부채 520억원을 인식했다. 회사 측은 “콜린알포세레이트제제의 유효성 입증을 위한 임상재평가 실패시 건강보험공단에 납부할 추정금액을 환불부채로 인식했다”라고 설명했다. 콜린제제 판매로 발생한 수익의 일부를 추후 환불할 것으로 예상되는 부채로 미리 인식했다는 의미다.대웅바이오는 콜린제제 임상재평가 실패시 납부할 금액 추정치를 장기선수금으로 인식한다. 선수금은 상품이나 서비스를 제공하기 전에 미리 받은 금액 부채에 해당한다. 지난해 말 대웅바이오의 기타비유동부채 중 장기선수금은 666억원에 달했다.동구바이오제약은 비유동부채 중 기타 비유동부채 항목에 콜린제제 환수액을 사전에 인식했다. 3분기 말 동구바이오제약의 기타 비유동부채는 139억원으로 설정됐다. 동구바이오제약은 “국민건강보험공단과의 '콜린알포세레이트'의 처방액의 일부 환수조건에 합의했으며 납부할 추정금액이 포함돼 있다. 임상재평가 결과에 따라 환수금액은 변동될 수 있다”라고 제시했다.알리코제약은 비유동부채 중 장기 환불부채에 콜린제제 환수금액 추정치를 선반영하고 있다. 알리코제약은 지난 9월 말 기준 비유동부채 장기환불부채 113억원을 인식했다.한미약품은 지난 상반기 말 기준 비유동부채 항목 중 계약부채 및 환불부채 35억원을 인식했다. 한미약품은 “콜리네이트연질캡슐 임상재평가 실패 시 국민건강보험공단으로 납부해야 할 금액 추정치에 해당한다”고 설명했다.국제약품은 비유동충당부채에 콜린제제 환수금액을 미리 반영했다. 국제약품은 “콜린알포세레이트 제제의 임상 재평가 실패시 처방액의 일정금액을 건강보험공단에서 환수 조치한다. 이에 회사는 납부해야 할 금액을 추정해 반영하고 있다”라고 소개했다. 지난 9월말 기준 국제약품의 비유동충당부채는 47억원 반영됐다.동광제약, 경동제약, 제뉴파마, 동국제약, 환인제약 등도 수십억원 규모의 콜린제제 환수금액을 사전에 부채 항목 등에 선인식했다.콜린제제의 지난해 콜린제제의 외래 처방금액은 6123억원으로 집계됐다. 올해 3분기 누적 처방 시장 규모는 4419억원으로 나타났다. 최근 시장 성장세는 주춤했지만 여전히 3개월 처방액이 1500억원에 육박하는 초대형 시장을 형성했다.만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 계산이 나온다. 이 경우 제약사들의 환수 금액은 5000억원 이상으로 추산된다. 제약사 입장에선 실적 손실을 감수하면서도 콜린제제의 수익금 일부를 미리 반영하면서 최악의 상황을 대비할 수 밖에 없는 처지다. 제약사들은 콜린제제의 허가가 효력을 유지하는 상황에서 재평가 임상시험 실패로 막대한 금액을 부담하는 것은 납득하기 어렵다는 인식이 팽배하다.고환율로 원가 부담 가중...제약사들 “약가인하시 치명적 타격 불가피”제약사들은 최근 고환율로 원가 부담에 가중되는 상황에서 제네릭 약가기준이 더욱 낮아지면 치명적인 손실을 초래할 것이란 우려가 팽배하다.지난 25일 서울 외환시장에서 원·달러 환율은 1472.9원을 기록했다. 지난해 10월 2일 1306.9원과 비교하면 1년 만에 13.1% 상승했다. 원달러 환율은 달러당 1500원 선을 위협할 정도로 최근 고공행진이 이어지고 있다.원화 가치 하락은 제약사들의 원가 상승 압박으로 이어진다. 제약사들은 의약품의 핵심 원자재인 원료의약품의 수입 의존도가 높아 원달러 환율 상승은 원가 인상으로 직결된다.국내 기업의 수입 의존도가 가장 높은 중국 원료의약품을 구매할 때에도 달러를 사용하기 때문에 원달러 환율 상승의 영향을 받을 수밖에 없다. 수입 규모가 큰 인도산 원료의약품도 달러로 거래가 이뤄지는 것으로 전해졌다.지난해 원료의약품 자급도는 31.4%로 2023년 25.4%보다 6%포인트 상승했다. 작년 평균 원 달러 환율 1367원을 적용해 계산한 값이다. 자급도는 국내 생산 제품이 전체 시장에서 차지하는 비율을 말한다. 국내 시장 규모(생산-수출+수입)에서 국내 생산 제품의 국내 사용량(생산-수출)의 비중이다.국내 원료의약품 자급도는 2020년 36.5%를 기록한 이후 2021년 24.4%, 2022년 11.9%로 급감했는데 2023년 25.4%로 3년 만에 반등했고 2년 연속 상승세를 이어갔다.지난해 원료의약품 자급도는 전년대비 반등했지만 국내 사용 69.6%가 수입 제품이라는 점에서 여전히 수입 원료의약품 의존도가 높다는 지적이 나온다.국내 기업의 원료의약품 생산 규모가 매년 증가하고 있지만 원가 절감을 위해 저렴한 수입 제품을 사용하면서 낮은 자급도가 고착화했다. 정부의 반복된 약가인하 정책이 제약사들의 저렴한 수입 원료의약품 사용 동력으로 작용한다는 지적이 꾸준히 제기됐다.달러 강세는 수출이 많은 원료의약품 업체에도 영향을 미칠 수 있다. 국내 기업은 기초 물질을 수입·가공해 원료의약품을 생산한 이후 해외에 수출하는 사례가 많다는 게 업계 관계자들의 설명이다. 원달러 상승으로 기초 물질 수입 가격이 상승하면 국내 생산 원료의약품의 원가도 열악해지는 구조다.최근 달러 초강세로 제약사들은 더욱 원가 압박에 시달리고 있지만 다른 소비재와는 달리 완제의약품의 가격을 올릴 수도 없어 체감하는 걱정은 더욱 크다.건강보험 의약품의 보험상한가는 원가 가격이 상승하더라도 제약사가 자발적으로 보험상한가를 인상할 수 없는 구조다. 퇴장방지의약품에 한해 정부가 원가 보전 차원에서 보험약가를 올려줄 수 있다. 다른 약물에 비해 가격이 낮아 품절이 빈번하게 발생하거나 원가 압박으로 제약사가 생산·수입을 기피해 임상진료에 지장을 초래하는 의약품은 퇴장방지의약품으로 지정될 수 있다.업계 한 관계자는 “최근 고환율로 원가 압박이 감당하기 힘든 수준으로 거세지는 상황이다”라면서 “지난 몇 년간 약가 규제로 수익성이 크게 악화했는데 또 다시 제네릭 약가기준이 낮아지면 제약사들은 기업 존폐마저 걱정해야 하는 처지다”라고 토로했다.약가제도 개편과 위기의 제약업계(2)2025-11-26 06:13:36천승현
2년 전 8천개 인하했는데...제약산업 발목잡는 약가 정책[데일리팜=천승현 기자] 제약사들은 정부의 반복된 약가인하 기조 정책이 산업 생태계를 위협하는 가장 큰 요인이라고 지적한다.제약사들은 5년 전 약가제도 전면 개편으로 수천개 의약품의 약가가 인하되면서 적잖은 손실을 감수했다. 뇌기능개선제 ‘콜린알포세레이트’ 임상재평가에 실패하면 기존 판매 금액도 환수한다는 압박에 많게는 수백억원 규모의 보이지 않는 부채를 떠안은 실정이다.정부의 급여재평가로 주력 캐시카우가 속속 퇴출되면서 지속적으로 예상치 못한 손실을 감수하는 현실이다. 최근에는 고환율로 원가 부담마저 커지면서 원가 압박이 커지는 상황에서 제네릭 약가가 또 다시 내려가면 기업 생존마저 위협받는다는 볼멘소리가 나온다.2020년 약가제도 개편 이후 8천여개 약가인하..."정부 정책, 지속적 손실 야기"제약사들이 정부의 약가제도 개편 움직임에 강한 저항을 갖는다. 정부 정책이 약가인하와 급여 삭제를 집중적으로 겨냥하면서 지속적으로 제약사들의 손실을 가중시킨다는 이유에서다.5년 전 제네릭 약가제도가 전면 개편되면서 2023년 9월과 지난해 3월 두 차례에 걸쳐 제네릭 8000여개 품목의 약가가 인하됐다.2023년 9월 5일부터 제네릭 7355개 품목의 약가가 최대 28.6% 인하됐다. 지난 2020년부터 추진한 제네릭 약가재평가의 1차 결과다. 지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 올해 2월말까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다.제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 개편 약가제도에서 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다. 한 가지 요건이 충족되지 않을 때마다 상한가는 15%씩 내려간다. 2개 요건 모두 충족하지 못하면 27.75% 인하되는 구조다. 당시 일부 제품은 기준 요건 2가지 미충족에 사용량 약가연동제에 따른 약가인하가 중복되면서 인하율이 27.75%를 초과했다.이때 총 179개 업체가 약가인하로 손실이 불가피했다. 한국휴텍스제약이 154개 품목이 약가인하 대상에 포함됐다. 하나제약과 대웅바이오가 각각 122개, 104개 품목이 약가가 내려갔고 일화는 101개 품목의 상한가가 인하됐다.2023년 9월 제네릭 약가재평가 결과 업체별 약가인하 품목 수(자료: 보건복지부)마더스제약, 셀트리온제약, 삼성제약, 한국글로벌제약, 이연제약, 메디카코리아, 보령바이오파마, 대한뉴팜, 동국제약, 아주약품, 건일바이오팜, 제일약품, 한국유니온제약, 동구바이오제약 등이 약가인하 제품이 80개가 넘었다.지난해 3월에는 제네릭 약가재평가의 두 번째 결과로 의약품 948개 품목의 약가가 최대 27.9% 떨어졌다. 제네릭 약가재평가 대상 중 주사제와 같은 무균제제 등 동등성시험 대상으로 새롭게 편입된 의약품에 대해 작년 3월 추가로 약가인하가 시행됐다.제네릭 약가재평가 2차 결과 제약사 156개 업체가 약가인하 의약품을 보유했다. 삼천당제약과 이연제약이 각각 23개 품목으로 가장 많았다. 국제약품과 신풍제약은 각각 21개 품목이 약가인하 대상에 포함됐다. 한국휴텍스제약은 19개 품목의 약가가 인하됐고 유니메드제약은 16개 품목이 인하 대상으로 분류됐다.2020년 7월 개편 약가인하가 시행됐고 기등재 의약품에도 새 약가제도로 적용하면서 4년 만에 총 8303개 품목의 약가가 떨어진 셈이다.업계 한 관계자는 “약가제도 개편으로 불과 2년 전에 수천개 품목의 약가가 인하됐는데 또 다시 제도를 개편하는 이유를 납득할 수 없다"라고 비판했다.4년간 급여재평가로 6개 성분 퇴출...제약사들, 캐시카우 상실로 실적 타격제약사들은 정부의 재평가 정책으로 지속적으로 수익성 하락 변수가 발생했다. 지난 2021년부터 4년 동안 진행한 급여 적정성 평가 결과 총 6개 품목이 건강보험 급여가 취소되면서 제약사들의 손실이 현실화했다.보건당국은 지난 2021년 급여재평가 결과 실리마린과 빌베리건조엑스는 급여적정성이 없는 것으로 결론 나면서 건강보험 급여 삭제가 결정됐다. 실리마린은 독성간질환, 간세포보호, 만성간염, 간경변 등에 사용되는 일반의약품이다. 빌베리건조엑스는 당뇨병에 의한 망막변성 및 눈의 혈관장애 개선에 사용되는 약물이다. 지난 2020년 기준 실리마린과 빌베리건조엑스는 각각 275억원, 287억원 규모의 외래 처방시장을 형성했다.지난 2022년부터 급여재평가 결과 스트렙토키나제·스트렙토도르나제(스트렙토제제), 옥시라세탐, 아세틸엘카르니틴 등의 성분에 대해 전 품목 급여 삭제가 결정됐다. 이중 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 식약처의 임상재평가를 통과하지 못하면서 처방 시장이 소멸했다. 지난 2020년 기준 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 총 732억원의 처방시장을 형성했다.지난해 급여재평가 결과 급여 삭제가 결정된 이토프리드도 처방 시장이 사라졌다. 이토프리드는 복부팽만, 상복부통, 식욕부진, 속쓰림, 구역, 구토 등 기능성소화불량으로 인한 소화기증상에 사용되는 의약품이다. 이토프리드는 지난해 221억원의 처방시장을 나타냈다. 매 분기 50억원대 처방시장을 형성했는데 올해 2월부터 소멸했다.제약사들은 록소프로펜의 급여 축소로 인한 손실도 감수한 상황이다. 록소프로펜은 ▲만성 류마티스관절염, 골관절염(퇴행관절염), 요통, 견관절주위염, 경견완증후군 등의 소염·진통 ▲수술 후, 외상 후 및 발치 후의 소염·진통 ▲급성 상기도염의 해열·진통 등에 사용되는 약물이다. 급성 상기도염의 해열·진통’ 적응증에 대해 급여 적정성이 없다고 결론 내리고 지난해부터 급여가 삭제됐다.록소프로펜은 지난 2021년 724억원의 처방시장을 형성했는데 2022년 1035억원으로 43.0% 치솟았고 2023년에는 1135억원으로 확대됐다. 지난해 록소프로펜 성분 외래 처방시장 규모는 총 833억원으로 전년대비 26.7% 감소하며 급여 축소 직격탄을 맞았다. 록소프로펜은 2023년 4분기 307억원의 처방액을 기록했는데 올해 들어 1분기 208억원, 2분기와 3분기에는 202억원, 204억원으로 쪼그라들었다.콜린알포 환수 대비 부채 인식...“정부 정책에 실적 손실 현실화”제약사들은 뇌기능개선제 ‘콜린알포세레이트’(콜린제제)의 임상재평가가 끝나지 않았는데도 이미 임상 실패를 가정한 부채를 인식한 상황이다. 정부 정책으로 가상 부채를 회계에 반영하는 이례적인 현상이다.금융감독원에 따르면 종근당, 대웅바이오, 한미약품, 알리코제약, 동구바이오제약, 국제약품, 동광약품, 경동제약, 제뉴파마, 동국제약, 환인제약 등이 콜린제제 임상실패를 대비한 환수 금액 추정치를 미리 부채 항목 등에 반영한 것으로 나타났다.콜린제제의 임상시험 실패시 발생할 수 있는 최악의 시나리오를 대비해 사전 대책 마련 움직임이다. 수익의 일부를 부채로 인식하면서 추후 일시적으로 발생할 수 있는 거액의 환수에 따른 피해를 최소화하겠다는 의도다. 일부 실적 공백을 감수하면서 임상 실패를 대비한 막대한 손실을 분산시키겠다는 고육책이다.콜린제제는 효능 논란이 불거지자 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사들은 재평가 임상시험에 착수했다.지난 2020년 복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 만약 제약사들의 콜린제제 재평가 임상시험이 실패로 결론나면 보건당국에 임상시험 기간 동안 올린 처방액 20%를 되돌려줘야 하는 상황이다.종근당은 지난 3분기 말 기준 비유동부채 항목에 환불부채 520억원을 인식했다. 회사 측은 “콜린알포세레이트제제의 유효성 입증을 위한 임상재평가 실패시 건강보험공단에 납부할 추정금액을 환불부채로 인식했다”라고 설명했다. 콜린제제 판매로 발생한 수익의 일부를 추후 환불할 것으로 예상되는 부채로 미리 인식했다는 의미다.대웅바이오는 콜린제제 임상재평가 실패시 납부할 금액 추정치를 장기선수금으로 인식한다. 선수금은 상품이나 서비스를 제공하기 전에 미리 받은 금액 부채에 해당한다. 지난해 말 대웅바이오의 기타비유동부채 중 장기선수금은 666억원에 달했다.동구바이오제약은 비유동부채 중 기타 비유동부채 항목에 콜린제제 환수액을 사전에 인식했다. 3분기 말 동구바이오제약의 기타 비유동부채는 139억원으로 설정됐다. 동구바이오제약은 “국민건강보험공단과의 '콜린알포세레이트'의 처방액의 일부 환수조건에 합의했으며 납부할 추정금액이 포함돼 있다. 임상재평가 결과에 따라 환수금액은 변동될 수 있다”라고 제시했다.알리코제약은 비유동부채 중 장기 환불부채에 콜린제제 환수금액 추정치를 선반영하고 있다. 알리코제약은 지난 9월 말 기준 비유동부채 장기환불부채 113억원을 인식했다.한미약품은 지난 상반기 말 기준 비유동부채 항목 중 계약부채 및 환불부채 35억원을 인식했다. 한미약품은 “콜리네이트연질캡슐 임상재평가 실패 시 국민건강보험공단으로 납부해야 할 금액 추정치에 해당한다”고 설명했다.국제약품은 비유동충당부채에 콜린제제 환수금액을 미리 반영했다. 국제약품은 “콜린알포세레이트 제제의 임상 재평가 실패시 처방액의 일정금액을 건강보험공단에서 환수 조치한다. 이에 회사는 납부해야 할 금액을 추정해 반영하고 있다”라고 소개했다. 지난 9월말 기준 국제약품의 비유동충당부채는 47억원 반영됐다.동광제약, 경동제약, 제뉴파마, 동국제약, 환인제약 등도 수십억원 규모의 콜린제제 환수금액을 사전에 부채 항목 등에 선인식했다.콜린제제의 지난해 콜린제제의 외래 처방금액은 6123억원으로 집계됐다. 올해 3분기 누적 처방 시장 규모는 4419억원으로 나타났다. 최근 시장 성장세는 주춤했지만 여전히 3개월 처방액이 1500억원에 육박하는 초대형 시장을 형성했다.만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 계산이 나온다. 이 경우 제약사들의 환수 금액은 5000억원 이상으로 추산된다. 제약사 입장에선 실적 손실을 감수하면서도 콜린제제의 수익금 일부를 미리 반영하면서 최악의 상황을 대비할 수 밖에 없는 처지다. 제약사들은 콜린제제의 허가가 효력을 유지하는 상황에서 재평가 임상시험 실패로 막대한 금액을 부담하는 것은 납득하기 어렵다는 인식이 팽배하다.고환율로 원가 부담 가중...제약사들 “약가인하시 치명적 타격 불가피”제약사들은 최근 고환율로 원가 부담에 가중되는 상황에서 제네릭 약가기준이 더욱 낮아지면 치명적인 손실을 초래할 것이란 우려가 팽배하다.지난 25일 서울 외환시장에서 원·달러 환율은 1472.9원을 기록했다. 지난해 10월 2일 1306.9원과 비교하면 1년 만에 13.1% 상승했다. 원달러 환율은 달러당 1500원 선을 위협할 정도로 최근 고공행진이 이어지고 있다.원화 가치 하락은 제약사들의 원가 상승 압박으로 이어진다. 제약사들은 의약품의 핵심 원자재인 원료의약품의 수입 의존도가 높아 원달러 환율 상승은 원가 인상으로 직결된다.국내 기업의 수입 의존도가 가장 높은 중국 원료의약품을 구매할 때에도 달러를 사용하기 때문에 원달러 환율 상승의 영향을 받을 수밖에 없다. 수입 규모가 큰 인도산 원료의약품도 달러로 거래가 이뤄지는 것으로 전해졌다.지난해 원료의약품 자급도는 31.4%로 2023년 25.4%보다 6%포인트 상승했다. 작년 평균 원 달러 환율 1367원을 적용해 계산한 값이다. 자급도는 국내 생산 제품이 전체 시장에서 차지하는 비율을 말한다. 국내 시장 규모(생산-수출+수입)에서 국내 생산 제품의 국내 사용량(생산-수출)의 비중이다.국내 원료의약품 자급도는 2020년 36.5%를 기록한 이후 2021년 24.4%, 2022년 11.9%로 급감했는데 2023년 25.4%로 3년 만에 반등했고 2년 연속 상승세를 이어갔다.지난해 원료의약품 자급도는 전년대비 반등했지만 국내 사용 69.6%가 수입 제품이라는 점에서 여전히 수입 원료의약품 의존도가 높다는 지적이 나온다.국내 기업의 원료의약품 생산 규모가 매년 증가하고 있지만 원가 절감을 위해 저렴한 수입 제품을 사용하면서 낮은 자급도가 고착화했다. 정부의 반복된 약가인하 정책이 제약사들의 저렴한 수입 원료의약품 사용 동력으로 작용한다는 지적이 꾸준히 제기됐다.달러 강세는 수출이 많은 원료의약품 업체에도 영향을 미칠 수 있다. 국내 기업은 기초 물질을 수입·가공해 원료의약품을 생산한 이후 해외에 수출하는 사례가 많다는 게 업계 관계자들의 설명이다. 원달러 상승으로 기초 물질 수입 가격이 상승하면 국내 생산 원료의약품의 원가도 열악해지는 구조다.최근 달러 초강세로 제약사들은 더욱 원가 압박에 시달리고 있지만 다른 소비재와는 달리 완제의약품의 가격을 올릴 수도 없어 체감하는 걱정은 더욱 크다.건강보험 의약품의 보험상한가는 원가 가격이 상승하더라도 제약사가 자발적으로 보험상한가를 인상할 수 없는 구조다. 퇴장방지의약품에 한해 정부가 원가 보전 차원에서 보험약가를 올려줄 수 있다. 다른 약물에 비해 가격이 낮아 품절이 빈번하게 발생하거나 원가 압박으로 제약사가 생산·수입을 기피해 임상진료에 지장을 초래하는 의약품은 퇴장방지의약품으로 지정될 수 있다.업계 한 관계자는 “최근 고환율로 원가 압박이 감당하기 힘든 수준으로 거세지는 상황이다”라면서 “지난 몇 년간 약가 규제로 수익성이 크게 악화했는데 또 다시 제네릭 약가기준이 낮아지면 제약사들은 기업 존폐마저 걱정해야 하는 처지다”라고 토로했다.약가제도 개편과 위기의 제약업계(2)2025-11-26 06:13:36천승현 -
대웅제약 브이올렛, 中서 임상 사례 첫 공개…글로벌 공략AMWC CHINA 2025 브이올렛 부스 운영되 모습 [데일리팜=황병우 기자] 대웅제약이 지방파괴주사제 브이올렛을 중국 최대 규모 미용·성형학회에서 처음으로 소개하며 글로벌 진출을 본격화한다.대웅제약은 지난달 17일 중국 청두에서 열린 AMWC CHINA 2025에서 브이올렛 사이언티픽 포럼(V-OLET Scientific forum)을 열고 중국 및 글로벌 의료진에게 브이올렛의 임상 데이터와 차별점, 시술 사례를 공개했다고 18일 밝혔다.브이올렛은 지난 21년 대웅제약이 국내에 출시한 데옥시콜산(DCA) 성분 지방파괴주사제로, 국내에서 유일하게 960명 이상이 참여한 대규모 임상 3상과 시판후조사(PMS) 등을 통해 안전성과 유효성이 검증됐다.최근엔 위고비·마운자로 등 GLP-1을 통한 체중 감량 후 턱밑, 팔뚝 등 국소 부위 라인을 아름답게 가꾸고자 하는 ‘마이크로 뷰티’ 트렌드가 확산되면서 반영구적인 지방파괴와 콜라겐 생성 기전을 통해 정교한 라인 관리가 가능한 브이올렛에 대한 관심이 높아지고 있는 추세다.이번 AMWC CHINA 2025에는 중국 현지 의료진 포함 200여명의 글로벌 연자와 200곳 이상의 기업이 참여했으며, 대웅제약은 포럼 개최와 부스 운영을 통해 글로벌 시장으로 브이올렛을 확장하는 교두보로 삼는다는 계획이다.한편, 이날 행사에선 우선 AMWC CHINA 임원인 왕항(Wang Hang) 사천대 성형외과 교수가 좌장을 맡아 중국 지방분해 시장의 동향과 브이올렛의 차별화 포인트를 소개하는 환영사를 진행했다.이어 고범준 닥터스피부과 신사점 원장이 국내 브이올렛 임상 3상 결과와 환자 사례를 발표하며, 한국의 다년간 축적된 임상 데이터를 바탕으로 브이올렛의 효과와 안전성을 강조했다. 리쉐(Li Xue) ARSMO 하이난 원장도 연자로 참여해 현지 의료진들의 높은 관심을 받았다.윤준수 대웅제약 나보타사업본부장은 "이번 AMWC CHINA 2025는 브이올렛이 한국을 넘어 글로벌 시장으로 나아가는 첫 무대이자, 국내외 의료진이 함께 그 가능성을 확인한 뜻 깊은 자리였다"며 "앞으로 브이올렛은 나보타와 함께 대웅제약의 글로벌 메디컬 에스테틱 포트폴리오를 이끌어갈 블록버스터 브랜드로 성장할 것"이라고 밝혔다.2025-11-18 09:32:05황병우
-
 "성분·함량 최대"…아연 보강 아로나민골드액티브 허가[데일리팜=이탁순 기자] 성분과 함량을 최대로 한 아로나민골드 시리즈의 끝판왕이 허가를 받았다.일동은 일주일 새 아로나민골드 신제품 2개를 선보이며, 향후 라인업 강화를 예고했다.식품의약품안전처는 14일 일동제약 아로나민골드액티브정(일반의약품)을 품목 허가했다. 이 약은 비타민 D, E, B1, B2, B6, C를 보급하며, 아연 보충 효능·효과도 가지고 있다.지금껏 허가된 아로나민골드 제품 가운데 아연 보급 효능·효과는 이 제품이 처음이다. 아연은 면역력 강화, 세포 발달에 중요한 역할을 하는 필수 미네랄로, 아로나민골드액티브에는 산화아연 18.69mg이 함유돼 있다.이 뿐만이 아니다. 간세포 보호 기능이 있는 우르소데옥시콜산, 강력한 항산화 작용을 하는 셀레늄함유건조효모, 비타민B6 일종인 피리독신염산염이 아로나민 시리즈 가운데 처음으로 함유됐다.비타민B1 푸르설티아민과 비타민B2 리보플라빈부티레이트 등 아로나민 시리즈에 함유된 공용 비타민B군도 최대 함량이 들어갔다. 지난 5일 허가받은 '아로나민골드원'처럼 체내에서 별도 전환 과정 없이 바로 작용해 효과가 빠르다는 장점이 있는 비타민B12 일종인 메코발라민이 함유된 것도 특징이다.이번 아로나민골드액티브정 허가로 아로나민골드 시리즈만 4개로 늘었다. 아로나민골드원과 아로나민골드액티브가 향후 출시되면 아로나민골드 시리즈를 세분화해 다양한 연령층에 어필할 것으로 보인다.현재 판매되고 있는 아로나민 제품군은 아로나민골드와 아로나민골드프리미엄, 아로나민씨플러스, 아로나민이맥스플러스, 아로나민케어콤플렉스, 아로나민실버프리미엄, 아로나민케어디엠 등 7종에 달한다. 작년 아로나민류 매출액은 622억원이다.2025-11-14 16:50:54이탁순
"성분·함량 최대"…아연 보강 아로나민골드액티브 허가[데일리팜=이탁순 기자] 성분과 함량을 최대로 한 아로나민골드 시리즈의 끝판왕이 허가를 받았다.일동은 일주일 새 아로나민골드 신제품 2개를 선보이며, 향후 라인업 강화를 예고했다.식품의약품안전처는 14일 일동제약 아로나민골드액티브정(일반의약품)을 품목 허가했다. 이 약은 비타민 D, E, B1, B2, B6, C를 보급하며, 아연 보충 효능·효과도 가지고 있다.지금껏 허가된 아로나민골드 제품 가운데 아연 보급 효능·효과는 이 제품이 처음이다. 아연은 면역력 강화, 세포 발달에 중요한 역할을 하는 필수 미네랄로, 아로나민골드액티브에는 산화아연 18.69mg이 함유돼 있다.이 뿐만이 아니다. 간세포 보호 기능이 있는 우르소데옥시콜산, 강력한 항산화 작용을 하는 셀레늄함유건조효모, 비타민B6 일종인 피리독신염산염이 아로나민 시리즈 가운데 처음으로 함유됐다.비타민B1 푸르설티아민과 비타민B2 리보플라빈부티레이트 등 아로나민 시리즈에 함유된 공용 비타민B군도 최대 함량이 들어갔다. 지난 5일 허가받은 '아로나민골드원'처럼 체내에서 별도 전환 과정 없이 바로 작용해 효과가 빠르다는 장점이 있는 비타민B12 일종인 메코발라민이 함유된 것도 특징이다.이번 아로나민골드액티브정 허가로 아로나민골드 시리즈만 4개로 늘었다. 아로나민골드원과 아로나민골드액티브가 향후 출시되면 아로나민골드 시리즈를 세분화해 다양한 연령층에 어필할 것으로 보인다.현재 판매되고 있는 아로나민 제품군은 아로나민골드와 아로나민골드프리미엄, 아로나민씨플러스, 아로나민이맥스플러스, 아로나민케어콤플렉스, 아로나민실버프리미엄, 아로나민케어디엠 등 7종에 달한다. 작년 아로나민류 매출액은 622억원이다.2025-11-14 16:50:54이탁순 -
 동국제약, 턱밑 지방 주사제 ‘밀리핏’ 심포지엄 개최[데일리팜=최다은 기자] 동국제약은 턱밑 지방 개선 주사제 ‘밀리핏(Millifit)’ 출시를 기념해 지난 11일 서울 이태원 몬드리안 호텔에서 의료진 대상 심포지엄을 개최했다고 밝혔다.‘밀리핏’(성분명: 데옥시콜산, DCA)은 2025년 식품의약품안전처로부터 허가받은 국내 첫 턱밑 지방 개선 주사제로, 동국제약의 메디컬 에스테틱 브랜드 ‘dkma’ 라인업 중 하나로 올해 9월 국내 시장에 새롭게 선보였다. 이번 심포지엄은 제품 특장점과 임상적 근거를 공유하고, 의료 현장에서의 시술 경험을 나누는 교류의 장으로 마련됐다. 행사에서는 김연진 대표원장(연세라인업의원)과 이명준 대표원장(리스토리성형외과)이 ‘안전하고 효과적인 시너지 DCA 시술 경험’을 주제로 강연을 진행했으며, 참석한 의료진들과의 질의응답을 통해 다양한 시술 노하우를 공유했다.김기보 동국제약 상무이사는 “이번 심포지엄을 시작으로 ‘밀리핏’의 안전성과 임상적 유효성을 입증하는 다양한 학술 활동을 지속적으로 추진할 예정”이라며, “앞으로도 ‘밀리핏’을 비롯한 동국제약의 메디컬 에스테틱 제품군을 통해 의료진에게 새로운 시술 솔루션을 제공하고, 환자들의 만족도를 높이는 데 기여하겠다”고 말했다.2025-11-11 09:56:30최다은
동국제약, 턱밑 지방 주사제 ‘밀리핏’ 심포지엄 개최[데일리팜=최다은 기자] 동국제약은 턱밑 지방 개선 주사제 ‘밀리핏(Millifit)’ 출시를 기념해 지난 11일 서울 이태원 몬드리안 호텔에서 의료진 대상 심포지엄을 개최했다고 밝혔다.‘밀리핏’(성분명: 데옥시콜산, DCA)은 2025년 식품의약품안전처로부터 허가받은 국내 첫 턱밑 지방 개선 주사제로, 동국제약의 메디컬 에스테틱 브랜드 ‘dkma’ 라인업 중 하나로 올해 9월 국내 시장에 새롭게 선보였다. 이번 심포지엄은 제품 특장점과 임상적 근거를 공유하고, 의료 현장에서의 시술 경험을 나누는 교류의 장으로 마련됐다. 행사에서는 김연진 대표원장(연세라인업의원)과 이명준 대표원장(리스토리성형외과)이 ‘안전하고 효과적인 시너지 DCA 시술 경험’을 주제로 강연을 진행했으며, 참석한 의료진들과의 질의응답을 통해 다양한 시술 노하우를 공유했다.김기보 동국제약 상무이사는 “이번 심포지엄을 시작으로 ‘밀리핏’의 안전성과 임상적 유효성을 입증하는 다양한 학술 활동을 지속적으로 추진할 예정”이라며, “앞으로도 ‘밀리핏’을 비롯한 동국제약의 메디컬 에스테틱 제품군을 통해 의료진에게 새로운 시술 솔루션을 제공하고, 환자들의 만족도를 높이는 데 기여하겠다”고 말했다.2025-11-11 09:56:30최다은 -
 제약 오너일가 잇단 장내매수…책임경영·승계 포석[데일리팜=이석준 기자] 제약사 오너일가의 장내매수가 이어지고 있다. 책임경영과 성장 자신감의 표현으로 풀이된다. 일부는 주가 방어와 지배력 강화, 승계 포석으로 해석된다. JW그룹 오너 4세 이기환(28)씨는 지주사 JW홀딩스 지분을 꾸준히 확대하고 있다. 10월만 봐도 2만9504주를 장내에서 매입하며 지분율을 4.34%(320만9356주)까지 끌어올렸다. 지주사 5% 돌파가 목전이다.이기환씨는 이경하 JW그룹 회장의 유일한 아들로, 지난해 초 지주사 경영지원본부에 입사했다.업계는 그의 입사를 경영수업의 일환으로 보고 있으며, 최근의 지분 매입은 후계 구도 정착과 책임경영 의지의 표현으로 해석하고 있다.JW그룹은 일찌감치 승계를 준비해온 기업으로 꼽힌다. 고(故) 이종호 명예회장은 70세 이전에 지분 증여 등 승계 절차를 마무리했다. 이경하 회장 역시 1986년 24세 나이에 그룹에 입사하며 일찌감치 경영 수업을 시작했다.류덕희(87) 경동제약 회장(창업주)도 장내매수에 나섰다. 지난 10월 24·27·30일 사흘에 걸쳐 총 7140주를 사들였다.경동제약은 퀀텀점프를 준비중이다. 올해 창립 50주년을 맞아 ‘PACE 2028’ 전략을 본격 가동했다. ▲성과(Performance) ▲가속(Acceleration) ▲도전(Courage) ▲효율성(Efficiency) 등 4대 키워드를 중심으로 글로벌 제약사 도약을 목표로 하고 있다.발판은 마련됐다. 회사는 2023년 영업방식을 CSO(영업대행)로 전환하며 한때 창립 첫 적자를 냈으나, 지난해 흑자 전환에 성공했다. 올해도 흑자를 유지하고 있다. 지난해는 헬스케어 신사업을 출범했다. 2030년까지 매출 5000억원 달성을 목표로 신공장 건설과 CDMO(위탁개발생산) 사업 확장도 추진 중이다.허승범(44) 삼일제약 회장도 10월 27일 1만600주(약 1억원 규모)를 장내에서 취득했다. 올해 들어서만 8만주 이상(약 10억원 규모)을 매입했다. 이로써 허 회장의 지분율은 8.2%까지 올랐다.허 회장의 지분 확대는 신약개발과 CDMO/CMO 사업에 대한 자신감으로 해석된다. 삼일제약은 국내 독점권을 보유한 골관절염 신약 ‘로어시비빈트’의 미국 FDA 허가 신청을 올해 4분기에 추진하고 있다.베트남 CMO 공장도 내년 본격 가동 예정이다. 해당 공장은 지난해 베트남 GMP와 WHO GMP 인증을 받았으며, 현재 한국 KGMP·미국 cGMP·유럽 EU-GMP 인증 절차를 진행 중이다. 삼일제약은 지난해말 대만 상장 제약사 포모사(Formosa)와 안과용 의약품 ‘APP 13007’ 생산 계약을 체결하며 첫 해외 수주를 확보했다.정현호(63) 메디톡스 대표 역시 11월 3일 자사주 2500주(약 3억원어치)를 장내에서 매입했다.메디톡스는 최근 세계 최초로 콜산 성분을 활용한 지방분해주사제 ‘뉴비쥬주’의 품목허가를 획득했다. 이는 국내에서 개발된 40번째 신약으로, 메디톡스의 첫 케미컬 신약이기도 하다.‘뉴비쥬’는 기존 데옥시콜산(DCA) 성분 제품 대비 계면활성 작용이 낮아 통증·부종·멍 등 이상반응을 줄인 것이 특징이다. 회사는 2018년 임상 1상을 시작해 7년 만에 품목허가를 받아냈다.임원급에서도 자사주 매입 움직임이 나타나고 있다.정준일 명문제약 상무는 최근 10만주를 장내에서 매입했다. 명문제약은 재무건전성 강화를 위한 체질 개선에 속도를 내고 있다.회사는 자회사 ‘더반골프클럽’ 매각을 추진 중이다. 수년간 적자를 이어온 골프장 사업을 정리해 현금 유입과 함께 재무구조 개선을 꾀한다는 계획이다.매각이 완료되면 단기차입금 상환→이자비용 절감→현금흐름 개선으로 이어지는 선순환 구조를 기대할 수 있다. 올 6월 말 기준 총차입금 950억원 중 단기차입금(유동성장기차입금 127억원 포함)은 538억원으로, 전체의 56.6%를 차지한다. 더반골프클럽 매각가는 500억~600억원 수준으로 거론된다.제약업계 관계자는 “오너일가와 경영진의 장내매수는 주가 방어 차원을 넘어 책임경영과 후계 구도 정착의 신호로 볼 수 있다. 지속적인 지분 확대는 시장과 기업 성장에 대한 자신감의 표현”이라고 말했다.2025-11-06 06:19:42이석준
제약 오너일가 잇단 장내매수…책임경영·승계 포석[데일리팜=이석준 기자] 제약사 오너일가의 장내매수가 이어지고 있다. 책임경영과 성장 자신감의 표현으로 풀이된다. 일부는 주가 방어와 지배력 강화, 승계 포석으로 해석된다. JW그룹 오너 4세 이기환(28)씨는 지주사 JW홀딩스 지분을 꾸준히 확대하고 있다. 10월만 봐도 2만9504주를 장내에서 매입하며 지분율을 4.34%(320만9356주)까지 끌어올렸다. 지주사 5% 돌파가 목전이다.이기환씨는 이경하 JW그룹 회장의 유일한 아들로, 지난해 초 지주사 경영지원본부에 입사했다.업계는 그의 입사를 경영수업의 일환으로 보고 있으며, 최근의 지분 매입은 후계 구도 정착과 책임경영 의지의 표현으로 해석하고 있다.JW그룹은 일찌감치 승계를 준비해온 기업으로 꼽힌다. 고(故) 이종호 명예회장은 70세 이전에 지분 증여 등 승계 절차를 마무리했다. 이경하 회장 역시 1986년 24세 나이에 그룹에 입사하며 일찌감치 경영 수업을 시작했다.류덕희(87) 경동제약 회장(창업주)도 장내매수에 나섰다. 지난 10월 24·27·30일 사흘에 걸쳐 총 7140주를 사들였다.경동제약은 퀀텀점프를 준비중이다. 올해 창립 50주년을 맞아 ‘PACE 2028’ 전략을 본격 가동했다. ▲성과(Performance) ▲가속(Acceleration) ▲도전(Courage) ▲효율성(Efficiency) 등 4대 키워드를 중심으로 글로벌 제약사 도약을 목표로 하고 있다.발판은 마련됐다. 회사는 2023년 영업방식을 CSO(영업대행)로 전환하며 한때 창립 첫 적자를 냈으나, 지난해 흑자 전환에 성공했다. 올해도 흑자를 유지하고 있다. 지난해는 헬스케어 신사업을 출범했다. 2030년까지 매출 5000억원 달성을 목표로 신공장 건설과 CDMO(위탁개발생산) 사업 확장도 추진 중이다.허승범(44) 삼일제약 회장도 10월 27일 1만600주(약 1억원 규모)를 장내에서 취득했다. 올해 들어서만 8만주 이상(약 10억원 규모)을 매입했다. 이로써 허 회장의 지분율은 8.2%까지 올랐다.허 회장의 지분 확대는 신약개발과 CDMO/CMO 사업에 대한 자신감으로 해석된다. 삼일제약은 국내 독점권을 보유한 골관절염 신약 ‘로어시비빈트’의 미국 FDA 허가 신청을 올해 4분기에 추진하고 있다.베트남 CMO 공장도 내년 본격 가동 예정이다. 해당 공장은 지난해 베트남 GMP와 WHO GMP 인증을 받았으며, 현재 한국 KGMP·미국 cGMP·유럽 EU-GMP 인증 절차를 진행 중이다. 삼일제약은 지난해말 대만 상장 제약사 포모사(Formosa)와 안과용 의약품 ‘APP 13007’ 생산 계약을 체결하며 첫 해외 수주를 확보했다.정현호(63) 메디톡스 대표 역시 11월 3일 자사주 2500주(약 3억원어치)를 장내에서 매입했다.메디톡스는 최근 세계 최초로 콜산 성분을 활용한 지방분해주사제 ‘뉴비쥬주’의 품목허가를 획득했다. 이는 국내에서 개발된 40번째 신약으로, 메디톡스의 첫 케미컬 신약이기도 하다.‘뉴비쥬’는 기존 데옥시콜산(DCA) 성분 제품 대비 계면활성 작용이 낮아 통증·부종·멍 등 이상반응을 줄인 것이 특징이다. 회사는 2018년 임상 1상을 시작해 7년 만에 품목허가를 받아냈다.임원급에서도 자사주 매입 움직임이 나타나고 있다.정준일 명문제약 상무는 최근 10만주를 장내에서 매입했다. 명문제약은 재무건전성 강화를 위한 체질 개선에 속도를 내고 있다.회사는 자회사 ‘더반골프클럽’ 매각을 추진 중이다. 수년간 적자를 이어온 골프장 사업을 정리해 현금 유입과 함께 재무구조 개선을 꾀한다는 계획이다.매각이 완료되면 단기차입금 상환→이자비용 절감→현금흐름 개선으로 이어지는 선순환 구조를 기대할 수 있다. 올 6월 말 기준 총차입금 950억원 중 단기차입금(유동성장기차입금 127억원 포함)은 538억원으로, 전체의 56.6%를 차지한다. 더반골프클럽 매각가는 500억~600억원 수준으로 거론된다.제약업계 관계자는 “오너일가와 경영진의 장내매수는 주가 방어 차원을 넘어 책임경영과 후계 구도 정착의 신호로 볼 수 있다. 지속적인 지분 확대는 시장과 기업 성장에 대한 자신감의 표현”이라고 말했다.2025-11-06 06:19:42이석준 -
 후발주자 등장으로 더 뜨거워지는 PDRN 일반약 시장[데일리팜=이탁순 기자] PDRN(폴리데옥시리노뷰크레오티드) 성분의 피부 재생 크림이 일반의약품 시장의 새로운 트렌드로 자리잡고 있습니다. 파마리처시치의 '리쥬비넥스크림'이 인기를 끌면서 후발주자들도 속속 시장에 진출하고 있습니다.국산 위식도역류질환 신약 자큐보는 제형을 추가해 이번에 구강붕해정 신제품을 허가받았습니다. 종근당은 고혈압 복합제 '텔미누보'의 라인업을 확장, 이번에 3제 복합제를 준비합니다.식품의약품안전처는 10월 총 86개의 품목을 허가했습니다. 신약은 없지만, 자료제출의약품이 17개나 나오는 등 기존 의약품을 활용한 제품 개발이 활발히 이어졌습니다.분석기간 (10.1~10.30)분석기간 (10.1~10.30) ◆일반의약품 = 10월 허가(신고)받은 일반의약품은 총 37개 품목으로, 자료제출의약품 1개 품목이 포함돼 있습니다. 표준제조기준으로 개발된 의약품은 19개 품목, 제네릭은 16개 품목으로 집계됐습니다.분석기간 (10.1~10.30) 엔비케이제약 '실리스칸정350mg'(자료제출의약품, 10월 20일 허가)밀크시슬 정제 제품을 개발한 엔비케이제약은 이번에는 하루 한 정 복용하는 고용량 제품을 허가받았습니다.실리스칸정350mg으로, 밀크시슬열매건조엑스 성분으로 독성 간질환, 만성간염, 간경변 보조치료에 사용되는 일반의약품입니다.전작 실리스칸정이 지난 4월 대웅제약과 공동 판매 계약을 체결했는데, 이번 고용량 제품 등장으로 경쟁력이 배가될 것으로 전망됩니다.실리스칸정350mg은 1일1회 1정 복용하는 제품입니다. 기존 밀크시슬 175mg 분량이 함유된 실리스칸정은 캡슐 제형보다 열과 습기에 안정성과 1년 더 늘어난 사용기간이 장점이었지만, 1일 3회 복용하는 단점도 있었습니다.반면 시중에 나온 캡슐 제형 밀크시슬 일반약은 1일 1정 복용합니다. 이번에 1일 1정 복용하는 실리스칸정350mg도 등장하면서 엔비케이-대웅 연합이 밀크시슬 캡슐 제형과의 경쟁에서 앞서 나갈 수 있는 동력을 마련할 것으로 기대됩니다.분석기간 (10.1~10.30) 제론셀베인 '리쥬메디크림'미용성형에 대한 관심 증가와 K-뷰티 열풍으로 최근 약국에서 가장 핫한 일반의약품이라면 파마리서치의 '리쥬비넥스크림'이 꼽힙니다.리쥬비넥스는 피부 조직을 재생하는데 도와주는 PDRN 성분이 함유돼 있는 제품입니다. PDRN은 연어 정소에서 얻을 수 있는 DNA 조각인데, 파마리서치가 자체 추출 기술을 통해 여러 PDRN 제품을 선보이며 큰 인기를 끌고 있습니다.일반의약품인 크림 제형은 피부 및 결합조직의 영양부족 또는 영양부족으로 인한 궤양이 생기기 쉬운 상처, 영양보급에 사용됩니다. 그동안 이 시장은 파마리서치의 독점 영역이었는데, 최근 경쟁자가 나타났습니다.지난 9월 종근당이 같은 PDRN 성분의 크림제 '더마그램피디알엔크림' 허가에 성공하면서 부터입니다. 지난달 24일 종근당은 출시 보도자료를 통해 제품 판매에 본격 들어갔습니다. 보도자료에서 종근당은 더마그램피디알엔이 특허 받은 Prism-Technology 공법을 적용한 저분자 PDRN을 사용해 입자를 균일화하고 피부 투과율을 높였으며 덱스판테놀을 더해 손상된 피부 장벽을 빠르게 회복하도록 설계됐다고 밝혔습니다.이번달에는 그간 PDRN 제품에 관심을 보여온 제론셀베인도 PDRN 크림 제형 일반의약품을 허가받았습니다. 제품명은 리쥬메디크림입니다.제론셀베인은 PDRN 기반의 셀베인주에 더해 이번 리쥬메디크림, 눈 영양 점안액 아이셀점안액 등 PDRN 라인업을 구축했습니다.이처럼 후발업체들이 속속 등장하면서 PDRN 크림 일반의약품 시장이 파마리서치 독점 구도에서 어떻게 변화할지도 궁금해집니다.◆전문의약품 = 10월 전문의약품 총 49개 품목이 허가받았습니다. 이 가운데 자료제출의약품 16개에 달합니다. 최초 조합 복합제들이 속속 등장했기 때문입니다.또한 제네릭은 32개, 희귀의약품 1개 품목도 허가를 받았습니다.분석기간 (10.1~10.30) 셀트리온 '이달디핀정'(자료제출의약품, 10월 29일 허가)삼성바이오와 함께 바이오시밀러 양대 강자인 셀트리온이 합성의약품 시장에서도 자체 개발 의약품으로 승부를 겁니다.2020년 다케다제약 아시아태평양 의약품 사업부를 인수해 획득한 고혈압 치료제 오리지널 '이달비'를 기반으로 한 복합제가 그 주인공입니다.식약처는 셀트리온의 이달디핀정 4개 품목을 10월 29일 허가했습니다. 이달디핀정은 ARB 계열 아질사르탄메독소밀칼륨 성분과 CCB 계열 암로디핀베실산염 성분이 결합된 복합제입니다.특히 셀트리온이 아질사르탄메독소밀칼륨(브랜드명 : 이달비) 성분을 활용해 개발 완료한 첫 복합제라는 점에서 의미가 큽니다.셀트리온은 지난 2020년 다케다제약 아시아태평양 의약품 사업부를 인수하면서 이달비의 판권을 확보했습니다.이후 셀트리온의 자회사 셀트리온제약이 이달비정과 이달비클로정(아질사르탄메독소밀칼륨+클로르탈리돈) 수입 허가권을 인수했고, 자체 제조 전환을 추진해 제조품목 허가도 새로 받았습니다. 이달비정과 이달비클로정은 동아에스티와 공동 판매하고 있습니다.이번 이달디핀은 셀트리온제약이 아닌 셀트리온의 이름으로 허가를 받았습니다. 셀트리온 브랜드를 전면에 내세운 것이죠. 셀트리온은 지난 2021년 치매치료제 성분 도네페질을 활용한 패취제 '도네리온패취' 외에는 합성의약품 허가가 없습니다.국내 ARB+CCB 고혈압 복합제는 1조8000억원 규모로 고혈압치료제 시장에서 약 50% 점유율로 가장 많이 판매되고 있습니다. 오리지널의약품 독점권 만료로 제네릭의약품들도 많이 출시돼 있는 시장입니다.비록 오리지널 성분으로 무장했지만, 무한 경쟁이 펼쳐지고 있는 시장인 만큼 셀트리온의 도전이 쉽지 만은 않아 보입니다. 셀트리온이 합성의약품 시장에서도 이정표를 남길 수 있을지 관심이 모아집니다.온코닉테라퓨틱스 '자큐보구강붕해정'(자료제출의약품, 10월 30일 허가)지난해 4월 국산 신약으로 37번째로 허가받은 P-CAB(칼륨경쟁적 위산분비억제제) 계열 위시도역류질환 신약 자큐보정이 새로운 제형을 선보입니다. 바로 구강붕해정입니다.구강붕해정은 물 없이 입안에서 빠르게 녹여 복용할 수 있는 제형으로, 식도연하 운동 저하로 정제 삼킴이 어려운 고령환자나 즉각적인 복용이 필요한 상황에 사용됩니다.특히 향에도 신경을 썼습니다. 온코닉테라퓨틱스 측은 구강붕해 제형에 많이 사용되는 민트향이 오히려 위식도역류환자에게는 속쓰림을 유발할 수 있다는 점을 고려해 오렌지향을 적용해 복약 순응도를 높였다고 설명합니다.현재 P-CAB 계열 약제 중 구강붕해정 제품은 HK이노엔의 '케이캡구강붕해정'이 있습니다. 케이캡구강붕해정은 매 분기 60억원 내외 실적을 보이며 시장에서 견고한 모습을 보이고 있습니다.케이캡, 펙수클루에 이은 세번째 주자인 온코닉테라퓨틱스는 이번 구강붕해정 라인업 구축으로 실적 향상이 기대됩니다. 더불어 해외 시장에서도 경쟁력이 높아질 것으로 기대하고 있습니다. 회사 측은 "글로벌 40조 원 규모의 P-CAB 시장에서 경쟁력을 증명하는 동시에, 블록버스터로 성장시킨 경험을 후속 파이프라인 개발에 속도를 낼 것"이라고 말했습니다.종근당 '텔미누보플러스정'(자료제출의약품, 10월 31일 허가)텔미누보는 2013년 출시된 이후 종근당의 대표 고혈압 복합제로 입지를 구축했습니다. 작년 유비스트 기준 원외처방 실적만 573억원에 달합니다.종근당은 여기에 멈추지 않고 계속 제품 업그레이드와 라인업 확장에 나섰습니다. 인습성이 개선된 리뉴얼 제품을 출시했으며, 지난 8월에는 초기요법에 사용되는 저용량 제품도 허가받았습니다. 텔미누보는 현재 6개 용량 제품으로 다양성을 확보했다는 평가를 받았습니다.여기서 한발 더 나아가 3제 복합제 허가에도 성공했습니다. 10월 마지막 날 허가받은 텔미누보플러스정은 텔미누보 성분(텔미사르탄, 에스암로디핀)에 이뇨제인 클로르탈리돈이 결합한 3제 복합제입니다.텔미사르탄과 에스암로디핀(암로디핀)의 복합요법으로 혈압이 적절하게 조절되지 않는 본태성 고혈압에 사용되면서, 텔미누보의 보완 요법으로 활용될 것으로 보입니다. 종근당은 임상시험을 통해 이 복합제가 각 성분을 따로 투여하는 것과 생물학적동등성을 입증했습니다.2025-11-02 17:43:34이탁순
후발주자 등장으로 더 뜨거워지는 PDRN 일반약 시장[데일리팜=이탁순 기자] PDRN(폴리데옥시리노뷰크레오티드) 성분의 피부 재생 크림이 일반의약품 시장의 새로운 트렌드로 자리잡고 있습니다. 파마리처시치의 '리쥬비넥스크림'이 인기를 끌면서 후발주자들도 속속 시장에 진출하고 있습니다.국산 위식도역류질환 신약 자큐보는 제형을 추가해 이번에 구강붕해정 신제품을 허가받았습니다. 종근당은 고혈압 복합제 '텔미누보'의 라인업을 확장, 이번에 3제 복합제를 준비합니다.식품의약품안전처는 10월 총 86개의 품목을 허가했습니다. 신약은 없지만, 자료제출의약품이 17개나 나오는 등 기존 의약품을 활용한 제품 개발이 활발히 이어졌습니다.분석기간 (10.1~10.30)분석기간 (10.1~10.30) ◆일반의약품 = 10월 허가(신고)받은 일반의약품은 총 37개 품목으로, 자료제출의약품 1개 품목이 포함돼 있습니다. 표준제조기준으로 개발된 의약품은 19개 품목, 제네릭은 16개 품목으로 집계됐습니다.분석기간 (10.1~10.30) 엔비케이제약 '실리스칸정350mg'(자료제출의약품, 10월 20일 허가)밀크시슬 정제 제품을 개발한 엔비케이제약은 이번에는 하루 한 정 복용하는 고용량 제품을 허가받았습니다.실리스칸정350mg으로, 밀크시슬열매건조엑스 성분으로 독성 간질환, 만성간염, 간경변 보조치료에 사용되는 일반의약품입니다.전작 실리스칸정이 지난 4월 대웅제약과 공동 판매 계약을 체결했는데, 이번 고용량 제품 등장으로 경쟁력이 배가될 것으로 전망됩니다.실리스칸정350mg은 1일1회 1정 복용하는 제품입니다. 기존 밀크시슬 175mg 분량이 함유된 실리스칸정은 캡슐 제형보다 열과 습기에 안정성과 1년 더 늘어난 사용기간이 장점이었지만, 1일 3회 복용하는 단점도 있었습니다.반면 시중에 나온 캡슐 제형 밀크시슬 일반약은 1일 1정 복용합니다. 이번에 1일 1정 복용하는 실리스칸정350mg도 등장하면서 엔비케이-대웅 연합이 밀크시슬 캡슐 제형과의 경쟁에서 앞서 나갈 수 있는 동력을 마련할 것으로 기대됩니다.분석기간 (10.1~10.30) 제론셀베인 '리쥬메디크림'미용성형에 대한 관심 증가와 K-뷰티 열풍으로 최근 약국에서 가장 핫한 일반의약품이라면 파마리서치의 '리쥬비넥스크림'이 꼽힙니다.리쥬비넥스는 피부 조직을 재생하는데 도와주는 PDRN 성분이 함유돼 있는 제품입니다. PDRN은 연어 정소에서 얻을 수 있는 DNA 조각인데, 파마리서치가 자체 추출 기술을 통해 여러 PDRN 제품을 선보이며 큰 인기를 끌고 있습니다.일반의약품인 크림 제형은 피부 및 결합조직의 영양부족 또는 영양부족으로 인한 궤양이 생기기 쉬운 상처, 영양보급에 사용됩니다. 그동안 이 시장은 파마리서치의 독점 영역이었는데, 최근 경쟁자가 나타났습니다.지난 9월 종근당이 같은 PDRN 성분의 크림제 '더마그램피디알엔크림' 허가에 성공하면서 부터입니다. 지난달 24일 종근당은 출시 보도자료를 통해 제품 판매에 본격 들어갔습니다. 보도자료에서 종근당은 더마그램피디알엔이 특허 받은 Prism-Technology 공법을 적용한 저분자 PDRN을 사용해 입자를 균일화하고 피부 투과율을 높였으며 덱스판테놀을 더해 손상된 피부 장벽을 빠르게 회복하도록 설계됐다고 밝혔습니다.이번달에는 그간 PDRN 제품에 관심을 보여온 제론셀베인도 PDRN 크림 제형 일반의약품을 허가받았습니다. 제품명은 리쥬메디크림입니다.제론셀베인은 PDRN 기반의 셀베인주에 더해 이번 리쥬메디크림, 눈 영양 점안액 아이셀점안액 등 PDRN 라인업을 구축했습니다.이처럼 후발업체들이 속속 등장하면서 PDRN 크림 일반의약품 시장이 파마리서치 독점 구도에서 어떻게 변화할지도 궁금해집니다.◆전문의약품 = 10월 전문의약품 총 49개 품목이 허가받았습니다. 이 가운데 자료제출의약품 16개에 달합니다. 최초 조합 복합제들이 속속 등장했기 때문입니다.또한 제네릭은 32개, 희귀의약품 1개 품목도 허가를 받았습니다.분석기간 (10.1~10.30) 셀트리온 '이달디핀정'(자료제출의약품, 10월 29일 허가)삼성바이오와 함께 바이오시밀러 양대 강자인 셀트리온이 합성의약품 시장에서도 자체 개발 의약품으로 승부를 겁니다.2020년 다케다제약 아시아태평양 의약품 사업부를 인수해 획득한 고혈압 치료제 오리지널 '이달비'를 기반으로 한 복합제가 그 주인공입니다.식약처는 셀트리온의 이달디핀정 4개 품목을 10월 29일 허가했습니다. 이달디핀정은 ARB 계열 아질사르탄메독소밀칼륨 성분과 CCB 계열 암로디핀베실산염 성분이 결합된 복합제입니다.특히 셀트리온이 아질사르탄메독소밀칼륨(브랜드명 : 이달비) 성분을 활용해 개발 완료한 첫 복합제라는 점에서 의미가 큽니다.셀트리온은 지난 2020년 다케다제약 아시아태평양 의약품 사업부를 인수하면서 이달비의 판권을 확보했습니다.이후 셀트리온의 자회사 셀트리온제약이 이달비정과 이달비클로정(아질사르탄메독소밀칼륨+클로르탈리돈) 수입 허가권을 인수했고, 자체 제조 전환을 추진해 제조품목 허가도 새로 받았습니다. 이달비정과 이달비클로정은 동아에스티와 공동 판매하고 있습니다.이번 이달디핀은 셀트리온제약이 아닌 셀트리온의 이름으로 허가를 받았습니다. 셀트리온 브랜드를 전면에 내세운 것이죠. 셀트리온은 지난 2021년 치매치료제 성분 도네페질을 활용한 패취제 '도네리온패취' 외에는 합성의약품 허가가 없습니다.국내 ARB+CCB 고혈압 복합제는 1조8000억원 규모로 고혈압치료제 시장에서 약 50% 점유율로 가장 많이 판매되고 있습니다. 오리지널의약품 독점권 만료로 제네릭의약품들도 많이 출시돼 있는 시장입니다.비록 오리지널 성분으로 무장했지만, 무한 경쟁이 펼쳐지고 있는 시장인 만큼 셀트리온의 도전이 쉽지 만은 않아 보입니다. 셀트리온이 합성의약품 시장에서도 이정표를 남길 수 있을지 관심이 모아집니다.온코닉테라퓨틱스 '자큐보구강붕해정'(자료제출의약품, 10월 30일 허가)지난해 4월 국산 신약으로 37번째로 허가받은 P-CAB(칼륨경쟁적 위산분비억제제) 계열 위시도역류질환 신약 자큐보정이 새로운 제형을 선보입니다. 바로 구강붕해정입니다.구강붕해정은 물 없이 입안에서 빠르게 녹여 복용할 수 있는 제형으로, 식도연하 운동 저하로 정제 삼킴이 어려운 고령환자나 즉각적인 복용이 필요한 상황에 사용됩니다.특히 향에도 신경을 썼습니다. 온코닉테라퓨틱스 측은 구강붕해 제형에 많이 사용되는 민트향이 오히려 위식도역류환자에게는 속쓰림을 유발할 수 있다는 점을 고려해 오렌지향을 적용해 복약 순응도를 높였다고 설명합니다.현재 P-CAB 계열 약제 중 구강붕해정 제품은 HK이노엔의 '케이캡구강붕해정'이 있습니다. 케이캡구강붕해정은 매 분기 60억원 내외 실적을 보이며 시장에서 견고한 모습을 보이고 있습니다.케이캡, 펙수클루에 이은 세번째 주자인 온코닉테라퓨틱스는 이번 구강붕해정 라인업 구축으로 실적 향상이 기대됩니다. 더불어 해외 시장에서도 경쟁력이 높아질 것으로 기대하고 있습니다. 회사 측은 "글로벌 40조 원 규모의 P-CAB 시장에서 경쟁력을 증명하는 동시에, 블록버스터로 성장시킨 경험을 후속 파이프라인 개발에 속도를 낼 것"이라고 말했습니다.종근당 '텔미누보플러스정'(자료제출의약품, 10월 31일 허가)텔미누보는 2013년 출시된 이후 종근당의 대표 고혈압 복합제로 입지를 구축했습니다. 작년 유비스트 기준 원외처방 실적만 573억원에 달합니다.종근당은 여기에 멈추지 않고 계속 제품 업그레이드와 라인업 확장에 나섰습니다. 인습성이 개선된 리뉴얼 제품을 출시했으며, 지난 8월에는 초기요법에 사용되는 저용량 제품도 허가받았습니다. 텔미누보는 현재 6개 용량 제품으로 다양성을 확보했다는 평가를 받았습니다.여기서 한발 더 나아가 3제 복합제 허가에도 성공했습니다. 10월 마지막 날 허가받은 텔미누보플러스정은 텔미누보 성분(텔미사르탄, 에스암로디핀)에 이뇨제인 클로르탈리돈이 결합한 3제 복합제입니다.텔미사르탄과 에스암로디핀(암로디핀)의 복합요법으로 혈압이 적절하게 조절되지 않는 본태성 고혈압에 사용되면서, 텔미누보의 보완 요법으로 활용될 것으로 보입니다. 종근당은 임상시험을 통해 이 복합제가 각 성분을 따로 투여하는 것과 생물학적동등성을 입증했습니다.2025-11-02 17:43:34이탁순 -
 세계 첫 항체 무관 혈우병 A·B 치료제 '피투시란'큐피틀리아(Qfitlia, 성분명 피투시란, Fitusiran, 사노피)는 GalXC 기술 플랫폼을 기반으로 개발된 항트롬빈(antithrombin)을 표적으로 하는 소간섭 리보핵산(small interfering RNA, siRNA) 치료제다.이 약제는 2024년 유럽의약청(EMA) 에서, 이어 올해 3월 미국 식품의약국(FDA) 에서 제VIII인자 또는 제IX인자 억제인자(inhibitor)의 유무와 관계없이, 12세 이상 성인 및 소아 혈우병 A 또는 B 환자에서 출혈 에피소드의 발생을 예방하거나 빈도를 감소시키기 위한 정기적 예방요법(routine prophylaxis)에 ‘두 달에 한번 피하주사’로 승인되었다. 국내에서는 올해 5월 희귀의약품(Orphan drug) 으로 지정되었다.혈우병(hemophilia)은 X염색체 연관 열성 유전질환으로, 제Ⅷ인자(FVIII) 또는 제Ⅸ인자(FIX) 의 결핍으로 인해 혈액응고 연쇄반응(coagulation cascade) 이 정상적으로 진행되지 못하며, 그 결과 트롬빈(thrombin) 생성 부족으로 지혈(hemostasis) 이 저하된다. 이러한 병태생리적 이상은 반복적인 출혈, 특히 관절 출혈을 초래하여 만성 관절병증(chronic arthropathy) 및 삶의 질 저하로 이어진다.기존의 표준 치료는 응고인자제제(clotting factor concentrate, CFC) 의 정맥 내 투여를 통한 인자 보충요법(replacement therapy) 이었다. 그러나 이 방식은 정맥 투여의 불편성, 반복적 투여 부담, 그리고 항체(억제인자, inhibitor) 형성으로 인한 치료 저항성이라는 한계를 지닌다.이에 따라 최근에는 비(非)응고인자 기반 치료(non-factor therapy) 의 개발이 활발히 이루어지고 있으며, 그중에서도 RNA 간섭(RNA interference, RNAi) 기술을 이용한 피투시란(Fitusiran) 은 새로운 치료 옵션으로 주목 받고 있다.피투시란은 간세포 내에서 항트롬빈(antithrombin, AT) 합성을 억제하도록 설계된 siRNA 기반 치료제로, 내인성 응고 조절 인자의 발현을 조절함으로써 응고 균형(hemostatic balance) 을 회복시키는 새로운 접근법을 제시한다.피투시란의 승인은 다국가, 무작위배정, 대조, 3상 임상시험들로 구성된 ATLAS 임상 프로그램의 결과를 근거로 하였다.이 프로그램에는 ATLAS-A/B, ATLAS-INH, 그리고 ATLAS-PPX 연구가 포함되며, 각각 혈우병 A 또는 B 환자 중 인자 억제인자의 유무, 그리고 기존 예방요법(prophylaxis) 사용 여부에 따라 구분되었다.ATLAS-A/B 연구는 억제인자가 없는(non-inhibitor) 혈우병 A 또는 B 환자를 대상으로, ATLAS-INH 연구는 억제인자가 존재하는(inhibitor-positive) 환자를 대상으로 수행되었다. ATLAS-PPX 연구는 기존 예방요법을 받고 있던 환자에서 피투시란으로 전환했을 때의 출혈률 변화를 평가하였다.이들 연구에서 피투시란은 월 1회 피하주사(subcutaneous injection) 투여만으로도 연간 출혈률(annualized bleeding rate, ABR)을 기존 치료 대비 약 90% 이상 유의하게 감소시켰으며, 절반 이상의 환자에서 무출혈(ABR = 0)이 관찰되었다. 또한 억제인자 유무와 관계없이 일관된 출혈 억제 효과가 확인되었다.혈우병이란 무엇인가?혈우병(hemophilia)은 그리스어 ‘hemo(피)’와 ‘philia(사랑하다)’에서 유래한 용어로, 1828년 Schönlein에 의해 Hämophilie라 명명됐다. 19세기 말 유럽 왕실 내 근친혼으로 인해 영국, 스페인, 독일, 러시아 등 여러 나라에서 다수의 환자가 발생하면서 ‘왕실병(The Royal Disease)’이라는 별칭을 얻었다.혈우병은 혈액응고인자의 결핍으로 인해 발생하는 대표적인 선천성 출혈성 질환이다. 제VIII응고인자(FVIII)의 결핍은 혈우병 A로, 전체 환자의 약 80~85%를 차지하며 ‘고전적 혈우병(classic hemophilia)’이라 불린다. 제IX응고인자(FIX)의 결핍은 혈우병 B로 약 15%를 차지하며, 최초 환자의 이름을 따 ‘크리스마스병(Christmas disease)’으로도 알려져 있다. 제XI응고인자(FXI)의 결핍은 혈우병 C로 상대적으로 드물게 발생한다.혈우병 A와 B는 X 염색체 열성 유전 양식을 가지므로 주로 남성에서 발병하며, 여성은 보인자로 존재하거나 드물게 태아기에 사망하기도 한다. 반면 혈우병 C는 4번 염색체 이상에 기인하므로 성별에 관계없이 발생할 수 있으며, 일부 환자에서는 가족력 없이 자연 발생적 유전자 변이에 의해 발현되기도 한다.혈우병과 유사한 질환으로는 폰빌레브란트병(von Willebrand disease, vWD)이 있다. 이는 응고인자 VIII과 결합하는 폰빌레브란트인자(vWF)의 결핍으로 인해 혈우병과 유사한 임상 양상을 보인다.이외에도 프로트롬빈(II), 피브리노겐(I), V, VII, X, XII, XIII 응고인자의 결핍으로 인한 선천성 응고장애가 보고되어 있으나, 이러한 질환들은 혈우병의 범주에는 포함되지 않는다.혈액응고 과정은 어떻게 일어나는가?혈액응고는 인체의 항상성을 유지하기 위한 필수적인 생리적 방어기전으로, 외상이나 혈관 손상 시 과도한 출혈을 방지하는 역할을 한다. 이 과정은 혈관수축, 혈소판 기능, 그리고 혈액응고인자의 연속적인 활성화로 이루어지는 응고 연쇄(cascade)로 설명되며, 궁극적으로 안정적인 피브린 혈전(fibrin clot)을 형성한다.혈액응고인자(Coagulation factors)는 주로 간에서 합성되는 단백질로, 로마 숫자로 표기된 I번부터 XIII번까지의 인자가 알려져 있다. 이들은 각각 특정 효소 활성 또는 보조인자로 작용하면서 정교하고 단계적인 반응을 매개한다. 주요 응고인자로는 피브리노겐(Factor I), 프로트롬빈(Factor II), 그리고 프로트롬빈 복합체를 구성하는 V, VII, IX, X, XI, XII 인자, 마지막으로 XIII 인자 등이 있다. 응고 연쇄는 크게 내인성 경로(intrinsic pathway), 외인성 경로(extrinsic pathway), 그리고 두 경로가 합류하는 공통 경로(common pathway)로 구성된다.내인성 경로는 Factor XII의 활성화를 시작으로 XI, IX, VIII 인자가 순차적으로 활성화되며, 외인성 경로는 조직인자(tissue factor, TF)와 Factor VII의 상호작용을 통해 개시된다.두 경로는 Factor X의 활성화 단계에서 공통 경로로 수렴하며, 활성화된 Factor X는 Factor V와 결합하여 프로트롬비나제(prothrombinase) 복합체를 형성한다. 이 복합체는 프로트롬빈(Factor II)을 트롬빈(thrombin)으로 전환시키고, 생성된 트롬빈은 피브리노겐(Factor I)을 불용성 피브린(fibrin)으로 전환시켜 최종적으로 혈전을 완성한다.또한 트롬빈은 Factor V, VIII, XI 등을 다시 활성화시키는 양성 되먹임(positive feedback) 작용을 통해 응고 반응을 증폭시키며, Factor XIII을 활성화시켜 피브린 가교결합(fibrin cross-linking)을 형성함으로써 혈전의 안정성을 더욱 높인다.이러한 정교한 연쇄 반응은 항응고 단백질(antithrombin, protein C/S system 등)과 섬유소 용해(fibrinolysis) 기전 간의 정밀한 균형 속에서 조절된다. 이 균형이 깨질 경우 출혈성 질환이나 혈전성 질환으로 이어질 수 있다.항트롬빈(Antithrombin, AT, heparin cofactor I)은 어떤 물질인가?항트롬빈(AT)은 혈액응고 조절에서 가장 중요한 내인성 항응고인자로, 전체 생리적 응고 억제 작용의 약 70~80%를 담당하는 핵심 단백질이다. AT는 혈장에 존재하는 세린 단백질분해효소 억제제(serpin) 계열의 당단백질로, 주된 표적은 트롬빈(thrombin)이지만, Factor Xa, IXa, XIa, XIIa 및 칼리크레인(kallikrein) 등 다양한 혈액응고인자를 동시에 억제함으로써 응고 연쇄(cascade) 전반의 균형 유지에 기여한다.The Coagulation Cascade(출처: Ann Pharmacother . 2016 Sep;50(9):758-67). AT는 트롬빈의 활성 중심부에 위치한 세린(serine) 잔기와 1:1 비율로 결합하여 불활성 복합체를 형성함으로써 트롬빈 활성을 차단한다. 이를 통해 소규모 응고 반응이나 불필요한 혈전 형성을 신속히 억제하며, 정상적인 생리 상태에서 과도한 혈액응고를 방지하는 핵심 역할을 수행한다.그러나 대규모 혈관 손상이나 파종성 혈관내응고(Disseminated intravascular coagulation, DIC)와 같이 트롬빈 생성이 폭발적으로 증가하는 상황에서는 AT의 억제 능력이 상대적으로 부족해져, 생리적 항응고 메커니즘만으로는 병적 혈전 형성을 완전히 제어하기 어렵다.AT의 항응고 활성이 가장 강력하게 발휘되는 조건은 헤파린(heparin)의 존재 하에서이다. 헤파린은 AT에 결합하여 구조적 변화를 유도하고, AT와 트롬빈 및 Factor Xa 간의 결합 친화도를 수백 배 이상 증폭시킨다.이로 인해 헤파린은 AT의 촉매제(cofactor) 역할을 하며, 임상적으로 항응고 효과를 발휘하는 주요 기전이 바로 AT 매개 억제 반응이다. 이러한 이유로 AT 결핍 환자에서는 헤파린의 항응고 효과가 현저히 감소하며, 이는 선천성 또는 후천성 AT 결핍에서 혈전성 질환 발생 위험이 증가하는 중요한 근거가 된다.AT는 간에서 합성되며 혈중 농도는 약 0.15mg/mL로 유지되고, 정상 활성도는 80~120% 범위 내에 있다. 선천성 AT 결핍은 드문 질환이지만 정맥혈전증과 폐색전증 발생의 중요한 위험 요인으로 알려져 있으며, 후천성 결핍은 간질환, 신증후군, DIC, 항응고제 치료 등 다양한 상황에서 관찰된다. AT 농도의 감소는 항응고 균형을 무너뜨려 과도한 혈전 형성을 유발하므로, 임상적으로 AT 농축제제 보충 또는 헤파린·직접 트롬빈 억제제와 같은 항응고 요법을 병행하는 치료 전략이 고려된다.이처럼 AT는 단순한 혈액응고인자 억제 단백질을 넘어, 혈액응고와 항응고, 그리고 섬유소 용해(fibrinolysis) 시스템 사이의 미세한 균형을 유지하는 핵심 조절인자로서, 혈전성 질환의 병태생리 이해와 새로운 항응고 치료제 개발에 있어 중요한 연구 대상이 되고 있다.혈우병 A 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor Replacement Therapy) 혈우병 A의 전통적인 치료는 부족한 제Ⅷ인자(FVIII)를 직접 보충하는 방식이다. 초기에는 혈액 유래 FVIII 제제가 사용되었으나, 감염 위험 등 안전성 문제가 제기되면서 현재는 재조합 FVIII(rFVIII)이 표준으로 자리잡았다. 또한 최근에는 반감기를 연장한 FVIII 제제들이 개발되어 투여 빈도를 줄이고 환자 순응도를 높이는 데 기여하고 있다.1) 표준 반감기(Standard half-life, SHL) FVIII 제제 표준 반감기 제제는 혈액 유래 FVIII와 재조합 FVIII로 나눌 수 있다. 혈액 유래 제제는 감염 위험 관리가 필요하지만 여전히 일부에서 사용되고 있으며, 재조합 FVIII로 애드베이트(AdvateⓇ, 코지네이트 에프에스(Kogenate FSⓇ) 등은 안전성 측면에서 더 선호된다.2) 반감기 연장형(Extended half-life, EHL) FVIII 제제 반감기 연장형 제제는 투여 간격을 늘리기 위해 Fc-fusion(엘록테이트, EloctateⓇ), PEGylation(애디노베이트, AdynovateⓇ, 지비, JiviⓇ) 등 다양한 기술이 적용되었다. 이러한 약제들은 환자의 주사 횟수를 줄여 장기적인 치료 순응도를 개선하는 장점이 있다.3) VWF-independent EHL(VWF 비의존성 반감기 연장형) FVIII 제제 VWF 비의존성 반감기 연장형 제제인 알투비오(AltuviiioⓇ)는 주 1회 주사로 FVIII 활성을 더 오래 유지할 수 있도록 설계된 최신형 지속형 치료제(high sustained factor, HSF)로 2023년 미 FDA에서 승인되었고 국내에서는 진행중이다,2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 A 환자의 약 20~30%는 치료 과정에서 FVIII에 대한 억제항체를 형성하게 되며, 이 경우 기존의 FVIII 보충요법은 효과가 제한적이다. 억제인자 환자의 치료에는 크게 두 가지 접근법이 있다.첫째, 우회제제(bypassing agents, BPA)를 사용하는 방법이다. 활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBAⓇ)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSevenⓇ)는 응고경로를 우회적으로 활성화하여 지혈 효과를 발휘하지만, 지혈 반응의 변동성과 혈전 위험이라는 한계가 존재한다.둘째, 에미시주맙(Emicizumab, HemlibraⓇ)는 FIXa와 FX를 연결하여 FVIII의 기능을 모방하는 이중특이성 항체로, 억제인자 환자뿐 아니라 비(非)억제인자 환자에서도 예방요법으로 사용 가능하다. 피하 주사로 1주~4주 간격 투여가 가능하여 투여 편의성이 획기적으로 개선되었다.3. 대체 인자제제(Replacement therapy) 재조합 돼지 유래 FVIII(r-pFVIII)인 오비주르(Obizur®, Susoctocog alfa)는 2014년 미 FDA, 2015년 EMA 그리고 2023년 국내에서 ‘성인 후천성 혈우병 A(Acquired Haemophilia A, AHA) 환자의 출혈 에피소드 치료’에 승인되었다. 후천성 혈우병 A는 선천성 혈우병과 다르게, 정상 혈액응고인자 VIII(FVIII) 수준을 가지고 있지만, 이에 대해 자가면역 항체(중화 항체)가 생겨 혈액 응고 기능이 저해되어 출혈 위험이 커지는 인구 100만 명당 약 1명꼴로 발생하는 초희귀 자가면역 응고질환이다.4. 비응고인자 기반 치료(Non-factor Therapy) 최근 혈우병 A 치료에서 가장 주목받는 변화는 FVIII를 직접 보충하지 않고, 다른 경로를 통해 응고 균형을 회복하는 비응고인자 기반 치료이다. 대표적인 약제가 에미시주맙(Emicizumab, HemlibraⓇ)으로, FIXa와 FX을 연결하여 FVIII의 보조인자 기능을 모방하는 이중특이성 항체이다. 피하 주사로 주 1회, 격주, 또는 4주 간격 투여가 가능해 환자의 치료 편의성이 획기적으로 개선되었다.이외에도 피투시란(Fitusiran)과 콘시주맙(Concizumab, Alhemo®)가 있다. 피투시란은 RNA 간섭(RNAi) 기술을 이용하여 간세포에서 항트롬빈 합성을 억제함으로써 응고 활성을 높인다. 월 1회 피하 주사가 가능하지만, 혈전 및 간독성 발생 위험으로 인해 항트롬빈 활성(15–35%)을 유지하는 개별화 용량조절(AT-DR)이 필요하다. 콘시주맙은 조직인자경로억제인자(TFPI)를 차단하여 내인성 응고를 촉진하는 약제이다.5. 유전자 치료(Gene Therapy) 혈우병 A에서 유전자 치료는 단회 정맥투여를 통해 간세포에 FVIII 유전자를 도입하여 장기간 발현을 유도하는 새로운 전략이다. 대표적인 약제가 록타비안(RoctavianⓇ, Valoctocogene roxaparvovec)으로, AAV5 벡터를 이용해 개발되었으며 2022년 유럽, 2023년 미국 FDA의 승인을 받았다.단일 투여로 FVIII 발현을 장기간 유지할 수 있어 치료 패러다임의 변화를 예고했으나, 발현 지속 기간의 불확실성, 간효소 상승, 재투여 불가 등의 문제점이 여전히 남아 있다.혈우병 B 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor IX Replacement Therapy) 혈우병 B의 가장 기본적인 치료는 부족한 제Ⅸ인자(FIX)를 직접 보충하는 방식이다. 과거에는 혈액 유래 제제가 널리 사용되었으나, 감염 위험 문제로 현재는 재조합 FIX(rFIX) 제제가 주로 사용된다. 여기에 더해 반감기를 연장한 제제들이 개발되면서 투여 간격이 길어지고 환자의 치료 순응도가 크게 향상되었다.1) 표준 반감기(Standard half-life, SHL) FIX 제제 표준 반감기 FIX 제제는 투여 후 약 18~24시간의 반감기를 가지며, 주 2~3회 정맥 주사가 필요하다. 혈액 유래 FIX 제제는 여전히 일부에서 사용되지만, 바이러스 감염에 대한 안전성 우려가 있었다. 이를 보완하기 위해 개발된 재조합 FIX 제제인 베네픽스(BeneFIXⓇ, Nonacog alfa)는 안전성이 확보되어 현재 임상에서 가장 널리 사용되고 있다.2) 반감기 연장(Extended half-life, EHL) FIX 제제 반감기 연장 제제는 기존 표준 제제보다 3~5배 긴 반감기를 가지며, 1~2주 간격으로 투여가 가능하다. 이들 약제에는 Fc-fusion 단백을 이용한 알프로릭스(Alprolix(Ⓡ, Eftrenonacog alfa), albumin-fusion 기술이 적용된 아이델비온(IdelvionⓇ Albutrepenonacog alfa) 등이 포함된다. 이러한 제제들은 주사 횟수를 줄여 환자의 삶의 질과 치료 순응도를 높이는 중요한 진보로 평가된다.2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 B 환자에서 억제인자 발생은 상대적으로 드물지만, 일단 형성되면 치료가 매우 어렵다. 억제인자가 형성된 경우 기존 FIX 제제의 효과가 소실되므로 우회제제(bypassing agents)가 사용된다.활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBAⓇ)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSevenⓇ)가 대표적이다. 그러나 혈우병 A와 달리 에미시주맙은 FVIII 기능을 모방하는 기전이기 때문에 혈우병 B 환자에게는 효과가 없다. 따라서 억제인자 환자의 치료는 여전히 제한적이며, 새로운 치료 전략이 필요한 영역이다.3. 비응고인자 기반 치료(Non-factor Therapy) 혈우병 B에서도 비응고인자 기반 치료가 적용될 수 있다. 이들 약제는 특정 응고인자를 보충하지 않고 응고 균형 자체를 조절하는 기전을 갖는다. 대표적으로 RNA 간섭 기반의 피투시란(Fitusiran)은 간세포에서 항트롬빈 합성을 억제하여 응고 활성을 증가시키며, 혈우병 A와 B 모두에 승인되었다.또한 항 TFPI 항체인 콘시주맙(Concizumab, Alhemo®) 역시 혈우병 A와 B 모두에 적용 가능하며, 내인성 응고경로를 촉진하여 출혈을 억제한다. 이처럼 비응고인자 기반 치료는 억제인자 보유 여부와 관계없이 사용할 수 있는 장점이 있어, 혈우병 B 환자에서도 중요한 치료 대안으로 부상하고 있다.4. 유전자 치료(Gene Therapy) 혈우병 B는 유전자 치료 분야에서 가장 먼저 성과를 낸 질환 중 하나이다. FIX 유전자의 크기가 FVIII보다 작아 AAV 벡터 전달이 용이하기 때문에, 임상개발이 상대적으로 앞서 진행되었다.대표적인 약제는 헴제닉스(HemgenixⓇ, Etranacogene dezaparvovec)으로, 2022년 미국 FDA와 2023년 유럽 EMA에서 세계 최초로 혈우병 유전자 치료제로 승인되었다. 단회 정맥투여만으로 간세포에서 FIX 발현이 장기간 유지될 수 있으며, 환자의 치료 부담을 획기적으로 줄일 수 있다. 그러나 여전히 발현 지속 기간의 변동성, 간효소 상승, 재투여 불가 등의 문제점이 존재하며, 고가의 치료비용 역시 중요한 사회적 논의 대상이 되고 있다.피투시란은 어떤 약제인가?피투시란은 안티트롬빈(AT) mRNA를 절단·분해하여 AT 발현을 억제함으로써 혈중 AT 농도를 감소시키는 기전을 가진다. siRNA 치료제는 RNAi 과정을 활용하는 대표적인 플랫폼으로, 표적 mRNA를 인식하고 분해하도록 설계된 합성 RNA 이중가닥 구조를 기반으로 한다. 이 과정은 특정 단백질의 번역을 저해하여 표적 단백질의 합성을 효과적으로 억제한다.피투시란은 화학적으로 안정화된 이중가닥 siRNA로 설계되어 뉴클레아제에 의한 분해나 Toll-like receptor(TLR)3, TLR7 등 선천면역 수용체의 인식을 회피한다. 특히 리보뉴클레오티드의 2′-데옥시-2′-플루오로 치환, 2′-O-메틸 치환, 인산 골격의 선택적 변형이 적용되어 높은 안정성과 생체 내 지속성을 확보하였다.이 siRNA는 삼중 안테나(tri-antenna) 형태의 N-아세틸갈락토사민(GalNAc) 잔기와 결합되어 있으며, 간세포 표면의 아실글리코프로테인 수용체(asialoglycoprotein receptor, ASGPR)를 통해 효율적으로 간세포 내로 전달된다. 세포 내로 흡수된 후 산성 환경에서 siRNA는 ASGPR로부터 해리되고, 엔도솜을 탈출하여 세포질 내 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 탑재된다.RISC는 siRNA의 안티센스(antisense) 가닥을 선택적으로 유지하고, 이를 이용해 표적 유전자인 SERPINC1 mRNA를 서열 특이적으로 절단·분해함으로써 AT 발현을 억제한다. 이 과정의 결과로 혈중 AT 농도가 감소하며, 그에 따라 트롬빈 생성이 증가하여 혈우병 환자의 응고능이 향상된다.RISC 내 안티센스 가닥은 세포 내에서 수 주간 안정적으로 존재하면서 반복적으로 전사체 절단을 매개하므로, 세포당 수백 개 수준의 siRNA 분자만으로도 강력하고 지속적인 knockdown 효과를 낸다. 이러한 특성 덕분에 피투시란은 임상시험에서 한 달에 한 번의 피하 투여만으로도 충분한 약효를 유지할 수 있는 장점을 보인다.Antithrombin Knockdown by Fitusiran(출처: Molecular Therapy Vol. 28 No 3 April 2020).피투시란의 약리 기전은?피투시란은 간에서 합성되는 AT(antithrombin) mRNA를 표적하는 siRNA로 개발된 약제로, 항트롬빈 발현을 효율적으로 억제함으로써 체내의 친응고 상태를 강화하는 새로운 치료 전략이다.즉, AT 억제 작용을 통해 내인성 및 외인성 경로 모두에서 Factor Xa와 트롬빈의 활성을 증가시켜 응고 연쇄의 효율성을 회복시키며, 그 결과 FVIII 또는 FIX 결핍이 있는 혈우병 환자에서도 출혈 위험을 효과적으로 감소시킨다.The Role of Thrombin and Antithrombin in Hemostasis, and the Mechanism of Action of Fitusiran(출처: Res Pract Thromb Haemost. 2023;7:e100179).피투시란은 혈우병 A 또는 B 환자의 출혈 예방을 위해 2개월에 한 번 피하 주사로 투여된다. 초기 권장 용량은 50mg이며, 이후 항트롬빈 활성도를 모니터링하여 용량과 투여 간격을 조정한다. 목표 AT 활성도는 15~35% 사이로 유지하는 것이 바람직하다.AT 활성도가 15% 미만으로 떨어질 경우 용량을 줄이고, 35% 이상으로 증가하면 용량을 늘릴 수 있다. 예를 들어, 50mg을 2개월 간격으로 투여하던 환자의 AT 활성도가 35%를 초과할 경우, 동일 용량을 매월 투여하도록 변경할 수 있다.약동학 연구에서 피투시란은 혈장에서 비교적 짧은 반감기(약 3~5시간)를 보였으나, 모든 임상시험 용량군에서 투여 중단 후에도 수개월간 AT 감소 효과가 지속되었다. 평균 AT 회복 속도는 한 달에 약 10~15% 수준이었으며, 이 기간 동안 트롬빈 생성은 억제되고 출혈 사건 발생 위험은 증가하는 경향을 보였다.투여 중단 후 약 5개월 시점에서 중앙값 AT 수치는 약 60% 이상으로 회복되었다. 약력학적 분석 결과, AT 억제 효과는 첫 투여 후 약 15~28일 사이에 나타났으며, 개인 간 AT 감소 정도에는 차이가 있으나 개인 내에서는 일정하게 유지되어 지속적인 지혈 보호 효과를 제공하는 것으로 확인되었다.피투시란은 또한 비인자(non-factor) 치료제 중 유일하게 특정 역전제(reversal agent)를 보유한 약제로, 이는 재조합 또는 혈장 유래 항트롬빈 제제 형태로 제공된다. 이러한 역전제는 돌파성 출혈 시 다른 지혈제와 병용할 경우 혈전증 위험을 조절할 수 있다는 점에서 임상적으로 중요한 의미를 갖는다.한편, 혈중 AT 감소가 표준 응고 검사에 직접적인 영향을 미치지 않는다는 점은, CFC(concentrated factor concentrate) 또는 BPA(bypassing agent)를 사용하는 상황이나 수술 시 지혈 상태 및 인자 수치를 보다 용이하게 모니터링할 수 있음을 시사한다.피투시란(QFITLIA)의 허가임상은 어떠한가?성인 및 12세 이상의 소아 환자에서 억제인자(inhibitors)의 존재 여부와 관계없이 혈우병 A 또는 B를 가진 환자에서 QFITLIA의 유효성과 안전성은 두 건의 임상시험에서 입증되었다.-억제인자가 있는 혈우병 A 또는 B: ATLAS-INH -억제인자가 없는 혈우병 A 또는 B: ATLAS-A/B위의 본 임상시험에 참여한 환자들은 장기 연장 연구인 ATLAS-OLE로 이월되었다.임상시험 ATLAS-INH 및 ATLAS-A/B에서는 QFITLIA 80mg 고정 월 1회 용량을 시험하였다. 그러나 이 용량에서 혈전성 사건(thrombotic events)이 발생하여, ATLAS-OLE에서는 항트롬빈(AT) 활성 15–35%를 목표로 하는 QFITLIA AT-DR 용법이 도입되었다.AT-DR 용법은 ATLAS-INH 및 ATLAS-A/B 연구가 거의 완료될 시점에 도입되었으므로, QFITLIA AT-DR 치료의 유효성은 장기 연장 연구 ATLAS-OLE에서 얻어진 AT-DR 치료 데이터를 ATLAS-INH 및 ATLAS-A/B 연구의 대조(control) 데이터와 비교하여 평가되었다.유효성 분석은 본 임상시험들의 무작위 배정(randomization)을 보존하면서, 부모 연구(parent studies)에서의 의도한 치료(intent-to-treat, ITT) 원칙에 따라 수행되었다.[ATLAS-INH] ATLAS-INH은 혈우병 A 또는 B 환자 중 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체를 가진 성인 및 소아 남성 환자(≥12세) 57명을 대상으로 실시된 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 이들은 모두 과거에 출혈 시 우회제제(BPAs)를 필요에 따라(episodic, on-demand) 투여받은 병력이 있었다.대상 환자들은 2:1 비율로 무작위 배정되어, 월 1회 80mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=38)과, 돌발 출혈(breakthrough bleeding) 발생 시 BPA를 필요에 따라 투여받은 군(N=19)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg 용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다. 현재 50mg과 20mg이 허가되어 있다.[ATLAS A/B] ATLAS A/B는 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체가 없는 혈우병 A 또는 B 환자를 대상으로 한 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 대상자는 모두 성인 및 소아 남성(≥12세)으로, 과거에 출혈 시 응고인자제제(CFC)를 필요에 따라(on-demand, episodic) 투여받은 병력이 있었다.대상 환자 120명은 2:1 비율로 무작위 배정되어, 월 1회 80 mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=80)과, 돌발 출혈 발생 시 CFC를 필요에 따라 투여받은 군(N=40)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다.[ATLAS-OLE] 총 227명의 환자가 두 임상시험(ATLAS-INH 및 ATLAS-A/B)과, CFC 또는 BPA 예방요법을 받던 환자를 대상으로 한 교차 임상시험 ATLAS-PPX에서 이월되어 ATLAS-OLE 연구에서 QFITLIA 치료를 받았다. 이 다기관 공개 연장 임상시험은 FVIII 또는 FIX 억제항체 유무와 관계없이, 12세 이상의 성인 및 소아 남성 혈우병 A 또는 B 환자에서 QFITLIA의 장기적인 안전성과 유효성을 평가하였다.대상자는 초기에는 월 1회 80mg QFITLIA 피하 주사를 투여받았으나, 연구가 개정되어 AT-DR(항트롬빈 활성 15–35% 목표) 용법의 유효성과 안전성을 평가하도록 설계가 변경되었다. 이후 총 213명의 환자가 AT-DR로 전환되었다.AT-DR에서는 시작 용량이 50mg 격월(2개월 간격) 투여였으며, INNOVANCE Antithrombin 분석법을 이용해 측정한 AT 활성 수치에 따라 개별적으로 용량을 조정하였다. 용량은 50mg 월 1회 또는 80mg 월 1회로 증량하거나, 20mg 격월 또는 20mg 월 1회로 감량할 수 있었다.AT 활성 수치가 최저 용량에서도2025-10-23 23:25:17최병철 박사
세계 첫 항체 무관 혈우병 A·B 치료제 '피투시란'큐피틀리아(Qfitlia, 성분명 피투시란, Fitusiran, 사노피)는 GalXC 기술 플랫폼을 기반으로 개발된 항트롬빈(antithrombin)을 표적으로 하는 소간섭 리보핵산(small interfering RNA, siRNA) 치료제다.이 약제는 2024년 유럽의약청(EMA) 에서, 이어 올해 3월 미국 식품의약국(FDA) 에서 제VIII인자 또는 제IX인자 억제인자(inhibitor)의 유무와 관계없이, 12세 이상 성인 및 소아 혈우병 A 또는 B 환자에서 출혈 에피소드의 발생을 예방하거나 빈도를 감소시키기 위한 정기적 예방요법(routine prophylaxis)에 ‘두 달에 한번 피하주사’로 승인되었다. 국내에서는 올해 5월 희귀의약품(Orphan drug) 으로 지정되었다.혈우병(hemophilia)은 X염색체 연관 열성 유전질환으로, 제Ⅷ인자(FVIII) 또는 제Ⅸ인자(FIX) 의 결핍으로 인해 혈액응고 연쇄반응(coagulation cascade) 이 정상적으로 진행되지 못하며, 그 결과 트롬빈(thrombin) 생성 부족으로 지혈(hemostasis) 이 저하된다. 이러한 병태생리적 이상은 반복적인 출혈, 특히 관절 출혈을 초래하여 만성 관절병증(chronic arthropathy) 및 삶의 질 저하로 이어진다.기존의 표준 치료는 응고인자제제(clotting factor concentrate, CFC) 의 정맥 내 투여를 통한 인자 보충요법(replacement therapy) 이었다. 그러나 이 방식은 정맥 투여의 불편성, 반복적 투여 부담, 그리고 항체(억제인자, inhibitor) 형성으로 인한 치료 저항성이라는 한계를 지닌다.이에 따라 최근에는 비(非)응고인자 기반 치료(non-factor therapy) 의 개발이 활발히 이루어지고 있으며, 그중에서도 RNA 간섭(RNA interference, RNAi) 기술을 이용한 피투시란(Fitusiran) 은 새로운 치료 옵션으로 주목 받고 있다.피투시란은 간세포 내에서 항트롬빈(antithrombin, AT) 합성을 억제하도록 설계된 siRNA 기반 치료제로, 내인성 응고 조절 인자의 발현을 조절함으로써 응고 균형(hemostatic balance) 을 회복시키는 새로운 접근법을 제시한다.피투시란의 승인은 다국가, 무작위배정, 대조, 3상 임상시험들로 구성된 ATLAS 임상 프로그램의 결과를 근거로 하였다.이 프로그램에는 ATLAS-A/B, ATLAS-INH, 그리고 ATLAS-PPX 연구가 포함되며, 각각 혈우병 A 또는 B 환자 중 인자 억제인자의 유무, 그리고 기존 예방요법(prophylaxis) 사용 여부에 따라 구분되었다.ATLAS-A/B 연구는 억제인자가 없는(non-inhibitor) 혈우병 A 또는 B 환자를 대상으로, ATLAS-INH 연구는 억제인자가 존재하는(inhibitor-positive) 환자를 대상으로 수행되었다. ATLAS-PPX 연구는 기존 예방요법을 받고 있던 환자에서 피투시란으로 전환했을 때의 출혈률 변화를 평가하였다.이들 연구에서 피투시란은 월 1회 피하주사(subcutaneous injection) 투여만으로도 연간 출혈률(annualized bleeding rate, ABR)을 기존 치료 대비 약 90% 이상 유의하게 감소시켰으며, 절반 이상의 환자에서 무출혈(ABR = 0)이 관찰되었다. 또한 억제인자 유무와 관계없이 일관된 출혈 억제 효과가 확인되었다.혈우병이란 무엇인가?혈우병(hemophilia)은 그리스어 ‘hemo(피)’와 ‘philia(사랑하다)’에서 유래한 용어로, 1828년 Schönlein에 의해 Hämophilie라 명명됐다. 19세기 말 유럽 왕실 내 근친혼으로 인해 영국, 스페인, 독일, 러시아 등 여러 나라에서 다수의 환자가 발생하면서 ‘왕실병(The Royal Disease)’이라는 별칭을 얻었다.혈우병은 혈액응고인자의 결핍으로 인해 발생하는 대표적인 선천성 출혈성 질환이다. 제VIII응고인자(FVIII)의 결핍은 혈우병 A로, 전체 환자의 약 80~85%를 차지하며 ‘고전적 혈우병(classic hemophilia)’이라 불린다. 제IX응고인자(FIX)의 결핍은 혈우병 B로 약 15%를 차지하며, 최초 환자의 이름을 따 ‘크리스마스병(Christmas disease)’으로도 알려져 있다. 제XI응고인자(FXI)의 결핍은 혈우병 C로 상대적으로 드물게 발생한다.혈우병 A와 B는 X 염색체 열성 유전 양식을 가지므로 주로 남성에서 발병하며, 여성은 보인자로 존재하거나 드물게 태아기에 사망하기도 한다. 반면 혈우병 C는 4번 염색체 이상에 기인하므로 성별에 관계없이 발생할 수 있으며, 일부 환자에서는 가족력 없이 자연 발생적 유전자 변이에 의해 발현되기도 한다.혈우병과 유사한 질환으로는 폰빌레브란트병(von Willebrand disease, vWD)이 있다. 이는 응고인자 VIII과 결합하는 폰빌레브란트인자(vWF)의 결핍으로 인해 혈우병과 유사한 임상 양상을 보인다.이외에도 프로트롬빈(II), 피브리노겐(I), V, VII, X, XII, XIII 응고인자의 결핍으로 인한 선천성 응고장애가 보고되어 있으나, 이러한 질환들은 혈우병의 범주에는 포함되지 않는다.혈액응고 과정은 어떻게 일어나는가?혈액응고는 인체의 항상성을 유지하기 위한 필수적인 생리적 방어기전으로, 외상이나 혈관 손상 시 과도한 출혈을 방지하는 역할을 한다. 이 과정은 혈관수축, 혈소판 기능, 그리고 혈액응고인자의 연속적인 활성화로 이루어지는 응고 연쇄(cascade)로 설명되며, 궁극적으로 안정적인 피브린 혈전(fibrin clot)을 형성한다.혈액응고인자(Coagulation factors)는 주로 간에서 합성되는 단백질로, 로마 숫자로 표기된 I번부터 XIII번까지의 인자가 알려져 있다. 이들은 각각 특정 효소 활성 또는 보조인자로 작용하면서 정교하고 단계적인 반응을 매개한다. 주요 응고인자로는 피브리노겐(Factor I), 프로트롬빈(Factor II), 그리고 프로트롬빈 복합체를 구성하는 V, VII, IX, X, XI, XII 인자, 마지막으로 XIII 인자 등이 있다. 응고 연쇄는 크게 내인성 경로(intrinsic pathway), 외인성 경로(extrinsic pathway), 그리고 두 경로가 합류하는 공통 경로(common pathway)로 구성된다.내인성 경로는 Factor XII의 활성화를 시작으로 XI, IX, VIII 인자가 순차적으로 활성화되며, 외인성 경로는 조직인자(tissue factor, TF)와 Factor VII의 상호작용을 통해 개시된다.두 경로는 Factor X의 활성화 단계에서 공통 경로로 수렴하며, 활성화된 Factor X는 Factor V와 결합하여 프로트롬비나제(prothrombinase) 복합체를 형성한다. 이 복합체는 프로트롬빈(Factor II)을 트롬빈(thrombin)으로 전환시키고, 생성된 트롬빈은 피브리노겐(Factor I)을 불용성 피브린(fibrin)으로 전환시켜 최종적으로 혈전을 완성한다.또한 트롬빈은 Factor V, VIII, XI 등을 다시 활성화시키는 양성 되먹임(positive feedback) 작용을 통해 응고 반응을 증폭시키며, Factor XIII을 활성화시켜 피브린 가교결합(fibrin cross-linking)을 형성함으로써 혈전의 안정성을 더욱 높인다.이러한 정교한 연쇄 반응은 항응고 단백질(antithrombin, protein C/S system 등)과 섬유소 용해(fibrinolysis) 기전 간의 정밀한 균형 속에서 조절된다. 이 균형이 깨질 경우 출혈성 질환이나 혈전성 질환으로 이어질 수 있다.항트롬빈(Antithrombin, AT, heparin cofactor I)은 어떤 물질인가?항트롬빈(AT)은 혈액응고 조절에서 가장 중요한 내인성 항응고인자로, 전체 생리적 응고 억제 작용의 약 70~80%를 담당하는 핵심 단백질이다. AT는 혈장에 존재하는 세린 단백질분해효소 억제제(serpin) 계열의 당단백질로, 주된 표적은 트롬빈(thrombin)이지만, Factor Xa, IXa, XIa, XIIa 및 칼리크레인(kallikrein) 등 다양한 혈액응고인자를 동시에 억제함으로써 응고 연쇄(cascade) 전반의 균형 유지에 기여한다.The Coagulation Cascade(출처: Ann Pharmacother . 2016 Sep;50(9):758-67). AT는 트롬빈의 활성 중심부에 위치한 세린(serine) 잔기와 1:1 비율로 결합하여 불활성 복합체를 형성함으로써 트롬빈 활성을 차단한다. 이를 통해 소규모 응고 반응이나 불필요한 혈전 형성을 신속히 억제하며, 정상적인 생리 상태에서 과도한 혈액응고를 방지하는 핵심 역할을 수행한다.그러나 대규모 혈관 손상이나 파종성 혈관내응고(Disseminated intravascular coagulation, DIC)와 같이 트롬빈 생성이 폭발적으로 증가하는 상황에서는 AT의 억제 능력이 상대적으로 부족해져, 생리적 항응고 메커니즘만으로는 병적 혈전 형성을 완전히 제어하기 어렵다.AT의 항응고 활성이 가장 강력하게 발휘되는 조건은 헤파린(heparin)의 존재 하에서이다. 헤파린은 AT에 결합하여 구조적 변화를 유도하고, AT와 트롬빈 및 Factor Xa 간의 결합 친화도를 수백 배 이상 증폭시킨다.이로 인해 헤파린은 AT의 촉매제(cofactor) 역할을 하며, 임상적으로 항응고 효과를 발휘하는 주요 기전이 바로 AT 매개 억제 반응이다. 이러한 이유로 AT 결핍 환자에서는 헤파린의 항응고 효과가 현저히 감소하며, 이는 선천성 또는 후천성 AT 결핍에서 혈전성 질환 발생 위험이 증가하는 중요한 근거가 된다.AT는 간에서 합성되며 혈중 농도는 약 0.15mg/mL로 유지되고, 정상 활성도는 80~120% 범위 내에 있다. 선천성 AT 결핍은 드문 질환이지만 정맥혈전증과 폐색전증 발생의 중요한 위험 요인으로 알려져 있으며, 후천성 결핍은 간질환, 신증후군, DIC, 항응고제 치료 등 다양한 상황에서 관찰된다. AT 농도의 감소는 항응고 균형을 무너뜨려 과도한 혈전 형성을 유발하므로, 임상적으로 AT 농축제제 보충 또는 헤파린·직접 트롬빈 억제제와 같은 항응고 요법을 병행하는 치료 전략이 고려된다.이처럼 AT는 단순한 혈액응고인자 억제 단백질을 넘어, 혈액응고와 항응고, 그리고 섬유소 용해(fibrinolysis) 시스템 사이의 미세한 균형을 유지하는 핵심 조절인자로서, 혈전성 질환의 병태생리 이해와 새로운 항응고 치료제 개발에 있어 중요한 연구 대상이 되고 있다.혈우병 A 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor Replacement Therapy) 혈우병 A의 전통적인 치료는 부족한 제Ⅷ인자(FVIII)를 직접 보충하는 방식이다. 초기에는 혈액 유래 FVIII 제제가 사용되었으나, 감염 위험 등 안전성 문제가 제기되면서 현재는 재조합 FVIII(rFVIII)이 표준으로 자리잡았다. 또한 최근에는 반감기를 연장한 FVIII 제제들이 개발되어 투여 빈도를 줄이고 환자 순응도를 높이는 데 기여하고 있다.1) 표준 반감기(Standard half-life, SHL) FVIII 제제 표준 반감기 제제는 혈액 유래 FVIII와 재조합 FVIII로 나눌 수 있다. 혈액 유래 제제는 감염 위험 관리가 필요하지만 여전히 일부에서 사용되고 있으며, 재조합 FVIII로 애드베이트(AdvateⓇ, 코지네이트 에프에스(Kogenate FSⓇ) 등은 안전성 측면에서 더 선호된다.2) 반감기 연장형(Extended half-life, EHL) FVIII 제제 반감기 연장형 제제는 투여 간격을 늘리기 위해 Fc-fusion(엘록테이트, EloctateⓇ), PEGylation(애디노베이트, AdynovateⓇ, 지비, JiviⓇ) 등 다양한 기술이 적용되었다. 이러한 약제들은 환자의 주사 횟수를 줄여 장기적인 치료 순응도를 개선하는 장점이 있다.3) VWF-independent EHL(VWF 비의존성 반감기 연장형) FVIII 제제 VWF 비의존성 반감기 연장형 제제인 알투비오(AltuviiioⓇ)는 주 1회 주사로 FVIII 활성을 더 오래 유지할 수 있도록 설계된 최신형 지속형 치료제(high sustained factor, HSF)로 2023년 미 FDA에서 승인되었고 국내에서는 진행중이다,2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 A 환자의 약 20~30%는 치료 과정에서 FVIII에 대한 억제항체를 형성하게 되며, 이 경우 기존의 FVIII 보충요법은 효과가 제한적이다. 억제인자 환자의 치료에는 크게 두 가지 접근법이 있다.첫째, 우회제제(bypassing agents, BPA)를 사용하는 방법이다. 활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBAⓇ)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSevenⓇ)는 응고경로를 우회적으로 활성화하여 지혈 효과를 발휘하지만, 지혈 반응의 변동성과 혈전 위험이라는 한계가 존재한다.둘째, 에미시주맙(Emicizumab, HemlibraⓇ)는 FIXa와 FX를 연결하여 FVIII의 기능을 모방하는 이중특이성 항체로, 억제인자 환자뿐 아니라 비(非)억제인자 환자에서도 예방요법으로 사용 가능하다. 피하 주사로 1주~4주 간격 투여가 가능하여 투여 편의성이 획기적으로 개선되었다.3. 대체 인자제제(Replacement therapy) 재조합 돼지 유래 FVIII(r-pFVIII)인 오비주르(Obizur®, Susoctocog alfa)는 2014년 미 FDA, 2015년 EMA 그리고 2023년 국내에서 ‘성인 후천성 혈우병 A(Acquired Haemophilia A, AHA) 환자의 출혈 에피소드 치료’에 승인되었다. 후천성 혈우병 A는 선천성 혈우병과 다르게, 정상 혈액응고인자 VIII(FVIII) 수준을 가지고 있지만, 이에 대해 자가면역 항체(중화 항체)가 생겨 혈액 응고 기능이 저해되어 출혈 위험이 커지는 인구 100만 명당 약 1명꼴로 발생하는 초희귀 자가면역 응고질환이다.4. 비응고인자 기반 치료(Non-factor Therapy) 최근 혈우병 A 치료에서 가장 주목받는 변화는 FVIII를 직접 보충하지 않고, 다른 경로를 통해 응고 균형을 회복하는 비응고인자 기반 치료이다. 대표적인 약제가 에미시주맙(Emicizumab, HemlibraⓇ)으로, FIXa와 FX을 연결하여 FVIII의 보조인자 기능을 모방하는 이중특이성 항체이다. 피하 주사로 주 1회, 격주, 또는 4주 간격 투여가 가능해 환자의 치료 편의성이 획기적으로 개선되었다.이외에도 피투시란(Fitusiran)과 콘시주맙(Concizumab, Alhemo®)가 있다. 피투시란은 RNA 간섭(RNAi) 기술을 이용하여 간세포에서 항트롬빈 합성을 억제함으로써 응고 활성을 높인다. 월 1회 피하 주사가 가능하지만, 혈전 및 간독성 발생 위험으로 인해 항트롬빈 활성(15–35%)을 유지하는 개별화 용량조절(AT-DR)이 필요하다. 콘시주맙은 조직인자경로억제인자(TFPI)를 차단하여 내인성 응고를 촉진하는 약제이다.5. 유전자 치료(Gene Therapy) 혈우병 A에서 유전자 치료는 단회 정맥투여를 통해 간세포에 FVIII 유전자를 도입하여 장기간 발현을 유도하는 새로운 전략이다. 대표적인 약제가 록타비안(RoctavianⓇ, Valoctocogene roxaparvovec)으로, AAV5 벡터를 이용해 개발되었으며 2022년 유럽, 2023년 미국 FDA의 승인을 받았다.단일 투여로 FVIII 발현을 장기간 유지할 수 있어 치료 패러다임의 변화를 예고했으나, 발현 지속 기간의 불확실성, 간효소 상승, 재투여 불가 등의 문제점이 여전히 남아 있다.혈우병 B 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor IX Replacement Therapy) 혈우병 B의 가장 기본적인 치료는 부족한 제Ⅸ인자(FIX)를 직접 보충하는 방식이다. 과거에는 혈액 유래 제제가 널리 사용되었으나, 감염 위험 문제로 현재는 재조합 FIX(rFIX) 제제가 주로 사용된다. 여기에 더해 반감기를 연장한 제제들이 개발되면서 투여 간격이 길어지고 환자의 치료 순응도가 크게 향상되었다.1) 표준 반감기(Standard half-life, SHL) FIX 제제 표준 반감기 FIX 제제는 투여 후 약 18~24시간의 반감기를 가지며, 주 2~3회 정맥 주사가 필요하다. 혈액 유래 FIX 제제는 여전히 일부에서 사용되지만, 바이러스 감염에 대한 안전성 우려가 있었다. 이를 보완하기 위해 개발된 재조합 FIX 제제인 베네픽스(BeneFIXⓇ, Nonacog alfa)는 안전성이 확보되어 현재 임상에서 가장 널리 사용되고 있다.2) 반감기 연장(Extended half-life, EHL) FIX 제제 반감기 연장 제제는 기존 표준 제제보다 3~5배 긴 반감기를 가지며, 1~2주 간격으로 투여가 가능하다. 이들 약제에는 Fc-fusion 단백을 이용한 알프로릭스(Alprolix(Ⓡ, Eftrenonacog alfa), albumin-fusion 기술이 적용된 아이델비온(IdelvionⓇ Albutrepenonacog alfa) 등이 포함된다. 이러한 제제들은 주사 횟수를 줄여 환자의 삶의 질과 치료 순응도를 높이는 중요한 진보로 평가된다.2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 B 환자에서 억제인자 발생은 상대적으로 드물지만, 일단 형성되면 치료가 매우 어렵다. 억제인자가 형성된 경우 기존 FIX 제제의 효과가 소실되므로 우회제제(bypassing agents)가 사용된다.활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBAⓇ)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSevenⓇ)가 대표적이다. 그러나 혈우병 A와 달리 에미시주맙은 FVIII 기능을 모방하는 기전이기 때문에 혈우병 B 환자에게는 효과가 없다. 따라서 억제인자 환자의 치료는 여전히 제한적이며, 새로운 치료 전략이 필요한 영역이다.3. 비응고인자 기반 치료(Non-factor Therapy) 혈우병 B에서도 비응고인자 기반 치료가 적용될 수 있다. 이들 약제는 특정 응고인자를 보충하지 않고 응고 균형 자체를 조절하는 기전을 갖는다. 대표적으로 RNA 간섭 기반의 피투시란(Fitusiran)은 간세포에서 항트롬빈 합성을 억제하여 응고 활성을 증가시키며, 혈우병 A와 B 모두에 승인되었다.또한 항 TFPI 항체인 콘시주맙(Concizumab, Alhemo®) 역시 혈우병 A와 B 모두에 적용 가능하며, 내인성 응고경로를 촉진하여 출혈을 억제한다. 이처럼 비응고인자 기반 치료는 억제인자 보유 여부와 관계없이 사용할 수 있는 장점이 있어, 혈우병 B 환자에서도 중요한 치료 대안으로 부상하고 있다.4. 유전자 치료(Gene Therapy) 혈우병 B는 유전자 치료 분야에서 가장 먼저 성과를 낸 질환 중 하나이다. FIX 유전자의 크기가 FVIII보다 작아 AAV 벡터 전달이 용이하기 때문에, 임상개발이 상대적으로 앞서 진행되었다.대표적인 약제는 헴제닉스(HemgenixⓇ, Etranacogene dezaparvovec)으로, 2022년 미국 FDA와 2023년 유럽 EMA에서 세계 최초로 혈우병 유전자 치료제로 승인되었다. 단회 정맥투여만으로 간세포에서 FIX 발현이 장기간 유지될 수 있으며, 환자의 치료 부담을 획기적으로 줄일 수 있다. 그러나 여전히 발현 지속 기간의 변동성, 간효소 상승, 재투여 불가 등의 문제점이 존재하며, 고가의 치료비용 역시 중요한 사회적 논의 대상이 되고 있다.피투시란은 어떤 약제인가?피투시란은 안티트롬빈(AT) mRNA를 절단·분해하여 AT 발현을 억제함으로써 혈중 AT 농도를 감소시키는 기전을 가진다. siRNA 치료제는 RNAi 과정을 활용하는 대표적인 플랫폼으로, 표적 mRNA를 인식하고 분해하도록 설계된 합성 RNA 이중가닥 구조를 기반으로 한다. 이 과정은 특정 단백질의 번역을 저해하여 표적 단백질의 합성을 효과적으로 억제한다.피투시란은 화학적으로 안정화된 이중가닥 siRNA로 설계되어 뉴클레아제에 의한 분해나 Toll-like receptor(TLR)3, TLR7 등 선천면역 수용체의 인식을 회피한다. 특히 리보뉴클레오티드의 2′-데옥시-2′-플루오로 치환, 2′-O-메틸 치환, 인산 골격의 선택적 변형이 적용되어 높은 안정성과 생체 내 지속성을 확보하였다.이 siRNA는 삼중 안테나(tri-antenna) 형태의 N-아세틸갈락토사민(GalNAc) 잔기와 결합되어 있으며, 간세포 표면의 아실글리코프로테인 수용체(asialoglycoprotein receptor, ASGPR)를 통해 효율적으로 간세포 내로 전달된다. 세포 내로 흡수된 후 산성 환경에서 siRNA는 ASGPR로부터 해리되고, 엔도솜을 탈출하여 세포질 내 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 탑재된다.RISC는 siRNA의 안티센스(antisense) 가닥을 선택적으로 유지하고, 이를 이용해 표적 유전자인 SERPINC1 mRNA를 서열 특이적으로 절단·분해함으로써 AT 발현을 억제한다. 이 과정의 결과로 혈중 AT 농도가 감소하며, 그에 따라 트롬빈 생성이 증가하여 혈우병 환자의 응고능이 향상된다.RISC 내 안티센스 가닥은 세포 내에서 수 주간 안정적으로 존재하면서 반복적으로 전사체 절단을 매개하므로, 세포당 수백 개 수준의 siRNA 분자만으로도 강력하고 지속적인 knockdown 효과를 낸다. 이러한 특성 덕분에 피투시란은 임상시험에서 한 달에 한 번의 피하 투여만으로도 충분한 약효를 유지할 수 있는 장점을 보인다.Antithrombin Knockdown by Fitusiran(출처: Molecular Therapy Vol. 28 No 3 April 2020).피투시란의 약리 기전은?피투시란은 간에서 합성되는 AT(antithrombin) mRNA를 표적하는 siRNA로 개발된 약제로, 항트롬빈 발현을 효율적으로 억제함으로써 체내의 친응고 상태를 강화하는 새로운 치료 전략이다.즉, AT 억제 작용을 통해 내인성 및 외인성 경로 모두에서 Factor Xa와 트롬빈의 활성을 증가시켜 응고 연쇄의 효율성을 회복시키며, 그 결과 FVIII 또는 FIX 결핍이 있는 혈우병 환자에서도 출혈 위험을 효과적으로 감소시킨다.The Role of Thrombin and Antithrombin in Hemostasis, and the Mechanism of Action of Fitusiran(출처: Res Pract Thromb Haemost. 2023;7:e100179).피투시란은 혈우병 A 또는 B 환자의 출혈 예방을 위해 2개월에 한 번 피하 주사로 투여된다. 초기 권장 용량은 50mg이며, 이후 항트롬빈 활성도를 모니터링하여 용량과 투여 간격을 조정한다. 목표 AT 활성도는 15~35% 사이로 유지하는 것이 바람직하다.AT 활성도가 15% 미만으로 떨어질 경우 용량을 줄이고, 35% 이상으로 증가하면 용량을 늘릴 수 있다. 예를 들어, 50mg을 2개월 간격으로 투여하던 환자의 AT 활성도가 35%를 초과할 경우, 동일 용량을 매월 투여하도록 변경할 수 있다.약동학 연구에서 피투시란은 혈장에서 비교적 짧은 반감기(약 3~5시간)를 보였으나, 모든 임상시험 용량군에서 투여 중단 후에도 수개월간 AT 감소 효과가 지속되었다. 평균 AT 회복 속도는 한 달에 약 10~15% 수준이었으며, 이 기간 동안 트롬빈 생성은 억제되고 출혈 사건 발생 위험은 증가하는 경향을 보였다.투여 중단 후 약 5개월 시점에서 중앙값 AT 수치는 약 60% 이상으로 회복되었다. 약력학적 분석 결과, AT 억제 효과는 첫 투여 후 약 15~28일 사이에 나타났으며, 개인 간 AT 감소 정도에는 차이가 있으나 개인 내에서는 일정하게 유지되어 지속적인 지혈 보호 효과를 제공하는 것으로 확인되었다.피투시란은 또한 비인자(non-factor) 치료제 중 유일하게 특정 역전제(reversal agent)를 보유한 약제로, 이는 재조합 또는 혈장 유래 항트롬빈 제제 형태로 제공된다. 이러한 역전제는 돌파성 출혈 시 다른 지혈제와 병용할 경우 혈전증 위험을 조절할 수 있다는 점에서 임상적으로 중요한 의미를 갖는다.한편, 혈중 AT 감소가 표준 응고 검사에 직접적인 영향을 미치지 않는다는 점은, CFC(concentrated factor concentrate) 또는 BPA(bypassing agent)를 사용하는 상황이나 수술 시 지혈 상태 및 인자 수치를 보다 용이하게 모니터링할 수 있음을 시사한다.피투시란(QFITLIA)의 허가임상은 어떠한가?성인 및 12세 이상의 소아 환자에서 억제인자(inhibitors)의 존재 여부와 관계없이 혈우병 A 또는 B를 가진 환자에서 QFITLIA의 유효성과 안전성은 두 건의 임상시험에서 입증되었다.-억제인자가 있는 혈우병 A 또는 B: ATLAS-INH -억제인자가 없는 혈우병 A 또는 B: ATLAS-A/B위의 본 임상시험에 참여한 환자들은 장기 연장 연구인 ATLAS-OLE로 이월되었다.임상시험 ATLAS-INH 및 ATLAS-A/B에서는 QFITLIA 80mg 고정 월 1회 용량을 시험하였다. 그러나 이 용량에서 혈전성 사건(thrombotic events)이 발생하여, ATLAS-OLE에서는 항트롬빈(AT) 활성 15–35%를 목표로 하는 QFITLIA AT-DR 용법이 도입되었다.AT-DR 용법은 ATLAS-INH 및 ATLAS-A/B 연구가 거의 완료될 시점에 도입되었으므로, QFITLIA AT-DR 치료의 유효성은 장기 연장 연구 ATLAS-OLE에서 얻어진 AT-DR 치료 데이터를 ATLAS-INH 및 ATLAS-A/B 연구의 대조(control) 데이터와 비교하여 평가되었다.유효성 분석은 본 임상시험들의 무작위 배정(randomization)을 보존하면서, 부모 연구(parent studies)에서의 의도한 치료(intent-to-treat, ITT) 원칙에 따라 수행되었다.[ATLAS-INH] ATLAS-INH은 혈우병 A 또는 B 환자 중 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체를 가진 성인 및 소아 남성 환자(≥12세) 57명을 대상으로 실시된 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 이들은 모두 과거에 출혈 시 우회제제(BPAs)를 필요에 따라(episodic, on-demand) 투여받은 병력이 있었다.대상 환자들은 2:1 비율로 무작위 배정되어, 월 1회 80mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=38)과, 돌발 출혈(breakthrough bleeding) 발생 시 BPA를 필요에 따라 투여받은 군(N=19)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg 용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다. 현재 50mg과 20mg이 허가되어 있다.[ATLAS A/B] ATLAS A/B는 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체가 없는 혈우병 A 또는 B 환자를 대상으로 한 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 대상자는 모두 성인 및 소아 남성(≥12세)으로, 과거에 출혈 시 응고인자제제(CFC)를 필요에 따라(on-demand, episodic) 투여받은 병력이 있었다.대상 환자 120명은 2:1 비율로 무작위 배정되어, 월 1회 80 mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=80)과, 돌발 출혈 발생 시 CFC를 필요에 따라 투여받은 군(N=40)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다.[ATLAS-OLE] 총 227명의 환자가 두 임상시험(ATLAS-INH 및 ATLAS-A/B)과, CFC 또는 BPA 예방요법을 받던 환자를 대상으로 한 교차 임상시험 ATLAS-PPX에서 이월되어 ATLAS-OLE 연구에서 QFITLIA 치료를 받았다. 이 다기관 공개 연장 임상시험은 FVIII 또는 FIX 억제항체 유무와 관계없이, 12세 이상의 성인 및 소아 남성 혈우병 A 또는 B 환자에서 QFITLIA의 장기적인 안전성과 유효성을 평가하였다.대상자는 초기에는 월 1회 80mg QFITLIA 피하 주사를 투여받았으나, 연구가 개정되어 AT-DR(항트롬빈 활성 15–35% 목표) 용법의 유효성과 안전성을 평가하도록 설계가 변경되었다. 이후 총 213명의 환자가 AT-DR로 전환되었다.AT-DR에서는 시작 용량이 50mg 격월(2개월 간격) 투여였으며, INNOVANCE Antithrombin 분석법을 이용해 측정한 AT 활성 수치에 따라 개별적으로 용량을 조정하였다. 용량은 50mg 월 1회 또는 80mg 월 1회로 증량하거나, 20mg 격월 또는 20mg 월 1회로 감량할 수 있었다.AT 활성 수치가 최저 용량에서도2025-10-23 23:25:17최병철 박사 -
 분류 논란 '니코틴 스프레이' 일반약으로 뒤늦게 허가[데일리팜=이탁순 기자] 니코틴 성분의 스프레이 제형 금연보조제가 국내 첫 허가를 받았습니다. 해외에서는 이미 오랫동안 사용돼 왔지만, 국내에서는 오남용 문제로 전문의약품 분류 결정이 나오면서 시장에 출시되지 못했습니다. 하지만 이번에는 일반의약품 분류 결정이 나오면서 시장 판매가 가능해졌습니다.전문의약품 가운데는 국내 개발 40호 신약이 허가됐습니다. 바로 메디톡스의 '뉴비쥬주'가 그 주인공입니다. 뉴비쥬쥬는 콜산 성분으로, 턱밑 지방 개선 치료에 사용됩니다.식약처는 지난 9월 일반의약품 40개, 전문의약품 84개 품목을 허가했습니다. 이 가운데 신약은 3개로 뉴비쥬쥬를 포함해 현대약품 윈레비크림(클라스코테론), 레오파마 엔줍고크림(델고시티닙)이 허가를 받았습니다. ◆일반의약품 =9월 허가(신고)된 일반의약품으로 총 40개로, 표준제조기준 유형이 25개로 가장 많았습니다. 이어 제네릭 등 기타 품목이 14개 품목, 안전성·유효성 심사 제외 품목도 1개가 있었습니다. 안·유 심사 제외 품목은 니코틴 성분 스프레이 제형 금연보조제 '니코레트퀵미스트구강용스프레이'입니다. 하지만 이 제품은 실제로는 안전성·유효성 자료가 제출돼 일반의약품 분류를 받았습니다.한국존슨앤드존슨판매 '니코레트퀵미스트구강용스프레이'(안·유 심사 제외, 9월 15일 허가)니코틴 성분의 스프레이 제형 금연보조제가 일반의약품으로 첫 허가를 받았습니다.식약처는 지난 9월 15일 한국존슨앤드존슨판매 '니코레트퀵미스트구강용스프레이'를 품목 허가했습니다.니코레트 브랜드는 우리나라에서도 껌과 패취 제형으로 판매되며 인지도가 높은 금연보조제입니다. 다만 국내에서는 해외와 달리 스프레이 제형 제품이 출시되지 않았습니다. 분류 논란 때문이었습니다.지난 2019년에도 이 제품이 허가 신청됐으나, 당시 식약처는 이 제품을 전문의약품으로 분류했습니다. 당시 이를 논의했던 중앙약사심의위원회(중앙약심)는 스프레이 제형이 청소년에게 오남용을 부추길 수 있다며 전문의약품으로 분류해야 한다는 결정을 내렸습니다.하지만 6년만에 다시 열린 중앙약심은 임삼시험 자료와 시판 후 안전성을 근거로 위원 전원이 일반의약품으로 분류하자는 의견을 모았습니다. 다만, 오남용 우려를 차단하기 위해 용기에 경고 문구 추가와 정보 제공, 주기적 모니터링 등을 조건을 걸었습니다.이에 최종적으로 일반약으로 허가받아 국내 시장 출시가 가능해진 겁니다. 현재 존슨앤드존슨의 소비자 사업부는 분사해 '켄뷰'라는 이름의 독립 회사가 됐습니다. 우리나라에서는 한국존슨앤드존슨판매와 켄뷰코리아가 혼용해 사용되고 있습니다.캔뷰코리아 측은 "니코레트퀵미스트구강용스프레이 국내 출시를 글로벌 본사와 논의 중"이라고 밝혔습니다. 이 제품이 출시되면 금연 소비자의 접근성이 한층 확대될 전망입니다.종근당 '더마그램피디알엔크림'(제네릭, 9월 26일 허가)종근당이 PDRN(폴리데옥시리보뉴크레오티드) 성분의 피부 재생 크림을 허가받고, 파마리서치 '리쥬비넥스크림'에 도전합니다.현재 리쥬비넥스크림은 일반의약품 시장에서 큰 인기를 끌고 있습니다. 여성들의 피부 건강에 대한 관심 증가와 입소문으로 올 한해 일반의약품 매출 순위 탑10에 꾸준히 이름을 올리고 있는 제품입니다.특히 한국을 방문하는 외국 관광객들에게도 소문이 돌면서 리쥬비넥스크림이 쇼핑 1순위 제품으로 인기 몰이 중입니다.PDRN 크림은 피부 및 결합조직의 영양부족 또는 영양부족으로 인한 궤양이 생기기 쉬운 상처, 영양보급에 사용됩니다. PDRN은 연어 정소에서 얻을 수 있는 DNA 조각으로, 피부 조직을 재생하는 데 효과가 있습니다. 주사제뿐만 아니라 화장품 브랜드도 인기를 끌면서 덩달아 일반의약품 크림도 수요가 높아지고 있습니다.이런 상황에서 종근당이 PDRN을 기반으로 한 크림 제형을 허가받으면서 파마리서치 독점 시장에 경쟁이 펼쳐질 것으로 예상됩니다. 종근당도 PDRN의 최근 인기를 지렛대 삼아 마케팅에 심혈을 기울일 것으로 보입니다.종근당의 후발의약품 가세가 약국 시장의 활성화로 이어질지도 기대됩니다. 동아제약 '판텍타임산제'(표준제조기준, 9월 17일 허가)동아제약이 산제 제형의 감기약을 허가받으며 관심을 모으고 있습니다.9월 17일 허가받은 판텍타임산제는 종합감기약으로, 해열제 성분인 아세트아미노펜을 포함해 클로르페니라민, 리보플라빈, 디페피딘, DL-메틸에페드린 등 감기약 성분이 포함돼 있습니다.만 2세부터 ?ㅏ育?가능해 알약을 삼키기 어렵거나 액제형을 마시기 힘든 어린이들에게 유용할 것으로 보입니다.아세트아미노펜 성분의 해열진통제나 감기약에 산제형이 나온 건 오래되지 않았습니다. 어린이타이레놀산160mg 같은 품목이 대표적입니다.어린이의 복용 편의성 향상을 목표로 시장에 나섰지만, 사실 큰 인기는 끌지 못하고 있습니다. 어린이 감기약 시장이 액제형이 중심인데다 산제형은 아직 익숙치 않기 때문입니다.이 제품을 생산하는 코아팜바이오는 산제형을 꾸준히 연구해 온 기업입니다. '오디프스'라는 독보적 산제 기술을 개발해 기존 알약이나 액제형에 적용하고 있습니다.동아제약은 작년에도 코아팜바이오와 손잡고 아세트아미노펜 산제형 제품 2개를 허가를 받았습니다. 이번에는 종합감기약까지 허가받으며 감기약 산제 시장 개척을 추진 중인 것으로 보입니다.사실 이 제품은 처음 허가받을 때는 '판피린타임산제'라는 제품명이었으나, 곧바로 이름을 판텍타임산제로 바꿨습니다. 성인용 감기약으로 잘 알려진 판피린 브랜드보다는 판텍을 선택한 것으로 풀이됩니다. ◆전문의약품 =전문의약품은 총 84개 품목이 지난 9월 허가를 받았습니다. 이 가운데 신약이 3개, 자료제품의약품 35개, 제네릭 등 기타 품목이 43개였습니다. 자료제출의약품이 거의 절반에 가까운 허가를 받았다는 점이 특징입니다.메디톡스 '뉴비쥬주'(신약, 9월 19일 허가)국내 개발 40호 신약이 탄생했습니다. 그 주인공은 보툴리눔톡신 등으로 피부미용 시장을 개척해온 메디톡스의 '뉴비쥬주'입니다.식약처는 지난 19일 턱밑 지방 개선 치료에 사용하는 '뉴비쥬주(콜산)'를 국내에서 개발한 40번째 신약으로 허가했습니다. 이 약의 제조는 JW중외제약이 담당합니다.콜산(Cholic acid)은 간에서 합성되어 담즙으로 분비되는 담즙산의 일종입니다.이 약은 계면활성제 작용에 의한 세포막의 이중지질층 구조를 파괴해 지방세포용해를 야기시켜 턱밑 피하의 지방세포를 감소시키는 치료제로 중등증~중증의 돌출되거나 과도한 턱밑 지방을 개선하고자 하는 성인 환자에게 사용됩니다.임상시험에서 효과를 입증했습니다. 216명을 대상으로 한 유효성 임상시험에서 마지막 투여 12주 후 의사 및 환자 평가 결과 모두 투여 전 대비 1단계 이상 턱밑 지방이 개선된 대상자의 비율은 이 약 투여군 88.57%(93/105명), 위약군 32.43%(36/111명)이었고, 2단계 이상 턱밑 지방이 개선된 대상자의 비율은 이 약 투여군 46.67%(49/105명), 위약군 5.41%(6/111명)로, 뉴비쥬주의 턱밑 지방 개선 효과가 위약군과 비교해 우월함을 입증했습니다.뉴비쥬주는 돌출되거나 과도한 턱밑 지방을 개선하고자 하는 성인 환자에게 치료제 선택의 폭을 확대하는 데 도움을 줄 것으로 기대됩니다.대원제약 '코대원플러스정'(자료제출의약품, 9월 28일 허가)코대원포르테, 코대원에스 등으로 호흡기 질환 치료제 시장에서 높은 점유율을 기록하고 있는 대원제약이 또 하나의 신제품을 통해 성장을 기대하고 있습니다.지난 9월 28일 허가받은 코대원플러스정을 통해서입니다. 코대원 라인업 제품 중 4번째 제품으로 급성 기관지염 치료에 사용됩니다.코대원플러스정은 기존 진해거담제 코대원정(디히드로코데인타르타르산염, 클로르페니라민말레산염, dl-메틸에페드린염산염, 구아이페네신)에 펠라고니움시도이데스11% 에탄올건조엑스 성분을 결합한 복합제입니다. 펠라고니움시도이데스는 급성 기관지염 치료에 쓰이는 항균 및 항바이러스 작용을 하는 생약 성분입니다.임상시험에서 코대원플러스정은 대조군 대비 우월성을 입증했습니다. 국내 273명을 대상으로 임상시험에서 BSS(기관지염 증상도 척도) 총점 변화량에서 대조군 대비 우월성을 입증한 것입니다.대원재약은 큰 기대를 걸고 있습니다. 회사 측은 "코대원플러스정은 기존 치료제 대비 우월한 증상 완화 효과와 입증된 안전성을 바탕으로 의료진과 환자 모두에게 효과적이고 안전한 추가 치료 옵션을 제공하게 될 것"이라면서 "오는 12월 발매를 목표로 준비에 최선을 다하겠다"고 밝혔습니다. JW중외제약 '리바로하이정'(자료제출의약품 9월 24일·30일 허가)JW중외제약이 1000억원 규모의 고지혈증치료제 '리바로'를 활용한 복합제 개발을 꾸준히 하고 있습니다.2제 고혈압-고지혈증 복합제 '리바로브이정'을 시작으로 고지혈증 2제 '리바로젯정', '리바로페노캡슐'에 이어 이번에는 3제 복합제를 허가받는 데 성공했습니다.주인공은 '리바로하이정'입니다. 이 제품은 리바로의 피타바스타틴칼슘수화물과 고혈압치료제 성분인 발사르탄, 암로디핀이 결합된 고혈압-고지혈증 3제 복합제입니다.리바로하이정은 1일 1정으로 암로디핀·발사르탄 복합제와 피타바스타틴을 동시에 투여해야 하는 환자에 사용할 수 있습니다. 관련 환자의 복용 편의성이 크게 향상될 것으로 보입니다.임상시험에서는 발사르탄 160mg과 피타바스타틴 4mg 병용 투여군과 비교해 통계적 유의성을 입증했습니다.JW중외제약의 리바로 확장 전략은 지금까지 성공적입니다. 안전성이 입증된 피타바스타틴을 활용한 이 전략으로 시장 매출이 크게 늘었습니다.리바로가 작년 유비스트 기준 964억원을 기록했고, 리바로젯도 이에 못지 않은 932억원을 기록했습니다. 두 제품만으로 2000억원 가까운 실적을 올린 것입니다.이번 리바로하이정이 복합제 전략의 정점을 찍을지 기대됩니다. 식약처는 지난 9월 24일과 30일 리바로하이정 6개 용량 품목을 허가했습니다.2025-10-12 18:00:46이탁순
분류 논란 '니코틴 스프레이' 일반약으로 뒤늦게 허가[데일리팜=이탁순 기자] 니코틴 성분의 스프레이 제형 금연보조제가 국내 첫 허가를 받았습니다. 해외에서는 이미 오랫동안 사용돼 왔지만, 국내에서는 오남용 문제로 전문의약품 분류 결정이 나오면서 시장에 출시되지 못했습니다. 하지만 이번에는 일반의약품 분류 결정이 나오면서 시장 판매가 가능해졌습니다.전문의약품 가운데는 국내 개발 40호 신약이 허가됐습니다. 바로 메디톡스의 '뉴비쥬주'가 그 주인공입니다. 뉴비쥬쥬는 콜산 성분으로, 턱밑 지방 개선 치료에 사용됩니다.식약처는 지난 9월 일반의약품 40개, 전문의약품 84개 품목을 허가했습니다. 이 가운데 신약은 3개로 뉴비쥬쥬를 포함해 현대약품 윈레비크림(클라스코테론), 레오파마 엔줍고크림(델고시티닙)이 허가를 받았습니다. ◆일반의약품 =9월 허가(신고)된 일반의약품으로 총 40개로, 표준제조기준 유형이 25개로 가장 많았습니다. 이어 제네릭 등 기타 품목이 14개 품목, 안전성·유효성 심사 제외 품목도 1개가 있었습니다. 안·유 심사 제외 품목은 니코틴 성분 스프레이 제형 금연보조제 '니코레트퀵미스트구강용스프레이'입니다. 하지만 이 제품은 실제로는 안전성·유효성 자료가 제출돼 일반의약품 분류를 받았습니다.한국존슨앤드존슨판매 '니코레트퀵미스트구강용스프레이'(안·유 심사 제외, 9월 15일 허가)니코틴 성분의 스프레이 제형 금연보조제가 일반의약품으로 첫 허가를 받았습니다.식약처는 지난 9월 15일 한국존슨앤드존슨판매 '니코레트퀵미스트구강용스프레이'를 품목 허가했습니다.니코레트 브랜드는 우리나라에서도 껌과 패취 제형으로 판매되며 인지도가 높은 금연보조제입니다. 다만 국내에서는 해외와 달리 스프레이 제형 제품이 출시되지 않았습니다. 분류 논란 때문이었습니다.지난 2019년에도 이 제품이 허가 신청됐으나, 당시 식약처는 이 제품을 전문의약품으로 분류했습니다. 당시 이를 논의했던 중앙약사심의위원회(중앙약심)는 스프레이 제형이 청소년에게 오남용을 부추길 수 있다며 전문의약품으로 분류해야 한다는 결정을 내렸습니다.하지만 6년만에 다시 열린 중앙약심은 임삼시험 자료와 시판 후 안전성을 근거로 위원 전원이 일반의약품으로 분류하자는 의견을 모았습니다. 다만, 오남용 우려를 차단하기 위해 용기에 경고 문구 추가와 정보 제공, 주기적 모니터링 등을 조건을 걸었습니다.이에 최종적으로 일반약으로 허가받아 국내 시장 출시가 가능해진 겁니다. 현재 존슨앤드존슨의 소비자 사업부는 분사해 '켄뷰'라는 이름의 독립 회사가 됐습니다. 우리나라에서는 한국존슨앤드존슨판매와 켄뷰코리아가 혼용해 사용되고 있습니다.캔뷰코리아 측은 "니코레트퀵미스트구강용스프레이 국내 출시를 글로벌 본사와 논의 중"이라고 밝혔습니다. 이 제품이 출시되면 금연 소비자의 접근성이 한층 확대될 전망입니다.종근당 '더마그램피디알엔크림'(제네릭, 9월 26일 허가)종근당이 PDRN(폴리데옥시리보뉴크레오티드) 성분의 피부 재생 크림을 허가받고, 파마리서치 '리쥬비넥스크림'에 도전합니다.현재 리쥬비넥스크림은 일반의약품 시장에서 큰 인기를 끌고 있습니다. 여성들의 피부 건강에 대한 관심 증가와 입소문으로 올 한해 일반의약품 매출 순위 탑10에 꾸준히 이름을 올리고 있는 제품입니다.특히 한국을 방문하는 외국 관광객들에게도 소문이 돌면서 리쥬비넥스크림이 쇼핑 1순위 제품으로 인기 몰이 중입니다.PDRN 크림은 피부 및 결합조직의 영양부족 또는 영양부족으로 인한 궤양이 생기기 쉬운 상처, 영양보급에 사용됩니다. PDRN은 연어 정소에서 얻을 수 있는 DNA 조각으로, 피부 조직을 재생하는 데 효과가 있습니다. 주사제뿐만 아니라 화장품 브랜드도 인기를 끌면서 덩달아 일반의약품 크림도 수요가 높아지고 있습니다.이런 상황에서 종근당이 PDRN을 기반으로 한 크림 제형을 허가받으면서 파마리서치 독점 시장에 경쟁이 펼쳐질 것으로 예상됩니다. 종근당도 PDRN의 최근 인기를 지렛대 삼아 마케팅에 심혈을 기울일 것으로 보입니다.종근당의 후발의약품 가세가 약국 시장의 활성화로 이어질지도 기대됩니다. 동아제약 '판텍타임산제'(표준제조기준, 9월 17일 허가)동아제약이 산제 제형의 감기약을 허가받으며 관심을 모으고 있습니다.9월 17일 허가받은 판텍타임산제는 종합감기약으로, 해열제 성분인 아세트아미노펜을 포함해 클로르페니라민, 리보플라빈, 디페피딘, DL-메틸에페드린 등 감기약 성분이 포함돼 있습니다.만 2세부터 ?ㅏ育?가능해 알약을 삼키기 어렵거나 액제형을 마시기 힘든 어린이들에게 유용할 것으로 보입니다.아세트아미노펜 성분의 해열진통제나 감기약에 산제형이 나온 건 오래되지 않았습니다. 어린이타이레놀산160mg 같은 품목이 대표적입니다.어린이의 복용 편의성 향상을 목표로 시장에 나섰지만, 사실 큰 인기는 끌지 못하고 있습니다. 어린이 감기약 시장이 액제형이 중심인데다 산제형은 아직 익숙치 않기 때문입니다.이 제품을 생산하는 코아팜바이오는 산제형을 꾸준히 연구해 온 기업입니다. '오디프스'라는 독보적 산제 기술을 개발해 기존 알약이나 액제형에 적용하고 있습니다.동아제약은 작년에도 코아팜바이오와 손잡고 아세트아미노펜 산제형 제품 2개를 허가를 받았습니다. 이번에는 종합감기약까지 허가받으며 감기약 산제 시장 개척을 추진 중인 것으로 보입니다.사실 이 제품은 처음 허가받을 때는 '판피린타임산제'라는 제품명이었으나, 곧바로 이름을 판텍타임산제로 바꿨습니다. 성인용 감기약으로 잘 알려진 판피린 브랜드보다는 판텍을 선택한 것으로 풀이됩니다. ◆전문의약품 =전문의약품은 총 84개 품목이 지난 9월 허가를 받았습니다. 이 가운데 신약이 3개, 자료제품의약품 35개, 제네릭 등 기타 품목이 43개였습니다. 자료제출의약품이 거의 절반에 가까운 허가를 받았다는 점이 특징입니다.메디톡스 '뉴비쥬주'(신약, 9월 19일 허가)국내 개발 40호 신약이 탄생했습니다. 그 주인공은 보툴리눔톡신 등으로 피부미용 시장을 개척해온 메디톡스의 '뉴비쥬주'입니다.식약처는 지난 19일 턱밑 지방 개선 치료에 사용하는 '뉴비쥬주(콜산)'를 국내에서 개발한 40번째 신약으로 허가했습니다. 이 약의 제조는 JW중외제약이 담당합니다.콜산(Cholic acid)은 간에서 합성되어 담즙으로 분비되는 담즙산의 일종입니다.이 약은 계면활성제 작용에 의한 세포막의 이중지질층 구조를 파괴해 지방세포용해를 야기시켜 턱밑 피하의 지방세포를 감소시키는 치료제로 중등증~중증의 돌출되거나 과도한 턱밑 지방을 개선하고자 하는 성인 환자에게 사용됩니다.임상시험에서 효과를 입증했습니다. 216명을 대상으로 한 유효성 임상시험에서 마지막 투여 12주 후 의사 및 환자 평가 결과 모두 투여 전 대비 1단계 이상 턱밑 지방이 개선된 대상자의 비율은 이 약 투여군 88.57%(93/105명), 위약군 32.43%(36/111명)이었고, 2단계 이상 턱밑 지방이 개선된 대상자의 비율은 이 약 투여군 46.67%(49/105명), 위약군 5.41%(6/111명)로, 뉴비쥬주의 턱밑 지방 개선 효과가 위약군과 비교해 우월함을 입증했습니다.뉴비쥬주는 돌출되거나 과도한 턱밑 지방을 개선하고자 하는 성인 환자에게 치료제 선택의 폭을 확대하는 데 도움을 줄 것으로 기대됩니다.대원제약 '코대원플러스정'(자료제출의약품, 9월 28일 허가)코대원포르테, 코대원에스 등으로 호흡기 질환 치료제 시장에서 높은 점유율을 기록하고 있는 대원제약이 또 하나의 신제품을 통해 성장을 기대하고 있습니다.지난 9월 28일 허가받은 코대원플러스정을 통해서입니다. 코대원 라인업 제품 중 4번째 제품으로 급성 기관지염 치료에 사용됩니다.코대원플러스정은 기존 진해거담제 코대원정(디히드로코데인타르타르산염, 클로르페니라민말레산염, dl-메틸에페드린염산염, 구아이페네신)에 펠라고니움시도이데스11% 에탄올건조엑스 성분을 결합한 복합제입니다. 펠라고니움시도이데스는 급성 기관지염 치료에 쓰이는 항균 및 항바이러스 작용을 하는 생약 성분입니다.임상시험에서 코대원플러스정은 대조군 대비 우월성을 입증했습니다. 국내 273명을 대상으로 임상시험에서 BSS(기관지염 증상도 척도) 총점 변화량에서 대조군 대비 우월성을 입증한 것입니다.대원재약은 큰 기대를 걸고 있습니다. 회사 측은 "코대원플러스정은 기존 치료제 대비 우월한 증상 완화 효과와 입증된 안전성을 바탕으로 의료진과 환자 모두에게 효과적이고 안전한 추가 치료 옵션을 제공하게 될 것"이라면서 "오는 12월 발매를 목표로 준비에 최선을 다하겠다"고 밝혔습니다. JW중외제약 '리바로하이정'(자료제출의약품 9월 24일·30일 허가)JW중외제약이 1000억원 규모의 고지혈증치료제 '리바로'를 활용한 복합제 개발을 꾸준히 하고 있습니다.2제 고혈압-고지혈증 복합제 '리바로브이정'을 시작으로 고지혈증 2제 '리바로젯정', '리바로페노캡슐'에 이어 이번에는 3제 복합제를 허가받는 데 성공했습니다.주인공은 '리바로하이정'입니다. 이 제품은 리바로의 피타바스타틴칼슘수화물과 고혈압치료제 성분인 발사르탄, 암로디핀이 결합된 고혈압-고지혈증 3제 복합제입니다.리바로하이정은 1일 1정으로 암로디핀·발사르탄 복합제와 피타바스타틴을 동시에 투여해야 하는 환자에 사용할 수 있습니다. 관련 환자의 복용 편의성이 크게 향상될 것으로 보입니다.임상시험에서는 발사르탄 160mg과 피타바스타틴 4mg 병용 투여군과 비교해 통계적 유의성을 입증했습니다.JW중외제약의 리바로 확장 전략은 지금까지 성공적입니다. 안전성이 입증된 피타바스타틴을 활용한 이 전략으로 시장 매출이 크게 늘었습니다.리바로가 작년 유비스트 기준 964억원을 기록했고, 리바로젯도 이에 못지 않은 932억원을 기록했습니다. 두 제품만으로 2000억원 가까운 실적을 올린 것입니다.이번 리바로하이정이 복합제 전략의 정점을 찍을지 기대됩니다. 식약처는 지난 9월 24일과 30일 리바로하이정 6개 용량 품목을 허가했습니다.2025-10-12 18:00:46이탁순 -
 본안소송도 종료...제약, 콜린 급여축소 공방 최종 고배[데일리팜=천승현 기자] 제약사들이 뇌기능개선제 ‘콜린알포세레이트’의 급여 축소를 두고 5년간 진행된 법정 공방이 최종 종료됐다. 제약사들이 2심 패소 이후 상고를 제기했지만 상고장 각하 명령으로 소송전에 종지부가 찍혔다. 지난달 말 집행정지 기각으로 5년간 보류됐던 급여 축소가 시행됐고, 본안 소송 2건 모두 제약사들의 패소로 마무리됐다.10일 업계에 따르면 서울고등법원 제9-1행정부는 대웅바이오외 12인이 청구한 요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부개정고시 취소 소송에 상고장 각하명령을 내렸다. 상고장 각하는 상고가 성립되지 않았다는 것을 의미한다.항소심 재판부는 보정기간 내에 보정을 하지 않은 경우 또는 상고기간을 넘겨 상고를 제기한 경우 상고장을 각하할 수 있다. 제약사들이 지난 8월 21일 콜린제제 급여 축소 취소소송 항소심 패소한 이후 지난달 1일 상고심을 청구했지만 추가 자료를 제출하지 않으면서 상고심이 성립되지 않았다. 사실상 제약사들이 상고심을 자진 취하한 셈이다.이로써 제약사들이 콜린제제 급여축소 취소소송 본안소송도 마무리되면서 제약사들과 보건당국이 콜린제제 급여축소를 법정 공방은 모두 제약사들의 패소로 종지부를 찍었다. 보건복지부는 2020년 8월 콜린제제의 새로운 급여 기준 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다. 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용이다.제약사들은 콜린제제 급여 축소의 부당함을 따지는 취소 소송을 제기했다. 소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다.종근당 그룹은 지난 2022년 7월 1심에서 패소 판결을 받았고 항소심에서도 지난해 5월 기각 판결이 내려졌다. 종근당 등은 지난해 6월 상고심을 제기했고 지난 3월 대법원에서도 기각 판결이 내려졌다.대웅바이오 그룹은 지난 2022년 11월 패소 판결을 받은 이후 항소심을 청구했고 지난 8월 패소 판결이 나왔다. 상고심 각하명령이 나오면서 5년 만에 본안소송이 종료됐다.콜린제제 급여축소 취소소송 판결문을 보면 제약사들이 부당하다고 주장한 논리는 모두 기각됐다.지난 3월 13일 선고된 종근당 그룹 사건의 대법원 판결문을 보면 재판부는 제약사들이 주장한 절자적 위법성을 인정하지 않았다.제약사들은 콜린제제의 선별급여 대상 지정은 요양 급여대상으로서의 지위가 박탈된 것에 해당하기 때문에 약제의 요양급여대상 여부 직권조정에 관한 요양급여기준규칙에 따라야 하는데 정부는 다른 기준과 절차를 적용했다고 주장했다.하지만 재판부는 “요양급여 대상 약제를 선별급여 대상으로 변경하는 것을 비급여대상으로 변경한 것이라고 할 수 없다”라고 판단했다.제약사들이 콜린제제의 선별급여 변경 과정에서 절차적 권리를 침해 당했다고 주장했는데 재판부는 보건당국이 제약사들에 사전통지와 의견제출 기회, 이의신청 기회까지 보장했다는 점을 들어 절차적 하자가 없었다고 결론내렸다.대법원에서는 콜린제제의 선별급여 대상 지정의 실제적 요건 충족에 대해서도 “행정청이 국민 건강을 보호·증진하고 보험재정 건전성을 유지하고자 하는 목적에서 정하는 바에 따라 전문적인 판단을 했다면 그 판단은 기초가 된 사실인정에 중대한 오류가 있거나 판단이 객관적으로 불합리하거나 부당하다는 등의 특별한 사정이 없는 한 존중돼야 한다”라는 이유로 인정했다.재판부는 콜린제제의 재량권 일탈·남용 지적에 대해서도 “이 사건 고시가 건강보험재정의 건전성을 도모하기 위한 것으로 목적의 정당성과 수단의 적합성이 인정되고, 약제의 일부 질환에 대한 본인부담률을 80%로 정한 것이 침해 최소성이나 법의 균형성 원칙에 위배된다고 볼 수 없다”라고 일축했다.대웅바이오 그룹의 2심 판결에서도 절차적 하자, 실체적 하자, 선별급여 요건 미충족, 재량권의 일탈·남용 등의 문제가 제기됐지만 재판부는 모두 기각했다.제약사들은 종근당 그룹의 대법원 판결에서 언급되지 않은 대체약제 관련 문제를 제기했지만 재판부는 받아들이지 않았다.제약사들은 “정부의 약제급여위원회 회의 자료에서 콜린제제의 대체약제로 제시된 니세르골린 등은 경도인지장애 허가를 받지 않았다”라면서 “아세틸엘카르니틴과 옥세라세탐은 허가가 취소됐다”라고 설명했다.아세틸엘카르니틴과 옥시라세탐은 콜린제제의 급여 축소 결정 당시 콜린제제의 대체약제로 지목됐다. 아세틸엘카르니틴은 ‘일차적 퇴행성 질환’ 또는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’에 사용하도록 허가 받았다. 옥시라세탐은 알츠하이머형 치매, 다발경색성 치매, 뇌기능부전으로 인한 기질성 뇌증후군 등으로 인한 인지장애의 개선 용도로 허가받았다.하지만 아세틸엘카르니틴와 옥시라세탐은 식품의약품안전처의 임상재평가 결과 유효성 입증에 실패했다. 아세틸엘카르니틴은 2022년 적응증이 모두 삭제됐고 옥시라세탐은 2023년 사용이 중지됐다. 콜린제제의 대체약제로 지목된 의약품이 사라졌기 때문에 콜린제제의 급여가 유지돼야 한다는 게 원고 측의 주장이다.제약사들은 시티콜린, 이부딜라스트, 이펜프로딜, 니세르골린 등 대체 약물로 제시된 다른 성분 의약품의 허가사항에 경도인지장애가 포함되지 않아 대체약제로 인정할 수 없다고 주장했다.하지만 재판부는 제약사들의 주장을 모두 받아들이지 않고 보건당국 측의 손을 들어줬다. 2심 재판부는 “대체 가능성의 평가 척도로 ‘선택 가능한 동일 목적의 급여 항목의 유무’만을 요구할 뿐 식약청의 허가사항의 상세내역까지 동일할 것을 요구하지 않는다”라면서 식약처의 허가사항이 달라도 대체약제로 인정할 수 있다고 판단했다.재판부는 “대체 가능성에 관한 판단에 대해서는 고도의 의료·보건상 전문성이 필요하므로 보건당국이 전문적인 판단을 했다면 판단의 기초가 된 사실인정에 중대한 오류가 없는 한 존중돼야 한다”라고 결론내렸다.당초 콜린제제 급여축소는 제약사들이 청구한 집행정지가 인용되면서 시행이 보류됐다. 하지만 대웅바이오 등이 항소심 패소 이후 청구한 집행정지가 기각되면서 지난달 21일부터 효력이 발생했다. 대웅바이오 등은 집행정지 기각 이후 상고심을 청구하지 않았다.해당 집행정지 사건의 결정문을 보면 재판부는 “이 사건 고시로 인해 신청인들에게 생길 회복하기 어려운 손해를 예방하기 위해 고시 효력을 정지할 긴급한 필요가 인정하기에 부족하다”라고 봤다.대웅바이오 등은 “상고심 판결 선고일로부터 30일이 되는 날까지 효력을 정지해달라”고 청구했지만 재판부는 “고시의 효력을 정지할 경우 공공복리에 중대한 영향을 미칠 우려가 있다고 인정할 수 있다”라고 판단했다.콜린제제 급여축소 법정다툼 마무리2025-10-10 12:00:19천승현
본안소송도 종료...제약, 콜린 급여축소 공방 최종 고배[데일리팜=천승현 기자] 제약사들이 뇌기능개선제 ‘콜린알포세레이트’의 급여 축소를 두고 5년간 진행된 법정 공방이 최종 종료됐다. 제약사들이 2심 패소 이후 상고를 제기했지만 상고장 각하 명령으로 소송전에 종지부가 찍혔다. 지난달 말 집행정지 기각으로 5년간 보류됐던 급여 축소가 시행됐고, 본안 소송 2건 모두 제약사들의 패소로 마무리됐다.10일 업계에 따르면 서울고등법원 제9-1행정부는 대웅바이오외 12인이 청구한 요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부개정고시 취소 소송에 상고장 각하명령을 내렸다. 상고장 각하는 상고가 성립되지 않았다는 것을 의미한다.항소심 재판부는 보정기간 내에 보정을 하지 않은 경우 또는 상고기간을 넘겨 상고를 제기한 경우 상고장을 각하할 수 있다. 제약사들이 지난 8월 21일 콜린제제 급여 축소 취소소송 항소심 패소한 이후 지난달 1일 상고심을 청구했지만 추가 자료를 제출하지 않으면서 상고심이 성립되지 않았다. 사실상 제약사들이 상고심을 자진 취하한 셈이다.이로써 제약사들이 콜린제제 급여축소 취소소송 본안소송도 마무리되면서 제약사들과 보건당국이 콜린제제 급여축소를 법정 공방은 모두 제약사들의 패소로 종지부를 찍었다. 보건복지부는 2020년 8월 콜린제제의 새로운 급여 기준 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다. 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용이다.제약사들은 콜린제제 급여 축소의 부당함을 따지는 취소 소송을 제기했다. 소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다.종근당 그룹은 지난 2022년 7월 1심에서 패소 판결을 받았고 항소심에서도 지난해 5월 기각 판결이 내려졌다. 종근당 등은 지난해 6월 상고심을 제기했고 지난 3월 대법원에서도 기각 판결이 내려졌다.대웅바이오 그룹은 지난 2022년 11월 패소 판결을 받은 이후 항소심을 청구했고 지난 8월 패소 판결이 나왔다. 상고심 각하명령이 나오면서 5년 만에 본안소송이 종료됐다.콜린제제 급여축소 취소소송 판결문을 보면 제약사들이 부당하다고 주장한 논리는 모두 기각됐다.지난 3월 13일 선고된 종근당 그룹 사건의 대법원 판결문을 보면 재판부는 제약사들이 주장한 절자적 위법성을 인정하지 않았다.제약사들은 콜린제제의 선별급여 대상 지정은 요양 급여대상으로서의 지위가 박탈된 것에 해당하기 때문에 약제의 요양급여대상 여부 직권조정에 관한 요양급여기준규칙에 따라야 하는데 정부는 다른 기준과 절차를 적용했다고 주장했다.하지만 재판부는 “요양급여 대상 약제를 선별급여 대상으로 변경하는 것을 비급여대상으로 변경한 것이라고 할 수 없다”라고 판단했다.제약사들이 콜린제제의 선별급여 변경 과정에서 절차적 권리를 침해 당했다고 주장했는데 재판부는 보건당국이 제약사들에 사전통지와 의견제출 기회, 이의신청 기회까지 보장했다는 점을 들어 절차적 하자가 없었다고 결론내렸다.대법원에서는 콜린제제의 선별급여 대상 지정의 실제적 요건 충족에 대해서도 “행정청이 국민 건강을 보호·증진하고 보험재정 건전성을 유지하고자 하는 목적에서 정하는 바에 따라 전문적인 판단을 했다면 그 판단은 기초가 된 사실인정에 중대한 오류가 있거나 판단이 객관적으로 불합리하거나 부당하다는 등의 특별한 사정이 없는 한 존중돼야 한다”라는 이유로 인정했다.재판부는 콜린제제의 재량권 일탈·남용 지적에 대해서도 “이 사건 고시가 건강보험재정의 건전성을 도모하기 위한 것으로 목적의 정당성과 수단의 적합성이 인정되고, 약제의 일부 질환에 대한 본인부담률을 80%로 정한 것이 침해 최소성이나 법의 균형성 원칙에 위배된다고 볼 수 없다”라고 일축했다.대웅바이오 그룹의 2심 판결에서도 절차적 하자, 실체적 하자, 선별급여 요건 미충족, 재량권의 일탈·남용 등의 문제가 제기됐지만 재판부는 모두 기각했다.제약사들은 종근당 그룹의 대법원 판결에서 언급되지 않은 대체약제 관련 문제를 제기했지만 재판부는 받아들이지 않았다.제약사들은 “정부의 약제급여위원회 회의 자료에서 콜린제제의 대체약제로 제시된 니세르골린 등은 경도인지장애 허가를 받지 않았다”라면서 “아세틸엘카르니틴과 옥세라세탐은 허가가 취소됐다”라고 설명했다.아세틸엘카르니틴과 옥시라세탐은 콜린제제의 급여 축소 결정 당시 콜린제제의 대체약제로 지목됐다. 아세틸엘카르니틴은 ‘일차적 퇴행성 질환’ 또는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’에 사용하도록 허가 받았다. 옥시라세탐은 알츠하이머형 치매, 다발경색성 치매, 뇌기능부전으로 인한 기질성 뇌증후군 등으로 인한 인지장애의 개선 용도로 허가받았다.하지만 아세틸엘카르니틴와 옥시라세탐은 식품의약품안전처의 임상재평가 결과 유효성 입증에 실패했다. 아세틸엘카르니틴은 2022년 적응증이 모두 삭제됐고 옥시라세탐은 2023년 사용이 중지됐다. 콜린제제의 대체약제로 지목된 의약품이 사라졌기 때문에 콜린제제의 급여가 유지돼야 한다는 게 원고 측의 주장이다.제약사들은 시티콜린, 이부딜라스트, 이펜프로딜, 니세르골린 등 대체 약물로 제시된 다른 성분 의약품의 허가사항에 경도인지장애가 포함되지 않아 대체약제로 인정할 수 없다고 주장했다.하지만 재판부는 제약사들의 주장을 모두 받아들이지 않고 보건당국 측의 손을 들어줬다. 2심 재판부는 “대체 가능성의 평가 척도로 ‘선택 가능한 동일 목적의 급여 항목의 유무’만을 요구할 뿐 식약청의 허가사항의 상세내역까지 동일할 것을 요구하지 않는다”라면서 식약처의 허가사항이 달라도 대체약제로 인정할 수 있다고 판단했다.재판부는 “대체 가능성에 관한 판단에 대해서는 고도의 의료·보건상 전문성이 필요하므로 보건당국이 전문적인 판단을 했다면 판단의 기초가 된 사실인정에 중대한 오류가 없는 한 존중돼야 한다”라고 결론내렸다.당초 콜린제제 급여축소는 제약사들이 청구한 집행정지가 인용되면서 시행이 보류됐다. 하지만 대웅바이오 등이 항소심 패소 이후 청구한 집행정지가 기각되면서 지난달 21일부터 효력이 발생했다. 대웅바이오 등은 집행정지 기각 이후 상고심을 청구하지 않았다.해당 집행정지 사건의 결정문을 보면 재판부는 “이 사건 고시로 인해 신청인들에게 생길 회복하기 어려운 손해를 예방하기 위해 고시 효력을 정지할 긴급한 필요가 인정하기에 부족하다”라고 봤다.대웅바이오 등은 “상고심 판결 선고일로부터 30일이 되는 날까지 효력을 정지해달라”고 청구했지만 재판부는 “고시의 효력을 정지할 경우 공공복리에 중대한 영향을 미칠 우려가 있다고 인정할 수 있다”라고 판단했다.콜린제제 급여축소 법정다툼 마무리2025-10-10 12:00:19천승현 -
 국내 희귀약 지정 RNAi 기반 PH1 치료제 '네도시란'리브플로자(RivflozaⓇ, 성분명: 네도시란, Nedosiran, 노보 노디스크)는 GalXC RNAi 기술 플랫폼을 기반으로 개발된 희귀 유전질환 치료제다. 미 FDA는 2023년 9월 이 약제를 ‘원발성 고옥살뇨증 1형(Primary hyperoxaluria type 1, PH1) 치료제’로 승인했으며, 국내에서는 2025년 6월 희귀의약품으로 지정했다.네도시란은 간에서 lactate dehydrogenase type A(LDH-A)를 표적으로 하는 소간섭 RNA(siRNA) 치료제로, 2세 이상 소아 및 성인에서 신기능이 비교적 보존된(eGFR ≥30mL/min/1.73m²) PH1 환자의 요중 옥살산(urinary oxalate, Uox) 수치를 낮추는 것을 적응증으로 한다.PH1은 드문 유전성 대사질환으로, 간세포의 alanine-glyoxylate aminotransferase(AGXT) 결핍으로 인해 glyoxylate가 비정상적으로 축적되고 최종적으로 oxalate가 과잉 생성되는 것이 특징이다.그 결과 만성 고옥살산뇨증이 발생하며, 반복적인 칼슘 옥살산(calcium oxalate) 신장결석, 점진적인 신기능 저하, 전신 옥살산 침착(systemic oxalosis)으로 이어져 많은 환자들이 조기에 말기 신부전(ESKD)에 도달한다.네도시란의 미 FDA 승인은 2상 핵심 임상시험 PHYOX2와 3상 연장 연구 PHYOX3의 중간 분석 결과를 근거로 이뤄졌다. PHYOX2는 리브플로자와 위약을 비교한 무작위 배정, 이중맹검, 위약 대조 임상시험으로, 주요 평가 변수(primary endpoint)를 충족했다.치료군에서는 투여 90일부터 180일까지 24시간 요중 옥살산 배설량(AUC24-hour Uox)이 기저치 대비 유의하게 감소하였다. 또한 PHYOX3 중간 분석 결과에 따르면, 리브플로자를 추가로 6개월간 투여한 환자군에서 요중 옥살산 감소 효과가 지속적으로 유지되는 것으로 나타났다.원발성 고옥살산뇨증 1형(Primary Hyperoxaluria type 1, PH1)는 어떤 질환인가?원발성 고옥살산뇨증(Primary Hyperoxaluria, PH)은 glyoxylate 대사 효소의 결핍으로 인해 oxalate가 과도하게 생성돼 신장결석, 신부전, 전신 옥살산증으로 이어지는 희귀 유전질환이다. PH는 원인 유전자에 따라 PH1, PH2, PH3의 세 가지 아형으로 분류되며, 모두 glyoxylate 축적을 특징으로 하지만 관여하는 효소(AGT, GRHPR, HOGA1)가 서로 달라 임상 양상과 질환의 중증도에 차이를 보인다.이러한 효소 결손으로 인해 glyoxylate가 효율적으로 glycine으로 대사되지 못하고, 결국 oxalate로 과잉 전환된다. 그 결과 신장에서 칼슘 옥살산(calcium oxalate) 결석과 신부전이 발생하며, 전신 조직에 oxalate가 침착되는 systemic oxalosis로 진행될 수 있다. 특히 PH1 환자에서의 만성적인 고옥살산 배설은 삶의 질을 현저히 저해할 뿐 아니라 조기 신부전으로 이어지는 경우가 많아 예후가 불량하다.기존 치료법으로는 고용량 피리독신(pyridoxine) 투여와 수분 섭취가 사용됐으나, 효과가 제한적이며 궁극적으로 간 이식 또는 간-신장 동시 이식이 필요하다. 또 이식 치료는 높은 수술 위험과 제한된 공여자 문제로 인해 근본적 해결책이 되지 못한다. 이러한 한계를 극복하기 위한 전략으로 RNA 간섭(RNAi) 기반 치료제가 개발되었으며, 대표적으로 glycolate oxidase(HAO1) 또는 LDHA를 표적으로 하는 접근이 주목 받고 있다.옥살산(Oxalate)은 어떤 작용을 하는가?혈중 oxalate는 간의 내인성 합성과 장에서의 식이 흡수를 통해 기인한다. 인간은 oxalate를 분해하는 효소를 보유하지 않으므로, 체내 oxalate는 반드시 신장을 통해 배설된다. 그러나 세뇨관 내에서 oxalate는 칼슘과 결합하여 불용성 결정체인 칼슘 옥살산(calcium oxalate)을 형성할 수 있으며, 이는 신장결석 및 옥살산 신병증으로 이어질 수 있다.간에서의 옥살산 합성은 원발성 고옥살산뇨증의 병태생리에 핵심적이다. PH1은 AGXT, PH2는 GRHPR, PH3는 HOGA1 유전자의 결손으로 발생하며, 이들 결손은 공통적으로 glyoxylate 축적을 유발한다. 과도한 glyoxylate는 비정상적으로 간 LDH-A(Lactate Dehydrogenase A)에 의해 oxalate로 전환되며, 이 과정이 oxalate 과잉 생성의 주요 원인으로 작용한다.한편, 장에서의 식이 oxalate 흡수 역시 혈중 농도에 기여한다. 대부분은 세포 간격을 통한 수동적 흡수에 의존하지만, 일부 능동적 분비 기전도 보고되었다. 특히 Oxalobacter formigenes를 비롯한 장내 세균은 oxalate 분해 또는 SLC26A6 경로를 통한 분비 촉진에 기여할 수 있어, 장내 미생물 조절은 잠재적 치료 전략으로 주목받고 있다. Generation and Elimination of Oxalate and Potential Therapeutic Targets(출처: Clinical Kidney Journal, 2022, vol. 15, Suppl 1, i17–i22).PH1에서 옥살산(Oxalate)과 LDHA는 어떤 관계인가? Oxalate는 자연계에 존재하는 단순 이염기성 카르복실산으로, 칼슘염인 calcium oxalate(CaOx)의 낮은 용해도 때문에 임상적으로 중요한 의미를 갖는다. 사람에서는 oxalate가 대사의 최종 산물로 더 이상 분해되지 않으며, 정상적인 경우 대부분 신장을 통해 배설된다.그러나 원발성 고옥살산뇨증(PH) 환자에서는 과도한 oxalate 생성으로 인해 CaOx 결정이 신장과 요로에 침착하게 되고, 이로 인해 신석회증(nephrocalcinosis)이나 요로결석이 발생할 수 있으며, 질병이 진행하면 전신성 옥살산증(systemic oxalosis)으로 이어질 수 있다.이러한 CaOx 결정은 단순히 기계적인 조직 손상을 일으킬 뿐만 아니라 염증 반응과 산화 스트레스를 촉발하여 신기능 저하를 가속화한다. 그 결과 혈장 내 oxalate 농도가 더욱 상승하게 되고, 이는 다시 결정 형성을 촉진하는 악순환을 형성한다.사람에서 oxalate는 대부분 내인성 합성으로부터 기인하며, 식이를 통한 장내 흡수는 상대적으로 기여도가 낮다. 내인성 합성의 중심에는 glyoxylate가 있으며, 이는 젖산탈수소효소(lactate dehydrogenase, LDH)에 의해 oxalate로 산화된다. 따라서 모든 유형의 PH는 glyoxylate 대사 이상과 밀접하게 연관되어 있다.특히 PH1에서는 간 퍼옥시좀에 존재하는 alanine:glyoxylate aminotransferase(AGT)가 결핍되면서 glyoxylate가 glycine으로 전환되지 못하고, 대신 비정상적으로 LDH 경로를 통해 oxalate로 축적된다. 이 과정에는 glycolate, 아스코르빈산, 하이드록시프롤린 등의 대사 산물도 oxalate 합성에 추가적으로 기여한다. 결국 PH의 병태생리는 간에서의 과도한 glycolate 축적과 LDH 매개 oxalate 합성이 핵심 기전으로 작용하며, 이러한 분자적 이상은 임상적으로 신장 결석과 전신 합병증을 초래한다.최근 이러한 병태생리에 착안하여 LDH isoenzyme인 LDH-A를 직접 억제하는 RNA 간섭(RNAi) 기반 치료제인 네도시란(Nedosiran)이 개발되었다. 전임상 연구와 임상시험에서 네도시란은 혈중 및 요중 oxalate 수치를 유의하게 감소시키는 효과를 보여주었고, 이는 LDHA가 단순히 해당과정(glycolysis)의 보조 효소에 그치는 것이 아니라 PH1 치료에서 혁신적이고 유망한 타깃으로 기능할 수 있음을 보여준다.그러나 LDHA 억제 전략이 장기적으로 안전한지, 간 외(extra-hepatic) 조직에 미치는 영향은 어떠한지, 나아가 PH2나 PH3 같은 다른 아형에서도 적용될 수 있는지 여부는 여전히 연구가 필요한 부분이다. 따라서 PH1에서 LDHA 억제의 기전적 의미와 임상적 근거를 검토하고, 향후 치료 전략으로서 확장될 가능성을 고찰하는 일은 학문적·임상적으로 매우 중요한 과제가 된다.원발성 고옥살산뇨증 1형(PH1)의 치료 방법은?기존 치료 전략은 다량의 수분 섭취, 알칼리 요법, 일부 환자에서의 고용량 피리독신 반응에 의존해 왔으나, 질환 진행을 근본적으로 억제하기에는 불충분하다. 궁극적 치료로 제시된 간 혹은 간-신장 동시 이식은 이식 관련 위험성과 기증자 제한이라는 큰 장벽을 가진다.이러한 한계를 극복하기 위해 최근에는 RNA 간섭RNAi) 기술을 이용한 혁신적 치료 전략이 개발되고 있다. 대표적으로 glycolate oxidase(Hao1) 억제를 통한 루마시란(Lumasiran)이 임상에서 입증되었으며, 이어서 LDH-A를 표적으로 하는 네도시란(Nedosiran)이 차세대 치료제로 주목받고 있다.LDH-A는 해당과정의 최종 단계에서 피루브산을 젖산으로 환원하는 효소이지만, 동시에 글리옥실산 대사 경로와 연결되어 PH1에서 옥살산 과생산에 기여한다. 따라서 LDH-A의 억제는 간세포에서 옥살산 생성을 근본적으로 차단할 수 있는 새로운 접근법이다.네도시란은 어떤 약제인가?네도시란(Nedosiran)은 GalNAc 접합 siRNA 플랫폼을 기반으로 간세포에 특이적으로 전달되어 LDH-A 발현을 억제한다. 초기 임상 연구에서 네도시란은 PH1 환자뿐 아니라 PH2, PH3 등 다양한 PH 아형에서도 요중 옥살산 수치를 유의미하게 감소시켰으며, 이는 단일 아형에 국한되지 않는 광범위한 치료 가능성을 보여주었다. 또한 월 1회 피하 투여라는 단순화된 투여 방식은 환자 순응도를 높혔다.PHYOX-1 연구는 무작위, 단일 상승 용량(randomized, single-ascending-dose)의 제1상 임상시험으로, PH1 또는 PH2 환자 18명과 건강한 성인 대조군 25명을 대상으로 피하 주사된 네도시란의 안전성, 약동학, 약력학 및 옥살산 대사에 미치는 효과를 평가하였다.이 연구에서 성인 환자들은 57일차에 24시간 요 옥살산 배설(24-h UOx)이 평균 최대 55% 감소하였으며, 전체 환자의 67%가 정상 또는 정상에 근접한 24시간 요 옥살산 배설치를 달성하였다.LDH-A가 간과 근육에서 모두 발현되기 때문에, 이러한 접근이 근육에서 간외적 부작용(extrahepatic side effects)을 유발할 가능성에 대한 우려가 있었다. 그러나 생쥐 및 영장류를 대상으로 한 전임상 자료에서는 RNAi에 의한 LDH-A 억제가 UOx 배설을 감소시키는 효과를 보였고, GalNAc 태그를 활용함으로써 효과가 간 특이적으로 나타났으며 근육을 포함한 다른 조직에서는 표적 외 효과(off-target effect)가 관찰되지 않았다.또한 보고된 인간 LDH-A 결핍 사례들은 유의한 근육 관련 표현형을 보이지 않았으며, PHYOX-1 1상 연구에 참여한 건강한 지원자들에서도 약물 관련 근골격계 이상반응은 보고되지 않았다. 더 나아가, 네도시란 투여군에서는 위약군과 비교했을 때 혈장 젖산, 피루브산, 크레아틴 키나아제 농도의 유의한 변화가 관찰되지 않았다.따라서 현재까지의 근거는 간의 LDH-A를 표적으로 하는 네도시란의 사용이 모든 유형의 PH 환자에서 안전하고 유망한 접근법임을 시사한다. 다만, PH1 및 PH2 환자를 대상으로 한 위약 대조 이중맹검 제3상 임상시험이 진행 중이며, 그 결과는 아직 발표되지 않았다.네도시란과 루마시란과의 차이점은 무엇인가?최근 RNA 간섭(RNAi) 기술을 이용하여 간세포의 특정 효소를 선택적으로 억제하는 새로운 치료 전략이 등장하였다. 그 중 루마시란(Lumasiran)은 glycolate oxidase(HAO1)를 표적으로 하여 글리콜산이 글리옥실산으로 전환되는 상류 단계에서 대사 흐름을 차단함으로써 옥살산 생성을 억제한다.루마시란은 임상시험에서 PH1 환자에서 유의미한 옥살산 감소 효과를 입증하여, 최초로 승인된 RNAi 기반 PH 치료제로 자리매김하였다. 그러나 이 약제는 PH1 아형에 국한된다는 한계가 존재한다.이와 달리 네도시란(Nedosiran)은 lactate dehydrogenase A(LDHA)를 억제하여 글리옥실산이 옥살산으로 전환되는 최종 단계를 직접 차단하는 기전을 가진다.이러한 작용 기전은 PH1뿐 아니라 PH2, PH3 등 모든 PH 아형에서 공통적으로 적용 가능하다는 점에서 임상적 의미가 크다. 실제 임상 연구에서 네도시란은 다양한 PH 아형 환자에서 요중 옥살산 수치를 유의하게 감소시켜, “pan-PH” 치료제로서의 가능성을 입증하였다.Liver Metabolism of Oxalate and Targets of the Novel RNAi Therapies(출처: Clinical Kidney Journal, 2022, vol. 15, Suppl 1, i17–i22) 따라서 루마시란과 네도시란은 모두 PH 치료의 RNAi 치료제이지만, 적응증 범위와 대사 경로 내 표적 단계의 차이로 인해 임상적 적용 범위가 구분된다.네도시란의 약리 기전은 무엇인가?네도시란은 이중가닥 siRNA로, GalNAc 아미노당 잔기에 결합되어 있다. 피하 주사 후 GalNAc-결합 당은 아실로당단백 수용체(ASGPR)에 결합하여 네도시란을 간세포(hepatocyte)로 전달한다. GalNAc-siRNA-ASGPR 복합체는 세포 내로 유입되어 엔도솜(endosome) 내에서 분리된다. 이후 siRNA는 엔도솜으로부터 방출되고, GalNAc은 분해되어 제거된다. ASGPR을 포함한 소포는 다시 세포막과 융합되어 간세포 표면으로 되돌아가 수용체 순환(recycling)을 마친다.엔도솜에서 방출된 siRNA는 헬리케이스(helicase)에 의해 이중가닥 구조가 풀리고, 안티센스 가닥(antisense strand)은 Ago2 단백질을 포함한 다양한 효소들과 함께 RISC를 형성한다. RISC는 표적 mRNA와 상보적인 염기서열에 결합하며, Ago2는 안티센스 가닥의 5′ 말단에서 10번째와 11번째 염기 사이의 인산다이에스터 결합(phosphodiester bond)을 절단하여 mRNA를 분해하고 유전자 발현을 억제한다.GalNAc facilitates gene silencing through a specific mechanism(출처: Journal of Nanobiotechnology (2024) 22:745). 따라서 네도시란은 RNA 간섭(RNAi)을 통해 간세포 내 LDHA 메신저 리보핵산(mRNA)을 분해함으로써 간성 젖산 탈수소효소(LDH)의 발현 수준을 억제시킨다. LDH-A 억제는 글리옥실레이트(glyoxylate)가 옥살산(oxalate)으로 전환되는 과정을 차단함으로써, 옥살산 대사 경로에서 LDH가 매우 하위 단계에 위치한다는 점 때문에 모든 유형의 PH에서 잠재적 치료 옵션이 된다.네도시란(RIVFLOZA)의 허가임상은 어떠한가? PHYOX2는 RIVFLOZA와 위약을 비교한 무작위, 이중눈가림 임상시험으로, 6세 이상이면서 eGFR ≥30mL/min/1.73m²를 가진 PH1 또는 PH2 환자를 대상으로 진행되었다. PH2 환자는 등록 수가 너무 적어 PH2 집단에서의 유효성을 평가할 수 없었다. 따라서 RIVFLOZA는 PH1 환자에서만 적응증이 승인되었다.환자들은 매월 RIVFLOZA(N=23) 또는 위약(N=12)을 투여받았다. 만 12세 이상, 체중 ≥ 50kg 환자의 용량은 160mg, 만 12세 이상 체중2025-10-09 15:41:17최병철 박사
국내 희귀약 지정 RNAi 기반 PH1 치료제 '네도시란'리브플로자(RivflozaⓇ, 성분명: 네도시란, Nedosiran, 노보 노디스크)는 GalXC RNAi 기술 플랫폼을 기반으로 개발된 희귀 유전질환 치료제다. 미 FDA는 2023년 9월 이 약제를 ‘원발성 고옥살뇨증 1형(Primary hyperoxaluria type 1, PH1) 치료제’로 승인했으며, 국내에서는 2025년 6월 희귀의약품으로 지정했다.네도시란은 간에서 lactate dehydrogenase type A(LDH-A)를 표적으로 하는 소간섭 RNA(siRNA) 치료제로, 2세 이상 소아 및 성인에서 신기능이 비교적 보존된(eGFR ≥30mL/min/1.73m²) PH1 환자의 요중 옥살산(urinary oxalate, Uox) 수치를 낮추는 것을 적응증으로 한다.PH1은 드문 유전성 대사질환으로, 간세포의 alanine-glyoxylate aminotransferase(AGXT) 결핍으로 인해 glyoxylate가 비정상적으로 축적되고 최종적으로 oxalate가 과잉 생성되는 것이 특징이다.그 결과 만성 고옥살산뇨증이 발생하며, 반복적인 칼슘 옥살산(calcium oxalate) 신장결석, 점진적인 신기능 저하, 전신 옥살산 침착(systemic oxalosis)으로 이어져 많은 환자들이 조기에 말기 신부전(ESKD)에 도달한다.네도시란의 미 FDA 승인은 2상 핵심 임상시험 PHYOX2와 3상 연장 연구 PHYOX3의 중간 분석 결과를 근거로 이뤄졌다. PHYOX2는 리브플로자와 위약을 비교한 무작위 배정, 이중맹검, 위약 대조 임상시험으로, 주요 평가 변수(primary endpoint)를 충족했다.치료군에서는 투여 90일부터 180일까지 24시간 요중 옥살산 배설량(AUC24-hour Uox)이 기저치 대비 유의하게 감소하였다. 또한 PHYOX3 중간 분석 결과에 따르면, 리브플로자를 추가로 6개월간 투여한 환자군에서 요중 옥살산 감소 효과가 지속적으로 유지되는 것으로 나타났다.원발성 고옥살산뇨증 1형(Primary Hyperoxaluria type 1, PH1)는 어떤 질환인가?원발성 고옥살산뇨증(Primary Hyperoxaluria, PH)은 glyoxylate 대사 효소의 결핍으로 인해 oxalate가 과도하게 생성돼 신장결석, 신부전, 전신 옥살산증으로 이어지는 희귀 유전질환이다. PH는 원인 유전자에 따라 PH1, PH2, PH3의 세 가지 아형으로 분류되며, 모두 glyoxylate 축적을 특징으로 하지만 관여하는 효소(AGT, GRHPR, HOGA1)가 서로 달라 임상 양상과 질환의 중증도에 차이를 보인다.이러한 효소 결손으로 인해 glyoxylate가 효율적으로 glycine으로 대사되지 못하고, 결국 oxalate로 과잉 전환된다. 그 결과 신장에서 칼슘 옥살산(calcium oxalate) 결석과 신부전이 발생하며, 전신 조직에 oxalate가 침착되는 systemic oxalosis로 진행될 수 있다. 특히 PH1 환자에서의 만성적인 고옥살산 배설은 삶의 질을 현저히 저해할 뿐 아니라 조기 신부전으로 이어지는 경우가 많아 예후가 불량하다.기존 치료법으로는 고용량 피리독신(pyridoxine) 투여와 수분 섭취가 사용됐으나, 효과가 제한적이며 궁극적으로 간 이식 또는 간-신장 동시 이식이 필요하다. 또 이식 치료는 높은 수술 위험과 제한된 공여자 문제로 인해 근본적 해결책이 되지 못한다. 이러한 한계를 극복하기 위한 전략으로 RNA 간섭(RNAi) 기반 치료제가 개발되었으며, 대표적으로 glycolate oxidase(HAO1) 또는 LDHA를 표적으로 하는 접근이 주목 받고 있다.옥살산(Oxalate)은 어떤 작용을 하는가?혈중 oxalate는 간의 내인성 합성과 장에서의 식이 흡수를 통해 기인한다. 인간은 oxalate를 분해하는 효소를 보유하지 않으므로, 체내 oxalate는 반드시 신장을 통해 배설된다. 그러나 세뇨관 내에서 oxalate는 칼슘과 결합하여 불용성 결정체인 칼슘 옥살산(calcium oxalate)을 형성할 수 있으며, 이는 신장결석 및 옥살산 신병증으로 이어질 수 있다.간에서의 옥살산 합성은 원발성 고옥살산뇨증의 병태생리에 핵심적이다. PH1은 AGXT, PH2는 GRHPR, PH3는 HOGA1 유전자의 결손으로 발생하며, 이들 결손은 공통적으로 glyoxylate 축적을 유발한다. 과도한 glyoxylate는 비정상적으로 간 LDH-A(Lactate Dehydrogenase A)에 의해 oxalate로 전환되며, 이 과정이 oxalate 과잉 생성의 주요 원인으로 작용한다.한편, 장에서의 식이 oxalate 흡수 역시 혈중 농도에 기여한다. 대부분은 세포 간격을 통한 수동적 흡수에 의존하지만, 일부 능동적 분비 기전도 보고되었다. 특히 Oxalobacter formigenes를 비롯한 장내 세균은 oxalate 분해 또는 SLC26A6 경로를 통한 분비 촉진에 기여할 수 있어, 장내 미생물 조절은 잠재적 치료 전략으로 주목받고 있다. Generation and Elimination of Oxalate and Potential Therapeutic Targets(출처: Clinical Kidney Journal, 2022, vol. 15, Suppl 1, i17–i22).PH1에서 옥살산(Oxalate)과 LDHA는 어떤 관계인가? Oxalate는 자연계에 존재하는 단순 이염기성 카르복실산으로, 칼슘염인 calcium oxalate(CaOx)의 낮은 용해도 때문에 임상적으로 중요한 의미를 갖는다. 사람에서는 oxalate가 대사의 최종 산물로 더 이상 분해되지 않으며, 정상적인 경우 대부분 신장을 통해 배설된다.그러나 원발성 고옥살산뇨증(PH) 환자에서는 과도한 oxalate 생성으로 인해 CaOx 결정이 신장과 요로에 침착하게 되고, 이로 인해 신석회증(nephrocalcinosis)이나 요로결석이 발생할 수 있으며, 질병이 진행하면 전신성 옥살산증(systemic oxalosis)으로 이어질 수 있다.이러한 CaOx 결정은 단순히 기계적인 조직 손상을 일으킬 뿐만 아니라 염증 반응과 산화 스트레스를 촉발하여 신기능 저하를 가속화한다. 그 결과 혈장 내 oxalate 농도가 더욱 상승하게 되고, 이는 다시 결정 형성을 촉진하는 악순환을 형성한다.사람에서 oxalate는 대부분 내인성 합성으로부터 기인하며, 식이를 통한 장내 흡수는 상대적으로 기여도가 낮다. 내인성 합성의 중심에는 glyoxylate가 있으며, 이는 젖산탈수소효소(lactate dehydrogenase, LDH)에 의해 oxalate로 산화된다. 따라서 모든 유형의 PH는 glyoxylate 대사 이상과 밀접하게 연관되어 있다.특히 PH1에서는 간 퍼옥시좀에 존재하는 alanine:glyoxylate aminotransferase(AGT)가 결핍되면서 glyoxylate가 glycine으로 전환되지 못하고, 대신 비정상적으로 LDH 경로를 통해 oxalate로 축적된다. 이 과정에는 glycolate, 아스코르빈산, 하이드록시프롤린 등의 대사 산물도 oxalate 합성에 추가적으로 기여한다. 결국 PH의 병태생리는 간에서의 과도한 glycolate 축적과 LDH 매개 oxalate 합성이 핵심 기전으로 작용하며, 이러한 분자적 이상은 임상적으로 신장 결석과 전신 합병증을 초래한다.최근 이러한 병태생리에 착안하여 LDH isoenzyme인 LDH-A를 직접 억제하는 RNA 간섭(RNAi) 기반 치료제인 네도시란(Nedosiran)이 개발되었다. 전임상 연구와 임상시험에서 네도시란은 혈중 및 요중 oxalate 수치를 유의하게 감소시키는 효과를 보여주었고, 이는 LDHA가 단순히 해당과정(glycolysis)의 보조 효소에 그치는 것이 아니라 PH1 치료에서 혁신적이고 유망한 타깃으로 기능할 수 있음을 보여준다.그러나 LDHA 억제 전략이 장기적으로 안전한지, 간 외(extra-hepatic) 조직에 미치는 영향은 어떠한지, 나아가 PH2나 PH3 같은 다른 아형에서도 적용될 수 있는지 여부는 여전히 연구가 필요한 부분이다. 따라서 PH1에서 LDHA 억제의 기전적 의미와 임상적 근거를 검토하고, 향후 치료 전략으로서 확장될 가능성을 고찰하는 일은 학문적·임상적으로 매우 중요한 과제가 된다.원발성 고옥살산뇨증 1형(PH1)의 치료 방법은?기존 치료 전략은 다량의 수분 섭취, 알칼리 요법, 일부 환자에서의 고용량 피리독신 반응에 의존해 왔으나, 질환 진행을 근본적으로 억제하기에는 불충분하다. 궁극적 치료로 제시된 간 혹은 간-신장 동시 이식은 이식 관련 위험성과 기증자 제한이라는 큰 장벽을 가진다.이러한 한계를 극복하기 위해 최근에는 RNA 간섭RNAi) 기술을 이용한 혁신적 치료 전략이 개발되고 있다. 대표적으로 glycolate oxidase(Hao1) 억제를 통한 루마시란(Lumasiran)이 임상에서 입증되었으며, 이어서 LDH-A를 표적으로 하는 네도시란(Nedosiran)이 차세대 치료제로 주목받고 있다.LDH-A는 해당과정의 최종 단계에서 피루브산을 젖산으로 환원하는 효소이지만, 동시에 글리옥실산 대사 경로와 연결되어 PH1에서 옥살산 과생산에 기여한다. 따라서 LDH-A의 억제는 간세포에서 옥살산 생성을 근본적으로 차단할 수 있는 새로운 접근법이다.네도시란은 어떤 약제인가?네도시란(Nedosiran)은 GalNAc 접합 siRNA 플랫폼을 기반으로 간세포에 특이적으로 전달되어 LDH-A 발현을 억제한다. 초기 임상 연구에서 네도시란은 PH1 환자뿐 아니라 PH2, PH3 등 다양한 PH 아형에서도 요중 옥살산 수치를 유의미하게 감소시켰으며, 이는 단일 아형에 국한되지 않는 광범위한 치료 가능성을 보여주었다. 또한 월 1회 피하 투여라는 단순화된 투여 방식은 환자 순응도를 높혔다.PHYOX-1 연구는 무작위, 단일 상승 용량(randomized, single-ascending-dose)의 제1상 임상시험으로, PH1 또는 PH2 환자 18명과 건강한 성인 대조군 25명을 대상으로 피하 주사된 네도시란의 안전성, 약동학, 약력학 및 옥살산 대사에 미치는 효과를 평가하였다.이 연구에서 성인 환자들은 57일차에 24시간 요 옥살산 배설(24-h UOx)이 평균 최대 55% 감소하였으며, 전체 환자의 67%가 정상 또는 정상에 근접한 24시간 요 옥살산 배설치를 달성하였다.LDH-A가 간과 근육에서 모두 발현되기 때문에, 이러한 접근이 근육에서 간외적 부작용(extrahepatic side effects)을 유발할 가능성에 대한 우려가 있었다. 그러나 생쥐 및 영장류를 대상으로 한 전임상 자료에서는 RNAi에 의한 LDH-A 억제가 UOx 배설을 감소시키는 효과를 보였고, GalNAc 태그를 활용함으로써 효과가 간 특이적으로 나타났으며 근육을 포함한 다른 조직에서는 표적 외 효과(off-target effect)가 관찰되지 않았다.또한 보고된 인간 LDH-A 결핍 사례들은 유의한 근육 관련 표현형을 보이지 않았으며, PHYOX-1 1상 연구에 참여한 건강한 지원자들에서도 약물 관련 근골격계 이상반응은 보고되지 않았다. 더 나아가, 네도시란 투여군에서는 위약군과 비교했을 때 혈장 젖산, 피루브산, 크레아틴 키나아제 농도의 유의한 변화가 관찰되지 않았다.따라서 현재까지의 근거는 간의 LDH-A를 표적으로 하는 네도시란의 사용이 모든 유형의 PH 환자에서 안전하고 유망한 접근법임을 시사한다. 다만, PH1 및 PH2 환자를 대상으로 한 위약 대조 이중맹검 제3상 임상시험이 진행 중이며, 그 결과는 아직 발표되지 않았다.네도시란과 루마시란과의 차이점은 무엇인가?최근 RNA 간섭(RNAi) 기술을 이용하여 간세포의 특정 효소를 선택적으로 억제하는 새로운 치료 전략이 등장하였다. 그 중 루마시란(Lumasiran)은 glycolate oxidase(HAO1)를 표적으로 하여 글리콜산이 글리옥실산으로 전환되는 상류 단계에서 대사 흐름을 차단함으로써 옥살산 생성을 억제한다.루마시란은 임상시험에서 PH1 환자에서 유의미한 옥살산 감소 효과를 입증하여, 최초로 승인된 RNAi 기반 PH 치료제로 자리매김하였다. 그러나 이 약제는 PH1 아형에 국한된다는 한계가 존재한다.이와 달리 네도시란(Nedosiran)은 lactate dehydrogenase A(LDHA)를 억제하여 글리옥실산이 옥살산으로 전환되는 최종 단계를 직접 차단하는 기전을 가진다.이러한 작용 기전은 PH1뿐 아니라 PH2, PH3 등 모든 PH 아형에서 공통적으로 적용 가능하다는 점에서 임상적 의미가 크다. 실제 임상 연구에서 네도시란은 다양한 PH 아형 환자에서 요중 옥살산 수치를 유의하게 감소시켜, “pan-PH” 치료제로서의 가능성을 입증하였다.Liver Metabolism of Oxalate and Targets of the Novel RNAi Therapies(출처: Clinical Kidney Journal, 2022, vol. 15, Suppl 1, i17–i22) 따라서 루마시란과 네도시란은 모두 PH 치료의 RNAi 치료제이지만, 적응증 범위와 대사 경로 내 표적 단계의 차이로 인해 임상적 적용 범위가 구분된다.네도시란의 약리 기전은 무엇인가?네도시란은 이중가닥 siRNA로, GalNAc 아미노당 잔기에 결합되어 있다. 피하 주사 후 GalNAc-결합 당은 아실로당단백 수용체(ASGPR)에 결합하여 네도시란을 간세포(hepatocyte)로 전달한다. GalNAc-siRNA-ASGPR 복합체는 세포 내로 유입되어 엔도솜(endosome) 내에서 분리된다. 이후 siRNA는 엔도솜으로부터 방출되고, GalNAc은 분해되어 제거된다. ASGPR을 포함한 소포는 다시 세포막과 융합되어 간세포 표면으로 되돌아가 수용체 순환(recycling)을 마친다.엔도솜에서 방출된 siRNA는 헬리케이스(helicase)에 의해 이중가닥 구조가 풀리고, 안티센스 가닥(antisense strand)은 Ago2 단백질을 포함한 다양한 효소들과 함께 RISC를 형성한다. RISC는 표적 mRNA와 상보적인 염기서열에 결합하며, Ago2는 안티센스 가닥의 5′ 말단에서 10번째와 11번째 염기 사이의 인산다이에스터 결합(phosphodiester bond)을 절단하여 mRNA를 분해하고 유전자 발현을 억제한다.GalNAc facilitates gene silencing through a specific mechanism(출처: Journal of Nanobiotechnology (2024) 22:745). 따라서 네도시란은 RNA 간섭(RNAi)을 통해 간세포 내 LDHA 메신저 리보핵산(mRNA)을 분해함으로써 간성 젖산 탈수소효소(LDH)의 발현 수준을 억제시킨다. LDH-A 억제는 글리옥실레이트(glyoxylate)가 옥살산(oxalate)으로 전환되는 과정을 차단함으로써, 옥살산 대사 경로에서 LDH가 매우 하위 단계에 위치한다는 점 때문에 모든 유형의 PH에서 잠재적 치료 옵션이 된다.네도시란(RIVFLOZA)의 허가임상은 어떠한가? PHYOX2는 RIVFLOZA와 위약을 비교한 무작위, 이중눈가림 임상시험으로, 6세 이상이면서 eGFR ≥30mL/min/1.73m²를 가진 PH1 또는 PH2 환자를 대상으로 진행되었다. PH2 환자는 등록 수가 너무 적어 PH2 집단에서의 유효성을 평가할 수 없었다. 따라서 RIVFLOZA는 PH1 환자에서만 적응증이 승인되었다.환자들은 매월 RIVFLOZA(N=23) 또는 위약(N=12)을 투여받았다. 만 12세 이상, 체중 ≥ 50kg 환자의 용량은 160mg, 만 12세 이상 체중2025-10-09 15:41:17최병철 박사 -
 종근당, 일반약 PDRN 시장 진입…크림제형 허가파마리서치 [데일리팜=이탁순 기자] 종근당이 최근 인기를 끌고 있는 PDRN(폴리데옥시리보뉴크레오티드) 성분의 크림 제형 제품을 허가받았다.PDRN 크림 제형은 현재 파마리서치의 '리쥬비넥스크림'이 유일하다. 리쥬비넥스는 피부 재생의 효과가 입소문을 타고 최근 일반의약품 시장에서 대세 품목으로 떠올랐다.식품의약품안전처는 26일 종근당 '더마그램피디알엔크림(폴리데옥시리보뉴클레오티드나트륨)'을 품목 허가했다.이 제품은 피부 및 결합조직의 영양부족 또는 영양부족으로 인한 궤양이 생기기 쉬운 상처, 영양보급에 사용된다. 생산은 더유제약이 한다.같은 성분의 크림 제형은 현재 파마리서치의 '리쥬비넥스크림'이 유일하다. 이 제품 역시 PDRN이 주성분이다. PDRN은 연어 정소에서 얻을 수 있는 DNA 조각으로, 피부 조직을 재생하는데 도와준다.파마리서치는 자체 기술을 통해 PDRN 제품을 공급하며 매출 3500억원의 중견 제약사로 성장했다. 조직 재생 주사제 리쥬비넥스, 각막 재생 점안액 리안과 리쥬란 등 화장품 브랜드가 있다.특히 일반의약품 시장에서는 리쥬비넥스크림이 최근 인기를 끌고 있다. 리쥬비넥스크림은 올 한해 일반의약품 매출 순위 탑10에 꾸준히 들고 있다.피부 건강에 대한 여성들의 높은 관심에 힘입어 입소문이 터지면서 약국에서 가장 뜨거운 품목으로 떠올랐다. 특히, 외국 관광객들 사이에서도 한국 쇼핑 1순위 제품으로 인기 몰이를 하고 있다.케어인사이트가 지난 8월 POS가 설치된 459곳 약국을 대상으로 100위 내 일반약을 조사해 데일리팜에 공개한 자료에 따르면 리쥬비넥스크림은 판매횟수 1065회로 6위를 기록했다.종근당 더마그램피디알엔크림이 시장에 출시하면 이같은 리쥬비넥스크림 인기에 편승해 자리를 잡을 것으로 보인다. 약국에서는 양사의 경쟁으로 판매량이 더 상승할 거란 기대를 하고 있다.2025-09-26 15:59:11이탁순
종근당, 일반약 PDRN 시장 진입…크림제형 허가파마리서치 [데일리팜=이탁순 기자] 종근당이 최근 인기를 끌고 있는 PDRN(폴리데옥시리보뉴크레오티드) 성분의 크림 제형 제품을 허가받았다.PDRN 크림 제형은 현재 파마리서치의 '리쥬비넥스크림'이 유일하다. 리쥬비넥스는 피부 재생의 효과가 입소문을 타고 최근 일반의약품 시장에서 대세 품목으로 떠올랐다.식품의약품안전처는 26일 종근당 '더마그램피디알엔크림(폴리데옥시리보뉴클레오티드나트륨)'을 품목 허가했다.이 제품은 피부 및 결합조직의 영양부족 또는 영양부족으로 인한 궤양이 생기기 쉬운 상처, 영양보급에 사용된다. 생산은 더유제약이 한다.같은 성분의 크림 제형은 현재 파마리서치의 '리쥬비넥스크림'이 유일하다. 이 제품 역시 PDRN이 주성분이다. PDRN은 연어 정소에서 얻을 수 있는 DNA 조각으로, 피부 조직을 재생하는데 도와준다.파마리서치는 자체 기술을 통해 PDRN 제품을 공급하며 매출 3500억원의 중견 제약사로 성장했다. 조직 재생 주사제 리쥬비넥스, 각막 재생 점안액 리안과 리쥬란 등 화장품 브랜드가 있다.특히 일반의약품 시장에서는 리쥬비넥스크림이 최근 인기를 끌고 있다. 리쥬비넥스크림은 올 한해 일반의약품 매출 순위 탑10에 꾸준히 들고 있다.피부 건강에 대한 여성들의 높은 관심에 힘입어 입소문이 터지면서 약국에서 가장 뜨거운 품목으로 떠올랐다. 특히, 외국 관광객들 사이에서도 한국 쇼핑 1순위 제품으로 인기 몰이를 하고 있다.케어인사이트가 지난 8월 POS가 설치된 459곳 약국을 대상으로 100위 내 일반약을 조사해 데일리팜에 공개한 자료에 따르면 리쥬비넥스크림은 판매횟수 1065회로 6위를 기록했다.종근당 더마그램피디알엔크림이 시장에 출시하면 이같은 리쥬비넥스크림 인기에 편승해 자리를 잡을 것으로 보인다. 약국에서는 양사의 경쟁으로 판매량이 더 상승할 거란 기대를 하고 있다.2025-09-26 15:59:11이탁순 -
 "콜린 급여축소 정지, 공공복리에 영향"...뒤집힌 논리 왜?[데일리팜=천승현 기자] 뇌기능개선제 ‘콜린알포세레이트’(콜린제제) 급여 축소 집행정지 기각은 시행을 중지하면 공공복리에 중대한 미칠 우려가 있다는 재판부의 판단이 결정적으로 작용했다. 1년 전 집행정지를 인용할 때와 정반대의 논리가 제시됐다. 이미 행정소송 본안소송에서 제약사들이 주장한 선별급여 부당성이 인정되지 않으면서 집행정지 필요성도 기각됐다. 제약사들은 본안소송에서 콜린제제 급여축소 부당성을 납득하기 위해 다양한 주장을 펼쳤지만 재판부는 모두 받아들이지 않았다.서울고법 "급여축소 효력 정지시 공공복리에 영향"...1년 전 집행정지 인용 때와 정반대26일 업계에 따르면 서울고등법원 제10-1행정부는 대웅바이오외 12인이 청구한 요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부개정고시 집행정지 청구를 기각했다. 제약사들은 지난달 콜린제제 급여축소 행정소송 항소심 패소 이후 급여 축소를 대법원 판결까지 중단해달라는 집행정지를 제기했지만 재판부는 받아들이지 않았다.해당 집행정지 사건의 결정문을 보면 재판부는 “이 사건 고시로 인해 신청인들에게 생길 회복하기 어려운 손해를 예방하기 위해 고시 효력을 정지할 긴급한 필요가 인정하기에 부족하다”라고 판단했다.대웅바이오 등의 콜린제제 급여축소 집행정지 청구의 기각 사유로 대웅바이오 등은 “상고심 판결 선고일로부터 30일이 되는 날까지 효력을 정지해달라”고 청구했지만 재판부는 “고시의 효력을 정지할 경우 공공복리에 중대한 영향을 미칠 우려가 있다고 인정할 수 있다”라고 봤다.대웅바이오, 대원제약, 삼진제약, 경동제약, 동광제약, 환인제약, 영진약품, 대화제약, JW중외제약, 킵스바이오파마, JW신약, 넥스팜코리아 등이 해당 집행정지 사건에 참여했다.종전 집행정지 결정과 정반대의 논리와 결과다.지난해 6월 서울고등법원 제9-1행정부는 종근당 등 제약사 19곳과 개인 6인이 청구한 콜린제제 급여축소 집행정지를 인용했다. 재판부는 콜린제제 급여축소의 효력을 고시 취소 청구 사건의 판결 확정시까지 정지한다고 판결했다.종근당, 한국프라임제약, 서흥, 알리코제약, 국제약품, 명문제약, 제뉴파마, 한국파마, 신풍제약, 경보제약, 유니메드제약, 동구바이오제약, 동국제약, 삼천당제약, 위더스제약, 고려제약, 마더스제약, 다산제약, 성원애드콕제약 등 19곳이 급여 축소 집행정지 인용 결정을 받았다.종근당 등의 콜린제제 급여축소 집행정지 인용 사유로 당시 재판부는 “처분 집행으로 신청인들에게 회복하기 어려운 손해를 예방하기 위해 긴급한 필요가 있다고 인정된다”라고 판단했다. 집행정지로 인해 공공복리에 중대한 영향을 미칠 우려가 있다고 인정하기 부족하다는 게 재판부가 내놓은 집행정지 인용 배경이다.재판부는 콜린제제 급여축소 시행으로 제약사들이 회복할 수 없는 심각한 손해가 발생하기 때문에 집행정지가 필요하다고 봤다. 하지만 1년 만에 콜린제제의 효력이 정지되면 오히려 공익에 중요한 영향을 미칠 수 있다며 정반대 견해를 개진했다.재판부가 연이어 콜린제제 급여축소 취소소송에서 정부 손을 들어주면서 처분 집행정지의 필요성에 대해 부정적인 견해가 커진 것으로 분석된다.앞서 보건복지부는 2020년 8월 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다.소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다. 종근당 그룹은 지난 2022년 7월 1심에서 패소 판결을 받았고 항소심에서도 지난해 5월 기각 판결이 내려졌다. 종근당 등은 지난해 6월 상고심을 제기했고 지난 3월 대법원에서도 기각 판결이 내려졌다. 대웅바이오 그룹은 지난 2022년 11월 패소 판결을 받은 이후 항소심을 청구했고 지난달 2심에서도 패소했다.제약사들, 급여축소 취소소송 전패...절차적 위법성·재량권 일탈 남용 등 모두 기각콜린제제 급여축소 취소소송 판결문을 보면 제약사들이 부당하다고 주장한 논리는 모두 기각됐다.지난 3월 13일 선고된 종근당 그룹 사건의 대법원 판결문을 보면 재판부는 제약사들이 주장한 절자적 위법성을 인정하지 않았다.제약사들은 콜린제제의 선별급여 대상 지정은 요양 급여대상으로서의 지위가 박탈된 것에 해당하기 때문에 약제의 요양급여대상 여부 직권조정에 관한 요양급여기준규칙에 따라야 하는데 정부는 다른 기준과 절차를 적용했다고 주장했다.하지만 재판부는 “요양급여 대상 약제를 선별급여 대상으로 변경하는 것을 비급여대상으로 변경한 것이라고 할 수 없다”라고 판단했다.제약사들이 콜린제제의 선별급여 변경 과정에서 절차적 권리를 침해 당했다고 주장했는데 재판부는 보건당국이 제약사들에 사전통지와 의견제출 기회, 이의신청 기회까지 보장했다는 점을 들어 절차적 하자가 없었다고 결론내렸다.대법원에서는 콜린제제의 선별급여 대상 지정의 실제적 요건 충족에 대해서도 “행정청이 국민 건강을 보호·증진하고 보험재정 건전성을 유지하고자 하는 목적에서 정하는 바에 따라 전문적인 판단을 했다면 그 판단은 기초가 된 사실인정에 중대한 오류가 있거나 판단이 객관적으로 불합리하거나 부당하다는 등의 특별한 사정이 없는 한 존중돼야 한다”라는 이유로 인정했다.재판부는 콜린제제의 재량권 일탈·남용 지적에 대해서도 “이 사건 고시가 건강보험재정의 건전성을 도모하기 위한 것으로 목적의 정당성과 수단의 적합성이 인정되고, 약제의 일부 질환에 대한 본인부담률을 80%로 정한 것이 침해 최소성이나 법의 균형성 원칙에 위배된다고 볼 수 없다”라고 일축했다. 대웅바이오 그룹의 2심 판결에서도 절차적 하자, 실체적 하자, 선별급여 요건 미충족, 재량권의 일탈·남용 등의 문제가 제기됐지만 재판부는 모두 기각했다.제약사들은 종근당 그룹의 대법원 판결에서 언급되지 않은 대체약제 관련 문제를 제기했지만 재판부는 받아들이지 않았다.제약사들은 “정부의 약제급여위원회 회의 자료에서 콜린제제의 대체약제로 제시된 니세르골린 등은 경도인지장애 허가를 받지 않았다”라면서 “아세틸엘카르니틴과 옥세라세탐은 허가가 취소됐다”라고 설명했다.아세틸엘카르니틴과 옥시라세탐은 콜린제제의 급여 축소 결정 당시 콜린제제의 대체약제로 지목됐다. 아세틸엘카르니틴은 ‘일차적 퇴행성 질환’ 또는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’에 사용하도록 허가 받았다. 옥시라세탐은 알츠하이머형 치매, 다발경색성 치매, 뇌기능부전으로 인한 기질성 뇌증후군 등으로 인한 인지장애의 개선 용도로 허가받았다.하지만 아세틸엘카르니틴와 옥시라세탐은 식품의약품안전처의 임상재평가 결과 유효성 입증에 실패했다. 아세틸엘카르니틴은 2022년 적응증이 모두 삭제됐고 옥시라세탐은 2023년 사용이 중지됐다. 콜린제제의 대체약제로 지목된 의약품이 사라졌기 때문에 콜린제제의 급여가 유지돼야 한다는 게 원고 측의 주장이다.제약사들은 시티콜린, 이부딜라스트, 이펜프로딜, 니세르골린 등 대체 약물로 제시된 다른 성분 의약품의 허가사항에 경도인지장애가 포함되지 않아 대체약제로 인정할 수 없다고 주장했다.하지만 재판부는 제약사들의 주장을 모두 받아들이지 않고 보건당국 측의 손을 들어줬다. 2심 재판부는 “대체 가능성의 평가 척도로 ‘선택 가능한 동일 목적의 급여 항목의 유무’만을 요구할 뿐 식약청의 허가사항의 상세내역까지 동일할 것을 요구하지 않는다”라면서 식약처의 허가사항이 달라도 대체약제로 인정할 수 있다고 판단했다.재판부는 “대체 가능성에 관한 판단에 대해서는 고도의 의료·보건상 전문성이 필요하므로 보건당국이 전문적인 판단을 했다면 판단의 기초가 된 사실인정에 중대한 오류가 없는 한 존중돼야 한다”라고 결론내렸다.2025-09-24 06:20:08천승현
"콜린 급여축소 정지, 공공복리에 영향"...뒤집힌 논리 왜?[데일리팜=천승현 기자] 뇌기능개선제 ‘콜린알포세레이트’(콜린제제) 급여 축소 집행정지 기각은 시행을 중지하면 공공복리에 중대한 미칠 우려가 있다는 재판부의 판단이 결정적으로 작용했다. 1년 전 집행정지를 인용할 때와 정반대의 논리가 제시됐다. 이미 행정소송 본안소송에서 제약사들이 주장한 선별급여 부당성이 인정되지 않으면서 집행정지 필요성도 기각됐다. 제약사들은 본안소송에서 콜린제제 급여축소 부당성을 납득하기 위해 다양한 주장을 펼쳤지만 재판부는 모두 받아들이지 않았다.서울고법 "급여축소 효력 정지시 공공복리에 영향"...1년 전 집행정지 인용 때와 정반대26일 업계에 따르면 서울고등법원 제10-1행정부는 대웅바이오외 12인이 청구한 요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부개정고시 집행정지 청구를 기각했다. 제약사들은 지난달 콜린제제 급여축소 행정소송 항소심 패소 이후 급여 축소를 대법원 판결까지 중단해달라는 집행정지를 제기했지만 재판부는 받아들이지 않았다.해당 집행정지 사건의 결정문을 보면 재판부는 “이 사건 고시로 인해 신청인들에게 생길 회복하기 어려운 손해를 예방하기 위해 고시 효력을 정지할 긴급한 필요가 인정하기에 부족하다”라고 판단했다.대웅바이오 등의 콜린제제 급여축소 집행정지 청구의 기각 사유로 대웅바이오 등은 “상고심 판결 선고일로부터 30일이 되는 날까지 효력을 정지해달라”고 청구했지만 재판부는 “고시의 효력을 정지할 경우 공공복리에 중대한 영향을 미칠 우려가 있다고 인정할 수 있다”라고 봤다.대웅바이오, 대원제약, 삼진제약, 경동제약, 동광제약, 환인제약, 영진약품, 대화제약, JW중외제약, 킵스바이오파마, JW신약, 넥스팜코리아 등이 해당 집행정지 사건에 참여했다.종전 집행정지 결정과 정반대의 논리와 결과다.지난해 6월 서울고등법원 제9-1행정부는 종근당 등 제약사 19곳과 개인 6인이 청구한 콜린제제 급여축소 집행정지를 인용했다. 재판부는 콜린제제 급여축소의 효력을 고시 취소 청구 사건의 판결 확정시까지 정지한다고 판결했다.종근당, 한국프라임제약, 서흥, 알리코제약, 국제약품, 명문제약, 제뉴파마, 한국파마, 신풍제약, 경보제약, 유니메드제약, 동구바이오제약, 동국제약, 삼천당제약, 위더스제약, 고려제약, 마더스제약, 다산제약, 성원애드콕제약 등 19곳이 급여 축소 집행정지 인용 결정을 받았다.종근당 등의 콜린제제 급여축소 집행정지 인용 사유로 당시 재판부는 “처분 집행으로 신청인들에게 회복하기 어려운 손해를 예방하기 위해 긴급한 필요가 있다고 인정된다”라고 판단했다. 집행정지로 인해 공공복리에 중대한 영향을 미칠 우려가 있다고 인정하기 부족하다는 게 재판부가 내놓은 집행정지 인용 배경이다.재판부는 콜린제제 급여축소 시행으로 제약사들이 회복할 수 없는 심각한 손해가 발생하기 때문에 집행정지가 필요하다고 봤다. 하지만 1년 만에 콜린제제의 효력이 정지되면 오히려 공익에 중요한 영향을 미칠 수 있다며 정반대 견해를 개진했다.재판부가 연이어 콜린제제 급여축소 취소소송에서 정부 손을 들어주면서 처분 집행정지의 필요성에 대해 부정적인 견해가 커진 것으로 분석된다.앞서 보건복지부는 2020년 8월 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다.소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다. 종근당 그룹은 지난 2022년 7월 1심에서 패소 판결을 받았고 항소심에서도 지난해 5월 기각 판결이 내려졌다. 종근당 등은 지난해 6월 상고심을 제기했고 지난 3월 대법원에서도 기각 판결이 내려졌다. 대웅바이오 그룹은 지난 2022년 11월 패소 판결을 받은 이후 항소심을 청구했고 지난달 2심에서도 패소했다.제약사들, 급여축소 취소소송 전패...절차적 위법성·재량권 일탈 남용 등 모두 기각콜린제제 급여축소 취소소송 판결문을 보면 제약사들이 부당하다고 주장한 논리는 모두 기각됐다.지난 3월 13일 선고된 종근당 그룹 사건의 대법원 판결문을 보면 재판부는 제약사들이 주장한 절자적 위법성을 인정하지 않았다.제약사들은 콜린제제의 선별급여 대상 지정은 요양 급여대상으로서의 지위가 박탈된 것에 해당하기 때문에 약제의 요양급여대상 여부 직권조정에 관한 요양급여기준규칙에 따라야 하는데 정부는 다른 기준과 절차를 적용했다고 주장했다.하지만 재판부는 “요양급여 대상 약제를 선별급여 대상으로 변경하는 것을 비급여대상으로 변경한 것이라고 할 수 없다”라고 판단했다.제약사들이 콜린제제의 선별급여 변경 과정에서 절차적 권리를 침해 당했다고 주장했는데 재판부는 보건당국이 제약사들에 사전통지와 의견제출 기회, 이의신청 기회까지 보장했다는 점을 들어 절차적 하자가 없었다고 결론내렸다.대법원에서는 콜린제제의 선별급여 대상 지정의 실제적 요건 충족에 대해서도 “행정청이 국민 건강을 보호·증진하고 보험재정 건전성을 유지하고자 하는 목적에서 정하는 바에 따라 전문적인 판단을 했다면 그 판단은 기초가 된 사실인정에 중대한 오류가 있거나 판단이 객관적으로 불합리하거나 부당하다는 등의 특별한 사정이 없는 한 존중돼야 한다”라는 이유로 인정했다.재판부는 콜린제제의 재량권 일탈·남용 지적에 대해서도 “이 사건 고시가 건강보험재정의 건전성을 도모하기 위한 것으로 목적의 정당성과 수단의 적합성이 인정되고, 약제의 일부 질환에 대한 본인부담률을 80%로 정한 것이 침해 최소성이나 법의 균형성 원칙에 위배된다고 볼 수 없다”라고 일축했다. 대웅바이오 그룹의 2심 판결에서도 절차적 하자, 실체적 하자, 선별급여 요건 미충족, 재량권의 일탈·남용 등의 문제가 제기됐지만 재판부는 모두 기각했다.제약사들은 종근당 그룹의 대법원 판결에서 언급되지 않은 대체약제 관련 문제를 제기했지만 재판부는 받아들이지 않았다.제약사들은 “정부의 약제급여위원회 회의 자료에서 콜린제제의 대체약제로 제시된 니세르골린 등은 경도인지장애 허가를 받지 않았다”라면서 “아세틸엘카르니틴과 옥세라세탐은 허가가 취소됐다”라고 설명했다.아세틸엘카르니틴과 옥시라세탐은 콜린제제의 급여 축소 결정 당시 콜린제제의 대체약제로 지목됐다. 아세틸엘카르니틴은 ‘일차적 퇴행성 질환’ 또는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’에 사용하도록 허가 받았다. 옥시라세탐은 알츠하이머형 치매, 다발경색성 치매, 뇌기능부전으로 인한 기질성 뇌증후군 등으로 인한 인지장애의 개선 용도로 허가받았다.하지만 아세틸엘카르니틴와 옥시라세탐은 식품의약품안전처의 임상재평가 결과 유효성 입증에 실패했다. 아세틸엘카르니틴은 2022년 적응증이 모두 삭제됐고 옥시라세탐은 2023년 사용이 중지됐다. 콜린제제의 대체약제로 지목된 의약품이 사라졌기 때문에 콜린제제의 급여가 유지돼야 한다는 게 원고 측의 주장이다.제약사들은 시티콜린, 이부딜라스트, 이펜프로딜, 니세르골린 등 대체 약물로 제시된 다른 성분 의약품의 허가사항에 경도인지장애가 포함되지 않아 대체약제로 인정할 수 없다고 주장했다.하지만 재판부는 제약사들의 주장을 모두 받아들이지 않고 보건당국 측의 손을 들어줬다. 2심 재판부는 “대체 가능성의 평가 척도로 ‘선택 가능한 동일 목적의 급여 항목의 유무’만을 요구할 뿐 식약청의 허가사항의 상세내역까지 동일할 것을 요구하지 않는다”라면서 식약처의 허가사항이 달라도 대체약제로 인정할 수 있다고 판단했다.재판부는 “대체 가능성에 관한 판단에 대해서는 고도의 의료·보건상 전문성이 필요하므로 보건당국이 전문적인 판단을 했다면 판단의 기초가 된 사실인정에 중대한 오류가 없는 한 존중돼야 한다”라고 결론내렸다.2025-09-24 06:20:08천승현 -
![[데스크 시선] 이해할 수 없는 급여재평가 비공개 행정](https://pds.dailypharm.com/news_image/202509/327086_1.jpg) [데스크 시선] 이해할 수 없는 급여재평가 비공개 행정[데일리팜=천승현 기자] 보건당국은 건강보험이 적용 중인 의약품에 대해 재정을 투입해 약값을 지원할 가치가 있는지 따져보는 급여 적정성 평가 제도를 가동하고 있다.지난 2021년부터 진행된 급여재평가에서 총 6개 성분 의약품 전 품목이 급여 목록에서 퇴출됐다. 실리마린, 빌베리건조엑스, 스트렙토키나제·스트렙토도르나제, 옥시라세탐, 아세틸엘카르니틴, 이토프리드 등이 급여 재평가 관문을 통과하지 못하고 건강보험 적용 대상에서 제외됐다. 이중 스트렙토키나제·스트렙토도르나제, 옥시라세탐, 아세틸엘카르니틴 등은 임상재평가에서 유효성 입증에 실패하면서 급여 재평가도 좌절된 사례다. 적응증 일부가 급여 적용 대상에서 제외되는 의약품도 있다.올해 급여재평가에서는 애엽 추출물 성분 위염 치료제가 급여 적정성이 없다는 판단에 급여 퇴출 위기에 놓였다. 제약사들의 이의신청 절차를 거쳐 최종 급여 재평가 결과가 도출될 예정이다.급여재평가 진행 과정에서 늘 의문이 드는 점은 합격과 불합격의 구체적인 사유가 공개되지 않는다는 것이다.애엽추출물의 사례를 보면 ‘급여적정성 없음’이라는 심의 결과와 함께 ‘임상적 유용성 근거 없음’이라는 10글자짜리 사유만이 제시됐을 뿐이다. 유용성의 사전적 의미는 ‘소용에 닿고 이용할 만한 특성’이다. ‘임상 결과 값을 살펴보니 건강보험 재정을 투입할 정도의 쓸모가 없다’는 의미로 해석된다.하지만 어떤 임상 자료가 어떤 기준점에 미달했는지 또는 안전성에 어떤 문제가 발견됐는지 등 어떠한 구체적인 사유도 제시되지 않았다. 예를 들어 제약사가 제출한 임상 논문을 검증한 결과 위염 치료 효과가 얼마나 부족했는지 친절한 설명이라도 있었다면 급여재평가 결과에 대한 의구심은 덜 들었을 것이다.식품의약품안전처가 효과가 불분명한 의약품을 허가했다는 불신으로 이어질 수 있다. 식약처는 허가받은 의약품을 5년 마다 효능·안전성을 검증하는 의약품 품목허가 갱신제를 운영 중인데 임상적 유용성 근거가 없는 의약품이 어떻게 정기적으로 허가를 갱신할 수 있었는지도 의문이다. 행여 국내 개발 천연물의약품이 해외에서 판매되지 않는다는 점이 급여 재평가 감점의 요인으로 작용한건 아닌지도 의심스럽다.이전에 급여 재평가 결과를 발표하면서도 구체적인 임상적인 내용이 공개된 적은 단 한 번도 없었다.의약품 조사 기관 유비스트에 따르면 지난해 애엽 추출물의 처방 시장은 1298억원을 형성했다. 애엽추출물은 용량과 제조법에 따라 총 4종류가 있는데 평균 약가는 107원, 124원, 186원, 205원이다. 4종류의 애엽추출물이 비슷하게 처방됐다고 가정하면 지난해에만 총 8억개 이상이 처방됐다는 계산이 나온다.우리나라 국민 1인당 1년에 15개 이상 복용한 의약품을 건강보험 적용 대상에서 제외하면서 구체적인 사유조차 설명하지 않는 것이 불합리하다는 비판이 나올 수밖에 없다. 의료인들과 환자들은 오랜 기간 쓸모없는 약을 처방하고 복용한 셈이 되는데 구체적인 이유가 무엇인지조차 알 수 없다는 것은 매우 불편한 현상이다.애엽추출물은 국내제약사 100곳 이상이 판매 중인 의약품이다. 오리지널 의약품을 보유한 제약사가 관련 임상 자료를 제출했고 급여 재평가가 이뤄졌다. 제네릭을 보유한 100여곳의 제약사는 어떤 이유로 급여 재평가 통과가 힘들어졌는지 알 수도 없는 실정이다. 정상적으로 허가받고 판매 중인 자산이 쓸모가 없다는 이유로 시장에서 퇴출되는데도 해당 업체들은 구체적인 이유도 알 수 없는 이상한 현상이 매년 반복되고 있다는 얘기다. 급여 재평가를 결정하는 회의록조차 공개된 적이 없다.보건당국은 급여 재평가 탈락이 건강보험 재정 절감의 기회가 될 것으로 자평하는 분위기다. 하지만 반대로 그동안 임상적 유용성이 없는 의약품에 대해 불필요한 재정을 낭비했다는 실책을 실토하는 것이나 다름없다. 정부의 급여 재평가 탈락은 정부의 반성도 동반돼야 한다.심지어 애엽 추출물은 14년 전 보건당국이 급여재평가를 진행한 결과 이미 유용성을 인정받은 바 있다. 복지부는 지난 2011년 효능에 비해 약값이 비싼 약의 퇴출하거나 약가를 깎는 기등재의약품 목록정비의 일환으로 순환기계용약, 소화성궤양용약 등 5개 효능군에 대해 경제성을 검토한 결과 임상적 유용성이 부족한 211개 품목에 대해 보험 적용을 중단키로 했다.당시 보건당국은 스티렌의 ‘위염 치료’ 적응증에 대해서는 유용성을 인정했고 ‘위염 예방’ 유용성에 대해 문제를 제기했다. 위염 예방은 임상시험 자료 제출 지연을 이유로 제약사와 정부가 법정 공방을 펼쳤고 결국 약가인하와 급여 삭제로 결론났다. 위염 치료의 유용성에 대해서는 아무런 문제가 제기되지 않았다.불과 14년 전에 임상적 유용성에 아무 문제가 제기되지 않은 의약품이 왜 이제와서 급여 적정성이 없다고 판단됐는지 납득할만한 사유가 공개돼야 한다. 이재명 대통령 주재로 진행되는 국무회의도 전 국민들에게 생중계되는 시대다. 오랜 기간 국민들이 매년 10개 이상 복용한 의약품이 퇴출되는 중요한 행정이라면 절차와 결과는 더욱 투명하게 공개돼야 마땅하다.2025-09-22 06:15:00천승현
[데스크 시선] 이해할 수 없는 급여재평가 비공개 행정[데일리팜=천승현 기자] 보건당국은 건강보험이 적용 중인 의약품에 대해 재정을 투입해 약값을 지원할 가치가 있는지 따져보는 급여 적정성 평가 제도를 가동하고 있다.지난 2021년부터 진행된 급여재평가에서 총 6개 성분 의약품 전 품목이 급여 목록에서 퇴출됐다. 실리마린, 빌베리건조엑스, 스트렙토키나제·스트렙토도르나제, 옥시라세탐, 아세틸엘카르니틴, 이토프리드 등이 급여 재평가 관문을 통과하지 못하고 건강보험 적용 대상에서 제외됐다. 이중 스트렙토키나제·스트렙토도르나제, 옥시라세탐, 아세틸엘카르니틴 등은 임상재평가에서 유효성 입증에 실패하면서 급여 재평가도 좌절된 사례다. 적응증 일부가 급여 적용 대상에서 제외되는 의약품도 있다.올해 급여재평가에서는 애엽 추출물 성분 위염 치료제가 급여 적정성이 없다는 판단에 급여 퇴출 위기에 놓였다. 제약사들의 이의신청 절차를 거쳐 최종 급여 재평가 결과가 도출될 예정이다.급여재평가 진행 과정에서 늘 의문이 드는 점은 합격과 불합격의 구체적인 사유가 공개되지 않는다는 것이다.애엽추출물의 사례를 보면 ‘급여적정성 없음’이라는 심의 결과와 함께 ‘임상적 유용성 근거 없음’이라는 10글자짜리 사유만이 제시됐을 뿐이다. 유용성의 사전적 의미는 ‘소용에 닿고 이용할 만한 특성’이다. ‘임상 결과 값을 살펴보니 건강보험 재정을 투입할 정도의 쓸모가 없다’는 의미로 해석된다.하지만 어떤 임상 자료가 어떤 기준점에 미달했는지 또는 안전성에 어떤 문제가 발견됐는지 등 어떠한 구체적인 사유도 제시되지 않았다. 예를 들어 제약사가 제출한 임상 논문을 검증한 결과 위염 치료 효과가 얼마나 부족했는지 친절한 설명이라도 있었다면 급여재평가 결과에 대한 의구심은 덜 들었을 것이다.식품의약품안전처가 효과가 불분명한 의약품을 허가했다는 불신으로 이어질 수 있다. 식약처는 허가받은 의약품을 5년 마다 효능·안전성을 검증하는 의약품 품목허가 갱신제를 운영 중인데 임상적 유용성 근거가 없는 의약품이 어떻게 정기적으로 허가를 갱신할 수 있었는지도 의문이다. 행여 국내 개발 천연물의약품이 해외에서 판매되지 않는다는 점이 급여 재평가 감점의 요인으로 작용한건 아닌지도 의심스럽다.이전에 급여 재평가 결과를 발표하면서도 구체적인 임상적인 내용이 공개된 적은 단 한 번도 없었다.의약품 조사 기관 유비스트에 따르면 지난해 애엽 추출물의 처방 시장은 1298억원을 형성했다. 애엽추출물은 용량과 제조법에 따라 총 4종류가 있는데 평균 약가는 107원, 124원, 186원, 205원이다. 4종류의 애엽추출물이 비슷하게 처방됐다고 가정하면 지난해에만 총 8억개 이상이 처방됐다는 계산이 나온다.우리나라 국민 1인당 1년에 15개 이상 복용한 의약품을 건강보험 적용 대상에서 제외하면서 구체적인 사유조차 설명하지 않는 것이 불합리하다는 비판이 나올 수밖에 없다. 의료인들과 환자들은 오랜 기간 쓸모없는 약을 처방하고 복용한 셈이 되는데 구체적인 이유가 무엇인지조차 알 수 없다는 것은 매우 불편한 현상이다.애엽추출물은 국내제약사 100곳 이상이 판매 중인 의약품이다. 오리지널 의약품을 보유한 제약사가 관련 임상 자료를 제출했고 급여 재평가가 이뤄졌다. 제네릭을 보유한 100여곳의 제약사는 어떤 이유로 급여 재평가 통과가 힘들어졌는지 알 수도 없는 실정이다. 정상적으로 허가받고 판매 중인 자산이 쓸모가 없다는 이유로 시장에서 퇴출되는데도 해당 업체들은 구체적인 이유도 알 수 없는 이상한 현상이 매년 반복되고 있다는 얘기다. 급여 재평가를 결정하는 회의록조차 공개된 적이 없다.보건당국은 급여 재평가 탈락이 건강보험 재정 절감의 기회가 될 것으로 자평하는 분위기다. 하지만 반대로 그동안 임상적 유용성이 없는 의약품에 대해 불필요한 재정을 낭비했다는 실책을 실토하는 것이나 다름없다. 정부의 급여 재평가 탈락은 정부의 반성도 동반돼야 한다.심지어 애엽 추출물은 14년 전 보건당국이 급여재평가를 진행한 결과 이미 유용성을 인정받은 바 있다. 복지부는 지난 2011년 효능에 비해 약값이 비싼 약의 퇴출하거나 약가를 깎는 기등재의약품 목록정비의 일환으로 순환기계용약, 소화성궤양용약 등 5개 효능군에 대해 경제성을 검토한 결과 임상적 유용성이 부족한 211개 품목에 대해 보험 적용을 중단키로 했다.당시 보건당국은 스티렌의 ‘위염 치료’ 적응증에 대해서는 유용성을 인정했고 ‘위염 예방’ 유용성에 대해 문제를 제기했다. 위염 예방은 임상시험 자료 제출 지연을 이유로 제약사와 정부가 법정 공방을 펼쳤고 결국 약가인하와 급여 삭제로 결론났다. 위염 치료의 유용성에 대해서는 아무런 문제가 제기되지 않았다.불과 14년 전에 임상적 유용성에 아무 문제가 제기되지 않은 의약품이 왜 이제와서 급여 적정성이 없다고 판단됐는지 납득할만한 사유가 공개돼야 한다. 이재명 대통령 주재로 진행되는 국무회의도 전 국민들에게 생중계되는 시대다. 오랜 기간 국민들이 매년 10개 이상 복용한 의약품이 퇴출되는 중요한 행정이라면 절차와 결과는 더욱 투명하게 공개돼야 마땅하다.2025-09-22 06:15:00천승현 -
 메디톡스, 턱밑 지방 개선 치료 '뉴비쥬주' 국산신약 허가[데일리팜=이탁순 기자] 메디톡스의 턱밑 지방 개선 치료제 '뉴비쥬주(콜산)'가 국내 개발 40호 신약으로 허가됐다.콜산 성분의 턱밑 지방 개선 치료제는 뉴비쥬주가 처음이다. 기존 치료제들은 데옥시콜산을 주성분으로 했다.식품의약품안전처(처장 오유경)는 턱밑 지방 개선 치료에 사용하는 '뉴비쥬주(콜산)'를 국내에서 개발한 40번째 신약으로 19일 허가했다고 밝혔다. 이 약의 제조는 JW중외제약이 맡는다.콜산(Cholic acid)은 간에서 합성되어 담즙으로 분비되는 담즙산의 일종이다. 이 약은 계면활성제 작용에 의한 세포막의 이중지질층 구조를 파괴해 지방세포용해를 야기시켜 턱밑 피하의 지방세포를 감소시키는 치료제로 중등증~중증의 돌출되거나 과도한 턱밑 지방을 개선하고자 하는 성인 환자에게 사용한다.뉴비쥬주는 돌출되거나 과도한 턱밑 지방을 개선하고자 하는 성인 환자에게 치료제 선택의 폭을 확대하는 데 도움을 줄 것으로 기대되고 있다.216명을 대상으로 한 유효성 임상시험에서 마지막 투여 12주 후 의사 및 환자 평가 결과 모두 투여 전 대비 1단계 이상 턱밑 지방이 개선된 대상자의 비율은 이 약 투여군 88.57%(93/105명), 위약군 32.43%(36/111명)이었고, 2단계 이상 턱밑 지방이 개선된 대상자의 비율은 이 약 투여군 46.67%(49/105명), 위약군 5.41%(6/111명)로, 뉴비쥬주의 턱밑 지방 개선 효과가 위약군과 비교해 우월함을 입증했다.식약처는 "앞으로도 규제 과학 전문성을 바탕으로 안전성·효과성이 충분히 확인된 치료제가 신속하게 공급되고 환자에게 치료 기회가 확대될 수 있도록 최선을 다할 계획"이라고 밝혔다.2025-09-19 13:19:27이탁순
메디톡스, 턱밑 지방 개선 치료 '뉴비쥬주' 국산신약 허가[데일리팜=이탁순 기자] 메디톡스의 턱밑 지방 개선 치료제 '뉴비쥬주(콜산)'가 국내 개발 40호 신약으로 허가됐다.콜산 성분의 턱밑 지방 개선 치료제는 뉴비쥬주가 처음이다. 기존 치료제들은 데옥시콜산을 주성분으로 했다.식품의약품안전처(처장 오유경)는 턱밑 지방 개선 치료에 사용하는 '뉴비쥬주(콜산)'를 국내에서 개발한 40번째 신약으로 19일 허가했다고 밝혔다. 이 약의 제조는 JW중외제약이 맡는다.콜산(Cholic acid)은 간에서 합성되어 담즙으로 분비되는 담즙산의 일종이다. 이 약은 계면활성제 작용에 의한 세포막의 이중지질층 구조를 파괴해 지방세포용해를 야기시켜 턱밑 피하의 지방세포를 감소시키는 치료제로 중등증~중증의 돌출되거나 과도한 턱밑 지방을 개선하고자 하는 성인 환자에게 사용한다.뉴비쥬주는 돌출되거나 과도한 턱밑 지방을 개선하고자 하는 성인 환자에게 치료제 선택의 폭을 확대하는 데 도움을 줄 것으로 기대되고 있다.216명을 대상으로 한 유효성 임상시험에서 마지막 투여 12주 후 의사 및 환자 평가 결과 모두 투여 전 대비 1단계 이상 턱밑 지방이 개선된 대상자의 비율은 이 약 투여군 88.57%(93/105명), 위약군 32.43%(36/111명)이었고, 2단계 이상 턱밑 지방이 개선된 대상자의 비율은 이 약 투여군 46.67%(49/105명), 위약군 5.41%(6/111명)로, 뉴비쥬주의 턱밑 지방 개선 효과가 위약군과 비교해 우월함을 입증했다.식약처는 "앞으로도 규제 과학 전문성을 바탕으로 안전성·효과성이 충분히 확인된 치료제가 신속하게 공급되고 환자에게 치료 기회가 확대될 수 있도록 최선을 다할 계획"이라고 밝혔다.2025-09-19 13:19:27이탁순 -
 소송 패소에 무너진 콜린알포 급여축소 저지선[데일리팜=천승현 기자] 뇌기능개선제 ‘콜린알포세레이트’의 급여 축소가 시행된다. 제약사들의 고시 집행정지 청구가 기각되면서 고시 발령 5년 만에 환자들 한 달 평균 약값이 최대 2만원 가량 인상된다. 제약사들이 청구한 집행정지가 총 10차례 인용되면서 급여 축소 시행이 중단됐지만 행정소송이 패색이 짙어지면서 집행정지 저지선마저 무너졌다.18일 업계에 따르면 서울고등법원 제10-1행정부는 대웅바이오외 12인이 청구한 요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부개정고시 집행정지 청구를 기각했다. 제약사들은 지난달 콜린제제 급여축소 행정소송 항소심 패소 이후 급여 축소를 대법원 판결까지 중단해달라는 집행정지를 제기했지만 재판부는 받아들이지 않았다.보건복지부는 2020년 8월 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다.제약사들은 콜린제제 급여 축소의 부당함을 따지는 취소 소송을 제기하면서 집행정지를 청구했다. 기존에는 제약사들이 보건당국과 다툰 집행정지 사건 10건 모두 승소하면서 급여축소가 보류됐다. 소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다.종근당 등이 행정소송을 제기하면서 청구한 급여축소 집행정지는 2020년 9월 서울행정법원이 집행정지 인용결정을 내렸고 같은 해 12월 항고심에서도 재판부는 제약사들의 손을 들어줬다. 대법원은 집행정지 재항고심에서도 원심 결정을 그대로 유지했다.대웅바이오 등이 제기한 콜린제제 집행정지는 2020년 10월 인용됐고, 복지부가 항고한 지 9개월 만에 2심에서도 집행정지 인용 판결이 나왔다. 2022년 10월 복지부가 제기한 재항고심에서도 기각 판결이 나왔다.제약사들은 본안소송 1심 패소 이후 항소심을 제기하면서 또 다시 급여축소 집행정지도 청구했다. 종근당 그룹이 청구한 집행정지 사건은 2022년 11월 “2심 판결 선고일부터 30일이 되는 날까지 고시 시행을 중단하라”는 판결을 받았고 복지부의 재항고도 대법원에서 기각됐다. 대웅바이오 그룹이 청구한 집행정지는 2022년 12월 인용됐다. 복지부가 집행정지 재항고를 청구했지만 대법원에서도 제약사들의 손을 들어줬다. 제약사 입장에서는 콜린제제 급여축소 집행정지 사건에서 10번 모두 승소한 셈이다.하지만 제약사들은 콜린제제 급여 축소 행정소송 본안소송에서 패색이 짙어지면서 집행정지도 고배를 들었다. 종근당 그룹의 대법원 판결이 나왔다는 점이 집행정지 기각의 주요 배경으로 분석된다.종근당 그룹은 지난 2022년 7월 1심에서 패소 판결을 받았고 항소심에서도 지난해 5월 기각 판결이 내려졌다. 종근당 등은 지난해 6월 상고심을 제기했고 지난 3월 대법원에서도 기각 판결이 내려졌다.대웅바이오 그룹은 지난 2022년 11월 패소 판결을 받은 이후 항소심을 청구했고 지난달 2심에서도 패소했다.대웅바이오 그룹은 콜린제제의 대체약제가 없다는 점을 급여 축소 부당성의 근거로 강하게 주장하고 있다. 실제로 지난 6월 콜린제제 급여축소 취소소송 항소심 마지막 변론에서 종근당 그룹의 대법원 판결에서 대체약제 관련 쟁점이 언급되지 않았다는 점을 적극적으로 부각했다.원고 측은 “정부의 약제급여위원회 회의 자료에서 콜린제제의 대체약제로 제시된 니세르골린 등은 경도인지장애 허가를 받지 않았다”라면서 “아세틸엘카르니틴과 옥세라세탐은 허가가 취소됐다”라고 설명했다.아세틸엘카르니틴과 옥시라세탐은 콜린제제의 급여 축소 결정 당시 콜린제제의 대체약제로 지목됐다. 아세틸엘카르니틴은 ‘일차적 퇴행성 질환’ 또는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’에 사용하도록 허가 받았다. 옥시라세탐은 알츠하이머형 치매, 다발경색성 치매, 뇌기능부전으로 인한 기질성 뇌증후군 등으로 인한 인지장애의 개선 용도로 허가받았다.하지만 아세틸엘카르니틴와 옥시라세탐은 식품의약품안전처의 임상재평가 결과 유효성 입증에 실패했다. 아세틸엘카르니틴은 2022년 적응증이 모두 삭제됐고 옥시라세탐은 2023년 사용이 중지됐다. 콜린제제의 대체약제로 지목된 의약품이 사라졌기 때문에 콜린제제의 급여가 유지돼야 한다는 게 원고 측의 주장이다.제약사들은 시티콜린, 이부딜라스트, 이펜프로딜, 니세르골린 등 대체 약물로 제시된 다른 성분 의약품의 허가사항에 경도인지장애가 포함되지 않아 대체약제로 인정할 수 없다고 주장했다.하지만 재판부는 제약사들의 주장을 모두 받아들이지 않고 보건당국 측의 손을 들어줬다. 2심 재판부는 “대체 가능성의 평가 척도로 ‘선택 가능한 동일 목적의 급여 항목의 유무’만을 요구할 뿐 식약청의 허가사항의 상세내역까지 동일할 것을 요구하지 않는다”라면서 식약처의 허가사항이 달라도 대체약제로 인정할 수 있다고 판단했다.재판부는 “대체 가능성에 관한 판단에 대해서는 고도의 의료·보건상 전문성이 필요하므로 보건당국이 전문적인 판단을 했다면 판단의 기초가 된 사실인정에 중대한 오류가 없는 한 존중돼야 한다”라고 결론내렸다.대웅바이오 그룹은 1심 패소 이후 항소를 제기하면서 집행정지를 청구했고 2심 선고일부터 30일까지 급여축소 효력 집행정지 판결을 받았다. 2심 선고일부터 30일이 지난 오는 21일 시행이 예고됐다. 제약사들은 또 다시 집행정지를 청구하면서 대법원 판결까지 급여 축소 시행을 저지할 계획이었지만 수포로 돌아갔다. 이에 따라 정부의 콜린제제 급여 축소 고시 발령 5년 만에 시행되는 셈이다.대웅바이오 등이 집행정지 기각에 반발해 상고할 가능성도 있다. 이미 대법원 패소 판결이 나왔고 급여 축소가 시행된 이후 집행정지 청구는 승산이 희박하다는 이유로 또 다시 집행정지를 청구할 가능성은 낮다. 대웅바이오 등이 대법원에 상고한 본안소송도 완주 여부마저 불투명해졌다.콜린제제의 급여축소로 환자 본인부담률이 상승하면 제약사들의 실적도 악영향을 받을 공산이 크다. 약값 상승은 처방 기피로 이어질 수 있기 때문이다.의약품 조사기관 유비스트에 따르면 콜린제제의 지난해 처방 실적은 6123억원이다. 이중 종전대로 급여가 유지되는 치매 환자 진단 영역은 전체의 20%에도 못 미치는 것으로 전해졌다. 급여 축소가 시행될 경우 콜린제제의 처방 영역 중 80% 이상이 환자 약값 부담이 2.7배 증가할 전망이다. 콜린제제 정제는 1일 2~3회 복용한다. 건강보험심사평가원에 따르면 상반기 기준 콜린제제 정제의 가중평균가는 472원이다. 1일 2회 복용하는 환자의 본인부담률이 30%에서 80%로 상승하면 한달 평균 약값은 8496원에서 2만2656원으로 1만4160원 비싸진다는 계산이 나온다. 치매 진단을 받지 않은 환자가 콜린제제를 1일 3회 복용하는 경우 한달 약값은 1만2744원에서 3만3984원으로 2만1240원 상승한다.다만 콜린제제의 약값이 저렴한 수준이어서 급여 축소 이후에도 처방 중단으로 이어지지 않을 것이란 전망도 나온다.제약사 한 관계자는 “콜린제제는 연간 6000억원 이상의 시장을 올릴 정도로 처방 현장에서 의료진과 환자들의 만족도가 높다”라면서 “본인부담률이 2배 이상 상승하더라도 약값이 비싸지 않아 처방 중단 움직임이 크지 않을 것”이라고 진단했다.집행정지는 이겼지만 본안소송은 전패2025-09-19 06:20:41천승현
소송 패소에 무너진 콜린알포 급여축소 저지선[데일리팜=천승현 기자] 뇌기능개선제 ‘콜린알포세레이트’의 급여 축소가 시행된다. 제약사들의 고시 집행정지 청구가 기각되면서 고시 발령 5년 만에 환자들 한 달 평균 약값이 최대 2만원 가량 인상된다. 제약사들이 청구한 집행정지가 총 10차례 인용되면서 급여 축소 시행이 중단됐지만 행정소송이 패색이 짙어지면서 집행정지 저지선마저 무너졌다.18일 업계에 따르면 서울고등법원 제10-1행정부는 대웅바이오외 12인이 청구한 요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부개정고시 집행정지 청구를 기각했다. 제약사들은 지난달 콜린제제 급여축소 행정소송 항소심 패소 이후 급여 축소를 대법원 판결까지 중단해달라는 집행정지를 제기했지만 재판부는 받아들이지 않았다.보건복지부는 2020년 8월 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다.제약사들은 콜린제제 급여 축소의 부당함을 따지는 취소 소송을 제기하면서 집행정지를 청구했다. 기존에는 제약사들이 보건당국과 다툰 집행정지 사건 10건 모두 승소하면서 급여축소가 보류됐다. 소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다.종근당 등이 행정소송을 제기하면서 청구한 급여축소 집행정지는 2020년 9월 서울행정법원이 집행정지 인용결정을 내렸고 같은 해 12월 항고심에서도 재판부는 제약사들의 손을 들어줬다. 대법원은 집행정지 재항고심에서도 원심 결정을 그대로 유지했다.대웅바이오 등이 제기한 콜린제제 집행정지는 2020년 10월 인용됐고, 복지부가 항고한 지 9개월 만에 2심에서도 집행정지 인용 판결이 나왔다. 2022년 10월 복지부가 제기한 재항고심에서도 기각 판결이 나왔다.제약사들은 본안소송 1심 패소 이후 항소심을 제기하면서 또 다시 급여축소 집행정지도 청구했다. 종근당 그룹이 청구한 집행정지 사건은 2022년 11월 “2심 판결 선고일부터 30일이 되는 날까지 고시 시행을 중단하라”는 판결을 받았고 복지부의 재항고도 대법원에서 기각됐다. 대웅바이오 그룹이 청구한 집행정지는 2022년 12월 인용됐다. 복지부가 집행정지 재항고를 청구했지만 대법원에서도 제약사들의 손을 들어줬다. 제약사 입장에서는 콜린제제 급여축소 집행정지 사건에서 10번 모두 승소한 셈이다.하지만 제약사들은 콜린제제 급여 축소 행정소송 본안소송에서 패색이 짙어지면서 집행정지도 고배를 들었다. 종근당 그룹의 대법원 판결이 나왔다는 점이 집행정지 기각의 주요 배경으로 분석된다.종근당 그룹은 지난 2022년 7월 1심에서 패소 판결을 받았고 항소심에서도 지난해 5월 기각 판결이 내려졌다. 종근당 등은 지난해 6월 상고심을 제기했고 지난 3월 대법원에서도 기각 판결이 내려졌다.대웅바이오 그룹은 지난 2022년 11월 패소 판결을 받은 이후 항소심을 청구했고 지난달 2심에서도 패소했다.대웅바이오 그룹은 콜린제제의 대체약제가 없다는 점을 급여 축소 부당성의 근거로 강하게 주장하고 있다. 실제로 지난 6월 콜린제제 급여축소 취소소송 항소심 마지막 변론에서 종근당 그룹의 대법원 판결에서 대체약제 관련 쟁점이 언급되지 않았다는 점을 적극적으로 부각했다.원고 측은 “정부의 약제급여위원회 회의 자료에서 콜린제제의 대체약제로 제시된 니세르골린 등은 경도인지장애 허가를 받지 않았다”라면서 “아세틸엘카르니틴과 옥세라세탐은 허가가 취소됐다”라고 설명했다.아세틸엘카르니틴과 옥시라세탐은 콜린제제의 급여 축소 결정 당시 콜린제제의 대체약제로 지목됐다. 아세틸엘카르니틴은 ‘일차적 퇴행성 질환’ 또는 ‘뇌혈관 질환에 의한 이차적 퇴행성 질환’에 사용하도록 허가 받았다. 옥시라세탐은 알츠하이머형 치매, 다발경색성 치매, 뇌기능부전으로 인한 기질성 뇌증후군 등으로 인한 인지장애의 개선 용도로 허가받았다.하지만 아세틸엘카르니틴와 옥시라세탐은 식품의약품안전처의 임상재평가 결과 유효성 입증에 실패했다. 아세틸엘카르니틴은 2022년 적응증이 모두 삭제됐고 옥시라세탐은 2023년 사용이 중지됐다. 콜린제제의 대체약제로 지목된 의약품이 사라졌기 때문에 콜린제제의 급여가 유지돼야 한다는 게 원고 측의 주장이다.제약사들은 시티콜린, 이부딜라스트, 이펜프로딜, 니세르골린 등 대체 약물로 제시된 다른 성분 의약품의 허가사항에 경도인지장애가 포함되지 않아 대체약제로 인정할 수 없다고 주장했다.하지만 재판부는 제약사들의 주장을 모두 받아들이지 않고 보건당국 측의 손을 들어줬다. 2심 재판부는 “대체 가능성의 평가 척도로 ‘선택 가능한 동일 목적의 급여 항목의 유무’만을 요구할 뿐 식약청의 허가사항의 상세내역까지 동일할 것을 요구하지 않는다”라면서 식약처의 허가사항이 달라도 대체약제로 인정할 수 있다고 판단했다.재판부는 “대체 가능성에 관한 판단에 대해서는 고도의 의료·보건상 전문성이 필요하므로 보건당국이 전문적인 판단을 했다면 판단의 기초가 된 사실인정에 중대한 오류가 없는 한 존중돼야 한다”라고 결론내렸다.대웅바이오 그룹은 1심 패소 이후 항소를 제기하면서 집행정지를 청구했고 2심 선고일부터 30일까지 급여축소 효력 집행정지 판결을 받았다. 2심 선고일부터 30일이 지난 오는 21일 시행이 예고됐다. 제약사들은 또 다시 집행정지를 청구하면서 대법원 판결까지 급여 축소 시행을 저지할 계획이었지만 수포로 돌아갔다. 이에 따라 정부의 콜린제제 급여 축소 고시 발령 5년 만에 시행되는 셈이다.대웅바이오 등이 집행정지 기각에 반발해 상고할 가능성도 있다. 이미 대법원 패소 판결이 나왔고 급여 축소가 시행된 이후 집행정지 청구는 승산이 희박하다는 이유로 또 다시 집행정지를 청구할 가능성은 낮다. 대웅바이오 등이 대법원에 상고한 본안소송도 완주 여부마저 불투명해졌다.콜린제제의 급여축소로 환자 본인부담률이 상승하면 제약사들의 실적도 악영향을 받을 공산이 크다. 약값 상승은 처방 기피로 이어질 수 있기 때문이다.의약품 조사기관 유비스트에 따르면 콜린제제의 지난해 처방 실적은 6123억원이다. 이중 종전대로 급여가 유지되는 치매 환자 진단 영역은 전체의 20%에도 못 미치는 것으로 전해졌다. 급여 축소가 시행될 경우 콜린제제의 처방 영역 중 80% 이상이 환자 약값 부담이 2.7배 증가할 전망이다. 콜린제제 정제는 1일 2~3회 복용한다. 건강보험심사평가원에 따르면 상반기 기준 콜린제제 정제의 가중평균가는 472원이다. 1일 2회 복용하는 환자의 본인부담률이 30%에서 80%로 상승하면 한달 평균 약값은 8496원에서 2만2656원으로 1만4160원 비싸진다는 계산이 나온다. 치매 진단을 받지 않은 환자가 콜린제제를 1일 3회 복용하는 경우 한달 약값은 1만2744원에서 3만3984원으로 2만1240원 상승한다.다만 콜린제제의 약값이 저렴한 수준이어서 급여 축소 이후에도 처방 중단으로 이어지지 않을 것이란 전망도 나온다.제약사 한 관계자는 “콜린제제는 연간 6000억원 이상의 시장을 올릴 정도로 처방 현장에서 의료진과 환자들의 만족도가 높다”라면서 “본인부담률이 2배 이상 상승하더라도 약값이 비싸지 않아 처방 중단 움직임이 크지 않을 것”이라고 진단했다.집행정지는 이겼지만 본안소송은 전패2025-09-19 06:20:41천승현 -
 약 보다 나은 화장품?...약국화장품 수요 늘며 혼란 가중SNS에 소개된 PDRN 화장품 홍보 내용. [데일리팜=강혜경 기자] 피부 재생 효과를 가진 PDRN(폴리데옥시리보뉴클레오티드) 성분이 유명세를 타면서 관련 제품 출시가 줄을 잇고 있다. 그러나 일반약은 물론 PDRN 성분의 화장품도 연이어 출시되고 있는데, '약국 화장품'이라는 미명 아래 SNS 등에서 무분별하게 판매되고 있어 혼란이 가중되고 있다는 지적이다.지역의 한 약사는 SNS에서 PDRN 화장품이 '의약품의 업그레이드 버전'으로 홍보되고 있는 사실에 기가 찼다. 심지어 SNS에서 이를 소개한 사람은 많은 팔로워를 보유한 약사 인플루언서였다.이 약사는 "약국에서 일반약으로 판매되고 있는 제품의 업그레이드 버전으로 화장품을 소개·판매하고 있었다"며 "일반약과 전혀 다른 화장품을 대체제, 개선판인 것처럼 전달하는 것은 소비자에게 혼란을 야기하고 법을 위반하는 행위"라고 꼬집었다.이 약사는 "문제는 약국이라는 후광 효과를 이용해 '약국에서 판매되는', '약국 판매 1위' 같은 수식어를 무작위하게 사용하고 있는 것"이라고 지적했다.지난 달 식품의약품안전처가 적발한 화장품 부당광고 83건 중 의약품 오인 광고는 53건으로 64%에 달했다.전문가들 역시 약국 화장품에 대해 의약품과 화장품 등을 명확하게 구분하고 설명할 필요가 있다는 주장이다.화장품과 의약품은 같지 않다는 내용의 식약처 포스터. 의약품은 '질병의 치료 및 예방' 목적으로 식약처의 허가심사와 관리를 받는 반면 '인체 미화 및 청결, 피부 건강 유지'를 목적으로 하는 화장품은 화장품법을 적용받는다는 것. 즉 개발부터 법적 정의, 적용 법 등이 전혀 다르다는 설명이다.업계 관계자는 "PDRN 성분이 뜨면서 일반약과 화장품 등이 혼재돼 '약국 화장품'으로 통칭되는 경우가 빚어지고 있다"며 "하지만 치료와 미용이라는 부분은 본질적으로 다른 궤도를 가지고 있으며, 약국에서도 환자의 사용 목적과 니즈에 따라 각각 제품을 추천, 설명해 줘야 할 부분"이라고 말했다.가령 데일리로 사용하는 경우라면 화장품을, 보다 집중적인 효능·효과를 필요로 하는 경우라면 일반약을 추천할 필요가 있다는 것이다.이 관계자는 "의약품과 화장품이 나란히 진열된 환경에서 전문가인 약사가 두 제품을 비교·설명할 때 소비자는 그 정보를 비판 없이 수용할 가능성이 높다"며 "전문가에 대한 신뢰가 독이 되지 않도록 판매자와 소비자 모두의 현명한 접근이 필요하며, 특히 시장 혼란을 조장하며 소비자의 오인을 유도하는 행태는 불신이라는 부메랑을 자초할 수 있음을 직시해야 할 것"이라고 강조했다.한편 PDRN 성분으로 허가를 받은 일반약은 파마리서치의 리쥬비넥스가 유일하다.2025-09-11 13:14:27강혜경
약 보다 나은 화장품?...약국화장품 수요 늘며 혼란 가중SNS에 소개된 PDRN 화장품 홍보 내용. [데일리팜=강혜경 기자] 피부 재생 효과를 가진 PDRN(폴리데옥시리보뉴클레오티드) 성분이 유명세를 타면서 관련 제품 출시가 줄을 잇고 있다. 그러나 일반약은 물론 PDRN 성분의 화장품도 연이어 출시되고 있는데, '약국 화장품'이라는 미명 아래 SNS 등에서 무분별하게 판매되고 있어 혼란이 가중되고 있다는 지적이다.지역의 한 약사는 SNS에서 PDRN 화장품이 '의약품의 업그레이드 버전'으로 홍보되고 있는 사실에 기가 찼다. 심지어 SNS에서 이를 소개한 사람은 많은 팔로워를 보유한 약사 인플루언서였다.이 약사는 "약국에서 일반약으로 판매되고 있는 제품의 업그레이드 버전으로 화장품을 소개·판매하고 있었다"며 "일반약과 전혀 다른 화장품을 대체제, 개선판인 것처럼 전달하는 것은 소비자에게 혼란을 야기하고 법을 위반하는 행위"라고 꼬집었다.이 약사는 "문제는 약국이라는 후광 효과를 이용해 '약국에서 판매되는', '약국 판매 1위' 같은 수식어를 무작위하게 사용하고 있는 것"이라고 지적했다.지난 달 식품의약품안전처가 적발한 화장품 부당광고 83건 중 의약품 오인 광고는 53건으로 64%에 달했다.전문가들 역시 약국 화장품에 대해 의약품과 화장품 등을 명확하게 구분하고 설명할 필요가 있다는 주장이다.화장품과 의약품은 같지 않다는 내용의 식약처 포스터. 의약품은 '질병의 치료 및 예방' 목적으로 식약처의 허가심사와 관리를 받는 반면 '인체 미화 및 청결, 피부 건강 유지'를 목적으로 하는 화장품은 화장품법을 적용받는다는 것. 즉 개발부터 법적 정의, 적용 법 등이 전혀 다르다는 설명이다.업계 관계자는 "PDRN 성분이 뜨면서 일반약과 화장품 등이 혼재돼 '약국 화장품'으로 통칭되는 경우가 빚어지고 있다"며 "하지만 치료와 미용이라는 부분은 본질적으로 다른 궤도를 가지고 있으며, 약국에서도 환자의 사용 목적과 니즈에 따라 각각 제품을 추천, 설명해 줘야 할 부분"이라고 말했다.가령 데일리로 사용하는 경우라면 화장품을, 보다 집중적인 효능·효과를 필요로 하는 경우라면 일반약을 추천할 필요가 있다는 것이다.이 관계자는 "의약품과 화장품이 나란히 진열된 환경에서 전문가인 약사가 두 제품을 비교·설명할 때 소비자는 그 정보를 비판 없이 수용할 가능성이 높다"며 "전문가에 대한 신뢰가 독이 되지 않도록 판매자와 소비자 모두의 현명한 접근이 필요하며, 특히 시장 혼란을 조장하며 소비자의 오인을 유도하는 행태는 불신이라는 부메랑을 자초할 수 있음을 직시해야 할 것"이라고 강조했다.한편 PDRN 성분으로 허가를 받은 일반약은 파마리서치의 리쥬비넥스가 유일하다.2025-09-11 13:14:27강혜경
오늘의 TOP 10
- 1급여 생존의 대가...애엽 위염약 약가인하 손실 연 150억
- 2개설허가 7개월 만에 제1호 창고형약국 개설자 변경
- 3약국서 카드 15만원+현금 5만원 결제, 현금영수증은?
- 4부광, 유니온제약 인수…공장은 얻었지만 부채는 부담
- 51호 창고형약국 불법 전용 논란 일단락…위반건축물 해제
- 6P-CAB 3종 경쟁력 제고 박차…자큐보, 구강붕해정 탑재
- 7발사르탄 원료 사기 사건 2심으로...민사소송 확전될까
- 8GC녹십자 코로나19 mRNA 백신, 임상1상 승인
- 9의협, 대통령 의료정책 인식 '엄지척'...저수가 해결 기대감
- 10파마리서치, 약국 기반 ‘리쥬비-에스 앰플’ 출시
-
순위상품명횟수
-
1타이레놀정500mg(10정)30,426
-
2판콜에스내복액16,732
-
3텐텐츄정(10정)13,671
-
4까스활명수큐액12,867
-
5판피린큐액12,851













![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
