총 58건
-
 상장 바이오 추정 순이익 '껑충'...비교군 한미약품 '최다'[데일리팜=차지현 기자] 올해 기술특례로 신규 상장한 제약바이오·헬스케어 기업은 공모가 산정에 있어 과거보다 훨씬 공격적인 접근법을 택했다. 기업들은 공모가 산정의 핵심 근거가 되는 미래 실적 추정치를 전년보다 대폭 상향했다. 또 대형 제약 기업을 비교 대상으로 삼는 구조 역시 흐름도 이어졌다.17일 바이오 업계에 따르면 올해 기술특례로 상장한 바이오·헬스케어 기업 총 15개사가 공모가 산정 과정에서 제시한 상장 후 2~4년 후 순이익 추정치는 평균 335억원으로 집계됐다. 스팩(SPAC) 합병과 이전상장을 제외하고 기술특례로 코스닥에 신규 상장한 바이오 기업의 증권신고서를 분석한 결과다.기술특례는 수익성은 부족하지만 기술성과 성장성을 갖춘 기업의 상장 문턱을 낮춘 제도다. 뚜렷한 수익원 없이 연구개발(R&D)에 막대한 비용을 투입해야 하는 바이오 기업의 주된 기업공개(IPO) 창구로 꼽힌다.통상 기술특례로 상장하는 기업은 공모가를 책정할 때 상대가치평가법을 주로 사용한다. 대부분 유의미한 실적이 없기 때문에 회사가 향후 몇 년 뒤 실현할 수 있을 것으로 제시한 추정 실적에 동종 업종 상장 기업과 실적, 재무구조 등을 종합 비교해 가치를 매긴다.올해 기술특례로 코스닥에 신규 입성한 바이오 기업은 모두 상대가치법 중 주가수익비율(PER) 계산 방법을 활용했다. PER은 주가를 한 주당 얻을 수 있는 이익(주당순이익)으로 나눈 값으로 기업 영업활동의 수익성과 위험성, 시장 평가 등을 종합 반영한 지표다. 유사한 사업을 영위하는 기업의 순이익, 발행주식총수, 기준주가 등을 고려해 기업가치를 산출했다.올해 상장 기업의 순이익 추정치는 지난해보다 뚜렷하게 상향됐다. 지난해 기술특례로 신규 상장한 제약바이오·헬스케어 기업 18개사는 2~4년 후 평균 159억원의 순이익을 낼 수 있다고 추정했다. 1년 만에 평균 순이익 추정치가 두 배 이상 급증한 셈이다.올해 가장 큰 순이익을 공모가 산정 근거로 제시한 곳은 오름테라퓨틱이다. 2016년 설립한 오름테라퓨틱은 항체-약물 접합체(ADC)와 표적단백질 분해(TPD) 기술을 융합해 차세대 신약을 개발하는 바이오벤처로 지난 2월 코스닥 시장에 입성했다.오름테라퓨틱은 조사 기업 가운데 유일하게 공모가 산정 시 미래 추정치가 아닌 실제 실적을 반영한 사례다. 회사는 2023년 4분기부터 2024년 3분기까지 실적을 묶은 2024년 3분기말 LTM(Last Twelve Months) 기준 순이익을 이용해 기업가치를 산정했다. 오름테라퓨틱이 반영한 순이익 지표는 993억원이다.오름테라퓨틱은 글로벌 빅파마와 체결한 대규모 기술수출 계약의 기술료가 반영된 데 따라 추정치가 아닌 실제 벌어들인 금액을 근거로 공모가를 책정했다. 이 회사는 2023년 11월 글로벌 빅파마 브리스톨마이어스스큅에 급성골수성백혈병 신약 후보물질 'ORM-6151'에 대한 전체 권리를 양도한 데 이어 지난해 7월 미국 버텍스파마슈티컬스에 자체개발 TPD 플랫폼 기술수출 계약을 맺었다.이어 에임드바이오가 2029년 871억원의 순이익을 낼 것으로 전망, 두 번째로 큰 순이익 추정치를 내놨다. 에임드바이오는 AMB302, AMB303, QDS025 등 기존에 체결한 기술수출 계약에서 발생 가능한 수익을 산정 과정에 반영했다. 구체적으로 계약 조건에 기반해 수취하는 선급금과 특정 임상 단계 달성 시 수령하는 마일스톤 등을 고려해 순이익을 추정했다는 게 회사 측 설명이다.오는 24일 상장 예정인 리브스메드는 상장 2년 후인 2027년 710억원의 순이익을 낼 수 있을 것으로 내다봤다. 이 회사는 다관절·다자유도 성능을 갖춘 복강경 수술기구를 기반으로 수술용 로봇을 개발 중으로 수술용 로봇 매출이 본격화하는 시점과 해외 매출 비중이 확대되는 구간을 기준으로 순이익을 추정했다.알지노믹스의 경우 2027년 353억원, 2028년 29억원, 2029년 672억원의 순이익을 거둘 것으로 추정했다. 지투지바이오는 2029년 400억원의 순이익을 낼 것이라는 전망치를 내놨다. 이외 이뮨온시아는 2028년 517억원, 뉴로핏은 2027년과 2028년 각각 91억원과 289억원, 인투셀은 2027년 240억원의 순이익을 달성할 수 있다는 추정치를 공모가 산정 근거로 제시했다.작년과 비교하면 올해 기술특례 상장 기업이 제시한 추정 순이익 변화는 더욱 두드러진다. 지난해 기술특례로 신규 상장한 기업 가운데 가장 높은 순이익 추정치를 전망한 곳은 디앤디파마텍으로 이 회사는 상장 2년 뒤인 2026년 순이익으로 333억원을 제시했다. 오름테라퓨틱스(993억원), 에임드바이오(871억원), 리브스메드(710억원), 알지노믹스(672억원) 등 올해 상장 기업이 제시한 추정치 규모는 작년 최고치의 두 배 이상을 훌쩍 뛰어넘는 수준이다.실적 추정치가 전반적으로 상향된 가운데 공모가 산정 과정에서 대형 제약사를 유사기업으로 선정하는 흐름 역시 올해에도 이어졌다. 대부분 신규 상장 업체들이 지난해 적자 상태였지만 유사기업으로는 적게는 수백억원에서 많게는 수천억원의 이익을 내는 대형 업체를 선정했다.올해 조사 대상 기업 15개사가 선정한 피어그룹을 보면 한미약품이 가장 많았다. 오름테라퓨틱, 에임드바이오, 알지노믹스, 이뮨온시아, 지투지바이오, 인투셀 등이 공모가 책정 과정에서 한미약품을 비교군으로 선정했다. 한미약품은 올해 주가가 큰 폭으로 상승한 업체 중 하나다. 한미약품 주가는 올초 21만원대에서 출발해 연말 44만원 수준까지 상승했다. 지난달에는 52주 최고가인 49만4000원을 돌파하기도 했다.HK이노엔도 올해 기술특례 상장 업체의 유사기업으로 많이 포함했다. 오름테라퓨틱, 에임드바이오, 이뮨온시아, 인투셀, 오가노이드사이언스 등이 공모가 산출 시 HK이노엔을 비교 대상으로 선정했다. HK이노엔은 지난해 기술특례 상장사의 비교기업으로 가장 많이 활용된 곳으로 작년에는 디앤디파마텍, 이엔셀, 셀비온, 온코닉테라퓨틱스 등이 유사기업에 HK이노엔을 포함했다.대웅제약도 올해 기술특례 상장사의 유사기업으로 반복 포함됐다. 지투지바이오와 에임드바이오, 인투셀, 쿼드메디슨 등이 공모가 산정 과정에서 대웅제약을 비교 대상으로 선정했다. 또 SK바이오팜과 종근당, 삼진제약, 동국제약, 대원제약 등 국내 상장 제약사도 기술특례 상장사의 비교기업으로 다수 활용되며 기업들의 공모가 산정 잣대로 작용했다.해외 업체를 비교기업으로 제시한 곳도 적지 않다. 녹십자그룹 유전체 분석 계열사 지씨지놈은 국내 바디텍메드를 포함해 레비티, 홀로직, 디아소린 등 4곳을 유사기업으로 선정했다. 지씨지놈의 피어그룹은 코스닥에 상장한 바디텍메드를 제외하고 나머지 3개사 모두 해외 상장사로 연 매출이 조(兆) 단위에 이르는 글로벌 진단 기업이다.프로티나 역시 피어그룹에 다나허, 레비티를 포함시켰고 그래피는 얼라인테크놀로지, 슈트라우만 홀딩, 모던덴탈그룹 등 전부 해외 기업을 비교기업으로 뽑았다. 큐리오시스와 리브스메드도 수조원대 순이익을 내는 대형 글로벌 기업을 비교군에 대거 포함했다. 큐리오시스는 써모 피셔 사이언티픽, 레비티, 메틀러-톨레도 인터내셔널, 얼라인드제네틱스 등을 비교 대상으로 지목했고 리브스메드는 메드트로닉, 스트라이커, 인튜이티브서지컬 등을 유사 업체로 선정했다.상장에 나선 기업이 몸집이 큰 기업을 비교군에 다수 포함하면서 주당 평가가액 산출 과정에서 PER도 높아졌다. 피어그룹의 시장가치를 기반으로 리브스메드가 산출한 PER은 45.5배로 조사 대상 기업 15개사 중 적용 PER 배수가 가장 높았다. 이어 알지노믹스(29.6배), 그래피(29.0배), 지투지바이오(28.1배), 쿼드메디슨(27.5배) 등이 뒤를 이었다.2025-12-17 06:00:59차지현 기자
상장 바이오 추정 순이익 '껑충'...비교군 한미약품 '최다'[데일리팜=차지현 기자] 올해 기술특례로 신규 상장한 제약바이오·헬스케어 기업은 공모가 산정에 있어 과거보다 훨씬 공격적인 접근법을 택했다. 기업들은 공모가 산정의 핵심 근거가 되는 미래 실적 추정치를 전년보다 대폭 상향했다. 또 대형 제약 기업을 비교 대상으로 삼는 구조 역시 흐름도 이어졌다.17일 바이오 업계에 따르면 올해 기술특례로 상장한 바이오·헬스케어 기업 총 15개사가 공모가 산정 과정에서 제시한 상장 후 2~4년 후 순이익 추정치는 평균 335억원으로 집계됐다. 스팩(SPAC) 합병과 이전상장을 제외하고 기술특례로 코스닥에 신규 상장한 바이오 기업의 증권신고서를 분석한 결과다.기술특례는 수익성은 부족하지만 기술성과 성장성을 갖춘 기업의 상장 문턱을 낮춘 제도다. 뚜렷한 수익원 없이 연구개발(R&D)에 막대한 비용을 투입해야 하는 바이오 기업의 주된 기업공개(IPO) 창구로 꼽힌다.통상 기술특례로 상장하는 기업은 공모가를 책정할 때 상대가치평가법을 주로 사용한다. 대부분 유의미한 실적이 없기 때문에 회사가 향후 몇 년 뒤 실현할 수 있을 것으로 제시한 추정 실적에 동종 업종 상장 기업과 실적, 재무구조 등을 종합 비교해 가치를 매긴다.올해 기술특례로 코스닥에 신규 입성한 바이오 기업은 모두 상대가치법 중 주가수익비율(PER) 계산 방법을 활용했다. PER은 주가를 한 주당 얻을 수 있는 이익(주당순이익)으로 나눈 값으로 기업 영업활동의 수익성과 위험성, 시장 평가 등을 종합 반영한 지표다. 유사한 사업을 영위하는 기업의 순이익, 발행주식총수, 기준주가 등을 고려해 기업가치를 산출했다.올해 상장 기업의 순이익 추정치는 지난해보다 뚜렷하게 상향됐다. 지난해 기술특례로 신규 상장한 제약바이오·헬스케어 기업 18개사는 2~4년 후 평균 159억원의 순이익을 낼 수 있다고 추정했다. 1년 만에 평균 순이익 추정치가 두 배 이상 급증한 셈이다.올해 가장 큰 순이익을 공모가 산정 근거로 제시한 곳은 오름테라퓨틱이다. 2016년 설립한 오름테라퓨틱은 항체-약물 접합체(ADC)와 표적단백질 분해(TPD) 기술을 융합해 차세대 신약을 개발하는 바이오벤처로 지난 2월 코스닥 시장에 입성했다.오름테라퓨틱은 조사 기업 가운데 유일하게 공모가 산정 시 미래 추정치가 아닌 실제 실적을 반영한 사례다. 회사는 2023년 4분기부터 2024년 3분기까지 실적을 묶은 2024년 3분기말 LTM(Last Twelve Months) 기준 순이익을 이용해 기업가치를 산정했다. 오름테라퓨틱이 반영한 순이익 지표는 993억원이다.오름테라퓨틱은 글로벌 빅파마와 체결한 대규모 기술수출 계약의 기술료가 반영된 데 따라 추정치가 아닌 실제 벌어들인 금액을 근거로 공모가를 책정했다. 이 회사는 2023년 11월 글로벌 빅파마 브리스톨마이어스스큅에 급성골수성백혈병 신약 후보물질 'ORM-6151'에 대한 전체 권리를 양도한 데 이어 지난해 7월 미국 버텍스파마슈티컬스에 자체개발 TPD 플랫폼 기술수출 계약을 맺었다.이어 에임드바이오가 2029년 871억원의 순이익을 낼 것으로 전망, 두 번째로 큰 순이익 추정치를 내놨다. 에임드바이오는 AMB302, AMB303, QDS025 등 기존에 체결한 기술수출 계약에서 발생 가능한 수익을 산정 과정에 반영했다. 구체적으로 계약 조건에 기반해 수취하는 선급금과 특정 임상 단계 달성 시 수령하는 마일스톤 등을 고려해 순이익을 추정했다는 게 회사 측 설명이다.오는 24일 상장 예정인 리브스메드는 상장 2년 후인 2027년 710억원의 순이익을 낼 수 있을 것으로 내다봤다. 이 회사는 다관절·다자유도 성능을 갖춘 복강경 수술기구를 기반으로 수술용 로봇을 개발 중으로 수술용 로봇 매출이 본격화하는 시점과 해외 매출 비중이 확대되는 구간을 기준으로 순이익을 추정했다.알지노믹스의 경우 2027년 353억원, 2028년 29억원, 2029년 672억원의 순이익을 거둘 것으로 추정했다. 지투지바이오는 2029년 400억원의 순이익을 낼 것이라는 전망치를 내놨다. 이외 이뮨온시아는 2028년 517억원, 뉴로핏은 2027년과 2028년 각각 91억원과 289억원, 인투셀은 2027년 240억원의 순이익을 달성할 수 있다는 추정치를 공모가 산정 근거로 제시했다.작년과 비교하면 올해 기술특례 상장 기업이 제시한 추정 순이익 변화는 더욱 두드러진다. 지난해 기술특례로 신규 상장한 기업 가운데 가장 높은 순이익 추정치를 전망한 곳은 디앤디파마텍으로 이 회사는 상장 2년 뒤인 2026년 순이익으로 333억원을 제시했다. 오름테라퓨틱스(993억원), 에임드바이오(871억원), 리브스메드(710억원), 알지노믹스(672억원) 등 올해 상장 기업이 제시한 추정치 규모는 작년 최고치의 두 배 이상을 훌쩍 뛰어넘는 수준이다.실적 추정치가 전반적으로 상향된 가운데 공모가 산정 과정에서 대형 제약사를 유사기업으로 선정하는 흐름 역시 올해에도 이어졌다. 대부분 신규 상장 업체들이 지난해 적자 상태였지만 유사기업으로는 적게는 수백억원에서 많게는 수천억원의 이익을 내는 대형 업체를 선정했다.올해 조사 대상 기업 15개사가 선정한 피어그룹을 보면 한미약품이 가장 많았다. 오름테라퓨틱, 에임드바이오, 알지노믹스, 이뮨온시아, 지투지바이오, 인투셀 등이 공모가 책정 과정에서 한미약품을 비교군으로 선정했다. 한미약품은 올해 주가가 큰 폭으로 상승한 업체 중 하나다. 한미약품 주가는 올초 21만원대에서 출발해 연말 44만원 수준까지 상승했다. 지난달에는 52주 최고가인 49만4000원을 돌파하기도 했다.HK이노엔도 올해 기술특례 상장 업체의 유사기업으로 많이 포함했다. 오름테라퓨틱, 에임드바이오, 이뮨온시아, 인투셀, 오가노이드사이언스 등이 공모가 산출 시 HK이노엔을 비교 대상으로 선정했다. HK이노엔은 지난해 기술특례 상장사의 비교기업으로 가장 많이 활용된 곳으로 작년에는 디앤디파마텍, 이엔셀, 셀비온, 온코닉테라퓨틱스 등이 유사기업에 HK이노엔을 포함했다.대웅제약도 올해 기술특례 상장사의 유사기업으로 반복 포함됐다. 지투지바이오와 에임드바이오, 인투셀, 쿼드메디슨 등이 공모가 산정 과정에서 대웅제약을 비교 대상으로 선정했다. 또 SK바이오팜과 종근당, 삼진제약, 동국제약, 대원제약 등 국내 상장 제약사도 기술특례 상장사의 비교기업으로 다수 활용되며 기업들의 공모가 산정 잣대로 작용했다.해외 업체를 비교기업으로 제시한 곳도 적지 않다. 녹십자그룹 유전체 분석 계열사 지씨지놈은 국내 바디텍메드를 포함해 레비티, 홀로직, 디아소린 등 4곳을 유사기업으로 선정했다. 지씨지놈의 피어그룹은 코스닥에 상장한 바디텍메드를 제외하고 나머지 3개사 모두 해외 상장사로 연 매출이 조(兆) 단위에 이르는 글로벌 진단 기업이다.프로티나 역시 피어그룹에 다나허, 레비티를 포함시켰고 그래피는 얼라인테크놀로지, 슈트라우만 홀딩, 모던덴탈그룹 등 전부 해외 기업을 비교기업으로 뽑았다. 큐리오시스와 리브스메드도 수조원대 순이익을 내는 대형 글로벌 기업을 비교군에 대거 포함했다. 큐리오시스는 써모 피셔 사이언티픽, 레비티, 메틀러-톨레도 인터내셔널, 얼라인드제네틱스 등을 비교 대상으로 지목했고 리브스메드는 메드트로닉, 스트라이커, 인튜이티브서지컬 등을 유사 업체로 선정했다.상장에 나선 기업이 몸집이 큰 기업을 비교군에 다수 포함하면서 주당 평가가액 산출 과정에서 PER도 높아졌다. 피어그룹의 시장가치를 기반으로 리브스메드가 산출한 PER은 45.5배로 조사 대상 기업 15개사 중 적용 PER 배수가 가장 높았다. 이어 알지노믹스(29.6배), 그래피(29.0배), 지투지바이오(28.1배), 쿼드메디슨(27.5배) 등이 뒤를 이었다.2025-12-17 06:00:59차지현 기자 -
 41호 국내 개발 신약 탄생…아로나민골드 라인업 확대[데일리팜=이탁순 기자] 국내 개발 신약이 41개까지 늘었습니다. 동아에스티가 뇌전증치료제 '엑스코프리정'를 허가받은 것입니다.국내 제약사가 개발한 복합 개량신약도 꾸준합니다. 이번엔 암로디핀과 발사르탄, 클로르탈리돈이 최초로 결합한 3제 고혈압치료제가 나왔습니다.일반약 가운데는 비타민 D 유사체인 '알파칼시톨' 성분이 인기를 끌고 있습니다. 최근 급여약으로 처방량이 급증하고 있기 때문입니다.일동제약은 스테디셀러 '아로나민골드'의 라인업 확대에 나섰습니다. 새로운 성분도 보강하고, 함량도 추가했습니다.지난 11월에는 전문의약품 69개, 일반의약품 53개가 허가를 받았습니다. ◆일반의약품 = 일반의약품은 자료제출의약품이 1개, 표준제조기준이 34개, 제네릭 18개가 허가를 받았습니다. 올해 초 표준제조기준 개정 확대로 새로운 조합의 복합제제 표제기 품목이 늘고 있는 모습입니다. 와이에스생명과학 와이에스알파정1마이크로그램(11월 7일 허가, 자료제출의약품)와이에스알파정1마이크로그램은 11월 허가(신고)된 일반의약품 가운데 유일한 자료제출의약품입니다. 이는 해당 동일 성분, 동일 함량 제제 가운데 유일한 정제이기 때문입니다.알파칼시톨은 비타민 D 유사체로 간에서 대사되어 활성형으로 바로 작용된다는 장점 때문에 신기능 환자에 유용하게 사용됩니다. 칼슘과 인의 흡수를 돕고 뼈 형성을 촉진하는데, 만성 신부전 등 환자에 많이 사용됩니다.최근 사용량이 급증하면서 제약사들의 허가 추진도 많아지고 있습니다.글로벌 의약품 시장조사기관 아이큐비아에 따르면, 국내 알파칼시돌 매출은 2021년 87억원, 2022년 108억원, 2023년 120억원, 2024년 190억원으로 지속적으로 증가 추세를 보이고 있습니다.와이에스알파정1마이크로그램은 고함량 정제 제형으로 개발돼 복용 횟수를 줄이고 순응도를 높였으며, 연질캡슐 대비 삼킴 부담이 적어 고령층 환자의 복용 편의성도 향상될 것으로 기대되고 있습니다.YS생명과학 관계자는 “정제형 알파칼시돌 제제화는 제형 안정성과 정밀 합성 기술이 동시에 요구되는 고난도 프로젝트로, 해외에서도 사례가 많지 않다”며 “이번 성과는 YS생명과학이 원료 중심 기업에서 완제의약품 전문기업으로 도약하는 전환점이 될 것”이라고 말했습니다. YS생명과학은 추후 0.5마이크로그램 함량 제품도 추가 출시할 계획입니다.동국제약 프리이지정(11월 6일 허가, 제네릭)동국제약 프리이지정은 소염진통 성분인 에텐자미드와 근윤이완 작용을 하는 클로르족사존이 함유된 근육이완 일반의약품입니다.최근 해당 성분 제품이 늘고 있습니다. 작년부터 최근까지 26개 품목이 허가를 받았습니다. 그 전까지는 2개 품목 뿐이었습니다.에텐자미드+클로르족사존 복합제가 늘고 있는 건 아세트아미노펜+클로르족사존 제품이 유효성 자료 제출 문제로 사라지면서 에텐자미드+클로르족사존 복합 이완제 시장으로 제약사들이 넘어왔기 때문입니다.아세트아미노펜+클로르족사존 제품은 유효성 자료 부족으로 식약처로부터 갱신이 불허되자 제약사 대부분이 제품 허가를 취하하거나 갱신하지 않았습니다.이에 40개 되던 제품이 한순간에 사라졌습니다. 하지만 근육이완 정제에 수요는 꾸준하다 보니 제약사들이 에텐자미드+클로르족사존 복합제를 만들기 시작한 것이죠.에텐자미드는 아세트아미노펜과 달리 진통뿐만 아니라 소염 효과도 존재하고, 간에 부담도 적다는 점이 특징입니다.이 성분의 오리지널의약품은 동아제약의 '스카풀라정'입니다. 일동제약 아로나민골드 원·액티브정(11월 5, 14일 허가, 표준제조기준)일동제약이 아로나민골드 제품군 허가를 늘려나가고 있습니다. 지난달에만 아로나민골드원과 아로나민골드액티브 2개의 제품을 허가받았습니다.아로나민골드원은 비타민B군을 보강하고, 비타민B12 종류인 메코발라민을 함유했다는 점이 기존 아로나민골드 제품군과 차별점입니다.메코발라민은 체내에서 별도 전환 과정 없이 바로 작용해 효과가 빠르다는 장점이 있습니다. 반면 히드록소코발라민이나 시아노코발라민은 안정성이 높지만, 추가적인 활성 단계를 거쳐야 한다는 단점이 있지요.아로나민골드액티브 역시 메코발라민이 함유됐습니다. 또한 면역력 강화, 세포 발달에 중요한 역할을 하는 필수 미네랄인 아연도 포함돼 있다는 점이 기존 제품과 달라진 점입니다.여기에 간세포 보호 기능이 있는 우르소데옥시콜산, 강력한 항산화 작용을 하는 셀레늄함유건조효모, 비타민B6 일종인 피리독신염산염이 아로나민 시리즈 가운데 처음으로 함유됐습니다.현재 아로나민골드 시리즈는 아로나민골드와 아로나민골드프리미엄이 판매되고 있습니다. 작년 아로나민류 매출액은 622억원에 달합니다.일동은 이번에 허가받은 제품을 통해 아로나민골드 라인업을 강화하면서 매출 극대화에 나설 것으로 보입니다.◆전문의약품 = 11월 전문의약품은 신약 4개, 자료제출의약품 21개, 제네릭 41개, 희귀의약품 2개가 허가를 받았습니다. 신약 중 국내 개발 신약이 포함돼 있습니다. 동아에스티 엑스코프리정(11월 3일 허가, 신약)SK바이오팜이 개발한 뇌전증치료제 '엑스코프리'가 동아에스티를 통해 국내 허가를 획득했습니다. 41번째 국내 개발신약입니다.엑스코프리는 성인 뇌전증 환자에서 2차성 전신발작을 동반하거나 동반하지 않는 부분발작 치료의 부가요법으로 허가됐습니다.기존 항뇌전증약 투여로 적절하게 조절되지 않는 뇌전증 환자에게 새로운 치료 기회를 제공할 전망입니다.이 약은 국내보다 미국에서 먼저 승인됐습니다. SK바이오팜이 초기 개발부터 진두지휘해 지난 2019년 11월 FDA 승인을 받았습니다. 2020년 5월부터는 SK바이오팜의 미국 현지 법인 SK라이프사이언스를 통해 직접 판매도 진행하고 있습니다.올해 상반기까지 엑스코프리의 미국 누적 매출만 1조2563억원에 달합니다.동아에스티는 지난해 1월 SK바이오팜과 라이선싱 계약을 맺고, 30개국의 허가·생산·판매 권리를 확보했습니다.식약처는 이 약을 '글로벌 혁신제품 신속심사 지원체계(GIFT)'로 지정한 후, 심사 역량을 최대한 집중한 신속 심사를 진행했고, 동아에스티는 기술이전 이후 1년 9개월만에 상업화 허가를 획득하는데 성공했습니다.한국파마 아크루퍼캡슐30mg(11월 5일 허가, 신약)한국파마(대표 박은희)가 수입·판매하는 철 결핍 치료제 '아크루퍼캡슐30mg(제이철말톨)'이 신약으로 국내 품목허가를 획득했습니다.이 약은 빈혈의 유무와 관계없이 철 결핍에 사용하는 유일한 치료제입니다.아크루퍼의 효능·효과는 성인에서 철 결핍증의 치료이며, 용법·용량은 1회 1캡슐(30mg), 1일 2회입니다.한국파마가 영국 쉴드 테라퓨틱스와 기술이전 계약을 체결해 국내 도입한 약으로, 작년 2월에는 국내 가교임상을 통해 미국·유럽 등 서양인과 동일한 효과와 안전성을 입증했습니다.이 약은 3가 철 이온과 말톨의 화합물로 위장관 내에서 이온화되지 않아 기존의 국내 철결핍성 빈혈 치료제 복용 시 나타날 수 있는 속쓰림, 변비 등 위장 장애를 개선한 제품으로, 세계에서 유일하게 빈혈의 유무와 관계없이 철 결핍에 사용하는 제품으로 FDA 및 유럽 EMA에서 승인받은 약으로 알려져 있습니다.임상시험에서도 철의 저용량 투여로 투여 4주 만에 현저한 빈혈의 개선 효과를 보였고, 64주간의 장기 투여 시에도 효과와 안전성을 입증했습니다. 한국파마는 급여 등재 절차를 거쳐 이 약을 국내 판매할 것으로 보입니다.경동제약 발디핀플러스정(11월 7일 허가, 자료제출의약품)경동제약 발디핀플러스정은 안지오텐신II 수용체 차단제(ARB) 계열의 발사르탄, 칼슘 채널 차단제(CCB) 암로디핀, 이뇨제 클로르탈리돈의 세 성분이 최초 결합한 고혈압 3제 복합제입니다.암로디핀과 발사르탄 복합요법으로 혈압이 충분히 조절되지 않는 본태성 고혈압 환자를 대상으로 하며, 1일 1회 1정 식사와 관계없이 섭취 가능하도록 복약 편의성을 높인 게 특징입니다.경동제약은 약물상호작용 및 동등성 평가를 포함한 임상 1상 2건과, 한국인을 포함한 임상 3상 치료적 확증 시험을 통해 발사르탄·암로디핀 복합제 대비 병용요법 시 유효성과 우월성을 입증했습니다.회사 측은 발디핀플러스정이 서로 다른 기전의 세 성분이 상호 보완적으로 작용해, 보다 강력한 혈압 강하 효과를 기대할 수 있다면서 고정용량 복합제의 선택 폭을 확대하고 처방의 단순화를 통해 환자의 복약 순응도 향상에 기여할 것이라고 전했습니다.발디핀플러스정 허가 이후 공동 개발을 추진한 동광제약과 HK이노엔도 허가를 받았습니다. 동광제약은 바로셋정, HK이노엔은 엑스원플러스정입니다. 처방 편의성을 위해 4개 용량으로 세분화해 제품이 출시됩니다.2025-12-08 06:00:56이탁순 기자
41호 국내 개발 신약 탄생…아로나민골드 라인업 확대[데일리팜=이탁순 기자] 국내 개발 신약이 41개까지 늘었습니다. 동아에스티가 뇌전증치료제 '엑스코프리정'를 허가받은 것입니다.국내 제약사가 개발한 복합 개량신약도 꾸준합니다. 이번엔 암로디핀과 발사르탄, 클로르탈리돈이 최초로 결합한 3제 고혈압치료제가 나왔습니다.일반약 가운데는 비타민 D 유사체인 '알파칼시톨' 성분이 인기를 끌고 있습니다. 최근 급여약으로 처방량이 급증하고 있기 때문입니다.일동제약은 스테디셀러 '아로나민골드'의 라인업 확대에 나섰습니다. 새로운 성분도 보강하고, 함량도 추가했습니다.지난 11월에는 전문의약품 69개, 일반의약품 53개가 허가를 받았습니다. ◆일반의약품 = 일반의약품은 자료제출의약품이 1개, 표준제조기준이 34개, 제네릭 18개가 허가를 받았습니다. 올해 초 표준제조기준 개정 확대로 새로운 조합의 복합제제 표제기 품목이 늘고 있는 모습입니다. 와이에스생명과학 와이에스알파정1마이크로그램(11월 7일 허가, 자료제출의약품)와이에스알파정1마이크로그램은 11월 허가(신고)된 일반의약품 가운데 유일한 자료제출의약품입니다. 이는 해당 동일 성분, 동일 함량 제제 가운데 유일한 정제이기 때문입니다.알파칼시톨은 비타민 D 유사체로 간에서 대사되어 활성형으로 바로 작용된다는 장점 때문에 신기능 환자에 유용하게 사용됩니다. 칼슘과 인의 흡수를 돕고 뼈 형성을 촉진하는데, 만성 신부전 등 환자에 많이 사용됩니다.최근 사용량이 급증하면서 제약사들의 허가 추진도 많아지고 있습니다.글로벌 의약품 시장조사기관 아이큐비아에 따르면, 국내 알파칼시돌 매출은 2021년 87억원, 2022년 108억원, 2023년 120억원, 2024년 190억원으로 지속적으로 증가 추세를 보이고 있습니다.와이에스알파정1마이크로그램은 고함량 정제 제형으로 개발돼 복용 횟수를 줄이고 순응도를 높였으며, 연질캡슐 대비 삼킴 부담이 적어 고령층 환자의 복용 편의성도 향상될 것으로 기대되고 있습니다.YS생명과학 관계자는 “정제형 알파칼시돌 제제화는 제형 안정성과 정밀 합성 기술이 동시에 요구되는 고난도 프로젝트로, 해외에서도 사례가 많지 않다”며 “이번 성과는 YS생명과학이 원료 중심 기업에서 완제의약품 전문기업으로 도약하는 전환점이 될 것”이라고 말했습니다. YS생명과학은 추후 0.5마이크로그램 함량 제품도 추가 출시할 계획입니다.동국제약 프리이지정(11월 6일 허가, 제네릭)동국제약 프리이지정은 소염진통 성분인 에텐자미드와 근윤이완 작용을 하는 클로르족사존이 함유된 근육이완 일반의약품입니다.최근 해당 성분 제품이 늘고 있습니다. 작년부터 최근까지 26개 품목이 허가를 받았습니다. 그 전까지는 2개 품목 뿐이었습니다.에텐자미드+클로르족사존 복합제가 늘고 있는 건 아세트아미노펜+클로르족사존 제품이 유효성 자료 제출 문제로 사라지면서 에텐자미드+클로르족사존 복합 이완제 시장으로 제약사들이 넘어왔기 때문입니다.아세트아미노펜+클로르족사존 제품은 유효성 자료 부족으로 식약처로부터 갱신이 불허되자 제약사 대부분이 제품 허가를 취하하거나 갱신하지 않았습니다.이에 40개 되던 제품이 한순간에 사라졌습니다. 하지만 근육이완 정제에 수요는 꾸준하다 보니 제약사들이 에텐자미드+클로르족사존 복합제를 만들기 시작한 것이죠.에텐자미드는 아세트아미노펜과 달리 진통뿐만 아니라 소염 효과도 존재하고, 간에 부담도 적다는 점이 특징입니다.이 성분의 오리지널의약품은 동아제약의 '스카풀라정'입니다. 일동제약 아로나민골드 원·액티브정(11월 5, 14일 허가, 표준제조기준)일동제약이 아로나민골드 제품군 허가를 늘려나가고 있습니다. 지난달에만 아로나민골드원과 아로나민골드액티브 2개의 제품을 허가받았습니다.아로나민골드원은 비타민B군을 보강하고, 비타민B12 종류인 메코발라민을 함유했다는 점이 기존 아로나민골드 제품군과 차별점입니다.메코발라민은 체내에서 별도 전환 과정 없이 바로 작용해 효과가 빠르다는 장점이 있습니다. 반면 히드록소코발라민이나 시아노코발라민은 안정성이 높지만, 추가적인 활성 단계를 거쳐야 한다는 단점이 있지요.아로나민골드액티브 역시 메코발라민이 함유됐습니다. 또한 면역력 강화, 세포 발달에 중요한 역할을 하는 필수 미네랄인 아연도 포함돼 있다는 점이 기존 제품과 달라진 점입니다.여기에 간세포 보호 기능이 있는 우르소데옥시콜산, 강력한 항산화 작용을 하는 셀레늄함유건조효모, 비타민B6 일종인 피리독신염산염이 아로나민 시리즈 가운데 처음으로 함유됐습니다.현재 아로나민골드 시리즈는 아로나민골드와 아로나민골드프리미엄이 판매되고 있습니다. 작년 아로나민류 매출액은 622억원에 달합니다.일동은 이번에 허가받은 제품을 통해 아로나민골드 라인업을 강화하면서 매출 극대화에 나설 것으로 보입니다.◆전문의약품 = 11월 전문의약품은 신약 4개, 자료제출의약품 21개, 제네릭 41개, 희귀의약품 2개가 허가를 받았습니다. 신약 중 국내 개발 신약이 포함돼 있습니다. 동아에스티 엑스코프리정(11월 3일 허가, 신약)SK바이오팜이 개발한 뇌전증치료제 '엑스코프리'가 동아에스티를 통해 국내 허가를 획득했습니다. 41번째 국내 개발신약입니다.엑스코프리는 성인 뇌전증 환자에서 2차성 전신발작을 동반하거나 동반하지 않는 부분발작 치료의 부가요법으로 허가됐습니다.기존 항뇌전증약 투여로 적절하게 조절되지 않는 뇌전증 환자에게 새로운 치료 기회를 제공할 전망입니다.이 약은 국내보다 미국에서 먼저 승인됐습니다. SK바이오팜이 초기 개발부터 진두지휘해 지난 2019년 11월 FDA 승인을 받았습니다. 2020년 5월부터는 SK바이오팜의 미국 현지 법인 SK라이프사이언스를 통해 직접 판매도 진행하고 있습니다.올해 상반기까지 엑스코프리의 미국 누적 매출만 1조2563억원에 달합니다.동아에스티는 지난해 1월 SK바이오팜과 라이선싱 계약을 맺고, 30개국의 허가·생산·판매 권리를 확보했습니다.식약처는 이 약을 '글로벌 혁신제품 신속심사 지원체계(GIFT)'로 지정한 후, 심사 역량을 최대한 집중한 신속 심사를 진행했고, 동아에스티는 기술이전 이후 1년 9개월만에 상업화 허가를 획득하는데 성공했습니다.한국파마 아크루퍼캡슐30mg(11월 5일 허가, 신약)한국파마(대표 박은희)가 수입·판매하는 철 결핍 치료제 '아크루퍼캡슐30mg(제이철말톨)'이 신약으로 국내 품목허가를 획득했습니다.이 약은 빈혈의 유무와 관계없이 철 결핍에 사용하는 유일한 치료제입니다.아크루퍼의 효능·효과는 성인에서 철 결핍증의 치료이며, 용법·용량은 1회 1캡슐(30mg), 1일 2회입니다.한국파마가 영국 쉴드 테라퓨틱스와 기술이전 계약을 체결해 국내 도입한 약으로, 작년 2월에는 국내 가교임상을 통해 미국·유럽 등 서양인과 동일한 효과와 안전성을 입증했습니다.이 약은 3가 철 이온과 말톨의 화합물로 위장관 내에서 이온화되지 않아 기존의 국내 철결핍성 빈혈 치료제 복용 시 나타날 수 있는 속쓰림, 변비 등 위장 장애를 개선한 제품으로, 세계에서 유일하게 빈혈의 유무와 관계없이 철 결핍에 사용하는 제품으로 FDA 및 유럽 EMA에서 승인받은 약으로 알려져 있습니다.임상시험에서도 철의 저용량 투여로 투여 4주 만에 현저한 빈혈의 개선 효과를 보였고, 64주간의 장기 투여 시에도 효과와 안전성을 입증했습니다. 한국파마는 급여 등재 절차를 거쳐 이 약을 국내 판매할 것으로 보입니다.경동제약 발디핀플러스정(11월 7일 허가, 자료제출의약품)경동제약 발디핀플러스정은 안지오텐신II 수용체 차단제(ARB) 계열의 발사르탄, 칼슘 채널 차단제(CCB) 암로디핀, 이뇨제 클로르탈리돈의 세 성분이 최초 결합한 고혈압 3제 복합제입니다.암로디핀과 발사르탄 복합요법으로 혈압이 충분히 조절되지 않는 본태성 고혈압 환자를 대상으로 하며, 1일 1회 1정 식사와 관계없이 섭취 가능하도록 복약 편의성을 높인 게 특징입니다.경동제약은 약물상호작용 및 동등성 평가를 포함한 임상 1상 2건과, 한국인을 포함한 임상 3상 치료적 확증 시험을 통해 발사르탄·암로디핀 복합제 대비 병용요법 시 유효성과 우월성을 입증했습니다.회사 측은 발디핀플러스정이 서로 다른 기전의 세 성분이 상호 보완적으로 작용해, 보다 강력한 혈압 강하 효과를 기대할 수 있다면서 고정용량 복합제의 선택 폭을 확대하고 처방의 단순화를 통해 환자의 복약 순응도 향상에 기여할 것이라고 전했습니다.발디핀플러스정 허가 이후 공동 개발을 추진한 동광제약과 HK이노엔도 허가를 받았습니다. 동광제약은 바로셋정, HK이노엔은 엑스원플러스정입니다. 처방 편의성을 위해 4개 용량으로 세분화해 제품이 출시됩니다.2025-12-08 06:00:56이탁순 기자 -
 A등급 4년 새 30→70%…대형제약, ESG 경영 안착국내 주요 제약바이오 기업의 ESG(환경·사회·지배구조) 경영 수준이 지난 4년간 비약적으로 성장했다. 상위 20개사 ESG 등급 변화를 분석한 결과 2021년 전체의 30%에 불과했던 A등급 기업 비중이 2025년 70%로 2배 이상 급증한 것으로 나타났다.전반적인 ESG 등급 개선 흐름 속 기업 간 희비를 가른 건 지배구조(G) 부문이다. 이사회 독립성과 내부통제를 강화한 기업은 등급이 상향 조정된 반면, 오너 리스크나 주주가치 훼손 논란이 발생한 기업은 등급이 정체되거나 오히려 낮아지는 양상을 보였다.상위 제약사 10곳 중 7곳 A등급…ESG 등급 가른 결정타는 '지배구조'1일 업계에 따르면 제약바이오 상위 20개사 중 14개사가 올해 한국ESG기준원(KCGS) ESG 종합 평가에서 A등급을 획득했다. 분석 대상 기업의 70%가 A등급을 받은 셈이다. 이어 B+등급 3곳(15%), B등급 2곳(10%), C등급 1곳(5%)으로 뒤를 이었다. 조사 기업 가운데 최상위 A+등급과 최하위 D등급을 받은 기업은 없었다.KCGS는 매년 국내 주요 상장 기업을 대상으로 환경(E)·사회(S)·지배구조(G) 부문의 지속가능경영 수준을 평가해 등급을 부여한다. 등급 체계는 S(탁월), A+(매우 우수), A(우수), B+(양호), B(보통), C(취약), D(미흡) 등 총 7개 등급으로 나뉜다. 통상 B+등급 이상은 유가증권시장 공시 규정 등에 따라 비재무적 리스크가 적어 투자가치가 있는 양호한 기업군으로 분류된다.이번 조사는 의약품 중심 사업구조를 가진 국내 상장 제약사 중 매출 상위 20곳을 기준으로 집계한 결과다. 녹십자, 대웅제약, 대원제약, 동국제약, 동아에스티, 보령, 삼성바이오로직스, 셀트리온, 유한양행, 일동제약, 제일약품, 종근당, 파마리서치, 한독, 한미약품, 휴온스, HK이노엔, JW중외제약, SK바이오사이언스, SK바이오팜 등이다.지난 2021년부터 올해까지 4년간 ESG 등급 추이를 살펴보면 국내 상위 제약사의 ESG 경영 수준은 꾸준히 상승한 것으로 나타났다. 2021년에는 A등급을 받은 기업이 20곳 중 6곳(30%)에 불과했지만 2023년 11곳(55%)으로 증가하며 A등급 획득 기업이 절반을 넘어섰다. 이어 올해 14곳(70%)으로 확대하면서 4년 동안 상위권 비중이 약 2.3배 증가했다.반대로 중위권과 하위권은 축소하는 모습이다. 2022년과 2023년 각각 7곳(35%)에 달했던 B+등급 기업은 2024년 3곳(15%)으로 57%가량 줄어든 뒤 올해도 같은 수준에 머물렀다. B등급은 역시 5년간 5곳(25%)→4곳(20%)→4곳(20%)→3곳(15%)→2곳(10%)으로 지속해서 감소했다. C등급의 경우 2021년 3곳(15%)에서 올해 1곳(5%)까지 줄었고 D등급은 2022년 1곳을 끝으로 완전히 사라졌다.기업 간 성과 차이를 결정지은 핵심 변수가 지배구조(G) 부문이라는 점도 주목할 만하다. 다수 기업이 4년 새 환경(E)·사회(S) 영역에서 빠르게 개선세를 보였지만 지배구조(G) 영역은 상대적으로 답보 상태에 머무르는 경우가 많았다. 거버넌스 이슈는 오너 리스크나 이사회 독립성 등 단기간에 해결하기 어려운 과제가 많은 데다 평가 기준이 까다로운 만큼 실질적인 등급 변별력을 가르는 결정적 잣대가 되고 있다는 설명이다.실제로 조사 기간 동안 이사회 독립성 강화, 대표와 이사회 의장 분리, 내부감사 기능 고도화 등을 정비한 기업은 A등급권으로 빠르게 편입된 반면 오너 리스크, 사외이사 독립성 논란, 내부통제 미비 등 거버넌스 이슈가 노출된 기업은 상위 등급 진입이 막히거나 오히려 등급이 내려가는 흐름을 보였다.SK·동아 '굳건', 대웅제약·셀트리온 '환골탈태', 한미·제일약품 '역주행'기업별로 보면 SK바이오사이언스, SK바이오팜 그리고 동아에스티가 4년 동안 안정적으로 우수한 ESG 성적을 유지했다. 이들 기업은 2021년부터 2025년까지 단 한 차례도 A등급을 벗어나지 않으며 업계 최상위권을 굳건히 지켰다. SK 계열사들은 그룹 차원의 강력한 ESG 경영 드라이브와 인프라가 강점으로 작용한 것으로 보인다. 전통 제약사인 동아에스티의 경우 오랜 기간 공을 들여온 ESG 경영 시스템이 안정화 단계에 접어들었다는 평가다.삼성바이오로직스와 HK이노엔도 ESG 상위권 기업에 이름을 올렸다. 삼성바이오로직스는 2023년 국내 주요 제약사 가운데 유일하게 A+등급을 획득하며 최상위 수준의 ESG 경쟁력을 입증했다. HK이노엔 역시 2024년 A+등급을 받으며 ESG 분야의 신흥 강자로 급부상했다. A+등급이 매년 전체 기업의 1~2%만 받는 희소 등급이라는 점을 감안하면 두 회사의 성과는 업계 최고 수준의 ESG 관리 역량을 공식적으로 인정받은 결과로 볼 수 있다.다만 최정상급 타이틀 방어는 쉽지 않았다. 삼성바이오로직스와 HK이노엔 모두 A+등급을 받은 이듬해 A등급으로 하향 조정되며 최상위 자리를 반납했다. 삼성바이오로직스는 지배구조(G) 항목에서 점수 변동이 발생하며 종합 등급이 한 단계 내려앉았다. 삼성바이오로직스는 2023년 지배구조(G) 부문에서 최고점인 A+등급을 받으면서 ESG 종합 A+등급을 달성했지만 2024년에는 지배구조(G) 부문 점수가 다시 A로 내려갔다. 존림 대표의 이사회 의장 겸직 이슈가 지배구조(G) 항목 평가에 부담으로 작용했다는 분석이다.HK이노엔도 상황이 비슷하다. 이 회사는 2024년 지배구조(G) 부문에서 최고등급인 A+등급을 받으며 ESG 종합 등급이 2023년에서 A등급에서 2024년 A+등급으로 한 단계 상승했다. 그러나 올해 지배구조(G) 부문 점수가 다시 A등급으로 하향 조정되면서 종합 등급 역시 A등급으로 내려앉았다. HK이노엔은 2023년 대표와 이사회 의장을 분리하고 사외이사를 의장에 선임하는 등 지배구조 개선 노력을 이어왔지만 최상위 등급을 지속적으로 유지하기에는 한계가 있었던 것으로 보인다.대웅제약, 대원제약, 휴온스 등은 4년 새 등급을 단계적으로 끌어올리며 상위권으로 도약한 기업으로 분류된다. 대웅제약은 2021년 ESG 종합 C등급에서 출발했으나 2022년·2023년 B+등급, 2024년 B등급, 올해 A등급으로 매년 등급이 상승했다. 환경(E) 부문이 2021년 D등급에서 올해 A등급으로, 사회(S) 부문이 B등급에서 A+등급으로, 지배구조(G) 부문이 B등급에서 B+등급으로 개선되는 등 전 부문에서 균형 있는 체질 개선이 이뤄진 결과다.셀트리온도 가파른 반등을 이뤄낸 기업으로 손꼽힌다. 셀트리온의 ESG 종합 등급은 2021년 B등급에서 2024년 A등급으로 올라선 데 이어 올해 역시 A등급을 유지하며 상위권에 안착했다. 사회(S) 부문이 2021년 B+등급에서 2023년 A+등급까지 두 단계 상승했고 환경(E) 부문도 2021년 C등급에서 지난해 A등급으로 크게 개선됐다. 2023년 C등급을 기록했던 지배구조(G) 부문 역시 2024년 A등급까지 올라가면서 ESG 종합 등급이 반등했다. 셀트리온과 셀트리온헬스케어 합병 이후 거버넌스 리스크를 상당 부분 해소한 것이 지배구조(G) 부문 등급 상향에 주된 역할을 한 것으로 풀이된다.녹십자와 보령, 유한양행, 종근당 등도 완만하지만 뚜렷한 개선 흐름을 보인 기업이다. 녹십자는 4년 연속 B+등급을 유지하다가 올해 처음으로 A등급에 진입했고 줄곧 B+등급에 머물던 유한양행은 2023년 A등급으로 올라선 뒤 올해까지 이를 유지했다. 종근당 역시 2022~2023년 B+에서 2024년 A등급으로 복귀하며 안정적인 상향 흐름을 이어갔다. 이들 기업 대부분 이사회 구성 개편, 내부감사 기능 강화 등 지배구조(G) 중심 개선 작업을 추진한 점이 등급 상향의 핵심 요인으로 작용했다.한미약품과 일동제약은 5년간 ESG 종합 등급이 역주행한 사례다. 한미약품은 2021년 ESG 종합 A등급에서 출발했지만 2022년 B+등급으로 내려앉은 뒤 2024~2025년까지 B등급에 머물며 하락 추세가 이어졌다. 지배구조(G) 부문이 가장 큰 변동 요인으로 해당 항목은 2021년 A등급에서 올해 C등급까지 떨어지며 전반적인 종합 점수 하락을 이끌었다. 한미약품은 환경(E)·사회(S) 부문에서 오히려 개선세를 보였음에도 장기화된 오너일가 경영권 분쟁과 이사회 기능 약화 등 거버넌스 리스크가 기업 신뢰도에 타격을 주면서 ESG 전체 등급이 하락했다. 비슷하게 일동제약도 지배구조(G) 부문이 2021년 A등급에서 올해 C등급으로 추락하면서 ESG 종합 등급이 A등급에서 B등급으로 떨어졌다.제일약품은 5년 내내 C~D 등급에 머물며 하위권에서 벗어나지 못했다. 제일약품은 2021년 ESG 종합 C등급에서 시작해 2022년에는 전 항목이 동시에 하락하며 D등급까지 떨어졌고 이후에도 3년 내내 C등급에 머물며 반등의 모멘텀을 확보하지 못했다. 환경(E)과 사회(S) 부문은 최근 개선 조짐이 나타났지만 지배구조(G) 부문이 5년 내내 D등급에 고착되면서 종합 등급 상향의 발목을 잡았다.2025-12-01 12:10:54차지현 기자
A등급 4년 새 30→70%…대형제약, ESG 경영 안착국내 주요 제약바이오 기업의 ESG(환경·사회·지배구조) 경영 수준이 지난 4년간 비약적으로 성장했다. 상위 20개사 ESG 등급 변화를 분석한 결과 2021년 전체의 30%에 불과했던 A등급 기업 비중이 2025년 70%로 2배 이상 급증한 것으로 나타났다.전반적인 ESG 등급 개선 흐름 속 기업 간 희비를 가른 건 지배구조(G) 부문이다. 이사회 독립성과 내부통제를 강화한 기업은 등급이 상향 조정된 반면, 오너 리스크나 주주가치 훼손 논란이 발생한 기업은 등급이 정체되거나 오히려 낮아지는 양상을 보였다.상위 제약사 10곳 중 7곳 A등급…ESG 등급 가른 결정타는 '지배구조'1일 업계에 따르면 제약바이오 상위 20개사 중 14개사가 올해 한국ESG기준원(KCGS) ESG 종합 평가에서 A등급을 획득했다. 분석 대상 기업의 70%가 A등급을 받은 셈이다. 이어 B+등급 3곳(15%), B등급 2곳(10%), C등급 1곳(5%)으로 뒤를 이었다. 조사 기업 가운데 최상위 A+등급과 최하위 D등급을 받은 기업은 없었다.KCGS는 매년 국내 주요 상장 기업을 대상으로 환경(E)·사회(S)·지배구조(G) 부문의 지속가능경영 수준을 평가해 등급을 부여한다. 등급 체계는 S(탁월), A+(매우 우수), A(우수), B+(양호), B(보통), C(취약), D(미흡) 등 총 7개 등급으로 나뉜다. 통상 B+등급 이상은 유가증권시장 공시 규정 등에 따라 비재무적 리스크가 적어 투자가치가 있는 양호한 기업군으로 분류된다.이번 조사는 의약품 중심 사업구조를 가진 국내 상장 제약사 중 매출 상위 20곳을 기준으로 집계한 결과다. 녹십자, 대웅제약, 대원제약, 동국제약, 동아에스티, 보령, 삼성바이오로직스, 셀트리온, 유한양행, 일동제약, 제일약품, 종근당, 파마리서치, 한독, 한미약품, 휴온스, HK이노엔, JW중외제약, SK바이오사이언스, SK바이오팜 등이다.지난 2021년부터 올해까지 4년간 ESG 등급 추이를 살펴보면 국내 상위 제약사의 ESG 경영 수준은 꾸준히 상승한 것으로 나타났다. 2021년에는 A등급을 받은 기업이 20곳 중 6곳(30%)에 불과했지만 2023년 11곳(55%)으로 증가하며 A등급 획득 기업이 절반을 넘어섰다. 이어 올해 14곳(70%)으로 확대하면서 4년 동안 상위권 비중이 약 2.3배 증가했다.반대로 중위권과 하위권은 축소하는 모습이다. 2022년과 2023년 각각 7곳(35%)에 달했던 B+등급 기업은 2024년 3곳(15%)으로 57%가량 줄어든 뒤 올해도 같은 수준에 머물렀다. B등급은 역시 5년간 5곳(25%)→4곳(20%)→4곳(20%)→3곳(15%)→2곳(10%)으로 지속해서 감소했다. C등급의 경우 2021년 3곳(15%)에서 올해 1곳(5%)까지 줄었고 D등급은 2022년 1곳을 끝으로 완전히 사라졌다.기업 간 성과 차이를 결정지은 핵심 변수가 지배구조(G) 부문이라는 점도 주목할 만하다. 다수 기업이 4년 새 환경(E)·사회(S) 영역에서 빠르게 개선세를 보였지만 지배구조(G) 영역은 상대적으로 답보 상태에 머무르는 경우가 많았다. 거버넌스 이슈는 오너 리스크나 이사회 독립성 등 단기간에 해결하기 어려운 과제가 많은 데다 평가 기준이 까다로운 만큼 실질적인 등급 변별력을 가르는 결정적 잣대가 되고 있다는 설명이다.실제로 조사 기간 동안 이사회 독립성 강화, 대표와 이사회 의장 분리, 내부감사 기능 고도화 등을 정비한 기업은 A등급권으로 빠르게 편입된 반면 오너 리스크, 사외이사 독립성 논란, 내부통제 미비 등 거버넌스 이슈가 노출된 기업은 상위 등급 진입이 막히거나 오히려 등급이 내려가는 흐름을 보였다.SK·동아 '굳건', 대웅제약·셀트리온 '환골탈태', 한미·제일약품 '역주행'기업별로 보면 SK바이오사이언스, SK바이오팜 그리고 동아에스티가 4년 동안 안정적으로 우수한 ESG 성적을 유지했다. 이들 기업은 2021년부터 2025년까지 단 한 차례도 A등급을 벗어나지 않으며 업계 최상위권을 굳건히 지켰다. SK 계열사들은 그룹 차원의 강력한 ESG 경영 드라이브와 인프라가 강점으로 작용한 것으로 보인다. 전통 제약사인 동아에스티의 경우 오랜 기간 공을 들여온 ESG 경영 시스템이 안정화 단계에 접어들었다는 평가다.삼성바이오로직스와 HK이노엔도 ESG 상위권 기업에 이름을 올렸다. 삼성바이오로직스는 2023년 국내 주요 제약사 가운데 유일하게 A+등급을 획득하며 최상위 수준의 ESG 경쟁력을 입증했다. HK이노엔 역시 2024년 A+등급을 받으며 ESG 분야의 신흥 강자로 급부상했다. A+등급이 매년 전체 기업의 1~2%만 받는 희소 등급이라는 점을 감안하면 두 회사의 성과는 업계 최고 수준의 ESG 관리 역량을 공식적으로 인정받은 결과로 볼 수 있다.다만 최정상급 타이틀 방어는 쉽지 않았다. 삼성바이오로직스와 HK이노엔 모두 A+등급을 받은 이듬해 A등급으로 하향 조정되며 최상위 자리를 반납했다. 삼성바이오로직스는 지배구조(G) 항목에서 점수 변동이 발생하며 종합 등급이 한 단계 내려앉았다. 삼성바이오로직스는 2023년 지배구조(G) 부문에서 최고점인 A+등급을 받으면서 ESG 종합 A+등급을 달성했지만 2024년에는 지배구조(G) 부문 점수가 다시 A로 내려갔다. 존림 대표의 이사회 의장 겸직 이슈가 지배구조(G) 항목 평가에 부담으로 작용했다는 분석이다.HK이노엔도 상황이 비슷하다. 이 회사는 2024년 지배구조(G) 부문에서 최고등급인 A+등급을 받으며 ESG 종합 등급이 2023년에서 A등급에서 2024년 A+등급으로 한 단계 상승했다. 그러나 올해 지배구조(G) 부문 점수가 다시 A등급으로 하향 조정되면서 종합 등급 역시 A등급으로 내려앉았다. HK이노엔은 2023년 대표와 이사회 의장을 분리하고 사외이사를 의장에 선임하는 등 지배구조 개선 노력을 이어왔지만 최상위 등급을 지속적으로 유지하기에는 한계가 있었던 것으로 보인다.대웅제약, 대원제약, 휴온스 등은 4년 새 등급을 단계적으로 끌어올리며 상위권으로 도약한 기업으로 분류된다. 대웅제약은 2021년 ESG 종합 C등급에서 출발했으나 2022년·2023년 B+등급, 2024년 B등급, 올해 A등급으로 매년 등급이 상승했다. 환경(E) 부문이 2021년 D등급에서 올해 A등급으로, 사회(S) 부문이 B등급에서 A+등급으로, 지배구조(G) 부문이 B등급에서 B+등급으로 개선되는 등 전 부문에서 균형 있는 체질 개선이 이뤄진 결과다.셀트리온도 가파른 반등을 이뤄낸 기업으로 손꼽힌다. 셀트리온의 ESG 종합 등급은 2021년 B등급에서 2024년 A등급으로 올라선 데 이어 올해 역시 A등급을 유지하며 상위권에 안착했다. 사회(S) 부문이 2021년 B+등급에서 2023년 A+등급까지 두 단계 상승했고 환경(E) 부문도 2021년 C등급에서 지난해 A등급으로 크게 개선됐다. 2023년 C등급을 기록했던 지배구조(G) 부문 역시 2024년 A등급까지 올라가면서 ESG 종합 등급이 반등했다. 셀트리온과 셀트리온헬스케어 합병 이후 거버넌스 리스크를 상당 부분 해소한 것이 지배구조(G) 부문 등급 상향에 주된 역할을 한 것으로 풀이된다.녹십자와 보령, 유한양행, 종근당 등도 완만하지만 뚜렷한 개선 흐름을 보인 기업이다. 녹십자는 4년 연속 B+등급을 유지하다가 올해 처음으로 A등급에 진입했고 줄곧 B+등급에 머물던 유한양행은 2023년 A등급으로 올라선 뒤 올해까지 이를 유지했다. 종근당 역시 2022~2023년 B+에서 2024년 A등급으로 복귀하며 안정적인 상향 흐름을 이어갔다. 이들 기업 대부분 이사회 구성 개편, 내부감사 기능 강화 등 지배구조(G) 중심 개선 작업을 추진한 점이 등급 상향의 핵심 요인으로 작용했다.한미약품과 일동제약은 5년간 ESG 종합 등급이 역주행한 사례다. 한미약품은 2021년 ESG 종합 A등급에서 출발했지만 2022년 B+등급으로 내려앉은 뒤 2024~2025년까지 B등급에 머물며 하락 추세가 이어졌다. 지배구조(G) 부문이 가장 큰 변동 요인으로 해당 항목은 2021년 A등급에서 올해 C등급까지 떨어지며 전반적인 종합 점수 하락을 이끌었다. 한미약품은 환경(E)·사회(S) 부문에서 오히려 개선세를 보였음에도 장기화된 오너일가 경영권 분쟁과 이사회 기능 약화 등 거버넌스 리스크가 기업 신뢰도에 타격을 주면서 ESG 전체 등급이 하락했다. 비슷하게 일동제약도 지배구조(G) 부문이 2021년 A등급에서 올해 C등급으로 추락하면서 ESG 종합 등급이 A등급에서 B등급으로 떨어졌다.제일약품은 5년 내내 C~D 등급에 머물며 하위권에서 벗어나지 못했다. 제일약품은 2021년 ESG 종합 C등급에서 시작해 2022년에는 전 항목이 동시에 하락하며 D등급까지 떨어졌고 이후에도 3년 내내 C등급에 머물며 반등의 모멘텀을 확보하지 못했다. 환경(E)과 사회(S) 부문은 최근 개선 조짐이 나타났지만 지배구조(G) 부문이 5년 내내 D등급에 고착되면서 종합 등급 상향의 발목을 잡았다.2025-12-01 12:10:54차지현 기자 -
 보령, 트루버디 출시 2주년 심포지엄...최신 지견 공유[데일리팜=최다은 기자] 보령은 당뇨병 복합제 ‘트루버디’ 출시 2주년을 기념해 지난 8일 서울 웨스틴조선 파르나스 호텔에서 심포지엄을 개최했다고 18일 밝혔다.‘당신생각 REMIND’를 주제로 열린 이번 행사에는 전국에서 개원의 100여 명이 참석해 성황을 이뤘다. 참석자들은 다파글리플로진과 피오글리타존 병용요법의 임상적 이점 등 최신 지견을 공유하며 치료 전략을 논의했다.트루버디는 보령이 세계 최초로 개발한 개량신약으로, SGLT-2 억제제인 다파글리플로진에 TZD 계열 피오글리타존을 결합한 복합제다. 출시 이후 동일 성분 시장에서 약 80%의 점유율을 차지하며 1위 품목으로 자리잡았다. 두 성분은 혈당 강하 효과는 물론 서로의 부작용을 상쇄하며 병용 시 시너지 효과를 내는 것이 강점이다.심포지엄 강연은 내분비내과 분야의 전문가들이 맡았다. 김성래 부천성모병원 교수(차기 대한당뇨병학회 이사장)와 윤석기 천안엔도내과의원 원장이 좌장을 맡아 두 개 세션을 진행했다.첫 번째 세션에서 이은정 강북삼성병원 교수는 피오글리타존의 베타세포 기능 보호 효과와 최대 5년 지속되는 혈당 조절 능력, 뇌심혈관질환 및 MASLD(대사기능장애 관련 지방간질환) 개선 효과 등을 강조했다.또한 TZD 계열의 심혈관 안전성은 ‘PROactive’ 연구에서 이미 재확인된 만큼 젊은 남성 환자, 비만·고혈압·고콜레스테롤혈증 등 동반질환을 가진 제2형 당뇨병 환자에게 특히 유효하다고 설명했다.두 번째 세션에서 김미경 은평성모병원 교수는 제2형 당뇨병 환자의 다양한 병태와 동반질환을 고려할 때 단일제만으로는 치료가 어렵다고 지적하며 조기 병용요법의 필요성을 강조했다. 특히 트루버디의 두 성분이 다른 기전으로 작용해 추가적인 혈당 강하 효과를 제공하고, 심뇌혈관질환 및 만성신질환 개선에도 기여할 수 있다고 설명했다.김 교수는 “SGLT-2 억제제와 TZD 조합은 말 그대로 ‘트루버디(True Buddy)’”라며 3제 병용 급여 확대 이후 더 많은 환자와 의료진에게 우선 고려될 치료 옵션이 될 것이라고 전망했다.보령은 이번 심포지엄을 계기로 신제품 개발과 출시를 통해 당뇨 사업 확대에 더욱 속도를 낼 방침이다.성백민 보령 마케팅본부장은 “비만도가 높고 합병증 환자가 많은 국내 상황에서 트루버디가 대사적 원인을 개선하는 대표 치료옵션으로 주목받고 있다”며 “앞으로도 당뇨병 치료 시장을 선도할 제품을 지속 선보이며 환자 치료에 진심을 다하는 기업이 되겠다”고 말했다.2025-11-18 10:20:57최다은
보령, 트루버디 출시 2주년 심포지엄...최신 지견 공유[데일리팜=최다은 기자] 보령은 당뇨병 복합제 ‘트루버디’ 출시 2주년을 기념해 지난 8일 서울 웨스틴조선 파르나스 호텔에서 심포지엄을 개최했다고 18일 밝혔다.‘당신생각 REMIND’를 주제로 열린 이번 행사에는 전국에서 개원의 100여 명이 참석해 성황을 이뤘다. 참석자들은 다파글리플로진과 피오글리타존 병용요법의 임상적 이점 등 최신 지견을 공유하며 치료 전략을 논의했다.트루버디는 보령이 세계 최초로 개발한 개량신약으로, SGLT-2 억제제인 다파글리플로진에 TZD 계열 피오글리타존을 결합한 복합제다. 출시 이후 동일 성분 시장에서 약 80%의 점유율을 차지하며 1위 품목으로 자리잡았다. 두 성분은 혈당 강하 효과는 물론 서로의 부작용을 상쇄하며 병용 시 시너지 효과를 내는 것이 강점이다.심포지엄 강연은 내분비내과 분야의 전문가들이 맡았다. 김성래 부천성모병원 교수(차기 대한당뇨병학회 이사장)와 윤석기 천안엔도내과의원 원장이 좌장을 맡아 두 개 세션을 진행했다.첫 번째 세션에서 이은정 강북삼성병원 교수는 피오글리타존의 베타세포 기능 보호 효과와 최대 5년 지속되는 혈당 조절 능력, 뇌심혈관질환 및 MASLD(대사기능장애 관련 지방간질환) 개선 효과 등을 강조했다.또한 TZD 계열의 심혈관 안전성은 ‘PROactive’ 연구에서 이미 재확인된 만큼 젊은 남성 환자, 비만·고혈압·고콜레스테롤혈증 등 동반질환을 가진 제2형 당뇨병 환자에게 특히 유효하다고 설명했다.두 번째 세션에서 김미경 은평성모병원 교수는 제2형 당뇨병 환자의 다양한 병태와 동반질환을 고려할 때 단일제만으로는 치료가 어렵다고 지적하며 조기 병용요법의 필요성을 강조했다. 특히 트루버디의 두 성분이 다른 기전으로 작용해 추가적인 혈당 강하 효과를 제공하고, 심뇌혈관질환 및 만성신질환 개선에도 기여할 수 있다고 설명했다.김 교수는 “SGLT-2 억제제와 TZD 조합은 말 그대로 ‘트루버디(True Buddy)’”라며 3제 병용 급여 확대 이후 더 많은 환자와 의료진에게 우선 고려될 치료 옵션이 될 것이라고 전망했다.보령은 이번 심포지엄을 계기로 신제품 개발과 출시를 통해 당뇨 사업 확대에 더욱 속도를 낼 방침이다.성백민 보령 마케팅본부장은 “비만도가 높고 합병증 환자가 많은 국내 상황에서 트루버디가 대사적 원인을 개선하는 대표 치료옵션으로 주목받고 있다”며 “앞으로도 당뇨병 치료 시장을 선도할 제품을 지속 선보이며 환자 치료에 진심을 다하는 기업이 되겠다”고 말했다.2025-11-18 10:20:57최다은 -
 '빅파마 연거푸 러브콜' 에이비엘 "계약금 1조 딜 목표"이상훈 에이비엘바이오 대표가 17일 기업설명회(IR)를 열고 회사의 플랫폼 확장 전략과 향후 성장 계획을 설명했다. [데일리팜=차지현 기자] 최근 글로벌 제약사 일라이 릴리와 대규모 기술수출 계약을 체결한 이중항체 전문 바이오텍 에이비엘바이오가 뇌혈관장벽(BBB) 셔틀 플랫폼의 확장성을 기반으로 성장을 가속화한다는 청사진을 제시했다. 다양한 모달리티 전달 능력과 폭넓은 적응증 스펙트럼을 앞세워 플랫폼 경쟁력을 극대화하겠다는 구상이다.이상훈 에이비엘바이오 대표는 17일 서울 광화문 포시즌스 호텔에서 기업간담회를 열고 최근 성사시킨 일라이 릴리 기술수출 계약의 의미와 BBB 셔틀의 확장 전략, 중장기 성장 전략 등을 발표했다.앞서 에이비엘바이오는 지난 12일 일라이 릴리와 총 26억200만 달러(약 3조8072억원) 규모로 BBB 셔틀 플랫폼 '그랩바디-B' 기술수출과 공동 연구개발 계약을 맺었다. 일라이 릴리가 다양한 모달리티를 기반으로 에이비엘바이오의 그랩바디-B 플랫폼을 적용한 복수의 비공개 타깃 후보물질을 개발·상업화할 수 있는 전세계 독점 권리를 확보하는 게 골자다. 이어 회사는 일라이 릴리로부터 1500만 달러(약 220억원) 규모 전략적 투자를 유치하며 기술 경쟁력을 재차 입증했다.이날 이 대표는 이번 일라이 릴리 계약이 1년 반 이상 단계적으로 논의를 쌓아온 끝에 맺은 결실이라고 말했다. 그는 "2023년 바이오USA에서 일라이 릴리와 처음 논의를 시작해 이후 JP모건 헬스케어 콘퍼런스, 올해 바이오USA와 바이오유럽 등 주요 글로벌 행사에서 꾸준히 기술 검증과 조건 조율을 이어왔다"며 "여름부터는 사실상 현재 계약 구조의 윤곽이 잡혔고 미국 인디애나폴리스 본사 법무 검토까지 모두 통과하면서 최종적으로 딜을 성사시킬 수 있었다"고 했다.이 대표는 이번 일라이 릴리 계약으로 글로벌 시장에서 자사 기술에 대한 검증이 확실하게 이뤄졌다는 데 의미가 크다고 평가했다. 2022년 프랑스 사노피, 올해 초 글로벌 제약사 글락소스미스클라인(GSK)에 이어 일라이 릴리까지 협업을 결정한 건 글로벌 빅파마가 에이비엘바이오 기술의 잠재력을 공식적으로 인정하고 있다는 방증이라는 게 그의 설명이다.에이비엘바이오 그랩바디-B 플랫폼 개요 (자료: 에이비엘바이오) 특히 그는 이번 일라이 릴리 계약의 핵심 키워드로 '확장성'을 거듭 강조했다. 이번 계약이 개별 후보물질이 아닌 플랫폼을 중심에 두고 다양한 모달리티와 적응증으로 확장할 수 있는 구조라는 점에서 플랫폼의 기술적·사업적 확장성을 한층 넓혔다는 취지다.모달리티 측면에서 그랩바디-B는 항체뿐만 아니라 짧은 간섭 리보핵산(siRNA), 안티센스 올리고뉴클레오타이드(ASO) 등 뉴클레오타이드 기반 물질까지 실어 나를 수 있는 플랫폼으로 확장 중이다.이 대표는 "초기에는 이중항체 위주로 셔틀을 설계했지만 2년 전부터 글로벌 제약사가 'siRNA를 BBB 셔틀에 실을 수 없냐'고 먼저 물어오기 시작했다"며 "이후 미국 아이오니스(Ionis)와 공동연구를 통해 siRNA를 뇌로 안정적으로 전달할 수 있다는 전임상 데이터를 확보했고 이를 논문화하는 작업까지 진행 중"이라고 소개했다.적응증 확장성 역시 플랫폼 가치의 핵심으로 꼽힌다. 그랩바디-B는 알츠하이머·파킨슨 등 전통적인 뇌질환 영역을 넘어 근육·지방 등 말초 조직까지 겨냥할 수 있다는 점에서 향후 파이프라인 구성 폭이 크게 달라질 수 있다는 기대가 나온다.이 대표는 "IGF1R 기반 BBB 셔틀은 뇌혈관만 타깃하는 것이 아니라 근육과 지방 조직에도 발현이 있어 CNS 외에도 비만·근감질환 등으로 확장할 수 있는 잠재력이 크다"며 "이번 일라이 릴리 전략적 투자에는 이 같은 말초 조직 딜리버리 가능성에 대한 기대도 반영돼 있다"고 말했다.여기에 IGF1R를 기반으로 한 셔틀 구조 자체가 이러한 확장 전략을 뒷받침하는 기술적 기반으로 작용한다. 이 대표는 "기존 트랜스페린 수용체(TfR) 기반 셔틀은 주로 한 가지 엔도사이토시스 경로에 의존하지만 IGF1R 기반 셔틀은 케이비올린(caveolin), 클라트린(clathrin), FEM 등 세 가지 경로를 통해 BBB를 통과하는 것이 특징"이라며 "고령으로 갈수록 수용체 발현이 감소하는 TfR과 달리 IGF1R은 노화에 따른 발현 저하가 크지 않아 알츠하이머·파킨슨 등 고령 환자군에서도 안정적으로 투과가 가능한 장점이 있다"고 설명했다.최근 BBB에 대한 글로벌 빅파마의 관심도가 급격히 높아졌다는 점도 주목할 만하다. 이 대표는 "작년까지만 해도 BBB 셔틀은 있으면 좋은(Nice to have) 기술이었지만 이제는 반드시 확보해야 하는(Must have) 핵심 플랫폼으로 인식이 바뀌었다"며 "CNS뿐 아니라 대사·근감 질환으로 적응증이 확장되면서 기술 수요가 폭발적으로 증가하고 있다"고 덧붙였다.이 대표는 그랩바디-B를 포함한 에이비엘바이오의 네 가지 비즈니스 모델을 공개하며 향후 성장 전략의 큰 틀도 제시했다. 크게 ▲신약 로열티 사업 ▲BBB 셔틀 플랫폼 사업 ▲Grabody-T 이중항암 플랫폼 ▲이중항체 ADC 기반 차세대 치료제 사업 등을 중심으로 기업가치를 지속해서 끌어올리겠다는 포부다.먼저 이 대표는 담도암 치료제 후보물질 'ABL001'을 통해 회사의 첫 로열티 기반 신약 상업화 가능성이 현실화하고 있다고 전망했다. 에이비엘바이오는 지난 2018년 미국 컴퍼스 테라퓨틱스에 ABL001의 글로벌 권리를 이전했는데 현재 담도암 2차 치료제로 개발 중인 해당 후보물질은 내년 1분기 말 최종 데이터 발표를 앞두고 있다.이 대표는 "유한양행의 렉라자 이후 국내에서 두 번째로 기술수출 기반 신약이 탄생할 가능성이 열렸다"면서 "컴퍼스 테라퓨틱스가 담도암 2차 치료제 허가를 받게 되면 에이비엘바이오의 첫 로열티 비즈니스 모델이 본격적으로 열리게 된다"고 했다.그는 "ABL001은 담도암 2차 치료에서 기존 치료제보다 3배 이상 높은 반응률(17.1%)을 보였고 내년 1분기 탑라인 결과에서도 긍정적 성과가 기대된다"면서 "시장 규모와 파트너의 판매 전략을 감안하면 연 500억~2000억원 수준 로열티 수익이 가능할 것으로 본다"고 했다. 컴퍼스 테라퓨틱스는 최종 데이터가 나오면 바로 미국 식품의약국(FDA)에 생물의약품허가 신청서(BLA)를 제출하겠다는 계획을 밝힌 상태다.에이비엘바이오 중장기 성장 전략 (자료: 에이비엘바이오) 4-1BB 기반 이중항체 플랫폼 '그랩바디-T'도 본격적으로 구체화하는 모습이다. 해당 플랫폼을 적용한 이중항체 후보물질 'ABL111'은 위암 1차 치료 병용에서 객관적반응률(ORR) 76%를 기록하며 핵심 파이프라인으로 부상했다. 특히 CLDN18.2 저발현 환자에서도 의미 있는 반응이 나타나 경쟁 항체 대비 차별성이 뚜렷하다는 게 이 대표의 설명이다. 후속 후보물질인 ABL503·ABL104·ABL105 역시 병용 전략 중심으로 개발을 이어나가고 있다.이중항체 기반 ADC 신약개발도 회사가 내세우는 또 하나의 핵심 성장축이다. 에이비엘바이오는 ROR1×B7-H3 이중항체 ADC 후보물질 'ABL206'과 EGFR×MUC1 ADC 후보물질 'ABL209'를 핵심 파이프라인으로 공개하며 본격적인 개발 로드맵을 제시했다. 회사는 미국 보스턴에 설립한 자회사 네옥바이오를 차세대 ADC 신약개발의 전초기지로 삼고 대형 기술이전 또는 인수합병(M&A)로 이어지는 투자금 회수(엑시트) 전략을 염두에 두고 있다.이 대표는 "최근 글로벌 빅파마에서 ADC 협업 미팅 요청이 꾸준히 들어오고 있는데 에이비엘바이오와 네옥바이오가 설정한 정확한 비즈니스 모델은 POC까지 직접 끌고 간 뒤 충분히 큰 규모의 M&A를 성사시키는 구조"라며 "화이자가 멧세라를 인수한 방식과 유사한 방식의 전략적 모델을 따라가려 한다"고 했다.마지막으로 이 대표는 "향후 로열티 수익이나 지속적인 기술수출 계약 그리고 네옥바이오를 통한 대형 M&A 등 다양한 자체 수입원을 기반으로 걱정 없이 연구개발을를 이어갈 수 있는 구조를 만들고 싶다"고 강조했다. 그는 "그동안은 비임상·임상 1상 단계에서 어떻게든 기술이전을 해야 회사가 버틸 수 있는 구조였지만 이제는 후기 임상까지 직접 가져갈 수 있는 체력과 모델이 갖춰지고 있다"며 "언젠가 후기 임상을 자체적으로 마치고 1조원 규모 업프론트를 받는 빅딜을 성사시키는 게 개인적인 목표이자 회사의 다음 단계"라고 했다.2025-11-17 16:53:07차지현
'빅파마 연거푸 러브콜' 에이비엘 "계약금 1조 딜 목표"이상훈 에이비엘바이오 대표가 17일 기업설명회(IR)를 열고 회사의 플랫폼 확장 전략과 향후 성장 계획을 설명했다. [데일리팜=차지현 기자] 최근 글로벌 제약사 일라이 릴리와 대규모 기술수출 계약을 체결한 이중항체 전문 바이오텍 에이비엘바이오가 뇌혈관장벽(BBB) 셔틀 플랫폼의 확장성을 기반으로 성장을 가속화한다는 청사진을 제시했다. 다양한 모달리티 전달 능력과 폭넓은 적응증 스펙트럼을 앞세워 플랫폼 경쟁력을 극대화하겠다는 구상이다.이상훈 에이비엘바이오 대표는 17일 서울 광화문 포시즌스 호텔에서 기업간담회를 열고 최근 성사시킨 일라이 릴리 기술수출 계약의 의미와 BBB 셔틀의 확장 전략, 중장기 성장 전략 등을 발표했다.앞서 에이비엘바이오는 지난 12일 일라이 릴리와 총 26억200만 달러(약 3조8072억원) 규모로 BBB 셔틀 플랫폼 '그랩바디-B' 기술수출과 공동 연구개발 계약을 맺었다. 일라이 릴리가 다양한 모달리티를 기반으로 에이비엘바이오의 그랩바디-B 플랫폼을 적용한 복수의 비공개 타깃 후보물질을 개발·상업화할 수 있는 전세계 독점 권리를 확보하는 게 골자다. 이어 회사는 일라이 릴리로부터 1500만 달러(약 220억원) 규모 전략적 투자를 유치하며 기술 경쟁력을 재차 입증했다.이날 이 대표는 이번 일라이 릴리 계약이 1년 반 이상 단계적으로 논의를 쌓아온 끝에 맺은 결실이라고 말했다. 그는 "2023년 바이오USA에서 일라이 릴리와 처음 논의를 시작해 이후 JP모건 헬스케어 콘퍼런스, 올해 바이오USA와 바이오유럽 등 주요 글로벌 행사에서 꾸준히 기술 검증과 조건 조율을 이어왔다"며 "여름부터는 사실상 현재 계약 구조의 윤곽이 잡혔고 미국 인디애나폴리스 본사 법무 검토까지 모두 통과하면서 최종적으로 딜을 성사시킬 수 있었다"고 했다.이 대표는 이번 일라이 릴리 계약으로 글로벌 시장에서 자사 기술에 대한 검증이 확실하게 이뤄졌다는 데 의미가 크다고 평가했다. 2022년 프랑스 사노피, 올해 초 글로벌 제약사 글락소스미스클라인(GSK)에 이어 일라이 릴리까지 협업을 결정한 건 글로벌 빅파마가 에이비엘바이오 기술의 잠재력을 공식적으로 인정하고 있다는 방증이라는 게 그의 설명이다.에이비엘바이오 그랩바디-B 플랫폼 개요 (자료: 에이비엘바이오) 특히 그는 이번 일라이 릴리 계약의 핵심 키워드로 '확장성'을 거듭 강조했다. 이번 계약이 개별 후보물질이 아닌 플랫폼을 중심에 두고 다양한 모달리티와 적응증으로 확장할 수 있는 구조라는 점에서 플랫폼의 기술적·사업적 확장성을 한층 넓혔다는 취지다.모달리티 측면에서 그랩바디-B는 항체뿐만 아니라 짧은 간섭 리보핵산(siRNA), 안티센스 올리고뉴클레오타이드(ASO) 등 뉴클레오타이드 기반 물질까지 실어 나를 수 있는 플랫폼으로 확장 중이다.이 대표는 "초기에는 이중항체 위주로 셔틀을 설계했지만 2년 전부터 글로벌 제약사가 'siRNA를 BBB 셔틀에 실을 수 없냐'고 먼저 물어오기 시작했다"며 "이후 미국 아이오니스(Ionis)와 공동연구를 통해 siRNA를 뇌로 안정적으로 전달할 수 있다는 전임상 데이터를 확보했고 이를 논문화하는 작업까지 진행 중"이라고 소개했다.적응증 확장성 역시 플랫폼 가치의 핵심으로 꼽힌다. 그랩바디-B는 알츠하이머·파킨슨 등 전통적인 뇌질환 영역을 넘어 근육·지방 등 말초 조직까지 겨냥할 수 있다는 점에서 향후 파이프라인 구성 폭이 크게 달라질 수 있다는 기대가 나온다.이 대표는 "IGF1R 기반 BBB 셔틀은 뇌혈관만 타깃하는 것이 아니라 근육과 지방 조직에도 발현이 있어 CNS 외에도 비만·근감질환 등으로 확장할 수 있는 잠재력이 크다"며 "이번 일라이 릴리 전략적 투자에는 이 같은 말초 조직 딜리버리 가능성에 대한 기대도 반영돼 있다"고 말했다.여기에 IGF1R를 기반으로 한 셔틀 구조 자체가 이러한 확장 전략을 뒷받침하는 기술적 기반으로 작용한다. 이 대표는 "기존 트랜스페린 수용체(TfR) 기반 셔틀은 주로 한 가지 엔도사이토시스 경로에 의존하지만 IGF1R 기반 셔틀은 케이비올린(caveolin), 클라트린(clathrin), FEM 등 세 가지 경로를 통해 BBB를 통과하는 것이 특징"이라며 "고령으로 갈수록 수용체 발현이 감소하는 TfR과 달리 IGF1R은 노화에 따른 발현 저하가 크지 않아 알츠하이머·파킨슨 등 고령 환자군에서도 안정적으로 투과가 가능한 장점이 있다"고 설명했다.최근 BBB에 대한 글로벌 빅파마의 관심도가 급격히 높아졌다는 점도 주목할 만하다. 이 대표는 "작년까지만 해도 BBB 셔틀은 있으면 좋은(Nice to have) 기술이었지만 이제는 반드시 확보해야 하는(Must have) 핵심 플랫폼으로 인식이 바뀌었다"며 "CNS뿐 아니라 대사·근감 질환으로 적응증이 확장되면서 기술 수요가 폭발적으로 증가하고 있다"고 덧붙였다.이 대표는 그랩바디-B를 포함한 에이비엘바이오의 네 가지 비즈니스 모델을 공개하며 향후 성장 전략의 큰 틀도 제시했다. 크게 ▲신약 로열티 사업 ▲BBB 셔틀 플랫폼 사업 ▲Grabody-T 이중항암 플랫폼 ▲이중항체 ADC 기반 차세대 치료제 사업 등을 중심으로 기업가치를 지속해서 끌어올리겠다는 포부다.먼저 이 대표는 담도암 치료제 후보물질 'ABL001'을 통해 회사의 첫 로열티 기반 신약 상업화 가능성이 현실화하고 있다고 전망했다. 에이비엘바이오는 지난 2018년 미국 컴퍼스 테라퓨틱스에 ABL001의 글로벌 권리를 이전했는데 현재 담도암 2차 치료제로 개발 중인 해당 후보물질은 내년 1분기 말 최종 데이터 발표를 앞두고 있다.이 대표는 "유한양행의 렉라자 이후 국내에서 두 번째로 기술수출 기반 신약이 탄생할 가능성이 열렸다"면서 "컴퍼스 테라퓨틱스가 담도암 2차 치료제 허가를 받게 되면 에이비엘바이오의 첫 로열티 비즈니스 모델이 본격적으로 열리게 된다"고 했다.그는 "ABL001은 담도암 2차 치료에서 기존 치료제보다 3배 이상 높은 반응률(17.1%)을 보였고 내년 1분기 탑라인 결과에서도 긍정적 성과가 기대된다"면서 "시장 규모와 파트너의 판매 전략을 감안하면 연 500억~2000억원 수준 로열티 수익이 가능할 것으로 본다"고 했다. 컴퍼스 테라퓨틱스는 최종 데이터가 나오면 바로 미국 식품의약국(FDA)에 생물의약품허가 신청서(BLA)를 제출하겠다는 계획을 밝힌 상태다.에이비엘바이오 중장기 성장 전략 (자료: 에이비엘바이오) 4-1BB 기반 이중항체 플랫폼 '그랩바디-T'도 본격적으로 구체화하는 모습이다. 해당 플랫폼을 적용한 이중항체 후보물질 'ABL111'은 위암 1차 치료 병용에서 객관적반응률(ORR) 76%를 기록하며 핵심 파이프라인으로 부상했다. 특히 CLDN18.2 저발현 환자에서도 의미 있는 반응이 나타나 경쟁 항체 대비 차별성이 뚜렷하다는 게 이 대표의 설명이다. 후속 후보물질인 ABL503·ABL104·ABL105 역시 병용 전략 중심으로 개발을 이어나가고 있다.이중항체 기반 ADC 신약개발도 회사가 내세우는 또 하나의 핵심 성장축이다. 에이비엘바이오는 ROR1×B7-H3 이중항체 ADC 후보물질 'ABL206'과 EGFR×MUC1 ADC 후보물질 'ABL209'를 핵심 파이프라인으로 공개하며 본격적인 개발 로드맵을 제시했다. 회사는 미국 보스턴에 설립한 자회사 네옥바이오를 차세대 ADC 신약개발의 전초기지로 삼고 대형 기술이전 또는 인수합병(M&A)로 이어지는 투자금 회수(엑시트) 전략을 염두에 두고 있다.이 대표는 "최근 글로벌 빅파마에서 ADC 협업 미팅 요청이 꾸준히 들어오고 있는데 에이비엘바이오와 네옥바이오가 설정한 정확한 비즈니스 모델은 POC까지 직접 끌고 간 뒤 충분히 큰 규모의 M&A를 성사시키는 구조"라며 "화이자가 멧세라를 인수한 방식과 유사한 방식의 전략적 모델을 따라가려 한다"고 했다.마지막으로 이 대표는 "향후 로열티 수익이나 지속적인 기술수출 계약 그리고 네옥바이오를 통한 대형 M&A 등 다양한 자체 수입원을 기반으로 걱정 없이 연구개발을를 이어갈 수 있는 구조를 만들고 싶다"고 강조했다. 그는 "그동안은 비임상·임상 1상 단계에서 어떻게든 기술이전을 해야 회사가 버틸 수 있는 구조였지만 이제는 후기 임상까지 직접 가져갈 수 있는 체력과 모델이 갖춰지고 있다"며 "언젠가 후기 임상을 자체적으로 마치고 1조원 규모 업프론트를 받는 빅딜을 성사시키는 게 개인적인 목표이자 회사의 다음 단계"라고 했다.2025-11-17 16:53:07차지현 -
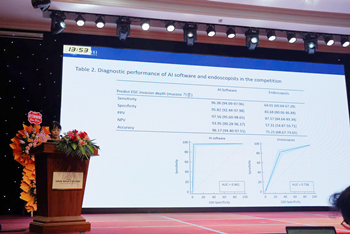 웨이센, AI 내시경 '웨이메드 엔도' 조기위암 진단 성과 공개김윤아 교수 발표 모습 [데일리팜=황병우 기자] 웨이센은 지난 10월 31일부터 이틀간 베트남에서 열린 Vietnam Gastroenterology Association(이하 VNAGE 2025)에 참가해, AI 내시경 ‘웨이메드 엔도’를 활용한 조기 위암 진단 관련 최신 연구 성과를 공개했다고 3일 밝혔다.웨이센은 이번 학회에서 자사의 AI내시경 웨이메드 엔도를 활용한 조기위암 진단 연구 결과를 소개했다.해당 연구는 연세대학교 강남세브란스병원 소화기내과 김지현 교수, 김윤아 교수 연구팀이 수행한 임상시험으로, 김윤아 교수가 직접 발표를 맡았다. 실제 임상 데이터를 기반으로 AI와 전문의 간 침윤깊이 진단 정확도를 비교 분석한 결과가 공유됐다.이번 연구는 조기위암 환자의 임상 데이터를 기반으로, 인공지능 소프트웨어와 내시경 전문의 간의 침윤깊이 진단 정확도를 비교한 임상시험이다.그 결과 AI는 민감도 96%, 특이도 95%, 전체 정확도 96%로, 내시경 전문의(정확도 71%) 대비 현저히 높은 진단 성능을 보였다.또 병변의 크기나 형태에 관계없이 일관된 판독 정확도를 유지해, AI의 객관적이고 안정적인 진단 가능성을 입증했다.이번 연구는 단순한 조기위암 탐지 성능을 넘어, 병변의 침윤 깊이(Depth of invasion) 예측 영역에서도 인공지능이 전문의 수준 이상의 임상적 판단력을 가질 수 있음을 보여준 데 의미가 크다.이는 향후 내시경 시술 중 실시간 진단 보조 및 치료 전략 수립 과정에서 AI가 의사의 의사결정을 강화하는 핵심 도구로 자리 잡을 수 있음을 시사한다.한편, VNAGE 2025 현장에서는 김윤아 교수의 발표 이후 현지 의료진들의 적극적인 질문과 토론이 이어지며 뜨거운 관심을 모았다.특히 베트남을 포함한 동남아 지역 의료진들이 조기위암 진단에 AI를 어떻게 임상에 적용할 수 있을지에 대해 높은 관심을 보이며, 웨이센의 AI 내시경 기술이 국제 학계에서 주목받고 있음을 확인했다.김경남 웨이센 대표는 "이번 연구 결과는 웨이메드 엔도가 조기위암 진단의 정밀도와 일관성을 한 단계 높였다는 점에서 매우 고무적이다"며 "이미 베트남을 중심으로 웨이메드 엔도의 도입과 판매가 빠르게 확대되고 있는 만큼, 임상적 신뢰를 기반으로 사업적 성과와 글로벌 시장 확장을 더욱 가속화해 나가겠다"고 밝혔다.2025-11-03 17:32:52황병우
웨이센, AI 내시경 '웨이메드 엔도' 조기위암 진단 성과 공개김윤아 교수 발표 모습 [데일리팜=황병우 기자] 웨이센은 지난 10월 31일부터 이틀간 베트남에서 열린 Vietnam Gastroenterology Association(이하 VNAGE 2025)에 참가해, AI 내시경 ‘웨이메드 엔도’를 활용한 조기 위암 진단 관련 최신 연구 성과를 공개했다고 3일 밝혔다.웨이센은 이번 학회에서 자사의 AI내시경 웨이메드 엔도를 활용한 조기위암 진단 연구 결과를 소개했다.해당 연구는 연세대학교 강남세브란스병원 소화기내과 김지현 교수, 김윤아 교수 연구팀이 수행한 임상시험으로, 김윤아 교수가 직접 발표를 맡았다. 실제 임상 데이터를 기반으로 AI와 전문의 간 침윤깊이 진단 정확도를 비교 분석한 결과가 공유됐다.이번 연구는 조기위암 환자의 임상 데이터를 기반으로, 인공지능 소프트웨어와 내시경 전문의 간의 침윤깊이 진단 정확도를 비교한 임상시험이다.그 결과 AI는 민감도 96%, 특이도 95%, 전체 정확도 96%로, 내시경 전문의(정확도 71%) 대비 현저히 높은 진단 성능을 보였다.또 병변의 크기나 형태에 관계없이 일관된 판독 정확도를 유지해, AI의 객관적이고 안정적인 진단 가능성을 입증했다.이번 연구는 단순한 조기위암 탐지 성능을 넘어, 병변의 침윤 깊이(Depth of invasion) 예측 영역에서도 인공지능이 전문의 수준 이상의 임상적 판단력을 가질 수 있음을 보여준 데 의미가 크다.이는 향후 내시경 시술 중 실시간 진단 보조 및 치료 전략 수립 과정에서 AI가 의사의 의사결정을 강화하는 핵심 도구로 자리 잡을 수 있음을 시사한다.한편, VNAGE 2025 현장에서는 김윤아 교수의 발표 이후 현지 의료진들의 적극적인 질문과 토론이 이어지며 뜨거운 관심을 모았다.특히 베트남을 포함한 동남아 지역 의료진들이 조기위암 진단에 AI를 어떻게 임상에 적용할 수 있을지에 대해 높은 관심을 보이며, 웨이센의 AI 내시경 기술이 국제 학계에서 주목받고 있음을 확인했다.김경남 웨이센 대표는 "이번 연구 결과는 웨이메드 엔도가 조기위암 진단의 정밀도와 일관성을 한 단계 높였다는 점에서 매우 고무적이다"며 "이미 베트남을 중심으로 웨이메드 엔도의 도입과 판매가 빠르게 확대되고 있는 만큼, 임상적 신뢰를 기반으로 사업적 성과와 글로벌 시장 확장을 더욱 가속화해 나가겠다"고 밝혔다.2025-11-03 17:32:52황병우 -
 세계 첫 항체 무관 혈우병 A·B 치료제 '피투시란'큐피틀리아(Qfitlia, 성분명 피투시란, Fitusiran, 사노피)는 GalXC 기술 플랫폼을 기반으로 개발된 항트롬빈(antithrombin)을 표적으로 하는 소간섭 리보핵산(small interfering RNA, siRNA) 치료제다.이 약제는 2024년 유럽의약청(EMA) 에서, 이어 올해 3월 미국 식품의약국(FDA) 에서 제VIII인자 또는 제IX인자 억제인자(inhibitor)의 유무와 관계없이, 12세 이상 성인 및 소아 혈우병 A 또는 B 환자에서 출혈 에피소드의 발생을 예방하거나 빈도를 감소시키기 위한 정기적 예방요법(routine prophylaxis)에 ‘두 달에 한번 피하주사’로 승인되었다. 국내에서는 올해 5월 희귀의약품(Orphan drug) 으로 지정되었다.혈우병(hemophilia)은 X염색체 연관 열성 유전질환으로, 제Ⅷ인자(FVIII) 또는 제Ⅸ인자(FIX) 의 결핍으로 인해 혈액응고 연쇄반응(coagulation cascade) 이 정상적으로 진행되지 못하며, 그 결과 트롬빈(thrombin) 생성 부족으로 지혈(hemostasis) 이 저하된다. 이러한 병태생리적 이상은 반복적인 출혈, 특히 관절 출혈을 초래하여 만성 관절병증(chronic arthropathy) 및 삶의 질 저하로 이어진다.기존의 표준 치료는 응고인자제제(clotting factor concentrate, CFC) 의 정맥 내 투여를 통한 인자 보충요법(replacement therapy) 이었다. 그러나 이 방식은 정맥 투여의 불편성, 반복적 투여 부담, 그리고 항체(억제인자, inhibitor) 형성으로 인한 치료 저항성이라는 한계를 지닌다.이에 따라 최근에는 비(非)응고인자 기반 치료(non-factor therapy) 의 개발이 활발히 이루어지고 있으며, 그중에서도 RNA 간섭(RNA interference, RNAi) 기술을 이용한 피투시란(Fitusiran) 은 새로운 치료 옵션으로 주목 받고 있다.피투시란은 간세포 내에서 항트롬빈(antithrombin, AT) 합성을 억제하도록 설계된 siRNA 기반 치료제로, 내인성 응고 조절 인자의 발현을 조절함으로써 응고 균형(hemostatic balance) 을 회복시키는 새로운 접근법을 제시한다.피투시란의 승인은 다국가, 무작위배정, 대조, 3상 임상시험들로 구성된 ATLAS 임상 프로그램의 결과를 근거로 하였다.이 프로그램에는 ATLAS-A/B, ATLAS-INH, 그리고 ATLAS-PPX 연구가 포함되며, 각각 혈우병 A 또는 B 환자 중 인자 억제인자의 유무, 그리고 기존 예방요법(prophylaxis) 사용 여부에 따라 구분되었다.ATLAS-A/B 연구는 억제인자가 없는(non-inhibitor) 혈우병 A 또는 B 환자를 대상으로, ATLAS-INH 연구는 억제인자가 존재하는(inhibitor-positive) 환자를 대상으로 수행되었다. ATLAS-PPX 연구는 기존 예방요법을 받고 있던 환자에서 피투시란으로 전환했을 때의 출혈률 변화를 평가하였다.이들 연구에서 피투시란은 월 1회 피하주사(subcutaneous injection) 투여만으로도 연간 출혈률(annualized bleeding rate, ABR)을 기존 치료 대비 약 90% 이상 유의하게 감소시켰으며, 절반 이상의 환자에서 무출혈(ABR = 0)이 관찰되었다. 또한 억제인자 유무와 관계없이 일관된 출혈 억제 효과가 확인되었다.혈우병이란 무엇인가?혈우병(hemophilia)은 그리스어 ‘hemo(피)’와 ‘philia(사랑하다)’에서 유래한 용어로, 1828년 Schönlein에 의해 Hämophilie라 명명됐다. 19세기 말 유럽 왕실 내 근친혼으로 인해 영국, 스페인, 독일, 러시아 등 여러 나라에서 다수의 환자가 발생하면서 ‘왕실병(The Royal Disease)’이라는 별칭을 얻었다.혈우병은 혈액응고인자의 결핍으로 인해 발생하는 대표적인 선천성 출혈성 질환이다. 제VIII응고인자(FVIII)의 결핍은 혈우병 A로, 전체 환자의 약 80~85%를 차지하며 ‘고전적 혈우병(classic hemophilia)’이라 불린다. 제IX응고인자(FIX)의 결핍은 혈우병 B로 약 15%를 차지하며, 최초 환자의 이름을 따 ‘크리스마스병(Christmas disease)’으로도 알려져 있다. 제XI응고인자(FXI)의 결핍은 혈우병 C로 상대적으로 드물게 발생한다.혈우병 A와 B는 X 염색체 열성 유전 양식을 가지므로 주로 남성에서 발병하며, 여성은 보인자로 존재하거나 드물게 태아기에 사망하기도 한다. 반면 혈우병 C는 4번 염색체 이상에 기인하므로 성별에 관계없이 발생할 수 있으며, 일부 환자에서는 가족력 없이 자연 발생적 유전자 변이에 의해 발현되기도 한다.혈우병과 유사한 질환으로는 폰빌레브란트병(von Willebrand disease, vWD)이 있다. 이는 응고인자 VIII과 결합하는 폰빌레브란트인자(vWF)의 결핍으로 인해 혈우병과 유사한 임상 양상을 보인다.이외에도 프로트롬빈(II), 피브리노겐(I), V, VII, X, XII, XIII 응고인자의 결핍으로 인한 선천성 응고장애가 보고되어 있으나, 이러한 질환들은 혈우병의 범주에는 포함되지 않는다.혈액응고 과정은 어떻게 일어나는가?혈액응고는 인체의 항상성을 유지하기 위한 필수적인 생리적 방어기전으로, 외상이나 혈관 손상 시 과도한 출혈을 방지하는 역할을 한다. 이 과정은 혈관수축, 혈소판 기능, 그리고 혈액응고인자의 연속적인 활성화로 이루어지는 응고 연쇄(cascade)로 설명되며, 궁극적으로 안정적인 피브린 혈전(fibrin clot)을 형성한다.혈액응고인자(Coagulation factors)는 주로 간에서 합성되는 단백질로, 로마 숫자로 표기된 I번부터 XIII번까지의 인자가 알려져 있다. 이들은 각각 특정 효소 활성 또는 보조인자로 작용하면서 정교하고 단계적인 반응을 매개한다. 주요 응고인자로는 피브리노겐(Factor I), 프로트롬빈(Factor II), 그리고 프로트롬빈 복합체를 구성하는 V, VII, IX, X, XI, XII 인자, 마지막으로 XIII 인자 등이 있다. 응고 연쇄는 크게 내인성 경로(intrinsic pathway), 외인성 경로(extrinsic pathway), 그리고 두 경로가 합류하는 공통 경로(common pathway)로 구성된다.내인성 경로는 Factor XII의 활성화를 시작으로 XI, IX, VIII 인자가 순차적으로 활성화되며, 외인성 경로는 조직인자(tissue factor, TF)와 Factor VII의 상호작용을 통해 개시된다.두 경로는 Factor X의 활성화 단계에서 공통 경로로 수렴하며, 활성화된 Factor X는 Factor V와 결합하여 프로트롬비나제(prothrombinase) 복합체를 형성한다. 이 복합체는 프로트롬빈(Factor II)을 트롬빈(thrombin)으로 전환시키고, 생성된 트롬빈은 피브리노겐(Factor I)을 불용성 피브린(fibrin)으로 전환시켜 최종적으로 혈전을 완성한다.또한 트롬빈은 Factor V, VIII, XI 등을 다시 활성화시키는 양성 되먹임(positive feedback) 작용을 통해 응고 반응을 증폭시키며, Factor XIII을 활성화시켜 피브린 가교결합(fibrin cross-linking)을 형성함으로써 혈전의 안정성을 더욱 높인다.이러한 정교한 연쇄 반응은 항응고 단백질(antithrombin, protein C/S system 등)과 섬유소 용해(fibrinolysis) 기전 간의 정밀한 균형 속에서 조절된다. 이 균형이 깨질 경우 출혈성 질환이나 혈전성 질환으로 이어질 수 있다.항트롬빈(Antithrombin, AT, heparin cofactor I)은 어떤 물질인가?항트롬빈(AT)은 혈액응고 조절에서 가장 중요한 내인성 항응고인자로, 전체 생리적 응고 억제 작용의 약 70~80%를 담당하는 핵심 단백질이다. AT는 혈장에 존재하는 세린 단백질분해효소 억제제(serpin) 계열의 당단백질로, 주된 표적은 트롬빈(thrombin)이지만, Factor Xa, IXa, XIa, XIIa 및 칼리크레인(kallikrein) 등 다양한 혈액응고인자를 동시에 억제함으로써 응고 연쇄(cascade) 전반의 균형 유지에 기여한다.The Coagulation Cascade(출처: Ann Pharmacother . 2016 Sep;50(9):758-67). AT는 트롬빈의 활성 중심부에 위치한 세린(serine) 잔기와 1:1 비율로 결합하여 불활성 복합체를 형성함으로써 트롬빈 활성을 차단한다. 이를 통해 소규모 응고 반응이나 불필요한 혈전 형성을 신속히 억제하며, 정상적인 생리 상태에서 과도한 혈액응고를 방지하는 핵심 역할을 수행한다.그러나 대규모 혈관 손상이나 파종성 혈관내응고(Disseminated intravascular coagulation, DIC)와 같이 트롬빈 생성이 폭발적으로 증가하는 상황에서는 AT의 억제 능력이 상대적으로 부족해져, 생리적 항응고 메커니즘만으로는 병적 혈전 형성을 완전히 제어하기 어렵다.AT의 항응고 활성이 가장 강력하게 발휘되는 조건은 헤파린(heparin)의 존재 하에서이다. 헤파린은 AT에 결합하여 구조적 변화를 유도하고, AT와 트롬빈 및 Factor Xa 간의 결합 친화도를 수백 배 이상 증폭시킨다.이로 인해 헤파린은 AT의 촉매제(cofactor) 역할을 하며, 임상적으로 항응고 효과를 발휘하는 주요 기전이 바로 AT 매개 억제 반응이다. 이러한 이유로 AT 결핍 환자에서는 헤파린의 항응고 효과가 현저히 감소하며, 이는 선천성 또는 후천성 AT 결핍에서 혈전성 질환 발생 위험이 증가하는 중요한 근거가 된다.AT는 간에서 합성되며 혈중 농도는 약 0.15mg/mL로 유지되고, 정상 활성도는 80~120% 범위 내에 있다. 선천성 AT 결핍은 드문 질환이지만 정맥혈전증과 폐색전증 발생의 중요한 위험 요인으로 알려져 있으며, 후천성 결핍은 간질환, 신증후군, DIC, 항응고제 치료 등 다양한 상황에서 관찰된다. AT 농도의 감소는 항응고 균형을 무너뜨려 과도한 혈전 형성을 유발하므로, 임상적으로 AT 농축제제 보충 또는 헤파린·직접 트롬빈 억제제와 같은 항응고 요법을 병행하는 치료 전략이 고려된다.이처럼 AT는 단순한 혈액응고인자 억제 단백질을 넘어, 혈액응고와 항응고, 그리고 섬유소 용해(fibrinolysis) 시스템 사이의 미세한 균형을 유지하는 핵심 조절인자로서, 혈전성 질환의 병태생리 이해와 새로운 항응고 치료제 개발에 있어 중요한 연구 대상이 되고 있다.혈우병 A 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor Replacement Therapy) 혈우병 A의 전통적인 치료는 부족한 제Ⅷ인자(FVIII)를 직접 보충하는 방식이다. 초기에는 혈액 유래 FVIII 제제가 사용되었으나, 감염 위험 등 안전성 문제가 제기되면서 현재는 재조합 FVIII(rFVIII)이 표준으로 자리잡았다. 또한 최근에는 반감기를 연장한 FVIII 제제들이 개발되어 투여 빈도를 줄이고 환자 순응도를 높이는 데 기여하고 있다.1) 표준 반감기(Standard half-life, SHL) FVIII 제제 표준 반감기 제제는 혈액 유래 FVIII와 재조합 FVIII로 나눌 수 있다. 혈액 유래 제제는 감염 위험 관리가 필요하지만 여전히 일부에서 사용되고 있으며, 재조합 FVIII로 애드베이트(AdvateⓇ, 코지네이트 에프에스(Kogenate FSⓇ) 등은 안전성 측면에서 더 선호된다.2) 반감기 연장형(Extended half-life, EHL) FVIII 제제 반감기 연장형 제제는 투여 간격을 늘리기 위해 Fc-fusion(엘록테이트, EloctateⓇ), PEGylation(애디노베이트, AdynovateⓇ, 지비, JiviⓇ) 등 다양한 기술이 적용되었다. 이러한 약제들은 환자의 주사 횟수를 줄여 장기적인 치료 순응도를 개선하는 장점이 있다.3) VWF-independent EHL(VWF 비의존성 반감기 연장형) FVIII 제제 VWF 비의존성 반감기 연장형 제제인 알투비오(AltuviiioⓇ)는 주 1회 주사로 FVIII 활성을 더 오래 유지할 수 있도록 설계된 최신형 지속형 치료제(high sustained factor, HSF)로 2023년 미 FDA에서 승인되었고 국내에서는 진행중이다,2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 A 환자의 약 20~30%는 치료 과정에서 FVIII에 대한 억제항체를 형성하게 되며, 이 경우 기존의 FVIII 보충요법은 효과가 제한적이다. 억제인자 환자의 치료에는 크게 두 가지 접근법이 있다.첫째, 우회제제(bypassing agents, BPA)를 사용하는 방법이다. 활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBAⓇ)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSevenⓇ)는 응고경로를 우회적으로 활성화하여 지혈 효과를 발휘하지만, 지혈 반응의 변동성과 혈전 위험이라는 한계가 존재한다.둘째, 에미시주맙(Emicizumab, HemlibraⓇ)는 FIXa와 FX를 연결하여 FVIII의 기능을 모방하는 이중특이성 항체로, 억제인자 환자뿐 아니라 비(非)억제인자 환자에서도 예방요법으로 사용 가능하다. 피하 주사로 1주~4주 간격 투여가 가능하여 투여 편의성이 획기적으로 개선되었다.3. 대체 인자제제(Replacement therapy) 재조합 돼지 유래 FVIII(r-pFVIII)인 오비주르(Obizur®, Susoctocog alfa)는 2014년 미 FDA, 2015년 EMA 그리고 2023년 국내에서 ‘성인 후천성 혈우병 A(Acquired Haemophilia A, AHA) 환자의 출혈 에피소드 치료’에 승인되었다. 후천성 혈우병 A는 선천성 혈우병과 다르게, 정상 혈액응고인자 VIII(FVIII) 수준을 가지고 있지만, 이에 대해 자가면역 항체(중화 항체)가 생겨 혈액 응고 기능이 저해되어 출혈 위험이 커지는 인구 100만 명당 약 1명꼴로 발생하는 초희귀 자가면역 응고질환이다.4. 비응고인자 기반 치료(Non-factor Therapy) 최근 혈우병 A 치료에서 가장 주목받는 변화는 FVIII를 직접 보충하지 않고, 다른 경로를 통해 응고 균형을 회복하는 비응고인자 기반 치료이다. 대표적인 약제가 에미시주맙(Emicizumab, HemlibraⓇ)으로, FIXa와 FX을 연결하여 FVIII의 보조인자 기능을 모방하는 이중특이성 항체이다. 피하 주사로 주 1회, 격주, 또는 4주 간격 투여가 가능해 환자의 치료 편의성이 획기적으로 개선되었다.이외에도 피투시란(Fitusiran)과 콘시주맙(Concizumab, Alhemo®)가 있다. 피투시란은 RNA 간섭(RNAi) 기술을 이용하여 간세포에서 항트롬빈 합성을 억제함으로써 응고 활성을 높인다. 월 1회 피하 주사가 가능하지만, 혈전 및 간독성 발생 위험으로 인해 항트롬빈 활성(15–35%)을 유지하는 개별화 용량조절(AT-DR)이 필요하다. 콘시주맙은 조직인자경로억제인자(TFPI)를 차단하여 내인성 응고를 촉진하는 약제이다.5. 유전자 치료(Gene Therapy) 혈우병 A에서 유전자 치료는 단회 정맥투여를 통해 간세포에 FVIII 유전자를 도입하여 장기간 발현을 유도하는 새로운 전략이다. 대표적인 약제가 록타비안(RoctavianⓇ, Valoctocogene roxaparvovec)으로, AAV5 벡터를 이용해 개발되었으며 2022년 유럽, 2023년 미국 FDA의 승인을 받았다.단일 투여로 FVIII 발현을 장기간 유지할 수 있어 치료 패러다임의 변화를 예고했으나, 발현 지속 기간의 불확실성, 간효소 상승, 재투여 불가 등의 문제점이 여전히 남아 있다.혈우병 B 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor IX Replacement Therapy) 혈우병 B의 가장 기본적인 치료는 부족한 제Ⅸ인자(FIX)를 직접 보충하는 방식이다. 과거에는 혈액 유래 제제가 널리 사용되었으나, 감염 위험 문제로 현재는 재조합 FIX(rFIX) 제제가 주로 사용된다. 여기에 더해 반감기를 연장한 제제들이 개발되면서 투여 간격이 길어지고 환자의 치료 순응도가 크게 향상되었다.1) 표준 반감기(Standard half-life, SHL) FIX 제제 표준 반감기 FIX 제제는 투여 후 약 18~24시간의 반감기를 가지며, 주 2~3회 정맥 주사가 필요하다. 혈액 유래 FIX 제제는 여전히 일부에서 사용되지만, 바이러스 감염에 대한 안전성 우려가 있었다. 이를 보완하기 위해 개발된 재조합 FIX 제제인 베네픽스(BeneFIXⓇ, Nonacog alfa)는 안전성이 확보되어 현재 임상에서 가장 널리 사용되고 있다.2) 반감기 연장(Extended half-life, EHL) FIX 제제 반감기 연장 제제는 기존 표준 제제보다 3~5배 긴 반감기를 가지며, 1~2주 간격으로 투여가 가능하다. 이들 약제에는 Fc-fusion 단백을 이용한 알프로릭스(Alprolix(Ⓡ, Eftrenonacog alfa), albumin-fusion 기술이 적용된 아이델비온(IdelvionⓇ Albutrepenonacog alfa) 등이 포함된다. 이러한 제제들은 주사 횟수를 줄여 환자의 삶의 질과 치료 순응도를 높이는 중요한 진보로 평가된다.2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 B 환자에서 억제인자 발생은 상대적으로 드물지만, 일단 형성되면 치료가 매우 어렵다. 억제인자가 형성된 경우 기존 FIX 제제의 효과가 소실되므로 우회제제(bypassing agents)가 사용된다.활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBAⓇ)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSevenⓇ)가 대표적이다. 그러나 혈우병 A와 달리 에미시주맙은 FVIII 기능을 모방하는 기전이기 때문에 혈우병 B 환자에게는 효과가 없다. 따라서 억제인자 환자의 치료는 여전히 제한적이며, 새로운 치료 전략이 필요한 영역이다.3. 비응고인자 기반 치료(Non-factor Therapy) 혈우병 B에서도 비응고인자 기반 치료가 적용될 수 있다. 이들 약제는 특정 응고인자를 보충하지 않고 응고 균형 자체를 조절하는 기전을 갖는다. 대표적으로 RNA 간섭 기반의 피투시란(Fitusiran)은 간세포에서 항트롬빈 합성을 억제하여 응고 활성을 증가시키며, 혈우병 A와 B 모두에 승인되었다.또한 항 TFPI 항체인 콘시주맙(Concizumab, Alhemo®) 역시 혈우병 A와 B 모두에 적용 가능하며, 내인성 응고경로를 촉진하여 출혈을 억제한다. 이처럼 비응고인자 기반 치료는 억제인자 보유 여부와 관계없이 사용할 수 있는 장점이 있어, 혈우병 B 환자에서도 중요한 치료 대안으로 부상하고 있다.4. 유전자 치료(Gene Therapy) 혈우병 B는 유전자 치료 분야에서 가장 먼저 성과를 낸 질환 중 하나이다. FIX 유전자의 크기가 FVIII보다 작아 AAV 벡터 전달이 용이하기 때문에, 임상개발이 상대적으로 앞서 진행되었다.대표적인 약제는 헴제닉스(HemgenixⓇ, Etranacogene dezaparvovec)으로, 2022년 미국 FDA와 2023년 유럽 EMA에서 세계 최초로 혈우병 유전자 치료제로 승인되었다. 단회 정맥투여만으로 간세포에서 FIX 발현이 장기간 유지될 수 있으며, 환자의 치료 부담을 획기적으로 줄일 수 있다. 그러나 여전히 발현 지속 기간의 변동성, 간효소 상승, 재투여 불가 등의 문제점이 존재하며, 고가의 치료비용 역시 중요한 사회적 논의 대상이 되고 있다.피투시란은 어떤 약제인가?피투시란은 안티트롬빈(AT) mRNA를 절단·분해하여 AT 발현을 억제함으로써 혈중 AT 농도를 감소시키는 기전을 가진다. siRNA 치료제는 RNAi 과정을 활용하는 대표적인 플랫폼으로, 표적 mRNA를 인식하고 분해하도록 설계된 합성 RNA 이중가닥 구조를 기반으로 한다. 이 과정은 특정 단백질의 번역을 저해하여 표적 단백질의 합성을 효과적으로 억제한다.피투시란은 화학적으로 안정화된 이중가닥 siRNA로 설계되어 뉴클레아제에 의한 분해나 Toll-like receptor(TLR)3, TLR7 등 선천면역 수용체의 인식을 회피한다. 특히 리보뉴클레오티드의 2′-데옥시-2′-플루오로 치환, 2′-O-메틸 치환, 인산 골격의 선택적 변형이 적용되어 높은 안정성과 생체 내 지속성을 확보하였다.이 siRNA는 삼중 안테나(tri-antenna) 형태의 N-아세틸갈락토사민(GalNAc) 잔기와 결합되어 있으며, 간세포 표면의 아실글리코프로테인 수용체(asialoglycoprotein receptor, ASGPR)를 통해 효율적으로 간세포 내로 전달된다. 세포 내로 흡수된 후 산성 환경에서 siRNA는 ASGPR로부터 해리되고, 엔도솜을 탈출하여 세포질 내 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 탑재된다.RISC는 siRNA의 안티센스(antisense) 가닥을 선택적으로 유지하고, 이를 이용해 표적 유전자인 SERPINC1 mRNA를 서열 특이적으로 절단·분해함으로써 AT 발현을 억제한다. 이 과정의 결과로 혈중 AT 농도가 감소하며, 그에 따라 트롬빈 생성이 증가하여 혈우병 환자의 응고능이 향상된다.RISC 내 안티센스 가닥은 세포 내에서 수 주간 안정적으로 존재하면서 반복적으로 전사체 절단을 매개하므로, 세포당 수백 개 수준의 siRNA 분자만으로도 강력하고 지속적인 knockdown 효과를 낸다. 이러한 특성 덕분에 피투시란은 임상시험에서 한 달에 한 번의 피하 투여만으로도 충분한 약효를 유지할 수 있는 장점을 보인다.Antithrombin Knockdown by Fitusiran(출처: Molecular Therapy Vol. 28 No 3 April 2020).피투시란의 약리 기전은?피투시란은 간에서 합성되는 AT(antithrombin) mRNA를 표적하는 siRNA로 개발된 약제로, 항트롬빈 발현을 효율적으로 억제함으로써 체내의 친응고 상태를 강화하는 새로운 치료 전략이다.즉, AT 억제 작용을 통해 내인성 및 외인성 경로 모두에서 Factor Xa와 트롬빈의 활성을 증가시켜 응고 연쇄의 효율성을 회복시키며, 그 결과 FVIII 또는 FIX 결핍이 있는 혈우병 환자에서도 출혈 위험을 효과적으로 감소시킨다.The Role of Thrombin and Antithrombin in Hemostasis, and the Mechanism of Action of Fitusiran(출처: Res Pract Thromb Haemost. 2023;7:e100179).피투시란은 혈우병 A 또는 B 환자의 출혈 예방을 위해 2개월에 한 번 피하 주사로 투여된다. 초기 권장 용량은 50mg이며, 이후 항트롬빈 활성도를 모니터링하여 용량과 투여 간격을 조정한다. 목표 AT 활성도는 15~35% 사이로 유지하는 것이 바람직하다.AT 활성도가 15% 미만으로 떨어질 경우 용량을 줄이고, 35% 이상으로 증가하면 용량을 늘릴 수 있다. 예를 들어, 50mg을 2개월 간격으로 투여하던 환자의 AT 활성도가 35%를 초과할 경우, 동일 용량을 매월 투여하도록 변경할 수 있다.약동학 연구에서 피투시란은 혈장에서 비교적 짧은 반감기(약 3~5시간)를 보였으나, 모든 임상시험 용량군에서 투여 중단 후에도 수개월간 AT 감소 효과가 지속되었다. 평균 AT 회복 속도는 한 달에 약 10~15% 수준이었으며, 이 기간 동안 트롬빈 생성은 억제되고 출혈 사건 발생 위험은 증가하는 경향을 보였다.투여 중단 후 약 5개월 시점에서 중앙값 AT 수치는 약 60% 이상으로 회복되었다. 약력학적 분석 결과, AT 억제 효과는 첫 투여 후 약 15~28일 사이에 나타났으며, 개인 간 AT 감소 정도에는 차이가 있으나 개인 내에서는 일정하게 유지되어 지속적인 지혈 보호 효과를 제공하는 것으로 확인되었다.피투시란은 또한 비인자(non-factor) 치료제 중 유일하게 특정 역전제(reversal agent)를 보유한 약제로, 이는 재조합 또는 혈장 유래 항트롬빈 제제 형태로 제공된다. 이러한 역전제는 돌파성 출혈 시 다른 지혈제와 병용할 경우 혈전증 위험을 조절할 수 있다는 점에서 임상적으로 중요한 의미를 갖는다.한편, 혈중 AT 감소가 표준 응고 검사에 직접적인 영향을 미치지 않는다는 점은, CFC(concentrated factor concentrate) 또는 BPA(bypassing agent)를 사용하는 상황이나 수술 시 지혈 상태 및 인자 수치를 보다 용이하게 모니터링할 수 있음을 시사한다.피투시란(QFITLIA)의 허가임상은 어떠한가?성인 및 12세 이상의 소아 환자에서 억제인자(inhibitors)의 존재 여부와 관계없이 혈우병 A 또는 B를 가진 환자에서 QFITLIA의 유효성과 안전성은 두 건의 임상시험에서 입증되었다.-억제인자가 있는 혈우병 A 또는 B: ATLAS-INH -억제인자가 없는 혈우병 A 또는 B: ATLAS-A/B위의 본 임상시험에 참여한 환자들은 장기 연장 연구인 ATLAS-OLE로 이월되었다.임상시험 ATLAS-INH 및 ATLAS-A/B에서는 QFITLIA 80mg 고정 월 1회 용량을 시험하였다. 그러나 이 용량에서 혈전성 사건(thrombotic events)이 발생하여, ATLAS-OLE에서는 항트롬빈(AT) 활성 15–35%를 목표로 하는 QFITLIA AT-DR 용법이 도입되었다.AT-DR 용법은 ATLAS-INH 및 ATLAS-A/B 연구가 거의 완료될 시점에 도입되었으므로, QFITLIA AT-DR 치료의 유효성은 장기 연장 연구 ATLAS-OLE에서 얻어진 AT-DR 치료 데이터를 ATLAS-INH 및 ATLAS-A/B 연구의 대조(control) 데이터와 비교하여 평가되었다.유효성 분석은 본 임상시험들의 무작위 배정(randomization)을 보존하면서, 부모 연구(parent studies)에서의 의도한 치료(intent-to-treat, ITT) 원칙에 따라 수행되었다.[ATLAS-INH] ATLAS-INH은 혈우병 A 또는 B 환자 중 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체를 가진 성인 및 소아 남성 환자(≥12세) 57명을 대상으로 실시된 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 이들은 모두 과거에 출혈 시 우회제제(BPAs)를 필요에 따라(episodic, on-demand) 투여받은 병력이 있었다.대상 환자들은 2:1 비율로 무작위 배정되어, 월 1회 80mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=38)과, 돌발 출혈(breakthrough bleeding) 발생 시 BPA를 필요에 따라 투여받은 군(N=19)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg 용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다. 현재 50mg과 20mg이 허가되어 있다.[ATLAS A/B] ATLAS A/B는 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체가 없는 혈우병 A 또는 B 환자를 대상으로 한 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 대상자는 모두 성인 및 소아 남성(≥12세)으로, 과거에 출혈 시 응고인자제제(CFC)를 필요에 따라(on-demand, episodic) 투여받은 병력이 있었다.대상 환자 120명은 2:1 비율로 무작위 배정되어, 월 1회 80 mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=80)과, 돌발 출혈 발생 시 CFC를 필요에 따라 투여받은 군(N=40)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다.[ATLAS-OLE] 총 227명의 환자가 두 임상시험(ATLAS-INH 및 ATLAS-A/B)과, CFC 또는 BPA 예방요법을 받던 환자를 대상으로 한 교차 임상시험 ATLAS-PPX에서 이월되어 ATLAS-OLE 연구에서 QFITLIA 치료를 받았다. 이 다기관 공개 연장 임상시험은 FVIII 또는 FIX 억제항체 유무와 관계없이, 12세 이상의 성인 및 소아 남성 혈우병 A 또는 B 환자에서 QFITLIA의 장기적인 안전성과 유효성을 평가하였다.대상자는 초기에는 월 1회 80mg QFITLIA 피하 주사를 투여받았으나, 연구가 개정되어 AT-DR(항트롬빈 활성 15–35% 목표) 용법의 유효성과 안전성을 평가하도록 설계가 변경되었다. 이후 총 213명의 환자가 AT-DR로 전환되었다.AT-DR에서는 시작 용량이 50mg 격월(2개월 간격) 투여였으며, INNOVANCE Antithrombin 분석법을 이용해 측정한 AT 활성 수치에 따라 개별적으로 용량을 조정하였다. 용량은 50mg 월 1회 또는 80mg 월 1회로 증량하거나, 20mg 격월 또는 20mg 월 1회로 감량할 수 있었다.AT 활성 수치가 최저 용량에서도2025-10-23 23:25:17최병철 박사
세계 첫 항체 무관 혈우병 A·B 치료제 '피투시란'큐피틀리아(Qfitlia, 성분명 피투시란, Fitusiran, 사노피)는 GalXC 기술 플랫폼을 기반으로 개발된 항트롬빈(antithrombin)을 표적으로 하는 소간섭 리보핵산(small interfering RNA, siRNA) 치료제다.이 약제는 2024년 유럽의약청(EMA) 에서, 이어 올해 3월 미국 식품의약국(FDA) 에서 제VIII인자 또는 제IX인자 억제인자(inhibitor)의 유무와 관계없이, 12세 이상 성인 및 소아 혈우병 A 또는 B 환자에서 출혈 에피소드의 발생을 예방하거나 빈도를 감소시키기 위한 정기적 예방요법(routine prophylaxis)에 ‘두 달에 한번 피하주사’로 승인되었다. 국내에서는 올해 5월 희귀의약품(Orphan drug) 으로 지정되었다.혈우병(hemophilia)은 X염색체 연관 열성 유전질환으로, 제Ⅷ인자(FVIII) 또는 제Ⅸ인자(FIX) 의 결핍으로 인해 혈액응고 연쇄반응(coagulation cascade) 이 정상적으로 진행되지 못하며, 그 결과 트롬빈(thrombin) 생성 부족으로 지혈(hemostasis) 이 저하된다. 이러한 병태생리적 이상은 반복적인 출혈, 특히 관절 출혈을 초래하여 만성 관절병증(chronic arthropathy) 및 삶의 질 저하로 이어진다.기존의 표준 치료는 응고인자제제(clotting factor concentrate, CFC) 의 정맥 내 투여를 통한 인자 보충요법(replacement therapy) 이었다. 그러나 이 방식은 정맥 투여의 불편성, 반복적 투여 부담, 그리고 항체(억제인자, inhibitor) 형성으로 인한 치료 저항성이라는 한계를 지닌다.이에 따라 최근에는 비(非)응고인자 기반 치료(non-factor therapy) 의 개발이 활발히 이루어지고 있으며, 그중에서도 RNA 간섭(RNA interference, RNAi) 기술을 이용한 피투시란(Fitusiran) 은 새로운 치료 옵션으로 주목 받고 있다.피투시란은 간세포 내에서 항트롬빈(antithrombin, AT) 합성을 억제하도록 설계된 siRNA 기반 치료제로, 내인성 응고 조절 인자의 발현을 조절함으로써 응고 균형(hemostatic balance) 을 회복시키는 새로운 접근법을 제시한다.피투시란의 승인은 다국가, 무작위배정, 대조, 3상 임상시험들로 구성된 ATLAS 임상 프로그램의 결과를 근거로 하였다.이 프로그램에는 ATLAS-A/B, ATLAS-INH, 그리고 ATLAS-PPX 연구가 포함되며, 각각 혈우병 A 또는 B 환자 중 인자 억제인자의 유무, 그리고 기존 예방요법(prophylaxis) 사용 여부에 따라 구분되었다.ATLAS-A/B 연구는 억제인자가 없는(non-inhibitor) 혈우병 A 또는 B 환자를 대상으로, ATLAS-INH 연구는 억제인자가 존재하는(inhibitor-positive) 환자를 대상으로 수행되었다. ATLAS-PPX 연구는 기존 예방요법을 받고 있던 환자에서 피투시란으로 전환했을 때의 출혈률 변화를 평가하였다.이들 연구에서 피투시란은 월 1회 피하주사(subcutaneous injection) 투여만으로도 연간 출혈률(annualized bleeding rate, ABR)을 기존 치료 대비 약 90% 이상 유의하게 감소시켰으며, 절반 이상의 환자에서 무출혈(ABR = 0)이 관찰되었다. 또한 억제인자 유무와 관계없이 일관된 출혈 억제 효과가 확인되었다.혈우병이란 무엇인가?혈우병(hemophilia)은 그리스어 ‘hemo(피)’와 ‘philia(사랑하다)’에서 유래한 용어로, 1828년 Schönlein에 의해 Hämophilie라 명명됐다. 19세기 말 유럽 왕실 내 근친혼으로 인해 영국, 스페인, 독일, 러시아 등 여러 나라에서 다수의 환자가 발생하면서 ‘왕실병(The Royal Disease)’이라는 별칭을 얻었다.혈우병은 혈액응고인자의 결핍으로 인해 발생하는 대표적인 선천성 출혈성 질환이다. 제VIII응고인자(FVIII)의 결핍은 혈우병 A로, 전체 환자의 약 80~85%를 차지하며 ‘고전적 혈우병(classic hemophilia)’이라 불린다. 제IX응고인자(FIX)의 결핍은 혈우병 B로 약 15%를 차지하며, 최초 환자의 이름을 따 ‘크리스마스병(Christmas disease)’으로도 알려져 있다. 제XI응고인자(FXI)의 결핍은 혈우병 C로 상대적으로 드물게 발생한다.혈우병 A와 B는 X 염색체 열성 유전 양식을 가지므로 주로 남성에서 발병하며, 여성은 보인자로 존재하거나 드물게 태아기에 사망하기도 한다. 반면 혈우병 C는 4번 염색체 이상에 기인하므로 성별에 관계없이 발생할 수 있으며, 일부 환자에서는 가족력 없이 자연 발생적 유전자 변이에 의해 발현되기도 한다.혈우병과 유사한 질환으로는 폰빌레브란트병(von Willebrand disease, vWD)이 있다. 이는 응고인자 VIII과 결합하는 폰빌레브란트인자(vWF)의 결핍으로 인해 혈우병과 유사한 임상 양상을 보인다.이외에도 프로트롬빈(II), 피브리노겐(I), V, VII, X, XII, XIII 응고인자의 결핍으로 인한 선천성 응고장애가 보고되어 있으나, 이러한 질환들은 혈우병의 범주에는 포함되지 않는다.혈액응고 과정은 어떻게 일어나는가?혈액응고는 인체의 항상성을 유지하기 위한 필수적인 생리적 방어기전으로, 외상이나 혈관 손상 시 과도한 출혈을 방지하는 역할을 한다. 이 과정은 혈관수축, 혈소판 기능, 그리고 혈액응고인자의 연속적인 활성화로 이루어지는 응고 연쇄(cascade)로 설명되며, 궁극적으로 안정적인 피브린 혈전(fibrin clot)을 형성한다.혈액응고인자(Coagulation factors)는 주로 간에서 합성되는 단백질로, 로마 숫자로 표기된 I번부터 XIII번까지의 인자가 알려져 있다. 이들은 각각 특정 효소 활성 또는 보조인자로 작용하면서 정교하고 단계적인 반응을 매개한다. 주요 응고인자로는 피브리노겐(Factor I), 프로트롬빈(Factor II), 그리고 프로트롬빈 복합체를 구성하는 V, VII, IX, X, XI, XII 인자, 마지막으로 XIII 인자 등이 있다. 응고 연쇄는 크게 내인성 경로(intrinsic pathway), 외인성 경로(extrinsic pathway), 그리고 두 경로가 합류하는 공통 경로(common pathway)로 구성된다.내인성 경로는 Factor XII의 활성화를 시작으로 XI, IX, VIII 인자가 순차적으로 활성화되며, 외인성 경로는 조직인자(tissue factor, TF)와 Factor VII의 상호작용을 통해 개시된다.두 경로는 Factor X의 활성화 단계에서 공통 경로로 수렴하며, 활성화된 Factor X는 Factor V와 결합하여 프로트롬비나제(prothrombinase) 복합체를 형성한다. 이 복합체는 프로트롬빈(Factor II)을 트롬빈(thrombin)으로 전환시키고, 생성된 트롬빈은 피브리노겐(Factor I)을 불용성 피브린(fibrin)으로 전환시켜 최종적으로 혈전을 완성한다.또한 트롬빈은 Factor V, VIII, XI 등을 다시 활성화시키는 양성 되먹임(positive feedback) 작용을 통해 응고 반응을 증폭시키며, Factor XIII을 활성화시켜 피브린 가교결합(fibrin cross-linking)을 형성함으로써 혈전의 안정성을 더욱 높인다.이러한 정교한 연쇄 반응은 항응고 단백질(antithrombin, protein C/S system 등)과 섬유소 용해(fibrinolysis) 기전 간의 정밀한 균형 속에서 조절된다. 이 균형이 깨질 경우 출혈성 질환이나 혈전성 질환으로 이어질 수 있다.항트롬빈(Antithrombin, AT, heparin cofactor I)은 어떤 물질인가?항트롬빈(AT)은 혈액응고 조절에서 가장 중요한 내인성 항응고인자로, 전체 생리적 응고 억제 작용의 약 70~80%를 담당하는 핵심 단백질이다. AT는 혈장에 존재하는 세린 단백질분해효소 억제제(serpin) 계열의 당단백질로, 주된 표적은 트롬빈(thrombin)이지만, Factor Xa, IXa, XIa, XIIa 및 칼리크레인(kallikrein) 등 다양한 혈액응고인자를 동시에 억제함으로써 응고 연쇄(cascade) 전반의 균형 유지에 기여한다.The Coagulation Cascade(출처: Ann Pharmacother . 2016 Sep;50(9):758-67). AT는 트롬빈의 활성 중심부에 위치한 세린(serine) 잔기와 1:1 비율로 결합하여 불활성 복합체를 형성함으로써 트롬빈 활성을 차단한다. 이를 통해 소규모 응고 반응이나 불필요한 혈전 형성을 신속히 억제하며, 정상적인 생리 상태에서 과도한 혈액응고를 방지하는 핵심 역할을 수행한다.그러나 대규모 혈관 손상이나 파종성 혈관내응고(Disseminated intravascular coagulation, DIC)와 같이 트롬빈 생성이 폭발적으로 증가하는 상황에서는 AT의 억제 능력이 상대적으로 부족해져, 생리적 항응고 메커니즘만으로는 병적 혈전 형성을 완전히 제어하기 어렵다.AT의 항응고 활성이 가장 강력하게 발휘되는 조건은 헤파린(heparin)의 존재 하에서이다. 헤파린은 AT에 결합하여 구조적 변화를 유도하고, AT와 트롬빈 및 Factor Xa 간의 결합 친화도를 수백 배 이상 증폭시킨다.이로 인해 헤파린은 AT의 촉매제(cofactor) 역할을 하며, 임상적으로 항응고 효과를 발휘하는 주요 기전이 바로 AT 매개 억제 반응이다. 이러한 이유로 AT 결핍 환자에서는 헤파린의 항응고 효과가 현저히 감소하며, 이는 선천성 또는 후천성 AT 결핍에서 혈전성 질환 발생 위험이 증가하는 중요한 근거가 된다.AT는 간에서 합성되며 혈중 농도는 약 0.15mg/mL로 유지되고, 정상 활성도는 80~120% 범위 내에 있다. 선천성 AT 결핍은 드문 질환이지만 정맥혈전증과 폐색전증 발생의 중요한 위험 요인으로 알려져 있으며, 후천성 결핍은 간질환, 신증후군, DIC, 항응고제 치료 등 다양한 상황에서 관찰된다. AT 농도의 감소는 항응고 균형을 무너뜨려 과도한 혈전 형성을 유발하므로, 임상적으로 AT 농축제제 보충 또는 헤파린·직접 트롬빈 억제제와 같은 항응고 요법을 병행하는 치료 전략이 고려된다.이처럼 AT는 단순한 혈액응고인자 억제 단백질을 넘어, 혈액응고와 항응고, 그리고 섬유소 용해(fibrinolysis) 시스템 사이의 미세한 균형을 유지하는 핵심 조절인자로서, 혈전성 질환의 병태생리 이해와 새로운 항응고 치료제 개발에 있어 중요한 연구 대상이 되고 있다.혈우병 A 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor Replacement Therapy) 혈우병 A의 전통적인 치료는 부족한 제Ⅷ인자(FVIII)를 직접 보충하는 방식이다. 초기에는 혈액 유래 FVIII 제제가 사용되었으나, 감염 위험 등 안전성 문제가 제기되면서 현재는 재조합 FVIII(rFVIII)이 표준으로 자리잡았다. 또한 최근에는 반감기를 연장한 FVIII 제제들이 개발되어 투여 빈도를 줄이고 환자 순응도를 높이는 데 기여하고 있다.1) 표준 반감기(Standard half-life, SHL) FVIII 제제 표준 반감기 제제는 혈액 유래 FVIII와 재조합 FVIII로 나눌 수 있다. 혈액 유래 제제는 감염 위험 관리가 필요하지만 여전히 일부에서 사용되고 있으며, 재조합 FVIII로 애드베이트(AdvateⓇ, 코지네이트 에프에스(Kogenate FSⓇ) 등은 안전성 측면에서 더 선호된다.2) 반감기 연장형(Extended half-life, EHL) FVIII 제제 반감기 연장형 제제는 투여 간격을 늘리기 위해 Fc-fusion(엘록테이트, EloctateⓇ), PEGylation(애디노베이트, AdynovateⓇ, 지비, JiviⓇ) 등 다양한 기술이 적용되었다. 이러한 약제들은 환자의 주사 횟수를 줄여 장기적인 치료 순응도를 개선하는 장점이 있다.3) VWF-independent EHL(VWF 비의존성 반감기 연장형) FVIII 제제 VWF 비의존성 반감기 연장형 제제인 알투비오(AltuviiioⓇ)는 주 1회 주사로 FVIII 활성을 더 오래 유지할 수 있도록 설계된 최신형 지속형 치료제(high sustained factor, HSF)로 2023년 미 FDA에서 승인되었고 국내에서는 진행중이다,2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 A 환자의 약 20~30%는 치료 과정에서 FVIII에 대한 억제항체를 형성하게 되며, 이 경우 기존의 FVIII 보충요법은 효과가 제한적이다. 억제인자 환자의 치료에는 크게 두 가지 접근법이 있다.첫째, 우회제제(bypassing agents, BPA)를 사용하는 방법이다. 활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBAⓇ)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSevenⓇ)는 응고경로를 우회적으로 활성화하여 지혈 효과를 발휘하지만, 지혈 반응의 변동성과 혈전 위험이라는 한계가 존재한다.둘째, 에미시주맙(Emicizumab, HemlibraⓇ)는 FIXa와 FX를 연결하여 FVIII의 기능을 모방하는 이중특이성 항체로, 억제인자 환자뿐 아니라 비(非)억제인자 환자에서도 예방요법으로 사용 가능하다. 피하 주사로 1주~4주 간격 투여가 가능하여 투여 편의성이 획기적으로 개선되었다.3. 대체 인자제제(Replacement therapy) 재조합 돼지 유래 FVIII(r-pFVIII)인 오비주르(Obizur®, Susoctocog alfa)는 2014년 미 FDA, 2015년 EMA 그리고 2023년 국내에서 ‘성인 후천성 혈우병 A(Acquired Haemophilia A, AHA) 환자의 출혈 에피소드 치료’에 승인되었다. 후천성 혈우병 A는 선천성 혈우병과 다르게, 정상 혈액응고인자 VIII(FVIII) 수준을 가지고 있지만, 이에 대해 자가면역 항체(중화 항체)가 생겨 혈액 응고 기능이 저해되어 출혈 위험이 커지는 인구 100만 명당 약 1명꼴로 발생하는 초희귀 자가면역 응고질환이다.4. 비응고인자 기반 치료(Non-factor Therapy) 최근 혈우병 A 치료에서 가장 주목받는 변화는 FVIII를 직접 보충하지 않고, 다른 경로를 통해 응고 균형을 회복하는 비응고인자 기반 치료이다. 대표적인 약제가 에미시주맙(Emicizumab, HemlibraⓇ)으로, FIXa와 FX을 연결하여 FVIII의 보조인자 기능을 모방하는 이중특이성 항체이다. 피하 주사로 주 1회, 격주, 또는 4주 간격 투여가 가능해 환자의 치료 편의성이 획기적으로 개선되었다.이외에도 피투시란(Fitusiran)과 콘시주맙(Concizumab, Alhemo®)가 있다. 피투시란은 RNA 간섭(RNAi) 기술을 이용하여 간세포에서 항트롬빈 합성을 억제함으로써 응고 활성을 높인다. 월 1회 피하 주사가 가능하지만, 혈전 및 간독성 발생 위험으로 인해 항트롬빈 활성(15–35%)을 유지하는 개별화 용량조절(AT-DR)이 필요하다. 콘시주맙은 조직인자경로억제인자(TFPI)를 차단하여 내인성 응고를 촉진하는 약제이다.5. 유전자 치료(Gene Therapy) 혈우병 A에서 유전자 치료는 단회 정맥투여를 통해 간세포에 FVIII 유전자를 도입하여 장기간 발현을 유도하는 새로운 전략이다. 대표적인 약제가 록타비안(RoctavianⓇ, Valoctocogene roxaparvovec)으로, AAV5 벡터를 이용해 개발되었으며 2022년 유럽, 2023년 미국 FDA의 승인을 받았다.단일 투여로 FVIII 발현을 장기간 유지할 수 있어 치료 패러다임의 변화를 예고했으나, 발현 지속 기간의 불확실성, 간효소 상승, 재투여 불가 등의 문제점이 여전히 남아 있다.혈우병 B 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor IX Replacement Therapy) 혈우병 B의 가장 기본적인 치료는 부족한 제Ⅸ인자(FIX)를 직접 보충하는 방식이다. 과거에는 혈액 유래 제제가 널리 사용되었으나, 감염 위험 문제로 현재는 재조합 FIX(rFIX) 제제가 주로 사용된다. 여기에 더해 반감기를 연장한 제제들이 개발되면서 투여 간격이 길어지고 환자의 치료 순응도가 크게 향상되었다.1) 표준 반감기(Standard half-life, SHL) FIX 제제 표준 반감기 FIX 제제는 투여 후 약 18~24시간의 반감기를 가지며, 주 2~3회 정맥 주사가 필요하다. 혈액 유래 FIX 제제는 여전히 일부에서 사용되지만, 바이러스 감염에 대한 안전성 우려가 있었다. 이를 보완하기 위해 개발된 재조합 FIX 제제인 베네픽스(BeneFIXⓇ, Nonacog alfa)는 안전성이 확보되어 현재 임상에서 가장 널리 사용되고 있다.2) 반감기 연장(Extended half-life, EHL) FIX 제제 반감기 연장 제제는 기존 표준 제제보다 3~5배 긴 반감기를 가지며, 1~2주 간격으로 투여가 가능하다. 이들 약제에는 Fc-fusion 단백을 이용한 알프로릭스(Alprolix(Ⓡ, Eftrenonacog alfa), albumin-fusion 기술이 적용된 아이델비온(IdelvionⓇ Albutrepenonacog alfa) 등이 포함된다. 이러한 제제들은 주사 횟수를 줄여 환자의 삶의 질과 치료 순응도를 높이는 중요한 진보로 평가된다.2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 B 환자에서 억제인자 발생은 상대적으로 드물지만, 일단 형성되면 치료가 매우 어렵다. 억제인자가 형성된 경우 기존 FIX 제제의 효과가 소실되므로 우회제제(bypassing agents)가 사용된다.활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBAⓇ)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSevenⓇ)가 대표적이다. 그러나 혈우병 A와 달리 에미시주맙은 FVIII 기능을 모방하는 기전이기 때문에 혈우병 B 환자에게는 효과가 없다. 따라서 억제인자 환자의 치료는 여전히 제한적이며, 새로운 치료 전략이 필요한 영역이다.3. 비응고인자 기반 치료(Non-factor Therapy) 혈우병 B에서도 비응고인자 기반 치료가 적용될 수 있다. 이들 약제는 특정 응고인자를 보충하지 않고 응고 균형 자체를 조절하는 기전을 갖는다. 대표적으로 RNA 간섭 기반의 피투시란(Fitusiran)은 간세포에서 항트롬빈 합성을 억제하여 응고 활성을 증가시키며, 혈우병 A와 B 모두에 승인되었다.또한 항 TFPI 항체인 콘시주맙(Concizumab, Alhemo®) 역시 혈우병 A와 B 모두에 적용 가능하며, 내인성 응고경로를 촉진하여 출혈을 억제한다. 이처럼 비응고인자 기반 치료는 억제인자 보유 여부와 관계없이 사용할 수 있는 장점이 있어, 혈우병 B 환자에서도 중요한 치료 대안으로 부상하고 있다.4. 유전자 치료(Gene Therapy) 혈우병 B는 유전자 치료 분야에서 가장 먼저 성과를 낸 질환 중 하나이다. FIX 유전자의 크기가 FVIII보다 작아 AAV 벡터 전달이 용이하기 때문에, 임상개발이 상대적으로 앞서 진행되었다.대표적인 약제는 헴제닉스(HemgenixⓇ, Etranacogene dezaparvovec)으로, 2022년 미국 FDA와 2023년 유럽 EMA에서 세계 최초로 혈우병 유전자 치료제로 승인되었다. 단회 정맥투여만으로 간세포에서 FIX 발현이 장기간 유지될 수 있으며, 환자의 치료 부담을 획기적으로 줄일 수 있다. 그러나 여전히 발현 지속 기간의 변동성, 간효소 상승, 재투여 불가 등의 문제점이 존재하며, 고가의 치료비용 역시 중요한 사회적 논의 대상이 되고 있다.피투시란은 어떤 약제인가?피투시란은 안티트롬빈(AT) mRNA를 절단·분해하여 AT 발현을 억제함으로써 혈중 AT 농도를 감소시키는 기전을 가진다. siRNA 치료제는 RNAi 과정을 활용하는 대표적인 플랫폼으로, 표적 mRNA를 인식하고 분해하도록 설계된 합성 RNA 이중가닥 구조를 기반으로 한다. 이 과정은 특정 단백질의 번역을 저해하여 표적 단백질의 합성을 효과적으로 억제한다.피투시란은 화학적으로 안정화된 이중가닥 siRNA로 설계되어 뉴클레아제에 의한 분해나 Toll-like receptor(TLR)3, TLR7 등 선천면역 수용체의 인식을 회피한다. 특히 리보뉴클레오티드의 2′-데옥시-2′-플루오로 치환, 2′-O-메틸 치환, 인산 골격의 선택적 변형이 적용되어 높은 안정성과 생체 내 지속성을 확보하였다.이 siRNA는 삼중 안테나(tri-antenna) 형태의 N-아세틸갈락토사민(GalNAc) 잔기와 결합되어 있으며, 간세포 표면의 아실글리코프로테인 수용체(asialoglycoprotein receptor, ASGPR)를 통해 효율적으로 간세포 내로 전달된다. 세포 내로 흡수된 후 산성 환경에서 siRNA는 ASGPR로부터 해리되고, 엔도솜을 탈출하여 세포질 내 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 탑재된다.RISC는 siRNA의 안티센스(antisense) 가닥을 선택적으로 유지하고, 이를 이용해 표적 유전자인 SERPINC1 mRNA를 서열 특이적으로 절단·분해함으로써 AT 발현을 억제한다. 이 과정의 결과로 혈중 AT 농도가 감소하며, 그에 따라 트롬빈 생성이 증가하여 혈우병 환자의 응고능이 향상된다.RISC 내 안티센스 가닥은 세포 내에서 수 주간 안정적으로 존재하면서 반복적으로 전사체 절단을 매개하므로, 세포당 수백 개 수준의 siRNA 분자만으로도 강력하고 지속적인 knockdown 효과를 낸다. 이러한 특성 덕분에 피투시란은 임상시험에서 한 달에 한 번의 피하 투여만으로도 충분한 약효를 유지할 수 있는 장점을 보인다.Antithrombin Knockdown by Fitusiran(출처: Molecular Therapy Vol. 28 No 3 April 2020).피투시란의 약리 기전은?피투시란은 간에서 합성되는 AT(antithrombin) mRNA를 표적하는 siRNA로 개발된 약제로, 항트롬빈 발현을 효율적으로 억제함으로써 체내의 친응고 상태를 강화하는 새로운 치료 전략이다.즉, AT 억제 작용을 통해 내인성 및 외인성 경로 모두에서 Factor Xa와 트롬빈의 활성을 증가시켜 응고 연쇄의 효율성을 회복시키며, 그 결과 FVIII 또는 FIX 결핍이 있는 혈우병 환자에서도 출혈 위험을 효과적으로 감소시킨다.The Role of Thrombin and Antithrombin in Hemostasis, and the Mechanism of Action of Fitusiran(출처: Res Pract Thromb Haemost. 2023;7:e100179).피투시란은 혈우병 A 또는 B 환자의 출혈 예방을 위해 2개월에 한 번 피하 주사로 투여된다. 초기 권장 용량은 50mg이며, 이후 항트롬빈 활성도를 모니터링하여 용량과 투여 간격을 조정한다. 목표 AT 활성도는 15~35% 사이로 유지하는 것이 바람직하다.AT 활성도가 15% 미만으로 떨어질 경우 용량을 줄이고, 35% 이상으로 증가하면 용량을 늘릴 수 있다. 예를 들어, 50mg을 2개월 간격으로 투여하던 환자의 AT 활성도가 35%를 초과할 경우, 동일 용량을 매월 투여하도록 변경할 수 있다.약동학 연구에서 피투시란은 혈장에서 비교적 짧은 반감기(약 3~5시간)를 보였으나, 모든 임상시험 용량군에서 투여 중단 후에도 수개월간 AT 감소 효과가 지속되었다. 평균 AT 회복 속도는 한 달에 약 10~15% 수준이었으며, 이 기간 동안 트롬빈 생성은 억제되고 출혈 사건 발생 위험은 증가하는 경향을 보였다.투여 중단 후 약 5개월 시점에서 중앙값 AT 수치는 약 60% 이상으로 회복되었다. 약력학적 분석 결과, AT 억제 효과는 첫 투여 후 약 15~28일 사이에 나타났으며, 개인 간 AT 감소 정도에는 차이가 있으나 개인 내에서는 일정하게 유지되어 지속적인 지혈 보호 효과를 제공하는 것으로 확인되었다.피투시란은 또한 비인자(non-factor) 치료제 중 유일하게 특정 역전제(reversal agent)를 보유한 약제로, 이는 재조합 또는 혈장 유래 항트롬빈 제제 형태로 제공된다. 이러한 역전제는 돌파성 출혈 시 다른 지혈제와 병용할 경우 혈전증 위험을 조절할 수 있다는 점에서 임상적으로 중요한 의미를 갖는다.한편, 혈중 AT 감소가 표준 응고 검사에 직접적인 영향을 미치지 않는다는 점은, CFC(concentrated factor concentrate) 또는 BPA(bypassing agent)를 사용하는 상황이나 수술 시 지혈 상태 및 인자 수치를 보다 용이하게 모니터링할 수 있음을 시사한다.피투시란(QFITLIA)의 허가임상은 어떠한가?성인 및 12세 이상의 소아 환자에서 억제인자(inhibitors)의 존재 여부와 관계없이 혈우병 A 또는 B를 가진 환자에서 QFITLIA의 유효성과 안전성은 두 건의 임상시험에서 입증되었다.-억제인자가 있는 혈우병 A 또는 B: ATLAS-INH -억제인자가 없는 혈우병 A 또는 B: ATLAS-A/B위의 본 임상시험에 참여한 환자들은 장기 연장 연구인 ATLAS-OLE로 이월되었다.임상시험 ATLAS-INH 및 ATLAS-A/B에서는 QFITLIA 80mg 고정 월 1회 용량을 시험하였다. 그러나 이 용량에서 혈전성 사건(thrombotic events)이 발생하여, ATLAS-OLE에서는 항트롬빈(AT) 활성 15–35%를 목표로 하는 QFITLIA AT-DR 용법이 도입되었다.AT-DR 용법은 ATLAS-INH 및 ATLAS-A/B 연구가 거의 완료될 시점에 도입되었으므로, QFITLIA AT-DR 치료의 유효성은 장기 연장 연구 ATLAS-OLE에서 얻어진 AT-DR 치료 데이터를 ATLAS-INH 및 ATLAS-A/B 연구의 대조(control) 데이터와 비교하여 평가되었다.유효성 분석은 본 임상시험들의 무작위 배정(randomization)을 보존하면서, 부모 연구(parent studies)에서의 의도한 치료(intent-to-treat, ITT) 원칙에 따라 수행되었다.[ATLAS-INH] ATLAS-INH은 혈우병 A 또는 B 환자 중 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체를 가진 성인 및 소아 남성 환자(≥12세) 57명을 대상으로 실시된 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 이들은 모두 과거에 출혈 시 우회제제(BPAs)를 필요에 따라(episodic, on-demand) 투여받은 병력이 있었다.대상 환자들은 2:1 비율로 무작위 배정되어, 월 1회 80mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=38)과, 돌발 출혈(breakthrough bleeding) 발생 시 BPA를 필요에 따라 투여받은 군(N=19)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg 용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다. 현재 50mg과 20mg이 허가되어 있다.[ATLAS A/B] ATLAS A/B는 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체가 없는 혈우병 A 또는 B 환자를 대상으로 한 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 대상자는 모두 성인 및 소아 남성(≥12세)으로, 과거에 출혈 시 응고인자제제(CFC)를 필요에 따라(on-demand, episodic) 투여받은 병력이 있었다.대상 환자 120명은 2:1 비율로 무작위 배정되어, 월 1회 80 mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=80)과, 돌발 출혈 발생 시 CFC를 필요에 따라 투여받은 군(N=40)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다.[ATLAS-OLE] 총 227명의 환자가 두 임상시험(ATLAS-INH 및 ATLAS-A/B)과, CFC 또는 BPA 예방요법을 받던 환자를 대상으로 한 교차 임상시험 ATLAS-PPX에서 이월되어 ATLAS-OLE 연구에서 QFITLIA 치료를 받았다. 이 다기관 공개 연장 임상시험은 FVIII 또는 FIX 억제항체 유무와 관계없이, 12세 이상의 성인 및 소아 남성 혈우병 A 또는 B 환자에서 QFITLIA의 장기적인 안전성과 유효성을 평가하였다.대상자는 초기에는 월 1회 80mg QFITLIA 피하 주사를 투여받았으나, 연구가 개정되어 AT-DR(항트롬빈 활성 15–35% 목표) 용법의 유효성과 안전성을 평가하도록 설계가 변경되었다. 이후 총 213명의 환자가 AT-DR로 전환되었다.AT-DR에서는 시작 용량이 50mg 격월(2개월 간격) 투여였으며, INNOVANCE Antithrombin 분석법을 이용해 측정한 AT 활성 수치에 따라 개별적으로 용량을 조정하였다. 용량은 50mg 월 1회 또는 80mg 월 1회로 증량하거나, 20mg 격월 또는 20mg 월 1회로 감량할 수 있었다.AT 활성 수치가 최저 용량에서도2025-10-23 23:25:17최병철 박사 -
 '당뇨약 사업과 시너지'...혈당측정기에 꽂힌 제약사들[데일리팜=김진구 기자] 당뇨병 치료제 시장의 확대와 함께 국내제약사들이 혈당측정기 사업에도 박차를 가하는 모습이다.최근 대세로 떠오른 연속혈당측정기(CGM) 영역에선 국내외 의료기기업체와 손을 잡는 방식으로 대웅제약·휴온스·한독이 경쟁 중인 가운데 동아에스티가 경쟁 합류를 예고했다. 여전히 수요가 큰 자가혈당측정기(BGM) 시장에선 유한양행이 최근 시장에 신규 진입했고 녹십자엠에스가 신제품 발매로 입지를 강화하고 있다.제약사들이 혈당측정기에 주목하는 이유는 당뇨 영역에서 치료제와의 시너지가 가능하기 때문이다. 각 제약사가 보유한 당뇨병 치료제와의 연계를 통해 통합 관리 플랫폼의 구축이 가능한 데다, 소모품이나 센서를 주기적으로 교체하는 구조로 혈당측정기 자체 매출도 확보할 수 있다는 분석이다.국내 연속혈당측정기 시장, 제약사-의료기기업체 협업 경쟁22일 제약업계에 따르면 동아에스티는 최근 아이센스와 연속혈당측정기 ‘케어센스 에어’ 전문가용 판매 계약을 체결했다. 아이센스는 전문가용 연속혈당측정기를 동아에스티에 공급하고, 동아에스티는 국내 병의원을 대상으로 영업·마케팅과 유통을 담당한다.이번 협약으로 동아에스티는 국내 연속혈당측정기 시장에 새롭게 뛰어들었다. 이를 통해 기존에 시장에 진출한 대웅제약·휴온스·한독과의 경쟁에 나선다. 국내제약사들은 의료기기 업체와 손잡고 제품을 판매하는 방식으로 연속혈당측정기 시장에서 경쟁 중이다. 휴온스는 2018년부터 글로벌 헬스케어 기업 덱스콤과 손잡고 연속혈당측정기 '덱스콤 G' 시리즈를 국내 판매하고 있다. 대웅제약은 애보트와 협력해 2020년 이후 ‘프리스타일 리브레’를 판매 중이다.한독은 지난 2024년 4월 아이센스와 연속혈당측정기 ‘바로잰 Fit’의 국내 영업·마케팅 계약을 체결했다. 아이센스는 동일 제품을 동아에스티와 한독을 통해 각각 공급한다. 동아에스티를 통해 자체 브랜드인 케어센스 에어의 전문가용 제품을, 한독을 통해선 별도 브랜드로 바로잰 Fit를 판매한다.연 700억원 규모 CGM 시장…최근 급성장하며 신제품 경쟁↑연속혈당측정기는 피부에 삽입하는 바늘이 달린 '센서'와 측정 혈당 값을 전송하는 '트랜스미터'로 구성돼, 연속적인 혈당 변화를 스마트폰 앱으로 관찰할 수 있다. 정확한 혈당 측정은 물론 적극적이고 효율적인 당뇨 관리가 가능하다.시장 규모는 연 700억원 규모로 추산된다. 전반적으로는 휴온스-덱스콤과 대웅제약-애보트가 주도하고, 나머지 제품들이 추격하는 양상이다.최근 시장이 급성장하면서 경쟁이 더욱 치열해지고 있다. 앞다퉈 업그레이드 제품을 발매하며 입지 강화에 나서고 있다. 휴온스와 덱스콤은 지난해 1월 덱스콤 G7을 발매했다. 기존 모델 대비 크기가 작아졌고, 시스템 예열 시간이 단축됐다. 2023년 11월엔 카카오헬스케어와의 판매협력 계약을 통해 영향력을 더욱 확대했다. 대웅제약과 애보트는 지난해 6월 사용 편의성이 개선된 ‘프리스타일 리브레2’를 발매했다. 한독과 아이센스 역시 올해 5월 실시간 혈당 모니터링 기능 등이 추가된 업그레이드 제품을 발매했다.신규 업체의 시장 진입도 예상된다. 이오플로우는 지난해 중국 당뇨 전문 의료기기업체인 시노케어와 연속혈당측정기를 국내 독점 공급하는 계약을 체결했다. 이후 3~4개 제약사와 국내 유통을 두고 협상을 진행했다. 유엑스엔도 연속혈당측정기 개발이 마무리 단계인 것으로 알려졌다. 제품 개발이 완료될 경우 국내제약사와의 협업이 전망된다.자가혈당측정기 경쟁도 지속…유한양행 시장 신규 진입시장에선 자가혈당측정기(BGM)의 존재감도 여전히 크다. 연속혈당측정기와 달리 환자가 매번 직접 채혈한 뒤 혈당을 측정해야 하지만, 오랜 기간 당뇨병 환자들이 혈당을 측정해왔던 방식인 데다 경제적으로 저렴하기 때문에 높은 수요가 유지되고 있다.관련 업체들도 꾸준히 신제품을 선보이며 경쟁력을 강화하고 있다. 녹십자엠에스는 지난 20일 ‘GC Fit 혈당측정기(GGP-100)’를 출시했다. 기존 제품과 대비해 측정 정확도와 사용 편의성을 개선한 제품이다. 동시에 원가를 절감해 수익성을 높였다.유한양행은 지난 6월 ‘유한당체크’라는 제품을 발매하며 혈당측정기 사업에 새롭게 뛰어들었다. 오상헬스케어가 개발하고 유한양행이 판매하는 제품으로, 시중 제품 대비 사용 편의성을 개선했다. 유한양행은 이 제품을 중심으로 디지털 당뇨 관리 플랫폼을 구축하고, 향후 연속혈당측정기와 같은 연계 서비스 영역으로의 확장 가능성을 모색한다는 방침이다.제약업계, 약물·기기 연계한 당뇨병 통합 관리 강화제약사들이 혈당측정기 사업에 뛰어드는 배경으로 당뇨병 치료제 사업과의 시너지가 꼽힌다. 전국적 판매망을 보유한 상황에서 기존의 영업 네트워크를 활용한 판매가 가능하다. 또한 혈당측정기를 통한 당뇨병 진단·관리에서 자사 의약품 처방으로 이어지는 선순환 구조를 구축할 수 있다.혈당측정기 자체 사업성도 높다는 분석이다. 혈당측정기 제품 특성상 소모품과 센서를 주기적으로 구매해야 하기 때문이다. 실제 대웅제약은 지난해 프리스타일 리브레를 통해 300억원 가까운 매출을 올렸다. 한독은 바로잰과 바로잰Fit으로 지난해 약 200억원의 매출을 기록했다. 휴온스는 올해 2분기 덱스콤G7이 분기 최대 매출을 기록했다고 설명했다.처방현장에서 혈당측정기의 쓰임새가 확대되고 있다는 점도 배경으로 지목된다. 최근 1형 당뇨병에 급여가 적용됐고, 2형 당뇨병 급여에 대한 목소리가 높아지는 추세다. 대한당뇨병학회는 '2025 당뇨병 진료지침' 개정을 통해 연속혈당측정기 사용 권고 수준을 기존의 '제한적 권고'에서 '일반적 권고'로 상향 조정했다. 중증 2형 당뇨병 환자로 연속혈당측정기 급여가 확대될 경우 약 150만명이 혜택을 받을 것으로 예상된다.중장기적으로는 디지털 헬스케어 영역으로의 확대를 노리고 있다. 최근 당뇨병 관리는 약물 처방에서 생활습관·식단·운동까지 포괄하는 통합 솔루션으로 확장되는 추세다. 혈당 변동을 실시간 모니터링하고 약물 복용 패턴과 생활습관을 분석하는 플랫폼 구축은 디지털 헬스케어 영역에서 제약사의 장기적 경쟁력으로 이어질 수 있다는 분석이다.2025-10-22 12:00:15김진구
'당뇨약 사업과 시너지'...혈당측정기에 꽂힌 제약사들[데일리팜=김진구 기자] 당뇨병 치료제 시장의 확대와 함께 국내제약사들이 혈당측정기 사업에도 박차를 가하는 모습이다.최근 대세로 떠오른 연속혈당측정기(CGM) 영역에선 국내외 의료기기업체와 손을 잡는 방식으로 대웅제약·휴온스·한독이 경쟁 중인 가운데 동아에스티가 경쟁 합류를 예고했다. 여전히 수요가 큰 자가혈당측정기(BGM) 시장에선 유한양행이 최근 시장에 신규 진입했고 녹십자엠에스가 신제품 발매로 입지를 강화하고 있다.제약사들이 혈당측정기에 주목하는 이유는 당뇨 영역에서 치료제와의 시너지가 가능하기 때문이다. 각 제약사가 보유한 당뇨병 치료제와의 연계를 통해 통합 관리 플랫폼의 구축이 가능한 데다, 소모품이나 센서를 주기적으로 교체하는 구조로 혈당측정기 자체 매출도 확보할 수 있다는 분석이다.국내 연속혈당측정기 시장, 제약사-의료기기업체 협업 경쟁22일 제약업계에 따르면 동아에스티는 최근 아이센스와 연속혈당측정기 ‘케어센스 에어’ 전문가용 판매 계약을 체결했다. 아이센스는 전문가용 연속혈당측정기를 동아에스티에 공급하고, 동아에스티는 국내 병의원을 대상으로 영업·마케팅과 유통을 담당한다.이번 협약으로 동아에스티는 국내 연속혈당측정기 시장에 새롭게 뛰어들었다. 이를 통해 기존에 시장에 진출한 대웅제약·휴온스·한독과의 경쟁에 나선다. 국내제약사들은 의료기기 업체와 손잡고 제품을 판매하는 방식으로 연속혈당측정기 시장에서 경쟁 중이다. 휴온스는 2018년부터 글로벌 헬스케어 기업 덱스콤과 손잡고 연속혈당측정기 '덱스콤 G' 시리즈를 국내 판매하고 있다. 대웅제약은 애보트와 협력해 2020년 이후 ‘프리스타일 리브레’를 판매 중이다.한독은 지난 2024년 4월 아이센스와 연속혈당측정기 ‘바로잰 Fit’의 국내 영업·마케팅 계약을 체결했다. 아이센스는 동일 제품을 동아에스티와 한독을 통해 각각 공급한다. 동아에스티를 통해 자체 브랜드인 케어센스 에어의 전문가용 제품을, 한독을 통해선 별도 브랜드로 바로잰 Fit를 판매한다.연 700억원 규모 CGM 시장…최근 급성장하며 신제품 경쟁↑연속혈당측정기는 피부에 삽입하는 바늘이 달린 '센서'와 측정 혈당 값을 전송하는 '트랜스미터'로 구성돼, 연속적인 혈당 변화를 스마트폰 앱으로 관찰할 수 있다. 정확한 혈당 측정은 물론 적극적이고 효율적인 당뇨 관리가 가능하다.시장 규모는 연 700억원 규모로 추산된다. 전반적으로는 휴온스-덱스콤과 대웅제약-애보트가 주도하고, 나머지 제품들이 추격하는 양상이다.최근 시장이 급성장하면서 경쟁이 더욱 치열해지고 있다. 앞다퉈 업그레이드 제품을 발매하며 입지 강화에 나서고 있다. 휴온스와 덱스콤은 지난해 1월 덱스콤 G7을 발매했다. 기존 모델 대비 크기가 작아졌고, 시스템 예열 시간이 단축됐다. 2023년 11월엔 카카오헬스케어와의 판매협력 계약을 통해 영향력을 더욱 확대했다. 대웅제약과 애보트는 지난해 6월 사용 편의성이 개선된 ‘프리스타일 리브레2’를 발매했다. 한독과 아이센스 역시 올해 5월 실시간 혈당 모니터링 기능 등이 추가된 업그레이드 제품을 발매했다.신규 업체의 시장 진입도 예상된다. 이오플로우는 지난해 중국 당뇨 전문 의료기기업체인 시노케어와 연속혈당측정기를 국내 독점 공급하는 계약을 체결했다. 이후 3~4개 제약사와 국내 유통을 두고 협상을 진행했다. 유엑스엔도 연속혈당측정기 개발이 마무리 단계인 것으로 알려졌다. 제품 개발이 완료될 경우 국내제약사와의 협업이 전망된다.자가혈당측정기 경쟁도 지속…유한양행 시장 신규 진입시장에선 자가혈당측정기(BGM)의 존재감도 여전히 크다. 연속혈당측정기와 달리 환자가 매번 직접 채혈한 뒤 혈당을 측정해야 하지만, 오랜 기간 당뇨병 환자들이 혈당을 측정해왔던 방식인 데다 경제적으로 저렴하기 때문에 높은 수요가 유지되고 있다.관련 업체들도 꾸준히 신제품을 선보이며 경쟁력을 강화하고 있다. 녹십자엠에스는 지난 20일 ‘GC Fit 혈당측정기(GGP-100)’를 출시했다. 기존 제품과 대비해 측정 정확도와 사용 편의성을 개선한 제품이다. 동시에 원가를 절감해 수익성을 높였다.유한양행은 지난 6월 ‘유한당체크’라는 제품을 발매하며 혈당측정기 사업에 새롭게 뛰어들었다. 오상헬스케어가 개발하고 유한양행이 판매하는 제품으로, 시중 제품 대비 사용 편의성을 개선했다. 유한양행은 이 제품을 중심으로 디지털 당뇨 관리 플랫폼을 구축하고, 향후 연속혈당측정기와 같은 연계 서비스 영역으로의 확장 가능성을 모색한다는 방침이다.제약업계, 약물·기기 연계한 당뇨병 통합 관리 강화제약사들이 혈당측정기 사업에 뛰어드는 배경으로 당뇨병 치료제 사업과의 시너지가 꼽힌다. 전국적 판매망을 보유한 상황에서 기존의 영업 네트워크를 활용한 판매가 가능하다. 또한 혈당측정기를 통한 당뇨병 진단·관리에서 자사 의약품 처방으로 이어지는 선순환 구조를 구축할 수 있다.혈당측정기 자체 사업성도 높다는 분석이다. 혈당측정기 제품 특성상 소모품과 센서를 주기적으로 구매해야 하기 때문이다. 실제 대웅제약은 지난해 프리스타일 리브레를 통해 300억원 가까운 매출을 올렸다. 한독은 바로잰과 바로잰Fit으로 지난해 약 200억원의 매출을 기록했다. 휴온스는 올해 2분기 덱스콤G7이 분기 최대 매출을 기록했다고 설명했다.처방현장에서 혈당측정기의 쓰임새가 확대되고 있다는 점도 배경으로 지목된다. 최근 1형 당뇨병에 급여가 적용됐고, 2형 당뇨병 급여에 대한 목소리가 높아지는 추세다. 대한당뇨병학회는 '2025 당뇨병 진료지침' 개정을 통해 연속혈당측정기 사용 권고 수준을 기존의 '제한적 권고'에서 '일반적 권고'로 상향 조정했다. 중증 2형 당뇨병 환자로 연속혈당측정기 급여가 확대될 경우 약 150만명이 혜택을 받을 것으로 예상된다.중장기적으로는 디지털 헬스케어 영역으로의 확대를 노리고 있다. 최근 당뇨병 관리는 약물 처방에서 생활습관·식단·운동까지 포괄하는 통합 솔루션으로 확장되는 추세다. 혈당 변동을 실시간 모니터링하고 약물 복용 패턴과 생활습관을 분석하는 플랫폼 구축은 디지털 헬스케어 영역에서 제약사의 장기적 경쟁력으로 이어질 수 있다는 분석이다.2025-10-22 12:00:15김진구 -
 국내 희귀약 지정 RNAi 기반 PH1 치료제 '네도시란'리브플로자(RivflozaⓇ, 성분명: 네도시란, Nedosiran, 노보 노디스크)는 GalXC RNAi 기술 플랫폼을 기반으로 개발된 희귀 유전질환 치료제다. 미 FDA는 2023년 9월 이 약제를 ‘원발성 고옥살뇨증 1형(Primary hyperoxaluria type 1, PH1) 치료제’로 승인했으며, 국내에서는 2025년 6월 희귀의약품으로 지정했다.네도시란은 간에서 lactate dehydrogenase type A(LDH-A)를 표적으로 하는 소간섭 RNA(siRNA) 치료제로, 2세 이상 소아 및 성인에서 신기능이 비교적 보존된(eGFR ≥30mL/min/1.73m²) PH1 환자의 요중 옥살산(urinary oxalate, Uox) 수치를 낮추는 것을 적응증으로 한다.PH1은 드문 유전성 대사질환으로, 간세포의 alanine-glyoxylate aminotransferase(AGXT) 결핍으로 인해 glyoxylate가 비정상적으로 축적되고 최종적으로 oxalate가 과잉 생성되는 것이 특징이다.그 결과 만성 고옥살산뇨증이 발생하며, 반복적인 칼슘 옥살산(calcium oxalate) 신장결석, 점진적인 신기능 저하, 전신 옥살산 침착(systemic oxalosis)으로 이어져 많은 환자들이 조기에 말기 신부전(ESKD)에 도달한다.네도시란의 미 FDA 승인은 2상 핵심 임상시험 PHYOX2와 3상 연장 연구 PHYOX3의 중간 분석 결과를 근거로 이뤄졌다. PHYOX2는 리브플로자와 위약을 비교한 무작위 배정, 이중맹검, 위약 대조 임상시험으로, 주요 평가 변수(primary endpoint)를 충족했다.치료군에서는 투여 90일부터 180일까지 24시간 요중 옥살산 배설량(AUC24-hour Uox)이 기저치 대비 유의하게 감소하였다. 또한 PHYOX3 중간 분석 결과에 따르면, 리브플로자를 추가로 6개월간 투여한 환자군에서 요중 옥살산 감소 효과가 지속적으로 유지되는 것으로 나타났다.원발성 고옥살산뇨증 1형(Primary Hyperoxaluria type 1, PH1)는 어떤 질환인가?원발성 고옥살산뇨증(Primary Hyperoxaluria, PH)은 glyoxylate 대사 효소의 결핍으로 인해 oxalate가 과도하게 생성돼 신장결석, 신부전, 전신 옥살산증으로 이어지는 희귀 유전질환이다. PH는 원인 유전자에 따라 PH1, PH2, PH3의 세 가지 아형으로 분류되며, 모두 glyoxylate 축적을 특징으로 하지만 관여하는 효소(AGT, GRHPR, HOGA1)가 서로 달라 임상 양상과 질환의 중증도에 차이를 보인다.이러한 효소 결손으로 인해 glyoxylate가 효율적으로 glycine으로 대사되지 못하고, 결국 oxalate로 과잉 전환된다. 그 결과 신장에서 칼슘 옥살산(calcium oxalate) 결석과 신부전이 발생하며, 전신 조직에 oxalate가 침착되는 systemic oxalosis로 진행될 수 있다. 특히 PH1 환자에서의 만성적인 고옥살산 배설은 삶의 질을 현저히 저해할 뿐 아니라 조기 신부전으로 이어지는 경우가 많아 예후가 불량하다.기존 치료법으로는 고용량 피리독신(pyridoxine) 투여와 수분 섭취가 사용됐으나, 효과가 제한적이며 궁극적으로 간 이식 또는 간-신장 동시 이식이 필요하다. 또 이식 치료는 높은 수술 위험과 제한된 공여자 문제로 인해 근본적 해결책이 되지 못한다. 이러한 한계를 극복하기 위한 전략으로 RNA 간섭(RNAi) 기반 치료제가 개발되었으며, 대표적으로 glycolate oxidase(HAO1) 또는 LDHA를 표적으로 하는 접근이 주목 받고 있다.옥살산(Oxalate)은 어떤 작용을 하는가?혈중 oxalate는 간의 내인성 합성과 장에서의 식이 흡수를 통해 기인한다. 인간은 oxalate를 분해하는 효소를 보유하지 않으므로, 체내 oxalate는 반드시 신장을 통해 배설된다. 그러나 세뇨관 내에서 oxalate는 칼슘과 결합하여 불용성 결정체인 칼슘 옥살산(calcium oxalate)을 형성할 수 있으며, 이는 신장결석 및 옥살산 신병증으로 이어질 수 있다.간에서의 옥살산 합성은 원발성 고옥살산뇨증의 병태생리에 핵심적이다. PH1은 AGXT, PH2는 GRHPR, PH3는 HOGA1 유전자의 결손으로 발생하며, 이들 결손은 공통적으로 glyoxylate 축적을 유발한다. 과도한 glyoxylate는 비정상적으로 간 LDH-A(Lactate Dehydrogenase A)에 의해 oxalate로 전환되며, 이 과정이 oxalate 과잉 생성의 주요 원인으로 작용한다.한편, 장에서의 식이 oxalate 흡수 역시 혈중 농도에 기여한다. 대부분은 세포 간격을 통한 수동적 흡수에 의존하지만, 일부 능동적 분비 기전도 보고되었다. 특히 Oxalobacter formigenes를 비롯한 장내 세균은 oxalate 분해 또는 SLC26A6 경로를 통한 분비 촉진에 기여할 수 있어, 장내 미생물 조절은 잠재적 치료 전략으로 주목받고 있다. Generation and Elimination of Oxalate and Potential Therapeutic Targets(출처: Clinical Kidney Journal, 2022, vol. 15, Suppl 1, i17–i22).PH1에서 옥살산(Oxalate)과 LDHA는 어떤 관계인가? Oxalate는 자연계에 존재하는 단순 이염기성 카르복실산으로, 칼슘염인 calcium oxalate(CaOx)의 낮은 용해도 때문에 임상적으로 중요한 의미를 갖는다. 사람에서는 oxalate가 대사의 최종 산물로 더 이상 분해되지 않으며, 정상적인 경우 대부분 신장을 통해 배설된다.그러나 원발성 고옥살산뇨증(PH) 환자에서는 과도한 oxalate 생성으로 인해 CaOx 결정이 신장과 요로에 침착하게 되고, 이로 인해 신석회증(nephrocalcinosis)이나 요로결석이 발생할 수 있으며, 질병이 진행하면 전신성 옥살산증(systemic oxalosis)으로 이어질 수 있다.이러한 CaOx 결정은 단순히 기계적인 조직 손상을 일으킬 뿐만 아니라 염증 반응과 산화 스트레스를 촉발하여 신기능 저하를 가속화한다. 그 결과 혈장 내 oxalate 농도가 더욱 상승하게 되고, 이는 다시 결정 형성을 촉진하는 악순환을 형성한다.사람에서 oxalate는 대부분 내인성 합성으로부터 기인하며, 식이를 통한 장내 흡수는 상대적으로 기여도가 낮다. 내인성 합성의 중심에는 glyoxylate가 있으며, 이는 젖산탈수소효소(lactate dehydrogenase, LDH)에 의해 oxalate로 산화된다. 따라서 모든 유형의 PH는 glyoxylate 대사 이상과 밀접하게 연관되어 있다.특히 PH1에서는 간 퍼옥시좀에 존재하는 alanine:glyoxylate aminotransferase(AGT)가 결핍되면서 glyoxylate가 glycine으로 전환되지 못하고, 대신 비정상적으로 LDH 경로를 통해 oxalate로 축적된다. 이 과정에는 glycolate, 아스코르빈산, 하이드록시프롤린 등의 대사 산물도 oxalate 합성에 추가적으로 기여한다. 결국 PH의 병태생리는 간에서의 과도한 glycolate 축적과 LDH 매개 oxalate 합성이 핵심 기전으로 작용하며, 이러한 분자적 이상은 임상적으로 신장 결석과 전신 합병증을 초래한다.최근 이러한 병태생리에 착안하여 LDH isoenzyme인 LDH-A를 직접 억제하는 RNA 간섭(RNAi) 기반 치료제인 네도시란(Nedosiran)이 개발되었다. 전임상 연구와 임상시험에서 네도시란은 혈중 및 요중 oxalate 수치를 유의하게 감소시키는 효과를 보여주었고, 이는 LDHA가 단순히 해당과정(glycolysis)의 보조 효소에 그치는 것이 아니라 PH1 치료에서 혁신적이고 유망한 타깃으로 기능할 수 있음을 보여준다.그러나 LDHA 억제 전략이 장기적으로 안전한지, 간 외(extra-hepatic) 조직에 미치는 영향은 어떠한지, 나아가 PH2나 PH3 같은 다른 아형에서도 적용될 수 있는지 여부는 여전히 연구가 필요한 부분이다. 따라서 PH1에서 LDHA 억제의 기전적 의미와 임상적 근거를 검토하고, 향후 치료 전략으로서 확장될 가능성을 고찰하는 일은 학문적·임상적으로 매우 중요한 과제가 된다.원발성 고옥살산뇨증 1형(PH1)의 치료 방법은?기존 치료 전략은 다량의 수분 섭취, 알칼리 요법, 일부 환자에서의 고용량 피리독신 반응에 의존해 왔으나, 질환 진행을 근본적으로 억제하기에는 불충분하다. 궁극적 치료로 제시된 간 혹은 간-신장 동시 이식은 이식 관련 위험성과 기증자 제한이라는 큰 장벽을 가진다.이러한 한계를 극복하기 위해 최근에는 RNA 간섭RNAi) 기술을 이용한 혁신적 치료 전략이 개발되고 있다. 대표적으로 glycolate oxidase(Hao1) 억제를 통한 루마시란(Lumasiran)이 임상에서 입증되었으며, 이어서 LDH-A를 표적으로 하는 네도시란(Nedosiran)이 차세대 치료제로 주목받고 있다.LDH-A는 해당과정의 최종 단계에서 피루브산을 젖산으로 환원하는 효소이지만, 동시에 글리옥실산 대사 경로와 연결되어 PH1에서 옥살산 과생산에 기여한다. 따라서 LDH-A의 억제는 간세포에서 옥살산 생성을 근본적으로 차단할 수 있는 새로운 접근법이다.네도시란은 어떤 약제인가?네도시란(Nedosiran)은 GalNAc 접합 siRNA 플랫폼을 기반으로 간세포에 특이적으로 전달되어 LDH-A 발현을 억제한다. 초기 임상 연구에서 네도시란은 PH1 환자뿐 아니라 PH2, PH3 등 다양한 PH 아형에서도 요중 옥살산 수치를 유의미하게 감소시켰으며, 이는 단일 아형에 국한되지 않는 광범위한 치료 가능성을 보여주었다. 또한 월 1회 피하 투여라는 단순화된 투여 방식은 환자 순응도를 높혔다.PHYOX-1 연구는 무작위, 단일 상승 용량(randomized, single-ascending-dose)의 제1상 임상시험으로, PH1 또는 PH2 환자 18명과 건강한 성인 대조군 25명을 대상으로 피하 주사된 네도시란의 안전성, 약동학, 약력학 및 옥살산 대사에 미치는 효과를 평가하였다.이 연구에서 성인 환자들은 57일차에 24시간 요 옥살산 배설(24-h UOx)이 평균 최대 55% 감소하였으며, 전체 환자의 67%가 정상 또는 정상에 근접한 24시간 요 옥살산 배설치를 달성하였다.LDH-A가 간과 근육에서 모두 발현되기 때문에, 이러한 접근이 근육에서 간외적 부작용(extrahepatic side effects)을 유발할 가능성에 대한 우려가 있었다. 그러나 생쥐 및 영장류를 대상으로 한 전임상 자료에서는 RNAi에 의한 LDH-A 억제가 UOx 배설을 감소시키는 효과를 보였고, GalNAc 태그를 활용함으로써 효과가 간 특이적으로 나타났으며 근육을 포함한 다른 조직에서는 표적 외 효과(off-target effect)가 관찰되지 않았다.또한 보고된 인간 LDH-A 결핍 사례들은 유의한 근육 관련 표현형을 보이지 않았으며, PHYOX-1 1상 연구에 참여한 건강한 지원자들에서도 약물 관련 근골격계 이상반응은 보고되지 않았다. 더 나아가, 네도시란 투여군에서는 위약군과 비교했을 때 혈장 젖산, 피루브산, 크레아틴 키나아제 농도의 유의한 변화가 관찰되지 않았다.따라서 현재까지의 근거는 간의 LDH-A를 표적으로 하는 네도시란의 사용이 모든 유형의 PH 환자에서 안전하고 유망한 접근법임을 시사한다. 다만, PH1 및 PH2 환자를 대상으로 한 위약 대조 이중맹검 제3상 임상시험이 진행 중이며, 그 결과는 아직 발표되지 않았다.네도시란과 루마시란과의 차이점은 무엇인가?최근 RNA 간섭(RNAi) 기술을 이용하여 간세포의 특정 효소를 선택적으로 억제하는 새로운 치료 전략이 등장하였다. 그 중 루마시란(Lumasiran)은 glycolate oxidase(HAO1)를 표적으로 하여 글리콜산이 글리옥실산으로 전환되는 상류 단계에서 대사 흐름을 차단함으로써 옥살산 생성을 억제한다.루마시란은 임상시험에서 PH1 환자에서 유의미한 옥살산 감소 효과를 입증하여, 최초로 승인된 RNAi 기반 PH 치료제로 자리매김하였다. 그러나 이 약제는 PH1 아형에 국한된다는 한계가 존재한다.이와 달리 네도시란(Nedosiran)은 lactate dehydrogenase A(LDHA)를 억제하여 글리옥실산이 옥살산으로 전환되는 최종 단계를 직접 차단하는 기전을 가진다.이러한 작용 기전은 PH1뿐 아니라 PH2, PH3 등 모든 PH 아형에서 공통적으로 적용 가능하다는 점에서 임상적 의미가 크다. 실제 임상 연구에서 네도시란은 다양한 PH 아형 환자에서 요중 옥살산 수치를 유의하게 감소시켜, “pan-PH” 치료제로서의 가능성을 입증하였다.Liver Metabolism of Oxalate and Targets of the Novel RNAi Therapies(출처: Clinical Kidney Journal, 2022, vol. 15, Suppl 1, i17–i22) 따라서 루마시란과 네도시란은 모두 PH 치료의 RNAi 치료제이지만, 적응증 범위와 대사 경로 내 표적 단계의 차이로 인해 임상적 적용 범위가 구분된다.네도시란의 약리 기전은 무엇인가?네도시란은 이중가닥 siRNA로, GalNAc 아미노당 잔기에 결합되어 있다. 피하 주사 후 GalNAc-결합 당은 아실로당단백 수용체(ASGPR)에 결합하여 네도시란을 간세포(hepatocyte)로 전달한다. GalNAc-siRNA-ASGPR 복합체는 세포 내로 유입되어 엔도솜(endosome) 내에서 분리된다. 이후 siRNA는 엔도솜으로부터 방출되고, GalNAc은 분해되어 제거된다. ASGPR을 포함한 소포는 다시 세포막과 융합되어 간세포 표면으로 되돌아가 수용체 순환(recycling)을 마친다.엔도솜에서 방출된 siRNA는 헬리케이스(helicase)에 의해 이중가닥 구조가 풀리고, 안티센스 가닥(antisense strand)은 Ago2 단백질을 포함한 다양한 효소들과 함께 RISC를 형성한다. RISC는 표적 mRNA와 상보적인 염기서열에 결합하며, Ago2는 안티센스 가닥의 5′ 말단에서 10번째와 11번째 염기 사이의 인산다이에스터 결합(phosphodiester bond)을 절단하여 mRNA를 분해하고 유전자 발현을 억제한다.GalNAc facilitates gene silencing through a specific mechanism(출처: Journal of Nanobiotechnology (2024) 22:745). 따라서 네도시란은 RNA 간섭(RNAi)을 통해 간세포 내 LDHA 메신저 리보핵산(mRNA)을 분해함으로써 간성 젖산 탈수소효소(LDH)의 발현 수준을 억제시킨다. LDH-A 억제는 글리옥실레이트(glyoxylate)가 옥살산(oxalate)으로 전환되는 과정을 차단함으로써, 옥살산 대사 경로에서 LDH가 매우 하위 단계에 위치한다는 점 때문에 모든 유형의 PH에서 잠재적 치료 옵션이 된다.네도시란(RIVFLOZA)의 허가임상은 어떠한가? PHYOX2는 RIVFLOZA와 위약을 비교한 무작위, 이중눈가림 임상시험으로, 6세 이상이면서 eGFR ≥30mL/min/1.73m²를 가진 PH1 또는 PH2 환자를 대상으로 진행되었다. PH2 환자는 등록 수가 너무 적어 PH2 집단에서의 유효성을 평가할 수 없었다. 따라서 RIVFLOZA는 PH1 환자에서만 적응증이 승인되었다.환자들은 매월 RIVFLOZA(N=23) 또는 위약(N=12)을 투여받았다. 만 12세 이상, 체중 ≥ 50kg 환자의 용량은 160mg, 만 12세 이상 체중2025-10-09 15:41:17최병철 박사
국내 희귀약 지정 RNAi 기반 PH1 치료제 '네도시란'리브플로자(RivflozaⓇ, 성분명: 네도시란, Nedosiran, 노보 노디스크)는 GalXC RNAi 기술 플랫폼을 기반으로 개발된 희귀 유전질환 치료제다. 미 FDA는 2023년 9월 이 약제를 ‘원발성 고옥살뇨증 1형(Primary hyperoxaluria type 1, PH1) 치료제’로 승인했으며, 국내에서는 2025년 6월 희귀의약품으로 지정했다.네도시란은 간에서 lactate dehydrogenase type A(LDH-A)를 표적으로 하는 소간섭 RNA(siRNA) 치료제로, 2세 이상 소아 및 성인에서 신기능이 비교적 보존된(eGFR ≥30mL/min/1.73m²) PH1 환자의 요중 옥살산(urinary oxalate, Uox) 수치를 낮추는 것을 적응증으로 한다.PH1은 드문 유전성 대사질환으로, 간세포의 alanine-glyoxylate aminotransferase(AGXT) 결핍으로 인해 glyoxylate가 비정상적으로 축적되고 최종적으로 oxalate가 과잉 생성되는 것이 특징이다.그 결과 만성 고옥살산뇨증이 발생하며, 반복적인 칼슘 옥살산(calcium oxalate) 신장결석, 점진적인 신기능 저하, 전신 옥살산 침착(systemic oxalosis)으로 이어져 많은 환자들이 조기에 말기 신부전(ESKD)에 도달한다.네도시란의 미 FDA 승인은 2상 핵심 임상시험 PHYOX2와 3상 연장 연구 PHYOX3의 중간 분석 결과를 근거로 이뤄졌다. PHYOX2는 리브플로자와 위약을 비교한 무작위 배정, 이중맹검, 위약 대조 임상시험으로, 주요 평가 변수(primary endpoint)를 충족했다.치료군에서는 투여 90일부터 180일까지 24시간 요중 옥살산 배설량(AUC24-hour Uox)이 기저치 대비 유의하게 감소하였다. 또한 PHYOX3 중간 분석 결과에 따르면, 리브플로자를 추가로 6개월간 투여한 환자군에서 요중 옥살산 감소 효과가 지속적으로 유지되는 것으로 나타났다.원발성 고옥살산뇨증 1형(Primary Hyperoxaluria type 1, PH1)는 어떤 질환인가?원발성 고옥살산뇨증(Primary Hyperoxaluria, PH)은 glyoxylate 대사 효소의 결핍으로 인해 oxalate가 과도하게 생성돼 신장결석, 신부전, 전신 옥살산증으로 이어지는 희귀 유전질환이다. PH는 원인 유전자에 따라 PH1, PH2, PH3의 세 가지 아형으로 분류되며, 모두 glyoxylate 축적을 특징으로 하지만 관여하는 효소(AGT, GRHPR, HOGA1)가 서로 달라 임상 양상과 질환의 중증도에 차이를 보인다.이러한 효소 결손으로 인해 glyoxylate가 효율적으로 glycine으로 대사되지 못하고, 결국 oxalate로 과잉 전환된다. 그 결과 신장에서 칼슘 옥살산(calcium oxalate) 결석과 신부전이 발생하며, 전신 조직에 oxalate가 침착되는 systemic oxalosis로 진행될 수 있다. 특히 PH1 환자에서의 만성적인 고옥살산 배설은 삶의 질을 현저히 저해할 뿐 아니라 조기 신부전으로 이어지는 경우가 많아 예후가 불량하다.기존 치료법으로는 고용량 피리독신(pyridoxine) 투여와 수분 섭취가 사용됐으나, 효과가 제한적이며 궁극적으로 간 이식 또는 간-신장 동시 이식이 필요하다. 또 이식 치료는 높은 수술 위험과 제한된 공여자 문제로 인해 근본적 해결책이 되지 못한다. 이러한 한계를 극복하기 위한 전략으로 RNA 간섭(RNAi) 기반 치료제가 개발되었으며, 대표적으로 glycolate oxidase(HAO1) 또는 LDHA를 표적으로 하는 접근이 주목 받고 있다.옥살산(Oxalate)은 어떤 작용을 하는가?혈중 oxalate는 간의 내인성 합성과 장에서의 식이 흡수를 통해 기인한다. 인간은 oxalate를 분해하는 효소를 보유하지 않으므로, 체내 oxalate는 반드시 신장을 통해 배설된다. 그러나 세뇨관 내에서 oxalate는 칼슘과 결합하여 불용성 결정체인 칼슘 옥살산(calcium oxalate)을 형성할 수 있으며, 이는 신장결석 및 옥살산 신병증으로 이어질 수 있다.간에서의 옥살산 합성은 원발성 고옥살산뇨증의 병태생리에 핵심적이다. PH1은 AGXT, PH2는 GRHPR, PH3는 HOGA1 유전자의 결손으로 발생하며, 이들 결손은 공통적으로 glyoxylate 축적을 유발한다. 과도한 glyoxylate는 비정상적으로 간 LDH-A(Lactate Dehydrogenase A)에 의해 oxalate로 전환되며, 이 과정이 oxalate 과잉 생성의 주요 원인으로 작용한다.한편, 장에서의 식이 oxalate 흡수 역시 혈중 농도에 기여한다. 대부분은 세포 간격을 통한 수동적 흡수에 의존하지만, 일부 능동적 분비 기전도 보고되었다. 특히 Oxalobacter formigenes를 비롯한 장내 세균은 oxalate 분해 또는 SLC26A6 경로를 통한 분비 촉진에 기여할 수 있어, 장내 미생물 조절은 잠재적 치료 전략으로 주목받고 있다. Generation and Elimination of Oxalate and Potential Therapeutic Targets(출처: Clinical Kidney Journal, 2022, vol. 15, Suppl 1, i17–i22).PH1에서 옥살산(Oxalate)과 LDHA는 어떤 관계인가? Oxalate는 자연계에 존재하는 단순 이염기성 카르복실산으로, 칼슘염인 calcium oxalate(CaOx)의 낮은 용해도 때문에 임상적으로 중요한 의미를 갖는다. 사람에서는 oxalate가 대사의 최종 산물로 더 이상 분해되지 않으며, 정상적인 경우 대부분 신장을 통해 배설된다.그러나 원발성 고옥살산뇨증(PH) 환자에서는 과도한 oxalate 생성으로 인해 CaOx 결정이 신장과 요로에 침착하게 되고, 이로 인해 신석회증(nephrocalcinosis)이나 요로결석이 발생할 수 있으며, 질병이 진행하면 전신성 옥살산증(systemic oxalosis)으로 이어질 수 있다.이러한 CaOx 결정은 단순히 기계적인 조직 손상을 일으킬 뿐만 아니라 염증 반응과 산화 스트레스를 촉발하여 신기능 저하를 가속화한다. 그 결과 혈장 내 oxalate 농도가 더욱 상승하게 되고, 이는 다시 결정 형성을 촉진하는 악순환을 형성한다.사람에서 oxalate는 대부분 내인성 합성으로부터 기인하며, 식이를 통한 장내 흡수는 상대적으로 기여도가 낮다. 내인성 합성의 중심에는 glyoxylate가 있으며, 이는 젖산탈수소효소(lactate dehydrogenase, LDH)에 의해 oxalate로 산화된다. 따라서 모든 유형의 PH는 glyoxylate 대사 이상과 밀접하게 연관되어 있다.특히 PH1에서는 간 퍼옥시좀에 존재하는 alanine:glyoxylate aminotransferase(AGT)가 결핍되면서 glyoxylate가 glycine으로 전환되지 못하고, 대신 비정상적으로 LDH 경로를 통해 oxalate로 축적된다. 이 과정에는 glycolate, 아스코르빈산, 하이드록시프롤린 등의 대사 산물도 oxalate 합성에 추가적으로 기여한다. 결국 PH의 병태생리는 간에서의 과도한 glycolate 축적과 LDH 매개 oxalate 합성이 핵심 기전으로 작용하며, 이러한 분자적 이상은 임상적으로 신장 결석과 전신 합병증을 초래한다.최근 이러한 병태생리에 착안하여 LDH isoenzyme인 LDH-A를 직접 억제하는 RNA 간섭(RNAi) 기반 치료제인 네도시란(Nedosiran)이 개발되었다. 전임상 연구와 임상시험에서 네도시란은 혈중 및 요중 oxalate 수치를 유의하게 감소시키는 효과를 보여주었고, 이는 LDHA가 단순히 해당과정(glycolysis)의 보조 효소에 그치는 것이 아니라 PH1 치료에서 혁신적이고 유망한 타깃으로 기능할 수 있음을 보여준다.그러나 LDHA 억제 전략이 장기적으로 안전한지, 간 외(extra-hepatic) 조직에 미치는 영향은 어떠한지, 나아가 PH2나 PH3 같은 다른 아형에서도 적용될 수 있는지 여부는 여전히 연구가 필요한 부분이다. 따라서 PH1에서 LDHA 억제의 기전적 의미와 임상적 근거를 검토하고, 향후 치료 전략으로서 확장될 가능성을 고찰하는 일은 학문적·임상적으로 매우 중요한 과제가 된다.원발성 고옥살산뇨증 1형(PH1)의 치료 방법은?기존 치료 전략은 다량의 수분 섭취, 알칼리 요법, 일부 환자에서의 고용량 피리독신 반응에 의존해 왔으나, 질환 진행을 근본적으로 억제하기에는 불충분하다. 궁극적 치료로 제시된 간 혹은 간-신장 동시 이식은 이식 관련 위험성과 기증자 제한이라는 큰 장벽을 가진다.이러한 한계를 극복하기 위해 최근에는 RNA 간섭RNAi) 기술을 이용한 혁신적 치료 전략이 개발되고 있다. 대표적으로 glycolate oxidase(Hao1) 억제를 통한 루마시란(Lumasiran)이 임상에서 입증되었으며, 이어서 LDH-A를 표적으로 하는 네도시란(Nedosiran)이 차세대 치료제로 주목받고 있다.LDH-A는 해당과정의 최종 단계에서 피루브산을 젖산으로 환원하는 효소이지만, 동시에 글리옥실산 대사 경로와 연결되어 PH1에서 옥살산 과생산에 기여한다. 따라서 LDH-A의 억제는 간세포에서 옥살산 생성을 근본적으로 차단할 수 있는 새로운 접근법이다.네도시란은 어떤 약제인가?네도시란(Nedosiran)은 GalNAc 접합 siRNA 플랫폼을 기반으로 간세포에 특이적으로 전달되어 LDH-A 발현을 억제한다. 초기 임상 연구에서 네도시란은 PH1 환자뿐 아니라 PH2, PH3 등 다양한 PH 아형에서도 요중 옥살산 수치를 유의미하게 감소시켰으며, 이는 단일 아형에 국한되지 않는 광범위한 치료 가능성을 보여주었다. 또한 월 1회 피하 투여라는 단순화된 투여 방식은 환자 순응도를 높혔다.PHYOX-1 연구는 무작위, 단일 상승 용량(randomized, single-ascending-dose)의 제1상 임상시험으로, PH1 또는 PH2 환자 18명과 건강한 성인 대조군 25명을 대상으로 피하 주사된 네도시란의 안전성, 약동학, 약력학 및 옥살산 대사에 미치는 효과를 평가하였다.이 연구에서 성인 환자들은 57일차에 24시간 요 옥살산 배설(24-h UOx)이 평균 최대 55% 감소하였으며, 전체 환자의 67%가 정상 또는 정상에 근접한 24시간 요 옥살산 배설치를 달성하였다.LDH-A가 간과 근육에서 모두 발현되기 때문에, 이러한 접근이 근육에서 간외적 부작용(extrahepatic side effects)을 유발할 가능성에 대한 우려가 있었다. 그러나 생쥐 및 영장류를 대상으로 한 전임상 자료에서는 RNAi에 의한 LDH-A 억제가 UOx 배설을 감소시키는 효과를 보였고, GalNAc 태그를 활용함으로써 효과가 간 특이적으로 나타났으며 근육을 포함한 다른 조직에서는 표적 외 효과(off-target effect)가 관찰되지 않았다.또한 보고된 인간 LDH-A 결핍 사례들은 유의한 근육 관련 표현형을 보이지 않았으며, PHYOX-1 1상 연구에 참여한 건강한 지원자들에서도 약물 관련 근골격계 이상반응은 보고되지 않았다. 더 나아가, 네도시란 투여군에서는 위약군과 비교했을 때 혈장 젖산, 피루브산, 크레아틴 키나아제 농도의 유의한 변화가 관찰되지 않았다.따라서 현재까지의 근거는 간의 LDH-A를 표적으로 하는 네도시란의 사용이 모든 유형의 PH 환자에서 안전하고 유망한 접근법임을 시사한다. 다만, PH1 및 PH2 환자를 대상으로 한 위약 대조 이중맹검 제3상 임상시험이 진행 중이며, 그 결과는 아직 발표되지 않았다.네도시란과 루마시란과의 차이점은 무엇인가?최근 RNA 간섭(RNAi) 기술을 이용하여 간세포의 특정 효소를 선택적으로 억제하는 새로운 치료 전략이 등장하였다. 그 중 루마시란(Lumasiran)은 glycolate oxidase(HAO1)를 표적으로 하여 글리콜산이 글리옥실산으로 전환되는 상류 단계에서 대사 흐름을 차단함으로써 옥살산 생성을 억제한다.루마시란은 임상시험에서 PH1 환자에서 유의미한 옥살산 감소 효과를 입증하여, 최초로 승인된 RNAi 기반 PH 치료제로 자리매김하였다. 그러나 이 약제는 PH1 아형에 국한된다는 한계가 존재한다.이와 달리 네도시란(Nedosiran)은 lactate dehydrogenase A(LDHA)를 억제하여 글리옥실산이 옥살산으로 전환되는 최종 단계를 직접 차단하는 기전을 가진다.이러한 작용 기전은 PH1뿐 아니라 PH2, PH3 등 모든 PH 아형에서 공통적으로 적용 가능하다는 점에서 임상적 의미가 크다. 실제 임상 연구에서 네도시란은 다양한 PH 아형 환자에서 요중 옥살산 수치를 유의하게 감소시켜, “pan-PH” 치료제로서의 가능성을 입증하였다.Liver Metabolism of Oxalate and Targets of the Novel RNAi Therapies(출처: Clinical Kidney Journal, 2022, vol. 15, Suppl 1, i17–i22) 따라서 루마시란과 네도시란은 모두 PH 치료의 RNAi 치료제이지만, 적응증 범위와 대사 경로 내 표적 단계의 차이로 인해 임상적 적용 범위가 구분된다.네도시란의 약리 기전은 무엇인가?네도시란은 이중가닥 siRNA로, GalNAc 아미노당 잔기에 결합되어 있다. 피하 주사 후 GalNAc-결합 당은 아실로당단백 수용체(ASGPR)에 결합하여 네도시란을 간세포(hepatocyte)로 전달한다. GalNAc-siRNA-ASGPR 복합체는 세포 내로 유입되어 엔도솜(endosome) 내에서 분리된다. 이후 siRNA는 엔도솜으로부터 방출되고, GalNAc은 분해되어 제거된다. ASGPR을 포함한 소포는 다시 세포막과 융합되어 간세포 표면으로 되돌아가 수용체 순환(recycling)을 마친다.엔도솜에서 방출된 siRNA는 헬리케이스(helicase)에 의해 이중가닥 구조가 풀리고, 안티센스 가닥(antisense strand)은 Ago2 단백질을 포함한 다양한 효소들과 함께 RISC를 형성한다. RISC는 표적 mRNA와 상보적인 염기서열에 결합하며, Ago2는 안티센스 가닥의 5′ 말단에서 10번째와 11번째 염기 사이의 인산다이에스터 결합(phosphodiester bond)을 절단하여 mRNA를 분해하고 유전자 발현을 억제한다.GalNAc facilitates gene silencing through a specific mechanism(출처: Journal of Nanobiotechnology (2024) 22:745). 따라서 네도시란은 RNA 간섭(RNAi)을 통해 간세포 내 LDHA 메신저 리보핵산(mRNA)을 분해함으로써 간성 젖산 탈수소효소(LDH)의 발현 수준을 억제시킨다. LDH-A 억제는 글리옥실레이트(glyoxylate)가 옥살산(oxalate)으로 전환되는 과정을 차단함으로써, 옥살산 대사 경로에서 LDH가 매우 하위 단계에 위치한다는 점 때문에 모든 유형의 PH에서 잠재적 치료 옵션이 된다.네도시란(RIVFLOZA)의 허가임상은 어떠한가? PHYOX2는 RIVFLOZA와 위약을 비교한 무작위, 이중눈가림 임상시험으로, 6세 이상이면서 eGFR ≥30mL/min/1.73m²를 가진 PH1 또는 PH2 환자를 대상으로 진행되었다. PH2 환자는 등록 수가 너무 적어 PH2 집단에서의 유효성을 평가할 수 없었다. 따라서 RIVFLOZA는 PH1 환자에서만 적응증이 승인되었다.환자들은 매월 RIVFLOZA(N=23) 또는 위약(N=12)을 투여받았다. 만 12세 이상, 체중 ≥ 50kg 환자의 용량은 160mg, 만 12세 이상 체중2025-10-09 15:41:17최병철 박사 -
 삼진제약-CSL시퀴러스, 플루아드쿼드 신규 광고 캠페인 진행면역증강제 함유 플루아드 쿼드, 신규 광고 캠페인 [데일리팜=황병우 기자] 삼진제약은 CSL시퀴러스코리아와 함께 만 65세 이상 고령층을 대상으로 하는 면역증강 인플루엔자 백신 '플루아드쿼드프리필드시린지(이하 플루아드쿼드)’의 신규 광고 캠페인을 9월 19일부터 본격적으로 진행한다고 밝혔다.삼진제약과 CSL시퀴러스코리아는 면역증강제를 함유한 플루아드쿼드의 특장점을 소비자에게 더욱 효과적으로 알리고자 대중들에게 신뢰도가 높은 방송인 한석준 아나운서를 광고 캠페인 엔도서로 발탁했다.한석준 아나운서는 이번 광고에서 특유의 친근함과 안정감으로 캠페인 메시지를 완벽하게 소화하였으며, 신뢰감을 바탕으로 한 설득력 있는 표현력으로 브랜드가 추구하는 가치를 자연스럽게 전달했다.이번 광고 캠페인에서 삼진제약과 CSL 시퀴러스코리아는 면역증강제 함유 플루아드쿼드의 소비자 브랜드 인지도 제고를 위해 '아드'라는 펫네임을 도입했다.아드는 제품명 플루아드쿼드에서 착안한 명칭으로서, 소비자가 자연스럽게 플루아드쿼드를 기억하고 인식할 수 있도록 하기 위한 이번 광고 캠페인의 핵심 전략이다.삼진제약과 CSL시퀴러스코리아는 이번 광고 캠페인을 TV와 유튜브 등 다양한 디지털 채널로 송출하고 이에 따라 고령층을 비롯 광범위한 연령층을 대상으로 한 면역증강제 함유 플루아드쿼드를 널리 알려 나갈 계획이다.세부적인 전개로는 ▲TVC, 고령층을 대상으로 한 제품 신뢰성 제고 메시지 전달 ▲디지털 채널, 접종을 위한 백신 선택 과정에서 가정 내 고령층을 부양하고 있는 가족들도 참여할 수 있도록 관심 유도 ▲플루아드쿼드의 주 키워드가 설정 된 포털 검색 엔진 가동 등이다.유기승 CSL 시퀴러스코리아 대표는 "한국은 이미 초고령 사회에 진입했으며, 특히 조부모·부모·손주 3대가 함께 교류하는 가족 구조가 일반적이다"라며 "손주로부터 전파된 인플루엔자가 노인에게 치명적인 결과를 초래할 수 있으며, 이는 가정 내 돌봄 공백을 넘어 사회 전반의 돌봄 체계와 공공보건에도 큰 영향을 미친다"고 말했다.그는 이어 "CSL시퀴러스코리아는 삼진제약과 협력해 플루아드쿼드와 같은 효과적인 백신을 안정적으로 공급함으로써, 국내 고령층과 국민 전체의 건강을 보호하고 공중보건 안전 강화에 기여하기 위해 최선을 다하겠다"고 강조했다.김상진 삼진제약 사장은 "이번 광고 캠페인을 통해 고령층에서 인플루엔자 예방에 보다 효과적인 백신은 면역증강제를 함유한 플루아드쿼드 라는 것이 확실하게 인식될 수 있기를 바란다"며 "다가오는 독감 시즌을 맞아 삼진제약은 CSL시퀴러스코리아와 함께 고품질 백신을 안정적으로 공급할 것이고, 이를 통해 고령층을 비롯 국민 모두의 건강을 위한 감염예방에 적극 기여할 수 있도록 최선을 다할 것"이라고 전했다.한편, 플루아드쿼드’는 고령층에서의 면역 반응을 강화하기 위한 면역증강제(MF59)가 함유된 프리미엄 인플루엔자 백신으로서, 이번 2025/26절기부터 전국 주요 병·의원에서 접종 가능하다.2025-09-19 09:12:40황병우
삼진제약-CSL시퀴러스, 플루아드쿼드 신규 광고 캠페인 진행면역증강제 함유 플루아드 쿼드, 신규 광고 캠페인 [데일리팜=황병우 기자] 삼진제약은 CSL시퀴러스코리아와 함께 만 65세 이상 고령층을 대상으로 하는 면역증강 인플루엔자 백신 '플루아드쿼드프리필드시린지(이하 플루아드쿼드)’의 신규 광고 캠페인을 9월 19일부터 본격적으로 진행한다고 밝혔다.삼진제약과 CSL시퀴러스코리아는 면역증강제를 함유한 플루아드쿼드의 특장점을 소비자에게 더욱 효과적으로 알리고자 대중들에게 신뢰도가 높은 방송인 한석준 아나운서를 광고 캠페인 엔도서로 발탁했다.한석준 아나운서는 이번 광고에서 특유의 친근함과 안정감으로 캠페인 메시지를 완벽하게 소화하였으며, 신뢰감을 바탕으로 한 설득력 있는 표현력으로 브랜드가 추구하는 가치를 자연스럽게 전달했다.이번 광고 캠페인에서 삼진제약과 CSL 시퀴러스코리아는 면역증강제 함유 플루아드쿼드의 소비자 브랜드 인지도 제고를 위해 '아드'라는 펫네임을 도입했다.아드는 제품명 플루아드쿼드에서 착안한 명칭으로서, 소비자가 자연스럽게 플루아드쿼드를 기억하고 인식할 수 있도록 하기 위한 이번 광고 캠페인의 핵심 전략이다.삼진제약과 CSL시퀴러스코리아는 이번 광고 캠페인을 TV와 유튜브 등 다양한 디지털 채널로 송출하고 이에 따라 고령층을 비롯 광범위한 연령층을 대상으로 한 면역증강제 함유 플루아드쿼드를 널리 알려 나갈 계획이다.세부적인 전개로는 ▲TVC, 고령층을 대상으로 한 제품 신뢰성 제고 메시지 전달 ▲디지털 채널, 접종을 위한 백신 선택 과정에서 가정 내 고령층을 부양하고 있는 가족들도 참여할 수 있도록 관심 유도 ▲플루아드쿼드의 주 키워드가 설정 된 포털 검색 엔진 가동 등이다.유기승 CSL 시퀴러스코리아 대표는 "한국은 이미 초고령 사회에 진입했으며, 특히 조부모·부모·손주 3대가 함께 교류하는 가족 구조가 일반적이다"라며 "손주로부터 전파된 인플루엔자가 노인에게 치명적인 결과를 초래할 수 있으며, 이는 가정 내 돌봄 공백을 넘어 사회 전반의 돌봄 체계와 공공보건에도 큰 영향을 미친다"고 말했다.그는 이어 "CSL시퀴러스코리아는 삼진제약과 협력해 플루아드쿼드와 같은 효과적인 백신을 안정적으로 공급함으로써, 국내 고령층과 국민 전체의 건강을 보호하고 공중보건 안전 강화에 기여하기 위해 최선을 다하겠다"고 강조했다.김상진 삼진제약 사장은 "이번 광고 캠페인을 통해 고령층에서 인플루엔자 예방에 보다 효과적인 백신은 면역증강제를 함유한 플루아드쿼드 라는 것이 확실하게 인식될 수 있기를 바란다"며 "다가오는 독감 시즌을 맞아 삼진제약은 CSL시퀴러스코리아와 함께 고품질 백신을 안정적으로 공급할 것이고, 이를 통해 고령층을 비롯 국민 모두의 건강을 위한 감염예방에 적극 기여할 수 있도록 최선을 다할 것"이라고 전했다.한편, 플루아드쿼드’는 고령층에서의 면역 반응을 강화하기 위한 면역증강제(MF59)가 함유된 프리미엄 인플루엔자 백신으로서, 이번 2025/26절기부터 전국 주요 병·의원에서 접종 가능하다.2025-09-19 09:12:40황병우 -
 첫 RNA 기반 ATTR-CM 치료제 '암부트라'④최초의 RNAi 기반 트랜스티레틴 아밀로이드 심근병증(ATTR-CM) 치료제, ‘암부트라(Vutrisiran)’암부트라(Amvuttra®, 성분명: 부트리시란 Vutrisiran, Alnylam Pharmaceuticals)는 소간섭 RNA(small interfering RNA, siRNA) 치료제로, 2022년 6월 미국 FDA에서 유전성 트랜스티레틴 매개 아밀로이드 다발신경병증(hATTR-PN) 치료제로 최초 승인되었다. 이어 2025년 3월에는 트랜스티레틴 아밀로이드 심근병증(ATTR-CM) 환자의 심혈관 사망, 입원 및 응급실 방문을 감소시키는 최초의 RNAi 치료제로 추가 승인을 받았다.Alnylam Pharmaceuticals는 siRNA 기술을 기반으로 간세포 내 TTR 합성을 직접 억제하는 신약 개발을 선도해 왔으며, 2018년 파티시란(Patisiran, Onpattro®)이 hATTR-PN 치료제로 최초 승인되었다. 이후 이를 개량한 2세대 제형인 부트리시란(Amvuttra®)이 개발되어 hATTR-PN과 ATTR-CM 모두에 사용 가능하게 되었다.트랜스티레틴 매개 아밀로이드증(ATTR amyloidosis)은 간에서 합성되는 단백질인 트랜스티레틴(TTR)의 구조적 불안정성에 의해 발생한다. 불안정한 TTR 사량체(tetramer)는 쉽게 해리되어 아밀로이드 형성 성향(amyloidogenic)을 띠는 잘못 접힌 단량체(misfolded monomer)로 전환된다. 이 단량체들이 서로 응집해 β-sheet 구조를 형성하면서 아밀로이드 섬유(amyloid fibril)로 축적되고, 신경·심장·소화관 등 다양한 장기에 침착되어 임상 증상을 유발한다.유전성 ATTR 다발신경병증(hATTR-PN)은 TTR 유전자 변이에 의해 발생하며, 주로 말초 및 자율신경에 침착해 신경병증을 유발한다.ATTR 심근병증(ATTR-CM)은 유전성(hATTR-CM) 또는 노화와 관련된 야생형(wild-type ATTR-CM)으로 발생할 수 있으며, 주 침착 부위는 심근이다.부트리시란은 RNAi 치료제로, 3개월 간격으로 1회 피하주사한다. 특정 mRNA를 표적·침묵시켜 야생형과 변이형 모두의 TTR 생성을 차단한다.HELIOS-A 시험은 hATTR-PN 환자를 대상으로 한 무작위 배정, 공개라벨, 다국가 3상 임상으로 진행되었다. 환자들은 3개월마다 피하로 부트리시란을 투여받거나 대조군으로 파티시란 정맥주사를 투여받았다.주요 유효성 평가는 mNIS+7 점수, Norfolk QoL-DN 설문, 보행 검사 등이었으며, 외부 위약군(APOLLO 연구 placebo arm)과의 비교를 통해 신뢰성을 보강하였다. 그 결과, 부트리시란 투여군은 신경학적 기능 악화를 유의하게 억제했으며 삶의 질과 신체 기능이 향상되는 양상을 보였다. 안전성 측면에서도 대부분의 이상반응은 경미하거나 중등도 수준에 그쳐 장기 투여의 내약성이 입증되었다.HELIOS-B 시험은 hATTR-CM뿐 아니라 야생형 ATTR-CM 환자를 포함한 심근병증 환자군을 대상으로 수행된 무작위 배정, 이중맹검, 위약 대조 3상 임상시험이다. ATTR-CM 환자에서 부트리시란의 심혈관 사망 및 입원 위험 감소 효과를 평가하는 데 중점을 두었으며, 1차 종료점으로 심혈관 사망률과 심부전 입원율이 설정되었다.연구 결과, 부트리시란은 ATTR-CM 환자에서 주요 심혈관 사건의 발생을 줄이는 경향을 보였고, 타파미디스(Tafamidis) 치료 경험 여부와 무관하게 일관된 효과를 나타냈다.트랜스티레틴(Transthyretin, TTR)은 무엇인가? 트랜스티레틴(Transthyretin)은 그 명칭이 transport + thyroxin + retinol에서 유래하였으며, 혈액과 뇌척수액에서 갑상선 호르몬과 비타민 A를 운반하는 필수 단백질이다.분자량 약 55kDa의 사량체(tetramer) 구조를 가진 TTR은 주로 간세포에서 합성되어 혈장으로 분비되며, 전체의 90% 이상이 간에서 생산된다. 혈중 TTR은 전체 단백질의 약 0.1–0.3%를 차지하며, 갑상선 호르몬 및 비타민 A 운반뿐 아니라 단백-에너지 영양 상태를 반영하는 민감한 지표로 활용된다.간 외에도 뇌의 맥락얼기(choroid plexus) 상피세포와 망막색소상피(retinal pigment epithelium, RPE)에서 국소적으로 합성된다. 맥락얼기에서 생성된 TTR은 뇌척수액 내에 풍부하게 존재하며, thyroxine(T4)의 주요 운반체로 기능한다. 혈액-뇌 장벽을 통한 갑상선 호르몬의 직접적 이동이 제한적이라는 점을 고려할 때, TTR은 중추신경계 발달과 대사 항상성 유지에 핵심적 역할을 한다.망막에서 합성된 TTR은 retinol-binding protein(RBP)과 결합하여 레티놀을 안정적으로 운반하고, RBP의 신장 여과를 방지함으로써 시각 회로 유지와 비타민 A 항상성 조절에 기여한다. TTR의 주요 기능은 세 가지로 요약된다. 첫째, 갑상선 호르몬 운반으로 혈중 thyroxine 운반의 약 15%를 담당하며, 알부민과 티록신 결합 글로불린(TBG)과 보완적으로 작용한다. 특히 뇌척수액에서는 TTR이 유일한 주요 운반 단백질이다. 둘째, 비타민 A 대사 및 운반으로 RBP와의 결합을 통해 레티놀을 안정화시키고 체내 항상성을 유지한다. 셋째, 대사적 지표 기능으로 혈중 농도가 영양 상태 및 단백질 합성 능력을 반영하여 임상적으로 영양평가의 바이오마커로 활용된다.한편, TTR은 구조적 불안정성으로 인해 단량체(monomer)로 분리되면 잘못 접힘(misfolding)이 발생하고, 이는 β-sheet 기반의 아밀로이드 섬유를 형성하여 조직에 침착할 수 있다. 이러한 병리적 변화가 트랜스티레틴 아밀로이드증(ATTR amyloidosis)의 기전이며, 연령 증가에 따른 야생형(wild-type) TTR의 불안정성은 심근병증(ATTR-CM)과 연관되고, 특정 유전자 변이에 의한 변이형 TTR은 다발신경병증(ATTR-PN)의 주요 원인으로 작용한다.트랜스티레틴 매개 아밀로이드증(Transthyretin-mediated amyloidosis, ATTR 아밀로이드증)이란 어떤 질환인가? ATTR 아밀로이드증은 트랜스티레틴(TTR)의 구조적 불안정성으로 인해 발생하는 전신성 단백질 침착 질환이다.TTR은 간에서 주로 합성되는 사량체 운반 단백질로, 정상 상태에서는 갑상선 호르몬과 비타민 A를 안정적으로 운반한다. 그러나 유전적 변이나 노화로 인해 단백질의 안정성이 저하되면 사량체(tetramer)가 단량체(monomer)로 해리되고, 이 단량체가 잘못 접힘(misfolding)을 거쳐 β-sheet 구조의 불용성 아밀로이드 섬유(amyloid fibril)로 전환된다. 축적된 아밀로이드 섬유는 다양한 장기에 침착하여 구조적 손상과 기능 저하를 유발한다.ATTR 아밀로이드증은 원인에 따라 변이형(hereditary ATTR, ATTRv)과 야생형(wild-type ATTR, ATTRwt)으로 구분된다. 변이형 ATTR은 TTR 유전자 변이에 의해 사량체의 안정성이 손상되면서 발생하며, 현재까지 120개 이상의 병인성 변이가 보고되어 있다. 임상 양상은 돌연변이 유형에 따라 다르지만, 크게 두 가지 표현형으로 나눌 수 있다.다발신경병증형(ATTR-PN, familial amyloid polyneuropathy, FAP)는 말초 및 자율신경계를 침범하며, 감각·운동 신경병증, 기립성 저혈압, 위장관 운동장애, 체중 감소 등을 동반한다.심근병증형(ATTR-CM, familial amyloid cardiomyopathy, FAC)는 심장 침착을 특징으로 하며, 심실 비후, 이완기 기능장애, 진행성 심부전 및 부정맥을 유발한다. 일부 변이는 신장, 안구, 연부조직을 동시에 침범해 복합적인 임상 양상을 보인다.ATTRv는 주로 성인기에 발병하며, 발현 연령과 진행 속도는 변이 종류와 지역적 특성에 따라 다양하다.야생형 ATTR은 유전자 이상이 없는 정상 TTR이 노화 과정에서 불안정해지며 발생한다. 과거에는 노인성 전신 아밀로이드증(senile systemic amyloidosis)으로 불렸으며, 주로 65세 이상 고령 남성에서 발견된다. 임상적으로는 대부분 심장을 침범하여 심근병증(ATTRwt-CM)의 형태로 발현되고, 진행성 심부전, 심실 비후, 전도장애, 심방세동이 주요 특징이다. 또한 손목터널증후군, 이두근건 파열, 척추관 협착증 등 근골격계 질환이 전구 증상으로 나타날 수 있으나, 비특이적인 증상과 고령 발병 특성으로 인해 과소진단되는 경우가 많다.ATTR 아밀로이드증의 치료는 이러한 발병 기전에 착안해 개발되었으며, 현재는 간에서 TTR 합성을 억제하는 RNA 기반 치료제, 사량체의 해리를 방지하는 안정화제, 그리고 이미 형성된 아밀로이드 침착을 제거하려는 면역학적 접근이 임상에 적용되고 있다.ATTR 아밀로이드증 치료에는 어떤 방법이 있는가? ATTR 아밀로이드증의 치료는 크게 두 축으로 발전해 왔다. 첫 번째는 증상을 조절하고 삶의 질을 유지하기 위한 기본 유지요법이며, 두 번째는 병태생리 자체를 교정하려는 표적 치료 전략이다.기본 유지요법은 질환의 근본적 진행을 막을 수는 없지만 환자의 기능 상태를 유지하고 합병증을 최소화하는 데 필수적이다. 울혈성 심부전 관리에는 루프 이뇨제가 주로 사용되며, 심방세동 및 전도 장애는 항응고제 투여와 함께 페이스메이커나 삽입형 제세동기(ICD)로 조절할 수 있다.신경병증성 통증은 가바펜티노이드, 삼환계 항우울제, SNRIs로 관리하며, 물리·재활 치료가 보조적 역할을 한다. 또한 기립성 저혈압과 같은 자율신경계 증상은 미도드린이나 플루드로코르티손으로 개선할 수 있고, 위장관 증상은 식이 조절 및 약물 치료로 완화할 수 있다.무엇보다 ATTR 아밀로이드증은 다장기 질환의 특성을 지니므로, 심장내과·신경과·소화기내과·재활의학과를 포함한 다학제적 접근이 필수적이다.병태생리 기반의 표적 치료는 TTR 단백질의 안정화, 합성 억제, 축적된 아밀로이드 제거, 그리고 간이식으로 구분된다. TTR 안정화제인 타파미디스(Tafamidis)는 사량체의 안정성을 높여 해체와 잘못 접힘을 억제하며, 임상시험에서 ATTR-CM 환자의 사망률과 입원율을 의미 있게 감소시켰다.RNA 기반 치료제는 TTR 합성을 근본적으로 차단하는 전략으로, siRNA 계열(파티시란, 부트리시란)과 ASO 계열(이노테르센, 에플로네르센)이 대표적이다. 이들 약제는 특히 hATTR-PN 환자에서 신경병증 진행을 억제하였고, 일부는 심근 침범 환자에서도 임상적 유효성이 입증되었다. 이미 형성된 아밀로이드 섬유를 제거하기 위한 항체 기반 치료도 연구되었으나 일부는 임상시험에서 실패하였고, 최근 새로운 접근법이 다시 모색되고 있다.마지막으로, 과거 hATTR 치료의 중요한 축이었던 간이식은 변이 TTR 합성을 근본적으로 차단할 수 있다는 장점이 있었으나, 이미 침착된 아밀로이드는 제거되지 않으며 야생형(wt) TTR에 의한 진행이 지속될 수 있다. 이러한 한계로 인해 현재는 RNA 기반 치료제의 도입과 함께 그 역할이 크게 줄어든 상태이다.TTR 안정화제(TTR stabilizer)는 어떤 약제인가? 최초의 트랜스티레틴 안정화제 타파미디스(Tafamidis)는 빈다켈(VyndaqelⓇ) 캡슐 20mg과 빈다맥스(VyndamaxⓇ) 캡슐 61mg 제형으로 출시되었다. 국내에서는 빈다켈이 ‘트랜스티레틴 가족성 아밀로이드성 다발신경병증(ATTR-PN)’ 치료제로, 빈다맥스가 ‘정상형(wild type) 또는 유전성 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 성인 환자의 심혈관계 사망률 및 심혈관계 관련 입원 감소’ 적응증으로 각각 승인되어 있다.타파미디스는 TTR 단백질 사량체(tetramer)의 티록신 결합 부위에 선택적으로 결합하여 단량체(monomer)로의 해체를 억제한다. 이를 통해 잘못 접힌 단량체의 발생을 차단하고 아밀로이드 섬유 형성을 예방한다.두 번째 트랜스티레틴 안정화제 아코라미디스(Acoramidis, AttrubyⓇ)는 2024년 11월 미국 FDA에서 ‘정상형(wild type) 또는 유전성 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 성인 환자의 심혈관계 사망률 및 심혈관계 관련 입원 감소’ 적응증으로 승인되었다.아코라미디스는 타파미디스 이후 처음 승인된 고강도 TTR 안정화제이자 경구 투여가 가능한 최신 치료제로, ATTR-CM 환자에서 생존률 및 입원율을 유의하게 개선한 점에서 임상적 의의가 크다.그러나 TTR 안정화제는 근본적으로 새로운 TTR 단백질 합성을 억제하지 못하고, 이미 형성된 아밀로이드 침착을 제거하지 못한다는 한계가 있다. 따라서 질환의 진행을 완전히 억제하기 어렵고, 특히 신경병증 환자에서는 RNAi 제제나 안티센스 올리고뉴클레오타이드(ASO) 제제에 비해 상대적으로 제한적인 효과를 보일 수 있다.트랜스티레틴 억제제(Transthyretin silencers)는 어떤 약제인가? TTR 억제제는 트랜스티레틴(TTR) 발현을 감소시키거나 제거함으로써 ATTR-CM의 진행을 늦추는 치료 전략이다. 이 접근법은 혈중 TTR 수치를 효과적으로 낮출 수 있으나, 동시에 TTR이 정상적으로 수행하는 운반 단백질로서의 기능까지 억제하게 된다는 한계를 지닌다.TTR 억제 요법에는 크게 두 가지 계열이 있다. 소간섭 RNA(siRNA)와 안티센스 올리고뉴클레오타이드(ASO) 모두 TTR mRNA에 결합하여 분해를 유도하지만, 세포 내에서 작용하는 기전에는 차이가 있다. siRNA는 표적 mRNA의 sense 가닥과 antisense 가닥으로 이루어진 이중가닥 RNA이다. 세포 내로 유입된 siRNA는 RNA-induced silencing complex(RISC)에 탑재되며, Ago2 엔도뉴클레아제가 sense 가닥을 제거하면 antisense 가닥이 노출되어 표적 mRNA와 상보적으로 결합한다. 이로 인해 해당 mRNA가 분해되어 유전자 발현이 억제된다.이러한 RNA 간섭 기전을 통해 siRNA는 특정 단백질 합성을 효과적으로 차단할 수 있으나, 세포 내 흡수율이 낮고 장기 특이성이 부족하다는 한계가 있다. 따라서 임상 적용을 위해서는 지질 나노입자(lipid nanoparticle, LNP)와 같은 전달체가 필요하다.이 문제를 해결하기 위해 개발된 첫 번째 상용화 약제가 파티시란(Patisiran)이다. 파티시란은 LNP 기반 전달체를 이용해 간세포 표적화를 가능하게 하였으며, 2015년 제2상 임상시험에서 3주 간격 투여 시 혈중 트랜스티레틴(TTR) 농도를 평균 약 80%까지 감소시켰다. 이어진 제3상 APOLLO 시험에서는 좌심실 벽 두께 감소(약 1 mm)와 NT-proBNP 수치 약 55% 감소가 확인되어, 신경병증뿐만 아니라 심혈관계 지표 개선 효과도 입증되었다.후속 약제인 부트리시란(Vutrisiran)은 2세대 siRNA 치료제로, LNP 대신 N-아세틸갈락토사민(GalNAc) 결합체를 적용하여 간세포 선택성을 높이고 약효 지속성을 강화하였다. 투여 용량은 파티시란보다 현저히 적으며, 3개월마다 피하주사 1회로 충분한 효과를 유지할 수 있다. 제1상 임상시험에서는 단일 투여 후 6주 시점에 혈중 TTR 농도가 약 83% 감소하였고, 이 억제 효과는 약 90일간 지속된 뒤 점진적으로 회복되는 양상이 관찰되었다.결론적으로, siRNA 기반 TTR 억제제는 ATTR 아밀로이드증 환자에서 혈중 TTR 농도를 크게 낮추고, 신경학적·심혈관학적 임상 지표를 개선하는 효과를 보인다. 특히 부트리시란은 투여 편의성과 안전성에서 진전을 이루어 ATTR-CM을 포함한 다양한 임상 영역에서 활용 가능성이 확대되고 있다.안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, ASO) ASO는 특정 mRNA에 직접 결합하여 RNase H 매개 절단을 유도하거나 스플라이싱을 조절함으로써 단백질 발현을 억제한다. 트랜스티레틴 아밀로이드증에서는 간세포에서 합성되는 TTR mRNA를 표적으로 하여 혈중 TTR 단백질 농도를 감소시킴으로써 질병의 진행을 억제한다.이러한 접근법은 RNA 간섭 기전을 활용하는 siRNA 기반 약물과 달리, RISC 복합체를 필요로 하지 않고 단일가닥 핵산 서열을 통해 작용한다는 점에서 차별성을 가진다.현재 승인된 대표적인 ASO 약제로는 이노테르센(Inotersen, TegsediⓇ)과 에플로네르센(Eplontersen, WainuaⓇ)이 있다. 미국 FDA는 이노테르센을 2018년 10월, 에플로네르센을 2023년 12월에 각각 ‘ATTRv-PN’ 치료제로 승인하였지만, 국내에는 아직 소개되지 않았다. 두 약제 모두 간에서 TTR 합성을 억제하여 혈중 TTR 농도를 낮추고, 아밀로이드 침착을 줄여 질환의 진행을 늦추거나 증상을 개선한다.이노테르센은 주 1회 피하주사로 투여되며, 임상시험에서 혈중 TTR 농도를 평균 70~80% 감소시키고 신경병증 점수 및 삶의 질 지표를 개선하는 효과가 확인되었다. 그러나 치료 과정에서 혈소판 감소와 신장 이상이 보고되어 정기적인 모니터링이 필요하다는 한계가 있다.이러한 안전성 문제와 투여 편의성의 제약을 개선하기 위해 개발된 차세대 약제가 에플로네르센이다. 에플로네르센은 N-아세틸갈락토사민(GalNAc) 결합체를 도입하여 간세포 특이적 흡수 효율을 높임으로써 약효를 극대화하는 동시에 부작용을 줄이도록 설계되었다.또한 이노테르센이 주 1회 투여를 필요로 하는 반면, 에플로네르센은 월 1회 피하주사만으로도 충분한 효과를 유지할 수 있어 환자 순응도를 크게 향상시켰다.부티리시란(Vutrisiran)는 어떤 약제인가? 부트리시란은 GalNAc(N-acetylgalactosamine) 플랫폼을 적용한 차세대 소간섭 RNA(siRNA) 치료제로, hATTR-PN과 ATTR-CM 환자 모두에서 사용 가능한 약제이다.이 약제는 기존의 파티시란(Patisiran)과 동일하게 TTR mRNA를 표적하여 단백질 발현을 억제하지만, 약리학적 특성에서 중요한 차별성을 지닌다. 먼저, 인산다이에스터(phosphodiester) 결합을 인산티오에이트(phosphorothioate) 결합으로 치환하여 핵산 분해효소에 대한 저항성을 강화하고 분자의 전신 안정성을 크게 향상시켰다. 이를 통해 보다 적은 용량으로도 지속적이고 강력한 TTR 억제 효과를 유지할 수 있게 되었다.또한 siRNA 분자와 삼분지(triantennary) N-아세틸갈락토사민(GalNAc) 리간드의 공유결합은 간세포 표면의 아실로글리코단백질 수용체(asialoglycoprotein receptor, ASGPR)를 통한 고효율적 내재화를 유도한다. 이로써 간세포 특이적 전달이 극대화되고 전신적 비특이적 분포가 최소화되어 약효의 선택성과 안전성이 동시에 확보된다.GalNAc 플랫폼의 도입은 정맥투여 대신 피하주사(SC) 제형을 가능하게 하였으며, 결과적으로 짧은 시간 내 간단한 투여가 가능해졌다. 부트리시란은 3개월마다 한 번의 피하 투여만으로 효과를 유지할 수 있어 환자의 치료 편의성과 순응도를 획기적으로 개선하였다. 더불어, 투여 전 스테로이드나 항히스타민제와 같은 항염증 전처치가 필요하지 않아 안전성과 내약성 측면에서도 우수한 특성을 보인다.임상적으로, 부트리시란은 HELIOS-A 3상 시험에서 파티시란과 동등한 수준의 신경학적 개선 효과를 보였으며, 주사 경로가 단순화되었음에도 불구하고 안전성 측면에서 우수한 결과를 나타냈다. 이어서 HELIOS-B 연구에서는 ATTR-CM 환자를 대상으로 심혈관 사망률과 입원율을 유의하게 감소시키는 효과가 확인되었고, 이를 근거로 2025년 FDA는 부트리시란의 적응증을 ATTR-CM으로 확장 승인하였다.부티리시란(Vutrisiran)의 약리 기전은? 부티시란은 소간섭 RNA(siRNA) 기술을 기반으로 트랜스티레틴(TTR) 단백질 합성을 근본적으로 억제하는 기전을 가진다. 일반적으로 siRNA는 이중가닥 구조를 이루어 세포 내로 유입된 뒤 RNA-induced silencing complex(RISC)에 탑재된다.이 과정에서 비표적 가닥(sense strand)은 분해되고, 표적을 인식하는 가닥(antisense strand)이 노출되어 상보적인 TTR mRNA와 결합한다. 결합된 mRNA는 Ago2와 같은 효소에 의해 절단·분해되며, 결과적으로 TTR 단백질 합성이 차단된다. 부티시란은 이러한 RNA 간섭(RNAi) 경로를 통해 병태생리의 근본 원인인 TTR 단백질 축적을 억제한다.특히 부티시란은 TTR 합성이 주로 일어나는 간세포로 siRNA를 선택적으로 전달함으로써 약효를 극대화하고 전신적 부작용을 최소화한다. 또한 화학적 변형인 인산티오에이트(phosphorothioate)를 도입하여 체내 핵산 분해효소에 대한 저항성을 강화하고, 안정성을 향상시켰다.이러한 최적화된 설계는 낮은 용량에서도 장기간 TTR 억제를 가능하게 하며, 3개월마다 한 번의 피하 투여만으로도 안정적인 약리 효과를 유지할 수 있게 한다.부트리시란(AMVUTTRA)의 허가임상은 어떠한가? -Polyneuropathy of Hereditary Transthyretin-mediated AmyloidosisAMVUTTRA(부트리시란, vutrisiran)의 유효성은 hATTR-PN 성인 환자를 대상으로 한 무작위 배정, 공개 임상시험(HELIOS-A; NCT03759379)에서 평가되었다.환자들은 3:1의 비율로 무작위 배정되어, 25mg의 AMVUTTRA를 3개월마다 피하 투여받은 군(N=122)과, 대조(reference)군으로서 0.3mg/kg의 파티시란(Patisiran)을 3주마다 정맥 투여받은 군(N=42)에 배정되었다. AMVUTTRA 투여군 환자의 97%, 파티시란 투여군 환자의 93%가 최소 9개월 동안 배정된 치료를 완료하였다.유효성 평가는 hATTR 아밀로이드증에 의한 다발신경병증(PN)을 가진 성인 환자군으로 구성된 외부 위약 대조군과 HELIOS-A 시험의 AMVUTTRA 투여군을 비교하는 방식으로 이루어졌다.주요 유효성 평가 변수는 기저치 대비 9개월 시점의 수정된 신경병증 장애 점수+7(modified Neuropathy Impairment Score +7, mNIS+7)의 변화였다. mNIS+7은 객관적인 신경병증 평가 도구로, 기본 NIS와 Modified +7 복합 점수로 구성된다.본 시험에서 사용된 mNIS+7 버전은, NIS가 뇌신경 기능, 근력, 반사 기능의 장애를 객관적으로 측정하고, +7 항목이 기립성 혈압(postural blood pressure), 정량적 감각 검사(quantitative sensory testing), 말초신경 전기생리학(peripheral nerve electrophysiology)을 평가하도록 설계되었다. mNIS+7은 총 0~304점 범위를 가지며, 점수가 높을수록 질환의 중증도가 크다는 것을 의미한다.mNIS+7 효과의 임상적 유의성은 기저치 대비 9개월 시점의 Norfolk 삶의 질-당뇨병성 신경병증(Norfolk Quality of Life-Diabetic Neuropathy, QoL-DN)총점 변화를 통해 추가적으로 평가되었다.Norfolk QoL-DN 척도는 환자 보고 기반 평가(patient-reported outcome)로서, 신경병증의 주관적 경험을 평가하며, 대섬유 신경병증/신체 기능(physical functioning/large fiber neuropathy), 일상생활 수행능력(activities of daily living), 증상(symptoms), 소섬유 신경병증(small fiber neuropathy), 자율신경병증(autonomic neuropathy) 영역을 포함한다. Norfolk QoL-DN의 총점 범위는 -4~136점이며, 점수가 높을수록 삶의 질 저하와 신경병증의 심각성이 큼을 의미한다.추가 평가 변수로는 10미터 보행 검사(10-meter walk test, 10MWT)를 통한 보행 속도와, 수정 체질량지수(modified body mass index, mBMI)가 포함되었다.HELIOS-A 시험에서 AMVUTTRA 치료는 위약군과 비교했을 때, 9개월 시점의 mNIS+7, Norfolk QoL-DN 총점, 10MWT에서 통계적으로 유의한 개선을 보였다(p2025-09-19 06:01:02최병철 박사
첫 RNA 기반 ATTR-CM 치료제 '암부트라'④최초의 RNAi 기반 트랜스티레틴 아밀로이드 심근병증(ATTR-CM) 치료제, ‘암부트라(Vutrisiran)’암부트라(Amvuttra®, 성분명: 부트리시란 Vutrisiran, Alnylam Pharmaceuticals)는 소간섭 RNA(small interfering RNA, siRNA) 치료제로, 2022년 6월 미국 FDA에서 유전성 트랜스티레틴 매개 아밀로이드 다발신경병증(hATTR-PN) 치료제로 최초 승인되었다. 이어 2025년 3월에는 트랜스티레틴 아밀로이드 심근병증(ATTR-CM) 환자의 심혈관 사망, 입원 및 응급실 방문을 감소시키는 최초의 RNAi 치료제로 추가 승인을 받았다.Alnylam Pharmaceuticals는 siRNA 기술을 기반으로 간세포 내 TTR 합성을 직접 억제하는 신약 개발을 선도해 왔으며, 2018년 파티시란(Patisiran, Onpattro®)이 hATTR-PN 치료제로 최초 승인되었다. 이후 이를 개량한 2세대 제형인 부트리시란(Amvuttra®)이 개발되어 hATTR-PN과 ATTR-CM 모두에 사용 가능하게 되었다.트랜스티레틴 매개 아밀로이드증(ATTR amyloidosis)은 간에서 합성되는 단백질인 트랜스티레틴(TTR)의 구조적 불안정성에 의해 발생한다. 불안정한 TTR 사량체(tetramer)는 쉽게 해리되어 아밀로이드 형성 성향(amyloidogenic)을 띠는 잘못 접힌 단량체(misfolded monomer)로 전환된다. 이 단량체들이 서로 응집해 β-sheet 구조를 형성하면서 아밀로이드 섬유(amyloid fibril)로 축적되고, 신경·심장·소화관 등 다양한 장기에 침착되어 임상 증상을 유발한다.유전성 ATTR 다발신경병증(hATTR-PN)은 TTR 유전자 변이에 의해 발생하며, 주로 말초 및 자율신경에 침착해 신경병증을 유발한다.ATTR 심근병증(ATTR-CM)은 유전성(hATTR-CM) 또는 노화와 관련된 야생형(wild-type ATTR-CM)으로 발생할 수 있으며, 주 침착 부위는 심근이다.부트리시란은 RNAi 치료제로, 3개월 간격으로 1회 피하주사한다. 특정 mRNA를 표적·침묵시켜 야생형과 변이형 모두의 TTR 생성을 차단한다.HELIOS-A 시험은 hATTR-PN 환자를 대상으로 한 무작위 배정, 공개라벨, 다국가 3상 임상으로 진행되었다. 환자들은 3개월마다 피하로 부트리시란을 투여받거나 대조군으로 파티시란 정맥주사를 투여받았다.주요 유효성 평가는 mNIS+7 점수, Norfolk QoL-DN 설문, 보행 검사 등이었으며, 외부 위약군(APOLLO 연구 placebo arm)과의 비교를 통해 신뢰성을 보강하였다. 그 결과, 부트리시란 투여군은 신경학적 기능 악화를 유의하게 억제했으며 삶의 질과 신체 기능이 향상되는 양상을 보였다. 안전성 측면에서도 대부분의 이상반응은 경미하거나 중등도 수준에 그쳐 장기 투여의 내약성이 입증되었다.HELIOS-B 시험은 hATTR-CM뿐 아니라 야생형 ATTR-CM 환자를 포함한 심근병증 환자군을 대상으로 수행된 무작위 배정, 이중맹검, 위약 대조 3상 임상시험이다. ATTR-CM 환자에서 부트리시란의 심혈관 사망 및 입원 위험 감소 효과를 평가하는 데 중점을 두었으며, 1차 종료점으로 심혈관 사망률과 심부전 입원율이 설정되었다.연구 결과, 부트리시란은 ATTR-CM 환자에서 주요 심혈관 사건의 발생을 줄이는 경향을 보였고, 타파미디스(Tafamidis) 치료 경험 여부와 무관하게 일관된 효과를 나타냈다.트랜스티레틴(Transthyretin, TTR)은 무엇인가? 트랜스티레틴(Transthyretin)은 그 명칭이 transport + thyroxin + retinol에서 유래하였으며, 혈액과 뇌척수액에서 갑상선 호르몬과 비타민 A를 운반하는 필수 단백질이다.분자량 약 55kDa의 사량체(tetramer) 구조를 가진 TTR은 주로 간세포에서 합성되어 혈장으로 분비되며, 전체의 90% 이상이 간에서 생산된다. 혈중 TTR은 전체 단백질의 약 0.1–0.3%를 차지하며, 갑상선 호르몬 및 비타민 A 운반뿐 아니라 단백-에너지 영양 상태를 반영하는 민감한 지표로 활용된다.간 외에도 뇌의 맥락얼기(choroid plexus) 상피세포와 망막색소상피(retinal pigment epithelium, RPE)에서 국소적으로 합성된다. 맥락얼기에서 생성된 TTR은 뇌척수액 내에 풍부하게 존재하며, thyroxine(T4)의 주요 운반체로 기능한다. 혈액-뇌 장벽을 통한 갑상선 호르몬의 직접적 이동이 제한적이라는 점을 고려할 때, TTR은 중추신경계 발달과 대사 항상성 유지에 핵심적 역할을 한다.망막에서 합성된 TTR은 retinol-binding protein(RBP)과 결합하여 레티놀을 안정적으로 운반하고, RBP의 신장 여과를 방지함으로써 시각 회로 유지와 비타민 A 항상성 조절에 기여한다. TTR의 주요 기능은 세 가지로 요약된다. 첫째, 갑상선 호르몬 운반으로 혈중 thyroxine 운반의 약 15%를 담당하며, 알부민과 티록신 결합 글로불린(TBG)과 보완적으로 작용한다. 특히 뇌척수액에서는 TTR이 유일한 주요 운반 단백질이다. 둘째, 비타민 A 대사 및 운반으로 RBP와의 결합을 통해 레티놀을 안정화시키고 체내 항상성을 유지한다. 셋째, 대사적 지표 기능으로 혈중 농도가 영양 상태 및 단백질 합성 능력을 반영하여 임상적으로 영양평가의 바이오마커로 활용된다.한편, TTR은 구조적 불안정성으로 인해 단량체(monomer)로 분리되면 잘못 접힘(misfolding)이 발생하고, 이는 β-sheet 기반의 아밀로이드 섬유를 형성하여 조직에 침착할 수 있다. 이러한 병리적 변화가 트랜스티레틴 아밀로이드증(ATTR amyloidosis)의 기전이며, 연령 증가에 따른 야생형(wild-type) TTR의 불안정성은 심근병증(ATTR-CM)과 연관되고, 특정 유전자 변이에 의한 변이형 TTR은 다발신경병증(ATTR-PN)의 주요 원인으로 작용한다.트랜스티레틴 매개 아밀로이드증(Transthyretin-mediated amyloidosis, ATTR 아밀로이드증)이란 어떤 질환인가? ATTR 아밀로이드증은 트랜스티레틴(TTR)의 구조적 불안정성으로 인해 발생하는 전신성 단백질 침착 질환이다.TTR은 간에서 주로 합성되는 사량체 운반 단백질로, 정상 상태에서는 갑상선 호르몬과 비타민 A를 안정적으로 운반한다. 그러나 유전적 변이나 노화로 인해 단백질의 안정성이 저하되면 사량체(tetramer)가 단량체(monomer)로 해리되고, 이 단량체가 잘못 접힘(misfolding)을 거쳐 β-sheet 구조의 불용성 아밀로이드 섬유(amyloid fibril)로 전환된다. 축적된 아밀로이드 섬유는 다양한 장기에 침착하여 구조적 손상과 기능 저하를 유발한다.ATTR 아밀로이드증은 원인에 따라 변이형(hereditary ATTR, ATTRv)과 야생형(wild-type ATTR, ATTRwt)으로 구분된다. 변이형 ATTR은 TTR 유전자 변이에 의해 사량체의 안정성이 손상되면서 발생하며, 현재까지 120개 이상의 병인성 변이가 보고되어 있다. 임상 양상은 돌연변이 유형에 따라 다르지만, 크게 두 가지 표현형으로 나눌 수 있다.다발신경병증형(ATTR-PN, familial amyloid polyneuropathy, FAP)는 말초 및 자율신경계를 침범하며, 감각·운동 신경병증, 기립성 저혈압, 위장관 운동장애, 체중 감소 등을 동반한다.심근병증형(ATTR-CM, familial amyloid cardiomyopathy, FAC)는 심장 침착을 특징으로 하며, 심실 비후, 이완기 기능장애, 진행성 심부전 및 부정맥을 유발한다. 일부 변이는 신장, 안구, 연부조직을 동시에 침범해 복합적인 임상 양상을 보인다.ATTRv는 주로 성인기에 발병하며, 발현 연령과 진행 속도는 변이 종류와 지역적 특성에 따라 다양하다.야생형 ATTR은 유전자 이상이 없는 정상 TTR이 노화 과정에서 불안정해지며 발생한다. 과거에는 노인성 전신 아밀로이드증(senile systemic amyloidosis)으로 불렸으며, 주로 65세 이상 고령 남성에서 발견된다. 임상적으로는 대부분 심장을 침범하여 심근병증(ATTRwt-CM)의 형태로 발현되고, 진행성 심부전, 심실 비후, 전도장애, 심방세동이 주요 특징이다. 또한 손목터널증후군, 이두근건 파열, 척추관 협착증 등 근골격계 질환이 전구 증상으로 나타날 수 있으나, 비특이적인 증상과 고령 발병 특성으로 인해 과소진단되는 경우가 많다.ATTR 아밀로이드증의 치료는 이러한 발병 기전에 착안해 개발되었으며, 현재는 간에서 TTR 합성을 억제하는 RNA 기반 치료제, 사량체의 해리를 방지하는 안정화제, 그리고 이미 형성된 아밀로이드 침착을 제거하려는 면역학적 접근이 임상에 적용되고 있다.ATTR 아밀로이드증 치료에는 어떤 방법이 있는가? ATTR 아밀로이드증의 치료는 크게 두 축으로 발전해 왔다. 첫 번째는 증상을 조절하고 삶의 질을 유지하기 위한 기본 유지요법이며, 두 번째는 병태생리 자체를 교정하려는 표적 치료 전략이다.기본 유지요법은 질환의 근본적 진행을 막을 수는 없지만 환자의 기능 상태를 유지하고 합병증을 최소화하는 데 필수적이다. 울혈성 심부전 관리에는 루프 이뇨제가 주로 사용되며, 심방세동 및 전도 장애는 항응고제 투여와 함께 페이스메이커나 삽입형 제세동기(ICD)로 조절할 수 있다.신경병증성 통증은 가바펜티노이드, 삼환계 항우울제, SNRIs로 관리하며, 물리·재활 치료가 보조적 역할을 한다. 또한 기립성 저혈압과 같은 자율신경계 증상은 미도드린이나 플루드로코르티손으로 개선할 수 있고, 위장관 증상은 식이 조절 및 약물 치료로 완화할 수 있다.무엇보다 ATTR 아밀로이드증은 다장기 질환의 특성을 지니므로, 심장내과·신경과·소화기내과·재활의학과를 포함한 다학제적 접근이 필수적이다.병태생리 기반의 표적 치료는 TTR 단백질의 안정화, 합성 억제, 축적된 아밀로이드 제거, 그리고 간이식으로 구분된다. TTR 안정화제인 타파미디스(Tafamidis)는 사량체의 안정성을 높여 해체와 잘못 접힘을 억제하며, 임상시험에서 ATTR-CM 환자의 사망률과 입원율을 의미 있게 감소시켰다.RNA 기반 치료제는 TTR 합성을 근본적으로 차단하는 전략으로, siRNA 계열(파티시란, 부트리시란)과 ASO 계열(이노테르센, 에플로네르센)이 대표적이다. 이들 약제는 특히 hATTR-PN 환자에서 신경병증 진행을 억제하였고, 일부는 심근 침범 환자에서도 임상적 유효성이 입증되었다. 이미 형성된 아밀로이드 섬유를 제거하기 위한 항체 기반 치료도 연구되었으나 일부는 임상시험에서 실패하였고, 최근 새로운 접근법이 다시 모색되고 있다.마지막으로, 과거 hATTR 치료의 중요한 축이었던 간이식은 변이 TTR 합성을 근본적으로 차단할 수 있다는 장점이 있었으나, 이미 침착된 아밀로이드는 제거되지 않으며 야생형(wt) TTR에 의한 진행이 지속될 수 있다. 이러한 한계로 인해 현재는 RNA 기반 치료제의 도입과 함께 그 역할이 크게 줄어든 상태이다.TTR 안정화제(TTR stabilizer)는 어떤 약제인가? 최초의 트랜스티레틴 안정화제 타파미디스(Tafamidis)는 빈다켈(VyndaqelⓇ) 캡슐 20mg과 빈다맥스(VyndamaxⓇ) 캡슐 61mg 제형으로 출시되었다. 국내에서는 빈다켈이 ‘트랜스티레틴 가족성 아밀로이드성 다발신경병증(ATTR-PN)’ 치료제로, 빈다맥스가 ‘정상형(wild type) 또는 유전성 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 성인 환자의 심혈관계 사망률 및 심혈관계 관련 입원 감소’ 적응증으로 각각 승인되어 있다.타파미디스는 TTR 단백질 사량체(tetramer)의 티록신 결합 부위에 선택적으로 결합하여 단량체(monomer)로의 해체를 억제한다. 이를 통해 잘못 접힌 단량체의 발생을 차단하고 아밀로이드 섬유 형성을 예방한다.두 번째 트랜스티레틴 안정화제 아코라미디스(Acoramidis, AttrubyⓇ)는 2024년 11월 미국 FDA에서 ‘정상형(wild type) 또는 유전성 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 성인 환자의 심혈관계 사망률 및 심혈관계 관련 입원 감소’ 적응증으로 승인되었다.아코라미디스는 타파미디스 이후 처음 승인된 고강도 TTR 안정화제이자 경구 투여가 가능한 최신 치료제로, ATTR-CM 환자에서 생존률 및 입원율을 유의하게 개선한 점에서 임상적 의의가 크다.그러나 TTR 안정화제는 근본적으로 새로운 TTR 단백질 합성을 억제하지 못하고, 이미 형성된 아밀로이드 침착을 제거하지 못한다는 한계가 있다. 따라서 질환의 진행을 완전히 억제하기 어렵고, 특히 신경병증 환자에서는 RNAi 제제나 안티센스 올리고뉴클레오타이드(ASO) 제제에 비해 상대적으로 제한적인 효과를 보일 수 있다.트랜스티레틴 억제제(Transthyretin silencers)는 어떤 약제인가? TTR 억제제는 트랜스티레틴(TTR) 발현을 감소시키거나 제거함으로써 ATTR-CM의 진행을 늦추는 치료 전략이다. 이 접근법은 혈중 TTR 수치를 효과적으로 낮출 수 있으나, 동시에 TTR이 정상적으로 수행하는 운반 단백질로서의 기능까지 억제하게 된다는 한계를 지닌다.TTR 억제 요법에는 크게 두 가지 계열이 있다. 소간섭 RNA(siRNA)와 안티센스 올리고뉴클레오타이드(ASO) 모두 TTR mRNA에 결합하여 분해를 유도하지만, 세포 내에서 작용하는 기전에는 차이가 있다. siRNA는 표적 mRNA의 sense 가닥과 antisense 가닥으로 이루어진 이중가닥 RNA이다. 세포 내로 유입된 siRNA는 RNA-induced silencing complex(RISC)에 탑재되며, Ago2 엔도뉴클레아제가 sense 가닥을 제거하면 antisense 가닥이 노출되어 표적 mRNA와 상보적으로 결합한다. 이로 인해 해당 mRNA가 분해되어 유전자 발현이 억제된다.이러한 RNA 간섭 기전을 통해 siRNA는 특정 단백질 합성을 효과적으로 차단할 수 있으나, 세포 내 흡수율이 낮고 장기 특이성이 부족하다는 한계가 있다. 따라서 임상 적용을 위해서는 지질 나노입자(lipid nanoparticle, LNP)와 같은 전달체가 필요하다.이 문제를 해결하기 위해 개발된 첫 번째 상용화 약제가 파티시란(Patisiran)이다. 파티시란은 LNP 기반 전달체를 이용해 간세포 표적화를 가능하게 하였으며, 2015년 제2상 임상시험에서 3주 간격 투여 시 혈중 트랜스티레틴(TTR) 농도를 평균 약 80%까지 감소시켰다. 이어진 제3상 APOLLO 시험에서는 좌심실 벽 두께 감소(약 1 mm)와 NT-proBNP 수치 약 55% 감소가 확인되어, 신경병증뿐만 아니라 심혈관계 지표 개선 효과도 입증되었다.후속 약제인 부트리시란(Vutrisiran)은 2세대 siRNA 치료제로, LNP 대신 N-아세틸갈락토사민(GalNAc) 결합체를 적용하여 간세포 선택성을 높이고 약효 지속성을 강화하였다. 투여 용량은 파티시란보다 현저히 적으며, 3개월마다 피하주사 1회로 충분한 효과를 유지할 수 있다. 제1상 임상시험에서는 단일 투여 후 6주 시점에 혈중 TTR 농도가 약 83% 감소하였고, 이 억제 효과는 약 90일간 지속된 뒤 점진적으로 회복되는 양상이 관찰되었다.결론적으로, siRNA 기반 TTR 억제제는 ATTR 아밀로이드증 환자에서 혈중 TTR 농도를 크게 낮추고, 신경학적·심혈관학적 임상 지표를 개선하는 효과를 보인다. 특히 부트리시란은 투여 편의성과 안전성에서 진전을 이루어 ATTR-CM을 포함한 다양한 임상 영역에서 활용 가능성이 확대되고 있다.안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, ASO) ASO는 특정 mRNA에 직접 결합하여 RNase H 매개 절단을 유도하거나 스플라이싱을 조절함으로써 단백질 발현을 억제한다. 트랜스티레틴 아밀로이드증에서는 간세포에서 합성되는 TTR mRNA를 표적으로 하여 혈중 TTR 단백질 농도를 감소시킴으로써 질병의 진행을 억제한다.이러한 접근법은 RNA 간섭 기전을 활용하는 siRNA 기반 약물과 달리, RISC 복합체를 필요로 하지 않고 단일가닥 핵산 서열을 통해 작용한다는 점에서 차별성을 가진다.현재 승인된 대표적인 ASO 약제로는 이노테르센(Inotersen, TegsediⓇ)과 에플로네르센(Eplontersen, WainuaⓇ)이 있다. 미국 FDA는 이노테르센을 2018년 10월, 에플로네르센을 2023년 12월에 각각 ‘ATTRv-PN’ 치료제로 승인하였지만, 국내에는 아직 소개되지 않았다. 두 약제 모두 간에서 TTR 합성을 억제하여 혈중 TTR 농도를 낮추고, 아밀로이드 침착을 줄여 질환의 진행을 늦추거나 증상을 개선한다.이노테르센은 주 1회 피하주사로 투여되며, 임상시험에서 혈중 TTR 농도를 평균 70~80% 감소시키고 신경병증 점수 및 삶의 질 지표를 개선하는 효과가 확인되었다. 그러나 치료 과정에서 혈소판 감소와 신장 이상이 보고되어 정기적인 모니터링이 필요하다는 한계가 있다.이러한 안전성 문제와 투여 편의성의 제약을 개선하기 위해 개발된 차세대 약제가 에플로네르센이다. 에플로네르센은 N-아세틸갈락토사민(GalNAc) 결합체를 도입하여 간세포 특이적 흡수 효율을 높임으로써 약효를 극대화하는 동시에 부작용을 줄이도록 설계되었다.또한 이노테르센이 주 1회 투여를 필요로 하는 반면, 에플로네르센은 월 1회 피하주사만으로도 충분한 효과를 유지할 수 있어 환자 순응도를 크게 향상시켰다.부티리시란(Vutrisiran)는 어떤 약제인가? 부트리시란은 GalNAc(N-acetylgalactosamine) 플랫폼을 적용한 차세대 소간섭 RNA(siRNA) 치료제로, hATTR-PN과 ATTR-CM 환자 모두에서 사용 가능한 약제이다.이 약제는 기존의 파티시란(Patisiran)과 동일하게 TTR mRNA를 표적하여 단백질 발현을 억제하지만, 약리학적 특성에서 중요한 차별성을 지닌다. 먼저, 인산다이에스터(phosphodiester) 결합을 인산티오에이트(phosphorothioate) 결합으로 치환하여 핵산 분해효소에 대한 저항성을 강화하고 분자의 전신 안정성을 크게 향상시켰다. 이를 통해 보다 적은 용량으로도 지속적이고 강력한 TTR 억제 효과를 유지할 수 있게 되었다.또한 siRNA 분자와 삼분지(triantennary) N-아세틸갈락토사민(GalNAc) 리간드의 공유결합은 간세포 표면의 아실로글리코단백질 수용체(asialoglycoprotein receptor, ASGPR)를 통한 고효율적 내재화를 유도한다. 이로써 간세포 특이적 전달이 극대화되고 전신적 비특이적 분포가 최소화되어 약효의 선택성과 안전성이 동시에 확보된다.GalNAc 플랫폼의 도입은 정맥투여 대신 피하주사(SC) 제형을 가능하게 하였으며, 결과적으로 짧은 시간 내 간단한 투여가 가능해졌다. 부트리시란은 3개월마다 한 번의 피하 투여만으로 효과를 유지할 수 있어 환자의 치료 편의성과 순응도를 획기적으로 개선하였다. 더불어, 투여 전 스테로이드나 항히스타민제와 같은 항염증 전처치가 필요하지 않아 안전성과 내약성 측면에서도 우수한 특성을 보인다.임상적으로, 부트리시란은 HELIOS-A 3상 시험에서 파티시란과 동등한 수준의 신경학적 개선 효과를 보였으며, 주사 경로가 단순화되었음에도 불구하고 안전성 측면에서 우수한 결과를 나타냈다. 이어서 HELIOS-B 연구에서는 ATTR-CM 환자를 대상으로 심혈관 사망률과 입원율을 유의하게 감소시키는 효과가 확인되었고, 이를 근거로 2025년 FDA는 부트리시란의 적응증을 ATTR-CM으로 확장 승인하였다.부티리시란(Vutrisiran)의 약리 기전은? 부티시란은 소간섭 RNA(siRNA) 기술을 기반으로 트랜스티레틴(TTR) 단백질 합성을 근본적으로 억제하는 기전을 가진다. 일반적으로 siRNA는 이중가닥 구조를 이루어 세포 내로 유입된 뒤 RNA-induced silencing complex(RISC)에 탑재된다.이 과정에서 비표적 가닥(sense strand)은 분해되고, 표적을 인식하는 가닥(antisense strand)이 노출되어 상보적인 TTR mRNA와 결합한다. 결합된 mRNA는 Ago2와 같은 효소에 의해 절단·분해되며, 결과적으로 TTR 단백질 합성이 차단된다. 부티시란은 이러한 RNA 간섭(RNAi) 경로를 통해 병태생리의 근본 원인인 TTR 단백질 축적을 억제한다.특히 부티시란은 TTR 합성이 주로 일어나는 간세포로 siRNA를 선택적으로 전달함으로써 약효를 극대화하고 전신적 부작용을 최소화한다. 또한 화학적 변형인 인산티오에이트(phosphorothioate)를 도입하여 체내 핵산 분해효소에 대한 저항성을 강화하고, 안정성을 향상시켰다.이러한 최적화된 설계는 낮은 용량에서도 장기간 TTR 억제를 가능하게 하며, 3개월마다 한 번의 피하 투여만으로도 안정적인 약리 효과를 유지할 수 있게 한다.부트리시란(AMVUTTRA)의 허가임상은 어떠한가? -Polyneuropathy of Hereditary Transthyretin-mediated AmyloidosisAMVUTTRA(부트리시란, vutrisiran)의 유효성은 hATTR-PN 성인 환자를 대상으로 한 무작위 배정, 공개 임상시험(HELIOS-A; NCT03759379)에서 평가되었다.환자들은 3:1의 비율로 무작위 배정되어, 25mg의 AMVUTTRA를 3개월마다 피하 투여받은 군(N=122)과, 대조(reference)군으로서 0.3mg/kg의 파티시란(Patisiran)을 3주마다 정맥 투여받은 군(N=42)에 배정되었다. AMVUTTRA 투여군 환자의 97%, 파티시란 투여군 환자의 93%가 최소 9개월 동안 배정된 치료를 완료하였다.유효성 평가는 hATTR 아밀로이드증에 의한 다발신경병증(PN)을 가진 성인 환자군으로 구성된 외부 위약 대조군과 HELIOS-A 시험의 AMVUTTRA 투여군을 비교하는 방식으로 이루어졌다.주요 유효성 평가 변수는 기저치 대비 9개월 시점의 수정된 신경병증 장애 점수+7(modified Neuropathy Impairment Score +7, mNIS+7)의 변화였다. mNIS+7은 객관적인 신경병증 평가 도구로, 기본 NIS와 Modified +7 복합 점수로 구성된다.본 시험에서 사용된 mNIS+7 버전은, NIS가 뇌신경 기능, 근력, 반사 기능의 장애를 객관적으로 측정하고, +7 항목이 기립성 혈압(postural blood pressure), 정량적 감각 검사(quantitative sensory testing), 말초신경 전기생리학(peripheral nerve electrophysiology)을 평가하도록 설계되었다. mNIS+7은 총 0~304점 범위를 가지며, 점수가 높을수록 질환의 중증도가 크다는 것을 의미한다.mNIS+7 효과의 임상적 유의성은 기저치 대비 9개월 시점의 Norfolk 삶의 질-당뇨병성 신경병증(Norfolk Quality of Life-Diabetic Neuropathy, QoL-DN)총점 변화를 통해 추가적으로 평가되었다.Norfolk QoL-DN 척도는 환자 보고 기반 평가(patient-reported outcome)로서, 신경병증의 주관적 경험을 평가하며, 대섬유 신경병증/신체 기능(physical functioning/large fiber neuropathy), 일상생활 수행능력(activities of daily living), 증상(symptoms), 소섬유 신경병증(small fiber neuropathy), 자율신경병증(autonomic neuropathy) 영역을 포함한다. Norfolk QoL-DN의 총점 범위는 -4~136점이며, 점수가 높을수록 삶의 질 저하와 신경병증의 심각성이 큼을 의미한다.추가 평가 변수로는 10미터 보행 검사(10-meter walk test, 10MWT)를 통한 보행 속도와, 수정 체질량지수(modified body mass index, mBMI)가 포함되었다.HELIOS-A 시험에서 AMVUTTRA 치료는 위약군과 비교했을 때, 9개월 시점의 mNIS+7, Norfolk QoL-DN 총점, 10MWT에서 통계적으로 유의한 개선을 보였다(p2025-09-19 06:01:02최병철 박사 -
 유한, 지분법이익 67%↓...킴벌리·얀센 등 관계사 부진[데일리팜=차지현 기자] 올 상반기 유한양행 지분법이익이 전년 동기 대비 3분의 1 수준으로 급감했다. 주요 관계기업의 실적이 부진했기 때문이다. 투자 성과가 위축된 상황에서 회사는 포트폴리오 효율화 전략을 더욱 가속화하는 모습이다.16일 금융감독원에 따르면 유한양행의 올 상반기 지분법이익은 100억원으로 지난해 같은 기간 300억원보다 66.9% 급감했다.지분법이익은 기업이 일정 지분을 보유한 관계기업의 순이익 또는 순손실을 지분율만큼 반영한 금액을 말한다. 종속기업처럼 재무제표 전체를 합치지 않고 투자 지분에 해당하는 성과만 반영하기 때문에 '관계기업 성적표'로 불린다. 지분법이익은 기업의 오픈이노베이션 전략 성과나 투자 포트폴리오 건전성, 미래 현금흐름 가능성을 판단하는 핵심 지표로 쓰인다.유한양행의 지분법이익 감소는 주요 관계기업의 기여도가 축소된 탓이다. 상반기 유한킴벌리 지분법이익은 129억원으로 전년 동기 241억원에서 절반가량 줄었다. 유한킴벌리는 6월 말 기준 유한양행이 지분 30.0%를 보유한 곳으로, 올 상반기 매출 7035억원, 순이익 431억원을 기록했다.같은 기간 한국얀센 지분법이익은 18억원으로 전년 동기 52억원에서 65.4% 감소했다. 한국얀센은 유한양행과 미국 존슨앤드존슨이 지난 1983년 설립한 합작사로, 6월 말 기준 유한양행이 지분 29.1% 보유한 최대주주로 올라 있다. 올 상반기 한국얀센 매출과 순이익은 각각 2237억원과 76억원으로 집계됐다.(자료: 금융감독원) 6월 말 기준 유한양행이 지분 50.0%를 보유한 유한크로락스는 상반기 지분법이익 작년 27억원에서 올해 11억원으로 줄었다. 유한크로락스는 위생용품 제조와 판매 등을 영위하는 곳으로, 이 회사의 상반기 매출은 296억원, 순이익은 21억원이었다.테라젠이텍스의 경우 작년 상반기 지분법손익 2억원에서 올 상반기 지분법손실 17억원으로 적자 전환했다. 6월 말 기준 테라젠이텍스에 대한 유한양행 지분율은 7.8%다. 테라젠이텍스는 상반기 매출 1340억원을 올렸고 18억원의 순손실을 냈다.손실 규모가 확대한 관계기업도 많다. 아임뉴런은 지분법손실이 지난해 상반기 5억원에서 올 상반기 15억원으로 세 배 확대됐다. 같은 기간 에임드바이오도 지분법손실이 1억원에서 8억원으로 늘었다. 프로젠은 지분법손실이 지난해 상반기 4억원에서 올 상반기 5억원으로 증가했다. 이외 온코마스터, 노보메디슨, 제이인츠바이오, 내츄럴엔도텍 등 관계기업의 지분법손실 손실 규모가 전년 동기 대비 커졌다.지분법손익과 별개로 장부가에서 아예 사라진 투자처도 있다. 유한양행은 상반기 중 주노랩에 대해 전액 손상을 인식했다. 상반기 재무정보를 입수하지 못해 지분법손익도 반영하지 못했다. 사실상 투자금 회수가 불가능해진 셈이다. 앞서 유한양행은 지난 2021년 주노랩에 3억원을 투자한 바 있다.투자 성과가 위축된 상황에서 유한양행은 포트폴리오 효율화 전략을 더욱 가속화하는 모습이다.유한양행은 상반기 중 지아이이노베이션 50만2642주를 51억원에 매도했다. 또 셀비온 주식 18만5185주를 약 22억원에 처분했다. 유한양행은 엔솔바이오사이언스 보유 주식 전량 81만860주도 매각, 142억원을 확보했다.유한양행은 이 같이 자산 처분을 통해 확보한 현금으로 또 다른 바이오텍에 재투자를 진행했다. 유한양행은 올 상반기 킴셀앤진에 11억원을 신규 투자했다. 킴셀엔진은 서울대병원 의생명연구원장을 역임한 김효수 교수가 창업한 신약개발기업으로 염증성 장질환 관련 항체 치료제를 개발 중이다.유한양행은 상반기 제이인츠바이오와 온코마스터에도 추가 투자를 단행했다. 유한양행은 올 상반기 중 20억원을 추가 투입했다. 유한양행은 제이인츠바이오에 2021년과 2022년 각각 20억원의 지분투자를 진행하며 인연을 맺었다. 유한양행은 지난 2023년 5월 제이인츠바이오와 표적치료제 후보물질 'JIN-A04'의 기술도입 계약을 체결한 바 있다.유한양행은 상반기 중 온코마스터에도 20억원을 추가로 투자했다. 온코마스터는 암 환자 정밀의료 플랫폼 업체로, 유한양행은 2022년 5월 온코마스터에 20억원을 투자해 지분 8.0%를 취득했다.2025-09-16 06:19:52차지현
유한, 지분법이익 67%↓...킴벌리·얀센 등 관계사 부진[데일리팜=차지현 기자] 올 상반기 유한양행 지분법이익이 전년 동기 대비 3분의 1 수준으로 급감했다. 주요 관계기업의 실적이 부진했기 때문이다. 투자 성과가 위축된 상황에서 회사는 포트폴리오 효율화 전략을 더욱 가속화하는 모습이다.16일 금융감독원에 따르면 유한양행의 올 상반기 지분법이익은 100억원으로 지난해 같은 기간 300억원보다 66.9% 급감했다.지분법이익은 기업이 일정 지분을 보유한 관계기업의 순이익 또는 순손실을 지분율만큼 반영한 금액을 말한다. 종속기업처럼 재무제표 전체를 합치지 않고 투자 지분에 해당하는 성과만 반영하기 때문에 '관계기업 성적표'로 불린다. 지분법이익은 기업의 오픈이노베이션 전략 성과나 투자 포트폴리오 건전성, 미래 현금흐름 가능성을 판단하는 핵심 지표로 쓰인다.유한양행의 지분법이익 감소는 주요 관계기업의 기여도가 축소된 탓이다. 상반기 유한킴벌리 지분법이익은 129억원으로 전년 동기 241억원에서 절반가량 줄었다. 유한킴벌리는 6월 말 기준 유한양행이 지분 30.0%를 보유한 곳으로, 올 상반기 매출 7035억원, 순이익 431억원을 기록했다.같은 기간 한국얀센 지분법이익은 18억원으로 전년 동기 52억원에서 65.4% 감소했다. 한국얀센은 유한양행과 미국 존슨앤드존슨이 지난 1983년 설립한 합작사로, 6월 말 기준 유한양행이 지분 29.1% 보유한 최대주주로 올라 있다. 올 상반기 한국얀센 매출과 순이익은 각각 2237억원과 76억원으로 집계됐다.(자료: 금융감독원) 6월 말 기준 유한양행이 지분 50.0%를 보유한 유한크로락스는 상반기 지분법이익 작년 27억원에서 올해 11억원으로 줄었다. 유한크로락스는 위생용품 제조와 판매 등을 영위하는 곳으로, 이 회사의 상반기 매출은 296억원, 순이익은 21억원이었다.테라젠이텍스의 경우 작년 상반기 지분법손익 2억원에서 올 상반기 지분법손실 17억원으로 적자 전환했다. 6월 말 기준 테라젠이텍스에 대한 유한양행 지분율은 7.8%다. 테라젠이텍스는 상반기 매출 1340억원을 올렸고 18억원의 순손실을 냈다.손실 규모가 확대한 관계기업도 많다. 아임뉴런은 지분법손실이 지난해 상반기 5억원에서 올 상반기 15억원으로 세 배 확대됐다. 같은 기간 에임드바이오도 지분법손실이 1억원에서 8억원으로 늘었다. 프로젠은 지분법손실이 지난해 상반기 4억원에서 올 상반기 5억원으로 증가했다. 이외 온코마스터, 노보메디슨, 제이인츠바이오, 내츄럴엔도텍 등 관계기업의 지분법손실 손실 규모가 전년 동기 대비 커졌다.지분법손익과 별개로 장부가에서 아예 사라진 투자처도 있다. 유한양행은 상반기 중 주노랩에 대해 전액 손상을 인식했다. 상반기 재무정보를 입수하지 못해 지분법손익도 반영하지 못했다. 사실상 투자금 회수가 불가능해진 셈이다. 앞서 유한양행은 지난 2021년 주노랩에 3억원을 투자한 바 있다.투자 성과가 위축된 상황에서 유한양행은 포트폴리오 효율화 전략을 더욱 가속화하는 모습이다.유한양행은 상반기 중 지아이이노베이션 50만2642주를 51억원에 매도했다. 또 셀비온 주식 18만5185주를 약 22억원에 처분했다. 유한양행은 엔솔바이오사이언스 보유 주식 전량 81만860주도 매각, 142억원을 확보했다.유한양행은 이 같이 자산 처분을 통해 확보한 현금으로 또 다른 바이오텍에 재투자를 진행했다. 유한양행은 올 상반기 킴셀앤진에 11억원을 신규 투자했다. 킴셀엔진은 서울대병원 의생명연구원장을 역임한 김효수 교수가 창업한 신약개발기업으로 염증성 장질환 관련 항체 치료제를 개발 중이다.유한양행은 상반기 제이인츠바이오와 온코마스터에도 추가 투자를 단행했다. 유한양행은 올 상반기 중 20억원을 추가 투입했다. 유한양행은 제이인츠바이오에 2021년과 2022년 각각 20억원의 지분투자를 진행하며 인연을 맺었다. 유한양행은 지난 2023년 5월 제이인츠바이오와 표적치료제 후보물질 'JIN-A04'의 기술도입 계약을 체결한 바 있다.유한양행은 상반기 중 온코마스터에도 20억원을 추가로 투자했다. 온코마스터는 암 환자 정밀의료 플랫폼 업체로, 유한양행은 2022년 5월 온코마스터에 20억원을 투자해 지분 8.0%를 취득했다.2025-09-16 06:19:52차지현 -
 밴티브코리아, 세계 패혈증의 날 맞아 AOX 사내 행사 개최밴티브코리아는 패혈증 인식을 제고하기 위한 사내 행사를 진행했다. [데일리팜=황병우 기자] 밴티브코리아는 세계 패혈증의 날을 맞아 임직원을 대상으로 패혈증 위험성과 조기 치료의 중요성을 알리는 ‘AOX 사내 행사’를 진행했다고 12일 밝혔다.세계 패혈증의 날은 매년 9월 13일로, 세계 패혈증 연대(GSA)가 패혈증에 대한 인식을 높이고 예방과 치료의 중요성을 알리기 위해 지정한 날이다.밴티브코리아는 이에 맞춰 'AOX(Advanced Oxiris eXpand Extracorporeal Blood Purification, 옥사이리스를 통한 확장된 체외혈액정화요법)' 슬로건 아래 패혈증 관련 정보와 치료의 중요성을 알리는 사내 행사를 운영했다.직원들은 패혈증 관련 OX 퀴즈 카드를 받아 풀면서 질환의 위험도, 원인과 증상, 치료 방법 등을 배우며 패혈증에 대한 이해를 높였다.패혈증은 미생물 감염에 의해 전신 염증 반응이 일어나고, 이로 인해 주요 장기의 기능 부전이 빠르게 진행하는 질환이다. 원인과 관계없이 수시간에서 수일 내에 신장 기능이 갑자기 떨어지는 급성 신손상을 유발할 수도 있다.밴티브코리아는 독자적인 지속적신대체요법(Continuous Renal Replacement Therapy, CRRT) 시스템을 통해 생명을 구하는 중환자 치료 발전을 이끌어왔다.패혈증성 쇼크로 인한 급성 신손상이 발생해 지속적신대체요법(CRRT)이 필요한 환자에게 밴티브는 최적화된 인공신장기용 혈액여과기 옥사이리스를 제공하여 엔도톡신과 사이토카인의 신속하고 효과적인 제거를 도와 환자의 혈역학적 안정성 개선에 기여하고 있다.이번 행사에서는 밴티브코리아의 인공신장기용 혈액여과기인 옥사이리스(oXiris)에 대한 정보도 함께 소개했다.옥사이리스는 3가지 층으로 구성돼 ▲엔도톡신 ▲사이토카인 ▲체액 및 요독소를 동시에 제거할 수 있는 국내 유일의 혈액여과기 세트로, 엔도톡신과 사이토카인 제거에 효과적이며 기존 CRRT 시스템과 별도의 장비 없이 호환이 가능해 의료진의 편의성도 높다.실제로 패혈증은 수많은 사람들에게 영향을 미치는 전 세계 보건 과제로 떠오르고 있다. 국내에서도 2023년 패혈증 사망자는 7809명으로, 10년 전 대비 255% 증가하며 꾸준히 늘어나고 있는 추세다.이처럼 패혈증은 사망률이 높아 패혈증성 쇼크로 악화되기 전 조기에 적극적인 치료를 통해 생존율을 높이는 것이 매우 중요하다.특히 발열, 전신 염증 반응, 장기 손상을 유발할 수 있는 내독소(엔도톡신)와 염증 매개체(사이토카인)를 제거해 혈역학적 안정성을 확보하는 치료가 필요하다. 이에 미국중환자의학회 와 질병관리청, 대한중환자의학회 에서는 성인 패혈증 및 급성 신손상 환자에게 지속적신대체요법(CRRT) 사용을 권고하고 있다.임광혁 밴티브코리아 대표는 "패혈증은 전 세계뿐만 아니라 한국에서도 사망률이 높은 질환으로, 조기 인식과 신속한 치료로 많은 생명을 구할 수 있다"며 "이번 행사는 직원들이 패혈증에 대한 경각심을 높이고 치료 방법을 함께 배우는 기회가 됐다"고 말했다.이어 임 대표는 "밴티브코리아는 생명 연장으로, 더 넓은 가능성을 향해(Extending Lives, Expanding Possibilities) 사명 아래 생명을 위협하는 질환을 관리하기 위한 새로운 치료 옵션을 발전시켜 나가는 기업으로서, 앞으로도 패혈증 예방과 치료를 위한 교육과 혁신 치료 솔루션 제공에 앞장서겠다"고 덧붙였다.2025-09-12 10:12:49황병우
밴티브코리아, 세계 패혈증의 날 맞아 AOX 사내 행사 개최밴티브코리아는 패혈증 인식을 제고하기 위한 사내 행사를 진행했다. [데일리팜=황병우 기자] 밴티브코리아는 세계 패혈증의 날을 맞아 임직원을 대상으로 패혈증 위험성과 조기 치료의 중요성을 알리는 ‘AOX 사내 행사’를 진행했다고 12일 밝혔다.세계 패혈증의 날은 매년 9월 13일로, 세계 패혈증 연대(GSA)가 패혈증에 대한 인식을 높이고 예방과 치료의 중요성을 알리기 위해 지정한 날이다.밴티브코리아는 이에 맞춰 'AOX(Advanced Oxiris eXpand Extracorporeal Blood Purification, 옥사이리스를 통한 확장된 체외혈액정화요법)' 슬로건 아래 패혈증 관련 정보와 치료의 중요성을 알리는 사내 행사를 운영했다.직원들은 패혈증 관련 OX 퀴즈 카드를 받아 풀면서 질환의 위험도, 원인과 증상, 치료 방법 등을 배우며 패혈증에 대한 이해를 높였다.패혈증은 미생물 감염에 의해 전신 염증 반응이 일어나고, 이로 인해 주요 장기의 기능 부전이 빠르게 진행하는 질환이다. 원인과 관계없이 수시간에서 수일 내에 신장 기능이 갑자기 떨어지는 급성 신손상을 유발할 수도 있다.밴티브코리아는 독자적인 지속적신대체요법(Continuous Renal Replacement Therapy, CRRT) 시스템을 통해 생명을 구하는 중환자 치료 발전을 이끌어왔다.패혈증성 쇼크로 인한 급성 신손상이 발생해 지속적신대체요법(CRRT)이 필요한 환자에게 밴티브는 최적화된 인공신장기용 혈액여과기 옥사이리스를 제공하여 엔도톡신과 사이토카인의 신속하고 효과적인 제거를 도와 환자의 혈역학적 안정성 개선에 기여하고 있다.이번 행사에서는 밴티브코리아의 인공신장기용 혈액여과기인 옥사이리스(oXiris)에 대한 정보도 함께 소개했다.옥사이리스는 3가지 층으로 구성돼 ▲엔도톡신 ▲사이토카인 ▲체액 및 요독소를 동시에 제거할 수 있는 국내 유일의 혈액여과기 세트로, 엔도톡신과 사이토카인 제거에 효과적이며 기존 CRRT 시스템과 별도의 장비 없이 호환이 가능해 의료진의 편의성도 높다.실제로 패혈증은 수많은 사람들에게 영향을 미치는 전 세계 보건 과제로 떠오르고 있다. 국내에서도 2023년 패혈증 사망자는 7809명으로, 10년 전 대비 255% 증가하며 꾸준히 늘어나고 있는 추세다.이처럼 패혈증은 사망률이 높아 패혈증성 쇼크로 악화되기 전 조기에 적극적인 치료를 통해 생존율을 높이는 것이 매우 중요하다.특히 발열, 전신 염증 반응, 장기 손상을 유발할 수 있는 내독소(엔도톡신)와 염증 매개체(사이토카인)를 제거해 혈역학적 안정성을 확보하는 치료가 필요하다. 이에 미국중환자의학회 와 질병관리청, 대한중환자의학회 에서는 성인 패혈증 및 급성 신손상 환자에게 지속적신대체요법(CRRT) 사용을 권고하고 있다.임광혁 밴티브코리아 대표는 "패혈증은 전 세계뿐만 아니라 한국에서도 사망률이 높은 질환으로, 조기 인식과 신속한 치료로 많은 생명을 구할 수 있다"며 "이번 행사는 직원들이 패혈증에 대한 경각심을 높이고 치료 방법을 함께 배우는 기회가 됐다"고 말했다.이어 임 대표는 "밴티브코리아는 생명 연장으로, 더 넓은 가능성을 향해(Extending Lives, Expanding Possibilities) 사명 아래 생명을 위협하는 질환을 관리하기 위한 새로운 치료 옵션을 발전시켜 나가는 기업으로서, 앞으로도 패혈증 예방과 치료를 위한 교육과 혁신 치료 솔루션 제공에 앞장서겠다"고 덧붙였다.2025-09-12 10:12:49황병우 -
 소간섭 RNA 기반 LDL 콜레스테롤 저하제 '렉비오'③ 최초 소간섭 RNA(siRNA) 기반 LDL 콜레스테롤 저하제, '렉비오(Inclisiran)'렉비오(Leqvio®, leck-vee-oh, 성분명: 인클리시란, Inclisiran, 노바티스)는 소간섭 RNA(small interfering RNA, siRNA)기반의 저밀도지단백 콜레스테롤(LDL-C) 저하제로, PCSK9(proprotein convertase subtilisin/kexin type 9) mRNA를 표적으로 하여 작용한다.이 약제는 2020년 유럽의약청(EMA), 2021년 미국 식품의약국(FDA)으로부터 승인을 받았으며, 2024년 국내에서도 승인되었다. 국내 승인 적응증은 식이요법의 보조요법으로 사용되는 경우로, 다음과 같은 성인 환자를 대상으로 한다:- 최대 내약 용량의 스타틴 치료에도 불구하고 LDL-C 조절이 불충분한 원발성 고콜레스테롤혈증(이형접합 가족형 및 비가족형)또는 혼합형 이상지질혈증 환자 - 스타틴 불내성또는 스타틴 금기 환자렉비오(inclisiran)는 저밀도지단백 콜레스테롤(LDL-C) 저하를 목표로 개발된 소간섭 RNA(small interfering RNA, siRNA) 기반 치료제로, 기존 지질강하제와 차별화되는 새로운 치료 전략을 제시한다. 본 제제의 가장 큰 특징은 연 2회 투여 요법으로, 최초 투여 후 3개월 뒤 1회 추가 투여를 시행하고 이후에는 6개월 간격으로 피하 주사하는 방식이다. 이러한 투여 간격은 환자의 복약 순응도를 현저히 개선시키고, 장기간에 걸친 지속적 LDL-C 조절 효과를 제공한다는 점에서 임상적 차별성이 있다.작용 기전은 간세포 내에서 PCSK9 단백질 합성에 관여하는 mRNA를 표적 분해하는 것으로, 결과적으로 PCSK9의 발현을 억제한다. 이로 인해 LDL 수용체의 분해가 억제되고 수용체의 재활용이 촉진되어 혈중 LDL-C 농도가 유의하게 감소한다. 이러한 분자 기전은 단순한 단백질 억제제가 아닌, 전사 단계에서부터 표적을 차단하는 혁신적 접근을 반영한다.렉비오의 임상적 유효성과 안전성은 ORION-9, ORION-10, ORION-11 등 다수의 3상 임상시험을 통해 평가되었다. 총 3456명의 환자를 대상으로 평균 17개월간 추적 관찰한 결과, 렉비오 투여군은 위약군에 비해 LDL-C 수치가 최대 52%까지 지속적으로 감소하였다.전반적인 내약성은 양호하였으며, 안전성 프로파일 또한 위약군과 유사하였다. 보고된 이상반응은 대부분 경도에서 중등도 수준으로, 주사 부위 반응(통증, 발적, 발진), 관절통, 요로감염, 설사, 기침, 사지통증, 호흡곤란 등이 있으나 임상적으로 중대한 안전성 문제는 확인되지 않았다.이러한 근거를 바탕으로 렉비오는 죽상경화성 심혈관질환(ASCVD) 또는 이형접합 가족형 고콜레스테롤혈증(HeFH) 환자에서, 기존 요법으로 충분한 LDL-C 강하가 이루어지지 않는 경우 사용 가능한 약제로 임상적 의의를 가진다. 특히, 장기간의 안정적인 LDL-C 감소 효과와 간편한 투여 스케줄은 실제 진료 현장에서 환자 관리의 효율성을 높인다.원발성 고콜레스테롤혈증(Primary hyperlipidemia)는 어떤 질환인가? 고콜레스테롤혈증은 혈중 저밀도지단백 콜레스테롤(low-density lipoprotein cholesterol, LDL-C) 수치가 비정상적으로 증가된 상태를 의미하며, 이는 죽상경화성 심혈관질환(atherosclerotic cardiovascular disease, ASCVD)의 발병 위험을 크게 높이는 대사적 이상 중 하나이다.원발성 고콜레스테롤혈증은 주로 유전적 요인에 의해 발생하며, 대표적으로 가족성 고콜레스테롤혈증(familial hypercholesterolemia, FH)이 포함된다. 이러한 유전성 이상지질혈증은 소아기 또는 청소년기부터 지속적인 LDL-C 상승이 나타나며, 적절한 치료가 이루어지지 않으면 조기 동맥경화증이 진행되고, 심근경색이나 뇌졸중과 같은 중증 심혈관질환으로 이어질 수 있다.원발성 고콜레스테롤혈증은 크게 FH와 비가족성(다유전자성) 고콜레스테롤혈증으로 구분된다. FH는 단일 유전자의 병적 변이에 의해 발생하는 모노제닉(monogenic) 질환으로, 주로 LDL 수용체(LDLR), 아포지단백 B(APOB), 또는 PCSK9 유전자의 기능 이상이 원인이다. 이로 인해 간세포에서 LDL 입자의 제거가 저해되고, 결과적으로 혈중 LDL-C가 병적으로 상승한다.FH는 다시 이형접합형(heterozygous FH, HeFH)과 동형접합형(homozygous FH, HoFH)으로 나뉜다. 이형접합형은 대립유전자 한 쌍 중 하나에 변이가 존재하는 경우로 약 500명 중 1명꼴로 비교적 흔하게 발생한다. 이들 환자는 출생 시부터 LDL-C 수치가 상승되어 있으며, 치료가 이루어지지 않으면 성인 초기(30~50대)에 관상동맥질환(coronary artery disease, CAD) 발생 위험이 크게 증가한다.반면, 동형접합형은 양쪽 대립유전자 모두에 변이가 존재하는 경우로 약 100만 명 중 1명꼴로 매우 드물다. 이 경우 출생 직후부터 LDL-C 수치가 극단적으로 상승하며, 10세 이전에 심근경색이나 대동맥 협착과 같은 심각한 심혈관질환이 발생할 수 있다. 동형접합 환자는 일반적인 스타틴 치료에 대한 반응이 낮아, LDL 성분 제거술(apheresis)이나 PCSK9 억제제, siRNA 기반 치료제 등 고강도 치료 전략이 요구된다.비가족성 고콜레스테롤혈증은 FH와 달리 단일 유전자 변이가 확인되지 않으며, 다수의 유전적 요인에 더해 식습관, 운동 부족, 대사 이상과 같은 환경적 요인이 복합적으로 작용하여 LDL-C가 상승하는 형태이다. 이 경우 뚜렷한 가족력이 없는 경우가 많으며, 임상적으로는 FH와 유사한 소견을 보이지만 병적 변이를 유전자 검사로 확인하기 어려운 경우가 많다.한편, 혼합형 이상지질혈증(mixed dyslipidemia 또는 familial combined hyperlipidemia, FCH)은 LDL-C와 중성지방(triglyceride)의 동반 상승을 특징으로 하며, 경우에 따라 고밀도지단백 콜레스테롤(high-density lipoprotein cholesterol, HDL-C)이 감소하기도 한다. 이는 강한 유전적 소인을 가지며, 조기 ASCVD 발생 위험이 높아 조기 진단과 적극적인 치료가 필수적이다.죽상동맥경화성 심혈관질환(Atherosclerotic cardiovascular disease, ASCVD)은 무엇인가?죽상경화증(Atherosclerosis)은 전 세계적으로 가장 중요한 만성 혈관 질환 중 하나로, 대형 탄성 동맥(elastic artery)과 근육형 동맥(muscular artery)의 내막(intima)에 지질, 염증세포, 평활근세포, 그리고 섬유성 기질이 비정상적으로 축적되는 병리학적 과정을 의미한다. 이러한 변화는 초기에는 무증상 상태에서 수십 년간 서서히 진행되며, 동맥 내강의 협착이나 혈류 장애를 즉각적으로 유발하지 않을 수 있다.병리학적으로는 지방선조(fatty streak)의 형성에서 시작하여, 섬유성 플라크(fibrous plaque)와 복합 병변(complicated lesion)으로 점진적으로 진행한다. 이 과정에는 내피세포 기능장애(endothelial dysfunction), 산화 변성된 저밀도지단백(oxidized LDL)의 침착, 염증 반응, 평활근세포 증식 및 기질 침착, 그리고 플라크의 파열 또는 미란에 따른 혈전 형성이 연속적으로 관여한다.죽상경화성 심혈관질환(Atherosclerotic cardiovascular disease, ASCVD)은 이러한 죽상경화증이 임상적으로 발현된 상태를 포괄하는 개념이다. ASCVD에는 관상동맥질환(coronary heart disease, CHD), 허혈성 뇌졸중(ischemic stroke)과 일과성 허혈발작(transient ischemic attack, TIA), 그리고 말초동맥질환(peripheral arterial disease, PAD) 등이 포함된다. 즉, 죽상경화증이 혈관벽 내부에서 일어나는 병리학적 변화를 지칭한다면, ASCVD는 이러한 변화가 특정 혈관의 혈류를 현저히 방해하거나 혈전을 유발함으로써 발생하는 임상적 결과를 의미한다.ASCVD의 발생은 죽상경화증의 진행과 직결되어 있으며, 특히 저밀도지단백 콜레스테롤(LDL-C)의 장기간 상승이 핵심적 병인 인자로 확립되어 있다. LDL-C 상승은 죽상경화증을 유발하는 필수적 요인으로, 기초과학 연구, 전향적 코호트 연구, 무작위 대조 임상시험 모두에서 LDL-C와 ASCVD 위험 간의 명확한 인과관계가 확인되었다.그러나 LDL-C 강하 치료가 ASCVD 발생 위험을 감소시킨다는 방대한 근거가 축적되어 있음에도 불구하고, 전 세계적으로 고위험군 및 초고위험군 환자 중 상당수는 여전히 LDL-C 목표치에 도달하지 못하고 있으며, 지난 수십 년간 이 비율의 뚜렷한 개선은 관찰되지 않았다.PCSK9(Proprotein convertase subtilisin kexin type 9)이란 무엇인가?혈장 내 저밀도지단백 콜레스테롤(LDL-C)은 주로 간세포 표면에 존재하는 LDL 수용체(LDL receptor, LDLR)를 통해 제거된다. LDL이 LDLR에 결합하면 이 복합체는 클라트린-피복 소낭(clathrin-coated vesicle)을 통해 세포 내로 내재화되어 엔도솜(endosome)으로 이동한다. 이 과정에서 LDL은 수용체로부터 분리된 후 리소좀(lysosome)에서 분해되고, LDLR은 재활용되어 다시 세포 표면으로 이동함으로써 추가적인 LDL 제거에 활용된다.PCSK9(Proprotein Convertase Subtilisin/Kexin Type 9)은 이러한 LDLR 재활용 과정을 억제하고, LDLR의 리소좀 분해를 촉진하는 역할을 한다(Figure 1). 순환 중인 PCSK9은 특히 간세포 표면의 헤파란 황산 프로테오글리칸(heparan sulfate proteoglycans, HSPG)과 결합하여 세포 내로 유입되며, LDLR의 분해를 선택적으로 강화한다. 실제로 PCSK9 유전자 결손 생쥐에서는 간 내 LDLR 발현이 증가하고 혈장 LDL-C가 감소하며, 스타틴 치료에 대한 반응성이 향상되는 것이 확인되었다. LDL은 간에서 분비되는 중성지방 풍부 리포단백질인 초저밀도지단백(very low-density lipoprotein, VLDL)의 대사 산물이다. VLDL은 혈관 내에서 지방단백질 리파아제(lipoprotein lipase)에 의해 중성지방이 가수분해되어 중간밀도지단백(intermediate-density lipoprotein, IDL)으로 전환되며, 이후 다시 LDL로 변환된다. PCSK9은 VLDL의 주요 구조 단백질인 아포지단백 B100(apolipoprotein B100, apoB100)과 직접 결합하여 그 분해를 억제하고, 결과적으로 VLDL의 분비를 촉진할 수 있다.실제로 PCSK9 유전자 결손 생쥐에서는 간 내 apoB 분비와 혈장 LDL-C가 감소하는 반면, 기능획득 변이를 가진 PCSK9은 간암 세포주에서 apoB100의 분비를 증가시킨 바 있다. 이러한 결과는 PCSK9이 간세포 표면의 LDLR 수를 감소시키는 것뿐 아니라, VLDL 분비를 증가시켜 LDL 생성에도 기여할 수 있음을 시사한다. 다만 간세포는 일반적으로 apoB100을 과량 생산하며, VLDL 분비의 병목 단계는 apoB100의 지질화(lipidation) 과정이므로, PCSK9 매개 VLDL 분비 증가의 생리적 중요성은 제한적일 수 있다.PCSK9은 간 이외에도 다양한 조직에서 발현되며, 혈관 평활근세포(vascular smooth muscle cell, VSMC), 대식세포, 내피세포뿐 아니라 췌장, 신장, 장, 중추신경계 등에서도 확인된다. 특히 혈류 전단 응력이 낮은 대동맥이나 대퇴동맥의 분지부와 같이 죽상경화증 호발 부위에서 혈관벽의 PCSK9 발현이 높게 관찰된다. 배양된 VSMC는 내피세포보다 훨씬 더 많은 PCSK9을 생성하며, 이로 인해 VSMC 및 대식세포 내 LDLR 수준이 감소할 수 있다. 이러한 변화는 LDL 제거 능력을 저해하고, LDL이 혈관벽에 잔류하여 죽상경화증 진행을 촉진하는 병리적 기전으로 작용할 가능성이 제기되고 있다.PSCK 억제제에는 어떤 약제가 있는가?혈중 LDL-C을 효과적으로 감소시키는 것은 ASCVD의 예방과 치료에서 핵심 전략으로 자리잡고 있다. 스타틴(statin)은 HMG-CoA 환원효소를 억제하여 간에서의 콜레스테롤 생합성을 감소시키고, LDL 수용체(LDL receptor, LDLR) 발현을 증가시킴으로써 LDL-C를 저하시킨다.이러한 기전으로 인해 스타틴은 1차 치료제로 널리 사용되어 왔으나, 일부 환자에서는 고용량 스타틴 또는 에제티미브 병용에도 불구하고 목표 LDL-C 수치에 도달하지 못하거나, 약물 관련 부작용으로 장기 치료 지속이 어려운 한계가 존재한다.이러한 한계를 극복하기 위해 새로운 지질강하제들이 개발되었으며, 그중에서도 PCSK9을 표적하는 치료제들이 주목받고 있다. PCSK9은 간세포 표면의 LDLR을 리소좀으로 유도하여 분해를 촉진함으로써 LDLR의 재활용을 억제하고, 결과적으로 혈중 LDL-C 제거를 감소시키는 단백질이다. 따라서 PCSK9 활성을 억제하면 간세포 표면의 LDLR 수가 증가하고, 이를 통해 혈중 LDL-C를 효과적으로 저하시킬 수 있다.현재 임상적으로 사용되는 PCSK9 억제제는 크게 두 계열로 구분된다. 첫째, 인간 단일클론 항체(monoclonal antibody) 계열로, 순환 중 PCSK9과 직접 결합하여 LDLR과의 상호작용을 차단한다. 대표적으로 에볼로쿠맙(Evolocumab, 상품명 Repatha)과 알리로쿠맙(alirocumab, 상품명 Praluent)이 있으며, 이들 약제는 2주 또는 4주 간격의 피하 주사제로 투여된다. 대규모 임상연구인 FOURIER 및 ODYSSEY Outcomes를 통해 이들 약제가 LDL-C를 유의하게 감소시킬 뿐만 아니라 주요 심혈관 사건 발생을 줄이는 효과가 입증되었다.둘째, 소간섭 RNA(small interfering RNA, siRNA) 기반 치료제가 있다. 대표적으로 인클리시란(inclisiran)은 간세포 내에서 PCSK9 mRNA를 선택적으로 분해하여 PCSK9 단백질 발현 자체를 억제한다. 이 약제는 연 2회의 피하 투여만으로도 지속적인 LDL-C 강하 효과를 유도할 수 있으며, 복약 순응도 측면에서 뚜렷한 장점을 제공한다.인클리시란(렉비오)는 어떤 약제인가?인클리시란은 이중가닥 소간섭 리보핵산(siRNA)으로, 센스 가닥(sense strand)에 삼분지 구조의 N-아세틸갈락토사민(triantennary N-acetylgalactosamine, GalNAc)이 결합되어 있다. 이 구조는 아실로당 수용체(asialoglycoprotein receptor, ASGPR)를 통한 간세포(hepatocyte)로의 선택적 흡수를 촉진한다. 세포 내로 유입된 인클리시란은 RNA 간섭(RNA interference) 경로를 통해 PCSK9 mRNA를 선택적으로 분해함으로써 단백질 발현을 억제한다.이 과정의 결과로 PCSK9 단백질의 생성이 감소하고, LDL 수용체(LDL receptor, LDLR)의 재활용과 세포 표면 발현이 증가한다. 발현이 증가한 LDLR은 혈액 내 저밀도지단백 콜레스테롤(low-density lipoprotein cholesterol, LDL-C)을 보다 효율적으로 흡수하게 되며, 이를 통해 혈중 LDL-C 농도가 유의하게 저하된다.인클리시란의 약리 기전은?인클리시란(inclisiran)은 간세포막에 존재하는 ASGPR에 선택적으로 결합함으로써 세포 내로 흡수된다. 이 과정에서 삼분지 구조의 GalNAc이 핵심적인 역할을 하며, GalNAc는 당 분자로서 인클리시란이 ASGPR에 대해 높은 친화도와 선택성을 가지도록 돕는다. ASGPR은 간세포에서 당단백질의 엔도시토시스(endocytosis)를 매개하는 수용체로, 인클리시란은 이 경로를 통해 효율적으로 간세포 내로 유입된다.세포 내로 진입한 인클리시란은 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 결합한다. RISC는 siRNA의 가이드 가닥을 이용하여 표적 mRNA를 인식하고 절단하는 단백질 복합체이다. 이 과정에서 인클리시란의 안티센스(antisense) 가닥이 PCSK9 단백질을 암호화하는 mRNA에 결합하여, 해당 mRNA를 선택적으로 절단하고 분해한다. 결과적으로 PCSK9 단백질의 합성이 억제된다(Figure 2).PCSK9은 간세포 표면의 LDL 수용체(LDL receptor, LDLR) 발현을 조절하는 핵심 단백질로, LDLR에 결합하여 이를 리소좀으로 유도하고 분해시킴으로써 혈중 LDL 콜레스테롤(LDL-C) 제거 능력을 저하시킨다. 따라서 인클리시란은 PCSK9 생성을 억제하여 간세포 표면의 LDLR 발현을 증가시키며, 이로써 혈중 LDL-C를 효율적으로 감소시키는 효과를 나타낸다. 렉비오의 임상 결과는 어떠한가?LEQVIO(렉비오)의 유효성은 총 3건의 무작위, 이중눈가림, 위약대조 임상시험을 통해 평가되었다. 이들 연구는 이형접합 가족성 고콜레스테롤혈증(HeFH), 임상적으로 확인된 죽상경화성 심혈관질환(ASCVD), 또는 ASCVD 고위험군에 해당하는 성인 총 3,660명을 대상으로 하였다.이들은 모두 최대 내약 용량의 스타틴 치료를 받고 있음에도 불구하고 추가적인 LDL-C 저하가 필요한 환자들이었다. 세 임상시험 모두에서 치료군 간의 인구학적 특성 및 기저 질환 특성은 균형 있게 분포되어 있었다.임상 연구 1(ORION-10)은 다기관, 이중눈가림, 무작위 배정, 위약대조 방식으로 수행된 18개월간의 임상시험으로, 죽상경화성 심혈관질환(ASCVD)을 가진 1,561명의 환자가 등록되었다. 이들은 LEQVIO 284mg 피하주사 또는 위약을 1:1 비율로 배정받아 1일차, 90일차, 270일차, 450일차에 각각 투여되었다.모든 참가자는 최대 내약 용량의 스타틴 치료를 받고 있었으며, 추가적인 LDL 콜레스테롤(LDL-C) 저하가 필요한 상태였다. 스타틴 또는 기타 지질 저하 치료제의 사용 여부에 따라 환자들은 층화 배정되었으며, PCSK9 억제제를 복용 중인 환자는 연구에서 제외되었다.등록 당시 평균 연령은 66세(범위: 35~90세)였으며, 전체의 60%가 65세 이상, 31%는 여성, 86%는 백인, 13%는 흑인 또는 아프리카계 미국인, 1%는 아시아인, 그리고 14%는 히스패닉 또는 라틴계로 자가 보고하였다. 또한 45%의 환자는 당뇨병을 동반하고 있었으며, 기저 LDL-C 평균치는 105mg/dL이었다. 무작위 배정 시점에서 89%의 환자가 스타틴 치료를 받고 있었고, 그 중 69%는 고강도 스타틴 치료를 받고 있었다.연구 결과, 1차 유효성 평가 변수는 기저 시점 대비 510일차까지의 LDL-C 수치 변화율이었다. 그 결과, LEQVIO군과 위약군 간 평균 LDL-C 변화율의 차이는 -52%였으며, 95% 신뢰구간은 -56%에서 -49%, 통계적으로 유의미한 차이가 나타났다(Table 2). 임상 연구 2(ORION-11)은 다기관, 이중눈가림, 무작위 배정, 위약대조 방식으로 수행된 18개월 임상시험으로, 죽상경화성 심혈관질환(ASCVD) 또는 ASCVD 고위험군에 해당하는 성인 1,617명을 대상으로 하였다. 피험자들은 LEQVIO 284mg 피하주사(n = 810) 또는 위약(n = 807)을 1일차, 90일차, 270일차, 450일차에 각각 투여받도록 1:1 비율로 무작위 배정되었다.참가자는 모두 최대 내약 용량의 스타틴 치료를 받고 있었으며, 경우에 따라 기타 지질저하 치료제를 병용하고 있었고, 추가적인 LDL 콜레스테롤(LDL-C) 감소가 필요한 상태였다. 환자들은 국가 및 스타틴/기타 지질저하제 사용 여부에 따라 층화 배정되었으며, PCSK9 억제제를 복용 중인 환자는 연구에서 제외되었다.기저 시점에서 평균 연령은 65세(범위: 20~88세)였으며, 55%가 65세 이상, 28%는 여성, 98%는 백인, 1%는 흑인 또는 아프리카계 미국인, 1% 미만은 아시아인, 1% 미만이 히스패닉 또는 라틴계로 자가 보고하였다. 또한 35%의 환자가 당뇨병을 동반하고 있었으며, 기저 LDL-C 평균치는 105 mg/dL이었다. 무작위 배정 시점에서 95%는 스타틴 치료를 받고 있었고, 이 중 78%는 고강도 스타틴 치료 중이었다.이 연구의 1차 유효성 평가 변수는 기저 시점 대비 510일차까지의 LDL-C 변화율이었다. 그 결과, LEQVIO군과 위약군 간 평균 LDL-C 변화율 차이는 -50%였으며, 95% 신뢰구간은 -53%에서 -47%, 통계적으로 유의한 차이가 확인되었다(Table 3). 연구 1과 연구 2의 통합 분석 결과, 치료 효과는 성별, 연령, 인종, 질환 특성, 지역, 당뇨병 유무, 체질량지수(BMI), 기저 LDL-C 수치, 스타틴 치료 강도 등 사전에 정의된 하위 그룹 전반에서 일관되게 유사하게 나타났다.임상 연구 3(ORION-9)은 다기관, 이중눈가림, 무작위 배정, 위약대조 방식으로 수행된 18개월 임상시험으로, 이형접합 가족성 고콜레스테롤혈증(HeFH)을 가진 482명의 환자가 등록되었다.피험자들은 LEQVIO 284mg 피하주사(n = 242) 또는 위약(n = 240)을 1일차, 90일차, 270일차, 450일차에 각각 투여받도록 1:1 비율로 무작위 배정되었다.모든 환자는 최대 내약 용량의 스타틴 치료를 받고 있었으며, 경우에 따라 기타 지질저하 치료제를 병용 중이었고, 추가적인 LDL 콜레스테롤 감소가 필요한 상태였다. HeFH 진단은 유전자 검사(genotyping) 또는 임상 진단 기준(Simon Broome 기준 또는 WHO/네덜란드 이상지질혈증 네트워크 기준)에 따라 이루어졌다. 환자들은 국가 및 스타틴/기타 지질저하제 사용 여부에 따라 층화 배정되었으며, PCSK9 억제제 사용자는 제외되었다.기저 시점에서 평균 연령은 55세(범위: 21~80세)였으며, 22%는 65세 이상, 53%는 여성, 94%는 백인, 3%는 흑인 또는 아프리카계 미국인, 3%는 아시아인, 3%는 히스패닉 또는 라틴계로 자가 보고하였다. 10%는 당뇨병을 동반, 기저 LDL-C 수치는 평균 153 mg/dL이었다. 무작위 배정 시점에서 90%는 스타틴 치료, 74%는 고강도 스타틴 치료, 52%는 에제티미브 병용 치료를 받고 있었다. 가장 흔히 사용된 스타틴은 아토르바스타틴과 로수바스타틴이었다.이 연구의 1차 유효성 평가 변수는 기저 시점 대비 510일차까지의 LDL-C 변화율이었다. 그 결과, LEQVIO군과 위약군 간 평균 LDL-C 변화율의 차이는 -48%, 95% 신뢰구간은 -54%에서 -42%, 통계적으로 매우 유의한 차이가 확인되었다(Table 4). 인클리시란의 어떤 쟁점이 예상되는가?인클리시란은 갈낙(GalNAc) 결합체를 이용해 간세포 특이적 전달을 구현하였으며, 반감기가 길어 초기 투여 후 3개월 시점에서 1회 추가 투여를 한 뒤에는 매 6개월 간격의 피하주사만으로 치료 효과를 유지할 수 있다. 이러한 간헐적 투여 방식은 기존의 PCSK9 단클론항체(mAb)와 비교해 환자 순응도 측면에서 분명한 이점을 제공하며, 임상 현장에서의 장기 관리 전략에 변화를 가져올 잠재력을 지닌다.3상 임상시험인 ORION-9, ORION-10, ORION-11에서 인클리시란은 18개월 동안 위약 대비 평균 약 50%의 LDL-C 지속 감소 효과를 입증하였으며, 효과 변동 폭이 적어(peak-trough variation 최소화) 일정한 치료 곡선을 유지하였다. 이러한 특징은 LDL-C의 지속적 억제가 중요한 죽상경화성 심혈관질환(ASCVD) 고위험군 환자에서 임상적으로 유리할 수 있다. 또한 약물의 전신적 부작용 발생률은 위약군과 유사하였으며, 가장 흔한 이상반응은 주사 부위 반응으로, 대부분 경미하고 일시적이었다.그러나 인클리시란의 임상적 가치에는 여전히 한계가 존재한다. 현재까지 보고된 자료는 LDL-C 감소라는 대리 지표(surrogate endpoint)에 기반하고 있으며, 심근경색, 뇌졸중, 심혈관 사망 등 주요 심혈관 사건을 감소시키는지에 대한 직접적 근거는 확보되지 않았다. 이를 검증하기 위한 대규모 무작위 대조시험 결과는 아직 발표되지 않았으며, 이는 약물의 장기적 위치를 결정하는 핵심 변수로 작용할 것이다. 또한 인클리시란은 투여 후 효과 발현까지 수 주에서 수개월이 소요되므로, 급성 관상동맥증후군(ACS) 직후와 같이 LDL-C의 신속한 강하가 필요한 상황에서는 mAb에 비해 제한적일 수 있다.더불어, siRNA 기반 치료제의 장기 안전성 자료는 제한적이며, 10년 이상 장기간 투여 시 면역 반응이나 비표적(off-target) 효과 가능성은 배제할 수 없으므로 지속적인 추적 관찰이 필요하다. 결과적으로 인클리시란은 PCSK9 억제제 영역에서 투여 편의성과 장기간 지속 효과라는 혁신적 특성을 바탕으로 차별화된 치료 옵션을 제공한다. 그러나 하드 아웃컴 자료의 부재, 효과 발현 속도의 한계, 경제성 논란, 장기 안전성 불확실성 등은 현 시점에서 광범위한 초기 사용을 제약하는 요소로 작용한다. 향후 심혈관 사건 감소에 대한 결정적 임상 근거가 확보되고 비용-효과성이 입증될 경우, 인클리시란은 고위험 ASCVD 환자의 2차 예방 및 장기 관리 전략에서 핵심적 역할을 차지할 잠재력이 크다.참고 문헌 1. Xiao-Long Lin et al. “Role of PCSK9 in Lipid Metabolism and Atherosclerosis” Biomedicine & Pharmacotherapy Volume 104, August 2018, Pages 36-44) 2. Yanzhen Zhang et al. “Inclisiran: a new generation of lipid-lowering siRNA therapeutic“ Front. Pharmacol., 13 October 2023. 3. Xiao-dan Xia et al. “Regulation of PCSK9 Expression and Function: Mechanisms and Therapeutic Implications” Front. Cardiovasc. Med. 8:764038, 2021. 4. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-09-05 12:00:14최병철 박사
소간섭 RNA 기반 LDL 콜레스테롤 저하제 '렉비오'③ 최초 소간섭 RNA(siRNA) 기반 LDL 콜레스테롤 저하제, '렉비오(Inclisiran)'렉비오(Leqvio®, leck-vee-oh, 성분명: 인클리시란, Inclisiran, 노바티스)는 소간섭 RNA(small interfering RNA, siRNA)기반의 저밀도지단백 콜레스테롤(LDL-C) 저하제로, PCSK9(proprotein convertase subtilisin/kexin type 9) mRNA를 표적으로 하여 작용한다.이 약제는 2020년 유럽의약청(EMA), 2021년 미국 식품의약국(FDA)으로부터 승인을 받았으며, 2024년 국내에서도 승인되었다. 국내 승인 적응증은 식이요법의 보조요법으로 사용되는 경우로, 다음과 같은 성인 환자를 대상으로 한다:- 최대 내약 용량의 스타틴 치료에도 불구하고 LDL-C 조절이 불충분한 원발성 고콜레스테롤혈증(이형접합 가족형 및 비가족형)또는 혼합형 이상지질혈증 환자 - 스타틴 불내성또는 스타틴 금기 환자렉비오(inclisiran)는 저밀도지단백 콜레스테롤(LDL-C) 저하를 목표로 개발된 소간섭 RNA(small interfering RNA, siRNA) 기반 치료제로, 기존 지질강하제와 차별화되는 새로운 치료 전략을 제시한다. 본 제제의 가장 큰 특징은 연 2회 투여 요법으로, 최초 투여 후 3개월 뒤 1회 추가 투여를 시행하고 이후에는 6개월 간격으로 피하 주사하는 방식이다. 이러한 투여 간격은 환자의 복약 순응도를 현저히 개선시키고, 장기간에 걸친 지속적 LDL-C 조절 효과를 제공한다는 점에서 임상적 차별성이 있다.작용 기전은 간세포 내에서 PCSK9 단백질 합성에 관여하는 mRNA를 표적 분해하는 것으로, 결과적으로 PCSK9의 발현을 억제한다. 이로 인해 LDL 수용체의 분해가 억제되고 수용체의 재활용이 촉진되어 혈중 LDL-C 농도가 유의하게 감소한다. 이러한 분자 기전은 단순한 단백질 억제제가 아닌, 전사 단계에서부터 표적을 차단하는 혁신적 접근을 반영한다.렉비오의 임상적 유효성과 안전성은 ORION-9, ORION-10, ORION-11 등 다수의 3상 임상시험을 통해 평가되었다. 총 3456명의 환자를 대상으로 평균 17개월간 추적 관찰한 결과, 렉비오 투여군은 위약군에 비해 LDL-C 수치가 최대 52%까지 지속적으로 감소하였다.전반적인 내약성은 양호하였으며, 안전성 프로파일 또한 위약군과 유사하였다. 보고된 이상반응은 대부분 경도에서 중등도 수준으로, 주사 부위 반응(통증, 발적, 발진), 관절통, 요로감염, 설사, 기침, 사지통증, 호흡곤란 등이 있으나 임상적으로 중대한 안전성 문제는 확인되지 않았다.이러한 근거를 바탕으로 렉비오는 죽상경화성 심혈관질환(ASCVD) 또는 이형접합 가족형 고콜레스테롤혈증(HeFH) 환자에서, 기존 요법으로 충분한 LDL-C 강하가 이루어지지 않는 경우 사용 가능한 약제로 임상적 의의를 가진다. 특히, 장기간의 안정적인 LDL-C 감소 효과와 간편한 투여 스케줄은 실제 진료 현장에서 환자 관리의 효율성을 높인다.원발성 고콜레스테롤혈증(Primary hyperlipidemia)는 어떤 질환인가? 고콜레스테롤혈증은 혈중 저밀도지단백 콜레스테롤(low-density lipoprotein cholesterol, LDL-C) 수치가 비정상적으로 증가된 상태를 의미하며, 이는 죽상경화성 심혈관질환(atherosclerotic cardiovascular disease, ASCVD)의 발병 위험을 크게 높이는 대사적 이상 중 하나이다.원발성 고콜레스테롤혈증은 주로 유전적 요인에 의해 발생하며, 대표적으로 가족성 고콜레스테롤혈증(familial hypercholesterolemia, FH)이 포함된다. 이러한 유전성 이상지질혈증은 소아기 또는 청소년기부터 지속적인 LDL-C 상승이 나타나며, 적절한 치료가 이루어지지 않으면 조기 동맥경화증이 진행되고, 심근경색이나 뇌졸중과 같은 중증 심혈관질환으로 이어질 수 있다.원발성 고콜레스테롤혈증은 크게 FH와 비가족성(다유전자성) 고콜레스테롤혈증으로 구분된다. FH는 단일 유전자의 병적 변이에 의해 발생하는 모노제닉(monogenic) 질환으로, 주로 LDL 수용체(LDLR), 아포지단백 B(APOB), 또는 PCSK9 유전자의 기능 이상이 원인이다. 이로 인해 간세포에서 LDL 입자의 제거가 저해되고, 결과적으로 혈중 LDL-C가 병적으로 상승한다.FH는 다시 이형접합형(heterozygous FH, HeFH)과 동형접합형(homozygous FH, HoFH)으로 나뉜다. 이형접합형은 대립유전자 한 쌍 중 하나에 변이가 존재하는 경우로 약 500명 중 1명꼴로 비교적 흔하게 발생한다. 이들 환자는 출생 시부터 LDL-C 수치가 상승되어 있으며, 치료가 이루어지지 않으면 성인 초기(30~50대)에 관상동맥질환(coronary artery disease, CAD) 발생 위험이 크게 증가한다.반면, 동형접합형은 양쪽 대립유전자 모두에 변이가 존재하는 경우로 약 100만 명 중 1명꼴로 매우 드물다. 이 경우 출생 직후부터 LDL-C 수치가 극단적으로 상승하며, 10세 이전에 심근경색이나 대동맥 협착과 같은 심각한 심혈관질환이 발생할 수 있다. 동형접합 환자는 일반적인 스타틴 치료에 대한 반응이 낮아, LDL 성분 제거술(apheresis)이나 PCSK9 억제제, siRNA 기반 치료제 등 고강도 치료 전략이 요구된다.비가족성 고콜레스테롤혈증은 FH와 달리 단일 유전자 변이가 확인되지 않으며, 다수의 유전적 요인에 더해 식습관, 운동 부족, 대사 이상과 같은 환경적 요인이 복합적으로 작용하여 LDL-C가 상승하는 형태이다. 이 경우 뚜렷한 가족력이 없는 경우가 많으며, 임상적으로는 FH와 유사한 소견을 보이지만 병적 변이를 유전자 검사로 확인하기 어려운 경우가 많다.한편, 혼합형 이상지질혈증(mixed dyslipidemia 또는 familial combined hyperlipidemia, FCH)은 LDL-C와 중성지방(triglyceride)의 동반 상승을 특징으로 하며, 경우에 따라 고밀도지단백 콜레스테롤(high-density lipoprotein cholesterol, HDL-C)이 감소하기도 한다. 이는 강한 유전적 소인을 가지며, 조기 ASCVD 발생 위험이 높아 조기 진단과 적극적인 치료가 필수적이다.죽상동맥경화성 심혈관질환(Atherosclerotic cardiovascular disease, ASCVD)은 무엇인가?죽상경화증(Atherosclerosis)은 전 세계적으로 가장 중요한 만성 혈관 질환 중 하나로, 대형 탄성 동맥(elastic artery)과 근육형 동맥(muscular artery)의 내막(intima)에 지질, 염증세포, 평활근세포, 그리고 섬유성 기질이 비정상적으로 축적되는 병리학적 과정을 의미한다. 이러한 변화는 초기에는 무증상 상태에서 수십 년간 서서히 진행되며, 동맥 내강의 협착이나 혈류 장애를 즉각적으로 유발하지 않을 수 있다.병리학적으로는 지방선조(fatty streak)의 형성에서 시작하여, 섬유성 플라크(fibrous plaque)와 복합 병변(complicated lesion)으로 점진적으로 진행한다. 이 과정에는 내피세포 기능장애(endothelial dysfunction), 산화 변성된 저밀도지단백(oxidized LDL)의 침착, 염증 반응, 평활근세포 증식 및 기질 침착, 그리고 플라크의 파열 또는 미란에 따른 혈전 형성이 연속적으로 관여한다.죽상경화성 심혈관질환(Atherosclerotic cardiovascular disease, ASCVD)은 이러한 죽상경화증이 임상적으로 발현된 상태를 포괄하는 개념이다. ASCVD에는 관상동맥질환(coronary heart disease, CHD), 허혈성 뇌졸중(ischemic stroke)과 일과성 허혈발작(transient ischemic attack, TIA), 그리고 말초동맥질환(peripheral arterial disease, PAD) 등이 포함된다. 즉, 죽상경화증이 혈관벽 내부에서 일어나는 병리학적 변화를 지칭한다면, ASCVD는 이러한 변화가 특정 혈관의 혈류를 현저히 방해하거나 혈전을 유발함으로써 발생하는 임상적 결과를 의미한다.ASCVD의 발생은 죽상경화증의 진행과 직결되어 있으며, 특히 저밀도지단백 콜레스테롤(LDL-C)의 장기간 상승이 핵심적 병인 인자로 확립되어 있다. LDL-C 상승은 죽상경화증을 유발하는 필수적 요인으로, 기초과학 연구, 전향적 코호트 연구, 무작위 대조 임상시험 모두에서 LDL-C와 ASCVD 위험 간의 명확한 인과관계가 확인되었다.그러나 LDL-C 강하 치료가 ASCVD 발생 위험을 감소시킨다는 방대한 근거가 축적되어 있음에도 불구하고, 전 세계적으로 고위험군 및 초고위험군 환자 중 상당수는 여전히 LDL-C 목표치에 도달하지 못하고 있으며, 지난 수십 년간 이 비율의 뚜렷한 개선은 관찰되지 않았다.PCSK9(Proprotein convertase subtilisin kexin type 9)이란 무엇인가?혈장 내 저밀도지단백 콜레스테롤(LDL-C)은 주로 간세포 표면에 존재하는 LDL 수용체(LDL receptor, LDLR)를 통해 제거된다. LDL이 LDLR에 결합하면 이 복합체는 클라트린-피복 소낭(clathrin-coated vesicle)을 통해 세포 내로 내재화되어 엔도솜(endosome)으로 이동한다. 이 과정에서 LDL은 수용체로부터 분리된 후 리소좀(lysosome)에서 분해되고, LDLR은 재활용되어 다시 세포 표면으로 이동함으로써 추가적인 LDL 제거에 활용된다.PCSK9(Proprotein Convertase Subtilisin/Kexin Type 9)은 이러한 LDLR 재활용 과정을 억제하고, LDLR의 리소좀 분해를 촉진하는 역할을 한다(Figure 1). 순환 중인 PCSK9은 특히 간세포 표면의 헤파란 황산 프로테오글리칸(heparan sulfate proteoglycans, HSPG)과 결합하여 세포 내로 유입되며, LDLR의 분해를 선택적으로 강화한다. 실제로 PCSK9 유전자 결손 생쥐에서는 간 내 LDLR 발현이 증가하고 혈장 LDL-C가 감소하며, 스타틴 치료에 대한 반응성이 향상되는 것이 확인되었다. LDL은 간에서 분비되는 중성지방 풍부 리포단백질인 초저밀도지단백(very low-density lipoprotein, VLDL)의 대사 산물이다. VLDL은 혈관 내에서 지방단백질 리파아제(lipoprotein lipase)에 의해 중성지방이 가수분해되어 중간밀도지단백(intermediate-density lipoprotein, IDL)으로 전환되며, 이후 다시 LDL로 변환된다. PCSK9은 VLDL의 주요 구조 단백질인 아포지단백 B100(apolipoprotein B100, apoB100)과 직접 결합하여 그 분해를 억제하고, 결과적으로 VLDL의 분비를 촉진할 수 있다.실제로 PCSK9 유전자 결손 생쥐에서는 간 내 apoB 분비와 혈장 LDL-C가 감소하는 반면, 기능획득 변이를 가진 PCSK9은 간암 세포주에서 apoB100의 분비를 증가시킨 바 있다. 이러한 결과는 PCSK9이 간세포 표면의 LDLR 수를 감소시키는 것뿐 아니라, VLDL 분비를 증가시켜 LDL 생성에도 기여할 수 있음을 시사한다. 다만 간세포는 일반적으로 apoB100을 과량 생산하며, VLDL 분비의 병목 단계는 apoB100의 지질화(lipidation) 과정이므로, PCSK9 매개 VLDL 분비 증가의 생리적 중요성은 제한적일 수 있다.PCSK9은 간 이외에도 다양한 조직에서 발현되며, 혈관 평활근세포(vascular smooth muscle cell, VSMC), 대식세포, 내피세포뿐 아니라 췌장, 신장, 장, 중추신경계 등에서도 확인된다. 특히 혈류 전단 응력이 낮은 대동맥이나 대퇴동맥의 분지부와 같이 죽상경화증 호발 부위에서 혈관벽의 PCSK9 발현이 높게 관찰된다. 배양된 VSMC는 내피세포보다 훨씬 더 많은 PCSK9을 생성하며, 이로 인해 VSMC 및 대식세포 내 LDLR 수준이 감소할 수 있다. 이러한 변화는 LDL 제거 능력을 저해하고, LDL이 혈관벽에 잔류하여 죽상경화증 진행을 촉진하는 병리적 기전으로 작용할 가능성이 제기되고 있다.PSCK 억제제에는 어떤 약제가 있는가?혈중 LDL-C을 효과적으로 감소시키는 것은 ASCVD의 예방과 치료에서 핵심 전략으로 자리잡고 있다. 스타틴(statin)은 HMG-CoA 환원효소를 억제하여 간에서의 콜레스테롤 생합성을 감소시키고, LDL 수용체(LDL receptor, LDLR) 발현을 증가시킴으로써 LDL-C를 저하시킨다.이러한 기전으로 인해 스타틴은 1차 치료제로 널리 사용되어 왔으나, 일부 환자에서는 고용량 스타틴 또는 에제티미브 병용에도 불구하고 목표 LDL-C 수치에 도달하지 못하거나, 약물 관련 부작용으로 장기 치료 지속이 어려운 한계가 존재한다.이러한 한계를 극복하기 위해 새로운 지질강하제들이 개발되었으며, 그중에서도 PCSK9을 표적하는 치료제들이 주목받고 있다. PCSK9은 간세포 표면의 LDLR을 리소좀으로 유도하여 분해를 촉진함으로써 LDLR의 재활용을 억제하고, 결과적으로 혈중 LDL-C 제거를 감소시키는 단백질이다. 따라서 PCSK9 활성을 억제하면 간세포 표면의 LDLR 수가 증가하고, 이를 통해 혈중 LDL-C를 효과적으로 저하시킬 수 있다.현재 임상적으로 사용되는 PCSK9 억제제는 크게 두 계열로 구분된다. 첫째, 인간 단일클론 항체(monoclonal antibody) 계열로, 순환 중 PCSK9과 직접 결합하여 LDLR과의 상호작용을 차단한다. 대표적으로 에볼로쿠맙(Evolocumab, 상품명 Repatha)과 알리로쿠맙(alirocumab, 상품명 Praluent)이 있으며, 이들 약제는 2주 또는 4주 간격의 피하 주사제로 투여된다. 대규모 임상연구인 FOURIER 및 ODYSSEY Outcomes를 통해 이들 약제가 LDL-C를 유의하게 감소시킬 뿐만 아니라 주요 심혈관 사건 발생을 줄이는 효과가 입증되었다.둘째, 소간섭 RNA(small interfering RNA, siRNA) 기반 치료제가 있다. 대표적으로 인클리시란(inclisiran)은 간세포 내에서 PCSK9 mRNA를 선택적으로 분해하여 PCSK9 단백질 발현 자체를 억제한다. 이 약제는 연 2회의 피하 투여만으로도 지속적인 LDL-C 강하 효과를 유도할 수 있으며, 복약 순응도 측면에서 뚜렷한 장점을 제공한다.인클리시란(렉비오)는 어떤 약제인가?인클리시란은 이중가닥 소간섭 리보핵산(siRNA)으로, 센스 가닥(sense strand)에 삼분지 구조의 N-아세틸갈락토사민(triantennary N-acetylgalactosamine, GalNAc)이 결합되어 있다. 이 구조는 아실로당 수용체(asialoglycoprotein receptor, ASGPR)를 통한 간세포(hepatocyte)로의 선택적 흡수를 촉진한다. 세포 내로 유입된 인클리시란은 RNA 간섭(RNA interference) 경로를 통해 PCSK9 mRNA를 선택적으로 분해함으로써 단백질 발현을 억제한다.이 과정의 결과로 PCSK9 단백질의 생성이 감소하고, LDL 수용체(LDL receptor, LDLR)의 재활용과 세포 표면 발현이 증가한다. 발현이 증가한 LDLR은 혈액 내 저밀도지단백 콜레스테롤(low-density lipoprotein cholesterol, LDL-C)을 보다 효율적으로 흡수하게 되며, 이를 통해 혈중 LDL-C 농도가 유의하게 저하된다.인클리시란의 약리 기전은?인클리시란(inclisiran)은 간세포막에 존재하는 ASGPR에 선택적으로 결합함으로써 세포 내로 흡수된다. 이 과정에서 삼분지 구조의 GalNAc이 핵심적인 역할을 하며, GalNAc는 당 분자로서 인클리시란이 ASGPR에 대해 높은 친화도와 선택성을 가지도록 돕는다. ASGPR은 간세포에서 당단백질의 엔도시토시스(endocytosis)를 매개하는 수용체로, 인클리시란은 이 경로를 통해 효율적으로 간세포 내로 유입된다.세포 내로 진입한 인클리시란은 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 결합한다. RISC는 siRNA의 가이드 가닥을 이용하여 표적 mRNA를 인식하고 절단하는 단백질 복합체이다. 이 과정에서 인클리시란의 안티센스(antisense) 가닥이 PCSK9 단백질을 암호화하는 mRNA에 결합하여, 해당 mRNA를 선택적으로 절단하고 분해한다. 결과적으로 PCSK9 단백질의 합성이 억제된다(Figure 2).PCSK9은 간세포 표면의 LDL 수용체(LDL receptor, LDLR) 발현을 조절하는 핵심 단백질로, LDLR에 결합하여 이를 리소좀으로 유도하고 분해시킴으로써 혈중 LDL 콜레스테롤(LDL-C) 제거 능력을 저하시킨다. 따라서 인클리시란은 PCSK9 생성을 억제하여 간세포 표면의 LDLR 발현을 증가시키며, 이로써 혈중 LDL-C를 효율적으로 감소시키는 효과를 나타낸다. 렉비오의 임상 결과는 어떠한가?LEQVIO(렉비오)의 유효성은 총 3건의 무작위, 이중눈가림, 위약대조 임상시험을 통해 평가되었다. 이들 연구는 이형접합 가족성 고콜레스테롤혈증(HeFH), 임상적으로 확인된 죽상경화성 심혈관질환(ASCVD), 또는 ASCVD 고위험군에 해당하는 성인 총 3,660명을 대상으로 하였다.이들은 모두 최대 내약 용량의 스타틴 치료를 받고 있음에도 불구하고 추가적인 LDL-C 저하가 필요한 환자들이었다. 세 임상시험 모두에서 치료군 간의 인구학적 특성 및 기저 질환 특성은 균형 있게 분포되어 있었다.임상 연구 1(ORION-10)은 다기관, 이중눈가림, 무작위 배정, 위약대조 방식으로 수행된 18개월간의 임상시험으로, 죽상경화성 심혈관질환(ASCVD)을 가진 1,561명의 환자가 등록되었다. 이들은 LEQVIO 284mg 피하주사 또는 위약을 1:1 비율로 배정받아 1일차, 90일차, 270일차, 450일차에 각각 투여되었다.모든 참가자는 최대 내약 용량의 스타틴 치료를 받고 있었으며, 추가적인 LDL 콜레스테롤(LDL-C) 저하가 필요한 상태였다. 스타틴 또는 기타 지질 저하 치료제의 사용 여부에 따라 환자들은 층화 배정되었으며, PCSK9 억제제를 복용 중인 환자는 연구에서 제외되었다.등록 당시 평균 연령은 66세(범위: 35~90세)였으며, 전체의 60%가 65세 이상, 31%는 여성, 86%는 백인, 13%는 흑인 또는 아프리카계 미국인, 1%는 아시아인, 그리고 14%는 히스패닉 또는 라틴계로 자가 보고하였다. 또한 45%의 환자는 당뇨병을 동반하고 있었으며, 기저 LDL-C 평균치는 105mg/dL이었다. 무작위 배정 시점에서 89%의 환자가 스타틴 치료를 받고 있었고, 그 중 69%는 고강도 스타틴 치료를 받고 있었다.연구 결과, 1차 유효성 평가 변수는 기저 시점 대비 510일차까지의 LDL-C 수치 변화율이었다. 그 결과, LEQVIO군과 위약군 간 평균 LDL-C 변화율의 차이는 -52%였으며, 95% 신뢰구간은 -56%에서 -49%, 통계적으로 유의미한 차이가 나타났다(Table 2). 임상 연구 2(ORION-11)은 다기관, 이중눈가림, 무작위 배정, 위약대조 방식으로 수행된 18개월 임상시험으로, 죽상경화성 심혈관질환(ASCVD) 또는 ASCVD 고위험군에 해당하는 성인 1,617명을 대상으로 하였다. 피험자들은 LEQVIO 284mg 피하주사(n = 810) 또는 위약(n = 807)을 1일차, 90일차, 270일차, 450일차에 각각 투여받도록 1:1 비율로 무작위 배정되었다.참가자는 모두 최대 내약 용량의 스타틴 치료를 받고 있었으며, 경우에 따라 기타 지질저하 치료제를 병용하고 있었고, 추가적인 LDL 콜레스테롤(LDL-C) 감소가 필요한 상태였다. 환자들은 국가 및 스타틴/기타 지질저하제 사용 여부에 따라 층화 배정되었으며, PCSK9 억제제를 복용 중인 환자는 연구에서 제외되었다.기저 시점에서 평균 연령은 65세(범위: 20~88세)였으며, 55%가 65세 이상, 28%는 여성, 98%는 백인, 1%는 흑인 또는 아프리카계 미국인, 1% 미만은 아시아인, 1% 미만이 히스패닉 또는 라틴계로 자가 보고하였다. 또한 35%의 환자가 당뇨병을 동반하고 있었으며, 기저 LDL-C 평균치는 105 mg/dL이었다. 무작위 배정 시점에서 95%는 스타틴 치료를 받고 있었고, 이 중 78%는 고강도 스타틴 치료 중이었다.이 연구의 1차 유효성 평가 변수는 기저 시점 대비 510일차까지의 LDL-C 변화율이었다. 그 결과, LEQVIO군과 위약군 간 평균 LDL-C 변화율 차이는 -50%였으며, 95% 신뢰구간은 -53%에서 -47%, 통계적으로 유의한 차이가 확인되었다(Table 3). 연구 1과 연구 2의 통합 분석 결과, 치료 효과는 성별, 연령, 인종, 질환 특성, 지역, 당뇨병 유무, 체질량지수(BMI), 기저 LDL-C 수치, 스타틴 치료 강도 등 사전에 정의된 하위 그룹 전반에서 일관되게 유사하게 나타났다.임상 연구 3(ORION-9)은 다기관, 이중눈가림, 무작위 배정, 위약대조 방식으로 수행된 18개월 임상시험으로, 이형접합 가족성 고콜레스테롤혈증(HeFH)을 가진 482명의 환자가 등록되었다.피험자들은 LEQVIO 284mg 피하주사(n = 242) 또는 위약(n = 240)을 1일차, 90일차, 270일차, 450일차에 각각 투여받도록 1:1 비율로 무작위 배정되었다.모든 환자는 최대 내약 용량의 스타틴 치료를 받고 있었으며, 경우에 따라 기타 지질저하 치료제를 병용 중이었고, 추가적인 LDL 콜레스테롤 감소가 필요한 상태였다. HeFH 진단은 유전자 검사(genotyping) 또는 임상 진단 기준(Simon Broome 기준 또는 WHO/네덜란드 이상지질혈증 네트워크 기준)에 따라 이루어졌다. 환자들은 국가 및 스타틴/기타 지질저하제 사용 여부에 따라 층화 배정되었으며, PCSK9 억제제 사용자는 제외되었다.기저 시점에서 평균 연령은 55세(범위: 21~80세)였으며, 22%는 65세 이상, 53%는 여성, 94%는 백인, 3%는 흑인 또는 아프리카계 미국인, 3%는 아시아인, 3%는 히스패닉 또는 라틴계로 자가 보고하였다. 10%는 당뇨병을 동반, 기저 LDL-C 수치는 평균 153 mg/dL이었다. 무작위 배정 시점에서 90%는 스타틴 치료, 74%는 고강도 스타틴 치료, 52%는 에제티미브 병용 치료를 받고 있었다. 가장 흔히 사용된 스타틴은 아토르바스타틴과 로수바스타틴이었다.이 연구의 1차 유효성 평가 변수는 기저 시점 대비 510일차까지의 LDL-C 변화율이었다. 그 결과, LEQVIO군과 위약군 간 평균 LDL-C 변화율의 차이는 -48%, 95% 신뢰구간은 -54%에서 -42%, 통계적으로 매우 유의한 차이가 확인되었다(Table 4). 인클리시란의 어떤 쟁점이 예상되는가?인클리시란은 갈낙(GalNAc) 결합체를 이용해 간세포 특이적 전달을 구현하였으며, 반감기가 길어 초기 투여 후 3개월 시점에서 1회 추가 투여를 한 뒤에는 매 6개월 간격의 피하주사만으로 치료 효과를 유지할 수 있다. 이러한 간헐적 투여 방식은 기존의 PCSK9 단클론항체(mAb)와 비교해 환자 순응도 측면에서 분명한 이점을 제공하며, 임상 현장에서의 장기 관리 전략에 변화를 가져올 잠재력을 지닌다.3상 임상시험인 ORION-9, ORION-10, ORION-11에서 인클리시란은 18개월 동안 위약 대비 평균 약 50%의 LDL-C 지속 감소 효과를 입증하였으며, 효과 변동 폭이 적어(peak-trough variation 최소화) 일정한 치료 곡선을 유지하였다. 이러한 특징은 LDL-C의 지속적 억제가 중요한 죽상경화성 심혈관질환(ASCVD) 고위험군 환자에서 임상적으로 유리할 수 있다. 또한 약물의 전신적 부작용 발생률은 위약군과 유사하였으며, 가장 흔한 이상반응은 주사 부위 반응으로, 대부분 경미하고 일시적이었다.그러나 인클리시란의 임상적 가치에는 여전히 한계가 존재한다. 현재까지 보고된 자료는 LDL-C 감소라는 대리 지표(surrogate endpoint)에 기반하고 있으며, 심근경색, 뇌졸중, 심혈관 사망 등 주요 심혈관 사건을 감소시키는지에 대한 직접적 근거는 확보되지 않았다. 이를 검증하기 위한 대규모 무작위 대조시험 결과는 아직 발표되지 않았으며, 이는 약물의 장기적 위치를 결정하는 핵심 변수로 작용할 것이다. 또한 인클리시란은 투여 후 효과 발현까지 수 주에서 수개월이 소요되므로, 급성 관상동맥증후군(ACS) 직후와 같이 LDL-C의 신속한 강하가 필요한 상황에서는 mAb에 비해 제한적일 수 있다.더불어, siRNA 기반 치료제의 장기 안전성 자료는 제한적이며, 10년 이상 장기간 투여 시 면역 반응이나 비표적(off-target) 효과 가능성은 배제할 수 없으므로 지속적인 추적 관찰이 필요하다. 결과적으로 인클리시란은 PCSK9 억제제 영역에서 투여 편의성과 장기간 지속 효과라는 혁신적 특성을 바탕으로 차별화된 치료 옵션을 제공한다. 그러나 하드 아웃컴 자료의 부재, 효과 발현 속도의 한계, 경제성 논란, 장기 안전성 불확실성 등은 현 시점에서 광범위한 초기 사용을 제약하는 요소로 작용한다. 향후 심혈관 사건 감소에 대한 결정적 임상 근거가 확보되고 비용-효과성이 입증될 경우, 인클리시란은 고위험 ASCVD 환자의 2차 예방 및 장기 관리 전략에서 핵심적 역할을 차지할 잠재력이 크다.참고 문헌 1. Xiao-Long Lin et al. “Role of PCSK9 in Lipid Metabolism and Atherosclerosis” Biomedicine & Pharmacotherapy Volume 104, August 2018, Pages 36-44) 2. Yanzhen Zhang et al. “Inclisiran: a new generation of lipid-lowering siRNA therapeutic“ Front. Pharmacol., 13 October 2023. 3. Xiao-dan Xia et al. “Regulation of PCSK9 Expression and Function: Mechanisms and Therapeutic Implications” Front. Cardiovasc. Med. 8:764038, 2021. 4. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-09-05 12:00:14최병철 박사 -
 "AI 내시경 도입, 중소도시 의료격차 해소 기대"[데일리팜=황병우 기자] 경남 밀양의 거점 의료기관인 밀양병원이 최신 AI 내시경 시스템 ‘웨이메드 엔도(WAYMED ENDO)’를 도입하며 소도시 의료 환경에 새로운 변화를 불러오고 있다.단순히 장비 교체 차원을 넘어, 숙련된 소화기내과 전문의와 인공지능 기술이 결합해 조기 진단과 치료 효율성을 높이는 데 기여하고 있다는 평가다.고상훈 밀양병원 3내과 과장데일리팜은 고상훈 밀양병원 3내과 과장(소화기내과)을 만나 지역의료에서 인공지능(AI) 활용 가능성에 대해 들어봤다.밀양병원 내시경센터가 AI 내시경을 도입한 배경에는 의료 환경 변화에 대한 대응이 자리하고 있다.고 과장은 "예전에는 환자를 많이 치료한 경험이 많은 의사가 명의로 통했지만, 요즘에는 누가 빠르고 정확하게 진단해 치료를 시작하느냐가 중요한 기준이 되고 있다"고 설명했다.빠르고 정밀한 진단이 곧 환자 생존율과 직결되는 만큼, 병원 차원에서 첨단 기술을 활용해 내시경 진단의 수준을 끌어올릴 필요가 있었다는 의미다. 이러한 이유로 밀양병원은 지난 5월 웨이센의 AI 내시경 보조솔루션 웨이메드 엔도를 지역 중소병원 가운데 선도적으로 도입한 상태다.AI 기술이 여전히 보조의 역할에 머무르고 있다는 점에서 활용도에 대해 의문부호가 여전히 있는 상황. AI 내시경 도입 초기 단계지만 활용도에 대한 우려는 해소됐다는 평가다.고 과장은 "아무리 숙련된 의사라도 본인이 판단하기 애매한 병변들이 있는데, 그때 옆에서 다른 의사가 같이 봐주는 느낌을 받을 수 있어서 도움이 됐다"며 "경험 많은 의사에게도 AI가 제2의 시야 역할을 하며 진단 보조 파트너처럼 기능할 것으로 본다"고 말했다.또 그는 내시경 검사에서 의사의 피로도 감소, 정확성의 증가, 환자 자체의 안정성 증가 등 실질적인 효과를 체감하고 있다고 언급했다.고 과장은 "작은 용종을 어떻게 놓치지 않느냐는 게 내시경 의사들의 늘 고민인데, 웨이메드 엔도 도입으로 그런 작은 병변도 직접 발견하고 정확한 진단과 치료가 빨리 이루어질 수 있게 됐다"며 "검사 시간 단축으로 환자의 수면 시간과 통증이 줄어들어 안전성도 높아졌다"고 강조했다.이어 그는 "내시경 의사가 편해야 환자도 안전하게 검사받을 수 있는데, 웨이메드 엔도는 정확도·안정성에서 장점을 가지고 있다"며 "AI가 실시간으로 이상 소견을 잡아주니 검사의 몰입도가 높아지고 실수에 대한 부담이 줄었다"고 전했다.이러한 강점은 환자의 만족도 상승으로 연결됐다는 게 고 과장의 의견이다.그는 "2~3년 전에 똑같은 검사를 받았던 분들이 AI 활용 과정을 설명 들은 후 정확하고 편안하게 검사를 받았다고 말한다"며 "AI 보조로 검사가 빨리 끝나며 수면내시경의 진정 시간도 짧아져 고령 환자의 부담이 감소하는 등 긍정적인 피드백을 받고 있다"고 말했다.고상훈 과장이 내시경을 시행하고 있다 '전문가+AI기술' 시너지 주목…정책적 지원 필요성 강조밀양병원의 사례는 AI 내시경이 수도권 대형병원뿐 아니라 지역 중소병원에서도 충분히 활용 가치가 높다는 점을 보여준다.이와 관련해 고 과장은 지방 중소도시 병원의 경우 전문의 인력이나 첨단 장비가 상대적으로 부족하기 쉽지만, AI 보조솔루션이 이런 약점을 일부 해소해 줄 수 있다"며 "오히려 대학병원보다 중소병원에서 AI 내시경이 더 필요할 것으로 본다"고 밝혔다.인력 부족한 의료 환경에서도 AI가 옆에서 정확도를 높여주고 안전하게 치료할 수 있도록 도와주는 환경이 조성되면 AI 내시경이 열악한 지역의료의 질 향상에 기여할 수 있다는 판단이다.다만 고 과장은 AI의 강점을 활용하되 무조건 AI에 의존해서는 안 된다고 말했다.그는 "AI 내시경이 아무리 정확도가 높아도 의사의 풍부한 숙련도와 경험을 완전히 대체하긴 어려워 의사와 AI의 시너지를 내는 게 중요하다"며 "의사 혼자만의 능력에 의존하지 않고 AI의 보조적 기능을 접목할 때 진정한 시너지가 날 것으로 본다"고 강조했다.끝으로 고상훈 과장은 AI 의료기술의 확산을 뒷받침할 정책적 지원이 필요하다고 조언했다.그는 "소도시 중소도시의 의료 환경이 열악하다 보니 시민들이 제대로 된 의료 혜택을 받기 힘든 상황"이라며 "오히려 큰 병원이 아니라 작은 중소도시에 혜택을 줘 의료진 부족과 시설 부족을 보완하고, 작은 도시 시민들도 의료 혜택을 크게 누릴 수 있게 해 줬으면 좋겠다"고 전했다.첨단 AI 내시경 도입에 대한 정부·지자체 차원의 지원이 이루어진다면, 더 많은 지역병원이 도입을 검토해 환자들에게 돌아가는 혜택이 커질 것이라는 의미다.고 과장은 "현재 도입한 웨이메드 엔도 같은 좋은 프로그램들이 계속 개발되고 활용된다면 환자들에게 더욱 많은 도움이 될 것"이라며 "병원과 의사는 결국 환자가 있기에 존재하는 만큼 앞으로도 환자 중심의 의료 환경을 위해 AI와 같은 새로운 기술을 적극 활용하겠다"고 덧붙였다.2025-09-05 06:12:12황병우
"AI 내시경 도입, 중소도시 의료격차 해소 기대"[데일리팜=황병우 기자] 경남 밀양의 거점 의료기관인 밀양병원이 최신 AI 내시경 시스템 ‘웨이메드 엔도(WAYMED ENDO)’를 도입하며 소도시 의료 환경에 새로운 변화를 불러오고 있다.단순히 장비 교체 차원을 넘어, 숙련된 소화기내과 전문의와 인공지능 기술이 결합해 조기 진단과 치료 효율성을 높이는 데 기여하고 있다는 평가다.고상훈 밀양병원 3내과 과장데일리팜은 고상훈 밀양병원 3내과 과장(소화기내과)을 만나 지역의료에서 인공지능(AI) 활용 가능성에 대해 들어봤다.밀양병원 내시경센터가 AI 내시경을 도입한 배경에는 의료 환경 변화에 대한 대응이 자리하고 있다.고 과장은 "예전에는 환자를 많이 치료한 경험이 많은 의사가 명의로 통했지만, 요즘에는 누가 빠르고 정확하게 진단해 치료를 시작하느냐가 중요한 기준이 되고 있다"고 설명했다.빠르고 정밀한 진단이 곧 환자 생존율과 직결되는 만큼, 병원 차원에서 첨단 기술을 활용해 내시경 진단의 수준을 끌어올릴 필요가 있었다는 의미다. 이러한 이유로 밀양병원은 지난 5월 웨이센의 AI 내시경 보조솔루션 웨이메드 엔도를 지역 중소병원 가운데 선도적으로 도입한 상태다.AI 기술이 여전히 보조의 역할에 머무르고 있다는 점에서 활용도에 대해 의문부호가 여전히 있는 상황. AI 내시경 도입 초기 단계지만 활용도에 대한 우려는 해소됐다는 평가다.고 과장은 "아무리 숙련된 의사라도 본인이 판단하기 애매한 병변들이 있는데, 그때 옆에서 다른 의사가 같이 봐주는 느낌을 받을 수 있어서 도움이 됐다"며 "경험 많은 의사에게도 AI가 제2의 시야 역할을 하며 진단 보조 파트너처럼 기능할 것으로 본다"고 말했다.또 그는 내시경 검사에서 의사의 피로도 감소, 정확성의 증가, 환자 자체의 안정성 증가 등 실질적인 효과를 체감하고 있다고 언급했다.고 과장은 "작은 용종을 어떻게 놓치지 않느냐는 게 내시경 의사들의 늘 고민인데, 웨이메드 엔도 도입으로 그런 작은 병변도 직접 발견하고 정확한 진단과 치료가 빨리 이루어질 수 있게 됐다"며 "검사 시간 단축으로 환자의 수면 시간과 통증이 줄어들어 안전성도 높아졌다"고 강조했다.이어 그는 "내시경 의사가 편해야 환자도 안전하게 검사받을 수 있는데, 웨이메드 엔도는 정확도·안정성에서 장점을 가지고 있다"며 "AI가 실시간으로 이상 소견을 잡아주니 검사의 몰입도가 높아지고 실수에 대한 부담이 줄었다"고 전했다.이러한 강점은 환자의 만족도 상승으로 연결됐다는 게 고 과장의 의견이다.그는 "2~3년 전에 똑같은 검사를 받았던 분들이 AI 활용 과정을 설명 들은 후 정확하고 편안하게 검사를 받았다고 말한다"며 "AI 보조로 검사가 빨리 끝나며 수면내시경의 진정 시간도 짧아져 고령 환자의 부담이 감소하는 등 긍정적인 피드백을 받고 있다"고 말했다.고상훈 과장이 내시경을 시행하고 있다 '전문가+AI기술' 시너지 주목…정책적 지원 필요성 강조밀양병원의 사례는 AI 내시경이 수도권 대형병원뿐 아니라 지역 중소병원에서도 충분히 활용 가치가 높다는 점을 보여준다.이와 관련해 고 과장은 지방 중소도시 병원의 경우 전문의 인력이나 첨단 장비가 상대적으로 부족하기 쉽지만, AI 보조솔루션이 이런 약점을 일부 해소해 줄 수 있다"며 "오히려 대학병원보다 중소병원에서 AI 내시경이 더 필요할 것으로 본다"고 밝혔다.인력 부족한 의료 환경에서도 AI가 옆에서 정확도를 높여주고 안전하게 치료할 수 있도록 도와주는 환경이 조성되면 AI 내시경이 열악한 지역의료의 질 향상에 기여할 수 있다는 판단이다.다만 고 과장은 AI의 강점을 활용하되 무조건 AI에 의존해서는 안 된다고 말했다.그는 "AI 내시경이 아무리 정확도가 높아도 의사의 풍부한 숙련도와 경험을 완전히 대체하긴 어려워 의사와 AI의 시너지를 내는 게 중요하다"며 "의사 혼자만의 능력에 의존하지 않고 AI의 보조적 기능을 접목할 때 진정한 시너지가 날 것으로 본다"고 강조했다.끝으로 고상훈 과장은 AI 의료기술의 확산을 뒷받침할 정책적 지원이 필요하다고 조언했다.그는 "소도시 중소도시의 의료 환경이 열악하다 보니 시민들이 제대로 된 의료 혜택을 받기 힘든 상황"이라며 "오히려 큰 병원이 아니라 작은 중소도시에 혜택을 줘 의료진 부족과 시설 부족을 보완하고, 작은 도시 시민들도 의료 혜택을 크게 누릴 수 있게 해 줬으면 좋겠다"고 전했다.첨단 AI 내시경 도입에 대한 정부·지자체 차원의 지원이 이루어진다면, 더 많은 지역병원이 도입을 검토해 환자들에게 돌아가는 혜택이 커질 것이라는 의미다.고 과장은 "현재 도입한 웨이메드 엔도 같은 좋은 프로그램들이 계속 개발되고 활용된다면 환자들에게 더욱 많은 도움이 될 것"이라며 "병원과 의사는 결국 환자가 있기에 존재하는 만큼 앞으로도 환자 중심의 의료 환경을 위해 AI와 같은 새로운 기술을 적극 활용하겠다"고 덧붙였다.2025-09-05 06:12:12황병우 -
 세 번째 RNAi 치료제...원발성옥살산뇨증 치료 '옥슬루모'차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼 ② 옥슬루모(Lumasiran) 옥슬루모(Oxlumo, 성분명: 루마시란, Lumasiran, Alnylam Pharmaceuticals)는 세 번째 RNA 간섭(siRNA) 기반 치료제로, 2020년 11월 미국 FDA와 유럽 EMA에서 희귀 유전 대사질환인 ‘원발성 고옥살산뇨증 1형(primary hyperoxaluria type 1, PH1)치료제’로 승인되었다. 국내에서는 2024년 식품의약품안전처에서 글로벌 혁신제품 신속심사 지원체계(GIFT, Global Innovative products on Fast Track) 대상으로 지정되었다.루마시란은 소아 및 성인 PH1 환자에서 요 및 혈장 옥살산 수치를 낮추는 목적으로 승인되었으며, 2022년 10월에는 고도 신부전 또는 투석 중인 환자에서도 혈장 옥살산(plasma oxalate) 수치 감소를 위한 적응증이 추가되었다.PH1은 간에서 옥살산(oxalate)이 과도하게 생성되어 발생하는 희귀질환으로, 신장과 요로에 옥살산 또는 옥살산칼슘 결정이 침착한다. 질환이 진행되면 신장 기능이 악화되어 투석이 필요하며, 최종적으로는 간이식이나 신장이식을 받아야 하는 경우가 많다. 기존에는 이뇨제를 통한 칼슘 배설 증가, 식이 조절을 통한 옥살산 섭취 제한 등 보존적 관리만 가능했으며, 승인된 표적 치료제는 없었다.루마시란은 HAO1(hydroxyacid oxidase 1) 유전자의 mRNA를 표적으로 하는 siRNA로, 이 유전자가 암호화하는 glycolate oxidase(GO) 효소의 생성을 억제한다. 결과적으로 간에서의 옥살산 생성이 감소하며, 요 및 혈장 옥살산 수치가 낮아져 PH1의 주요 병태인 신장 손상과 석회화 진행을 억제한다.이번 FDA 승인은 ILLUMINATE-A임상 3상 결과를 근거로 하였고, ILLUMINATE-B임상 3상 중간분석 결과도 참고했다. ILLUMINATE-A에서는 6세 이상 PH1 환자 39명을 대상으로 한 연구에서 루마시란 투여군의 소변 옥살산 수치가 위약군 대비 65.4% 감소했다. 또한 투여 환자의 84%는 소변 옥살산 수치가 정상 범위에 이르렀으며, 52%는 정상 범위로 회복되었다.원발성옥살산뇨증(Primary hyperoxaluria type 1, PH1)는 아떤 질환인가? PH1은 간에서 옥살산의 생성이 과도하게 증가하여 신장 기능 저하 및 전신성 합병증을 유발하고, 이로 인해 심각한 전신적 쇠약과 생명을 위협하는 임상 증상을 초래하는 희귀하고 진행성의 유전 질환이다.PH1의 대사적 결함은 간 특이적 퍼옥시좀(peroxisome) 효소인 알라닌–글리옥실산 아미노전이효소(alanine–glyoxylate aminotransferase, AGT)의 결핍으로 인해 발생한다. AGT는 옥살산의 전구체인 glyoxylate를 glycine으로 전환하는 핵심 효소이다.AGT 활성이 결여되거나 부족하면 glyoxylate이 oxalate로 산화되어 혈중 옥살산 농도가 상승한다. 간에서 생성된 oxalate는 주로 신장을 통해 배설되며, PH1에서 말초 장기 손상을 매개하는 주요 독성 물질로 작용한다.임상적으로 PH1 환자들은 주로 소아기에 신장 결석, 신석회증(nephrocalcinosis), 말기 신장 질환(end-stage renal disease, ESㄲD) 등을 경험한다. 혈중 옥살산 농도가 충분히 높아지면 전신성 옥살산침착증(systemic oxalosis)이 발생하여 뼈, 망막, 심장, 피부 등 여러 장기에 침착이 나타날 수 있다. 질환은 수년간 진단되지 않거나 오진되는 경우도 흔하다. 따라서 PH1 치료의 핵심 목표는 소변 옥살산 농도를 가능한 한 낮추는 데 두고 있다.현재 이용 가능한 치료 옵션은 제한적이다. 과도한 수분 섭취(hyperhydration), AGT의 보조효소 역할을 하는 고용량 피리독신(pyridoxine), 그리고 구연산(citrate)과 같은 수산칼슘 결정 억제제를 통해 신장 결석 발생을 줄이고 질환의 진행을 늦출 수 있다. 그러나 과도한 수분 섭취는 환자에게 큰 부담이 되며, 순응도가 낮아지고 일부 소아에서는 위루관(gastrostomy tube) 삽입이 필요할 수 있다.질환이 진행하여 신부전에 이르게 되면 과잉의 옥살산을 효과적으로 배출할 수 없으므로 주 6일에 달하는 집중적인 혈액투석과 경우에 따라 보조적 복막투석이 요구된다.현재까지 PH1에서 유일하게 유전적 결함 자체를 교정할 수 있는 치료법은 간이식(liver transplantation)이다. AGXT 유전자가 간세포에서만 발현되므로, 정상 AGXT를 가진 간을 이식하면 옥살산 과생성이 본질적으로 중단된다. 이는 진정한 의미의 근치적 치료(curative treatment)로 간주된다.그러나 간이식은 상당한 이환율과 사망률, 평생의 면역억제 치료가 수반되는 한계가 있으며, 종종 간이식과 신장이식을 동시에 시행하는 간-신장 동시이식(combined liver–kidney transplantation)이 필요하다. 이 경우 간의 대사 결함을 교정하면서 동시에 손상된 신기능을 회복할 수 있다.Alanine:glyoxylate aminotransferase(AGT)는 어떤 물질인가?정상 생리 상태에서 glycolate는 간세포 퍼옥시좀(peroxisome) 내에서 glycolate oxidase(GO)의 촉매 작용을 받아 glyoxylate로 산화된다. 생성된 glyoxylate는 세포 내에서 잠재적으로 독성을 지닌 중간대사산물이므로, 즉시 해독 경로를 통해 제거된다.주요 대사 경로는 AGT에 의한 전환으로, 이 과정에서 alanine의 아미노기가 glyoxylate로 전달되어 glycine과 pyruvate가 형성된다. 이러한 반응은 glyoxylate가 독성 종말대사산물인 oxalate로 전환되기 이전에 대사된다.그러나 퍼옥시좀 내에서 처리되지 못한 과잉의 glyoxylate는 세포질로 이동하며, 이후 두 가지 대사 경로 중 하나를 따른다. 첫째, glyoxylate reductase/hydroxypyruvate reductase(GRHPR)의 작용으로 다시 glycolate로 환원되는 경로이고, 둘째, lactate dehydrogenase(LDH)에 의해 oxalate로 산화되는 경로이다. 생성된 oxalate는 인체 내에서 추가적인 대사 경로가 존재하지 않기 때문에, 전적으로 신장을 통한 소변 배설에 의존한다(Figure 1). PH1 환자에서는 AGXT 유전자의 돌연변이로 인해 AGT 효소가 결핍되거나 비활성 상태가 되어 glyoxylate가 glycine으로 전환되지 못한다. 이로 인해 대부분의 glyoxylate가 LDH에 의해 oxalate로 산화된다. 일부 환자에서는 HAO1 유전자의 상대적 과발현으로 glycolate가 과도하게 glyoxylate로 전환되어 oxalate 생성이 더욱 증가한다.그 결과 소변 내 oxalate 배설량이 비정상적으로 상승하며, 일반적으로 하루 1.73m² 체표면적당 1 mmol을 초과하여 정상 범위(0.5 mmol/1.73m² 미만)를 현저히 상회한다.Oxalate는 수용성이 매우 낮기 때문에 소변 내 농도가 증가하면 과포화 상태에 도달하고, 이에 따라 신세뇨관 내강에서 칼슘 옥살레이트(calcium oxalate)결정이 형성된다. 형성된 결정은 서로 응집하여 결석을 만들거나, 세뇨관 상피세포에 부착되어 세포 내로 유입된 후 간질(interstitium) 공간으로 배출된다. 이러한 침착은 염증 반응을 유발하며, 결국 신석회증(nephrocalcinosis)과 신기능 저하로 이어질 수 있다.루마시란(Lumasiran)은 어떤 약제인가?루마시란은 합성 이중가닥 소간섭 RNA(siRNA)로, N-아세틸갈락토사민(GalNAc) 삼분지 구조가 공유결합 형태로 siRNA의 센스 가닥에 부착되어 있다. 이 약제는 내인성 RNA 간섭(RNA interference) 경로를 활용하여 간세포 내 HAO1 유전자 mRNA의 3’ 비번역영역을 표적으로 하여 해당 mRNA를 분해한다.루마시란은 간세포에 존재하는 HAO1 유전자를 표적으로하여 GO 효소의 발현을 억제함으로써 glyoxylate 생성을 근원적으로 감소시킨다(Figure 2). 따라서 HAO1을 침묵시키고 GO 효소를 고갈시킴으로써 간에서 옥살산의 생성을 억제하고 정상화하여 잠재적으로 PH1 질병의 진행을 예방할 수 있다. 루마시란(Lumasiran)의 약리 기전은?루마시란은 GalNAc가 결합된 이중가닥 RNA(GalNAc-double-stranded RNA conjugate)이다. 루마시란의 GalNAc 잔기는 간세포 표면에 존재하는 ASGPR 수용체에 결합하며, 이를 통해 이중가닥 RNA가 세포 내로 엔도사이토시스를 통해 유입된다(1).세포질 내에서는 이중가닥 RNA가 엔도좀에서 탈출하여 RNA 유도 침묵 복합체(RISC)에 탑재되고(2a), 동시에 ASGPR은 재활용되어(2b) 다시 세포 표면으로 이동해 루마시란의 반복적인 흡수를 가능하게 한다.이후 RISC는 루마시란의 안티센스 RNA 가닥의 상동성을 이용해 HAO1 mRNA를 인식하고 절단함(3)으로써, 해당 mRNA가 GO 효소로 번역되는 것을 차단한다(Figure 3). 이로 인해 GO 단백질의 합성이 차단되고, 그 결과 GO에 의해 생성되던 glyoxylate의 양이 감소하며, 이는 곧 oxalate 생성을 억제하는 효과로 이어진다. 루마시란(Lumasiran)의 임상 결과는 어떠한가?1. ILLUMINATE-A ILLUMINATE-A는 PH1(원발성 고옥살산뇨증 1형) 환자 중 6세 이상이며 사구체여과율(eGFR)이 30mL/min/1.73m² 이상인 환자 39명을 대상으로 루마시란(OXLUMO)과 위약(placebo)을 비교한 무작위 배정, 이중맹검 임상시험이다.환자들은 OXLUMO 3mg/kg을 월 1회, 3회에 걸쳐 초기 투여한 뒤, 이후에는 3개월 간격으로 유지 투여를 받았다. 위약군 역시 동일한 투여 스케줄을 따랐으며, 6개월 경과 후 모든 환자에게 OXLUMO가이 투여되었다. 시험 대상자의 중앙값 연령은 15세(범위: 6~61세)였고, 67%는 남성, 77%는 백인이었다.Base line에서의 24시간 요 옥살산 배출량(BSA로 보정한 값)의 중앙값은 1.7mmol/24시간/1.73 m², 혈장 옥살산 농도는 중앙값 13.1 μmol/L이었다.주요 평가 변수는 기저치 대비 3~6개월 동안 평균된 24시간 요 옥살산 배출량(BSA 보정)의 백분율 감소율이었다.결과적으로, OXLUMO 투여군에서는 요 옥살산 배출량이 평균 -65% 감소하였으며(95% CI: –71, –59%), 위약군에서는 –12% 감소(95% CI: –20, –4)로, 두 군 간 차이는 53%(95% CI: 45, 62), p< 0.0001로 통계적으로 유의미하였다. 이 결과는 OXLUMO가 PH1 환자에서 요 옥살산 수치를 임상적으로 의미 있게 감소시킴을 입증하였다(Figure 1). 6개월 시점까지, OXLUMO 투여군의 52%(95% 신뢰구간: 31%, 72%)가 정상 범위의 24시간 요 옥살산 배출량(BSA 보정값 기준 ≤0.514mmol/24시간/1.73m²)에 도달하였다.반면, 위약군 중 정상 범위에 도달한 비율은 0%(95% CI: 0%–25%)였으며, 그 차이는 통계적으로 유의미하였다(p=0.001). 또한, 루마시란을 투여받은 환자에서는 감소된 요 옥살산 수치가 24개월 시점까지 지속적으로 유지되었다.2. ILLUMINATE-B ILLUMINATE-B는 6세 미만의 PH1 환자 18명을 대상으로 한 단일군(single-arm) 임상시험이었다. 대상자는 12개월 이상인 경우 eGFR이 45mL/min/1.73m² 초과, 12개월 미만인 경우는 혈청 크레아티닌 수치가 정상 범위인 환자들로 구성되었다.OXLUMO의 용량은 체중에 따라 결정되었다. 첫 투여 시 환자의 중앙값 연령은 51개월(범위: 4~74개월)이었으며, 56%는 여성, 88%는 백인이었다.체중 분포는 10kg 미만 3명, 10kg 이상 20kg 미만 12명, 20kg 이상 3명이었다. 기저 상태에서의 요 옥살산:크레아티닌 비율(spot urinary oxalate:creatinine ratio)의 중앙값은 0.47 mmol/mmol이었다.주요 평가 변수는 3~6개월 동안 평균된 요 옥살산:크레아티닌 비율의 기저치 대비 백분율 감소율이었다. 그 결과, OXLUMO 투여군은 기저치 대비 평균 72%의 요 옥살산:크레아티닌 비율 감소를 나타냈으며(95% CI: 66, 78), 요 옥살산 배출 감소 효과는 12개월 시점까지 유지되었다.(Figure 2). 3. ILLUMINATE-C ILLUMINATE-C은 총 21명의 환자가 다기관 단일군 연구에 등록되어 OXLUMO 치료를 받았다. 이 연구는 원발성 고옥살산뇨증 1형(PH1) 환자 중 eGFR ≤45mL/min/1.73m²인 12개월 이상 환자, 또는 12개월 미만이면서 연령에 비해 혈청 크레아티닌 수치가 상승한 환자(혈액투석 중인 환자 포함)를 대상으로 시행되었다.환자들은 두 개의 코호트(cohort)로 나뉘었다. Cohort A는 등록 시점에서 투석이 필요하지 않은 환자 6명, Cohort B는 안정적인 혈액투석(hemodialysis) 치료를 받고 있던 환자 15명으로, 이들의 투석 일정은 임상시험 초기 6개월 동안 변경되지 않도록 유지되었다.환자들은 체중에 따라 권장된 OXLUMO 용량을 투여받았다. 복막투석 환자는 연구에서 제외되었다. 첫 투여 시 환자의 중앙값 연령은 9세(범위: 0~59세)였으며, 57%는 남성, 76%는 백인이었다.기저 상태에서의 혈장 옥살산 농도 중앙값은 Cohort A가 58μmol/L, Cohort B(투석 환자)가 투석 전 기준 104μmol/L이었다.주요 평가 변수는 Cohort A(N=5명)의 경우 기저치 대비 6개월 시점(3~6개월 평균)의 혈장 옥살산 농도 변화율, Cohort B(N=15명)의 경우 투석 전 혈장 옥살산 농도의 기저치 대비 6개월 시점(3~6개월 평균)의 변화율이었다.그 결과, Cohort A에서는 혈장 옥살산 농도가 기저치 대비 33% 감소(LS 평균, 95% CI: –82, 15)하였고, Cohort B에서는 42% 감소(95% CI: –51, –34%)하였다.구체적으로, Cohort A의 평균 혈장 옥살산 농도는 기저치 65μmol/L(95% CI: 21, 108)에서 6개월 시점 33μmol/L(95% CI: 10, 56)로 감소하였다.Cohort B의 평균 혈장 옥살산 농도는 기저치 108μmol/L(95% CI: 92, 125)에서 6개월 시점 62μmol/L(95% CI: 51, 72)로 감소하였다(Figure 3). 루마시란(Lumasiran)의 예상되는 쟁점은 무엇인가?루마시란(Lumasiran, 제품명 Oxlumo)은 원발성 고옥살산뇨증 1형(PH1)에 대한 최초의 siRNA 기반 치료제로, 임상시험에서 유의한 옥살산 감소 효과를 입증하였다. 이 약제는 RNA 간섭(RNA interference) 기술을 이용해 간세포 내 HAO1 유전자의 발현을 억제함으로써 glycolate oxidase(GO) 효소 생성을 차단하고, 결과적으로 glyoxylate 및 oxalate 생성을 줄인다.다만 루마시란은 PH1의 근본 원인인 AGXT 유전자의 기능 결손을 교정하지는 않는다. 즉, glyoxylate가 해독되지 못해 oxalate로 전환되는 병태생리에서, 루마시란은 상류 단계인 GO 발현을 억제하여 glyoxylate 생성 자체를 줄이는 간접적 치료 전략에 해당한다.루마시란은 피하 주사를 통해 주기적으로 투여해야 하며, 치료를 중단하면 GO 발현이 다시 활성화되어 glyoxylate 및 oxalate 생성이 재개된다. 이는 질환 재악화를 초래할 수 있어 지속적인 유지 치료가 필수적이다. 또한 이미 신장, 뼈, 망막 등에 침착된 옥살산, 즉 전신 옥살산증(systemic oxalosis)은 제거하거나 역전시키지 못한다. 따라서 말기 신부전이나 광범위한 옥살산 침착 환자의 경우 투석이나 간·신장 이식 등 추가 치료가 필요하다.결국 루마시란은 유전적 결함 자체를 교정하지는 않지만, PH1의 대사 경로를 효과적으로 차단하여 질환의 진행을 억제하고 옥살산 축적을 완화하는 표적 치료제이다. 이는 대사산물 생성을 억제하는 전략으로, 유전자 교정이나 단백질 기능 복원과는 구별된다.그럼에도 불구하고 루마시란은 간 이식 외에는 근본적 치료가 없던 PH1 치료 영역에 중요한 전환점을 마련하였다. 특히 조기 진단과 개입을 통해 신기능 보존과 예후 개선에 기여할 수 있으며, 향후 장기적 안전성 확보, 접근성 향상, 유전자 치료제와의 병용 또는 전환 전략이 논의될 경우 PH1 치료의 새로운 패러다임으로 자리매김할 수 있을 것으로 기대된다.참고문헌 1. Sally-Anne Hulton “Lumasiran: expanding the treatment options for patients with primary hyperoxaluria type 1” EXPERT OPINION ON ORPHAN DRUGS 2021, VOL. 9, NOS. 7–10, 189–198. 2. Xuan Gang et al. “Lumasiran for primary hyperoxaluria type 1: What we have learned?” Front. Pediatr. 10:1052625. 3. Viola D’Ambrosioet al. “Lumasiran in the Management of Patients with Primary Hyperoxaluria Type 1: From Bench to Bedside“ International Journal of Nephrology and Renovascular Disease 2022:15 197–206. 4. Sander F. Garrelfs at al. “Lumasiran, an RNAi Therapeutic for Primary Hyperoxaluria Type 1” N Engl J Med 2021;384:1216-26. 5. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-08-22 06:02:44최병철 박사
세 번째 RNAi 치료제...원발성옥살산뇨증 치료 '옥슬루모'차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼 ② 옥슬루모(Lumasiran) 옥슬루모(Oxlumo, 성분명: 루마시란, Lumasiran, Alnylam Pharmaceuticals)는 세 번째 RNA 간섭(siRNA) 기반 치료제로, 2020년 11월 미국 FDA와 유럽 EMA에서 희귀 유전 대사질환인 ‘원발성 고옥살산뇨증 1형(primary hyperoxaluria type 1, PH1)치료제’로 승인되었다. 국내에서는 2024년 식품의약품안전처에서 글로벌 혁신제품 신속심사 지원체계(GIFT, Global Innovative products on Fast Track) 대상으로 지정되었다.루마시란은 소아 및 성인 PH1 환자에서 요 및 혈장 옥살산 수치를 낮추는 목적으로 승인되었으며, 2022년 10월에는 고도 신부전 또는 투석 중인 환자에서도 혈장 옥살산(plasma oxalate) 수치 감소를 위한 적응증이 추가되었다.PH1은 간에서 옥살산(oxalate)이 과도하게 생성되어 발생하는 희귀질환으로, 신장과 요로에 옥살산 또는 옥살산칼슘 결정이 침착한다. 질환이 진행되면 신장 기능이 악화되어 투석이 필요하며, 최종적으로는 간이식이나 신장이식을 받아야 하는 경우가 많다. 기존에는 이뇨제를 통한 칼슘 배설 증가, 식이 조절을 통한 옥살산 섭취 제한 등 보존적 관리만 가능했으며, 승인된 표적 치료제는 없었다.루마시란은 HAO1(hydroxyacid oxidase 1) 유전자의 mRNA를 표적으로 하는 siRNA로, 이 유전자가 암호화하는 glycolate oxidase(GO) 효소의 생성을 억제한다. 결과적으로 간에서의 옥살산 생성이 감소하며, 요 및 혈장 옥살산 수치가 낮아져 PH1의 주요 병태인 신장 손상과 석회화 진행을 억제한다.이번 FDA 승인은 ILLUMINATE-A임상 3상 결과를 근거로 하였고, ILLUMINATE-B임상 3상 중간분석 결과도 참고했다. ILLUMINATE-A에서는 6세 이상 PH1 환자 39명을 대상으로 한 연구에서 루마시란 투여군의 소변 옥살산 수치가 위약군 대비 65.4% 감소했다. 또한 투여 환자의 84%는 소변 옥살산 수치가 정상 범위에 이르렀으며, 52%는 정상 범위로 회복되었다.원발성옥살산뇨증(Primary hyperoxaluria type 1, PH1)는 아떤 질환인가? PH1은 간에서 옥살산의 생성이 과도하게 증가하여 신장 기능 저하 및 전신성 합병증을 유발하고, 이로 인해 심각한 전신적 쇠약과 생명을 위협하는 임상 증상을 초래하는 희귀하고 진행성의 유전 질환이다.PH1의 대사적 결함은 간 특이적 퍼옥시좀(peroxisome) 효소인 알라닌–글리옥실산 아미노전이효소(alanine–glyoxylate aminotransferase, AGT)의 결핍으로 인해 발생한다. AGT는 옥살산의 전구체인 glyoxylate를 glycine으로 전환하는 핵심 효소이다.AGT 활성이 결여되거나 부족하면 glyoxylate이 oxalate로 산화되어 혈중 옥살산 농도가 상승한다. 간에서 생성된 oxalate는 주로 신장을 통해 배설되며, PH1에서 말초 장기 손상을 매개하는 주요 독성 물질로 작용한다.임상적으로 PH1 환자들은 주로 소아기에 신장 결석, 신석회증(nephrocalcinosis), 말기 신장 질환(end-stage renal disease, ESㄲD) 등을 경험한다. 혈중 옥살산 농도가 충분히 높아지면 전신성 옥살산침착증(systemic oxalosis)이 발생하여 뼈, 망막, 심장, 피부 등 여러 장기에 침착이 나타날 수 있다. 질환은 수년간 진단되지 않거나 오진되는 경우도 흔하다. 따라서 PH1 치료의 핵심 목표는 소변 옥살산 농도를 가능한 한 낮추는 데 두고 있다.현재 이용 가능한 치료 옵션은 제한적이다. 과도한 수분 섭취(hyperhydration), AGT의 보조효소 역할을 하는 고용량 피리독신(pyridoxine), 그리고 구연산(citrate)과 같은 수산칼슘 결정 억제제를 통해 신장 결석 발생을 줄이고 질환의 진행을 늦출 수 있다. 그러나 과도한 수분 섭취는 환자에게 큰 부담이 되며, 순응도가 낮아지고 일부 소아에서는 위루관(gastrostomy tube) 삽입이 필요할 수 있다.질환이 진행하여 신부전에 이르게 되면 과잉의 옥살산을 효과적으로 배출할 수 없으므로 주 6일에 달하는 집중적인 혈액투석과 경우에 따라 보조적 복막투석이 요구된다.현재까지 PH1에서 유일하게 유전적 결함 자체를 교정할 수 있는 치료법은 간이식(liver transplantation)이다. AGXT 유전자가 간세포에서만 발현되므로, 정상 AGXT를 가진 간을 이식하면 옥살산 과생성이 본질적으로 중단된다. 이는 진정한 의미의 근치적 치료(curative treatment)로 간주된다.그러나 간이식은 상당한 이환율과 사망률, 평생의 면역억제 치료가 수반되는 한계가 있으며, 종종 간이식과 신장이식을 동시에 시행하는 간-신장 동시이식(combined liver–kidney transplantation)이 필요하다. 이 경우 간의 대사 결함을 교정하면서 동시에 손상된 신기능을 회복할 수 있다.Alanine:glyoxylate aminotransferase(AGT)는 어떤 물질인가?정상 생리 상태에서 glycolate는 간세포 퍼옥시좀(peroxisome) 내에서 glycolate oxidase(GO)의 촉매 작용을 받아 glyoxylate로 산화된다. 생성된 glyoxylate는 세포 내에서 잠재적으로 독성을 지닌 중간대사산물이므로, 즉시 해독 경로를 통해 제거된다.주요 대사 경로는 AGT에 의한 전환으로, 이 과정에서 alanine의 아미노기가 glyoxylate로 전달되어 glycine과 pyruvate가 형성된다. 이러한 반응은 glyoxylate가 독성 종말대사산물인 oxalate로 전환되기 이전에 대사된다.그러나 퍼옥시좀 내에서 처리되지 못한 과잉의 glyoxylate는 세포질로 이동하며, 이후 두 가지 대사 경로 중 하나를 따른다. 첫째, glyoxylate reductase/hydroxypyruvate reductase(GRHPR)의 작용으로 다시 glycolate로 환원되는 경로이고, 둘째, lactate dehydrogenase(LDH)에 의해 oxalate로 산화되는 경로이다. 생성된 oxalate는 인체 내에서 추가적인 대사 경로가 존재하지 않기 때문에, 전적으로 신장을 통한 소변 배설에 의존한다(Figure 1). PH1 환자에서는 AGXT 유전자의 돌연변이로 인해 AGT 효소가 결핍되거나 비활성 상태가 되어 glyoxylate가 glycine으로 전환되지 못한다. 이로 인해 대부분의 glyoxylate가 LDH에 의해 oxalate로 산화된다. 일부 환자에서는 HAO1 유전자의 상대적 과발현으로 glycolate가 과도하게 glyoxylate로 전환되어 oxalate 생성이 더욱 증가한다.그 결과 소변 내 oxalate 배설량이 비정상적으로 상승하며, 일반적으로 하루 1.73m² 체표면적당 1 mmol을 초과하여 정상 범위(0.5 mmol/1.73m² 미만)를 현저히 상회한다.Oxalate는 수용성이 매우 낮기 때문에 소변 내 농도가 증가하면 과포화 상태에 도달하고, 이에 따라 신세뇨관 내강에서 칼슘 옥살레이트(calcium oxalate)결정이 형성된다. 형성된 결정은 서로 응집하여 결석을 만들거나, 세뇨관 상피세포에 부착되어 세포 내로 유입된 후 간질(interstitium) 공간으로 배출된다. 이러한 침착은 염증 반응을 유발하며, 결국 신석회증(nephrocalcinosis)과 신기능 저하로 이어질 수 있다.루마시란(Lumasiran)은 어떤 약제인가?루마시란은 합성 이중가닥 소간섭 RNA(siRNA)로, N-아세틸갈락토사민(GalNAc) 삼분지 구조가 공유결합 형태로 siRNA의 센스 가닥에 부착되어 있다. 이 약제는 내인성 RNA 간섭(RNA interference) 경로를 활용하여 간세포 내 HAO1 유전자 mRNA의 3’ 비번역영역을 표적으로 하여 해당 mRNA를 분해한다.루마시란은 간세포에 존재하는 HAO1 유전자를 표적으로하여 GO 효소의 발현을 억제함으로써 glyoxylate 생성을 근원적으로 감소시킨다(Figure 2). 따라서 HAO1을 침묵시키고 GO 효소를 고갈시킴으로써 간에서 옥살산의 생성을 억제하고 정상화하여 잠재적으로 PH1 질병의 진행을 예방할 수 있다. 루마시란(Lumasiran)의 약리 기전은?루마시란은 GalNAc가 결합된 이중가닥 RNA(GalNAc-double-stranded RNA conjugate)이다. 루마시란의 GalNAc 잔기는 간세포 표면에 존재하는 ASGPR 수용체에 결합하며, 이를 통해 이중가닥 RNA가 세포 내로 엔도사이토시스를 통해 유입된다(1).세포질 내에서는 이중가닥 RNA가 엔도좀에서 탈출하여 RNA 유도 침묵 복합체(RISC)에 탑재되고(2a), 동시에 ASGPR은 재활용되어(2b) 다시 세포 표면으로 이동해 루마시란의 반복적인 흡수를 가능하게 한다.이후 RISC는 루마시란의 안티센스 RNA 가닥의 상동성을 이용해 HAO1 mRNA를 인식하고 절단함(3)으로써, 해당 mRNA가 GO 효소로 번역되는 것을 차단한다(Figure 3). 이로 인해 GO 단백질의 합성이 차단되고, 그 결과 GO에 의해 생성되던 glyoxylate의 양이 감소하며, 이는 곧 oxalate 생성을 억제하는 효과로 이어진다. 루마시란(Lumasiran)의 임상 결과는 어떠한가?1. ILLUMINATE-A ILLUMINATE-A는 PH1(원발성 고옥살산뇨증 1형) 환자 중 6세 이상이며 사구체여과율(eGFR)이 30mL/min/1.73m² 이상인 환자 39명을 대상으로 루마시란(OXLUMO)과 위약(placebo)을 비교한 무작위 배정, 이중맹검 임상시험이다.환자들은 OXLUMO 3mg/kg을 월 1회, 3회에 걸쳐 초기 투여한 뒤, 이후에는 3개월 간격으로 유지 투여를 받았다. 위약군 역시 동일한 투여 스케줄을 따랐으며, 6개월 경과 후 모든 환자에게 OXLUMO가이 투여되었다. 시험 대상자의 중앙값 연령은 15세(범위: 6~61세)였고, 67%는 남성, 77%는 백인이었다.Base line에서의 24시간 요 옥살산 배출량(BSA로 보정한 값)의 중앙값은 1.7mmol/24시간/1.73 m², 혈장 옥살산 농도는 중앙값 13.1 μmol/L이었다.주요 평가 변수는 기저치 대비 3~6개월 동안 평균된 24시간 요 옥살산 배출량(BSA 보정)의 백분율 감소율이었다.결과적으로, OXLUMO 투여군에서는 요 옥살산 배출량이 평균 -65% 감소하였으며(95% CI: –71, –59%), 위약군에서는 –12% 감소(95% CI: –20, –4)로, 두 군 간 차이는 53%(95% CI: 45, 62), p< 0.0001로 통계적으로 유의미하였다. 이 결과는 OXLUMO가 PH1 환자에서 요 옥살산 수치를 임상적으로 의미 있게 감소시킴을 입증하였다(Figure 1). 6개월 시점까지, OXLUMO 투여군의 52%(95% 신뢰구간: 31%, 72%)가 정상 범위의 24시간 요 옥살산 배출량(BSA 보정값 기준 ≤0.514mmol/24시간/1.73m²)에 도달하였다.반면, 위약군 중 정상 범위에 도달한 비율은 0%(95% CI: 0%–25%)였으며, 그 차이는 통계적으로 유의미하였다(p=0.001). 또한, 루마시란을 투여받은 환자에서는 감소된 요 옥살산 수치가 24개월 시점까지 지속적으로 유지되었다.2. ILLUMINATE-B ILLUMINATE-B는 6세 미만의 PH1 환자 18명을 대상으로 한 단일군(single-arm) 임상시험이었다. 대상자는 12개월 이상인 경우 eGFR이 45mL/min/1.73m² 초과, 12개월 미만인 경우는 혈청 크레아티닌 수치가 정상 범위인 환자들로 구성되었다.OXLUMO의 용량은 체중에 따라 결정되었다. 첫 투여 시 환자의 중앙값 연령은 51개월(범위: 4~74개월)이었으며, 56%는 여성, 88%는 백인이었다.체중 분포는 10kg 미만 3명, 10kg 이상 20kg 미만 12명, 20kg 이상 3명이었다. 기저 상태에서의 요 옥살산:크레아티닌 비율(spot urinary oxalate:creatinine ratio)의 중앙값은 0.47 mmol/mmol이었다.주요 평가 변수는 3~6개월 동안 평균된 요 옥살산:크레아티닌 비율의 기저치 대비 백분율 감소율이었다. 그 결과, OXLUMO 투여군은 기저치 대비 평균 72%의 요 옥살산:크레아티닌 비율 감소를 나타냈으며(95% CI: 66, 78), 요 옥살산 배출 감소 효과는 12개월 시점까지 유지되었다.(Figure 2). 3. ILLUMINATE-C ILLUMINATE-C은 총 21명의 환자가 다기관 단일군 연구에 등록되어 OXLUMO 치료를 받았다. 이 연구는 원발성 고옥살산뇨증 1형(PH1) 환자 중 eGFR ≤45mL/min/1.73m²인 12개월 이상 환자, 또는 12개월 미만이면서 연령에 비해 혈청 크레아티닌 수치가 상승한 환자(혈액투석 중인 환자 포함)를 대상으로 시행되었다.환자들은 두 개의 코호트(cohort)로 나뉘었다. Cohort A는 등록 시점에서 투석이 필요하지 않은 환자 6명, Cohort B는 안정적인 혈액투석(hemodialysis) 치료를 받고 있던 환자 15명으로, 이들의 투석 일정은 임상시험 초기 6개월 동안 변경되지 않도록 유지되었다.환자들은 체중에 따라 권장된 OXLUMO 용량을 투여받았다. 복막투석 환자는 연구에서 제외되었다. 첫 투여 시 환자의 중앙값 연령은 9세(범위: 0~59세)였으며, 57%는 남성, 76%는 백인이었다.기저 상태에서의 혈장 옥살산 농도 중앙값은 Cohort A가 58μmol/L, Cohort B(투석 환자)가 투석 전 기준 104μmol/L이었다.주요 평가 변수는 Cohort A(N=5명)의 경우 기저치 대비 6개월 시점(3~6개월 평균)의 혈장 옥살산 농도 변화율, Cohort B(N=15명)의 경우 투석 전 혈장 옥살산 농도의 기저치 대비 6개월 시점(3~6개월 평균)의 변화율이었다.그 결과, Cohort A에서는 혈장 옥살산 농도가 기저치 대비 33% 감소(LS 평균, 95% CI: –82, 15)하였고, Cohort B에서는 42% 감소(95% CI: –51, –34%)하였다.구체적으로, Cohort A의 평균 혈장 옥살산 농도는 기저치 65μmol/L(95% CI: 21, 108)에서 6개월 시점 33μmol/L(95% CI: 10, 56)로 감소하였다.Cohort B의 평균 혈장 옥살산 농도는 기저치 108μmol/L(95% CI: 92, 125)에서 6개월 시점 62μmol/L(95% CI: 51, 72)로 감소하였다(Figure 3). 루마시란(Lumasiran)의 예상되는 쟁점은 무엇인가?루마시란(Lumasiran, 제품명 Oxlumo)은 원발성 고옥살산뇨증 1형(PH1)에 대한 최초의 siRNA 기반 치료제로, 임상시험에서 유의한 옥살산 감소 효과를 입증하였다. 이 약제는 RNA 간섭(RNA interference) 기술을 이용해 간세포 내 HAO1 유전자의 발현을 억제함으로써 glycolate oxidase(GO) 효소 생성을 차단하고, 결과적으로 glyoxylate 및 oxalate 생성을 줄인다.다만 루마시란은 PH1의 근본 원인인 AGXT 유전자의 기능 결손을 교정하지는 않는다. 즉, glyoxylate가 해독되지 못해 oxalate로 전환되는 병태생리에서, 루마시란은 상류 단계인 GO 발현을 억제하여 glyoxylate 생성 자체를 줄이는 간접적 치료 전략에 해당한다.루마시란은 피하 주사를 통해 주기적으로 투여해야 하며, 치료를 중단하면 GO 발현이 다시 활성화되어 glyoxylate 및 oxalate 생성이 재개된다. 이는 질환 재악화를 초래할 수 있어 지속적인 유지 치료가 필수적이다. 또한 이미 신장, 뼈, 망막 등에 침착된 옥살산, 즉 전신 옥살산증(systemic oxalosis)은 제거하거나 역전시키지 못한다. 따라서 말기 신부전이나 광범위한 옥살산 침착 환자의 경우 투석이나 간·신장 이식 등 추가 치료가 필요하다.결국 루마시란은 유전적 결함 자체를 교정하지는 않지만, PH1의 대사 경로를 효과적으로 차단하여 질환의 진행을 억제하고 옥살산 축적을 완화하는 표적 치료제이다. 이는 대사산물 생성을 억제하는 전략으로, 유전자 교정이나 단백질 기능 복원과는 구별된다.그럼에도 불구하고 루마시란은 간 이식 외에는 근본적 치료가 없던 PH1 치료 영역에 중요한 전환점을 마련하였다. 특히 조기 진단과 개입을 통해 신기능 보존과 예후 개선에 기여할 수 있으며, 향후 장기적 안전성 확보, 접근성 향상, 유전자 치료제와의 병용 또는 전환 전략이 논의될 경우 PH1 치료의 새로운 패러다임으로 자리매김할 수 있을 것으로 기대된다.참고문헌 1. Sally-Anne Hulton “Lumasiran: expanding the treatment options for patients with primary hyperoxaluria type 1” EXPERT OPINION ON ORPHAN DRUGS 2021, VOL. 9, NOS. 7–10, 189–198. 2. Xuan Gang et al. “Lumasiran for primary hyperoxaluria type 1: What we have learned?” Front. Pediatr. 10:1052625. 3. Viola D’Ambrosioet al. “Lumasiran in the Management of Patients with Primary Hyperoxaluria Type 1: From Bench to Bedside“ International Journal of Nephrology and Renovascular Disease 2022:15 197–206. 4. Sander F. Garrelfs at al. “Lumasiran, an RNAi Therapeutic for Primary Hyperoxaluria Type 1” N Engl J Med 2021;384:1216-26. 5. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-08-22 06:02:44최병철 박사 -
 20년 만에 새 기전 신약 등장...폐동맥고혈압약 경쟁 예고[데일리팜=손형민 기자] MSD가 개발한 폐동맥고혈압 신약 윈레브에어가 국내 등장하며 시장 경쟁을 예고했다. 그간 폐동맥고혈압에는 포스포디에스테라제(PDE5) 억제제, 칼슘채널차단제(CCB) 등이 활용돼 왔지만 증상 조절 효과에 그쳤다. 질환의 원발적 원인을 타깃할 수 있는 신규 치료제가 이런 의학적 미충족 수요를 해결할 수 있을지 주목된다.26일 관련 업계에 따르면 식품의약품안전처는 23일 폐동맥고혈압 치료제 윈레브에어를 허가했다. 이로써 MSD는 지난해 미국과 유럽에 이어 윈레브에어의 허가국을 늘리는 데 성공했다.윈레브에어는 기존 치료제와 병용해 세계보건기구(WHO) 기능분류 II-III 단계에 해당하는 18세 이상 성인 폐동맥고혈압(WHO Group I) 환자의 운동 능력을 개선하는 데 사용된다.윈레브에어는 폐동맥고혈압 분야 최초로 승인된 ‘액티빈 신호전달 억제제(ASI)’로, 20년 만에 등장한 새로운 기전의 치료제다. 이는 폐동맥 혈관 내 세포 증식을 유발하는 단백질 복합체 ‘액티빈’의 과도한 증식 신호를 차단하고, 항증식 신호와의 균형을 조정해 변형된 혈관 구조를 정상화하는 ‘역재형성(reverse remodeling)’을 유도하는 작용을 한다.이번 허가는 폐동맥고혈압 환자 323명을 대상으로 진행된 임상3상 STELLAR 연구 결과를 기반으로 했다. 임상은 성인 환자를 대상으로 윈레브에어+표준요법군과 위약+표준요법군 간의 효능 및 안전성을 평가했으며, 피하주사 방식으로 3주에 한 번 투여됐다.임상 결과, 윈레브에어군은 6분 보행거리(6MWD)가 40.1m 증가했으며, 위약군은 1.4m 감소했다. 윈레브에어는 폐동맥고혈압 관련 임상적 악화 또는 모든 원인에 의한 사망 위험을 84% 줄였다. 2차 평가변수인 복합 평가 항목(6분 보행거리 30m 이상 개선 등)을 충족한 환자 비율은 윈레브에어군 38.9%, 위약군 10%로 나타났다.가장 흔한 이상반응은 두통, 비문증, 발진, 모세혈관확장증, 설사, 현기증 등이었으며, 헤모글로빈 및 적혈구 증가로 인한 혈전 색전증 또는 고점도 증후군 위험이 있어, 의료진은 투여 시 혈액수치 모니터링이 요구된다.바이엘 폐동맥고혈압 치료제 '아뎀파스'윈레브에어는 기존 비급여로 사용되던 바이엘의 아뎀파스와 시장 잠식 경쟁을 펼칠 가능성이 높아졌다. 특히 최근 아뎀파스가 지난 급여 적용을 받게 되면서 폐동맥고혈압 환자들의 치료 선택지도 확대됐다.폐동맥고혈압의 발병과 진행은 혈관활성인자의 발현 변화, 산화 스트레스 증가, NO(일산화질소) 경로 조절 장애 등과 관련돼 있다. NO는 sGC(가용성 구아닐산 고리화효소)를 활성화시켜 cGMP(고리형 구아노신 일인산) 생성을 유도하며, 이 경로의 이상은 폐혈관 저항을 증가시키고 혈관 폐쇄를 초래한다.아뎀파스는 NO에 의존하지 않고 sGC를 직접 자극하는 방식으로 작용하며, WHO 기능분류 II~III 환자 중 기존 치료에 반응이 부족한 경우에도 급여 처방이 가능하다.후발 신약들도 개발 한창윈레브에어 이후 글로벌제약사의 후발 폐동맥고혈압 신약개발도 한창이다.얀센의 폐동맥고혈압 복합제 옵신비는 미국에서 승인되며 환자와 의료진의 치료옵션 선택권이 확대됐다. FDA는 지난해 옵신비를 폐동맥 고혈압 1차 치료제로 허가했다. 이번 허가로 옵신비는 치료 경험이 없거나 엔도텔린 수용체 길항제(ERA), PDE5 억제제를 복용 중인 환자에게 사용이 가능하다.옵신비는 PDE5 억제제인 시알리스와 ERA인 애드서카 복합제로 해당 기전 복합제의 허가 승인은 이번이 최초다. PDE5 억제제는 폐동맥 압력을 떨어뜨리는 기전을 갖고 있고 ERA는 엔도텔린1(ET-1)의 작용을 차단해 폐혈관 수축을 혈관 확장을 촉진한다.옵신비는 A DUE로 명명된 임상 3상연구에서 효과를 입증했다. 임상은 옵신비 투여군과 대조군 옵서머트 또는 시알리스 단독 투여군의 효능과 안전성을 비교 평가하는 방식으로 진행됐다.24개월 동안 환자를 추적한 결과, 옵신비는 1차 평가변수로 설정한 폐혈관 저항(PVR)에서 시알리스 또는 옵서머트 투여군보다 최대 29% 감소시킨 것으로 나타났다. 가장 흔한 이상반응은 부종, 체액저류, 빈혈, 두통 등이었다. 여성 환자들이 옵서머트를 투여받기 위해서는 배아-태아 독성 위험성으로 인해 위험성 평가완화전략(REMS) 프로그램에 등록해야 한다.미국 인스메드는 폐동맥고혈압 치료제 후보물질 ‘TPIP(트레프로스티닐 팔미틸 흡입분말)’의 2b상 임상 결과를 발표하며 치료 가능성을 입증했다. 1일 1회 흡입제로 개발 중인 TPIP는 모든 1·2차 평가변수를 충족했다.TPIP는 흡입형 프로스타노이드(prostanoid) 계열의 신약 후보물질로, 기존 트레프로스티닐(treprostinil)의 한계를 극복하기 위해 개발됐다. 트레프로스티닐은 폐혈관을 확장시키고 항염증·항섬유화 작용을 통해 폐동맥고혈압의 혈역학적 부담을 줄이는 약물로 알려져 있다.TPIP는 여기에 지속형 전구약물(prodrug) 형태인 ‘트레프로스티닐 팔미틸’을 적용해 흡입 1회로 24시간 동안 약효가 유지되도록 설계됐다.이 신약후보물질은 흡입 시 폐에 직접 전달돼 폐혈관 확장, 염증 억제, 혈관 재형성 방지 등의 작용을 유도하며, 경구제나 정맥주사제 대비 부작용을 최소화하면서도 높은 치료 효율을 기대할 수 있다.또 지속 방출 특성 덕분에 일일 투여 빈도를 줄여 복약 순응도를 개선할 수 있으며, 용량을 점진적으로 증량해 고용량까지 도달 가능하다는 점도 임상에서 확인됐다.임상 결과, TPIP는 위약 대비 폐혈관 저항(PVR)은 35% 감소했고, 6분 보행거리는 35.5m 증가했다. 심장 스트레스 지표인 N말단 pro-뇌 나트륨 이뇨펩티드(NT-proBNP) 수치도 60% 감소했다. 투여 24시간 후 평가에서도 지속 효과가 확인됐으며, 피험자 75%가 최고 허용 용량(640㎍)까지 용량을 증량할 수 있었다. 주요 이상반응은 기침(40.6%), 두통(31.9%), 피로, 가슴 불편감 등이었다.이번 결과를 바탕으로 인스메드는 미국 FDA와의 협의를 통해 2025년 말 폐섬유화성 폐고혈압(PH-ILD) 대상 임상 3상을 시작하고, 2026년 초에는 폐동맥고혈압(PAH) 대상 임상 3상에 돌입할 계획이다. 현재 인스메드는 2b상을 완료한 환자들을 대상으로 최대 1,280㎍까지 증량 가능한 장기 확장 연구가 진행 중이다.국내기업도 폐동맥고혈압 신약개발 시장 참전국내 기업도 폐동맥고혈압 신약 개발에 속도를 내고 있다.자이메디의 항체치료제 ZMA001은 지난해 미국 FDA로부터 희귀의약품 지정을 받았다고 밝혔다. ZMA001은 인간 단일클론항체로, 염증 유발 대식세포의 폐 침투를 차단해 질병의 초기 병태생리를 근본적으로 억제한다. 전임상 연구에서 기존 약물 대비 효능이 확인됐다.자이메디는 이 물질을 AI 기반 기술로 피하주사 제형(ZMA001-SC)으로 전환하고, 1상 임상시험계획(IND)까지 추진할 계획이다. 미국 NIH는 ZMA001의 혁신성과 공익성을 인정해 공동연구개발 협약(CRADA)을 체결했으며, 올해 1월부터 NIH 임상센터에서 1a상 임상시험을 진행 중이다.나이벡도 자체 개발한 펩타이드 기반 신약 NP-201의 전임상에서 폐동맥고혈압 치료 가능성을 확인했다. 모노크로탈린으로 유도된 동물모델에 투여한 결과, 혈압 강하 효과와 함께 병든 폐혈관이 정상 구조로 회복되는 재생기전이 입증됐다. 나이벡은 NP-201의 글로벌 임상에 폐동맥고혈압 적응증을 포함할 계획이다.2025-07-26 06:20:55손형민
20년 만에 새 기전 신약 등장...폐동맥고혈압약 경쟁 예고[데일리팜=손형민 기자] MSD가 개발한 폐동맥고혈압 신약 윈레브에어가 국내 등장하며 시장 경쟁을 예고했다. 그간 폐동맥고혈압에는 포스포디에스테라제(PDE5) 억제제, 칼슘채널차단제(CCB) 등이 활용돼 왔지만 증상 조절 효과에 그쳤다. 질환의 원발적 원인을 타깃할 수 있는 신규 치료제가 이런 의학적 미충족 수요를 해결할 수 있을지 주목된다.26일 관련 업계에 따르면 식품의약품안전처는 23일 폐동맥고혈압 치료제 윈레브에어를 허가했다. 이로써 MSD는 지난해 미국과 유럽에 이어 윈레브에어의 허가국을 늘리는 데 성공했다.윈레브에어는 기존 치료제와 병용해 세계보건기구(WHO) 기능분류 II-III 단계에 해당하는 18세 이상 성인 폐동맥고혈압(WHO Group I) 환자의 운동 능력을 개선하는 데 사용된다.윈레브에어는 폐동맥고혈압 분야 최초로 승인된 ‘액티빈 신호전달 억제제(ASI)’로, 20년 만에 등장한 새로운 기전의 치료제다. 이는 폐동맥 혈관 내 세포 증식을 유발하는 단백질 복합체 ‘액티빈’의 과도한 증식 신호를 차단하고, 항증식 신호와의 균형을 조정해 변형된 혈관 구조를 정상화하는 ‘역재형성(reverse remodeling)’을 유도하는 작용을 한다.이번 허가는 폐동맥고혈압 환자 323명을 대상으로 진행된 임상3상 STELLAR 연구 결과를 기반으로 했다. 임상은 성인 환자를 대상으로 윈레브에어+표준요법군과 위약+표준요법군 간의 효능 및 안전성을 평가했으며, 피하주사 방식으로 3주에 한 번 투여됐다.임상 결과, 윈레브에어군은 6분 보행거리(6MWD)가 40.1m 증가했으며, 위약군은 1.4m 감소했다. 윈레브에어는 폐동맥고혈압 관련 임상적 악화 또는 모든 원인에 의한 사망 위험을 84% 줄였다. 2차 평가변수인 복합 평가 항목(6분 보행거리 30m 이상 개선 등)을 충족한 환자 비율은 윈레브에어군 38.9%, 위약군 10%로 나타났다.가장 흔한 이상반응은 두통, 비문증, 발진, 모세혈관확장증, 설사, 현기증 등이었으며, 헤모글로빈 및 적혈구 증가로 인한 혈전 색전증 또는 고점도 증후군 위험이 있어, 의료진은 투여 시 혈액수치 모니터링이 요구된다.바이엘 폐동맥고혈압 치료제 '아뎀파스'윈레브에어는 기존 비급여로 사용되던 바이엘의 아뎀파스와 시장 잠식 경쟁을 펼칠 가능성이 높아졌다. 특히 최근 아뎀파스가 지난 급여 적용을 받게 되면서 폐동맥고혈압 환자들의 치료 선택지도 확대됐다.폐동맥고혈압의 발병과 진행은 혈관활성인자의 발현 변화, 산화 스트레스 증가, NO(일산화질소) 경로 조절 장애 등과 관련돼 있다. NO는 sGC(가용성 구아닐산 고리화효소)를 활성화시켜 cGMP(고리형 구아노신 일인산) 생성을 유도하며, 이 경로의 이상은 폐혈관 저항을 증가시키고 혈관 폐쇄를 초래한다.아뎀파스는 NO에 의존하지 않고 sGC를 직접 자극하는 방식으로 작용하며, WHO 기능분류 II~III 환자 중 기존 치료에 반응이 부족한 경우에도 급여 처방이 가능하다.후발 신약들도 개발 한창윈레브에어 이후 글로벌제약사의 후발 폐동맥고혈압 신약개발도 한창이다.얀센의 폐동맥고혈압 복합제 옵신비는 미국에서 승인되며 환자와 의료진의 치료옵션 선택권이 확대됐다. FDA는 지난해 옵신비를 폐동맥 고혈압 1차 치료제로 허가했다. 이번 허가로 옵신비는 치료 경험이 없거나 엔도텔린 수용체 길항제(ERA), PDE5 억제제를 복용 중인 환자에게 사용이 가능하다.옵신비는 PDE5 억제제인 시알리스와 ERA인 애드서카 복합제로 해당 기전 복합제의 허가 승인은 이번이 최초다. PDE5 억제제는 폐동맥 압력을 떨어뜨리는 기전을 갖고 있고 ERA는 엔도텔린1(ET-1)의 작용을 차단해 폐혈관 수축을 혈관 확장을 촉진한다.옵신비는 A DUE로 명명된 임상 3상연구에서 효과를 입증했다. 임상은 옵신비 투여군과 대조군 옵서머트 또는 시알리스 단독 투여군의 효능과 안전성을 비교 평가하는 방식으로 진행됐다.24개월 동안 환자를 추적한 결과, 옵신비는 1차 평가변수로 설정한 폐혈관 저항(PVR)에서 시알리스 또는 옵서머트 투여군보다 최대 29% 감소시킨 것으로 나타났다. 가장 흔한 이상반응은 부종, 체액저류, 빈혈, 두통 등이었다. 여성 환자들이 옵서머트를 투여받기 위해서는 배아-태아 독성 위험성으로 인해 위험성 평가완화전략(REMS) 프로그램에 등록해야 한다.미국 인스메드는 폐동맥고혈압 치료제 후보물질 ‘TPIP(트레프로스티닐 팔미틸 흡입분말)’의 2b상 임상 결과를 발표하며 치료 가능성을 입증했다. 1일 1회 흡입제로 개발 중인 TPIP는 모든 1·2차 평가변수를 충족했다.TPIP는 흡입형 프로스타노이드(prostanoid) 계열의 신약 후보물질로, 기존 트레프로스티닐(treprostinil)의 한계를 극복하기 위해 개발됐다. 트레프로스티닐은 폐혈관을 확장시키고 항염증·항섬유화 작용을 통해 폐동맥고혈압의 혈역학적 부담을 줄이는 약물로 알려져 있다.TPIP는 여기에 지속형 전구약물(prodrug) 형태인 ‘트레프로스티닐 팔미틸’을 적용해 흡입 1회로 24시간 동안 약효가 유지되도록 설계됐다.이 신약후보물질은 흡입 시 폐에 직접 전달돼 폐혈관 확장, 염증 억제, 혈관 재형성 방지 등의 작용을 유도하며, 경구제나 정맥주사제 대비 부작용을 최소화하면서도 높은 치료 효율을 기대할 수 있다.또 지속 방출 특성 덕분에 일일 투여 빈도를 줄여 복약 순응도를 개선할 수 있으며, 용량을 점진적으로 증량해 고용량까지 도달 가능하다는 점도 임상에서 확인됐다.임상 결과, TPIP는 위약 대비 폐혈관 저항(PVR)은 35% 감소했고, 6분 보행거리는 35.5m 증가했다. 심장 스트레스 지표인 N말단 pro-뇌 나트륨 이뇨펩티드(NT-proBNP) 수치도 60% 감소했다. 투여 24시간 후 평가에서도 지속 효과가 확인됐으며, 피험자 75%가 최고 허용 용량(640㎍)까지 용량을 증량할 수 있었다. 주요 이상반응은 기침(40.6%), 두통(31.9%), 피로, 가슴 불편감 등이었다.이번 결과를 바탕으로 인스메드는 미국 FDA와의 협의를 통해 2025년 말 폐섬유화성 폐고혈압(PH-ILD) 대상 임상 3상을 시작하고, 2026년 초에는 폐동맥고혈압(PAH) 대상 임상 3상에 돌입할 계획이다. 현재 인스메드는 2b상을 완료한 환자들을 대상으로 최대 1,280㎍까지 증량 가능한 장기 확장 연구가 진행 중이다.국내기업도 폐동맥고혈압 신약개발 시장 참전국내 기업도 폐동맥고혈압 신약 개발에 속도를 내고 있다.자이메디의 항체치료제 ZMA001은 지난해 미국 FDA로부터 희귀의약품 지정을 받았다고 밝혔다. ZMA001은 인간 단일클론항체로, 염증 유발 대식세포의 폐 침투를 차단해 질병의 초기 병태생리를 근본적으로 억제한다. 전임상 연구에서 기존 약물 대비 효능이 확인됐다.자이메디는 이 물질을 AI 기반 기술로 피하주사 제형(ZMA001-SC)으로 전환하고, 1상 임상시험계획(IND)까지 추진할 계획이다. 미국 NIH는 ZMA001의 혁신성과 공익성을 인정해 공동연구개발 협약(CRADA)을 체결했으며, 올해 1월부터 NIH 임상센터에서 1a상 임상시험을 진행 중이다.나이벡도 자체 개발한 펩타이드 기반 신약 NP-201의 전임상에서 폐동맥고혈압 치료 가능성을 확인했다. 모노크로탈린으로 유도된 동물모델에 투여한 결과, 혈압 강하 효과와 함께 병든 폐혈관이 정상 구조로 회복되는 재생기전이 입증됐다. 나이벡은 NP-201의 글로벌 임상에 폐동맥고혈압 적응증을 포함할 계획이다.2025-07-26 06:20:55손형민 -
 차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼에 대해핵산 치료제는 구성 성분에 따라 DNA 기반 약제와 RNA 기반 약제로 구분되며, RNA 기반 약제는 안티센스 올리고뉴클레오티드(antisense oligonucleotide, ASO), 유전자 발현을 억제하는 소형 간섭 RNA(small interfering RNA, siRNA), 마이크로RNA(miRNA), 메신저 RNA(mRNA), 그리고 아프타머(aptamer) 등이 있다.이 중 siRNA는 합성된 이중가닥 RNA(double-stranded RNA, dsRNA)로서, 센스 가닥(sense strand)과 안티센스 가닥(antisense strand)으로 구성되며, 일반적으로 19~25 염기쌍의 길이를 가지고 있다. 이 중 안티센스 가닥은 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC) 내에서 특정 mRNA를 인식하고 절단하는 가이드 역할을 한다.이러한 siRNA를 기반으로 하는 RNA 간섭(RNAi) 치료제의 개발은 2000년대 초반부터 본격적으로 시작되었으며, 약 20년에 걸친 기술 축적과 전달 플랫폼의 발전을 통해 상용화 단계에 도달하였다. 2018년, 트랜스사이레틴(transthyretin, TTR) 매개 가족성 아밀로이드 다발신경병증(hATTR) 치료제 파티시란(Patisiran)이 미국 FDA로부터 최초로 승인을 받으며 siRNA 기반 치료제의 상업화가 본격화되었다.이후 다양한 GalNAc conjugate(갈낙 접합체) 기반의 siRNA 치료제들이 연이어 FDA 승인을 획득하였다. 주요 승인 약제로는 2019년 급성 간성 포르피린증(acute hepatic porphyria, AHP) 치료제 기보시란(Givosiran), 2020년 원발성 옥살산뇨증 1형(primary hyperoxaluria type 1, PH1) 치료제 루마시란(Lumasiran), 2021년 고지혈증 치료제 인클리시란(Inclisiran), 2022년 hATTR 치료제 브루시란(Vutrisiran)이 있다.또한 2023년에는 PH1 치료제로 네도시란(Nedosiran), 2025년에는 A형 및 B형 혈우병 환자(항응고 인자 억제제 보유 여부와 무관)의 예방 치료제로 피투시란(Fitusiran)이 승인되었다.이러한 siRNA 기반 RNA 간섭(RNAi) 치료제 플랫폼은 암, 바이러스 감염, 유전성 대사질환 등 다양한 질환의 병태생리를 직접 조절할 수 있는 차세대 정밀의학 전략으로 주목받고 있으며, 이는 단순한 유전자 발현 억제를 넘어, 특정 병인 단백질의 발현을 선택적으로 차단함으로써 질병의 근원을 표적하는 질병 수정형(disease-modifying) 치료제로서의 가능성을 제시하고 있다. RNA(Ribonucleic acid, 리보핵산)는 무엇인가? 핵산은 생명체의 유전 정보를 저장하고 전달하는 데 핵심적인 역할을 하며, 그중 RNA는 진핵세포와 원핵세포 모두에서 유전자 발현 및 세포 내 조절 과정에 필수적인 고분자 생체분자로서, DNA와 함께 분자생물학의 센트랄 도그마(central dogma)를 구성하는 주요 요소이다.RNA는 주로 DNA의 유전 정보를 단백질로 전달하는 전령(messenger)의 역할로 인식되어 왔으나, 다양한 연구 결과에 따라 RNA는 단순한 정보 매개체를 넘어 효소적 기능, 유전자 발현 조절, 구조적 지지, 면역 조절 인자 등 폭넓은 생물학적 기능을 수행하는 분자로 밝혀졌다. 이에 따라 RNA는 단백질과 동등하거나 그 이상으로 기능적 다양성을 지닌 핵심 생체분자로 평가되고 있다.RNA는 리보오스를 포함한 단일가닥 핵산으로 구성되며, DNA와 달리 염기로 우라실(uracil)을 포함하고, 2′-탄소 위치에 하이드록시기(2′-OH group)를 갖는 리보오스를 지닌다. 이러한 구조적 특성은 RNA에 높은 구조적 유연성과 화학적 반응성을 부여하여, 다양한 입체 구조를 형성하고 특정 단백질이나 다른 핵산과 선택적으로 결합하며, 심지어 효소적 반응을 촉매할 수 있는 생화학적 기반이 된다.실제로 RNA는 염기 서열에 의한 상보적 결합 외에도 루프(loop), 헤어핀(hairpin), 스템(stem), 벌지(bulge), 가상매듭(pseudoknot) 등 복잡한 이차 및 삼차 구조를 형성하며, 이를 통해 단백질-리간드 상호작용, 효소 활성, 핵-세포질 간 수송, 세포 내 위치 특이적 기능 수행 등에 관여한다.RNA는 유전자 발현 조절, 세포분화, 세포주기, 세포사멸, 스트레스 반응, 면역 조절 등 거의 모든 생리적·병리적 현상에 직·간접적으로 관여하며, DNA로부터 유래된 정보를 전달하는 역할외에도 전사(transcription)와 번역(translation) 간의 연결을 매개하고 유전자 발현의 정밀한 조절자로 작용한다.특히 진핵세포에서는 RNA가 전사 후 변형(post-transcriptional modification), 스플라이싱(splicing), RNA 편집(RNA editing), 핵-세포질 수송(nuclear export), 안정성 조절, 국소화(localization) 등 유전자 발현을 다양한 수준에서 정교하게 조절한다하지먼 RNA의 기능 이상은 다양한 질환의 발병과 밀접하게 연관되어 있다. 즉 RNA의 안정성 혹은 조절 기전이 교란되면 특정 단백질의 비정상적 발현이 초래되며, 이는 암, 신경퇴행성 질환, 심혈관 질환, 자가면역 질환 등 다양한 병태생리적 상태를 유발하거나 악화시킬 수 있다.최근 연구에 따르면 RNA의 구조적 변이, 염기서열 돌연변이, 또는 RNA-단백질 상호작용의 이상은 질환의 새로운 병인으로 부상하고 있으며, RNA 수준에서의 진단 및 치료 접근은 생명과학의 주요 연구 영역으로 부각되고 있다.RNA에는 어떤 종류가 있는가? RNA는 그 기능에 따라 여러 유형으로 분류된다(Figure 1). 가장 기본인 형태는 전령 RNA(messenger RNA, mRNA)로, DNA의 유전 정보를 복사하여 리보솜으로 전달하며 단백질 합성에 직접 관여한다. 전이 RNA(transfer RNA, tRNA)는 아미노산을 리보솜으로 운반하는 역할을 하며, 리보솜 RNA(ribosomal RNA, rRNA)는 리보솜의 구조적 및 촉매적 핵심 요소로 기능한다.이 외에도 최근에는 유전자 발현을 정밀하게 조절하는 비번역 RNA(non-coding RNA)들이 주목받고 있다. 예를 들어, 소간섭 RNA(small interfering RNA, siRNA), 마이크로 RNA(microRNA, miRNA), 긴 비암호화 RNA(long non-coding RNA, lncRNA) 등은 세포 내 유전자 조절 네트워크의 핵심 조절자로 작용한다. 1. mRNA(messenger RNA, 전령 RNA) mRNA가 전달하는 유전 정보는 염기의 종류, 배열, 그리고 길이에 의해 결정된다. DNA는 아데닌(A), 구아닌(G), 시토신(C), 티민(T)의 네 가지 염기로 구성되어 있는 반면, RNA는 티민 대신 우라실(U)을 포함한다. 유전 정보는 이러한 염기의 조합으로 구성되며, RNA 중 mRNA는 전사(transcription) 후 모든 처리가 완료된 형태로, 5′-cap 구조와 poly(A) tail(폴리 A 꼬리)을 갖추고 있으며, 스플라이싱(splicing)도 완료된 상태이다.mRNA는 DNA의 유전 정보를 기반으로 리보솜에서 단백질을 합성할 때 번역 서열(translation sequence)로 작용하므로, 세포 내에서 mRNA의 발현 수준을 조절하는 것은 생명 현상을 통제하는 데 매우 중요하다.성숙한 mRNA는 긴 poly(A) tail을 가지며, 이 아데닌 꼬리는 mRNA의 분해를 방지하고 안정적인 기능 수행을 돕는다. 그러나 시간이 지나면 탈아데닐화(deadenylation) 효소에 의해 이 꼬리는 점차 짧아지게 되고, 이는 mRNA 분해의 신호로 작용한다. 반면, mRNA의 말단에 혼합 꼬리(mixed tail)가 형성될 경우, 이는 아데닌 꼬리의 제거 과정을 방해하여 mRNA의 분해를 억제하고 안정성을 높이는 것으로 알려져 있다. 따라서 혼합 꼬리는 mRNA의 생존을 유지하는 데 중요한 조절 요소로 작용한다.2. ncRNA(non-coding RNA, 비암호화 RNA) 센트럴 도그마에 따르면, 단백질을 암호화하지 않는 RNA는 비암호화 RNA(non-coding RNA, ncRNA)로 분류된다. 비록 ncRNA는 단백질을 직접 생성하지는 않지만, 전사 후 조절(post-transcriptional regulation) 및 후성유전학(epigenetic) 기전에 관여하는 중요한 조절자로 밝혀지고 있다.ncRNA는 기능적 역할에 따라 크게 하우스키핑 비암호화 RNA(housekeeping ncRNA)와 조절 비암호화 RNA(regulatory ncRNA)로 나뉘며, 그 길이에 따라 다시 분류된다. 일반적으로 200개 이하의 뉴클레오타이드(nucleotide)로 구성된 경우를 작은 ncRNA(small ncRNA 또는 short/medium ncRNA)라 하고, 200개 이상의 뉴클레오타이드를 포함할 경우 긴 ncRNA(long non-coding RNA, lncRNA)로 분류된다. 이들은 기능, 전사 후 가공, 상호작용 양상 등에 따라 더욱 세분화된다.1) Housekeeping ncRNA(하우스키핑 비암호화 RNA) ① tRNA(transfer RNA, 운반 RNA) tRNA는 단백질 합성 과정에서 mRNA의 코돈(codon)에 상보적으로 결합하는 안티코돈(anticodon)을 가지고 있으며, 해당 코돈에 대응하는 아미노산을 리보솜으로 운반하는 역할을 한다. 즉, mRNA의 코돈을 해독하여 해당 아미노산을 정확히 리보솜에 전달하고, 폴리펩타이드 사슬의 신장(elongation) 과정에 기여함으로써 단백질 합성의 핵심 요소로 작용한다.tRNA는 전사된 직후 바로 기능하는 것이 아니라 pre-tRNA라는 전구체 형태로 먼저 생성된다. 이 pre-tRNA는 5′ 말단과 3′ 말단에 불필요한 염기 서열을 포함하며, 일부는 안티코돈 고리(anticodon loop)에 인트론(intron)을 포함하기도 한다. 성숙한 tRNA는 이러한 전사 후 가공 과정을 통해 구조적으로 안정화되고 생물학적 활성을 갖춘다.② rRNA(ribosomal RNA, 리보솜 RNA) rRNA는 리보솜의 핵심 구성 요소로, 다양한 리보솜 단백질과 결합하여 기능적 리보솜 복합체를 형성한다. 리보솜은 세포 내 단백질 생합성의 중심 기구이며, rRNA는 전체 세포 내 RNA의 약 80%를 차지할 정도로 풍부하게 존재한다.rRNA는 단순한 구조적 지지체에 그치지 않고, 촉매적 기능까지 수행한다. 특히, 리보솜의 대단위 서브유닛(large subunit)에 존재하는 rRNA는 펩티딜전이효소(peptidyl transferase)로 작용하여 아미노산 사이의 펩타이드 결합 형성을 촉진한다. 이는 RNA 자체가 효소 활성을 수행하는 대표적 예로, rRNA가 리보자임(ribozyme)으로 기능함을 보여준다.2) Regulatory ncRNA(조절 비암호화 RNA) 인간 유전체는 약 30억 개의 염기쌍(base pairs)으로 구성되어 있으나, 이 중 약 1% 정도만이 단백질을 암호화하는 유전자로 기능하는 것으로 오랫동안 여겨져 왔다. 이러한 전통적인 관점을 검증하고 유전체의 기능적 요소를 체계적으로 규명하기 위해 시작된 국제적 연구가 바로 ENCODE(Encyclopedia of DNA Elements) 프로젝트이다.ENCODE 프로젝트를 통해 밝혀진 핵심 사실은, 과거에 ‘쓰레기 DNA(junk DNA)’ 혹은 ‘암흑 물질(dark matter)’로 간주되었던 비암호화 영역이 실제로 생화학적 활성 및 생물학적 기능을 수행한다는 점이다. 이는 ncRNA가 단순한 유전 정보의 부산물이 아니라, 유전자 발현을 정밀하게 조절하는 중요한 조절자(regulator)로 기능할 수 있음을 의미한다.특히, 차세대 염기서열 분석기법(NGS) 등 기술의 발전으로 유전체 전체의 전사(transcription) 양상을 정밀하게 분석할 수 있게 되었고, 그 결과 유전체의 실제 전사 비율이 단 1%가 아니라 약 80%에 이른다는 사실이 밝혀졌다. 이는 유전체의 대부분이 기능적 목적을 가지고 의도적으로 전사된다는 점을 시사한다.이러한 발견은 ncRNA, 특히 조절 비암호화 RNA(regulatory ncRNA)의 중요성을 부각시켰으며, 이들은 전사 후 조절, 염색질 구조 변형, 유전자 발현 억제 및 활성화, 세포 분화, 그리고 항상성 유지 등 다양한 생명 현상에 핵심적인 역할을 수행하는 것으로 밝혀졌다.① Small ncRNA(sncRNA, 작은 비암호화 RNA) a. miRNA(microRNA, 마이크로 RNA) miRNA는 RNA 간섭(RNA interference, RNAi)과 유사한 기전을 따르는, 자연적으로 존재하는 유전자 발현 조절 메커니즘이다. 현재까지 인간에서 수백 종의 miRNA가 확인되었으며, 전체적으로는 50,000종 이상이 존재할 것으로 추정된다.miRNA는 일반적으로 약 22개의 염기로 구성된 짧은 단일가닥 RNA이며, 표적 mRNA와 부분적으로 상보적인 염기서열을 인식하여 결합한다. 이를 통해 mRNA의 번역을 억제하거나 분해를 유도함으로써 유전자 발현을 음성 조절(negative regulation)한다.miRNA는 특히 개체 발생, 세포 분화, 세포 주기 조절, 세포사멸, 암 억제 또는 촉진 등 다양한 생명현상의 조절자로 기능하며, 이의 이상 발현은 암, 심혈관 질환, 신경계 질환 등 여러 병태생리학적 상태와 밀접한 관련이 있는 것으로 알려져 있다.b. siRNA(small interfering RNA, 소간섭 RNA) siRNA는 보통 인위적으로 합성된 긴 이중가닥 RNA(dsRNA)를 세포 외부에서 도입한 후, 세포 내에서 ATP-의존성 RNase인 Dicer에 의해 절단되어 생성되는 길이 21~23 염기쌍의 짧은 dsRNA이다.siRNA는 성숙한 miRNA(mature miRNA)와 구조적으로 유사하나, 기원과 기능적 특성에서 차이를 보인다. 특히 표적 mRNA와의 염기서열 상보성에 있어서 뚜렷한 차이가 있다. siRNA는 표적 mRNA와 완전한 상보성을 이루어 정확한 표적 유전자만을 선택적으로 억제하는 반면, miRNA는 일반적으로 불완전한 상보성을 바탕으로 여러 유전자의 번역을 동시에 조절할 수 있다.이러한 차이로 인해 siRNA는 고특이적 유전자 침묵(specific gene silencing)에 적합하며, miRNA는 보다 광범위한 유전자 조절(global regulation)에 기여하는 특성을 가진다.c. snRNA(small nuclear RNA, 작은 핵 RNA) snRNA는 주로 핵 내에서 pre-mRNA의 스플라이싱(splicing)에 관여하는 짧은 RNA 분자이다. 대표적으로 U1, U2, U4, U5, U6 등의 snRNA가 스플라이스좀(spliceosome)이라는 RNA-단백질 복합체(RNP complex)를 형성하여, 인트론(intron)의 제거 및 엑손(exon)의 연결에 필수적인 역할을 수행한다.snRNA는 mRNA 성숙 과정에서 엑손-인트론 경계의 인식과 절단을 통해 유전자 발현의 정밀한 조절을 수행하는 핵심 인자로 기능한다.d. snoRNA(small nucleolar RNA, 작은 인 RNA) snoRNA는 주로 세포핵 내 핵소체(nucleolus)에 존재하는 RNA로, rRNA의 성숙 및 가공에 핵심적인 역할을 한다. snoRNA는 pre-rRNA(전구체 리보솜 RNA)와 상보적인 염기서열을 바탕으로 결합하여, 특정 위치의 염기를 화학적으로 변형하거나 절단 위치를 안내한다.snoRNA의 주요 기능은 rRNA 염기에 대해 2′-O-메틸화(2′-O-methylation) 또는 위우리딘(pseudouridine)으로의 전환을 유도한다. 이러한 변형은 rRNA의 구조적 안정성과 리보솜 기능에 매우 중요하다. 또한 snoRNA는 pre-rRNA가 정확한 위치에서 절단되도록 도와줌으로써, 최종적으로 기능을 갖춘 성숙한 rRNA의 형성에 기여한다.② long ncRNA(lncRNA, 긴 비암호화 RNA) lncRNA는 단백질을 직접 암호화하지 않지만, 포유류 전사체(transcriptome) 내에서 비교적 풍부하게 존재하며 세포 기능에 다양한 방식으로 기여한다. 특히, lncRNA는 염색질 구조 조절 효소(chromatin-modifying enzyme)를 모집하거나 그 활성을 조절함으로써, 표적 유전자의 전사 활성 조절에 관여하는 것으로 잘 알려져 있다.lncRNA의 생물학적 기능은 크게 세 가지 기전으로 요약될 수 있다. 첫째, 시스(cis) 또는 트랜스(trans) 위치에서 전사 조절자(transcriptional regulator)로 작용하여, 인접 유전자의 발현을 직접 조절하거나, 떨어진 위치에 존재하는 유전자에 영향을 미친다.둘째, RNA 가공(splicing 등) 과정이나 전사 후(post-transcriptional) 조절, 또는 단백질 활성을 조절하는 기능을 수행한다. 이 경우 lncRNA는 특정 단백질 또는 RNA와 상호작용함으로써 기능적 복합체를 형성하거나, 조절자의 기능을 매개하는 플랫폼으로 작용한다.셋째, 일부 lncRNA는 핵 내 도메인(nuclear domain)의 구조적 구성에 기여하여, 세포핵 내 공간적 조직화와 기능적 구획화를 조절하는 역할을 수행한다. 이는 핵 내 RNA-단백질 복합체 형성과 같은 고차원적인 구조적 조절과 연관된다.lncRNA는 일반적으로 조직 또는 세포 유형 특이적인 발현 양상을 보이며, 단일 세포당 평균적으로 1개 미만의 사본만 검출되는 경우가 많다. 그러나 특정 조직이나 핵의 특정 구획에서는 높은 수준으로 발현되어, 기능적 다양성과 세포 간 복잡성을 더욱 증가시키는 요인으로 작용한다.특히, lncRNA는 개체 발생, 세포 분화, 노화, 스트레스 반응 등 다양한 생리적 과정뿐 아니라, 암의 발생 및 진행과 같은 병리적 현상에서도 중요한 조절 인자로 기능함이 밝혀지면서, 분자생물학 및 암 연구 분야에서 활발한 주목을 받고 있다.RNA 침묵(RNA silencing)은 어떤 현상인가? 생명체 내에서 유전자 발현은 정교한 조절 기전에 의해 통제되며, 이러한 조절은 개체의 발생, 항상성 유지, 외부 자극에 대한 반응, 병리적 상태에서의 적응 등 다양한 생물학적 과정에 핵심적인 역할을 한다. 이 가운데 유전자 침묵(gene silencing)은 특정 유전자의 발현을 억제하거나 완전히 차단하는 생물학적 현상이다.유전자 침묵(Gene silencing)에는 전사 시 유전자 침묵(transcriptional gene silencing, TGS)와, 전사 후 유전자 침묵(post-transcriptional gene silencing, PTGS)이 존재한다. 이 중 TGS는 일반적으로 DNA 메틸화(DNA methylation), 히스톤 변형(histone modification), 이질 염색질 형성(heterochromatinization) 등의 후성유전학적 메커니즘에 의해 매개되며, 유전자 접근성을 구조적으로 차단함으로써 발현을 억제한다.RNA 침묵(RNA silencing)은 유전자 침묵의 하위 개념으로, 주로 RNA 분자에 의해 매개되는 전사 후 유전자 침묵(PTGS) 기전을 지칭한다. RNA 침묵은 1990년대 후반, 식물과 동물, 곰팡이 등 다양한 진핵생물에서 확인되었으며, 진화적으로 보존된 염기서열 특이적 유전자 조절 기전으로 기능한다.RNA 침묵의 중심에는 짧은 비암호화 RNA 분자들, 즉 siRNA, miRNA, piRNA가 있으며, 이들은 각각 고유한 기원과 작용 기전을 통해 표적 mRNA의 발현을 억제한다.miRNA는 내인성 전사체로부터 유래하며, 개체의 발달, 세포 분화, 세포 주기, 세포사멸 등 생리적 과정뿐만 아니라 암, 심혈관 질환, 신경계 질환 등의 병태생리적 상태에서 정밀한 유전자 조절자로 기능한다.siRNA는 외부에서 유래된 dsRNA에 의해 형성되며, 실험적 유전자 침묵 기법이나 RNA 간섭 기반 치료제에 직접적인 유전자 억제 도구로 활용되고 있다.piRNA는 주로 생식세포에서 발현되며, 트랜스포존 억제, 유전체 안정성 유지, 세포 계통 유지 등 특수한 기능을 수행한다.RNA 침묵은 다양한 진핵생물에서 보편적으로 나타나며, 바이러스 감염에 대한 방어 기전, 전이 요소 억제, 비정상적 전사체 제거 등 세포 수준의 품질관리 및 유전체 보호 시스템으로 작용한다. 이러한 점에서 RNA 침묵은 단순한 유전자 억제를 넘어 생물학적 균형과 유전체 기능 유지의 핵심 축으로 간주된다.최근 RNA 침묵 기전은 치료 표적 및 플랫폼 기술로도 활발히 연구되고 있으며, siRNA 기반 치료제, antisense oligonucleotide(ASO) 기술 등은 RNA 침묵 원리를 기반으로 개발된 RNA 기반 정밀 의약품으로 발전하여 다양한 질환에서 임상적으로 응용되고 있다.RNA 간섭(RNA interference, RNAi)은 어떤 현상인가? RNAi는 1998년 Andrew Fire와 Craig Mello가 예쁜꼬마선충(Caenorhabditis elegans)을 대상으로 한 실험에서 처음 보고한 현상으로, 외부에서 도입된 이중가닥 RNA(dsRNA)가 세포 내 특정 mRNA를 인식하고 이를 선택적으로 분해함으로써 유전자 발현을 억제하는 고유의 생물학적 기전이다. 이 발견은 유전자 발현 조절에 대한 이해를 근본적으로 전환시켰으며, 두 연구자는 해당 업적으로 2006년 노벨 생리의학상을 수상하였다.RNA 침묵은 유전자 발현 억제를 유도하는 상위 개념이고, 그 중 RNAi는 기전이 명확히 규명되고 약물화 가능성이 높은 대표적인 하위 경로에 해당한다. RNAi는 염기서열 특이적 방식으로 작용하여, 표적 유전자의 발현을 정밀하게 제어할 수 있는 장점을 지니며, 바이러스 방어, 전이인자 억제, 후성유전 조절, 발생 및 분화 조절 등 다양한 생물학적 과정에 기여한다.특히 RNAi는 유전자 기능 연구, 질병 모델링, 표적 유전자 억제를 통한 치료제 개발 등 기초연구 및 임상분야 모두에서 응용 가능성이 높은 기술로 주목받고 있으며, siRNA 기반 치료제는 이러한 RNAi 원리를 임상에 성공적으로 도입한 대표적인 예로 평가되고 있다.소간섭 RNA(small interefering RNA, siRNA)는 무엇인가? siRNA는 RNAi 현상을 매개하는 대표적인 dsRNA로, 특정 mRNA의 발현을 염기서열 특이적으로 억제하는 기능을 수행한다. siRNA는 miRNA와 달리 전사산물의 절단(cleavage)을 직접 유도하는 강력한 침묵 효과를 나타낸다.이는 특히 바이러스 유전체, 종양 특이 유전자, 병리적 유전자 돌연변이 등을 표적으로 하는 데 적합하다. 이러한 특이성과 효능을 바탕으로 siRNA는 유전자 기능 연구뿐 아니라 질병 치료를 위한 유전자 기반 약물 플랫폼으로 빠르게 발전하고 있다.하지만, siRNA는 그 자체의 불안정성, 세포막 투과성 부족, 면역 자극 가능성 등의 한계도 지니고 있어, 이를 극복하기 위한 다양한 전달 시스템(delivery system) 개발이 병행되고 있다. 특히, 갈낵(GalNAc) 기반 간세포 표적 전달 시스템은 siRNA 치료제의 성공적 상용화에 핵심적인 기술로 평가된다.RNAi는 외부 또는 내부에서 유래된 dsRNA에 의해 유도되며, siRNA는 RNAi 경로의 핵심 매개체로 작용한다. siRNA는 RNAi이라 불리는 다단계 과정을 통해 유전자 발현을 억제하는 데 핵심적인 역할을 한다(Figure 1). 첫 번째 단계, dsRNA의 세포 내 유입과 Dicer에 의한 절단 siRNA는 주로 외인성 또는 인공적으로 도입된 dsRNA의 절단에 의해 생성된다. 일단 dsRNA가 세포 내로 유입되면 세포질(cytoplasm)에서 작용을 시작한다. 자연 상태에서는 긴 dsRNA 또는 전구체(pre-siRNA)가 Dicer라는 RNase III 계열의 효소에 의해 절단되어 siRNA가 생성된다. 그러나 합성 siRNA는 21~23개 염기쌍의 짧은 이중가닥 RNA로 구성되며, 이미 Dicer 가공 단계를 생략한 형태로 설계되어 있다.두번째 단계, RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC) 형성과 가이드 스트랜드 선택 세포질 내에서 siRNA는 RISC와 결합하게 된다. RISC는 Argonaute(AGO) 단백질을 핵심으로 하는 다단백 복합체이며, siRNA는 이 복합체에 의해 가이드 가닥(guide strand)와 패신저 가닥(passenger strand)로 분리된다. 이 과정에서 AGO2는 패신저 가닥을 제거하거나 분해하며, 가이드 가닥만이 RISC에 안정적으로 결합된다. 가이드 가닥은 이후 표적 mRNA의 염기서열을 인식한다.세 번째 단계, mRNA 인식 및 절단(유전자 침묵 유도) 가이드 가닥이 결합된 활성화된 RISC는 세포질 내에 존재하는 상보적 염기서열을 가진 mRNA를 탐색한다. siRNA와 표적 mRNA가 완전한 상보성을 이루는 경우, AGO2의 엔도뉴클레아제 활성이 유도되어 표적 mRNA를 특정 위치에서 절단(cleavage)하게 된다. 절단된 mRNA는 이후 세포 내 핵산 분해효소에 의해 빠르게 분해되며, 이는 궁극적으로 해당 유전자의 단백질 발현 억제로 이어진다.이러한 유전자 침묵은 염기서열 특이적이며, 시간적으로 수 일에서 수 주 이상 지속될 수 있으며, 반복 투여 시 누적 효과를 기대할 수 있다. 또한, siRNA는 번역 후 단계에 작용하기 때문에, 단백질 발현을 정밀하게 조절할 수 있는 장점이 있다.RNA 기반 치료제(RNA-based therapeutics)란 무엇인가? RNA 기반 치료제는 특정 유전자 또는 병리적 단백질의 발현을 직접적으로 조절하거나, 필요한 단백질을 체내에서 직접 합성하도록 유도함으로써 질병의 원인 자체를 정밀하게 조절할 수 있는 치료 전략이다. 이러한 치료제는 RNA의 구조적 및 기능적 다양성에 따라 여러 유형으로 분류된다.대표적인 RNA 기반 치료제에는 단백질 생성을 직접 유도하는 mRNA 치료제, 특정 mRNA를 분해하거나 스플라이싱을 조절하는 ASO, RNAi 기전을 통해 유전자 발현을 억제하는 siRNA 및 miRNA 유사체, 특정 단백질에 선택적으로 결합하여 기능을 저해하는 RNA 압타머(aptamer) 등이 있다.이들 치료제는 유전자 수준의 정밀한 조절이 필요한 질환에서 특히 유효성이 크며, 암, 유전질환, 감염병, 대사질환 등 다양한 분야에서 치료 효과가 확인되고 있다.RNA 기반 치료제의 가장 큰 강점은 염기서열 상보성에 기반한 높은 표적 특이성과 설계의 유연성이다. 환자의 유전 정보나 발현 프로파일에 따라 맞춤형으로 표적을 설계할 수 있으며, 기존의 항체나 저분자 화합물로는 접근이 어려운 내재적 유전자 조절 단계에 직접 개입할 수 있다는 이점이 있다.그러나 RNA 분자의 구조적 불안정성, 면역 자극 가능성, 세포 내 전달의 어려움은 여전히 극복해야 할 중요한 과제로 남아 있다. 이를 해결하기 위해 지질 나노입자(lipid nanoparticle, LNP), 갈낙(GalNAc) 접합체, 엑소좀(exosome), 바이러스 벡터 등 다양한 전달 기술이 병행 개발되고 있으며, RNA 분자 자체에 대한 화학적 변형 연구 또한 활발히 진행 중이다.RNAi 기반 치료제(RNA interference-based therapeutics)란 무엇인가? RNAi는 짧은 dsRNA 조각이 세포 내 RNA 유도 침묵 복합체(RISC)에 의해 가이드되어, 상보적인 서열을 갖는 표적 mRNA를 절단함으로써 유전자 발현을 억제한다. 이 과정은 고도로 염기서열 특이적인 방식으로 이루어지며, 세포 내에서 자연스럽게 일어나는 중요한 방어 및 조절 기전이다.RNAi 기반 치료제는 병리적 유전자의 발현을 직접적으로 차단함으로써, 단백질 생성 자체를 근본적으로 억제할 수 있는 전략이다. 이는 기존의 단백질 표적 저해제들이 개입하기 어려운 전사 후(post-transcriptional) 단계에 개입할 수 있다는 점에서 근본적으로 다른 치료 접근법을 제공한다. 특히 유전자 과발현 또는 독성 단백질의 생성이 질병의 주요 병태기전인 경우에 매우 적합하며, 유전질환, 암, 간질환, 감염병 등 다양한 질환에서 임상적 적용이 활발히 진행되고 있다.RNAi 기반 치료제는 작용 기전에 따라 크게 세 가지로 구분된다. 첫째, siRNA는 화학적으로 합성된 짧은 dsRNA로, 표적 mRNA에 대해 높은 서열 특이성을 갖는다. GalNAc(갈낙) 기반 간 표적화 기술, 리포솜 또는 지질나노입자(LNP) 기반 세포 내 전달 기술을 활용하여 체내 적용이 가능하며, 현재 대부분의 RNAi 치료제가 이 플랫폼을 기반으로 한다.둘째, shRNA(short hairpin RNA)는 플라스미드나 바이러스 벡터를 통해 세포 내에서 안정적으로 발현되며, 지속적인 유전자 억제를 유도하는 구조이다. 주로 세포를 체외에서 조작하는 ex vivo 유전자 치료 전략에 활용된다.셋째, miRNA 유도체는 내인성 microRNA의 기능을 모방하거나 경쟁적으로 억제하여, 보다 광범위한 유전자 네트워크를 조절하는 방식으로 개발 중이다. 이는 특정 유전자뿐 아니라 관련된 다수의 유전자를 동시에 조절할 수 있는 장점이 있다.따라서 RNAi 기반 치료제는 유전자 수준에서의 정밀 제어, 고특이성, 그리고 효율적인 발현 억제라는 특성을 지니며, 기존의 저분자 화합물이나 단백질 기반 치료제와는 차별화되는 생물학적 전략을 제공한다.실제로 Givosiran, Lumasiran, Inclisiran 등은 각각 급성 간성 포르피린증(AHP), 원발성 옥살산뇨증 1형(PH1), 고지혈증 등의 적응증으로 다수 국가에서 시판 승인을 획득하였으며, 이는 RNAi 기술이 실용적인 치료 플랫폼으로 진입했음을 보여주는 중요한 이정표가 되었다.GalNAc-siRNA란 무엇인가? siRNA는 분자량이 작고 음전하를 띠는 친수성 분자로서 세포막을 자발적으로 통과하기 어려우며, 혈중에서 RNase에 의해 쉽게 분해되는 한계를 지닌다. 이러한 점에서 siRNA의 안정적이고 표적 특이적인 전달은 치료 효과를 극대화하기 위해 반드시 극복되어야 할 과제이다.이에 따라 다양한 siRNA 전달 시스템(delivery vector)이 개발되어 왔으며, GalNAc conjugate, 지질 나노입자(lipid nanoparticle, LNP), 고분자 기반 전달체 등 다양한 전달 플랫폼이 개발되고 있으며, 이들은 siRNA의 생체 내 안정성 및 조직 특이적 투과성을 개선하는 데 중요한 역할을 하고 있다.이 중 약물을 세포 표면 수용체 리간드와 결합시키는 방식(GalNAc conjugate)은 표적 약물 전달을 위한 유망한 경로로 보고되고 있다. 이러한 수용체는 특정 세포 유형에만 발현되며, 일부 질환에서는 특정 장기나 조직에서 과발현된다.3방향 GalNAc(triantennary GalNAc)은 siRNA의 안티센스(antisense) 사슬 3′ 말단과 결합하여 GalNAc-siRNA conjugate를 형성한다. siRNA는 화학적으로 직접 합성할 수 있으며, 또는 효소 전사로 얻어진 긴 이중가닥 RNA를 세포질 RNase III 엔도뉴클레아제인 Dicer의 작용으로 절단하여 21~23 nt 길이의 siRNA를 생성할 수 있다. 이 siRNA는 3′ 말단에 두 개의 돌출된 뉴클레오타이드, 5′ 말단에 인산기, 그리고 가운데에 19 nt의 상보적인 이중가닥 영역을 가진다.따라서 siRNA와 GalNAc을 결합시켜 피하 주사로 투여하면, GalNAc-siRNA conjugate가 ASGPR(Asialoglycoprotein receptor)에 결합되고, 이어 ASGPR 매개 세포 내 유입(endocytosis)을 통해 세포 내로 들어가게 된다(Figure 2).GalNAc은 간세포 이외의 조직에서는 거의 발현되지 않는 수용체에 대한 높은 결합 친화성을 가지므로, siRNA 분자의 간 특이적(targeted delivery to hepatocytes) 전달을 가능하게 한다. GalNAc-siRNA의 작용 기전은? GalNAc-siRNA의 작용 기전의 핵심은, GalNAc-siRNA conjugate가 간세포 표면의 수용체(asialoglycoprotein receptor, ASGPR)에 선택적으로 인식되고 전달된다는 점에 있다. siRNA는 본래 음전하를 띠고 분자량이 큰 친수성 분자로서, 세포막을 자발적으로 통과하기 어렵다. 하지만 GalNAc으로 변형된 siRNA는 간세포에 특이적으로 발현되는 ASGPR를 통해 표적 조직으로 선택적 전달될 수 있으며, 효율적인 세포 내 유입도 가능하게 된다.ASGPR은 간소엽(liver lobule) 내 간 실질세포(hepatocyte)의 혈관사이 공간(hepatic sinusoid space) 표면에 주로 발현되는 수용체로, GalNAc-siRNA conjugate가 체내에 주입되면 GalNAc-siRNA-ASGPR 복합체는 세포 내로 유입되어 엔도솜(endosome) 내에서 분리된다. 이후 siRNA는 엔도솜으로부터 방출되고, GalNAc은 분해되어 제거된다. ASGPR을 포함한 소포는 다시 세포막과 융합되어 간세포 표면으로 되돌아가 수용체 순환(recycling)을 마친다.엔도솜에서 방출된 siRNA는 헬리케이스(helicase)에 의해 이중가닥 구조가 풀리고, 안티센스 가닥(antisense strand)은 Ago2 단백질을 포함한 다양한 효소들과 함께 RISC를 형성한다. RISC는 표적 mRNA와 상보적인 염기서열에 결합하며, Ago2는 안티센스 가닥의 5′ 말단에서 10번째와 11번째 염기 사이의 인산다이에스터 결합(phosphodiester bond)을 절단하여 mRNA를 분해하고 유전자 발현을 억제한다(Figure 3). siRNA 기반 RNAi 치료제 플랫폼의 특장점은? RNAi은 dsRNA의 존재에 의해 유도되는 유전자 침묵 현상으로, 세포 내에서 특정 mRNA를 선택적으로 분해함으로써 유전자 발현을 전사 후 수준에서 억제하는 고도로 보존된 생물학적 기전이다. RNAi 기전의 핵심 실행 인자인 siRNA는 염기서열 상보성에 기반하여 표적 mRNA를 인식하고 절단함으로써, 병리 단백질의 발현을 효과적으로 차단할 수 있다.이러한 기전을 치료 전략에 응용한 siRNA 기반 RNAi 플랫폼은 기존의 단백질 중심 치료제와는 차별화된 분자적 기전을 바탕으로 정밀하고 지속적인 유전자 억제를 가능하게 하며, 새로운 치료 패러다임으로 주목받고 있다.siRNA 기반 플랫폼의 가장 큰 장점 중 하나는 높은 표적 특이성(target specificity)이다. siRNA는 21~23개의 염기쌍으로 구성된 짧은 dsRNA 분자로, 염기서열 상보성에 따라 특정 mRNA만을 선택적으로 인식하여 작용하므로, 오프타깃(off-target) 효과를 최소화할 수 있다. 여기에 2'-O-methyl, 2'-fluoro 등의 화학적 변형을 적용하면 분해 저항성과 면역자극 회피 능력이 향상되어, 약물의 안전성과 유효성을 동시에 확보할 수 있다.또한 siRNA는 단백질 구조 정보에 의존하지 않고 유전자 염기서열 정보만으로 설계가 가능하기 때문에, 기존 저분자 화합물이나 단백질 기반 치료제들이 접근하기 어려운 ‘undruggable’ 표적(예: 비구조 단백질, 비효소 단백질 등)에 대해서도 유효하게 작용할 수 있다. 특히 단백질 생성 이전 단계인 mRNA 수준에서 병리 유전자의 발현을 차단하기 때문에, 병리 단백질의 생성 자체를 원천적으로 억제할 수 있다는 점에서 치료의 근본적 접근이 가능하다.siRNA 치료제는 일반적으로 한 번의 투여로 수 주에서 수개월간 지속적인 유전자 억제 효과를 유도할 수 있어, 만성질환 치료에서 약물 순응도 향상과 투여 횟수 감소라는 측면에서도 큰 장점을 제공한다.특히 GalNAc-siRNA 전달 플랫폼은 간세포 표면에 특이적으로 발현되는 ASGPR에 선택적으로 결합함으로써 고도의 간 특이성을 확보하면서도 피하주사가 가능하다는 점에서, 임상적 실용성과 접근성이 뛰어나다.siRNA 기반 RNAi 치료제 플랫폼의 문제점과 해결책은 무엇인가? siRNA 기반 RNAi 치료제는 유전자 발현을 정밀하게 조절할 수 있는 혁신적 플랫폼이지만 그 임상적 활용과 적용 범위를 넓히는 데에는 여전히 해결해야 할 중대한 제약이 존재한다. 이러한 한계는 약물의 물리화학적 특성, 전달 효율, 표적 조직 선택성, 면역 반응, 그리고 장기 안전성 측면에서 다양하게 나타난다.첫째, siRNA는 상대적으로 불안정한 고분자 음전하 물질로서, 체내에서 효소적 분해에 매우 취약하다. 자연 상태의 siRNA는 혈중에서 수 분 이내에 빠르게 분해되며, 조직으로 도달하기 전에 대부분 소실된다. 이러한 문제는 여러 화학적 변형을 통해 일부 개선되고 있으나, 여전히 체내 안정성과 전달 효율 간의 균형 조절은 중요한 과제로 남아 있다.둘째, siRNA는 세포막을 통과하기 어려운 물리적 특성을 가지고 있어, 전달 시스템에 대한 의존성이 매우 크다. GalNAc-siRNA 및 LNP-siRNA와 같은 플랫폼은 간세포 표적화에는 성공하였지만, 중추신경계, 심장, 폐, 근육 등 간 이외 조직으로의 선택적 전달은 여전히 기술적으로 제한적이다. 특히 혈관뇌장벽(BBB)과 같은 생리학적 장벽은 siRNA의 중추신경계 질환 치료 적용을 어렵게 하는 근본적 한계로 작용한다.셋째, siRNA는 본질적으로 면역 자극 가능성을 내포한다. siRNA 분자는 Toll-like receptor 3, 7, 8 등에 의해 인식되어 인터페론 반응 및 선천면역 경로를 활성화할 수 있으며, 이는 약물의 안전성과 내약성에 문제를 유발할 수 있다. 특히 반복 투여 시 면역 반응의 축적 또는 과민반응 발생 가능성은 장기 치료에 대한 제한 요소로 작용할 수 있다. 이러한 면역학적 문제는 화학적 안정화 및 설계 최적화를 통해 일부 완화되고 있으나, 특정 환자군에서는 여전히 우려 요소로 간주된다.넷째, siRNA 기반 RNAi는 유전자 발현을 일방적으로 억제(silencing)하는 방식이므로, 표적 유전자의 기능이 완전히 제거되는 것이 항상 바람직하지 않을 수 있다. 일부 유전자는 생리적 항상성 유지에 부분적으로 기여하므로, 과도한 억제가 예기치 않은 부작용이나 대체 경로 활성화를 유발할 수 있다. 특히 하나의 유전자가 다양한 기능을 수행하는 경우(pleiotropy), 정밀한 용량 조절과 억제 수준의 모니터링이 필수적이다.마지막으로, siRNA 기반 치료제는 아직까지 국소 투여나 ex vivo 적용이 제한적이며, 전신 투여를 기본으로 하기 때문에 조직 특이성, 투여 용량, 약물 반감기, 약물 상호작용 등에 대한 정밀한 약물동력학적 이해가 요구된다. 또한 생산 비용이 상대적으로 높고, 대규모 상업화 과정에서의 제조 일관성 및 품질 관리도 반드시 고려해야 할 요소이다.결론적으로, siRNA 기반 RNAi 치료제 플랫폼은 고유의 치료적 강점에도 불구하고, 약물 전달, 조직 선택성, 면역 자극성, 장기 안전성, 비용 구조 등 다양한 기술적 제약에 직면해 있다. 이러한 한계는 siRNA 분자 설계 기술과 전달 플랫폼, 임상 개발 전략의 지속적인 고도화를 통해 극복 가능할 것으로 보인다.다음 편부터 ① 기보시란(Givosiran) ② 루마시란(Lumasiran) ③ 인클리시란(Inclisiran) ④ 브루시란(Vutrisiran) ⑤ 네도시란(Nedosiran) ⑥ 피투시란(Fitusiran) 등의 순으로 게재될 예정이다.참고문헌 1. Giuseppe Cammarata, et al. “Emerging noncoding RNAs contained in extracellular vesicles” Ther Adv Med Oncol 2022, Vol. 14: 1–20 2. Synthesis of GalNAc-siRNA Conjugates(출처: Front. Pharmacol., 14 December 2022). 3. Lei Zhang et al. “The therapeutic prospects of N-acetylgalactosamine-siRNA conjugates“ Front. Pharmacol., 14 December 2022. 3. Vinod Khatri et al. ”Design Synthesis and Biomedical Applications of Glycotripods for Targeting Trimeric Lectins“ Eur J Org Chem Volume 26, Issue 9 March 1, 2023. 4. Katyayani Tatiparti et al. “Review siRNA Delivery Strategies: A Comprehensive Review of Recent Developments” Nanomaterials 2017, 7, 77, 5. Ogochukwu Amaeze et al. “The absorption, distribution, metabolism and elimination characteristics of small interfering RNA therapeutics and the opportunity to predict disposition in pregnant women” Drug Metabolism and Disposition 53 (2025) 100018. 6. 기타 인터넷 자료2025-07-25 06:33:37최병철 박사
차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼에 대해핵산 치료제는 구성 성분에 따라 DNA 기반 약제와 RNA 기반 약제로 구분되며, RNA 기반 약제는 안티센스 올리고뉴클레오티드(antisense oligonucleotide, ASO), 유전자 발현을 억제하는 소형 간섭 RNA(small interfering RNA, siRNA), 마이크로RNA(miRNA), 메신저 RNA(mRNA), 그리고 아프타머(aptamer) 등이 있다.이 중 siRNA는 합성된 이중가닥 RNA(double-stranded RNA, dsRNA)로서, 센스 가닥(sense strand)과 안티센스 가닥(antisense strand)으로 구성되며, 일반적으로 19~25 염기쌍의 길이를 가지고 있다. 이 중 안티센스 가닥은 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC) 내에서 특정 mRNA를 인식하고 절단하는 가이드 역할을 한다.이러한 siRNA를 기반으로 하는 RNA 간섭(RNAi) 치료제의 개발은 2000년대 초반부터 본격적으로 시작되었으며, 약 20년에 걸친 기술 축적과 전달 플랫폼의 발전을 통해 상용화 단계에 도달하였다. 2018년, 트랜스사이레틴(transthyretin, TTR) 매개 가족성 아밀로이드 다발신경병증(hATTR) 치료제 파티시란(Patisiran)이 미국 FDA로부터 최초로 승인을 받으며 siRNA 기반 치료제의 상업화가 본격화되었다.이후 다양한 GalNAc conjugate(갈낙 접합체) 기반의 siRNA 치료제들이 연이어 FDA 승인을 획득하였다. 주요 승인 약제로는 2019년 급성 간성 포르피린증(acute hepatic porphyria, AHP) 치료제 기보시란(Givosiran), 2020년 원발성 옥살산뇨증 1형(primary hyperoxaluria type 1, PH1) 치료제 루마시란(Lumasiran), 2021년 고지혈증 치료제 인클리시란(Inclisiran), 2022년 hATTR 치료제 브루시란(Vutrisiran)이 있다.또한 2023년에는 PH1 치료제로 네도시란(Nedosiran), 2025년에는 A형 및 B형 혈우병 환자(항응고 인자 억제제 보유 여부와 무관)의 예방 치료제로 피투시란(Fitusiran)이 승인되었다.이러한 siRNA 기반 RNA 간섭(RNAi) 치료제 플랫폼은 암, 바이러스 감염, 유전성 대사질환 등 다양한 질환의 병태생리를 직접 조절할 수 있는 차세대 정밀의학 전략으로 주목받고 있으며, 이는 단순한 유전자 발현 억제를 넘어, 특정 병인 단백질의 발현을 선택적으로 차단함으로써 질병의 근원을 표적하는 질병 수정형(disease-modifying) 치료제로서의 가능성을 제시하고 있다. RNA(Ribonucleic acid, 리보핵산)는 무엇인가? 핵산은 생명체의 유전 정보를 저장하고 전달하는 데 핵심적인 역할을 하며, 그중 RNA는 진핵세포와 원핵세포 모두에서 유전자 발현 및 세포 내 조절 과정에 필수적인 고분자 생체분자로서, DNA와 함께 분자생물학의 센트랄 도그마(central dogma)를 구성하는 주요 요소이다.RNA는 주로 DNA의 유전 정보를 단백질로 전달하는 전령(messenger)의 역할로 인식되어 왔으나, 다양한 연구 결과에 따라 RNA는 단순한 정보 매개체를 넘어 효소적 기능, 유전자 발현 조절, 구조적 지지, 면역 조절 인자 등 폭넓은 생물학적 기능을 수행하는 분자로 밝혀졌다. 이에 따라 RNA는 단백질과 동등하거나 그 이상으로 기능적 다양성을 지닌 핵심 생체분자로 평가되고 있다.RNA는 리보오스를 포함한 단일가닥 핵산으로 구성되며, DNA와 달리 염기로 우라실(uracil)을 포함하고, 2′-탄소 위치에 하이드록시기(2′-OH group)를 갖는 리보오스를 지닌다. 이러한 구조적 특성은 RNA에 높은 구조적 유연성과 화학적 반응성을 부여하여, 다양한 입체 구조를 형성하고 특정 단백질이나 다른 핵산과 선택적으로 결합하며, 심지어 효소적 반응을 촉매할 수 있는 생화학적 기반이 된다.실제로 RNA는 염기 서열에 의한 상보적 결합 외에도 루프(loop), 헤어핀(hairpin), 스템(stem), 벌지(bulge), 가상매듭(pseudoknot) 등 복잡한 이차 및 삼차 구조를 형성하며, 이를 통해 단백질-리간드 상호작용, 효소 활성, 핵-세포질 간 수송, 세포 내 위치 특이적 기능 수행 등에 관여한다.RNA는 유전자 발현 조절, 세포분화, 세포주기, 세포사멸, 스트레스 반응, 면역 조절 등 거의 모든 생리적·병리적 현상에 직·간접적으로 관여하며, DNA로부터 유래된 정보를 전달하는 역할외에도 전사(transcription)와 번역(translation) 간의 연결을 매개하고 유전자 발현의 정밀한 조절자로 작용한다.특히 진핵세포에서는 RNA가 전사 후 변형(post-transcriptional modification), 스플라이싱(splicing), RNA 편집(RNA editing), 핵-세포질 수송(nuclear export), 안정성 조절, 국소화(localization) 등 유전자 발현을 다양한 수준에서 정교하게 조절한다하지먼 RNA의 기능 이상은 다양한 질환의 발병과 밀접하게 연관되어 있다. 즉 RNA의 안정성 혹은 조절 기전이 교란되면 특정 단백질의 비정상적 발현이 초래되며, 이는 암, 신경퇴행성 질환, 심혈관 질환, 자가면역 질환 등 다양한 병태생리적 상태를 유발하거나 악화시킬 수 있다.최근 연구에 따르면 RNA의 구조적 변이, 염기서열 돌연변이, 또는 RNA-단백질 상호작용의 이상은 질환의 새로운 병인으로 부상하고 있으며, RNA 수준에서의 진단 및 치료 접근은 생명과학의 주요 연구 영역으로 부각되고 있다.RNA에는 어떤 종류가 있는가? RNA는 그 기능에 따라 여러 유형으로 분류된다(Figure 1). 가장 기본인 형태는 전령 RNA(messenger RNA, mRNA)로, DNA의 유전 정보를 복사하여 리보솜으로 전달하며 단백질 합성에 직접 관여한다. 전이 RNA(transfer RNA, tRNA)는 아미노산을 리보솜으로 운반하는 역할을 하며, 리보솜 RNA(ribosomal RNA, rRNA)는 리보솜의 구조적 및 촉매적 핵심 요소로 기능한다.이 외에도 최근에는 유전자 발현을 정밀하게 조절하는 비번역 RNA(non-coding RNA)들이 주목받고 있다. 예를 들어, 소간섭 RNA(small interfering RNA, siRNA), 마이크로 RNA(microRNA, miRNA), 긴 비암호화 RNA(long non-coding RNA, lncRNA) 등은 세포 내 유전자 조절 네트워크의 핵심 조절자로 작용한다. 1. mRNA(messenger RNA, 전령 RNA) mRNA가 전달하는 유전 정보는 염기의 종류, 배열, 그리고 길이에 의해 결정된다. DNA는 아데닌(A), 구아닌(G), 시토신(C), 티민(T)의 네 가지 염기로 구성되어 있는 반면, RNA는 티민 대신 우라실(U)을 포함한다. 유전 정보는 이러한 염기의 조합으로 구성되며, RNA 중 mRNA는 전사(transcription) 후 모든 처리가 완료된 형태로, 5′-cap 구조와 poly(A) tail(폴리 A 꼬리)을 갖추고 있으며, 스플라이싱(splicing)도 완료된 상태이다.mRNA는 DNA의 유전 정보를 기반으로 리보솜에서 단백질을 합성할 때 번역 서열(translation sequence)로 작용하므로, 세포 내에서 mRNA의 발현 수준을 조절하는 것은 생명 현상을 통제하는 데 매우 중요하다.성숙한 mRNA는 긴 poly(A) tail을 가지며, 이 아데닌 꼬리는 mRNA의 분해를 방지하고 안정적인 기능 수행을 돕는다. 그러나 시간이 지나면 탈아데닐화(deadenylation) 효소에 의해 이 꼬리는 점차 짧아지게 되고, 이는 mRNA 분해의 신호로 작용한다. 반면, mRNA의 말단에 혼합 꼬리(mixed tail)가 형성될 경우, 이는 아데닌 꼬리의 제거 과정을 방해하여 mRNA의 분해를 억제하고 안정성을 높이는 것으로 알려져 있다. 따라서 혼합 꼬리는 mRNA의 생존을 유지하는 데 중요한 조절 요소로 작용한다.2. ncRNA(non-coding RNA, 비암호화 RNA) 센트럴 도그마에 따르면, 단백질을 암호화하지 않는 RNA는 비암호화 RNA(non-coding RNA, ncRNA)로 분류된다. 비록 ncRNA는 단백질을 직접 생성하지는 않지만, 전사 후 조절(post-transcriptional regulation) 및 후성유전학(epigenetic) 기전에 관여하는 중요한 조절자로 밝혀지고 있다.ncRNA는 기능적 역할에 따라 크게 하우스키핑 비암호화 RNA(housekeeping ncRNA)와 조절 비암호화 RNA(regulatory ncRNA)로 나뉘며, 그 길이에 따라 다시 분류된다. 일반적으로 200개 이하의 뉴클레오타이드(nucleotide)로 구성된 경우를 작은 ncRNA(small ncRNA 또는 short/medium ncRNA)라 하고, 200개 이상의 뉴클레오타이드를 포함할 경우 긴 ncRNA(long non-coding RNA, lncRNA)로 분류된다. 이들은 기능, 전사 후 가공, 상호작용 양상 등에 따라 더욱 세분화된다.1) Housekeeping ncRNA(하우스키핑 비암호화 RNA) ① tRNA(transfer RNA, 운반 RNA) tRNA는 단백질 합성 과정에서 mRNA의 코돈(codon)에 상보적으로 결합하는 안티코돈(anticodon)을 가지고 있으며, 해당 코돈에 대응하는 아미노산을 리보솜으로 운반하는 역할을 한다. 즉, mRNA의 코돈을 해독하여 해당 아미노산을 정확히 리보솜에 전달하고, 폴리펩타이드 사슬의 신장(elongation) 과정에 기여함으로써 단백질 합성의 핵심 요소로 작용한다.tRNA는 전사된 직후 바로 기능하는 것이 아니라 pre-tRNA라는 전구체 형태로 먼저 생성된다. 이 pre-tRNA는 5′ 말단과 3′ 말단에 불필요한 염기 서열을 포함하며, 일부는 안티코돈 고리(anticodon loop)에 인트론(intron)을 포함하기도 한다. 성숙한 tRNA는 이러한 전사 후 가공 과정을 통해 구조적으로 안정화되고 생물학적 활성을 갖춘다.② rRNA(ribosomal RNA, 리보솜 RNA) rRNA는 리보솜의 핵심 구성 요소로, 다양한 리보솜 단백질과 결합하여 기능적 리보솜 복합체를 형성한다. 리보솜은 세포 내 단백질 생합성의 중심 기구이며, rRNA는 전체 세포 내 RNA의 약 80%를 차지할 정도로 풍부하게 존재한다.rRNA는 단순한 구조적 지지체에 그치지 않고, 촉매적 기능까지 수행한다. 특히, 리보솜의 대단위 서브유닛(large subunit)에 존재하는 rRNA는 펩티딜전이효소(peptidyl transferase)로 작용하여 아미노산 사이의 펩타이드 결합 형성을 촉진한다. 이는 RNA 자체가 효소 활성을 수행하는 대표적 예로, rRNA가 리보자임(ribozyme)으로 기능함을 보여준다.2) Regulatory ncRNA(조절 비암호화 RNA) 인간 유전체는 약 30억 개의 염기쌍(base pairs)으로 구성되어 있으나, 이 중 약 1% 정도만이 단백질을 암호화하는 유전자로 기능하는 것으로 오랫동안 여겨져 왔다. 이러한 전통적인 관점을 검증하고 유전체의 기능적 요소를 체계적으로 규명하기 위해 시작된 국제적 연구가 바로 ENCODE(Encyclopedia of DNA Elements) 프로젝트이다.ENCODE 프로젝트를 통해 밝혀진 핵심 사실은, 과거에 ‘쓰레기 DNA(junk DNA)’ 혹은 ‘암흑 물질(dark matter)’로 간주되었던 비암호화 영역이 실제로 생화학적 활성 및 생물학적 기능을 수행한다는 점이다. 이는 ncRNA가 단순한 유전 정보의 부산물이 아니라, 유전자 발현을 정밀하게 조절하는 중요한 조절자(regulator)로 기능할 수 있음을 의미한다.특히, 차세대 염기서열 분석기법(NGS) 등 기술의 발전으로 유전체 전체의 전사(transcription) 양상을 정밀하게 분석할 수 있게 되었고, 그 결과 유전체의 실제 전사 비율이 단 1%가 아니라 약 80%에 이른다는 사실이 밝혀졌다. 이는 유전체의 대부분이 기능적 목적을 가지고 의도적으로 전사된다는 점을 시사한다.이러한 발견은 ncRNA, 특히 조절 비암호화 RNA(regulatory ncRNA)의 중요성을 부각시켰으며, 이들은 전사 후 조절, 염색질 구조 변형, 유전자 발현 억제 및 활성화, 세포 분화, 그리고 항상성 유지 등 다양한 생명 현상에 핵심적인 역할을 수행하는 것으로 밝혀졌다.① Small ncRNA(sncRNA, 작은 비암호화 RNA) a. miRNA(microRNA, 마이크로 RNA) miRNA는 RNA 간섭(RNA interference, RNAi)과 유사한 기전을 따르는, 자연적으로 존재하는 유전자 발현 조절 메커니즘이다. 현재까지 인간에서 수백 종의 miRNA가 확인되었으며, 전체적으로는 50,000종 이상이 존재할 것으로 추정된다.miRNA는 일반적으로 약 22개의 염기로 구성된 짧은 단일가닥 RNA이며, 표적 mRNA와 부분적으로 상보적인 염기서열을 인식하여 결합한다. 이를 통해 mRNA의 번역을 억제하거나 분해를 유도함으로써 유전자 발현을 음성 조절(negative regulation)한다.miRNA는 특히 개체 발생, 세포 분화, 세포 주기 조절, 세포사멸, 암 억제 또는 촉진 등 다양한 생명현상의 조절자로 기능하며, 이의 이상 발현은 암, 심혈관 질환, 신경계 질환 등 여러 병태생리학적 상태와 밀접한 관련이 있는 것으로 알려져 있다.b. siRNA(small interfering RNA, 소간섭 RNA) siRNA는 보통 인위적으로 합성된 긴 이중가닥 RNA(dsRNA)를 세포 외부에서 도입한 후, 세포 내에서 ATP-의존성 RNase인 Dicer에 의해 절단되어 생성되는 길이 21~23 염기쌍의 짧은 dsRNA이다.siRNA는 성숙한 miRNA(mature miRNA)와 구조적으로 유사하나, 기원과 기능적 특성에서 차이를 보인다. 특히 표적 mRNA와의 염기서열 상보성에 있어서 뚜렷한 차이가 있다. siRNA는 표적 mRNA와 완전한 상보성을 이루어 정확한 표적 유전자만을 선택적으로 억제하는 반면, miRNA는 일반적으로 불완전한 상보성을 바탕으로 여러 유전자의 번역을 동시에 조절할 수 있다.이러한 차이로 인해 siRNA는 고특이적 유전자 침묵(specific gene silencing)에 적합하며, miRNA는 보다 광범위한 유전자 조절(global regulation)에 기여하는 특성을 가진다.c. snRNA(small nuclear RNA, 작은 핵 RNA) snRNA는 주로 핵 내에서 pre-mRNA의 스플라이싱(splicing)에 관여하는 짧은 RNA 분자이다. 대표적으로 U1, U2, U4, U5, U6 등의 snRNA가 스플라이스좀(spliceosome)이라는 RNA-단백질 복합체(RNP complex)를 형성하여, 인트론(intron)의 제거 및 엑손(exon)의 연결에 필수적인 역할을 수행한다.snRNA는 mRNA 성숙 과정에서 엑손-인트론 경계의 인식과 절단을 통해 유전자 발현의 정밀한 조절을 수행하는 핵심 인자로 기능한다.d. snoRNA(small nucleolar RNA, 작은 인 RNA) snoRNA는 주로 세포핵 내 핵소체(nucleolus)에 존재하는 RNA로, rRNA의 성숙 및 가공에 핵심적인 역할을 한다. snoRNA는 pre-rRNA(전구체 리보솜 RNA)와 상보적인 염기서열을 바탕으로 결합하여, 특정 위치의 염기를 화학적으로 변형하거나 절단 위치를 안내한다.snoRNA의 주요 기능은 rRNA 염기에 대해 2′-O-메틸화(2′-O-methylation) 또는 위우리딘(pseudouridine)으로의 전환을 유도한다. 이러한 변형은 rRNA의 구조적 안정성과 리보솜 기능에 매우 중요하다. 또한 snoRNA는 pre-rRNA가 정확한 위치에서 절단되도록 도와줌으로써, 최종적으로 기능을 갖춘 성숙한 rRNA의 형성에 기여한다.② long ncRNA(lncRNA, 긴 비암호화 RNA) lncRNA는 단백질을 직접 암호화하지 않지만, 포유류 전사체(transcriptome) 내에서 비교적 풍부하게 존재하며 세포 기능에 다양한 방식으로 기여한다. 특히, lncRNA는 염색질 구조 조절 효소(chromatin-modifying enzyme)를 모집하거나 그 활성을 조절함으로써, 표적 유전자의 전사 활성 조절에 관여하는 것으로 잘 알려져 있다.lncRNA의 생물학적 기능은 크게 세 가지 기전으로 요약될 수 있다. 첫째, 시스(cis) 또는 트랜스(trans) 위치에서 전사 조절자(transcriptional regulator)로 작용하여, 인접 유전자의 발현을 직접 조절하거나, 떨어진 위치에 존재하는 유전자에 영향을 미친다.둘째, RNA 가공(splicing 등) 과정이나 전사 후(post-transcriptional) 조절, 또는 단백질 활성을 조절하는 기능을 수행한다. 이 경우 lncRNA는 특정 단백질 또는 RNA와 상호작용함으로써 기능적 복합체를 형성하거나, 조절자의 기능을 매개하는 플랫폼으로 작용한다.셋째, 일부 lncRNA는 핵 내 도메인(nuclear domain)의 구조적 구성에 기여하여, 세포핵 내 공간적 조직화와 기능적 구획화를 조절하는 역할을 수행한다. 이는 핵 내 RNA-단백질 복합체 형성과 같은 고차원적인 구조적 조절과 연관된다.lncRNA는 일반적으로 조직 또는 세포 유형 특이적인 발현 양상을 보이며, 단일 세포당 평균적으로 1개 미만의 사본만 검출되는 경우가 많다. 그러나 특정 조직이나 핵의 특정 구획에서는 높은 수준으로 발현되어, 기능적 다양성과 세포 간 복잡성을 더욱 증가시키는 요인으로 작용한다.특히, lncRNA는 개체 발생, 세포 분화, 노화, 스트레스 반응 등 다양한 생리적 과정뿐 아니라, 암의 발생 및 진행과 같은 병리적 현상에서도 중요한 조절 인자로 기능함이 밝혀지면서, 분자생물학 및 암 연구 분야에서 활발한 주목을 받고 있다.RNA 침묵(RNA silencing)은 어떤 현상인가? 생명체 내에서 유전자 발현은 정교한 조절 기전에 의해 통제되며, 이러한 조절은 개체의 발생, 항상성 유지, 외부 자극에 대한 반응, 병리적 상태에서의 적응 등 다양한 생물학적 과정에 핵심적인 역할을 한다. 이 가운데 유전자 침묵(gene silencing)은 특정 유전자의 발현을 억제하거나 완전히 차단하는 생물학적 현상이다.유전자 침묵(Gene silencing)에는 전사 시 유전자 침묵(transcriptional gene silencing, TGS)와, 전사 후 유전자 침묵(post-transcriptional gene silencing, PTGS)이 존재한다. 이 중 TGS는 일반적으로 DNA 메틸화(DNA methylation), 히스톤 변형(histone modification), 이질 염색질 형성(heterochromatinization) 등의 후성유전학적 메커니즘에 의해 매개되며, 유전자 접근성을 구조적으로 차단함으로써 발현을 억제한다.RNA 침묵(RNA silencing)은 유전자 침묵의 하위 개념으로, 주로 RNA 분자에 의해 매개되는 전사 후 유전자 침묵(PTGS) 기전을 지칭한다. RNA 침묵은 1990년대 후반, 식물과 동물, 곰팡이 등 다양한 진핵생물에서 확인되었으며, 진화적으로 보존된 염기서열 특이적 유전자 조절 기전으로 기능한다.RNA 침묵의 중심에는 짧은 비암호화 RNA 분자들, 즉 siRNA, miRNA, piRNA가 있으며, 이들은 각각 고유한 기원과 작용 기전을 통해 표적 mRNA의 발현을 억제한다.miRNA는 내인성 전사체로부터 유래하며, 개체의 발달, 세포 분화, 세포 주기, 세포사멸 등 생리적 과정뿐만 아니라 암, 심혈관 질환, 신경계 질환 등의 병태생리적 상태에서 정밀한 유전자 조절자로 기능한다.siRNA는 외부에서 유래된 dsRNA에 의해 형성되며, 실험적 유전자 침묵 기법이나 RNA 간섭 기반 치료제에 직접적인 유전자 억제 도구로 활용되고 있다.piRNA는 주로 생식세포에서 발현되며, 트랜스포존 억제, 유전체 안정성 유지, 세포 계통 유지 등 특수한 기능을 수행한다.RNA 침묵은 다양한 진핵생물에서 보편적으로 나타나며, 바이러스 감염에 대한 방어 기전, 전이 요소 억제, 비정상적 전사체 제거 등 세포 수준의 품질관리 및 유전체 보호 시스템으로 작용한다. 이러한 점에서 RNA 침묵은 단순한 유전자 억제를 넘어 생물학적 균형과 유전체 기능 유지의 핵심 축으로 간주된다.최근 RNA 침묵 기전은 치료 표적 및 플랫폼 기술로도 활발히 연구되고 있으며, siRNA 기반 치료제, antisense oligonucleotide(ASO) 기술 등은 RNA 침묵 원리를 기반으로 개발된 RNA 기반 정밀 의약품으로 발전하여 다양한 질환에서 임상적으로 응용되고 있다.RNA 간섭(RNA interference, RNAi)은 어떤 현상인가? RNAi는 1998년 Andrew Fire와 Craig Mello가 예쁜꼬마선충(Caenorhabditis elegans)을 대상으로 한 실험에서 처음 보고한 현상으로, 외부에서 도입된 이중가닥 RNA(dsRNA)가 세포 내 특정 mRNA를 인식하고 이를 선택적으로 분해함으로써 유전자 발현을 억제하는 고유의 생물학적 기전이다. 이 발견은 유전자 발현 조절에 대한 이해를 근본적으로 전환시켰으며, 두 연구자는 해당 업적으로 2006년 노벨 생리의학상을 수상하였다.RNA 침묵은 유전자 발현 억제를 유도하는 상위 개념이고, 그 중 RNAi는 기전이 명확히 규명되고 약물화 가능성이 높은 대표적인 하위 경로에 해당한다. RNAi는 염기서열 특이적 방식으로 작용하여, 표적 유전자의 발현을 정밀하게 제어할 수 있는 장점을 지니며, 바이러스 방어, 전이인자 억제, 후성유전 조절, 발생 및 분화 조절 등 다양한 생물학적 과정에 기여한다.특히 RNAi는 유전자 기능 연구, 질병 모델링, 표적 유전자 억제를 통한 치료제 개발 등 기초연구 및 임상분야 모두에서 응용 가능성이 높은 기술로 주목받고 있으며, siRNA 기반 치료제는 이러한 RNAi 원리를 임상에 성공적으로 도입한 대표적인 예로 평가되고 있다.소간섭 RNA(small interefering RNA, siRNA)는 무엇인가? siRNA는 RNAi 현상을 매개하는 대표적인 dsRNA로, 특정 mRNA의 발현을 염기서열 특이적으로 억제하는 기능을 수행한다. siRNA는 miRNA와 달리 전사산물의 절단(cleavage)을 직접 유도하는 강력한 침묵 효과를 나타낸다.이는 특히 바이러스 유전체, 종양 특이 유전자, 병리적 유전자 돌연변이 등을 표적으로 하는 데 적합하다. 이러한 특이성과 효능을 바탕으로 siRNA는 유전자 기능 연구뿐 아니라 질병 치료를 위한 유전자 기반 약물 플랫폼으로 빠르게 발전하고 있다.하지만, siRNA는 그 자체의 불안정성, 세포막 투과성 부족, 면역 자극 가능성 등의 한계도 지니고 있어, 이를 극복하기 위한 다양한 전달 시스템(delivery system) 개발이 병행되고 있다. 특히, 갈낵(GalNAc) 기반 간세포 표적 전달 시스템은 siRNA 치료제의 성공적 상용화에 핵심적인 기술로 평가된다.RNAi는 외부 또는 내부에서 유래된 dsRNA에 의해 유도되며, siRNA는 RNAi 경로의 핵심 매개체로 작용한다. siRNA는 RNAi이라 불리는 다단계 과정을 통해 유전자 발현을 억제하는 데 핵심적인 역할을 한다(Figure 1). 첫 번째 단계, dsRNA의 세포 내 유입과 Dicer에 의한 절단 siRNA는 주로 외인성 또는 인공적으로 도입된 dsRNA의 절단에 의해 생성된다. 일단 dsRNA가 세포 내로 유입되면 세포질(cytoplasm)에서 작용을 시작한다. 자연 상태에서는 긴 dsRNA 또는 전구체(pre-siRNA)가 Dicer라는 RNase III 계열의 효소에 의해 절단되어 siRNA가 생성된다. 그러나 합성 siRNA는 21~23개 염기쌍의 짧은 이중가닥 RNA로 구성되며, 이미 Dicer 가공 단계를 생략한 형태로 설계되어 있다.두번째 단계, RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC) 형성과 가이드 스트랜드 선택 세포질 내에서 siRNA는 RISC와 결합하게 된다. RISC는 Argonaute(AGO) 단백질을 핵심으로 하는 다단백 복합체이며, siRNA는 이 복합체에 의해 가이드 가닥(guide strand)와 패신저 가닥(passenger strand)로 분리된다. 이 과정에서 AGO2는 패신저 가닥을 제거하거나 분해하며, 가이드 가닥만이 RISC에 안정적으로 결합된다. 가이드 가닥은 이후 표적 mRNA의 염기서열을 인식한다.세 번째 단계, mRNA 인식 및 절단(유전자 침묵 유도) 가이드 가닥이 결합된 활성화된 RISC는 세포질 내에 존재하는 상보적 염기서열을 가진 mRNA를 탐색한다. siRNA와 표적 mRNA가 완전한 상보성을 이루는 경우, AGO2의 엔도뉴클레아제 활성이 유도되어 표적 mRNA를 특정 위치에서 절단(cleavage)하게 된다. 절단된 mRNA는 이후 세포 내 핵산 분해효소에 의해 빠르게 분해되며, 이는 궁극적으로 해당 유전자의 단백질 발현 억제로 이어진다.이러한 유전자 침묵은 염기서열 특이적이며, 시간적으로 수 일에서 수 주 이상 지속될 수 있으며, 반복 투여 시 누적 효과를 기대할 수 있다. 또한, siRNA는 번역 후 단계에 작용하기 때문에, 단백질 발현을 정밀하게 조절할 수 있는 장점이 있다.RNA 기반 치료제(RNA-based therapeutics)란 무엇인가? RNA 기반 치료제는 특정 유전자 또는 병리적 단백질의 발현을 직접적으로 조절하거나, 필요한 단백질을 체내에서 직접 합성하도록 유도함으로써 질병의 원인 자체를 정밀하게 조절할 수 있는 치료 전략이다. 이러한 치료제는 RNA의 구조적 및 기능적 다양성에 따라 여러 유형으로 분류된다.대표적인 RNA 기반 치료제에는 단백질 생성을 직접 유도하는 mRNA 치료제, 특정 mRNA를 분해하거나 스플라이싱을 조절하는 ASO, RNAi 기전을 통해 유전자 발현을 억제하는 siRNA 및 miRNA 유사체, 특정 단백질에 선택적으로 결합하여 기능을 저해하는 RNA 압타머(aptamer) 등이 있다.이들 치료제는 유전자 수준의 정밀한 조절이 필요한 질환에서 특히 유효성이 크며, 암, 유전질환, 감염병, 대사질환 등 다양한 분야에서 치료 효과가 확인되고 있다.RNA 기반 치료제의 가장 큰 강점은 염기서열 상보성에 기반한 높은 표적 특이성과 설계의 유연성이다. 환자의 유전 정보나 발현 프로파일에 따라 맞춤형으로 표적을 설계할 수 있으며, 기존의 항체나 저분자 화합물로는 접근이 어려운 내재적 유전자 조절 단계에 직접 개입할 수 있다는 이점이 있다.그러나 RNA 분자의 구조적 불안정성, 면역 자극 가능성, 세포 내 전달의 어려움은 여전히 극복해야 할 중요한 과제로 남아 있다. 이를 해결하기 위해 지질 나노입자(lipid nanoparticle, LNP), 갈낙(GalNAc) 접합체, 엑소좀(exosome), 바이러스 벡터 등 다양한 전달 기술이 병행 개발되고 있으며, RNA 분자 자체에 대한 화학적 변형 연구 또한 활발히 진행 중이다.RNAi 기반 치료제(RNA interference-based therapeutics)란 무엇인가? RNAi는 짧은 dsRNA 조각이 세포 내 RNA 유도 침묵 복합체(RISC)에 의해 가이드되어, 상보적인 서열을 갖는 표적 mRNA를 절단함으로써 유전자 발현을 억제한다. 이 과정은 고도로 염기서열 특이적인 방식으로 이루어지며, 세포 내에서 자연스럽게 일어나는 중요한 방어 및 조절 기전이다.RNAi 기반 치료제는 병리적 유전자의 발현을 직접적으로 차단함으로써, 단백질 생성 자체를 근본적으로 억제할 수 있는 전략이다. 이는 기존의 단백질 표적 저해제들이 개입하기 어려운 전사 후(post-transcriptional) 단계에 개입할 수 있다는 점에서 근본적으로 다른 치료 접근법을 제공한다. 특히 유전자 과발현 또는 독성 단백질의 생성이 질병의 주요 병태기전인 경우에 매우 적합하며, 유전질환, 암, 간질환, 감염병 등 다양한 질환에서 임상적 적용이 활발히 진행되고 있다.RNAi 기반 치료제는 작용 기전에 따라 크게 세 가지로 구분된다. 첫째, siRNA는 화학적으로 합성된 짧은 dsRNA로, 표적 mRNA에 대해 높은 서열 특이성을 갖는다. GalNAc(갈낙) 기반 간 표적화 기술, 리포솜 또는 지질나노입자(LNP) 기반 세포 내 전달 기술을 활용하여 체내 적용이 가능하며, 현재 대부분의 RNAi 치료제가 이 플랫폼을 기반으로 한다.둘째, shRNA(short hairpin RNA)는 플라스미드나 바이러스 벡터를 통해 세포 내에서 안정적으로 발현되며, 지속적인 유전자 억제를 유도하는 구조이다. 주로 세포를 체외에서 조작하는 ex vivo 유전자 치료 전략에 활용된다.셋째, miRNA 유도체는 내인성 microRNA의 기능을 모방하거나 경쟁적으로 억제하여, 보다 광범위한 유전자 네트워크를 조절하는 방식으로 개발 중이다. 이는 특정 유전자뿐 아니라 관련된 다수의 유전자를 동시에 조절할 수 있는 장점이 있다.따라서 RNAi 기반 치료제는 유전자 수준에서의 정밀 제어, 고특이성, 그리고 효율적인 발현 억제라는 특성을 지니며, 기존의 저분자 화합물이나 단백질 기반 치료제와는 차별화되는 생물학적 전략을 제공한다.실제로 Givosiran, Lumasiran, Inclisiran 등은 각각 급성 간성 포르피린증(AHP), 원발성 옥살산뇨증 1형(PH1), 고지혈증 등의 적응증으로 다수 국가에서 시판 승인을 획득하였으며, 이는 RNAi 기술이 실용적인 치료 플랫폼으로 진입했음을 보여주는 중요한 이정표가 되었다.GalNAc-siRNA란 무엇인가? siRNA는 분자량이 작고 음전하를 띠는 친수성 분자로서 세포막을 자발적으로 통과하기 어려우며, 혈중에서 RNase에 의해 쉽게 분해되는 한계를 지닌다. 이러한 점에서 siRNA의 안정적이고 표적 특이적인 전달은 치료 효과를 극대화하기 위해 반드시 극복되어야 할 과제이다.이에 따라 다양한 siRNA 전달 시스템(delivery vector)이 개발되어 왔으며, GalNAc conjugate, 지질 나노입자(lipid nanoparticle, LNP), 고분자 기반 전달체 등 다양한 전달 플랫폼이 개발되고 있으며, 이들은 siRNA의 생체 내 안정성 및 조직 특이적 투과성을 개선하는 데 중요한 역할을 하고 있다.이 중 약물을 세포 표면 수용체 리간드와 결합시키는 방식(GalNAc conjugate)은 표적 약물 전달을 위한 유망한 경로로 보고되고 있다. 이러한 수용체는 특정 세포 유형에만 발현되며, 일부 질환에서는 특정 장기나 조직에서 과발현된다.3방향 GalNAc(triantennary GalNAc)은 siRNA의 안티센스(antisense) 사슬 3′ 말단과 결합하여 GalNAc-siRNA conjugate를 형성한다. siRNA는 화학적으로 직접 합성할 수 있으며, 또는 효소 전사로 얻어진 긴 이중가닥 RNA를 세포질 RNase III 엔도뉴클레아제인 Dicer의 작용으로 절단하여 21~23 nt 길이의 siRNA를 생성할 수 있다. 이 siRNA는 3′ 말단에 두 개의 돌출된 뉴클레오타이드, 5′ 말단에 인산기, 그리고 가운데에 19 nt의 상보적인 이중가닥 영역을 가진다.따라서 siRNA와 GalNAc을 결합시켜 피하 주사로 투여하면, GalNAc-siRNA conjugate가 ASGPR(Asialoglycoprotein receptor)에 결합되고, 이어 ASGPR 매개 세포 내 유입(endocytosis)을 통해 세포 내로 들어가게 된다(Figure 2).GalNAc은 간세포 이외의 조직에서는 거의 발현되지 않는 수용체에 대한 높은 결합 친화성을 가지므로, siRNA 분자의 간 특이적(targeted delivery to hepatocytes) 전달을 가능하게 한다. GalNAc-siRNA의 작용 기전은? GalNAc-siRNA의 작용 기전의 핵심은, GalNAc-siRNA conjugate가 간세포 표면의 수용체(asialoglycoprotein receptor, ASGPR)에 선택적으로 인식되고 전달된다는 점에 있다. siRNA는 본래 음전하를 띠고 분자량이 큰 친수성 분자로서, 세포막을 자발적으로 통과하기 어렵다. 하지만 GalNAc으로 변형된 siRNA는 간세포에 특이적으로 발현되는 ASGPR를 통해 표적 조직으로 선택적 전달될 수 있으며, 효율적인 세포 내 유입도 가능하게 된다.ASGPR은 간소엽(liver lobule) 내 간 실질세포(hepatocyte)의 혈관사이 공간(hepatic sinusoid space) 표면에 주로 발현되는 수용체로, GalNAc-siRNA conjugate가 체내에 주입되면 GalNAc-siRNA-ASGPR 복합체는 세포 내로 유입되어 엔도솜(endosome) 내에서 분리된다. 이후 siRNA는 엔도솜으로부터 방출되고, GalNAc은 분해되어 제거된다. ASGPR을 포함한 소포는 다시 세포막과 융합되어 간세포 표면으로 되돌아가 수용체 순환(recycling)을 마친다.엔도솜에서 방출된 siRNA는 헬리케이스(helicase)에 의해 이중가닥 구조가 풀리고, 안티센스 가닥(antisense strand)은 Ago2 단백질을 포함한 다양한 효소들과 함께 RISC를 형성한다. RISC는 표적 mRNA와 상보적인 염기서열에 결합하며, Ago2는 안티센스 가닥의 5′ 말단에서 10번째와 11번째 염기 사이의 인산다이에스터 결합(phosphodiester bond)을 절단하여 mRNA를 분해하고 유전자 발현을 억제한다(Figure 3). siRNA 기반 RNAi 치료제 플랫폼의 특장점은? RNAi은 dsRNA의 존재에 의해 유도되는 유전자 침묵 현상으로, 세포 내에서 특정 mRNA를 선택적으로 분해함으로써 유전자 발현을 전사 후 수준에서 억제하는 고도로 보존된 생물학적 기전이다. RNAi 기전의 핵심 실행 인자인 siRNA는 염기서열 상보성에 기반하여 표적 mRNA를 인식하고 절단함으로써, 병리 단백질의 발현을 효과적으로 차단할 수 있다.이러한 기전을 치료 전략에 응용한 siRNA 기반 RNAi 플랫폼은 기존의 단백질 중심 치료제와는 차별화된 분자적 기전을 바탕으로 정밀하고 지속적인 유전자 억제를 가능하게 하며, 새로운 치료 패러다임으로 주목받고 있다.siRNA 기반 플랫폼의 가장 큰 장점 중 하나는 높은 표적 특이성(target specificity)이다. siRNA는 21~23개의 염기쌍으로 구성된 짧은 dsRNA 분자로, 염기서열 상보성에 따라 특정 mRNA만을 선택적으로 인식하여 작용하므로, 오프타깃(off-target) 효과를 최소화할 수 있다. 여기에 2'-O-methyl, 2'-fluoro 등의 화학적 변형을 적용하면 분해 저항성과 면역자극 회피 능력이 향상되어, 약물의 안전성과 유효성을 동시에 확보할 수 있다.또한 siRNA는 단백질 구조 정보에 의존하지 않고 유전자 염기서열 정보만으로 설계가 가능하기 때문에, 기존 저분자 화합물이나 단백질 기반 치료제들이 접근하기 어려운 ‘undruggable’ 표적(예: 비구조 단백질, 비효소 단백질 등)에 대해서도 유효하게 작용할 수 있다. 특히 단백질 생성 이전 단계인 mRNA 수준에서 병리 유전자의 발현을 차단하기 때문에, 병리 단백질의 생성 자체를 원천적으로 억제할 수 있다는 점에서 치료의 근본적 접근이 가능하다.siRNA 치료제는 일반적으로 한 번의 투여로 수 주에서 수개월간 지속적인 유전자 억제 효과를 유도할 수 있어, 만성질환 치료에서 약물 순응도 향상과 투여 횟수 감소라는 측면에서도 큰 장점을 제공한다.특히 GalNAc-siRNA 전달 플랫폼은 간세포 표면에 특이적으로 발현되는 ASGPR에 선택적으로 결합함으로써 고도의 간 특이성을 확보하면서도 피하주사가 가능하다는 점에서, 임상적 실용성과 접근성이 뛰어나다.siRNA 기반 RNAi 치료제 플랫폼의 문제점과 해결책은 무엇인가? siRNA 기반 RNAi 치료제는 유전자 발현을 정밀하게 조절할 수 있는 혁신적 플랫폼이지만 그 임상적 활용과 적용 범위를 넓히는 데에는 여전히 해결해야 할 중대한 제약이 존재한다. 이러한 한계는 약물의 물리화학적 특성, 전달 효율, 표적 조직 선택성, 면역 반응, 그리고 장기 안전성 측면에서 다양하게 나타난다.첫째, siRNA는 상대적으로 불안정한 고분자 음전하 물질로서, 체내에서 효소적 분해에 매우 취약하다. 자연 상태의 siRNA는 혈중에서 수 분 이내에 빠르게 분해되며, 조직으로 도달하기 전에 대부분 소실된다. 이러한 문제는 여러 화학적 변형을 통해 일부 개선되고 있으나, 여전히 체내 안정성과 전달 효율 간의 균형 조절은 중요한 과제로 남아 있다.둘째, siRNA는 세포막을 통과하기 어려운 물리적 특성을 가지고 있어, 전달 시스템에 대한 의존성이 매우 크다. GalNAc-siRNA 및 LNP-siRNA와 같은 플랫폼은 간세포 표적화에는 성공하였지만, 중추신경계, 심장, 폐, 근육 등 간 이외 조직으로의 선택적 전달은 여전히 기술적으로 제한적이다. 특히 혈관뇌장벽(BBB)과 같은 생리학적 장벽은 siRNA의 중추신경계 질환 치료 적용을 어렵게 하는 근본적 한계로 작용한다.셋째, siRNA는 본질적으로 면역 자극 가능성을 내포한다. siRNA 분자는 Toll-like receptor 3, 7, 8 등에 의해 인식되어 인터페론 반응 및 선천면역 경로를 활성화할 수 있으며, 이는 약물의 안전성과 내약성에 문제를 유발할 수 있다. 특히 반복 투여 시 면역 반응의 축적 또는 과민반응 발생 가능성은 장기 치료에 대한 제한 요소로 작용할 수 있다. 이러한 면역학적 문제는 화학적 안정화 및 설계 최적화를 통해 일부 완화되고 있으나, 특정 환자군에서는 여전히 우려 요소로 간주된다.넷째, siRNA 기반 RNAi는 유전자 발현을 일방적으로 억제(silencing)하는 방식이므로, 표적 유전자의 기능이 완전히 제거되는 것이 항상 바람직하지 않을 수 있다. 일부 유전자는 생리적 항상성 유지에 부분적으로 기여하므로, 과도한 억제가 예기치 않은 부작용이나 대체 경로 활성화를 유발할 수 있다. 특히 하나의 유전자가 다양한 기능을 수행하는 경우(pleiotropy), 정밀한 용량 조절과 억제 수준의 모니터링이 필수적이다.마지막으로, siRNA 기반 치료제는 아직까지 국소 투여나 ex vivo 적용이 제한적이며, 전신 투여를 기본으로 하기 때문에 조직 특이성, 투여 용량, 약물 반감기, 약물 상호작용 등에 대한 정밀한 약물동력학적 이해가 요구된다. 또한 생산 비용이 상대적으로 높고, 대규모 상업화 과정에서의 제조 일관성 및 품질 관리도 반드시 고려해야 할 요소이다.결론적으로, siRNA 기반 RNAi 치료제 플랫폼은 고유의 치료적 강점에도 불구하고, 약물 전달, 조직 선택성, 면역 자극성, 장기 안전성, 비용 구조 등 다양한 기술적 제약에 직면해 있다. 이러한 한계는 siRNA 분자 설계 기술과 전달 플랫폼, 임상 개발 전략의 지속적인 고도화를 통해 극복 가능할 것으로 보인다.다음 편부터 ① 기보시란(Givosiran) ② 루마시란(Lumasiran) ③ 인클리시란(Inclisiran) ④ 브루시란(Vutrisiran) ⑤ 네도시란(Nedosiran) ⑥ 피투시란(Fitusiran) 등의 순으로 게재될 예정이다.참고문헌 1. Giuseppe Cammarata, et al. “Emerging noncoding RNAs contained in extracellular vesicles” Ther Adv Med Oncol 2022, Vol. 14: 1–20 2. Synthesis of GalNAc-siRNA Conjugates(출처: Front. Pharmacol., 14 December 2022). 3. Lei Zhang et al. “The therapeutic prospects of N-acetylgalactosamine-siRNA conjugates“ Front. Pharmacol., 14 December 2022. 3. Vinod Khatri et al. ”Design Synthesis and Biomedical Applications of Glycotripods for Targeting Trimeric Lectins“ Eur J Org Chem Volume 26, Issue 9 March 1, 2023. 4. Katyayani Tatiparti et al. “Review siRNA Delivery Strategies: A Comprehensive Review of Recent Developments” Nanomaterials 2017, 7, 77, 5. Ogochukwu Amaeze et al. “The absorption, distribution, metabolism and elimination characteristics of small interfering RNA therapeutics and the opportunity to predict disposition in pregnant women” Drug Metabolism and Disposition 53 (2025) 100018. 6. 기타 인터넷 자료2025-07-25 06:33:37최병철 박사 -
 신속절차 적용 폐동맥고혈압 신약 '윈레브에어' 국내 허가[데일리팜=이혜경 기자] 세계 첫 폐동맥고혈압 증상억제치료제 '윈레브에어(소타터셉트)'가 국내에서 품목허가를 받았다.식품의약품안전처는 23일 한국엠에스디의 '윈레브에어주45mg', 윈레브에어주60mg', '윈레브에어키트주45mg', '윈레브에어키트주60mg' 등 4개 품목을 허가했다.윈레브에어는 다른 폐동맥고혈압 치료와 병용해 WHO 기능분류 II-III 단계에 해당하는 성인 (18세 이상) 폐동맥고혈압(WHO Group I) 치료로 운동 능력 개선을 적응증으로 하고 있다.특히 지난해 1월 식약처로부터 희귀의약품으로 지정된 데 이어 4월에는 '글로벌 혁신제품 신속심사 지원체계(GIFT, Global Innovative products on Fast Track)'로 지정돼 신속허가 절차를 밟았왔다.올해는 '허가(식약처)-평가(심평원)-협상(건보공단) 병행 2차 시범사업' 대상으로 지정돼 허가와 동시에 급여 평가를 밟고 있다.이번에 허가가 이뤄진 만큼 빠른 단계로 급여 적용까지 이어질 것으로 보인다.윈레브에어는 2024년 3월 미국 FDA와 2024년 8월 유럽 EMA에서 '성인 폐동맥 고혈압(Pulmonary Artery Hypertensin, PAH) 환자의 운동 능력 향상, WHO 기능 등급 개선, 임상 악화 사건 위험 감소를 위한 치료제'로 승인됐다.이 약제는 재조합 'activin receptor IIA-Fc 융합 단백질(fusion protein)'로, 'activin A' 및 기타 'TGF-β 슈퍼패밀리 리간드'에 결합해 혈관 증식을 조절하도록 설계됐다.기존 PAH 치료제가 주로 혈관 이완 및 혈류 역학적 개선에 초점을 맞췄다면, 이 약제는 병적 폐혈관 리모델링과 평활근 세포 증식 억제를 통해 PAH의 근본적 병태생리를 타겟팅하는 기전을 가진다.폐동맥고혈압은 폐의 혈관이 좁아져 폐혈압을 높이는 질환으로 심장 기능 부전을 초래한다. 우리나라에서도 절반 가량의 환자들이 5년 이내 사망한다.해당 영역에는 포스포디에스테라아제-5 억제제, 엔도테린 수용체 길항제 등 10여개 약물이 승인됐지만 많은 환자들이 2~3가지 약물 병용요법에도 불구하고 심각한 증상에 시달린다.한편 STELLAR로 명명된 3상 연구에서 소타터셉트는 위약 대비 유효성이 확인됐다. 임상은 환자들을 소타터셉트와 위약군에 각각 1대 1로 배정해 유효성과 안전성을 평가하는 방식으로 진행됐다.임상 결과, 소타터셉트는 1차 평가변수로 설정한 6분 보행거리(6MWD)를 40.1m 늘렸다. 같은 기간 위약은 1.4m 감소했다.소타터셉트는 2차 평가변수인 6분 보행거리 30미터 이상 개선 등 다양한 복합 평가변수를 모두 달성한 환자는 38.9%를 기록했다. 이는 위약군 10.% 대비 네 배 가량 긴 수치였다.2025-07-23 11:22:45이혜경
신속절차 적용 폐동맥고혈압 신약 '윈레브에어' 국내 허가[데일리팜=이혜경 기자] 세계 첫 폐동맥고혈압 증상억제치료제 '윈레브에어(소타터셉트)'가 국내에서 품목허가를 받았다.식품의약품안전처는 23일 한국엠에스디의 '윈레브에어주45mg', 윈레브에어주60mg', '윈레브에어키트주45mg', '윈레브에어키트주60mg' 등 4개 품목을 허가했다.윈레브에어는 다른 폐동맥고혈압 치료와 병용해 WHO 기능분류 II-III 단계에 해당하는 성인 (18세 이상) 폐동맥고혈압(WHO Group I) 치료로 운동 능력 개선을 적응증으로 하고 있다.특히 지난해 1월 식약처로부터 희귀의약품으로 지정된 데 이어 4월에는 '글로벌 혁신제품 신속심사 지원체계(GIFT, Global Innovative products on Fast Track)'로 지정돼 신속허가 절차를 밟았왔다.올해는 '허가(식약처)-평가(심평원)-협상(건보공단) 병행 2차 시범사업' 대상으로 지정돼 허가와 동시에 급여 평가를 밟고 있다.이번에 허가가 이뤄진 만큼 빠른 단계로 급여 적용까지 이어질 것으로 보인다.윈레브에어는 2024년 3월 미국 FDA와 2024년 8월 유럽 EMA에서 '성인 폐동맥 고혈압(Pulmonary Artery Hypertensin, PAH) 환자의 운동 능력 향상, WHO 기능 등급 개선, 임상 악화 사건 위험 감소를 위한 치료제'로 승인됐다.이 약제는 재조합 'activin receptor IIA-Fc 융합 단백질(fusion protein)'로, 'activin A' 및 기타 'TGF-β 슈퍼패밀리 리간드'에 결합해 혈관 증식을 조절하도록 설계됐다.기존 PAH 치료제가 주로 혈관 이완 및 혈류 역학적 개선에 초점을 맞췄다면, 이 약제는 병적 폐혈관 리모델링과 평활근 세포 증식 억제를 통해 PAH의 근본적 병태생리를 타겟팅하는 기전을 가진다.폐동맥고혈압은 폐의 혈관이 좁아져 폐혈압을 높이는 질환으로 심장 기능 부전을 초래한다. 우리나라에서도 절반 가량의 환자들이 5년 이내 사망한다.해당 영역에는 포스포디에스테라아제-5 억제제, 엔도테린 수용체 길항제 등 10여개 약물이 승인됐지만 많은 환자들이 2~3가지 약물 병용요법에도 불구하고 심각한 증상에 시달린다.한편 STELLAR로 명명된 3상 연구에서 소타터셉트는 위약 대비 유효성이 확인됐다. 임상은 환자들을 소타터셉트와 위약군에 각각 1대 1로 배정해 유효성과 안전성을 평가하는 방식으로 진행됐다.임상 결과, 소타터셉트는 1차 평가변수로 설정한 6분 보행거리(6MWD)를 40.1m 늘렸다. 같은 기간 위약은 1.4m 감소했다.소타터셉트는 2차 평가변수인 6분 보행거리 30미터 이상 개선 등 다양한 복합 평가변수를 모두 달성한 환자는 38.9%를 기록했다. 이는 위약군 10.% 대비 네 배 가량 긴 수치였다.2025-07-23 11:22:45이혜경 -
웨이센, 베트남 중부지역 최대 병원과 AI 업무협약 체결(왼쪽부터)웨이센 김경남 대표, 후에중앙병원 팜느히엡 병원장 [데일리팜=황병우 기자] 웨이센은 지난 4일 베트남 중부 최대이자 보건부 산하 최대 의료기관인 후에중앙병원과 업무협약(MOU)을 체결했다고 7일 밝혔다.이번 협약은 웨이센의 AI 내시경 '웨이메드 엔도(WAYMED Endo)'의 베트남 전역 확산을 위한 협력의 일환으로 추진됐다.웨이센과 후에중앙병원(Hue Central Hospital)은 올해 상반기부터 웨이메드 엔도를 활용한 임상연구를 공동으로 수행하고 있으며, 실제 임상 환경에서의 AI 기술의 유효성과 적용 가능성을 검증하고 있다.1894년 설립된 후에중앙병원은 5,00병상 규모를 갖춘 베트남 중부 최대 종합병원이자, 베트남 보건부(Ministry of Health) 산하 의료기관 중 가장 큰 규모를 자랑하는 핵심 의료기관이다.교육·연구·진료를 아우르며 중부 지역 의료를 선도하고 있으며, 하루 300건 이상의 내시경 환자를 수용하는 내시경 센터를 운영하고 있다.특히 베트남 내시경 의료진을 양성하는 주요 교육기관으로서의 역할도 수행하고 있어, 이번 '웨이메드 엔도' 도입은 수련 중인 내시경 전문의들에게 AI 기반 진단 기술을 직접 접하고 학습할 수 있는 기회를 제공함으로써 교육 측면에서도 의미 있는 기여가 될 것으로 기대된다.실제 웨이메드 엔도를 활용한 임상연구 결과는 지난 4월 베트남 ‘VGEC 2025’ 학회와 6월 국내 국제소화기내시경학회(IDEN 2025)에서 각각 발표됐으며, AI 내시경의 임상적 유효성을 입증하며 현지 및 국내 전문가들의 주목을 받았다.팜느히엡(Pham Nhu Hiep) 후에중앙병원 병원장은 "후에중앙병원은 베트남 중부 지역민들의 건강을 책임지는 대표 의료 기관으로, 위·대장 내시경 스크리닝의 중요성을 깊이 인식하고 있다"며 "이번 웨이메드 엔도 도입은 우리 병원이 내시경 진단 역량을 한 단계 끌어올리는 좋은 기회가 될 것"이라고 밝혔다.김경남 웨이센 대표는 "역사와 권위를 갖춘 후에중앙병원과의 협력은 ‘웨이메드 엔도’의 임상적 신뢰도를 높이는 데 중요한 이정표"라며 "이번 협약을 바탕으로 베트남 전역으로의 도입 확대와 함께, AI 내시경을 통한 소화기 질환의 조기 진단 및 의료 접근성 향상에 기여하겠다"고 말했다.2025-07-07 10:01:38황병우
오늘의 TOP 10
- 1복지부, 1월 약가인하 4천품목 리스트 곧 사전 공개
- 2오름, 1450억 CPS 투자 유치…"TPD 임상 가속"
- 3임무 종료 위임형 제네릭 한국 철수…올메액트 허가 취하
- 4생존의 문제 '탈모'...급여 시급한 중증 원형탈모치료제
- 5위더스제약, 차세대 다중표적 알츠하이머 치료제 개발 속도
- 6'2천억 조달·해외 진출 고삐'...카티스템, 얼마나 팔렸나
- 7의협, 건보공단 특사경 반대 국회앞 1인 시위
- 8"신약 파이프라인 10배로"...정부, AI바이오 전략 발표
- 9이연제약, 130억 투자 뉴라클 신약 북미 1/2a상 완료
- 10모더나 RSV 예방백신, 식약처 신속심사 통해 허가
-
순위상품명횟수
-
1타이레놀정500mg(10정)30,426
-
2판콜에스내복액16,732
-
3텐텐츄정(10정)13,671
-
4까스활명수큐액12,867
-
5판피린큐액12,851













![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
