총 49건
-
 제품매출 90%의 고육책...한미, 이유있는 상품 판매 행보[데일리팜=천승현 기자] 한미약품이 '남의 제품' 판매에 적극적인 행보를 나타내고 있다. 자체 개발 제품의 매출 비중이 90%를 상회하며 남의 제품 판매에 소극적이었지만 최근 들어 국내제약사 신약과 바이오시밀러, 다국적제약사 신약 등 다양한 도입 의약품 판권 확보에 분주한 모습이다. 자체 개발 의약품으로 순도 높은 성장세를 지속하고 있지만 상대적으로 경쟁 업체보다 외형 확대가 더딘 한계를 극복하려는 노림수로 분석된다. 제품매출의 낮은 원가율로 높은 이익률을 거두고 있다는 점도 상품 판매에 적극성을 띠는 배경으로 지목된다. 한미약품, 지난해부터 도입 의약품 판매 본격 가세...상품매출 비중 7% 이례적 행보 8일 업계에 따르면 한미약품은 비보존제약과 비마약성 진통제 어나프라주'의 공동 프로모션 파트너사 계약을 체결했다. 양사는 300병상 이하의 의료기관을 주요 타깃으로 어나프라주의 유통, 영업 및 마케팅 전반에 대해 협업을 진행한다. 비보존제약은 어나프라주 완제품을 공급하고 한미약품은 자사의 병원 영업 네트워크를 활용해 중형병원 시장을 공략할 예정이다. 어나프라주는 2024년 12월 식품의약품안전처로부터 국산38호 신약으로 품목허가를 받은 비마약성 진통주사제다. 수술 후 중등도에서 중증의 급성 통증 조절에 사용된다. 한미약품은 최근 들어 다른 기업의 제품을 판매하려는 시도가 크게 눈에 띈다. 한미약품은 지난 6일 한독테바와 업무 협약을 체결하고 이달부터 편두통 예방 치료제 ‘아조비의 국내 유통과 판촉 활동에 돌입했다. 지난 2021년 국내 허가를 받은 아조비는 칼시토닌 유전자 관련 펩타이드(CGRP, calcitonin gene-related peptide) 리간드에 결합해 수용체와의 상호작용을 차단하는 인간화 단일클론 항체다. 국내에서 편두통 예방 적응증으로 허가된 항CGRP 단일클론항체 제제 중 유일하게 분기 1회 투여가 가능한 의약품이다. 지난 2024년 수입 실적은 336만달러 규모다. 한미약품은 지난해 3월 삼성바이오에피스와 프롤리아 바이오시밀러 국내 출시를 위한 공동 판매 협약을 체결했다. 삼성바이오에피스는 제품의 생산과 공급을 담당하고 국내 마케팅 및 영업 활동은 양사가 공동으로 맡는 내용이다. 지난해 7월 삼성바이오에피스의 프롤리아 바이오시밀러 오보덴스가 출시됐고 양사는 공동 판매를 시작했다. 암젠이 개발한 프롤리아는 뼈를 파괴하는 파골세포(osteoclast)의 활성을 억제해 골흡수를 막고 골밀도를 증가시키는 작용기전이다. 폐경 후 여성의 골 손실을 방지하고 골절 위험을 낮추며, 암 환자에서는 뼈 전이를 억제하고 골 구조를 보호해 합병증을 줄이는 역할을 한다. 한미약품은 지난해 10월 한국베링거인겔하임과 업무 협약을 맺고 만성폐쇄성폐질환(COPD) 치료제 3종의 국내 유통·판매를 시작했다. 한미약품은 베링거인겔하임이 개발한 스피리바흡입용캡슐, 스피리바레스피맷, 바헬바레스피맷 등 3종의 COPD 치료제의 국내 유통과 판촉활동을 시작했다. 한미약품이 최근 도입 의약품 판매에 나선 것은 매우 이례적인 행보다. 한미약품은 자체 개발 의약품이 실적 대부분을 차지한다. 상당수 제약기업들이 다국적제약사의 신약 판매를 늘리며 외형을 확대하는 전략을 구사하는 것과는 달리 자체 개발 의약품에 대한 의존도가 절대적이다. 지난해 3분기 한미약품의 제품매출은 3267억원으로 회사 매출 3623억원의 90.2%를 차지했다. 제품매출은 기업이 직접 생산해 물건을 판매해 얻은 매출을 말한다. 2024년 한미약품의 제품매출은 1조3779억원으로 전체 매출의 92.1%에 달했다. 한미약품은 지난해 1분기와 2분기에도 제품매출이 전체 매출의 90%를 상회했다. 한미약품은 로수젯 등 자체개발 복합신약을 중심으로 실적을 채우고 있다. 의약품 조사기관 유비스트에 따르면 고지혈증복합제 로수젯은 작년 3분기 외래 처방금액 589억원을 기록하며 전체 의약품 중 선두에 올랐다. 로수젯은 로수바스타틴과 에제티미브 2개 성분으로 구성된 고지혈증 복합제다. 로수젯은 2024년 1분기 국내 개발 의약품 중 처음으로 외래 처방시장 전체 선두에 올랐고 7분기 연속 1위 자리를 수성했다. 아모잘탄, 아모잘탄플러스, 아모잘탄큐, 아잘탄엑스큐 등 아모잘탄패밀리도 한미약품의 실적 버팀목 역할을 한다. 아모잘탄은 암로디핀과 로사르탄 성분이 결합된 복합제다. 아모잘탄플러스는 고혈압 치료제로 사용되는 암로디핀, 로사르탄, 클로르탈리돈 등 3개의 약물이 결합된 복합제다. 아모잘탄큐는 아모잘탄에 고지혈증치료제 로수바스타틴을 추가한 복합제다. 아모잘탄엑스큐는 아모잘탄에 로수바스타틴, 에제티미브를 결합한 제품이다. 한미약품은 지난 2018년 처음으로 처방실적 선두에 오른 이후 2024까지 7년 연속 1위에 이름을 올렸다. 한미약품의 작년 3분기 누적 처방액은 7569억원으로 2위 종근당과의 격차를 1772억원으로 벌리며 8년 연속 선두를 예약한 상태다. 이에 반해 한미약품의 상품매출 비중은 매우 미미한 수준이다. 상품매출은 재고자산을 구입해 가공하지 않고 일정 이윤만 붙여 판매되는 매출 형태를 말한다. 지난해 3분기 한미약품의 상품매출은 258억원으로 전체 매출의 7.1%에 불과했다. 한미약품은 지난 2020년 4분기 상품매출 비중이 10.1%를 기록한 이후 5년 동안 단 한번도 10%를 넘은 적이 없다. 2024년 한미약품의 상품매출은 961억원으로 전체 매출의 6.4%에 불과했다. 한미약품은 과거 셀트리온제약의 간장약 고덱스, 노바티스의 당뇨치료제 가브스 등을 공동 판매한 경험이 있다. 하지만 공동판매를 종료한 이후 최근까지 자체 개발 제품 판매에 주력했다. 도입 의약품 판매로 외형 확장...낮은 원가율로 상품매출 가세 부담↓ 한미약품이 최근 상품매출 판매를 적극적으로 시도하는 배경은 외형 확장이다. 자체 개발을 중심으로 영업 활동을 집중하는 특성상 도입 의약품을 많이 활용하는 경쟁 업체에 비해 매출 성장세가 더디다는 한계를 극복하려는 전략이다. 지난해 3분기 한미약품의 매출은 3623억원으로 전년동기대비 0.1% 증가했다. 2022년 3분기 3421억원에서 3년 동안 5.9% 증가하는데 그쳤다. 유한양행, 녹십자, 종근당, 대웅제약 등 주요 대형제약사 중 매출 성장률이 가장 낮은 수준이다. 유한양행은 2022년 3분기 매출 4315억원에서 작년 3분기 5700억원으로 3년 동안 32.1% 증가했다. 같은 기간 녹십자의 매출은 4597억원에서 6095억원으로 32.6% 늘었다. 종근당의 작년 3분기 매출은 4298억원으로 3년 전보다 19.9% 늘었고 대웅제약은 3319억원에서 4118억원으로 24.1% 증가했다. 한미약품은 높은 제품매출을 기반으로 고순도 실적을 나타낸다는 점도 상품매출 장착에 부담이 작다는 요소로 작용한다. 지난해 3분기 한미약품의 매출원가율은 43.3%로 유한양행(70.4%)과 녹십자(76.1%)보다 월등히 낮은 수준이다. 종근당과 대웅제약의 작년 3분기 매출원가율은 각각 68.3%, 48.0%로 한미약품보다 높다. 한미약품은 2010년 출범 이후 매출원가율이 단 한번도 50%를 넘은 적이 없다. 한미약품의 높은 제품매출 의존도가 원가구조 개선의 비결이다. 상대적으로 다른 업체로부터 사들이는 상품매출의 경우 원가율이 제품매출에 비해 크게 높을 수 밖에 없다. 작년 3분기 한미약품 제품매출의 원가율은 40.8%로 상품매출 원가율 86.1%의 절반에도 못 미친다. ㅎ한미약품은 2022년부터 분기별 제품매출 원가율이 단 한 번도 45%를 넘지 못했다. 상품매출의 경우 2023년 4분기와 2024년 4분기에 원가율이 90%를 넘을 정도로 수익성이 좋지 않다. 한미약품의 높은 제품매출 비중이 전체 매출원가를 억제하는데 기여한 셈이다. 자체개발 의약품의 높은 비중은 원가율을 떨어뜨리면서 수익성 개선 효과로 이어졌다. 지난해 3분기 한미약품의 매출 대비 영업이익률은 15.2%로 대형 전통제약사 중 가장 높은 수준이다. 지난해 3분기 대웅제약이 영업이익률 13.8%를 기록했고 종근당, 녹십자, 유한양행 등은 5%에도 못 미쳤다. 한미약품은 상품매출 증가로 영업이익률이 다소 낮아질 수 있다. 하지만 다른 제약사보다 월등한 원가율을 고려하면 도입 의약품 장착하더라도 수익성이 급격이 나빠지지 않는다는 판단을 한 것으로 분석된다. 새로운 제품을 도입하면서 기존 판매 제품과 파생되는 시너지도 기대하는 모습이다. 한미약품은 삼성바이오에피스의 오보덴스 공동판매에 돌입하면서 “골다공증 경구제 시장을 선도하는 라본디의 국내 영업·마케팅 경험을 통해 오보덴스는 다양한 골다공증 환자에서 근거 중심적인 선택지가 될 수 있을 것”이라고 내다봤다. 한미약품은 편두통치료제 아조비의 유통·판매 업무협약 체결 배경에 대해 “신경계 분야의 치료제 포트폴리오를 확장하고 국내 시장에 글로벌 혁신 신약을 안정적으로 공급하기 위해 추진됐다”라고 소개했다.2026-01-08 06:00:58천승현 기자
제품매출 90%의 고육책...한미, 이유있는 상품 판매 행보[데일리팜=천승현 기자] 한미약품이 '남의 제품' 판매에 적극적인 행보를 나타내고 있다. 자체 개발 제품의 매출 비중이 90%를 상회하며 남의 제품 판매에 소극적이었지만 최근 들어 국내제약사 신약과 바이오시밀러, 다국적제약사 신약 등 다양한 도입 의약품 판권 확보에 분주한 모습이다. 자체 개발 의약품으로 순도 높은 성장세를 지속하고 있지만 상대적으로 경쟁 업체보다 외형 확대가 더딘 한계를 극복하려는 노림수로 분석된다. 제품매출의 낮은 원가율로 높은 이익률을 거두고 있다는 점도 상품 판매에 적극성을 띠는 배경으로 지목된다. 한미약품, 지난해부터 도입 의약품 판매 본격 가세...상품매출 비중 7% 이례적 행보 8일 업계에 따르면 한미약품은 비보존제약과 비마약성 진통제 어나프라주'의 공동 프로모션 파트너사 계약을 체결했다. 양사는 300병상 이하의 의료기관을 주요 타깃으로 어나프라주의 유통, 영업 및 마케팅 전반에 대해 협업을 진행한다. 비보존제약은 어나프라주 완제품을 공급하고 한미약품은 자사의 병원 영업 네트워크를 활용해 중형병원 시장을 공략할 예정이다. 어나프라주는 2024년 12월 식품의약품안전처로부터 국산38호 신약으로 품목허가를 받은 비마약성 진통주사제다. 수술 후 중등도에서 중증의 급성 통증 조절에 사용된다. 한미약품은 최근 들어 다른 기업의 제품을 판매하려는 시도가 크게 눈에 띈다. 한미약품은 지난 6일 한독테바와 업무 협약을 체결하고 이달부터 편두통 예방 치료제 ‘아조비의 국내 유통과 판촉 활동에 돌입했다. 지난 2021년 국내 허가를 받은 아조비는 칼시토닌 유전자 관련 펩타이드(CGRP, calcitonin gene-related peptide) 리간드에 결합해 수용체와의 상호작용을 차단하는 인간화 단일클론 항체다. 국내에서 편두통 예방 적응증으로 허가된 항CGRP 단일클론항체 제제 중 유일하게 분기 1회 투여가 가능한 의약품이다. 지난 2024년 수입 실적은 336만달러 규모다. 한미약품은 지난해 3월 삼성바이오에피스와 프롤리아 바이오시밀러 국내 출시를 위한 공동 판매 협약을 체결했다. 삼성바이오에피스는 제품의 생산과 공급을 담당하고 국내 마케팅 및 영업 활동은 양사가 공동으로 맡는 내용이다. 지난해 7월 삼성바이오에피스의 프롤리아 바이오시밀러 오보덴스가 출시됐고 양사는 공동 판매를 시작했다. 암젠이 개발한 프롤리아는 뼈를 파괴하는 파골세포(osteoclast)의 활성을 억제해 골흡수를 막고 골밀도를 증가시키는 작용기전이다. 폐경 후 여성의 골 손실을 방지하고 골절 위험을 낮추며, 암 환자에서는 뼈 전이를 억제하고 골 구조를 보호해 합병증을 줄이는 역할을 한다. 한미약품은 지난해 10월 한국베링거인겔하임과 업무 협약을 맺고 만성폐쇄성폐질환(COPD) 치료제 3종의 국내 유통·판매를 시작했다. 한미약품은 베링거인겔하임이 개발한 스피리바흡입용캡슐, 스피리바레스피맷, 바헬바레스피맷 등 3종의 COPD 치료제의 국내 유통과 판촉활동을 시작했다. 한미약품이 최근 도입 의약품 판매에 나선 것은 매우 이례적인 행보다. 한미약품은 자체 개발 의약품이 실적 대부분을 차지한다. 상당수 제약기업들이 다국적제약사의 신약 판매를 늘리며 외형을 확대하는 전략을 구사하는 것과는 달리 자체 개발 의약품에 대한 의존도가 절대적이다. 지난해 3분기 한미약품의 제품매출은 3267억원으로 회사 매출 3623억원의 90.2%를 차지했다. 제품매출은 기업이 직접 생산해 물건을 판매해 얻은 매출을 말한다. 2024년 한미약품의 제품매출은 1조3779억원으로 전체 매출의 92.1%에 달했다. 한미약품은 지난해 1분기와 2분기에도 제품매출이 전체 매출의 90%를 상회했다. 한미약품은 로수젯 등 자체개발 복합신약을 중심으로 실적을 채우고 있다. 의약품 조사기관 유비스트에 따르면 고지혈증복합제 로수젯은 작년 3분기 외래 처방금액 589억원을 기록하며 전체 의약품 중 선두에 올랐다. 로수젯은 로수바스타틴과 에제티미브 2개 성분으로 구성된 고지혈증 복합제다. 로수젯은 2024년 1분기 국내 개발 의약품 중 처음으로 외래 처방시장 전체 선두에 올랐고 7분기 연속 1위 자리를 수성했다. 아모잘탄, 아모잘탄플러스, 아모잘탄큐, 아잘탄엑스큐 등 아모잘탄패밀리도 한미약품의 실적 버팀목 역할을 한다. 아모잘탄은 암로디핀과 로사르탄 성분이 결합된 복합제다. 아모잘탄플러스는 고혈압 치료제로 사용되는 암로디핀, 로사르탄, 클로르탈리돈 등 3개의 약물이 결합된 복합제다. 아모잘탄큐는 아모잘탄에 고지혈증치료제 로수바스타틴을 추가한 복합제다. 아모잘탄엑스큐는 아모잘탄에 로수바스타틴, 에제티미브를 결합한 제품이다. 한미약품은 지난 2018년 처음으로 처방실적 선두에 오른 이후 2024까지 7년 연속 1위에 이름을 올렸다. 한미약품의 작년 3분기 누적 처방액은 7569억원으로 2위 종근당과의 격차를 1772억원으로 벌리며 8년 연속 선두를 예약한 상태다. 이에 반해 한미약품의 상품매출 비중은 매우 미미한 수준이다. 상품매출은 재고자산을 구입해 가공하지 않고 일정 이윤만 붙여 판매되는 매출 형태를 말한다. 지난해 3분기 한미약품의 상품매출은 258억원으로 전체 매출의 7.1%에 불과했다. 한미약품은 지난 2020년 4분기 상품매출 비중이 10.1%를 기록한 이후 5년 동안 단 한번도 10%를 넘은 적이 없다. 2024년 한미약품의 상품매출은 961억원으로 전체 매출의 6.4%에 불과했다. 한미약품은 과거 셀트리온제약의 간장약 고덱스, 노바티스의 당뇨치료제 가브스 등을 공동 판매한 경험이 있다. 하지만 공동판매를 종료한 이후 최근까지 자체 개발 제품 판매에 주력했다. 도입 의약품 판매로 외형 확장...낮은 원가율로 상품매출 가세 부담↓ 한미약품이 최근 상품매출 판매를 적극적으로 시도하는 배경은 외형 확장이다. 자체 개발을 중심으로 영업 활동을 집중하는 특성상 도입 의약품을 많이 활용하는 경쟁 업체에 비해 매출 성장세가 더디다는 한계를 극복하려는 전략이다. 지난해 3분기 한미약품의 매출은 3623억원으로 전년동기대비 0.1% 증가했다. 2022년 3분기 3421억원에서 3년 동안 5.9% 증가하는데 그쳤다. 유한양행, 녹십자, 종근당, 대웅제약 등 주요 대형제약사 중 매출 성장률이 가장 낮은 수준이다. 유한양행은 2022년 3분기 매출 4315억원에서 작년 3분기 5700억원으로 3년 동안 32.1% 증가했다. 같은 기간 녹십자의 매출은 4597억원에서 6095억원으로 32.6% 늘었다. 종근당의 작년 3분기 매출은 4298억원으로 3년 전보다 19.9% 늘었고 대웅제약은 3319억원에서 4118억원으로 24.1% 증가했다. 한미약품은 높은 제품매출을 기반으로 고순도 실적을 나타낸다는 점도 상품매출 장착에 부담이 작다는 요소로 작용한다. 지난해 3분기 한미약품의 매출원가율은 43.3%로 유한양행(70.4%)과 녹십자(76.1%)보다 월등히 낮은 수준이다. 종근당과 대웅제약의 작년 3분기 매출원가율은 각각 68.3%, 48.0%로 한미약품보다 높다. 한미약품은 2010년 출범 이후 매출원가율이 단 한번도 50%를 넘은 적이 없다. 한미약품의 높은 제품매출 의존도가 원가구조 개선의 비결이다. 상대적으로 다른 업체로부터 사들이는 상품매출의 경우 원가율이 제품매출에 비해 크게 높을 수 밖에 없다. 작년 3분기 한미약품 제품매출의 원가율은 40.8%로 상품매출 원가율 86.1%의 절반에도 못 미친다. ㅎ한미약품은 2022년부터 분기별 제품매출 원가율이 단 한 번도 45%를 넘지 못했다. 상품매출의 경우 2023년 4분기와 2024년 4분기에 원가율이 90%를 넘을 정도로 수익성이 좋지 않다. 한미약품의 높은 제품매출 비중이 전체 매출원가를 억제하는데 기여한 셈이다. 자체개발 의약품의 높은 비중은 원가율을 떨어뜨리면서 수익성 개선 효과로 이어졌다. 지난해 3분기 한미약품의 매출 대비 영업이익률은 15.2%로 대형 전통제약사 중 가장 높은 수준이다. 지난해 3분기 대웅제약이 영업이익률 13.8%를 기록했고 종근당, 녹십자, 유한양행 등은 5%에도 못 미쳤다. 한미약품은 상품매출 증가로 영업이익률이 다소 낮아질 수 있다. 하지만 다른 제약사보다 월등한 원가율을 고려하면 도입 의약품 장착하더라도 수익성이 급격이 나빠지지 않는다는 판단을 한 것으로 분석된다. 새로운 제품을 도입하면서 기존 판매 제품과 파생되는 시너지도 기대하는 모습이다. 한미약품은 삼성바이오에피스의 오보덴스 공동판매에 돌입하면서 “골다공증 경구제 시장을 선도하는 라본디의 국내 영업·마케팅 경험을 통해 오보덴스는 다양한 골다공증 환자에서 근거 중심적인 선택지가 될 수 있을 것”이라고 내다봤다. 한미약품은 편두통치료제 아조비의 유통·판매 업무협약 체결 배경에 대해 “신경계 분야의 치료제 포트폴리오를 확장하고 국내 시장에 글로벌 혁신 신약을 안정적으로 공급하기 위해 추진됐다”라고 소개했다.2026-01-08 06:00:58천승현 기자 -
한미약품, 한독테바 편두통 예방 약 '아조비' 유통·판매[데일리팜=천승현 기자] 한미약품은 한독테바의 편두통 예방 치료제 ‘아조비’를 국내에 유통·판매한다고 6일 밝혔다. 한미약품은 한독테바와 업무 협약을 체결하고 이달부터 아조비프리필드시린지주와 아조비오토인젝터주의 국내 유통과 판촉 활동에 돌입했다. 이번 협약은 한미약품이 신경계 분야의 치료제 포트폴리오를 확장하고 국내 시장에 글로벌 혁신 신약을 안정적으로 공급하기 위해 추진됐다. 아조비는 칼시토닌 유전자 관련 펩타이드(CGRP, calcitonin gene-related peptide) 리간드에 결합해 수용체와의 상호작용을 차단하는 인간화 단일클론 항체다. 국내에서 편두통 예방 적응증으로 허가된 항CGRP 단일클론항체 제제 중 유일하게 분기 1회 투여가 가능한 의약품으로 2021년 7월 식품의약품안전처의 허가를 획득했다. 편두통은 중등도 이상의 통증으로 인해 일상생활에 지장을 초래하는 신경계 질환으로 효과적이고 지속적인 예방 치료 옵션에 대한 의료현장의 수요가 높다. 한미약품과 한독테바는 이번 협약을 통해 신경계 치료 분야에서 견고한 파트너십을 구축하고 글로벌 수준의 혁신 치료제를 국내 환자들에게 보다 신속하고 안정적으로 제공해 나갈 계획이다. 박재현 한미약품 대표는 “한독테바와의 협력을 통해 국내 편두통 환자들이 보다 효과적인 치료 혜택을 누릴 수 있을 것으로 기대한다”며 “한미약품은 지속적인 글로벌 파트너십을 바탕으로 환자 중심의 치료 가치를 확장하겠다”라고 말했다.2026-01-06 11:28:42천승현 기자
-
 올해 의약품 특허 등재 10% 증가...다국적사↑· 국내사↓[데일리팜=김진구 기자] 올해 신규로 등재된 제약바이오 특허는 총 264건으로, 전년대비 10% 증가한 것으로 나타났다. 다국적제약사 한국법인과 국내제약사가 대조적인 모습을 보였다. 다국적사의 경우 신규 등재 특허가 1년 새 187건에서 215건으로 늘었다. 한국화이자제약이 코로나 백신 코미나티 관련 특허를 대거 등재했다. 반면 국내제약사의 경우 작년 54건에서 올해 49건으로 감소했다. 한미약품과 종근당, 대웅제약, 제일약품이 5건 이상 특허를 신규 등재했다. 올해 신규 특허 264건…5건 중 4건은 다국적사 등재 26일 식품의약품안전처에 따르면 올해 들어 특허목록집에 신규 등재된 특허는 264건이다. 지난해 241건 대비 10% 증가했다. 올해가 아직 닷새가량 남은 점을 감안하면 이미 지난해의 신규 특허 등재건수를 뛰어넘은 상태다. 최근 10년 가운데 2022년을 제외하고 특허 등재가 가장 활발했다. 2022년의 경우 코로나 팬데믹의 영향으로 신약과 약물재창출 연구개발이 활발하게 전개됐고, 이 과정에서 278건의 특허가 신규 등재된 바 있다. 전반적으로 다국적제약사 한국법인의 특허 등재가 증가한 반면, 국내제약사는 저조한 경향을 보였다. 올해 등재된 특허 중 81%인 215건은 다국적제약사 한국법인이 특허권 등재자로 이름을 올렸다. 총 31개 다국적사가 신규로 특허를 1건 이상 등재했으며, 총 등재건수는 작년 187건 대비 15% 증가했다. 국내제약사는 17개 업체가 총 49건의 특허를 등재했다. 이들이 등재한 특허는 49건으로 지난해 54건 대비 9% 감소했다. 최근 10년 가운데 세 번째로 등재건수가 적다. 화이자 ‘코미나티’·릴리 ‘마운자로’ 특허 등재 집중 다국적사 중 특허를 가장 많이 등재한 업체는 한국화이자제약이다. 올해만 49건의 특허를 신규로 등재했다. 화이자는 코로나 백신 코미나티 특허 등재에 집중했다. 올해만 코미나티 관련 특허 36건이 신규 등재됐다. 화이자는 지난해도 코미나티 특허 13건을 등재한 바 있다. 이와 함께 올해는 차세대 폐렴구균 백신 프리베나20 관련 특허 8건을 추가로 등재했다. 프리베나20은 기존 폐렴구균 백신 프리베나13의 후속 제품이다. 예방 혈청형이 13개에서 20개로 늘었다. 이밖에 편두통 치료제 너텍 특허 3건과 전립선암 치료제 탈제나, 코로나 치료제 팍스로비드 특허 각 1건을 등재했다. 이어 한국릴리가 18건의 특허를 등재했다. 릴리는 GLP-1 계열 비만·당뇨 특허 등재에 주력했다. 올해 발매한 비만 치료제 마운자로 관련 특허 12건과 당뇨 치료제 트루리시티 특허 4건을 등재했다. 중증 건선 치료제 탈츠 관련 특허도 1건 등재했다. 알보젠코리아는 지속형 치매치료 패취제 애드라리티 특허 14건을 포함해 총 17건을 신규로 등재했다. 한국로슈도 유방암 표적치료제 이토베비 특허 6건과 척수성 근위축증(SMA) 치료제 에브리스디, 허셉틴+퍼제타 피하주사 제형 페스코 특허 각 4건 등 17건을 등재했다. 이밖에 한국아스텔라스제약과 한국얀센 각 13건, 한국애브비가 12건, 한국MSD 8건, 레코르다티코리아·한독테바 각 7건, 한국BMS제약·한국노바티스 각 6건 등의 순으로 나타났다. 국내제약, 자사 간판제품 후속 특허 등재 잇달아…한미>종근당>대웅·제일 순 국내제약사 가운데선 한미약품과 종근당, 대웅제약, 제일약품의 특허 등재가 두드러졌다. 한미약품은 올해 7건의 특허를 신규 등재했다. 시타글립틴·다파글리플로진 성분 당뇨병 복합제 실다파 관련 특허 2건과 시타글립틴·다파글리플로진·메트포르민 당뇨병 3제 복합제 관련 특허 3건, 케토프로펜 성분 소염진통제 루마겔 특허 1건, 구강붕해서방정 제형 탐스로신 성분 전립선비대증 치료제 한미탐스오디 1건 등이다. 이어 종근당이 칸데사르탄·암로디핀·아토르바스타틴 조합의 고혈압·고지혈증 복합제 칸타벨에이 관련 특허 5건을 비롯해 총 6건의 특허를 등재했다. 대웅제약은 자체개발 신약 펙수클루 관련 특허 5건을 등재했다. 제일약품은 세팔로스포린 계열 항생제 페트로자 특허 3건과 전이성 대장암·위암 치료제 론서프 특허 2건을 각각 등재했다. 페트로자는 일본 시오노기제약이 개발한 세파 계열 항생제로, 다제내성균에 효과를 보인다. 제일약품은 이 제품을 국내 도입, 올해 2월 품목허가를 받고 6월 특허를 등재했다. 이밖에 JW중외제약과 태준제약이 각 4건, 삼오제약·한국유나이티드제약 각 3건, HK이노엔·듀켐바이오 각 2건을 등재했다. LG화학과 비보존제약, 사이넥스, 신풍제약, 한국코러스, 한국팜비오, 한독, 현대약품은 각 1건씩 등재했다.2025-12-26 06:00:57김진구 기자
올해 의약품 특허 등재 10% 증가...다국적사↑· 국내사↓[데일리팜=김진구 기자] 올해 신규로 등재된 제약바이오 특허는 총 264건으로, 전년대비 10% 증가한 것으로 나타났다. 다국적제약사 한국법인과 국내제약사가 대조적인 모습을 보였다. 다국적사의 경우 신규 등재 특허가 1년 새 187건에서 215건으로 늘었다. 한국화이자제약이 코로나 백신 코미나티 관련 특허를 대거 등재했다. 반면 국내제약사의 경우 작년 54건에서 올해 49건으로 감소했다. 한미약품과 종근당, 대웅제약, 제일약품이 5건 이상 특허를 신규 등재했다. 올해 신규 특허 264건…5건 중 4건은 다국적사 등재 26일 식품의약품안전처에 따르면 올해 들어 특허목록집에 신규 등재된 특허는 264건이다. 지난해 241건 대비 10% 증가했다. 올해가 아직 닷새가량 남은 점을 감안하면 이미 지난해의 신규 특허 등재건수를 뛰어넘은 상태다. 최근 10년 가운데 2022년을 제외하고 특허 등재가 가장 활발했다. 2022년의 경우 코로나 팬데믹의 영향으로 신약과 약물재창출 연구개발이 활발하게 전개됐고, 이 과정에서 278건의 특허가 신규 등재된 바 있다. 전반적으로 다국적제약사 한국법인의 특허 등재가 증가한 반면, 국내제약사는 저조한 경향을 보였다. 올해 등재된 특허 중 81%인 215건은 다국적제약사 한국법인이 특허권 등재자로 이름을 올렸다. 총 31개 다국적사가 신규로 특허를 1건 이상 등재했으며, 총 등재건수는 작년 187건 대비 15% 증가했다. 국내제약사는 17개 업체가 총 49건의 특허를 등재했다. 이들이 등재한 특허는 49건으로 지난해 54건 대비 9% 감소했다. 최근 10년 가운데 세 번째로 등재건수가 적다. 화이자 ‘코미나티’·릴리 ‘마운자로’ 특허 등재 집중 다국적사 중 특허를 가장 많이 등재한 업체는 한국화이자제약이다. 올해만 49건의 특허를 신규로 등재했다. 화이자는 코로나 백신 코미나티 특허 등재에 집중했다. 올해만 코미나티 관련 특허 36건이 신규 등재됐다. 화이자는 지난해도 코미나티 특허 13건을 등재한 바 있다. 이와 함께 올해는 차세대 폐렴구균 백신 프리베나20 관련 특허 8건을 추가로 등재했다. 프리베나20은 기존 폐렴구균 백신 프리베나13의 후속 제품이다. 예방 혈청형이 13개에서 20개로 늘었다. 이밖에 편두통 치료제 너텍 특허 3건과 전립선암 치료제 탈제나, 코로나 치료제 팍스로비드 특허 각 1건을 등재했다. 이어 한국릴리가 18건의 특허를 등재했다. 릴리는 GLP-1 계열 비만·당뇨 특허 등재에 주력했다. 올해 발매한 비만 치료제 마운자로 관련 특허 12건과 당뇨 치료제 트루리시티 특허 4건을 등재했다. 중증 건선 치료제 탈츠 관련 특허도 1건 등재했다. 알보젠코리아는 지속형 치매치료 패취제 애드라리티 특허 14건을 포함해 총 17건을 신규로 등재했다. 한국로슈도 유방암 표적치료제 이토베비 특허 6건과 척수성 근위축증(SMA) 치료제 에브리스디, 허셉틴+퍼제타 피하주사 제형 페스코 특허 각 4건 등 17건을 등재했다. 이밖에 한국아스텔라스제약과 한국얀센 각 13건, 한국애브비가 12건, 한국MSD 8건, 레코르다티코리아·한독테바 각 7건, 한국BMS제약·한국노바티스 각 6건 등의 순으로 나타났다. 국내제약, 자사 간판제품 후속 특허 등재 잇달아…한미>종근당>대웅·제일 순 국내제약사 가운데선 한미약품과 종근당, 대웅제약, 제일약품의 특허 등재가 두드러졌다. 한미약품은 올해 7건의 특허를 신규 등재했다. 시타글립틴·다파글리플로진 성분 당뇨병 복합제 실다파 관련 특허 2건과 시타글립틴·다파글리플로진·메트포르민 당뇨병 3제 복합제 관련 특허 3건, 케토프로펜 성분 소염진통제 루마겔 특허 1건, 구강붕해서방정 제형 탐스로신 성분 전립선비대증 치료제 한미탐스오디 1건 등이다. 이어 종근당이 칸데사르탄·암로디핀·아토르바스타틴 조합의 고혈압·고지혈증 복합제 칸타벨에이 관련 특허 5건을 비롯해 총 6건의 특허를 등재했다. 대웅제약은 자체개발 신약 펙수클루 관련 특허 5건을 등재했다. 제일약품은 세팔로스포린 계열 항생제 페트로자 특허 3건과 전이성 대장암·위암 치료제 론서프 특허 2건을 각각 등재했다. 페트로자는 일본 시오노기제약이 개발한 세파 계열 항생제로, 다제내성균에 효과를 보인다. 제일약품은 이 제품을 국내 도입, 올해 2월 품목허가를 받고 6월 특허를 등재했다. 이밖에 JW중외제약과 태준제약이 각 4건, 삼오제약·한국유나이티드제약 각 3건, HK이노엔·듀켐바이오 각 2건을 등재했다. LG화학과 비보존제약, 사이넥스, 신풍제약, 한국코러스, 한국팜비오, 한독, 현대약품은 각 1건씩 등재했다.2025-12-26 06:00:57김진구 기자 -
 토시닙정 54.3% 최대 인하폭…애엽제제 74품목 14%↓[데일리팜=강혜경 기자]내년 1월부터 애엽제제 74개 품목이 14%대 인하된다. 애엽제제 가운데 넥스탈정(넥스팜코리아), 네오렌정(원광제약) 등 2개 품목은 급여가 삭제된다. 도네페질제제 100개 품목도 최대 10% 낮아진다. 약가변동 품목은 총 4064품목으로, 신규등재와 급여삭제 등을 제외한 3974품목의 약가가 인하된다. 데일리팜이 약국청구소프트웨어업체 이팜에 공개된 사전 약가변동 품목을 분석한 결과 내년 1월 약가인하 대상 품목에 애엽제제와 도네페질제제가 상당수 포함된 것으로 확인됐다. 애엽제제의 경우 급여재평가 이슈로 약가가 인하된다. 투여경로를 보면 내복이 2268품목으로 가장 많고, 주사 1475품목, 외용 320품목, 기타 1품목 순이다. 급여삭제 품목은 38품목이다. 토시닙정 54.3% 인하폭 최대 가장 큰 인하폭을 보인 품목은 SK케미칼의 면역질환치료제 '토시닙정'(토파시티닙)으로, 7697원에서 3515원으로 54.3% 인하된다. 명문제약 칼슘결핍치료제 '마이칼큐정'(시트르산칼슘수화물, 콜레칼시페롤농축물, 시아노코발라민, 폴산)은 178원에서 95원으로 46.6% 인하된다. SK케미칼 편두통치료제 '미가드정'(프로바트립탄숙신산염일수화물)은 3425원에서 2397원으로 30.0%, 명문제약 '마이칼디'(구연산칼슘, 콜레칼시페롤과립, 시나오코발라민, 폴산)는 89원에서 70원으로 21.3% 인하된다. 위염치료제로 사용되는 애엽제제 76개 품목 가운데 동아ST 스티렌 등 74개 품목은 14%대 가격이 인하되는데, 스티렌은 111원에서 95원으로 14.4% 내려간다. 넥스팜코리아 넥스탈정과 원광제약 네오렌정은 급여가 삭제된다. 치매치료제로 주로 처방되는 도네페질제제도 100개 품목이 약가인하 대상이 되는데, 조아제약 오넵트정5mg이 1377원에서 1239원으로 10.0% 인하돼 가장 큰 인하율을 보인다. 한독 아리셉트정10mg은 245원에서 234원으로 0.5% 인하된다. 1원 인하 763개 품목…5원 이내 인하 39.1% 사전 공개 리스트를 보면 5원 이내 인하 품목이 39.1%로 상당수를 차지하는 것으로 확인됐다. 데일리팜이 자체 분석한 바에 따르면 1원 인하 품목이 763개 품목으로 19.2%를 차지한다. 인하 대상 품목 5개 중 1개 꼴이다. 2원 인하는 343개 품목, 3원 202개 품목, 4원 149개 품목, 5원 97개 품목을 보였다. 한편 보건복지부는 현장의 혼란을 최소화하고자 1월 1일자로 시행되는 약가인하 품목에 한해 서류상 반품을 한시적으로 인정한다고 밝혔다. 적용기간은 1월 1일부터 2월 28일까지 2개월이다. 대한약사회는 17일 "약가인하 대상 품목과 최종 고시 내용은 확정되는 대로 추가 안내할 예정"이라며 "회원 약국에서는 청구프로그램 업데이트와 사전 점검을 통해 혼선을 최소화해 달라"고 당부했다.2025-12-19 06:00:59강혜경 기자
토시닙정 54.3% 최대 인하폭…애엽제제 74품목 14%↓[데일리팜=강혜경 기자]내년 1월부터 애엽제제 74개 품목이 14%대 인하된다. 애엽제제 가운데 넥스탈정(넥스팜코리아), 네오렌정(원광제약) 등 2개 품목은 급여가 삭제된다. 도네페질제제 100개 품목도 최대 10% 낮아진다. 약가변동 품목은 총 4064품목으로, 신규등재와 급여삭제 등을 제외한 3974품목의 약가가 인하된다. 데일리팜이 약국청구소프트웨어업체 이팜에 공개된 사전 약가변동 품목을 분석한 결과 내년 1월 약가인하 대상 품목에 애엽제제와 도네페질제제가 상당수 포함된 것으로 확인됐다. 애엽제제의 경우 급여재평가 이슈로 약가가 인하된다. 투여경로를 보면 내복이 2268품목으로 가장 많고, 주사 1475품목, 외용 320품목, 기타 1품목 순이다. 급여삭제 품목은 38품목이다. 토시닙정 54.3% 인하폭 최대 가장 큰 인하폭을 보인 품목은 SK케미칼의 면역질환치료제 '토시닙정'(토파시티닙)으로, 7697원에서 3515원으로 54.3% 인하된다. 명문제약 칼슘결핍치료제 '마이칼큐정'(시트르산칼슘수화물, 콜레칼시페롤농축물, 시아노코발라민, 폴산)은 178원에서 95원으로 46.6% 인하된다. SK케미칼 편두통치료제 '미가드정'(프로바트립탄숙신산염일수화물)은 3425원에서 2397원으로 30.0%, 명문제약 '마이칼디'(구연산칼슘, 콜레칼시페롤과립, 시나오코발라민, 폴산)는 89원에서 70원으로 21.3% 인하된다. 위염치료제로 사용되는 애엽제제 76개 품목 가운데 동아ST 스티렌 등 74개 품목은 14%대 가격이 인하되는데, 스티렌은 111원에서 95원으로 14.4% 내려간다. 넥스팜코리아 넥스탈정과 원광제약 네오렌정은 급여가 삭제된다. 치매치료제로 주로 처방되는 도네페질제제도 100개 품목이 약가인하 대상이 되는데, 조아제약 오넵트정5mg이 1377원에서 1239원으로 10.0% 인하돼 가장 큰 인하율을 보인다. 한독 아리셉트정10mg은 245원에서 234원으로 0.5% 인하된다. 1원 인하 763개 품목…5원 이내 인하 39.1% 사전 공개 리스트를 보면 5원 이내 인하 품목이 39.1%로 상당수를 차지하는 것으로 확인됐다. 데일리팜이 자체 분석한 바에 따르면 1원 인하 품목이 763개 품목으로 19.2%를 차지한다. 인하 대상 품목 5개 중 1개 꼴이다. 2원 인하는 343개 품목, 3원 202개 품목, 4원 149개 품목, 5원 97개 품목을 보였다. 한편 보건복지부는 현장의 혼란을 최소화하고자 1월 1일자로 시행되는 약가인하 품목에 한해 서류상 반품을 한시적으로 인정한다고 밝혔다. 적용기간은 1월 1일부터 2월 28일까지 2개월이다. 대한약사회는 17일 "약가인하 대상 품목과 최종 고시 내용은 확정되는 대로 추가 안내할 예정"이라며 "회원 약국에서는 청구프로그램 업데이트와 사전 점검을 통해 혼선을 최소화해 달라"고 당부했다.2025-12-19 06:00:59강혜경 기자 -
 아일리아 시밀러 3파전...제형 확대·저가 등재 전략[데일리팜=정흥준 기자]12월에는 산정대상 약제 79개, 신약 3개가 급여목록에 새롭게 등재됐다. 이달 황반병성치료제 아일리아(Eylea)의 바이오시밀러가 추가 등재하며 삼성바이오에피스-셀트리온-삼천당제약의 3파전 구도가 만들어졌다. 또 28개 제약사가 비타민D·칼슘 복합제를 등재하면서 골다공증치료제의 필수 보조요법 시장 공략에 나선다. 급여 적용 전체 약제는 2만1757개로 전월 대비 72개 증가했다. 이외에도 제네릭 급여 등재에 따라 당뇨병치료제 자디앙(엠파글리플로진)과 류마티스관절염치료제 젤잔즈(토파시티닙시트르산염)의 상한액이 이달 인하됐다. 삼천당제약 비젠프리 저가 등재...아일리아 바이오시밀러 경쟁 심화 삼천당제약은 이달 아일리아 바이오시밀러 비젠프리주사(11.12mg/0.278mL)와 비젠프리프리필드시린지(6.6mg/0.165mL)를 급여 등재했다. 두 약제 모두 19만8000원의 상한액으로 등재했다. 후발주자지만 저가 공략에 나서면서 경쟁력을 확보했다. 동일 성분 약제인 삼성바이오에피스 아필리부주40mg 29만8000원, 셀트리온 아이덴젤트 33만원과 비교해 월등히 저렴한 가격이다. 오리지널인 바이엘코리아 아일리아 상한액이 49만61168원인 것을 고려하면 약 40% 수준의 가격이다. 새로운 바이오시밀러의 급여 진입으로 3개 국내사의 경쟁이 심화될 전망이다. 지난 11월 셀트리온은 아이덴젤트주사에 이어 아이덴젤트프리필드시린지를 등재하며 제형을 확대한 바 있다. 가장 먼저 아필리부를 등재한 삼성바이오에피스에 이어 셀트리온과 삼천당제약이 바짝 뒤를 쫓는 모습이다. 국내 아일리아 시장은 1000억 규모로 추산하고 있다. 본격적으로 국내사들의 점유율 확대 경쟁이 심화될 전망이다. 비타민D·칼슘 복합제 28개 품목, 프롤리아 시밀러 등재 영향 비타민D·칼슘 복합제 28개 품목이 이달 무더기로 급여 등재됐다. 급여 일반약으로 골다공증치료제의 보조요법 시장을 타깃으로 한 제품 출시로 풀이된다. 올해 암젠의 골다공증치료제 프롤리아(데노수맙) 바이오시밀러가 잇달아 국내 출시하고 있다. 3월에는 셀트리온이 바이오시밀러인 ‘스토보클로’, 7월에는 삼성바이오에피스가 ‘오보덴스’를 출시했다. 데노수맙 주사제를 맞는 환자는 칼슘 1000mg과 비타민D 400IU를 매일 복용해야 한다. 아이큐비아에 따르면 프롤리아 작년 국내 판매액은 1749억원이다. 28개 제약사는 데노수맙 투약 환자에 동반 처방을 공략할 것으로 보인다. 아이월드제약의 칼디쓰리에프정이 95원으로 가장 높은 상한액을 받았다. 한미약품의 칼엠디정, 종근당의 애드칼큐정 등 나머지 제품은 대부분 88원이 책정됐다. 프롤리아와 프롤리아 시밀러 판권을 보유한 한미약품, 종근당 등의 제약사들도 시너지 효과를 기대하며 복합제 제품을 급여 등재했다. 명인제약, 미가드정 퍼스트제네릭 '프로트립탄정' 명인제약이 SK케미칼의 편두통 치료제 미가드정의 퍼스트 제네릭 ‘프로트립탄정’을 급여 등재했다. 중추신경계(CNS)에서 강한 면모를 보이는 명인제약은 편두통 관련 약제로 '수마트란(수마트립탄숙신산염)', '토파메이트(토피라메이트)', '폭센(나프록센나트륨)' 등을 보유하고 있다. 프로트립탄정까지 급여 등재하며 라인업을 강화했다. 경쟁 상대가 없었던 프로바트립탄 성분 편두통 치료제 시장을 놓고 SK케미칼과 명인제약이 맞붙는다. 미가드정 단일 제품의 매출액은 작년 25억원으로 크지 않지만, 급성기 편두통 치료제 시장은 약 230억 규모로 추산하고 있다. 명인제약과 SK케미칼뿐만 아니라 트립탄 계열 편두통 약제를 보유한 대웅바이오, 유유제약, 한화제약 등이 경쟁을 벌인다. 유한양행 고혈압 저용량 3제 복합제 '트루셋정 20/2.5/6.25' 고혈압 초기 치료 시장을 타깃한 유한양행의 고혈압 3제 복합제 ‘트루셋정 20/2.5/6.25(텔미사르탄, 암로디핀, 클로르탈리돈)’이 급여 목록에 이름을 올렸다. 기존 등재 용량인 트루셋정과 비교했을 때 모든 성분의 용량을 절반씩 줄인 제품이다. 저용량 3제 복합제까지 라인업을 늘리며 초기 환자 공략에 집중할 것으로 보인다. 올해 고혈압 치료제에서 저용량 복합제 경쟁이 심화되고 있다. 한미약품은 올해 6월 ‘아모프렐정 1.67/16.67/4.17(암로디핀, 로사르탄, 클로르탈리돈)’을 허가받았고 8월 급여 진입했다. 종근당은 이달 고혈압 2제 복합제 텔미누보 20/1.25(텔미사르탄 에스암로디핀) 저용량 제품을 급여 등재했다. 3개 제약사 모두 고용량 복합제 라인업을 이미 갖추고 있다. 저용량 복합제로 초기 치료 시장에서 점유율 확대에 나설 전망이다. 지속적 복용과 증량 등 고혈압 치료 특성에 따라 초기 환자 공략이 모든 용량의 점유율 제고에 중요한 영향을 미칠 것으로 보인다. JW중외, 고혈압·고지혈증 3제 복합제 '리바로하이정' JW중외의 ‘리바로하이정’ 6개 제품이 나란히 급여 등재됐다. 리바로하이정은 고지혈증 치료제인 리바로의 피타바스타틴칼슘수화물과 고혈압치료제 성분인 발사르탄, 암로디핀이 결합된 고혈압-고지혈증 3제 복합제다. 하루 1정으로 암로디핀·발사르탄 복합제와 피타바스타틴을 동시에 투여해야 하는 환자에 사용할 수 있다. 이번에 등재되는 용량은 리바로하이정(피타바스타틴칼슘수화물, 발사르탄, 암로디핀베실산염) 4/160/10, 4/160/5, 4/80/5, 2/160/10, 2/160/5, 2/80/5 등 6개다. 상한액은 1549원~ 1885원이다. JW중외는 피타바스타틴, 발사르탄 2제 복합제인 ‘리바로브이정’에 이어 3제 리베로하이정까지 잇달아 급여를 받게 됐다. 기등재된 리바로패밀리 연 매출만 약 2000억원에 달하기 때문에 3제 복합제를 추가하며 매출 상승세를 이어간다는 계획이다.2025-12-15 06:00:56정흥준 기자
아일리아 시밀러 3파전...제형 확대·저가 등재 전략[데일리팜=정흥준 기자]12월에는 산정대상 약제 79개, 신약 3개가 급여목록에 새롭게 등재됐다. 이달 황반병성치료제 아일리아(Eylea)의 바이오시밀러가 추가 등재하며 삼성바이오에피스-셀트리온-삼천당제약의 3파전 구도가 만들어졌다. 또 28개 제약사가 비타민D·칼슘 복합제를 등재하면서 골다공증치료제의 필수 보조요법 시장 공략에 나선다. 급여 적용 전체 약제는 2만1757개로 전월 대비 72개 증가했다. 이외에도 제네릭 급여 등재에 따라 당뇨병치료제 자디앙(엠파글리플로진)과 류마티스관절염치료제 젤잔즈(토파시티닙시트르산염)의 상한액이 이달 인하됐다. 삼천당제약 비젠프리 저가 등재...아일리아 바이오시밀러 경쟁 심화 삼천당제약은 이달 아일리아 바이오시밀러 비젠프리주사(11.12mg/0.278mL)와 비젠프리프리필드시린지(6.6mg/0.165mL)를 급여 등재했다. 두 약제 모두 19만8000원의 상한액으로 등재했다. 후발주자지만 저가 공략에 나서면서 경쟁력을 확보했다. 동일 성분 약제인 삼성바이오에피스 아필리부주40mg 29만8000원, 셀트리온 아이덴젤트 33만원과 비교해 월등히 저렴한 가격이다. 오리지널인 바이엘코리아 아일리아 상한액이 49만61168원인 것을 고려하면 약 40% 수준의 가격이다. 새로운 바이오시밀러의 급여 진입으로 3개 국내사의 경쟁이 심화될 전망이다. 지난 11월 셀트리온은 아이덴젤트주사에 이어 아이덴젤트프리필드시린지를 등재하며 제형을 확대한 바 있다. 가장 먼저 아필리부를 등재한 삼성바이오에피스에 이어 셀트리온과 삼천당제약이 바짝 뒤를 쫓는 모습이다. 국내 아일리아 시장은 1000억 규모로 추산하고 있다. 본격적으로 국내사들의 점유율 확대 경쟁이 심화될 전망이다. 비타민D·칼슘 복합제 28개 품목, 프롤리아 시밀러 등재 영향 비타민D·칼슘 복합제 28개 품목이 이달 무더기로 급여 등재됐다. 급여 일반약으로 골다공증치료제의 보조요법 시장을 타깃으로 한 제품 출시로 풀이된다. 올해 암젠의 골다공증치료제 프롤리아(데노수맙) 바이오시밀러가 잇달아 국내 출시하고 있다. 3월에는 셀트리온이 바이오시밀러인 ‘스토보클로’, 7월에는 삼성바이오에피스가 ‘오보덴스’를 출시했다. 데노수맙 주사제를 맞는 환자는 칼슘 1000mg과 비타민D 400IU를 매일 복용해야 한다. 아이큐비아에 따르면 프롤리아 작년 국내 판매액은 1749억원이다. 28개 제약사는 데노수맙 투약 환자에 동반 처방을 공략할 것으로 보인다. 아이월드제약의 칼디쓰리에프정이 95원으로 가장 높은 상한액을 받았다. 한미약품의 칼엠디정, 종근당의 애드칼큐정 등 나머지 제품은 대부분 88원이 책정됐다. 프롤리아와 프롤리아 시밀러 판권을 보유한 한미약품, 종근당 등의 제약사들도 시너지 효과를 기대하며 복합제 제품을 급여 등재했다. 명인제약, 미가드정 퍼스트제네릭 '프로트립탄정' 명인제약이 SK케미칼의 편두통 치료제 미가드정의 퍼스트 제네릭 ‘프로트립탄정’을 급여 등재했다. 중추신경계(CNS)에서 강한 면모를 보이는 명인제약은 편두통 관련 약제로 '수마트란(수마트립탄숙신산염)', '토파메이트(토피라메이트)', '폭센(나프록센나트륨)' 등을 보유하고 있다. 프로트립탄정까지 급여 등재하며 라인업을 강화했다. 경쟁 상대가 없었던 프로바트립탄 성분 편두통 치료제 시장을 놓고 SK케미칼과 명인제약이 맞붙는다. 미가드정 단일 제품의 매출액은 작년 25억원으로 크지 않지만, 급성기 편두통 치료제 시장은 약 230억 규모로 추산하고 있다. 명인제약과 SK케미칼뿐만 아니라 트립탄 계열 편두통 약제를 보유한 대웅바이오, 유유제약, 한화제약 등이 경쟁을 벌인다. 유한양행 고혈압 저용량 3제 복합제 '트루셋정 20/2.5/6.25' 고혈압 초기 치료 시장을 타깃한 유한양행의 고혈압 3제 복합제 ‘트루셋정 20/2.5/6.25(텔미사르탄, 암로디핀, 클로르탈리돈)’이 급여 목록에 이름을 올렸다. 기존 등재 용량인 트루셋정과 비교했을 때 모든 성분의 용량을 절반씩 줄인 제품이다. 저용량 3제 복합제까지 라인업을 늘리며 초기 환자 공략에 집중할 것으로 보인다. 올해 고혈압 치료제에서 저용량 복합제 경쟁이 심화되고 있다. 한미약품은 올해 6월 ‘아모프렐정 1.67/16.67/4.17(암로디핀, 로사르탄, 클로르탈리돈)’을 허가받았고 8월 급여 진입했다. 종근당은 이달 고혈압 2제 복합제 텔미누보 20/1.25(텔미사르탄 에스암로디핀) 저용량 제품을 급여 등재했다. 3개 제약사 모두 고용량 복합제 라인업을 이미 갖추고 있다. 저용량 복합제로 초기 치료 시장에서 점유율 확대에 나설 전망이다. 지속적 복용과 증량 등 고혈압 치료 특성에 따라 초기 환자 공략이 모든 용량의 점유율 제고에 중요한 영향을 미칠 것으로 보인다. JW중외, 고혈압·고지혈증 3제 복합제 '리바로하이정' JW중외의 ‘리바로하이정’ 6개 제품이 나란히 급여 등재됐다. 리바로하이정은 고지혈증 치료제인 리바로의 피타바스타틴칼슘수화물과 고혈압치료제 성분인 발사르탄, 암로디핀이 결합된 고혈압-고지혈증 3제 복합제다. 하루 1정으로 암로디핀·발사르탄 복합제와 피타바스타틴을 동시에 투여해야 하는 환자에 사용할 수 있다. 이번에 등재되는 용량은 리바로하이정(피타바스타틴칼슘수화물, 발사르탄, 암로디핀베실산염) 4/160/10, 4/160/5, 4/80/5, 2/160/10, 2/160/5, 2/80/5 등 6개다. 상한액은 1549원~ 1885원이다. JW중외는 피타바스타틴, 발사르탄 2제 복합제인 ‘리바로브이정’에 이어 3제 리베로하이정까지 잇달아 급여를 받게 됐다. 기등재된 리바로패밀리 연 매출만 약 2000억원에 달하기 때문에 3제 복합제를 추가하며 매출 상승세를 이어간다는 계획이다.2025-12-15 06:00:56정흥준 기자 -
 미가드정 첫 제네릭 '프로트립탄정' 등재...편두통 시장 경쟁SK케미칼의 편두통 치료제 미가드정의 퍼스트 제네릭인 명인제약의 프로트립탄정이 내달 급여 등재돼 본격적인 경쟁에 나선다. 명인제약은 이미 등재된 수마트란(수마트립탄숙신산염), 토파메이트(토피라메이트) 등과 함께 편두통 시장에서 더욱 경쟁력을 갖추게 됐다. 28일 업계에 따르면, 명인제약의 프로트립탄정2.5mg(프로바트립탄숙신산염일수화물)이 내달 급여 등재된다. 퍼스트 제네릭으로 59.5% 가산을 받아 상한액은 2038원이다. 명인제약은 지난해 국내사 중 처음으로 미가드정 제네릭 출시를 위해 생물학적 동등성 시험을 진행한 바 있다. 올해 6월에는 첫 제네릭 허가를 받았다. 미가드정은 지난 2009년 국내 허가를 획득한 프로바트립탄 성분의 편두통 치료제다. 전조증상을 수반하거나 수반하지 않는 편두통의 급성치료에 사용되고 있다. 의약품 시장조사기관 유비스트에 따르면 미가드정의 작년 매출은 약 25억원이었다. 전년 대비 16% 매출 상승을 보였다. 경쟁 상대가 없었던 프로바트립탄 성분 편두통 치료제 시장을 놓고 SK케미칼과 명인제약이 맞붙는다. 미가드정 매출만 보면 경쟁해야 할 시장 규모가 크지 않을 수 있지만, 수마트립탄 등 다른 트립탄 계열 성분까지 고려하면 시장이 작지 않다. 급성기 편두통 치료제 시장으로 보면 약 230억 규모로 추산하고 있다. 수마트립탄, 나라트립탄 등 유사 트리탄 계열 성분의 편두통 약제는 유유제약, 대웅바이오, 한화제약, 이연제약 등 다수의 제약사가 품목을 보유하고 있다. 중추신경계(CNS)에서 강한 면모를 보이는 명인제약도 편두통 관련 약제로 '수마트란(수마트립탄숙신산염)', '토파메이트(토피라메이트)', '폭센(나프록센나트륨)' 등에 이어 프로트립탄정까지 급여 등재하며 라인업을 확장했다. 경쟁사로 볼 수 있는 SK케미칼도 미가드정 외에 수마트립탄 성분에 신경 염증을 억제하는 나프로센을 결합시킨 ‘수벡스정’을 작년 출시했다. 또 작년 10월에는 졸미트립탄 오리지널 조믹정까지 아스트라제네카로부터 양도양수 받으면서 탄탄한 편두통 라인업을 갖추고 있다.2025-11-28 06:00:19정흥준 기자
미가드정 첫 제네릭 '프로트립탄정' 등재...편두통 시장 경쟁SK케미칼의 편두통 치료제 미가드정의 퍼스트 제네릭인 명인제약의 프로트립탄정이 내달 급여 등재돼 본격적인 경쟁에 나선다. 명인제약은 이미 등재된 수마트란(수마트립탄숙신산염), 토파메이트(토피라메이트) 등과 함께 편두통 시장에서 더욱 경쟁력을 갖추게 됐다. 28일 업계에 따르면, 명인제약의 프로트립탄정2.5mg(프로바트립탄숙신산염일수화물)이 내달 급여 등재된다. 퍼스트 제네릭으로 59.5% 가산을 받아 상한액은 2038원이다. 명인제약은 지난해 국내사 중 처음으로 미가드정 제네릭 출시를 위해 생물학적 동등성 시험을 진행한 바 있다. 올해 6월에는 첫 제네릭 허가를 받았다. 미가드정은 지난 2009년 국내 허가를 획득한 프로바트립탄 성분의 편두통 치료제다. 전조증상을 수반하거나 수반하지 않는 편두통의 급성치료에 사용되고 있다. 의약품 시장조사기관 유비스트에 따르면 미가드정의 작년 매출은 약 25억원이었다. 전년 대비 16% 매출 상승을 보였다. 경쟁 상대가 없었던 프로바트립탄 성분 편두통 치료제 시장을 놓고 SK케미칼과 명인제약이 맞붙는다. 미가드정 매출만 보면 경쟁해야 할 시장 규모가 크지 않을 수 있지만, 수마트립탄 등 다른 트립탄 계열 성분까지 고려하면 시장이 작지 않다. 급성기 편두통 치료제 시장으로 보면 약 230억 규모로 추산하고 있다. 수마트립탄, 나라트립탄 등 유사 트리탄 계열 성분의 편두통 약제는 유유제약, 대웅바이오, 한화제약, 이연제약 등 다수의 제약사가 품목을 보유하고 있다. 중추신경계(CNS)에서 강한 면모를 보이는 명인제약도 편두통 관련 약제로 '수마트란(수마트립탄숙신산염)', '토파메이트(토피라메이트)', '폭센(나프록센나트륨)' 등에 이어 프로트립탄정까지 급여 등재하며 라인업을 확장했다. 경쟁사로 볼 수 있는 SK케미칼도 미가드정 외에 수마트립탄 성분에 신경 염증을 억제하는 나프로센을 결합시킨 ‘수벡스정’을 작년 출시했다. 또 작년 10월에는 졸미트립탄 오리지널 조믹정까지 아스트라제네카로부터 양도양수 받으면서 탄탄한 편두통 라인업을 갖추고 있다.2025-11-28 06:00:19정흥준 기자 -
 YS생명과학, 와이에스알파 품목허가..."전주기 국산화"[데일리팜=김진구 기자] YS생명과학은 최근 식품의약품안전처로부터 ‘와이에스알파정 1.0마이크로그램(알파칼시돌)’의 품목허가를 획득했다고 10일 밝혔다. 이 제품은 국내 최초의 알파칼시돌 성분 1.0ug 정제형 제제다. 와이에스알파정은 활성형 비타민D 전구체인 '알파칼시돌'을 주성분으로 하며, 간에서 활성형 비타민D인 칼시트리올(calcitriol)로 전환돼 칼슘과 인의 흡수를 돕고 뼈 형성을 촉진한다. 이 데품은 만성 신부전, 부갑상선기능저하증, 비타민D 저항성 구루병, 골연화증, 골다공증 등에서 저칼슘혈증 및 뼈 통증 개선에 효과가 있다. 고함량 정제 제형으로 개발돼 복용 횟수를 줄이고 순응도를 높였으며, 연질캡슐 대비 삼킴 부담이 적어 고령층 환자의 복용 편의성도 향상됐다. 알파칼시돌은 간에서 활성형으로 대사되기 때문에 신기능이 저하된 환자에게도 안정적으로 작용해 일반 비타민D 제제보다 만성 신부전(CKD) 및 투석 환자에게 임상적 이점이 크다. YS생명과학은 자체 합성한 국산 원료를 활용, 원료의약품(API) 합성부터 완제 생산까지 전 과정을 국내 기술로 수행했다고 설명했다. 비타민D와 같은 고활성원료 함유 고형제제의 경우 연질캡슐로 제제 안정화를 구현하는 것이 일반적이지만, YS생명과학은 제제화 과정이 까다로운 정제 형태로 개발하는 데 성공했다. YS생명과학은 비타민D 유도체 시장에서 수입 원료 의존도를 낮추고, 품질 관리와 공급망 안정성 측면에도 기여할 것으로 기대했다. 회사는 이어 0.5마이크로그램 함량의 제품도 추가 출시할 계획이다. YS생명과학 관계자는 “정제형 알파칼시돌 제제화는 제형 안정성과 정밀 합성 기술이 동시에 요구되는 고난도 프로젝트로, 해외에서도 사례가 많지 않다”며 “이번 성과는 YS생명과학이 원료 중심 기업에서 완제의약품 전문기업으로 도약하는 전환점이 될 것”이라고 말했다. 또한 “와이에스알파정은 단순한 제네릭이 아닌, 원료부터 완제까지 전 과정을 국내 기술로 완성한 제품”이라며 “지난 25년여 동안 특정효능군 원료의약품 산업에서 획득한 글로벌 인지도와 이번 성과를 기반으로 완제의약품 시장 진출 본격화와 글로벌 시장 확대에 속도를 낼 것”이라고 덧붙였다. YS생명과학은 기술 중심 연구개발과 글로벌 시장 진출, 수직통합 전략을 기반으로 고난이도 원료의약품(API) 합성과 수출을 기반으로 성장해 왔으며, 최근에는 완제의약품 개발·생산까지 사업 영역을 확대하고 있다. 원료의약품으로는 프로스타글란딘 계열, Vitamine D류, 항암제, 편두통치료제, 당뇨병치료제 원료 등이 핵심이며, 완제의약품으로는 비타민 D류, 녹내장치료제, 위장관치료제, 혈액순환개선제, 당뇨병치료제 등 차별화된 제품을 제제화하고 있다.2025-11-10 11:05:56김진구
YS생명과학, 와이에스알파 품목허가..."전주기 국산화"[데일리팜=김진구 기자] YS생명과학은 최근 식품의약품안전처로부터 ‘와이에스알파정 1.0마이크로그램(알파칼시돌)’의 품목허가를 획득했다고 10일 밝혔다. 이 제품은 국내 최초의 알파칼시돌 성분 1.0ug 정제형 제제다. 와이에스알파정은 활성형 비타민D 전구체인 '알파칼시돌'을 주성분으로 하며, 간에서 활성형 비타민D인 칼시트리올(calcitriol)로 전환돼 칼슘과 인의 흡수를 돕고 뼈 형성을 촉진한다. 이 데품은 만성 신부전, 부갑상선기능저하증, 비타민D 저항성 구루병, 골연화증, 골다공증 등에서 저칼슘혈증 및 뼈 통증 개선에 효과가 있다. 고함량 정제 제형으로 개발돼 복용 횟수를 줄이고 순응도를 높였으며, 연질캡슐 대비 삼킴 부담이 적어 고령층 환자의 복용 편의성도 향상됐다. 알파칼시돌은 간에서 활성형으로 대사되기 때문에 신기능이 저하된 환자에게도 안정적으로 작용해 일반 비타민D 제제보다 만성 신부전(CKD) 및 투석 환자에게 임상적 이점이 크다. YS생명과학은 자체 합성한 국산 원료를 활용, 원료의약품(API) 합성부터 완제 생산까지 전 과정을 국내 기술로 수행했다고 설명했다. 비타민D와 같은 고활성원료 함유 고형제제의 경우 연질캡슐로 제제 안정화를 구현하는 것이 일반적이지만, YS생명과학은 제제화 과정이 까다로운 정제 형태로 개발하는 데 성공했다. YS생명과학은 비타민D 유도체 시장에서 수입 원료 의존도를 낮추고, 품질 관리와 공급망 안정성 측면에도 기여할 것으로 기대했다. 회사는 이어 0.5마이크로그램 함량의 제품도 추가 출시할 계획이다. YS생명과학 관계자는 “정제형 알파칼시돌 제제화는 제형 안정성과 정밀 합성 기술이 동시에 요구되는 고난도 프로젝트로, 해외에서도 사례가 많지 않다”며 “이번 성과는 YS생명과학이 원료 중심 기업에서 완제의약품 전문기업으로 도약하는 전환점이 될 것”이라고 말했다. 또한 “와이에스알파정은 단순한 제네릭이 아닌, 원료부터 완제까지 전 과정을 국내 기술로 완성한 제품”이라며 “지난 25년여 동안 특정효능군 원료의약품 산업에서 획득한 글로벌 인지도와 이번 성과를 기반으로 완제의약품 시장 진출 본격화와 글로벌 시장 확대에 속도를 낼 것”이라고 덧붙였다. YS생명과학은 기술 중심 연구개발과 글로벌 시장 진출, 수직통합 전략을 기반으로 고난이도 원료의약품(API) 합성과 수출을 기반으로 성장해 왔으며, 최근에는 완제의약품 개발·생산까지 사업 영역을 확대하고 있다. 원료의약품으로는 프로스타글란딘 계열, Vitamine D류, 항암제, 편두통치료제, 당뇨병치료제 원료 등이 핵심이며, 완제의약품으로는 비타민 D류, 녹내장치료제, 위장관치료제, 혈액순환개선제, 당뇨병치료제 등 차별화된 제품을 제제화하고 있다.2025-11-10 11:05:56김진구 -
 "하루 한 번 충분"...토라펜XR서방정, 복용 패턴 바꾼다[데일리팜=황병우 기자] CMG제약이 선보인 서방형 토피라메이트 제제 '토라펜XR서방정'이 의료 현장에서 의미 있는 변화를 이끌어내고 있다. 하루 한 번 복용으로 약효가 안정적으로 유지되고, 부작용 발생 가능성을 줄인 제형 특성으로 환자의 복약 순응도와 편의성이 크게 개선되고 있다는 평가다. 데일리팜과 만난 박민수 서울ND의원 원장은 토라펜XR서방정이 기존 치료제 사용 패턴을 바꾸며 임상 활용 범위를 넓혀가고 있다고 강조했다. 서방 제형 ‘토라펜’, 복약 순응도·안정성 향상 CMG제약은 최근 서방형 토피라메이트 제제인 토라펜XR서방정을 출시했다. 제형 변경을 통해 1일 1회 복용으로 하루 약효 유지가 가능해졌고(기존 속방형은 1일 2~3회), 복약 과정이 단순해지면서 순응도 개선이 기대된다. 한 번 복용으로 혈중 약물 농도가 완만하고 일정하게 유지되면 약효의 고저 폭이 줄어 약동 스트레스가 낮아진다는 것이 현장 의료진의 설명이다. 또한 저용량(25mg)에서 50mg·100mg으로 단계적 증량이 가능해 손발 저림 등 대표적 부작용을 관리하기 용이하다는 평가도 나온다. 박 원장은 "혈중 농도가 일정하게 유지되면 부작용 발생도 확실히 관리하기 쉽다"면서 "한 번 투약으로 약효 지속성과 편의성을 동시에 잡으면 복약 순응도와 치료 지속성에 긍정적 영향을 준다"고 말했다. 토피라메이트가 갖는 중추 신경 안정 효과에 주목하는 시각도 있다. 그는 "복용 후 수면의 질이 좋아지거나 정서적 기복이 줄었다고 말하는 환자들이 많다"며 "하루 한 번 복용으로 생활 리듬을 방해하지 않으면서 약효가 하루 내내 일정하게 유지된다는 점을 환자들이 '편하다'고 평가한다”고 전했다. "토피라메이트 성분 '뇌 비만 축' 공략 관심" 토라펜XR서방정의 성분인 토피라메이트는 이미 50년 가까운 사용 역사를 가진 약물로, 원래는 뇌전증 치료제로 개발됐다. 이후 편두통 예방 등으로도 쓰이며 임상 경험이 축적돼 안전성이 뒷받침된 약물로 평가된다. 최근에 토피라메이트 성분은 비만 치료제의 주요 성분으로도 관심을 받고 있다. 대표적으로 지난 2012년 미국 식품의약국(FDA) 승인을 받은 큐시미아가 펜터민과 토피라메이트의 복합제제로, 고도비만 환자의 체중 감량 치료에 쓰이고 있다. 박 원장은 "토피라메이트는 1979년 당뇨병 치료제로 개발된 이후 간질 치료제와 편두통 예방제로도 사용되며 50년 가까운 사용 역사를 쌓은 약"이라며 "국내에서는 해당 적응증을 획득하지 못했기 때문에 공식 비만약으로는 인정되지 않으며, 오프라벨 처방 시 의사의 책임 하에 사용된다"고 언급했다. 이러한 배경을 토대로 국내에서도 토피라메이트를 체중 관리의 보조적 수단으로 활용하려는 움직임이 생겨나고 있다는 게 그의 설명이다. 박 원장은 토피라메이트의 임상적 위치를 '뇌-중추 작용 축’에 두고 설명했다. GLP-1 계열 주사제들이 장을 통해 체중 조절 효과를 내는 '장 비만 축' 약제라면, 토피라메이트는 뇌 신경을 안정시켜 식욕과 충동을 조절하는 뇌 비만 축’에 작용한다는 의미로 서로 다른 기전을 활용할 경우 병용 시너지를 낼 수 있으므로 이에 대한 검토가 필요하다는 견해다. 또 고가의 주사제를 중단해야 하는 환자군에게는 토피라메이트가 장기적 대안이 될 수 있다고 언급했다. 박 원장은 "위고비 등 주사 치료에 15~20% 정도 반응하지 않는 환자들이 보고되는데, 이때 뇌 비만축에 작용하는 토피라메이트를 활용하면 부족한 부분을 채워줄 수 있다"며 "비만을 포함한 여러 대사 질환은 단기 성과보다 지속 가능성과 환자 맞춤 치료가 핵심으로 추후 임상연구와 정책논의를 통해 활용근거를 더 탄탄히 해야할 것으로 본다"고 밝혔다. 비만 치료 패러다임 전환…"장기 유지 관리·정책 지원 필요" 비만 치료의 관점에서 보면 최근에는 단순 미용이 아니라 당뇨병, 고혈압, 이상지질혈증, 심부전 등 합병증과 함께 조기 치료와 장기 관리의 중요성이 커지고 있다. 이에 대해 박 원장은 비만은 고혈압·당뇨처럼 만성질환으로 봐야 한다고 강조했다. 그는 "예전에 한 번 살을 빼고 끝내는 식의 접근에서 벗어나, 건강한 체중을 지속적으로 유지하는 '유지어터' 개념이 중요해졌다"며 "비만 치료도 환자별로 위험도를 평가해 개별화해 필요한 경우 비만을 질병으로 인식하고 끝까지 관리해줘야 한다"고 전했다. 가령 과체중 상태를 잘 견디는 사람도 있고, 약간만 비만이어도 금방 합병증이 나타나는 사람도 있는 만큼, 환자별 맞춤 치료로 접근해야 한다는 시각이다. 이런 가운데 정부 정책과 의료 환경도 변화 조짐을 보이고 있다. 과거에는 효과적인 약이 없고 미용 목적 처방이 많다는 이유로 비만약에 대한 지원이 전무했지만, 이제 새로운 강력한 치료제들이 속속 나오면서 의학적 필요성이 부각되고 있다. 다만 재정 부담을 감안해 초고도비만 등 고위험 환자를 선별 지원하는 등 단계적 도입이 거론된다. 박 원장은 "우리나라도 비용 효과적인 접근에 관심을 가지고 한정된 재원에서 안전하고 지속적인 치료 방법을 찾는 노력이 필요할 것으로 본다"며 "단편적 체중 감량이 아닌 지속성 있고 포괄적인 치료를 할 수 있도록 지속적인 고민이 필요하다"고 덧붙였다.2025-10-13 06:15:45황병우
"하루 한 번 충분"...토라펜XR서방정, 복용 패턴 바꾼다[데일리팜=황병우 기자] CMG제약이 선보인 서방형 토피라메이트 제제 '토라펜XR서방정'이 의료 현장에서 의미 있는 변화를 이끌어내고 있다. 하루 한 번 복용으로 약효가 안정적으로 유지되고, 부작용 발생 가능성을 줄인 제형 특성으로 환자의 복약 순응도와 편의성이 크게 개선되고 있다는 평가다. 데일리팜과 만난 박민수 서울ND의원 원장은 토라펜XR서방정이 기존 치료제 사용 패턴을 바꾸며 임상 활용 범위를 넓혀가고 있다고 강조했다. 서방 제형 ‘토라펜’, 복약 순응도·안정성 향상 CMG제약은 최근 서방형 토피라메이트 제제인 토라펜XR서방정을 출시했다. 제형 변경을 통해 1일 1회 복용으로 하루 약효 유지가 가능해졌고(기존 속방형은 1일 2~3회), 복약 과정이 단순해지면서 순응도 개선이 기대된다. 한 번 복용으로 혈중 약물 농도가 완만하고 일정하게 유지되면 약효의 고저 폭이 줄어 약동 스트레스가 낮아진다는 것이 현장 의료진의 설명이다. 또한 저용량(25mg)에서 50mg·100mg으로 단계적 증량이 가능해 손발 저림 등 대표적 부작용을 관리하기 용이하다는 평가도 나온다. 박 원장은 "혈중 농도가 일정하게 유지되면 부작용 발생도 확실히 관리하기 쉽다"면서 "한 번 투약으로 약효 지속성과 편의성을 동시에 잡으면 복약 순응도와 치료 지속성에 긍정적 영향을 준다"고 말했다. 토피라메이트가 갖는 중추 신경 안정 효과에 주목하는 시각도 있다. 그는 "복용 후 수면의 질이 좋아지거나 정서적 기복이 줄었다고 말하는 환자들이 많다"며 "하루 한 번 복용으로 생활 리듬을 방해하지 않으면서 약효가 하루 내내 일정하게 유지된다는 점을 환자들이 '편하다'고 평가한다”고 전했다. "토피라메이트 성분 '뇌 비만 축' 공략 관심" 토라펜XR서방정의 성분인 토피라메이트는 이미 50년 가까운 사용 역사를 가진 약물로, 원래는 뇌전증 치료제로 개발됐다. 이후 편두통 예방 등으로도 쓰이며 임상 경험이 축적돼 안전성이 뒷받침된 약물로 평가된다. 최근에 토피라메이트 성분은 비만 치료제의 주요 성분으로도 관심을 받고 있다. 대표적으로 지난 2012년 미국 식품의약국(FDA) 승인을 받은 큐시미아가 펜터민과 토피라메이트의 복합제제로, 고도비만 환자의 체중 감량 치료에 쓰이고 있다. 박 원장은 "토피라메이트는 1979년 당뇨병 치료제로 개발된 이후 간질 치료제와 편두통 예방제로도 사용되며 50년 가까운 사용 역사를 쌓은 약"이라며 "국내에서는 해당 적응증을 획득하지 못했기 때문에 공식 비만약으로는 인정되지 않으며, 오프라벨 처방 시 의사의 책임 하에 사용된다"고 언급했다. 이러한 배경을 토대로 국내에서도 토피라메이트를 체중 관리의 보조적 수단으로 활용하려는 움직임이 생겨나고 있다는 게 그의 설명이다. 박 원장은 토피라메이트의 임상적 위치를 '뇌-중추 작용 축’에 두고 설명했다. GLP-1 계열 주사제들이 장을 통해 체중 조절 효과를 내는 '장 비만 축' 약제라면, 토피라메이트는 뇌 신경을 안정시켜 식욕과 충동을 조절하는 뇌 비만 축’에 작용한다는 의미로 서로 다른 기전을 활용할 경우 병용 시너지를 낼 수 있으므로 이에 대한 검토가 필요하다는 견해다. 또 고가의 주사제를 중단해야 하는 환자군에게는 토피라메이트가 장기적 대안이 될 수 있다고 언급했다. 박 원장은 "위고비 등 주사 치료에 15~20% 정도 반응하지 않는 환자들이 보고되는데, 이때 뇌 비만축에 작용하는 토피라메이트를 활용하면 부족한 부분을 채워줄 수 있다"며 "비만을 포함한 여러 대사 질환은 단기 성과보다 지속 가능성과 환자 맞춤 치료가 핵심으로 추후 임상연구와 정책논의를 통해 활용근거를 더 탄탄히 해야할 것으로 본다"고 밝혔다. 비만 치료 패러다임 전환…"장기 유지 관리·정책 지원 필요" 비만 치료의 관점에서 보면 최근에는 단순 미용이 아니라 당뇨병, 고혈압, 이상지질혈증, 심부전 등 합병증과 함께 조기 치료와 장기 관리의 중요성이 커지고 있다. 이에 대해 박 원장은 비만은 고혈압·당뇨처럼 만성질환으로 봐야 한다고 강조했다. 그는 "예전에 한 번 살을 빼고 끝내는 식의 접근에서 벗어나, 건강한 체중을 지속적으로 유지하는 '유지어터' 개념이 중요해졌다"며 "비만 치료도 환자별로 위험도를 평가해 개별화해 필요한 경우 비만을 질병으로 인식하고 끝까지 관리해줘야 한다"고 전했다. 가령 과체중 상태를 잘 견디는 사람도 있고, 약간만 비만이어도 금방 합병증이 나타나는 사람도 있는 만큼, 환자별 맞춤 치료로 접근해야 한다는 시각이다. 이런 가운데 정부 정책과 의료 환경도 변화 조짐을 보이고 있다. 과거에는 효과적인 약이 없고 미용 목적 처방이 많다는 이유로 비만약에 대한 지원이 전무했지만, 이제 새로운 강력한 치료제들이 속속 나오면서 의학적 필요성이 부각되고 있다. 다만 재정 부담을 감안해 초고도비만 등 고위험 환자를 선별 지원하는 등 단계적 도입이 거론된다. 박 원장은 "우리나라도 비용 효과적인 접근에 관심을 가지고 한정된 재원에서 안전하고 지속적인 치료 방법을 찾는 노력이 필요할 것으로 본다"며 "단편적 체중 감량이 아닌 지속성 있고 포괄적인 치료를 할 수 있도록 지속적인 고민이 필요하다"고 덧붙였다.2025-10-13 06:15:45황병우 -
 뿌리는 이뇨제 등장…치료 영역 넓히는 '비강스프레이'[데일리팜=손형민 기자] 투여 편의성에서 강점을 보일 수 있는 비강 스프레이가 전신질환 관리의 대안으로 떠오르고 있다. 기존 비염·독감 백신을 넘어 심혈관·대사질환, 나아가 응급 알레르기 반응까지 활용이 가능해지면서 제형 혁신의 중심으로 자리잡는 모양새다. 엔뷰미스트, 부메타니드 이뇨제 첫 비강제형 등극 19일 제약업계에 따르면 미국 식품의약국(FDA)은 최근 미국 코르스타시스 테라퓨틱스의 부메타니드 비강 스프레이 제형 ‘엔뷰미스트(Enbumyst)’를 승인했다. 이번 허가로 엔뷰미스트는 성인 심부전, 간질환, 신장질환(신증후군 포함)에서 나타나는 부종 치료에 사용이 가능해졌다. 부메타니드는 루프(loop) 이뇨제로, 신세뇨관의 한 부분인 헨레 고리 상행각에서 나트륨, 칼륨, 염소 재흡수를 억제해 소변으로 배출하도록 돕는다. 이로 인해 체내 과잉 수분과 나트륨이 감소해 부종 완화와 혈압 조절에 효과적이다. 기존 부메타니드 경구·정맥주사 제형은 각각 흡수 지연, 병원 방문이 필요하다는 한계점이 있었다. 엔뷰미스트는 가정에서 환자가 직접 투여할 수 있어 편의성에 큰 강점이 있다. 임상에서 엔뷰미스트는 부메타니드 정맥주사 제형과 비교했을 때 이뇨, 나트륨 이뇨와 소변 칼륨 배설에 유사한 효과가 나타났다. 또 엔뷰미스트는 빠른 흡수와 예측 가능한 이뇨제 반응을 입증했다. 이번 엔뷰미스트의 허가는 만성질환 관리 시 자가 투여를 실시할 수 있다는 점에서 의미가 크다. 전문가들은 비강 제형의 확산이 환자 편의성 향상뿐 아니라 재입원율과 의료비 절감에도 기여할 수 있다고 평가한다. 응급질환까지 확장…아나필락시스 치료 도전장 비강 스프레이는 알레르기 비염 치료제 외에도 ▲우울증 치료제 ‘스프라바토’ ▲독감 백신 ‘플루미스트’ ▲편두통 치료제 ‘자베게판트’ 등이 개발되며 다양한 영역에서 활용되고 있다. 최근에는 응급질환 치료로도 확장되고 있다. 미국 ARS 파마슈티컬스는 아나필락시스 치료용 에피네프린 비강제형 ‘네피(Neffy)’에 대한 리얼얼드 데이터를 최근 국제 학술지 Annals of Allergy, Asthma and Immunology에 발표했다. 이 회사는 지난해 네피 원개발사인 덴마크 ALK로부터 글로벌 상업화 권리를 확보한 바 있다. 아나필락시스는 특정 알레르겐에 노출된 후 즉시 나타나는 심각한 전신 알레르기 반응으로, 두드러기, 부종, 호흡 곤란, 혈압 저하 등이 동반돼 즉각적인 응급 처치가 필요하며 심한 경우 사망에 이를 수 있다. 원인은 음식, 약물반응, 곤충 자상, 운동 등이 있다. 아나필락시스 표준치료요법은 에피네프린 주사제가 활용되고 있다. 에피네프린 비강스프레이 제형인 네피가 등장하면서 환자의 투여 편의성 확대될 것으로 기대된다. 네피의 리얼월드 데이터는 미국 내 301명의 의료 전문가들이 참여한 관찰 연구로, 음식에 대한 반응을 확인하는 검사나 알레르기 면역 요법 중 발생한 아나필락시스 증상에 네피를 사용한 사례를 분석했다. 네피를 사용한 545건 케이스를 분석한 결과, 네피 단일 용량 투여 시 89.2%의 환자에서 아나필락시스 증상이 빠르게 개선됐다. 이는 기존 에피네프린 주사제와 유사한 효과였다. 현재 네피는 미국을 비롯해 유럽에서 허가됐으며, 중국, 일본, 호주에 허가 신청서가 제출돼 아시아태평양 시장에도 진출이 예상된다. 기존 주사제 중심이던 아나필락시스 치료 패러다임에 변화가 예고됐다.2025-09-19 06:11:04손형민
뿌리는 이뇨제 등장…치료 영역 넓히는 '비강스프레이'[데일리팜=손형민 기자] 투여 편의성에서 강점을 보일 수 있는 비강 스프레이가 전신질환 관리의 대안으로 떠오르고 있다. 기존 비염·독감 백신을 넘어 심혈관·대사질환, 나아가 응급 알레르기 반응까지 활용이 가능해지면서 제형 혁신의 중심으로 자리잡는 모양새다. 엔뷰미스트, 부메타니드 이뇨제 첫 비강제형 등극 19일 제약업계에 따르면 미국 식품의약국(FDA)은 최근 미국 코르스타시스 테라퓨틱스의 부메타니드 비강 스프레이 제형 ‘엔뷰미스트(Enbumyst)’를 승인했다. 이번 허가로 엔뷰미스트는 성인 심부전, 간질환, 신장질환(신증후군 포함)에서 나타나는 부종 치료에 사용이 가능해졌다. 부메타니드는 루프(loop) 이뇨제로, 신세뇨관의 한 부분인 헨레 고리 상행각에서 나트륨, 칼륨, 염소 재흡수를 억제해 소변으로 배출하도록 돕는다. 이로 인해 체내 과잉 수분과 나트륨이 감소해 부종 완화와 혈압 조절에 효과적이다. 기존 부메타니드 경구·정맥주사 제형은 각각 흡수 지연, 병원 방문이 필요하다는 한계점이 있었다. 엔뷰미스트는 가정에서 환자가 직접 투여할 수 있어 편의성에 큰 강점이 있다. 임상에서 엔뷰미스트는 부메타니드 정맥주사 제형과 비교했을 때 이뇨, 나트륨 이뇨와 소변 칼륨 배설에 유사한 효과가 나타났다. 또 엔뷰미스트는 빠른 흡수와 예측 가능한 이뇨제 반응을 입증했다. 이번 엔뷰미스트의 허가는 만성질환 관리 시 자가 투여를 실시할 수 있다는 점에서 의미가 크다. 전문가들은 비강 제형의 확산이 환자 편의성 향상뿐 아니라 재입원율과 의료비 절감에도 기여할 수 있다고 평가한다. 응급질환까지 확장…아나필락시스 치료 도전장 비강 스프레이는 알레르기 비염 치료제 외에도 ▲우울증 치료제 ‘스프라바토’ ▲독감 백신 ‘플루미스트’ ▲편두통 치료제 ‘자베게판트’ 등이 개발되며 다양한 영역에서 활용되고 있다. 최근에는 응급질환 치료로도 확장되고 있다. 미국 ARS 파마슈티컬스는 아나필락시스 치료용 에피네프린 비강제형 ‘네피(Neffy)’에 대한 리얼얼드 데이터를 최근 국제 학술지 Annals of Allergy, Asthma and Immunology에 발표했다. 이 회사는 지난해 네피 원개발사인 덴마크 ALK로부터 글로벌 상업화 권리를 확보한 바 있다. 아나필락시스는 특정 알레르겐에 노출된 후 즉시 나타나는 심각한 전신 알레르기 반응으로, 두드러기, 부종, 호흡 곤란, 혈압 저하 등이 동반돼 즉각적인 응급 처치가 필요하며 심한 경우 사망에 이를 수 있다. 원인은 음식, 약물반응, 곤충 자상, 운동 등이 있다. 아나필락시스 표준치료요법은 에피네프린 주사제가 활용되고 있다. 에피네프린 비강스프레이 제형인 네피가 등장하면서 환자의 투여 편의성 확대될 것으로 기대된다. 네피의 리얼월드 데이터는 미국 내 301명의 의료 전문가들이 참여한 관찰 연구로, 음식에 대한 반응을 확인하는 검사나 알레르기 면역 요법 중 발생한 아나필락시스 증상에 네피를 사용한 사례를 분석했다. 네피를 사용한 545건 케이스를 분석한 결과, 네피 단일 용량 투여 시 89.2%의 환자에서 아나필락시스 증상이 빠르게 개선됐다. 이는 기존 에피네프린 주사제와 유사한 효과였다. 현재 네피는 미국을 비롯해 유럽에서 허가됐으며, 중국, 일본, 호주에 허가 신청서가 제출돼 아시아태평양 시장에도 진출이 예상된다. 기존 주사제 중심이던 아나필락시스 치료 패러다임에 변화가 예고됐다.2025-09-19 06:11:04손형민 -
 "마이크로니들, 국가마다 허가절차 달라...규제 조화 시급"[데일리팜=손형민 기자] 국가마다 상이한 규제 분류 체계가 마이크로니들 제제의 글로벌 진출을 가로막고 있다는 우려가 커지고 있다. 마이크로니들 제제는 투여 편의성과 보관·유통 장점으로 제약업계의 차세대 전달기술로 주목받고 있지만, 각국 규제기관의 허가 기준 불일치가 상용화의 발목을 잡고 있다는 지적이다. 28일 한국신약개발연구조합과 동국대학교 산학협력단은 서울 삼성동 코엑스에서 열린 2025 세계 제약·바이오·건강기능 산업 전시회(CPHI KOREA 2025)에서 마이크로니들 제제 관련 세미나를 개최했다. 이 자리에서 조헌제 한국신약개발연구조합 본부장은 글로벌 규제기관들의 규제 조화가 시급하다고 강조했다. 마이크로니들 제제는 미세 바늘을 통해 의약품을 체내에 전달하는 경피약물전달시스템(TDDS)이다. 특히 백신, 톡신, 항체 등 다양한 약물을 정량 투여할 수 있으며, 저온에서 핵심 공정이 이뤄져 바이오의약품 변성을 최소화할 수 있다는 장점이 있다. 또 주사 부위 통증을 현저히 줄이고, 상온 보관이 가능해 물류비 절감 효과도 기대된다. 투여 편의성 개선 효과가 뚜렷해 기존 경구제·주사제 대비 경쟁력이 부각되면서 많은 제약사들이 이 분야에 진출하고 있다. 실제로 아이큐어는 도네페질 패치제를 개발했으며, 비보존제약은 비마약성 진통제 ‘어나프라’ 패치제를 개발 중이다. 라파스, 대원제약, 대웅제약 등도 글루카곤 유사 펩타이드(GLP-1) 제제를 마이크로니들 형태로 개발하고 있다. 하지만 글로벌 진출 과정에서는 규제 불일치가 큰 걸림돌이 되고 있다. 각국 규제기관의 분류 체계, 품질 요건, 심사 항목과 허가 절차가 제각각이어서 제품 개발과 상용화, 수출 전략 수립에 실질적인 규제 장벽이 존재한다는 것이다. 조 본부장은 “동일 기술임에도 국가별 분류가 다르다. 중국은 피부를 뚫는 제품을 의료기기로 보지만 경우에 따라 의약품으로 분류하기도 한다”며 “미국은 약물을 포함하면 신약허가신청서(NDA)나 바이오시밀러허가신청서(BLA)를 제출해야 하지만, 약물이 포함되지 않으면 의료기기로 본다"라고 말했다. 이어 "유럽은 미용 목적이라도 침습성이 있으면 의료기기로 분류한다. 특히 CE 인증서를 요구해 진출 절차가 더 복잡하다. 또 각 국가별로 상이한 허가 신청 절차를 갖고 있어 시장 진출이 까다롭다"라고 평가했다. 이처럼 각 글로벌 규제기관들의 규제 불일치로 인해 데이터 중복 제출, 허가 지연, 제조 공정의 이중 적용 등 여러 문제점들이 발생하고 있다. 실제로 미국 조사노파마(Zosano Phrama)는 마이크로니들 기반 편두통 치료제 임상3상에서 유효성을 확보했지만 FDA로부터 약물 방출의 정량성 등 화학·제조·품질(CMC) 문제로 거절당하기도 했다. 조 본부장은 “현재 국제표준화기구(ISO) 차원에서 마이크로니들 제제의 분류 기준 표준화 논의가 진행 중이고, 국내에서도 식품의약품안전처가 관련 작업을 진행하는 것으로 안다”며 “표준화가 가시화되면 국내 업계에도 새로운 모달리티 형성 기회가 될 것”이라고 전망했다. 이어 “다만 아직까지 각국의 규제 기준이 상이해서 글로벌 진출을 원하는 기업은 반드시 해당 국가의 규제를 면밀히 분석해야 한다”고 덧붙였다.2025-08-28 12:00:19손형민
"마이크로니들, 국가마다 허가절차 달라...규제 조화 시급"[데일리팜=손형민 기자] 국가마다 상이한 규제 분류 체계가 마이크로니들 제제의 글로벌 진출을 가로막고 있다는 우려가 커지고 있다. 마이크로니들 제제는 투여 편의성과 보관·유통 장점으로 제약업계의 차세대 전달기술로 주목받고 있지만, 각국 규제기관의 허가 기준 불일치가 상용화의 발목을 잡고 있다는 지적이다. 28일 한국신약개발연구조합과 동국대학교 산학협력단은 서울 삼성동 코엑스에서 열린 2025 세계 제약·바이오·건강기능 산업 전시회(CPHI KOREA 2025)에서 마이크로니들 제제 관련 세미나를 개최했다. 이 자리에서 조헌제 한국신약개발연구조합 본부장은 글로벌 규제기관들의 규제 조화가 시급하다고 강조했다. 마이크로니들 제제는 미세 바늘을 통해 의약품을 체내에 전달하는 경피약물전달시스템(TDDS)이다. 특히 백신, 톡신, 항체 등 다양한 약물을 정량 투여할 수 있으며, 저온에서 핵심 공정이 이뤄져 바이오의약품 변성을 최소화할 수 있다는 장점이 있다. 또 주사 부위 통증을 현저히 줄이고, 상온 보관이 가능해 물류비 절감 효과도 기대된다. 투여 편의성 개선 효과가 뚜렷해 기존 경구제·주사제 대비 경쟁력이 부각되면서 많은 제약사들이 이 분야에 진출하고 있다. 실제로 아이큐어는 도네페질 패치제를 개발했으며, 비보존제약은 비마약성 진통제 ‘어나프라’ 패치제를 개발 중이다. 라파스, 대원제약, 대웅제약 등도 글루카곤 유사 펩타이드(GLP-1) 제제를 마이크로니들 형태로 개발하고 있다. 하지만 글로벌 진출 과정에서는 규제 불일치가 큰 걸림돌이 되고 있다. 각국 규제기관의 분류 체계, 품질 요건, 심사 항목과 허가 절차가 제각각이어서 제품 개발과 상용화, 수출 전략 수립에 실질적인 규제 장벽이 존재한다는 것이다. 조 본부장은 “동일 기술임에도 국가별 분류가 다르다. 중국은 피부를 뚫는 제품을 의료기기로 보지만 경우에 따라 의약품으로 분류하기도 한다”며 “미국은 약물을 포함하면 신약허가신청서(NDA)나 바이오시밀러허가신청서(BLA)를 제출해야 하지만, 약물이 포함되지 않으면 의료기기로 본다"라고 말했다. 이어 "유럽은 미용 목적이라도 침습성이 있으면 의료기기로 분류한다. 특히 CE 인증서를 요구해 진출 절차가 더 복잡하다. 또 각 국가별로 상이한 허가 신청 절차를 갖고 있어 시장 진출이 까다롭다"라고 평가했다. 이처럼 각 글로벌 규제기관들의 규제 불일치로 인해 데이터 중복 제출, 허가 지연, 제조 공정의 이중 적용 등 여러 문제점들이 발생하고 있다. 실제로 미국 조사노파마(Zosano Phrama)는 마이크로니들 기반 편두통 치료제 임상3상에서 유효성을 확보했지만 FDA로부터 약물 방출의 정량성 등 화학·제조·품질(CMC) 문제로 거절당하기도 했다. 조 본부장은 “현재 국제표준화기구(ISO) 차원에서 마이크로니들 제제의 분류 기준 표준화 논의가 진행 중이고, 국내에서도 식품의약품안전처가 관련 작업을 진행하는 것으로 안다”며 “표준화가 가시화되면 국내 업계에도 새로운 모달리티 형성 기회가 될 것”이라고 전망했다. 이어 “다만 아직까지 각국의 규제 기준이 상이해서 글로벌 진출을 원하는 기업은 반드시 해당 국가의 규제를 면밀히 분석해야 한다”고 덧붙였다.2025-08-28 12:00:19손형민 -
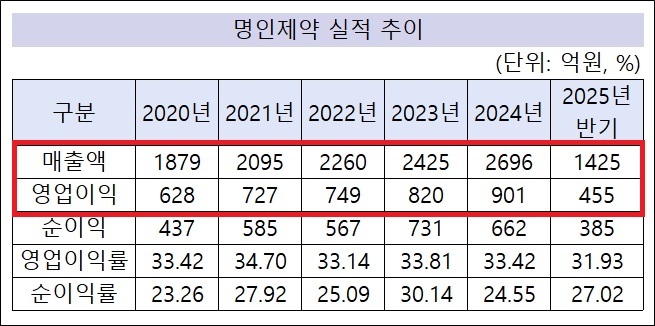 명인제약, IPO 앞두고 최대 매출 예고…반기 1425억 달성[데일리팜=이석준 기자] 명인제약이 올해 최대 매출을 예고했다. 올 반기에만 개별 기준 1425억원을 달성했다. 하반기 실적에 따라 매출 첫 3000억원 돌파도 가능해보인다. 기존 신기록은 지난해 2696억원이다. 명인제약은 21일 증권신고서를 제출하고 9월 코스피 상장을 앞두고 있다. IPO(기업공개)를 앞두고 최대 실적 예고되면서 스스로 기업 가치를 증명하고 있다는 분석이 나온다. 올해 영업이익도 산술적으로 신기록이 점쳐진다. 명인제약의 예상시가총액은 최대 8468억원이다. 증권신고서에는 명인제약 반기 실적이 첫 공개됐다. 이에 따르면 명인제약 올 반기 개별 기준 매출은 1425억원, 영업이익 455억원이다. 산술적으로 올해 매출 2850억원, 영업이익 910억원이 점쳐진다. 기존 연간 실적 신기록이 지난해 매출 2696억원, 영업이익 901억원인 점을 감안하면 올해 두 부문 모두 최대 수치가 전망된다. 하반기에 따라 연간 외형 첫 3000억원 돌파도 바라볼 수 있다. 특히 주력 사업인 CNS(중추신경계) 부문에서 신제품을 꾸준히 허가를 받으면서 외형 확장에 기여하고 있다. 올해만 봐도 실버셉트정3mg(치매), 아모닐정150.250mg(기면증), 에스벤서방정25mg(우울증), 프로트립탄정2.5mg(편두통), 리셀톤멀티데이패취 25.92mg/51.84mg (치매) 등이 승인을 받았다. 모두 CNS 약물로 기존 라인업과 시너지가 예상된다. 명인제약은 수익성도 잡고 있다. 영업이익은 매년 앞자리가 바뀌는 모양새다. 2017년 413억원, 2018년 544억원, 2019년 581억원, 2020년 628억원, 2021년 727억원, 2022년 749억원, 2023년 820억원, 2024년 901억원 등이다. 올 반기도 455억원이어서 하반기에 따라 첫 1000억원 돌파 가능성이 있다. 명인제약의 2024년 901억원 영업이익 규모는 상장사를 포함해도 최상위권이다. 한미약품(2162억원), 대웅제약(1638억원), 종근당(995억원) 등 소수 기업만 명인제약보다 지난해 영업이익이 많았다. 명인제약은 외형을 확대하면서도 수익성도 잡았다. 최근 5년만 봐도 2020년(33.42%), 2021년(34.70%), 2022년(33.14%), 2023년(33.81%), 2024년(33.42%) 등 모두 33% 이상이다. 업계 전체 1,2위를 다투는 수치다. 업계 관계자는 "호실적은 기업가치 중요 척도 중 하나다. 명인제약은 수년간 호실적에 이어 올해도 IPO 앞두고 최대 실적을 예고하고 있다. 상장 전 실적으로 경쟁력을 증명하고 있다"고 짚었다. 미래 동력 '국내 최대 펠렛 전용 공장' 명인제약은 향후 성장 동력도 준비하고 있다. 대표적으로 국내 최대 펠렛 전용 공장 신축이다. 1000억원이 투입되는 대형 프로젝트다. 주로 개량신약을 생산해 수익을 극대화할 계획이다. '펠렛 개량신약=명인제약' 공식을 만드는게 목표다. 국내 펠렛 의약품 시장은 3500억원 규모다. 다만 인도 및 중국 등 해외에서 사실상 전량 수입하고 있다. 명인제약이 이를 대체하면 3500억원 국내 시장의 점유율을 최대한 높일 수 있다는 계산이 나온다. 2031년 7조원으로 전망되는 해외 펠렛 시장 진출도 본격화한다. 10%만 차지해도 7000억원 신규 매출이 가능하다. 펠렛 전용 공장은 2025년 2월 착공했고 2026년 4월 완공, 2027년 상반기 본격적인 생산 가동을 목표로 하고 있다. 이행명 명인제약 회장도 "펠렛 의약품은 소수 업체만 구현할 수 있다. 대규모 투자와 기술력이 필요하기 때문이다. 그만큼 진입장벽이 높다. 초기 투자 비용이 1000억원으로 대규모지만 향후 사업 영속성이 보장돼 큰 수익을 낼 수 있다고 판단한다. 제네릭 개발도 사실상 어려워 후발주자 진입도 걱정할 필요가 없다"고 자신했다. CNS 신약 개발에도 나서고 있다. 명인제약은 8월 1일 CNS 혁신신약 '에베나마이드(Evenamide)' 국내 3상 승인을 받았다. 해당 임상은 글로벌 3상 일부다. 명인제약은 지난해말 이탈리아 뉴론(Newron)사와 치료 저항성 조현병 치료제 신약 '에베나마이드' 한국 내 상용화(허가, 등록, 마케팅, 상업화)를 위한 독점 라이센스 계약을 체결했다. 여기서 명인제약은 뉴론사에서 진행하는 글로벌 3상 전체 환자 중 10%를 한국서 모집하며 해당 임상 비용을 자체 부담하기로 했다. 또 에베나마이드 글로벌 전체 개발 비용의 일정 비율도 분담한다. 에베나마이드 글로벌 3상이 본격화되면서 명인제약의 IPO 경쟁력도 강화됐다는 평가를 받는다. 통상 제약사의 기업가치는 실적과 파이프라인이 좌우하기 때문이다. 한편 명인제약은 8월 21일 금융위원회에 증권신고서를 제출했다. 회사는 이번 상장에서 340만주를 공모할 계획이다. 희망 공모 밴드가는 4만5000~5만8000원으로 총 공모 금액은 1530억~1972억원 수준이다. 수요예측은 9월 9~15일까지며 일반 청약은 9월 18~19일까지 양일간 진행된다. 예상시가총액은 6570억~8468억원이다.2025-08-22 06:18:29이석준
명인제약, IPO 앞두고 최대 매출 예고…반기 1425억 달성[데일리팜=이석준 기자] 명인제약이 올해 최대 매출을 예고했다. 올 반기에만 개별 기준 1425억원을 달성했다. 하반기 실적에 따라 매출 첫 3000억원 돌파도 가능해보인다. 기존 신기록은 지난해 2696억원이다. 명인제약은 21일 증권신고서를 제출하고 9월 코스피 상장을 앞두고 있다. IPO(기업공개)를 앞두고 최대 실적 예고되면서 스스로 기업 가치를 증명하고 있다는 분석이 나온다. 올해 영업이익도 산술적으로 신기록이 점쳐진다. 명인제약의 예상시가총액은 최대 8468억원이다. 증권신고서에는 명인제약 반기 실적이 첫 공개됐다. 이에 따르면 명인제약 올 반기 개별 기준 매출은 1425억원, 영업이익 455억원이다. 산술적으로 올해 매출 2850억원, 영업이익 910억원이 점쳐진다. 기존 연간 실적 신기록이 지난해 매출 2696억원, 영업이익 901억원인 점을 감안하면 올해 두 부문 모두 최대 수치가 전망된다. 하반기에 따라 연간 외형 첫 3000억원 돌파도 바라볼 수 있다. 특히 주력 사업인 CNS(중추신경계) 부문에서 신제품을 꾸준히 허가를 받으면서 외형 확장에 기여하고 있다. 올해만 봐도 실버셉트정3mg(치매), 아모닐정150.250mg(기면증), 에스벤서방정25mg(우울증), 프로트립탄정2.5mg(편두통), 리셀톤멀티데이패취 25.92mg/51.84mg (치매) 등이 승인을 받았다. 모두 CNS 약물로 기존 라인업과 시너지가 예상된다. 명인제약은 수익성도 잡고 있다. 영업이익은 매년 앞자리가 바뀌는 모양새다. 2017년 413억원, 2018년 544억원, 2019년 581억원, 2020년 628억원, 2021년 727억원, 2022년 749억원, 2023년 820억원, 2024년 901억원 등이다. 올 반기도 455억원이어서 하반기에 따라 첫 1000억원 돌파 가능성이 있다. 명인제약의 2024년 901억원 영업이익 규모는 상장사를 포함해도 최상위권이다. 한미약품(2162억원), 대웅제약(1638억원), 종근당(995억원) 등 소수 기업만 명인제약보다 지난해 영업이익이 많았다. 명인제약은 외형을 확대하면서도 수익성도 잡았다. 최근 5년만 봐도 2020년(33.42%), 2021년(34.70%), 2022년(33.14%), 2023년(33.81%), 2024년(33.42%) 등 모두 33% 이상이다. 업계 전체 1,2위를 다투는 수치다. 업계 관계자는 "호실적은 기업가치 중요 척도 중 하나다. 명인제약은 수년간 호실적에 이어 올해도 IPO 앞두고 최대 실적을 예고하고 있다. 상장 전 실적으로 경쟁력을 증명하고 있다"고 짚었다. 미래 동력 '국내 최대 펠렛 전용 공장' 명인제약은 향후 성장 동력도 준비하고 있다. 대표적으로 국내 최대 펠렛 전용 공장 신축이다. 1000억원이 투입되는 대형 프로젝트다. 주로 개량신약을 생산해 수익을 극대화할 계획이다. '펠렛 개량신약=명인제약' 공식을 만드는게 목표다. 국내 펠렛 의약품 시장은 3500억원 규모다. 다만 인도 및 중국 등 해외에서 사실상 전량 수입하고 있다. 명인제약이 이를 대체하면 3500억원 국내 시장의 점유율을 최대한 높일 수 있다는 계산이 나온다. 2031년 7조원으로 전망되는 해외 펠렛 시장 진출도 본격화한다. 10%만 차지해도 7000억원 신규 매출이 가능하다. 펠렛 전용 공장은 2025년 2월 착공했고 2026년 4월 완공, 2027년 상반기 본격적인 생산 가동을 목표로 하고 있다. 이행명 명인제약 회장도 "펠렛 의약품은 소수 업체만 구현할 수 있다. 대규모 투자와 기술력이 필요하기 때문이다. 그만큼 진입장벽이 높다. 초기 투자 비용이 1000억원으로 대규모지만 향후 사업 영속성이 보장돼 큰 수익을 낼 수 있다고 판단한다. 제네릭 개발도 사실상 어려워 후발주자 진입도 걱정할 필요가 없다"고 자신했다. CNS 신약 개발에도 나서고 있다. 명인제약은 8월 1일 CNS 혁신신약 '에베나마이드(Evenamide)' 국내 3상 승인을 받았다. 해당 임상은 글로벌 3상 일부다. 명인제약은 지난해말 이탈리아 뉴론(Newron)사와 치료 저항성 조현병 치료제 신약 '에베나마이드' 한국 내 상용화(허가, 등록, 마케팅, 상업화)를 위한 독점 라이센스 계약을 체결했다. 여기서 명인제약은 뉴론사에서 진행하는 글로벌 3상 전체 환자 중 10%를 한국서 모집하며 해당 임상 비용을 자체 부담하기로 했다. 또 에베나마이드 글로벌 전체 개발 비용의 일정 비율도 분담한다. 에베나마이드 글로벌 3상이 본격화되면서 명인제약의 IPO 경쟁력도 강화됐다는 평가를 받는다. 통상 제약사의 기업가치는 실적과 파이프라인이 좌우하기 때문이다. 한편 명인제약은 8월 21일 금융위원회에 증권신고서를 제출했다. 회사는 이번 상장에서 340만주를 공모할 계획이다. 희망 공모 밴드가는 4만5000~5만8000원으로 총 공모 금액은 1530억~1972억원 수준이다. 수요예측은 9월 9~15일까지며 일반 청약은 9월 18~19일까지 양일간 진행된다. 예상시가총액은 6570억~8468억원이다.2025-08-22 06:18:29이석준 -
 종근당, 뇌전증약 '큐덱시서방캡슐' 제네릭 도전장[데일리팜=이혜경 기자] 종근당이 SK케미칼의 뇌전증 치료제 '큐덱시서방캡슐(토피라메이트)' 제네릭을 허가 받았다. 식품의약품안전처는 25일 '종근당토피라메이트서방정' 25mg과 50mg 등 2개 용량의 품목을 허가했다. 큐덱시서방캡슐의 특허가 2034년 1월 6일까지 보호되고 있어, 실제 출시를 하려면 특허회피부터 성공해야 하는 벽이 남아있다. 따라서 캡슐 제형 대신 필름코팅정 제형 등을 적용해 기존 서방캡슐의 특허를 우회하려는 후발 제제들도 나오고 있는 상황이다. 뇌전증 치료제인 토피라메이트 성분의 오리지널 의약품은 얀센의 '토파맥스정'이지만, 지난 2014년 미국 제네릭사인 업셔-스미스가 토파맥스에 없는 서방형 제제인 큐덱시서방캡슐을 개발해 미국 FDA 승인을 받았다. 국내에는 없던 토피라메이트 서방제제가 나타나면서 기존의 1일 2회 복용이 1일 1회 복용으로 간편해졌으며, SK케미칼이 독점 공급하면서 특허까지 획득한 상태다. 토파맥스는 뇌전증 치료제 뿐 아니라 효능효과로 편두통 예방까지 보유하고 있지만, 큐덱시서방캡슐은 6세 이상 소아 및 성인에서 부분발작 치료에 있어 단독요법으로 사용되며 ▲기존 뇌전증 치료제로 조절되지 않는 2세 이상의 소아 및 성인에서의 부분발작 ▲1차성 강직성·간대성 전시발작 ▲소아기 난치성 뇌전증인 레녹스-가스토 증후군 환자에게 부가요법으로 사용된다. 국내에서는 지난 2017년 큐덱시서방캡슐 허가 이후 2024년부터 제네릭 허가가 이어져왔다. 인트로바이오파마가 2024년 11월 '토피메드서방정' 4개 용량을 허가 받은데 이어 같은 해 휴온스, 씨엠지제약 등이 후발주자로 뛰어들었다. 올해는 종근당토피라메이트서방정이 허가 목록에 이름을 올렸다. 토피라메이트 성분 제제가 800억대 항간전제 시장에서 300억원 규모로 가장 많이 처방되고 있으며, 큐덱시서방캡슐의 2023년 유비스트 기준 원외처방액은 35억원이다. 국내 건강보험 급여는 2018년 2월부터 적용되고 있다.2025-07-25 16:35:40이혜경
종근당, 뇌전증약 '큐덱시서방캡슐' 제네릭 도전장[데일리팜=이혜경 기자] 종근당이 SK케미칼의 뇌전증 치료제 '큐덱시서방캡슐(토피라메이트)' 제네릭을 허가 받았다. 식품의약품안전처는 25일 '종근당토피라메이트서방정' 25mg과 50mg 등 2개 용량의 품목을 허가했다. 큐덱시서방캡슐의 특허가 2034년 1월 6일까지 보호되고 있어, 실제 출시를 하려면 특허회피부터 성공해야 하는 벽이 남아있다. 따라서 캡슐 제형 대신 필름코팅정 제형 등을 적용해 기존 서방캡슐의 특허를 우회하려는 후발 제제들도 나오고 있는 상황이다. 뇌전증 치료제인 토피라메이트 성분의 오리지널 의약품은 얀센의 '토파맥스정'이지만, 지난 2014년 미국 제네릭사인 업셔-스미스가 토파맥스에 없는 서방형 제제인 큐덱시서방캡슐을 개발해 미국 FDA 승인을 받았다. 국내에는 없던 토피라메이트 서방제제가 나타나면서 기존의 1일 2회 복용이 1일 1회 복용으로 간편해졌으며, SK케미칼이 독점 공급하면서 특허까지 획득한 상태다. 토파맥스는 뇌전증 치료제 뿐 아니라 효능효과로 편두통 예방까지 보유하고 있지만, 큐덱시서방캡슐은 6세 이상 소아 및 성인에서 부분발작 치료에 있어 단독요법으로 사용되며 ▲기존 뇌전증 치료제로 조절되지 않는 2세 이상의 소아 및 성인에서의 부분발작 ▲1차성 강직성·간대성 전시발작 ▲소아기 난치성 뇌전증인 레녹스-가스토 증후군 환자에게 부가요법으로 사용된다. 국내에서는 지난 2017년 큐덱시서방캡슐 허가 이후 2024년부터 제네릭 허가가 이어져왔다. 인트로바이오파마가 2024년 11월 '토피메드서방정' 4개 용량을 허가 받은데 이어 같은 해 휴온스, 씨엠지제약 등이 후발주자로 뛰어들었다. 올해는 종근당토피라메이트서방정이 허가 목록에 이름을 올렸다. 토피라메이트 성분 제제가 800억대 항간전제 시장에서 300억원 규모로 가장 많이 처방되고 있으며, 큐덱시서방캡슐의 2023년 유비스트 기준 원외처방액은 35억원이다. 국내 건강보험 급여는 2018년 2월부터 적용되고 있다.2025-07-25 16:35:40이혜경 -
 룬드백 지분 70% 재단 보유...장기 혁신전략 원동력[덴마크 코펜하겐=차지현 기자] "룬드벡은 상장사지만, 전체 주식의 70%를 룬드벡 재단(Lundbeck Foundation)이 보유 중이다. 이런 구조는 룬드벡이 단기적인 주가 변동에 휘둘리지 않고 본질적인 가치에 집중할 수 있는 토대가 됐다. 룬드벡 재단은 사업회사(룬드벡)로부터 받은 배당 수익을 등을 뇌 질환과 신경과학 분야 연구개발(R&D)에 재투자한다." 덴마크 코펜하겐 발뷔에 위치한 룬드벡 본사에서 만난 란 딩(Lan Ding) 기업·포트폴리오 전략 담당 부사장은 거버넌스 체계에 대해 이 같이 말했다. 재단이 뒷받침하는 안정적인 투자 구조가 선순환을 이루며 혁신을 가속화하는 촉진제 역할을 하고 있다는 게 그의 설명이다. 룬드벡은 1915년 설립 이래 오직 뇌질환 치료제에만 집중해온 제약사다. 조현병·우울증 등 정신질환부터 편두통·뇌전증 등 신경계 질환까지 중추신경계(CNS) 질환 전반을 아우르는 파이프라인을 구축했다. 10일 종가 기준 이 회사의 시가총액은 329억 크로네(약 8조원)로, 덴마크 증시 상위 20위권 내에 드는 수준이다. 딩 부사장은 영국 랭커스터대 공급망관리 석사, 런던비즈니스스쿨(LBS) 최고경영자과정(EMBA) 수료 후 글로벌 제약사 글락소스미스클라인(GSK) 등에서 전략과 포트폴리오 관리 업무를 수행해왔다. 그는 올 1월 룬드벡에 합류, 기업·포트폴리오 전략 담당 부사장으로서 회사의 중장기 성장 전략을 이끌고 있다. 룬드벡이 100년 넘게 혁신을 멈추지 않을 수 있던 동력은 무엇일까. 딩 부사장은 그 배경으로 ▲신경과학에 대한 집중 ▲지속적인 R&D 투자 ▲오픈 이노베이션 ▲재단 소유 지배구조 등 네 가지를 꼽았다. 먼저 그는 CNS에만 전념한 선택과 집중 전략을 강조했다. 딩 부사장은 "신경과학에 대한 깊고 흔들림 없는 집중이 룬드벡 혁신의 기반"이라면서 "과학적 통계와 미충족 의료 수요에 기반해 연 매출의 20% 이상을 R&D에 재투자하는 점도 핵심 요소"라고 했다. 오픈 이노베이션 역시 룬드벡의 혁신을 지탱하는 축이다. 룬드벡은 학계, 바이오텍, 환자 단체 등 여러 이해관계자와 전략적 파트너십을 맺으면서 과학적 범위를 넓히고 혁신의 속도를 높이고 있다. 룬드벡은 기술 도입뿐 아니라 성장 가속화를 위한 인수합병(M&A)에도 적극적이다. 지난해 26억 달러 규모로 롱보드 파마를 인수, 뇌전증 신약 후보물질을 확보한 게 대표적인 사례다. 재단 중심 지배구조는 이런 장기 전략을 실행할 수 있는 기반이 된다. 딩 부사장은 "룬드벡 재단이 룬드벡 지분 약 70%를 보유하고 있기 때문에 장기적인 관점에서 안정적인 투자가 가능하다"면서 "룬드벡 재단 자체가 전 세게 신경과학 연구의 주요 후원자"라고도 말 했다. 현재 룬드벡은 선택과 집중형 혁신 전략(Focused Innovator)을 통해 세 가지 핵심 분야에 자원을 투입하고 있다. 자본 배분의 효율성을 높이는 동시에, 장기적으로 지속 가능하고 수익성 있는 성장을 도모하기 위해서다. 딩 부사장은 "룬드벡은 정신질환 분야 오랜 유산을 기반으로 개발을 멈추지 않는 것, 신경 전문 영역에서 입지를 강화하는 것, 희귀 신경질환 분야로 영역을 넓히는 것에 중점을 두고 있다"며 "롱보드 파마 인수, 바이앱티 적응증 확장, PACAP 억제제 등 차세대 신경계 신약 프로그램 등에 집중하고 있다"고 설명했다. 룬드벡은 희귀질환 분야에서 글로벌 경쟁력을 높이기 위해 외부 파트너십 확장도 꾸준히 검토하고 있다. 딩 부사장은 "최근에는 인공지능(AI), 신경면역학(Neuroimmunology), RNA 기반 기술 등 외부 자산과 기술을 적극적으로 탐색하고 있다"면서 "룬드벡은 외부 기관과 협업할 때 과학적 우수성, 당사의 전략적 중점 분야와 적합성, 의미 있는 의료 성과를 도출할 수 있는 가능성 등을 중요하게 살피고 있다"고 했다. 한국을 포함한 아시아 시장도 룬드벡이 주목하는 지역 중 하나다. 앞서 룬드벡은 2021년 10월 국내 에이프릴바이오와 4억4800만달러(약 5370억원) 규모로 자가면역질환 치료제 후보물질 'APB-A1' 기술 도입 계약을 맺었다. 반환 의무가 없는 계약금(업프론트) 1600만 달러(약 190억원), 계발 진행에 따른 단계별 기술료(마일스톤) 최대 4억300만 달러(약 5180억원)의 계약이다. 딩 부사장은 "에이프릴바이오와 계약은 룬드벡이 신경면역학 분야로 확장을 가속화하는 전략적 이정표였다"면서 "룬드벡의 R&D 전략인 바이오마커 기반 실현 가능한(tracable) 개발과 잘 부합하는 프로그램이었다"고 했다. 이어 그는 "APB-A1은 다양한 신경면역 질환에 효과를 낼 수 있는 유망한 후보물질"이라며 "현재 *갑상선 안병증(Thyroid Eye Disease)을 적응증으로 임상 1b상을 진행 중"이라고 덧붙였다. 룬드벡의 사명은 '뇌 건강을 증진하고 삶을 변화시킨다'(advancing brain health and transforming lives)는 것. 딩 부사장은 회사가 항상 이 경영 철학을 모든 전략의 원칙으로 삼고 있다고 언급했다. 딩 부사장은 "룬드벡은 신경과학의 한계를 확장하려는 과학적 혁신을 지향하며, 환자 중심 사고를 모든 의사결정의 출발점으로 삼는다"며 "윤리적이고 책임 있는 연구 수행을 최우선으로 하고, 안전성과 투명성, 연구의 진정성을 중시한다"고 말했다. 이어 그는 "룬드벡은 단기 성과보다는 장기적 영향에 주목하고 여러 이해관계자와 협업을 통해 더 멀리 나아갈 수 있다는 철학을 바탕으로 외부와 연결에도 적극적"이라면서 "이런 원칙은 열정(Passionate), 책임감(Responsible), 진보에 대한 헌신(Committed to progress)이라는 룬드벡의 핵심 가치와 맞닿아 있다"고 했다.[DP스페셜] 덴마크, 글로벌 바이오 허브로 뜨다(4)2025-07-17 06:20:32차지현
룬드백 지분 70% 재단 보유...장기 혁신전략 원동력[덴마크 코펜하겐=차지현 기자] "룬드벡은 상장사지만, 전체 주식의 70%를 룬드벡 재단(Lundbeck Foundation)이 보유 중이다. 이런 구조는 룬드벡이 단기적인 주가 변동에 휘둘리지 않고 본질적인 가치에 집중할 수 있는 토대가 됐다. 룬드벡 재단은 사업회사(룬드벡)로부터 받은 배당 수익을 등을 뇌 질환과 신경과학 분야 연구개발(R&D)에 재투자한다." 덴마크 코펜하겐 발뷔에 위치한 룬드벡 본사에서 만난 란 딩(Lan Ding) 기업·포트폴리오 전략 담당 부사장은 거버넌스 체계에 대해 이 같이 말했다. 재단이 뒷받침하는 안정적인 투자 구조가 선순환을 이루며 혁신을 가속화하는 촉진제 역할을 하고 있다는 게 그의 설명이다. 룬드벡은 1915년 설립 이래 오직 뇌질환 치료제에만 집중해온 제약사다. 조현병·우울증 등 정신질환부터 편두통·뇌전증 등 신경계 질환까지 중추신경계(CNS) 질환 전반을 아우르는 파이프라인을 구축했다. 10일 종가 기준 이 회사의 시가총액은 329억 크로네(약 8조원)로, 덴마크 증시 상위 20위권 내에 드는 수준이다. 딩 부사장은 영국 랭커스터대 공급망관리 석사, 런던비즈니스스쿨(LBS) 최고경영자과정(EMBA) 수료 후 글로벌 제약사 글락소스미스클라인(GSK) 등에서 전략과 포트폴리오 관리 업무를 수행해왔다. 그는 올 1월 룬드벡에 합류, 기업·포트폴리오 전략 담당 부사장으로서 회사의 중장기 성장 전략을 이끌고 있다. 룬드벡이 100년 넘게 혁신을 멈추지 않을 수 있던 동력은 무엇일까. 딩 부사장은 그 배경으로 ▲신경과학에 대한 집중 ▲지속적인 R&D 투자 ▲오픈 이노베이션 ▲재단 소유 지배구조 등 네 가지를 꼽았다. 먼저 그는 CNS에만 전념한 선택과 집중 전략을 강조했다. 딩 부사장은 "신경과학에 대한 깊고 흔들림 없는 집중이 룬드벡 혁신의 기반"이라면서 "과학적 통계와 미충족 의료 수요에 기반해 연 매출의 20% 이상을 R&D에 재투자하는 점도 핵심 요소"라고 했다. 오픈 이노베이션 역시 룬드벡의 혁신을 지탱하는 축이다. 룬드벡은 학계, 바이오텍, 환자 단체 등 여러 이해관계자와 전략적 파트너십을 맺으면서 과학적 범위를 넓히고 혁신의 속도를 높이고 있다. 룬드벡은 기술 도입뿐 아니라 성장 가속화를 위한 인수합병(M&A)에도 적극적이다. 지난해 26억 달러 규모로 롱보드 파마를 인수, 뇌전증 신약 후보물질을 확보한 게 대표적인 사례다. 재단 중심 지배구조는 이런 장기 전략을 실행할 수 있는 기반이 된다. 딩 부사장은 "룬드벡 재단이 룬드벡 지분 약 70%를 보유하고 있기 때문에 장기적인 관점에서 안정적인 투자가 가능하다"면서 "룬드벡 재단 자체가 전 세게 신경과학 연구의 주요 후원자"라고도 말 했다. 현재 룬드벡은 선택과 집중형 혁신 전략(Focused Innovator)을 통해 세 가지 핵심 분야에 자원을 투입하고 있다. 자본 배분의 효율성을 높이는 동시에, 장기적으로 지속 가능하고 수익성 있는 성장을 도모하기 위해서다. 딩 부사장은 "룬드벡은 정신질환 분야 오랜 유산을 기반으로 개발을 멈추지 않는 것, 신경 전문 영역에서 입지를 강화하는 것, 희귀 신경질환 분야로 영역을 넓히는 것에 중점을 두고 있다"며 "롱보드 파마 인수, 바이앱티 적응증 확장, PACAP 억제제 등 차세대 신경계 신약 프로그램 등에 집중하고 있다"고 설명했다. 룬드벡은 희귀질환 분야에서 글로벌 경쟁력을 높이기 위해 외부 파트너십 확장도 꾸준히 검토하고 있다. 딩 부사장은 "최근에는 인공지능(AI), 신경면역학(Neuroimmunology), RNA 기반 기술 등 외부 자산과 기술을 적극적으로 탐색하고 있다"면서 "룬드벡은 외부 기관과 협업할 때 과학적 우수성, 당사의 전략적 중점 분야와 적합성, 의미 있는 의료 성과를 도출할 수 있는 가능성 등을 중요하게 살피고 있다"고 했다. 한국을 포함한 아시아 시장도 룬드벡이 주목하는 지역 중 하나다. 앞서 룬드벡은 2021년 10월 국내 에이프릴바이오와 4억4800만달러(약 5370억원) 규모로 자가면역질환 치료제 후보물질 'APB-A1' 기술 도입 계약을 맺었다. 반환 의무가 없는 계약금(업프론트) 1600만 달러(약 190억원), 계발 진행에 따른 단계별 기술료(마일스톤) 최대 4억300만 달러(약 5180억원)의 계약이다. 딩 부사장은 "에이프릴바이오와 계약은 룬드벡이 신경면역학 분야로 확장을 가속화하는 전략적 이정표였다"면서 "룬드벡의 R&D 전략인 바이오마커 기반 실현 가능한(tracable) 개발과 잘 부합하는 프로그램이었다"고 했다. 이어 그는 "APB-A1은 다양한 신경면역 질환에 효과를 낼 수 있는 유망한 후보물질"이라며 "현재 *갑상선 안병증(Thyroid Eye Disease)을 적응증으로 임상 1b상을 진행 중"이라고 덧붙였다. 룬드벡의 사명은 '뇌 건강을 증진하고 삶을 변화시킨다'(advancing brain health and transforming lives)는 것. 딩 부사장은 회사가 항상 이 경영 철학을 모든 전략의 원칙으로 삼고 있다고 언급했다. 딩 부사장은 "룬드벡은 신경과학의 한계를 확장하려는 과학적 혁신을 지향하며, 환자 중심 사고를 모든 의사결정의 출발점으로 삼는다"며 "윤리적이고 책임 있는 연구 수행을 최우선으로 하고, 안전성과 투명성, 연구의 진정성을 중시한다"고 말했다. 이어 그는 "룬드벡은 단기 성과보다는 장기적 영향에 주목하고 여러 이해관계자와 협업을 통해 더 멀리 나아갈 수 있다는 철학을 바탕으로 외부와 연결에도 적극적"이라면서 "이런 원칙은 열정(Passionate), 책임감(Responsible), 진보에 대한 헌신(Committed to progress)이라는 룬드벡의 핵심 가치와 맞닿아 있다"고 했다.[DP스페셜] 덴마크, 글로벌 바이오 허브로 뜨다(4)2025-07-17 06:20:32차지현 -
 화이자 비강분무제 급성 편두통 치료제 '자브즈프렛'7편: 비강분무 편두통 치료, 3세대 CGRP 수용체 길항제 자브즈프렛(Zavegepant) 자브즈프렛(Zavzpret& 9415;, zav-spret, 성분명: 자베게판트, Zavegepant, 화이자)은 3세대 칼시토닌 유전자 관련 펩타이드(calcitonin gene-related peptide, CGRP) 수용체 길항제로 2023년 3월 미국 FDA에서 편두통 급성치료에 승인을 받았다. 하지만 유럽 EMA에서는 아직 승인되지 않았다. 편두통은 전 세계적으로 높은 유병률을 보이는 신경혈관성 질환으로, 삶의 질 저하와 함께 사회경제적 부담을 초래하는 주요 질환 중 하나이다. 이러한 편두통의 병태생리에는 다양한 신경전달물질과 경로가 관여한다. 이에 따라 칼시토닌 유전자 관련 펩타이드(CGRP)의 중심적인 역할이 주목받고 있다. CGRP는 강력한 혈관확장 작용을 지닌 신경펩타이드로, 삼차신경혈관계(trigeminovascular system)의 활성화와 함께 방출된다. 이어 경막혈관의 확장, 혈관주변 염증(perivascular inflammation) 및 통각수용체를 활성화시켜 편두통을 유발한다. 이러한 CGRP를 표적으로 하는 약제로는 소분자 CGRP 수용체 길항제(Gepants)와 CGRP 수용체를 표적하는 단클론 항체(monoclonal Antibody)가 있다. 최초의 Gepant는 2019년 미국 FDA 승인을 받은 유브로게판트(Ubrogepant)이며, 이후, 리메게판트(Rimegepant), 아토게판트(Atogepant) 및 자베게판트(Zavegepant)가 승인되었다. 자베게판트는 편두통 급성치료제로 승인 근거가 된 3상 임상에서, 1차 평가변수인 투약 2시간 후 통증의 완전한 개선을 달성한 환자의 비율이 자베게판트군에서 24%, 위약군에서 15%였다. 편두통 완화 효과는 빠르면 투약 15분 만에 나타났으며, 경구제제에 비해 빠른 효과를 보였다. Gepant 계열 약제는 스테로이드를 기반으로 하지 않으며, CGRP 수용체를 선택적으로 차단한다. 이들은 기존 Triptan 계열 약제와 달리 혈관 평활근의 5-HT₁B 수용체를 자극하지 않아 직접적인 혈관수축을 유발하지 않으며, 심혈관계 질환자에게서도 비교적 안전한 치료 대안으로 간주된다. 이러한 약리학적 특성은 편두통 치료에 있어 비스테로이드성, 비혈관수축성 기전에 기반한 새로운 치료 전략을 가능하게 하였다. 편두통의 발생 기전은 무엇인가? 전통적으로는 혈관 확장이 편두통의 주요 원인으로 간주되었으나, 최근의 연구들은 신경계의 기능적 이상, 혈관 반응, 면역계 및 후성유전적 조절이 상호 작용하는 복합 질환임으로 설명하고 있다. 현대 편두통 기전의 핵심은 삼차신경혈관계(trigeminovascular system, TGVS)의 활성화이다. TGVS는 해부학적으로 경막 혈관을 지배하는 감각 신경들로 이루어져 있으며, 이 감각 신경들의 세포체는 삼차신경절(trigeminal ganglion)에 위치한다.(Figure 1) 기능적으로 TGVS는 혈관 및 경막의 감각 자극을 감지하고, 이 정보를 중추신경계로 전달하며, 동시에 칼시토닌 유전자 관련 펩타이드(calcitonin gene-related peptide, CGRP)와 같은 염증 매개 신경펩타이드를 방출하여 신경성 염증 및 통증 전달을 조절하는 역할을 수행한다. 이 체계가 활성화되면 CGRP의 분비가 증가하고, 경막혈관의 확장이 유도된다. 얼굴과 머리의 통증은 주로 삼차신경의 첫 번째 가지인 눈신경(ophthalmic division)의 통각 구심성 신경(nociceptive afferents)에 의해 매개된다. 경막 감각 신경(meningeal sensory afferents)이 활성화되면, 이 자극은 삼차신경 척수핵(trigeminal nucleus caudalis)로 전달되며, 이후 통증 지각에 관여하는 전방 뇌 구조물(rostral brain structures)까지 전달된다. 이 과정에서 삼차신경 말단에서 CGRP, Substance P, Neurokinin A와 같은 신경펩타이드가 방출되며, 혈관 확장과 함께 신경인성 염증(neurogenic inflammation)을 유발한다. 이러한 신경-혈관 반응은 말초 통각 수용기의 민감도를 증가시키고, 시간이 경과함에 따라 중추 감작(central sensitization)으로 진행되어 두통의 지속 시간과 통증 강도를 증가시킨다. 중추 감작은 시상, 대뇌피질, 삼차신경계 신경핵에서 일어나며, 이로 인해 광선공포증, 음향공포증, 피부 과민(allodynia)과 같은 감각 과민 증상이 동반된다. 또한 일부 환자에서 관찰되는 전조증상(aura)은 대뇌 피질에서 시작되는 피질 확산성 탈분극(cortical spreading depression, CSD)과 연관되며, 이는 시각피질에서부터 후두엽을 따라 진행되는 전기적 흥분 억제 현상으로 정의된다. CSD는 삼차신경계 자극과 혈관 반응을 촉진하며, 전조가 없는 환자에서도 유사한 신경생리학적 현상이 존재할 수 있음이 보고되고 있다. 따라서, 삼차신경 내에서 가장 풍부하게 발현되는 신경펩타이드는 CGRP이며, 이는 삼차신경절 뉴런의 약 35~50%에서 발현된다. CGRP는 편두통 발작 중 정맥 내 농도가 유의하게 증가함이 확인되면서 중요한 병태생리적 매개 인자로 주목받고 있다. CGRP는 혈관을 확장시키고, 비만세포로부터 히스타민 분비를 유도하며, 신경절 내 질산 생성도 촉진하는 역할을 한다. CGRP(Calcitonin gene-related peptide, 칼시토닌 유전자-관련 펩타이드)는 어떤 물질인가? CGRP는 1982년, 칼시토닌 유전자(CALCA)의 mRNA 대체 스플라이싱을 통해 신경조직에서 유래된 37개의 아미노산 잔기로 구성된 신경펩타이드로 처음 분리되었으며, α-CGRP로 명명되었다. 이후 CALCB 유전자로부터 유래되는 β-CGRP가 추가로 밝혀졌고, 인간에서는 이 두 아이소폼이 모두 존재한다. 이 중 병리적 의미에서 가장 주목받는 형태는 α-CGRP이며, 이는 특히 삼차신경 감각 신경계 및 통각 전달 경로에서 핵심적인 역할을 하는 것으로 알려져 있다. CGRP는 중추신경계(CNS)와 장신경계(enteric nervous system)에 광범위하게 발현되며, 수용체와의 결합을 위해 8~18번째 아미노산에 걸쳐 형성된 양친매성(양소수성) α-나선(amphiphilic α-helix) 구조를 가진다. CGRP 수용체는 조직별로 다양한 아형(subtypes)을 가지는 것으로 밝혀졌으며, 이는 약리학적 반응의 차이를 설명한다. 분자생물학적으로는 G 단백질 연결 수용체(GPCR) B 계열에 속하는 칼시토닌 유사 수용체(calcitonin-like receptor, CLR)가 RAMP(receptor activity-modifying protein)와 이합체를 형성하여 수용체의 기능적 특성이 결정된다. 예를 들어, CLR& 8211;RAMP1 복합체는 CGRP 수용체로, CLR& 8211;RAMP2 복합체는 아드레노메둘린(adrenomedullin) 수용체로 작용한다. 또한 RCP(receptor component protein)는 cAMP 신호전달 경로 활성화에 필수적인 요소로 작용한다. 편두통 병태생리에서 CGRP는 특히 삼차혈관계와 밀접하게 연관된다. 삼차신경절(trigeminal ganglion)에 위치한 감각성 위단극성 뉴런(pseudounipolar sensory neuron)은 두개내 혈관 및 경막(dura)을 지배하며, 중심축삭은 삼차경부 복합체(trigeminocervical complex)로 투사되어 시상(thalamus) 및 고차 대뇌 피질로 통각 정보를 전달한다. CGRP의 분비는 주로 Ca²& 8314;-의존적인 소포성 경로를 통해 이루어진다. 감각 신경 말단에 활동전위가 도달하면 전압의존성 칼슘 채널이 개방되고, 세포 내 Ca²& 8314; 농도가 급증한다. 이는 SNARE(soluble NSF attachment protein receptor) 복합체를 활성화시켜, CGRP가 저장된 소포가 세포막과 융합한 후, 외포작용(exocytosis)을 통해 CGRP가 분비된다. 이러한 기전을 표적으로 한 여러 치료 전략이 임상적으로 활용되고 있다. 예를 들어, 트립탄 계열 약물은 세로토닌 5-HT₁B/₁D 수용체를 자극하여 presynaptic 칼슘 유입을 차단함으로써 CGRP 분비를 억제한다. 또한 보툴리눔 톡신 A형은 SNARE 복합체의 핵심 구성요소인 SNAP-25를 절단하여 소포 융합 자체를 저해함으로써 CGRP의 방출을 차단한다. 그러나 최근 연구에서는 이러한 전통적인 Ca²& 8314; 및 SNARE 의존 경로와는 별개의 CGRP 분비 경로의 존재 가능성이 제기되고 있다. 특히 감각 신경의 근위 축삭 말단(proximal axon terminal)에서는 외포 경로에 의존하지 않는 CGRP 분비가 확인되었으며, 이 부위에서는 트립탄(Triptan)이나 보툴리눔 톡신(botulinum toxin)에 대한 반응성이 낮은 것으로 나타났다. 이러한 발견은 기존 치료제에 반응하지 않는 일부 편두통 환자의 존재를 설명하며, 단순한 분비 차단을 넘어, 수용체 수준에서의 CGRP 신호 전달 억제가 보다 효과적인 치료 전략이 될 수 있음을 시사한다. CGRP는 편두통에 어떤 영향을 미치는가? 삼차신경혈관계(TGVS)를 구성하는 비수초화 감각 C 섬유(unmyelinated sensory C fibers)는 주로 경막과 뇌혈관에 분포하며, 그 축삭은 척수 및 뇌간의 삼차신경 척수로핵(spinal trigeminal nucleus caudalis)까지 연장되어 시냅스를 형성한다. 이들 섬유는 CGRP를 풍부하게 발현하고 있으며, 편두통 발작 시 CGRP의 방출이 핵심 병태생리 기전이라는 가설을 뒷받침한다. 실제로 편두통 환자에서는 혈중 CGRP 농도가 유의하게 상승하며, 건강한 피험자에게 외인성 CGRP를 투여할 경우 편두통 유사 증상이 유발된다는 보고를 통해, CGRP의 병인적 역할이 점차 명확히 규명되고 있다. CGRP는 주로 혈관 평활근과 삼차신경 말단에 존재하는 CGRP 수용체(CGRP receptor, CGRP-R)를 통해 작용한다. 이러한 수용체는 중간 경막 동맥, 중대뇌동맥, 연질막 동맥, 천측 측두 동맥 등 주요 뇌혈관뿐만 아니라, 경막과 비강 부위를 지배하는 삼차신경 말단에도 분포하고 있어, CGRP가 말초에서 직접 작용하여 편두통을 유발함을 시사한다. 편두통 발작 시 CGRP는 삼차신경계의 다양한 부위(경막의 구심성 말단, 삼차신경절 내 세포체, 연수 및 척수로 투사되는 원심성 섬유)에서 방출된다. 이 과정은 신경성 염증과 통증 전달 경로의 활성을 유도하는 중요한 기전으로 작용한다. 특히 CGRP는 경막 내 비만세포(mast cells) 및 대식세포(macrophages)를 유인하고, 국소 염증 반응을 촉진하여 통증 유발 환경을 조성한다. 또한 CGRP는 삼차신경절 내 뉴런과 교세포(glial cells)를 활성화시켜 역행성 신호 전달(retrograde signaling)을 유도하고, 이는 말초 통각 수용기의 민감도를 증가시켜 말초 감작(peripheral sensitization)을 유발한다. 이러한 변화는 척수 배측각(dorsal horn)과 삼차신경 척수로핵에서의 중추 감작(central sensitization)으로 이어져, 통증 역치의 저하 및 과민 반응(hypersensitivity)을 유발하게 된다. 더 나아가, CGRP는 삼차신경절 내 위성 교세포(satellite glial cells)를 자극하여 염증성 사이토카인과 신경영양인자(예: BDNF)의 분비를 촉진하고, 이들 분비물은 다시 뉴런의 CGRP 발현을 증가시키는 파라크린(paracrine) 기전을 형성하여 삼차신경계의 흥분성과 감작을 증폭시킨다. CGRP는 혈액-뇌 장벽(BBB)을 직접 통과하지는 않지만, 말초에서의 작용을 통해 중추 통각 경로(시상, 대상회, 대뇌 피질 등)에 간접적으로 영향을 미치며, 삼차신경핵 후방부(nucleus caudalis)로의 투사를 통해 글루타메이트(glutamate) 방출을 증가시켜 통증 전달을 더욱 강화하는 것으로 알려져 있다. 편두통 치료제 중 국내에서 승인된 어떤 약제들이 있는가? 편두통 치료에는 다양한 약제가 사용되며, 급성기 치료에는 비스테로이드성 항염증제(NSAIDs)와 경구용 세로토닌(5-하이드록시트립타민) 수용체 1B/1D 작용제인 트립탄이 사용된다. 반면, 항경련제, 항우울제, 항고혈압제, 보툴리눔 독소 등의 약물은 편두통 예방 목적으로 사용된다. 이러한 약제 중 상당수는 편두통 치료를 위해 특별히 개발된 것이 아니며, 다양한 부작용을 유발할 수 있고 작용 기전도 명확하지 않다. 또한 복약 순응도의 저하와 잦은 치료 변경으로 인해 이들 약물의 효과적인 사용에는 한계가 있다. 1. 예방 치료토피라메이트(Topiramate)토피라메이트는 편두통 예방 치료의 1차 선택약제로 고려되며, 전간 치료에 사용하는 용량보다 낮은 1일 용량에서도 효과를 보인다. 이 약제는 삽화 편두통(episodic migraine)뿐만 아니라 만성 편두통 환자의 예방 치료에도 효과적인 것으로 입증되었으며, 약물 과용 두통이 동반된 경우에도 유용하게 사용될 수 있다. 가장 흔한 부작용은 손발 저림(paresthesia)이며, 이 외에도 집중력 저하, 피로, 식욕 감소, 구역, 설사, 감각 저하, 복통 등의 부작용이 나타날 수 있다. 장기간 투여 시 체중 감소와 신결석이 발생할 수 있다. 플루나리진(Flunarizine) 플루나리진은 칼슘채널차단제 중 비선택적 칼슘 통로 차단제로, 편두통 치료에 승인된 약물이다. 이 약제는 여러 임상시험에서 그 효과가 입증되었으며, 부작용으로는 체중 증가, 졸림, 구강 건조, 어지러움, 저혈압 등이 나타날 수 있다. 특히 장기간 투여 시 약물 유발 파킨슨 증후군(추체외로계 부작용)을 유발할 수 있으므로, 보행이 느려지거나 손떨림 증상이 발생하면 즉시 투약을 중단해야 한다. 보툴리눔 독소 A형(Botulinum toxin A, BoNT-A) 보툴리눔 독소 A형(botulinum neurotoxin type A, BoNT-A)은 강력한 신경독소로, 혐기성 세균인 Clostridium botulinum에 의해 생성된다. 이 독소는 신경근 접합부에서 아세틸콜린의 분비를 차단함으로써 이완성 근마비를 유발한다. BoNT-A는 미국 FDA 및 국내에서 만성 편두통의 예방 치료제로 승인되었으며, 기존의 예방 약물에 반응하지 않는 만성 편두통 환자에서 선택적 치료 옵션이 될 수 있다. BoNT-A는 수개월간 지속되는 일시적인 화학적 탈신경(chemodenervation)을 유도하여, 전신적 부작용 위험은 최소화하면서 국소적으로 근육, 한선, 수축근 등의 기능을 감소시키거나 억제한다. 이 약제는 최초로 원숭이 모델에서 사시의 비수술적 치료를 위한 연구 중에 임상 적용 가능성이 보고되었다. BoNT-A는 연접전 신경 종말에 결합하여 아세틸콜린 분비를 차단함으로써 사시, 안검경련, 편측 안면경련, 경부 근긴장이상 등 과도한 근수축과 관련된 질환에 효과적이다. 최근에는 편두통을 포함한 다양한 형태의 두통, 요부 통증, 근막통증 증후군 등의 치료에 적용되고 있으며, 이는 단순한 근육 이완에 따른 이차적 진통 효과를 넘어서는 추가적인 작용 기전이 있음을 시사한다. BoNT-A는 말초 구심성 신경 말단에서 CGRP, substance P, glutamate 등의 통각 매개 물질 분비를 억제함으로써, 중추 삼차신경혈관계의 감작(sensitization)을 차단하는 기전을 통해 편두통 치료 효과를 발휘하는 것으로 알려져 있다. 2. 급성기 치료 에르고타민(Ergotamine) 복합제 국내에서는 단일 성분의 Ergotamine 제제는 없으며, Ergotamine tartrate와 Caffeine의 복합제 형태로만 처방된다. 이 약제는 세로토닌 수용체인 5-HT₁ 및 5-HT₂ 수용체에 작용하여 혈관을 수축시키고, 경막의 신경성 염증을 억제하는 효과가 있다. 혈관 수축 및 평활근 수축 작용을 가지므로, 말초혈관질환, 관상동맥질환, 신장 또는 간 기능 이상, 임신, 조절되지 않는 고혈압 등의 기저 질환이 있는 환자에게는 사용을 피해야 한다. 경구 투여 시 흡수가 느리며, 구역, 구토, 복통, 손 저림, 설사 등의 위장관계 및 말초신경계 부작용이 나타날 수 있고, 드물게 사지 괴사와 같은 중대한 이상반응이 발생할 수 있다. 남용 시 약물 과용 두통(medication-overuse headache, MOH)으로 진행할 수 있으므로, 사용 빈도는 1주일에 2회 이하로 제한하는 것이 권장된다. 이 약제는 편두통 급성기 치료에서 작용 지속 시간이 길어 재발률이 낮기 때문에, Triptan 제제를 사용한 후 재발이 문제가 되는 경우 효과적인 대안이 될 수 있다. 그러나 구역 및 구토 등 부작용이 흔하고, 독성 및 오용의 위험이 더 높다. Triptan 제제와는 병용해서는 안 되며, Triptan 복용 후 12시간이 경과한 이후에만 안전하게 사용할 수 있다. Triptan제(5-HT1B/1D 수용체 작용제) Triptan 계열 약제에는 수마트립탄(Sumatriptan), 졸미트립탄(Zolmitriptan), 나라트립탄(Naratriptan), 프로바트립탄(Frovatriptan), 알모트립탄(Almotriptan) 등이 있으며, 경구제, 피하주사제, 비강 내 투여제 등 다양한 제형으로 제공된다. 이들 약제는 세로토닌 수용체인 5-HT₁B/₁D 수용체에 선택적으로 작용하여, 확장된 두개혈관을 수축시키고, 혈관 주위 삼차신경 말단에서 신경펩타이드의 방출 및 삼차신경원의 활성화를 억제함으로써 신경인성 염증반응을 차단한다. 이들 약제는 유사한 약리학적 기전을 공유하지만, 생체이용률(bioavailability), 혈중 반감기(half-life), 지방 친화도(lipophilicity), 약물상호작용(drug interactions) 등 약동학적 특성에서 차이를 보이므로, 각 환자의 편두통 양상에 따라 개별적으로 선택되어야 한다. 예를 들어, Tmax(최고 혈중농도에 도달하는 시간)가 짧을수록 약효 발현이 빠르고 급성기에 효과적이며, 반감기가 길수록 재발 빈도가 낮아지는 경향이 있다. Triptan 계열 약제는 모두 5-HT₁B/₁D 수용체에 선택적으로 작용하기 때문에, 기존의 비특이적 편두통 치료제에 비해 전신적 부작용이 적은 것이 장점이다. 그러나, 일시적으로 박동감, 저림, 비정상적인 감각, 흉부 압박감, 열감, 작열감, 냉감 등의 감각 이상 증상과 함께, 구역, 어지러움, 졸음, 피로감 등이 발생할 수 있다. 이들 약제는 심장 관상동맥의 수축을 유발할 수 있으므로, 허혈성 심질환(협심증, 심근경색, 심근 허혈 등), 심장판막 질환, 부정맥(특히 빈맥) 등의 심혈관 질환이 있는 환자에게는 투여하지 않는다. 또한, 관상동맥 질환의 위험인자(당뇨병, 고혈압, 고지혈증, 가족력, 흡연 등)를 보유한 환자에게는 주의하여 사용하거나 가능한 경우 다른 약제로 대체하는 것이 바람직하다. 또한, 에르고타민과 병용하거나 짧은 간격을 두고 투여하면 심각한 혈관 수축이 발생할 수 있으므로, 이들 약물과의 중복 투여는 피해야 한다. 아울러, SSRI(선택적 세로토닌 재흡수 억제제) 또는 SNRI(세로토닌-노르에피네프린 재흡수 억제제)를 복용 중인 환자에게는 세로토닌 증후군(serotonin syndrome) 발생 위험이 있으므로 주의가 필요하다. 이 증후군은 마비, 과다 반사, 운동 실조, 빈맥, 진전, 발한, 불안초조 등의 증상으로 나타날 수 있다. Ditan제(5-HT1F 수용체 작용제) 라스미디탄(Lasmiditan, 제품명: 레이보우정, Leyvow& 9415;)은 최초의 경구용 선택적 5-HT₁F 수용체 작용제(Ditan 계열)로, 현재 국내에서는 ‘전조 증상의 동반 여부와 관계없이 편두통의 급성 치료’ 적응증으로 승인되어 있다. 5-HT₁F 수용체는 삼차신경절, 삼차신경핵, 뇌혈관 등에 분포하며, 5-HT₁B 수용체와 달리 혈관 수축을 유발하지 않는 선택성을 가지기 때문에, Triptan 계열 약제에 비해 심혈관계 안전성이 높은 것이 특징이다. 또한, 5-HT₁F 수용체는 경막 주위에서의 신경인성 염증 억제와 삼차신경핵 내 신경세포 활성도 감소를 통해 항편두통 효과를 발휘한다. 라스미디탄은 두통 완화율 및 완전 관해율 측면에서 위약 대비 유의한 치료 효과를 보였으며, 기존 Triptan 계열 약제에 반응하지 않던 환자군에서도 효과가 입증되었다. 무엇보다 Triptan 계열에서 흔히 나타나는 혈관 수축에 의한 심혈관계 부작용의 위험이 현저히 낮은 것이 중요한 장점으로 평가된다. CGRP 관련 약제 편두통 발병 과정에서 CGRP의 역할에 대한 이해는 CGRP 및 그 수용체를 표적으로 하는 약물의 개발로 이어졌다. 여기에는 CGRP 수용체를 표적하는 단클론 항체들과 CGRP 수용체 길항제 계열약제(Gepants)가 있다.(Figure 3) 이들 약제는 표적 분자 및 치료 전략은 유사하지만, 약물 구조, 투여 방식, 작용 지속 시간 및 대사 경로 등에서 본질적인 차이를 보인다. 단클론 항체는 생물학적 제제로서 한 달 이상 작용할 수 있으며, 피하주사로 투여되며 면역학적 반응을 유발할 가능성이 있다. 반면 소분자 약제는 빠른 작용과 경구/비강 투여의 편의성을 바탕으로 급성기 치료에 적합하며, 간에서 대사되고 전신 반감기가 짧은 특징이 있다. 이들 약제는 Triptan과 작용 기전이 달라, 기존 약물에 반응이 없거나 부작용·금기가 있는 환자에서 대안으로 고려될 수 있다. CGRP 단클론 항체(monoclonal antibody, mAb)는 어떤 약제인가? CGRP는 말초뿐 아니라 중추신경계에서도 편두통의 유발 및 지속에 기여하는 신경펩타이드이다. 편두통 발작 시 환자의 혈중 및 타액 내 CGRP 농도가 유의하게 상승하는 것이 보고되었으며, 이러한 병태생리적 기전을 바탕으로 개발된 CGRP 표적 단클론 항체(mAb는 편두통 예방 치료에 새로운 전기를 마련한 치료 전략으로 주목받고 있다. 이들 단클론 항체는 분자량이 매우 커 혈액-뇌 장벽(BBB)을 거의 통과하지 못하며, 주로 경막, 뇌혈관, 삼차신경절 등 말초 삼차신경계 구조를 표적으로 작용한다. 이러한 특성은 중추신경계에 대한 비특이적 영향을 최소화하면서 병리적 말초 경로에 선택적으로 작용할 수 있는 기전을 제공하며, 이에 따라 중추 관련 부작용을 감소시킬 수 있다는 중요한 임상적 이점을 갖는다. 현재까지 개발된 CGRP 관련 항체는 크게 두 가지 계열로 나뉜다. CGRP 수용체를 표적으로 하는 에레누맙(Erenumab)은 수용체에 가역적으로 결합하여 리간드와의 결합을 차단하고, 반면 CGRP 리간드 자체를 중화하는 프레마네주맙(Fremanezumab), 갈카네주맙(Galcanezumab), 엡티네주맙(Eptinezumab)은 CGRP 펩타이드에 직접 결합하여 기능적 차단을 유도한다. 이들 약제는 모두 미국 FDA로부터 편두통 예방 치료제로 승인되었으며, 특히 에레누맙은 2018년, 만성 및 삽화성 편두통 모두에 대해 최초로 승인된 단클론 항체이다. 국내에서는 프레마네주맙(아조비& 9415;)과 갈카네주맙(앰갈리티& 9415;)이 편두통 예방 적응증으로 승인되어 사용되고 있다. 단클론 항체의 월 1회 또는 분기 1회 투여만으로도 치료 효과를 유지할 수 있다는 점이며, 이는 기존 예방 약제에 비해 복약 순응도 향상 및 지속적 관리의 용이성 측면에서 큰 이점을 제공한다. 또한, 높은 선택성과 긴 반감기를 기반으로 비특이적 신경계 억제 없이 표적 경로에 집중된 효과를 유도한다는 점에서 기존 예방제들과 차별화된다. CGRP는 강력한 혈관 확장 작용 외에도 혈류 조절, 염증 반응 조절, 조직 보호 등 다양한 생리적 기능에 관여한다. 일부 연구에서는 CGRP가 고혈압 상태에서 혈관을 보호하는 보상 기전으로 작용할 수 있으며, 이에 따라 고혈압 환자에서의 장기적 차단이 잠재적 위험이 될 수 있다는 우려가 제시되고 있다. 그럼에도 불구하고, 현재까지의 임상시험 결과는 이러한 항체 치료제가 Triptan 또는 CGRP 길항제와 비교해도 관상동맥 연축이나 심혈관계 중대한 부작용 없이 안전하게 사용 가능함을 보여주고 있다. 이처럼 CGRP 단클론 항체 치료제는 높은 표적 선택성, 낮은 투여 빈도, 우수한 안전성 프로파일을 바탕으로 편두통 예방 치료의 새로운 기준을 제시하고 있으며, 향후에는 장기적 안전성 평가 및 고위험군 환자에 대한 적용 가능성에 대한 후속 연구가 요구된다. CGRP 수용체 길항제(CGRP receptor antagonists)는 어떤 약제인가? 기존의 대부분 편두통 예방 치료제는 흥분성 신경전달물질(예: glutamate)의 방출을 억제하거나 신경세포의 흥분성을 낮추어 빠른 시냅스 전달(fast synaptic transmission)을 차단함으로써 효과를 나타낸다. 반면, CGRP 경로를 표적으로 하는 약제는 느린 신경조절(slow neuromodulation)에 관여하며, 신경활성도 자체를 조절함으로써 편두통의 발생을 억제하는 새로운 작용 기전을 가진다. CGRP는 일반적으로 세포 내 Ca²& 8314; 유입에 의해 활성화되는 SNARE 단백질 복합체를 통해 분비되며, 이는 소포의 세포막 도킹 및 융합을 통한 Ca²& 8314; 의존적 외포(exocytosis) 과정이다. Triptan 계열 약제는 Ca²& 8314; 신호전달을 억제하고, 보툴리눔 톡신 A형은 SNARE 복합체의 핵심인 SNAP-25 단백질을 절단하여 CGRP 분비를 차단한다. 그러나 일부 감각 신경 말단에서는 이와 무관한 비전형적 CGRP 분비 경로가 존재하는 것으로 보고되어, 기존 약제가 효과를 보이지 않는 일부 환자군의 기전을 설명하는 데 기여하고 있다. 이러한 한계를 극복하기 위해 개발된 것이 Gepant 계열의 약제들이다. Gepants는 소분자 CGRP 수용체 길항제로서, 주 수용체 복합체인 CLR:RAMP1(canonical CGRP receptor)에 대해 높은 친화도를 가지며, 아드레노메둘린 수용체(adrenomedullin receptors, CLR:RAMP2 또는 CLR:RAMP3)에는 거의 결합하지 않는다. 1세대 Gepant인 텔카게판트(Telcagepant)와 올세게판트(Olcegepant)는 CGRP 수용체에 대한 효능을 입증했으나, 간독성 문제와 제형 개발의 어려움으로 인해 상용화되지 못했다. 이후 개발된 2세대 gepants는 간 독성이 없고 경구용 제형으로 임상적 유용성이 높아졌다. 2세대 Gepant인 유브로게판트(Ubrogepant), 리메게판트(Rimegepant), 아토게판트(Atogepant)는 경구 투여 제형이며, 각각 급성 치료(유브로게판트), 예방 치료(아토게판트), 또는 두 가지 모두(리메게판트)를 위해 개발되었다. 이들 약제는 효과적이며 간 독성을 보이지 않는다. 미국 FDA는 2019년 우브로게판트(Ubrogepant)를 ‘급성 편두통 치료’, 2020년 리메가판트(Rimegepant)를 ‘편두통 예방 및 급성 치료’, 2021년 아토게판트(Atogepant)를 ‘편두통 예방’에 승인하였다. 국내에서는 리메게판트(Rimegepant, 제품명: 너텍 구강붕해정, Nurtec ODT& 9415;)는 ‘1. 성인에서의 전조증상을 수반하거나 수반하지 않는 편두통의 급성치료 2. 성인에서의 삽화성 편두통의 예방’, 아토게팜트(Atogepant, 제픔명: 아큅타, Aquipta& 9415;)는 ‘성인 18세 이상)에서의 편두통의 예방’에 승인되어 있다. 3세대 Gepant로 분류되는 자베게판트(Zavegepant)는 최초의 비강 분무형 CGRP 수용체 길항제로 개발되었으며, 2023년 3월 미국 FDA로부터 급성기 편두통 치료제로 승인되었다. 이 약제는 비강분무제형(nasal spray)으로 속효성을 장점으로 하며 리메가판트(Rimegepant)와 동일 회사 약제이다. ODT(Orally Disintegrating Tablet)는 경구 투여제형으로 편리성과 예방/치료의 이중 용도가 장점인 반면, 급성 발작 시 구토, 오심 등으로 경구 복용이 어려운 환자가 존재한다. 이에 반해 구강 흡수가 필요 없는 비강분무제는 급성기에서 더 빠르고 효과적으로 작용한다. 자베게판트는 어떤 약제인가? 자베게판트(Zavegepant, 제품명: 자브즈프렛 비강분무제, Zavzpret& 9415;)는 CGRP 수용체에 선택적으로 결합하는 3세대 소분자 비펩타이드형 길항제(small-molecule non-peptide antagonist)로, 비강 투여(intranasal administration)를 목적으로 개발된 최초의 Gepant 계열 약제이다. 자베게판트는 기존 Gepant 계열 약제들과 유사한 구조적 골격을 공유하지만, 비강용 스프레이(nasal spray) 제형으로 개발되어 속효성(rapid onset)을 극대화하기 위한 약물 전달 전략(drug delivery strategy)의 일환으로 설계되었다. 이는 특히 편두통 발작 시 구역 및 구토 증상으로 인해 경구 약물 복용이 어려운 환자군에서 유용한 치료 대안으로 평가된다. 전임상 연구에서는 자베게판트가 인간 세포막에 발현된 CGRP 수용체에 대한 강력한 결합 억제 활성을 나타냈으며, 또한 인간 두개내 동맥(intracranial artery)의 ex vivo 모델에서 CGRP 유도 혈관 확장을 완전하고 강력하게 억제하는 효과가 확인되었다. 자베게판트는 1회 투여량 10mg으로, 하루 1회 사용이 권장되며, 월 8회 초과 사용 시 안정성은 아직 확립되지 않았다. 따라서 사용 빈도에 대한 주의가 필요하다. 자베게판트의 약리 기전은? 자베게판트(Zavegepant)는 이 CGRP 수용체에 대해 고친화성(high affinity) 및 고선택성(high selectivity)을 나타내는 경쟁적 길항제(competitive antagonist)로, CGRP의 결합을 방해하여 해당 신호전달 경로(signal transduction pathway)를 차단한다. 수용체 차단 시, Gαs 단백질을 통한 아데닐산 고리화효소(adenylyl cyclase) 활성화가 저해되고, 이로 인한 세포내 cAMP 생성 감소는 혈관 확장을 억제하며, substance P, neurokinin A 등의 염증성 신경전달물질의 방출을 저해하는 효과를 나타낸다. 자베게판트는 기존의 경구용 Gepant 계열 약제와 달리, 비강 점막(nasal mucosa)을 통한 투과율이 우수하도록 설계되었다. 비강 분무 후 15~30분 이내에 혈중 최고 농도(Cmax)에 도달하며, 일회통과 대사(first-pass metabolism)를 회피함으로써 절대 생체이용률(bioavailability)이 높고, 보다 빠른 약효 발현이 가능하다. 또한 Gepant 계열 약제는 일반적으로 지용성(lipophilic)이 강해 체내 지방조직에 축적되는 경향이 있으며, 이로 인해 고체중 환자에서 유효 혈중 농도 감소 및 치료 반응 저하가 보고될 수 있다. 반면, 자베게판트는 비강 점막을 통한 국소 삼차신경 말단 전달이 가능하므로, 체중에 영향을 받지 않는 균일한 치료 효과가 기대된다. 자베게판트는 일부 혈액-뇌장벽(BBB)을 통과할 수 있는 것으로 알려져 있으며, 이에 따라 말초뿐 아니라 중추의 CGRP 수용체에도 작용 가능성이 제기되고 있다. 그러나 대부분의 약리 작용은 말초 삼차신경계 및 경막혈관계 수준에서 이루어진다. 혈장 단백 결합율은 중등도(moderate)이며, 체내 조직 분포(distribution)는 빠르고 광범위한 것으로 보고되었다. 자베게판트(ZAVZPRET& 9415;)의 허가임상은 어떠한가? 성인에서 전조(aura)의 유무와 관계없이 급성 편두통 치료를 위한 ZAVZPRET의 유효성은, 두 건의 무작위배정, 이중눈가림, 위약대조 임상시험(Study 1 및 Study 2)을 통해 입증되었다. 두 연구 모두에서, 환자들은 중등도에서 중증의 편두통 발작 발생 시 시험약을 투여하도록 지시받았으며, 구제 약물(예: NSAIDs, 아세트아미노펜, 항구토제)은 초기 투여 후 2시간 이후부터 허용되었다. 반면, Triptan 등 다른 형태의 구제 약물은 초기 투여 후 48시간 이내 사용이 제한되었다. Study 1 및 Study 2에서 각각 13.4% 및 13.6%의 환자가 연구 시작 당시 편두통 예방 약물을 복용 중이었으나, CGRP 경로에 작용하는 예방 치료제는 포함되지 않았다. Study 1에서는 환자들이 ZAVZPRET 10mg(n=623) 또는 위약(n=646)을 단회 투여받도록 무작위 배정되었다. ZAVZPRET의 유효성은 투여 후 2시간 시점에서의 두통 완전 소실(pain freedom)과 가장 성가신 증상(MBS, Most Bothersome Symptom) 소실이라는 공동 주요 평가변수(co-primary endpoints)에서 위약 대비 통계적으로 유의한 개선 효과를 보이며 입증되었다. 두통 완전 소실은 중등도 또는 중증의 두통이 무통 상태로 완화된 것으로 정의되며, MBS 소실은 환자가 사전에 보고한 가장 성가신 증상(예: 광공포증, 음향공포증, 오심) 중 해당 증상이 투여 2시간 후 소실된 경우로 정의되었다. 투약 직전 가장 흔한 MBS는 광공포증(photophobia, 55%), 오심(nausea, 28%), 음향공포증(phonophobia, 16%) 순으로 보고되었다. 결과적으로, Study 1에서 ZAVZPRET를 투여받은 환자군은 위약군에 비해 단일 투여 2시간 후 두통 완전 소실 및 MBS 소실을 달성한 비율이 통계적으로 유의하게 높았다(Table 2 참조). Study 1에서는 ZAVZPRET가 위약에 비해 다음과 같은 추가적인 유효성 평가 지표에서도 통계적으로 유의한 효과를 보였다: 투여 2시간 후 통증 완화, 투여 2시간 후 정상적인 기능 회복, 투여 2~48시간 동안 지속적인 통증 소실(Table 3 참조), 투여 2시간 후 음향과민 및 광과민 소실. 여기서 통증 완화(pain relief)는 편두통 통증의 강도가 중등도 또는 중증에서 경도 또는 무통 상태로 완화된 것을 의미한다. 또한, 투여 2시간 후 정상적인 기능 회복(normal function)에 대한 평가는 단일 항목 설문지를 통해 측정되었으며, 환자들은 아래 네 가지 중 하나를 선택하도록 하였다: 정상적인 기능(normal function), 경미한 기능 장애(mild impairment), 심한 기능 장애(severe impairment), 침상 안정이 필요한 상태(required bedrest). ZAVZPRET 10mg 투여 후 광공포증 및 음향공포증의 발생률은 위약에 비해 감소하였다. Study 2에서는 환자들이 ZAVZPRET 10mg(n=391) 또는 위약(n=401)을 단회 투여받도록 무작위 배정되었다. Study 2에서도 ZAVZPRET 10mg은 단일 투여 2시간 후 두통 완전 소실(pain freedom) 및 가장 성가신 증상(MBS: Most Bothersome Symptom) 소실이라는 공동 주요 평가변수에서 위약 대비 통계적으로 유의한 유효성을 보였다. 두통 완전 소실은 ZAVZPRET 투여군에서 22.5%, 위약군에서 15.5%의 환자에서 관찰되었으며, 통계적으로 유의한 차이를 보였다(p=0.011). MBS 소실은 ZAVZPRET 투여군에서 41.9%, 위약군에서 33.7%로 나타났으며, 역시 유의한 차이를 보였다(p=0.016). 투약 전 환자들이 보고한 가장 흔한 MBS는 광공포증(53%), 오심(31%), 음향공포증(15%) 순이었다. 자베게판트의 예상되는 쟁점은? Gepant 계열 약제는 심혈관계 부작용이 거의 없는 새로운 작용기전을 가지며, CGRP 수용체를 직접 차단함으로써 보다 선택적인 신경조절을 가능하게 한다. 이로 인해 Triptan 계열 약제의 사용이 제한되는 환자군에게 있어 안전하고 효과적인 대체 치료제이다. 이 중 자베게판트는 유일하게 비강 분무 제형(nasal spray)으로 개발된 약제로 주목받고 있다. 편두통 발작 시 자주 동반되는 구역감, 구토 등으로 인한 경구 약제 복용의 어려움을 극복할 수 있는 대안으로, 비강 점막을 통한 약물 전달은 빠른 흡수 및 작용 발현을 가능하게 하여, 급성기 치료에서 임상적으로 유의미한 이점을 제공할 수 있다. 그러나 이러한 비강 제형의 우월성에 대한 근거는 아직 제한적이다. 현재까지 Gepant 계열 약제 간의 직접 비교 임상시험(head-to-head trial)은 수행되지 않았으며, 약물동태학적 특성의 차이와 임상 반응성 간의 상관관계에 대한 연구 역시 부족하다. 특히 성별, 체질량지수(BMI), 유전적 요인 등 개별 환자 특성에 따라 이들 약제의 효과 및 부작용 프로파일이 어떻게 달라질 수 있는지에 대한 정보는 충분하지 않다. 자베게판트의 비강 분무 제형은 약물이 간에서 분해되거나 체중에 따라 흡수 속도가 달라지는 문제를 어느 정도 줄일 수 있는 장점이 있다. 그러나 실제 임상 현장에서 이 약제가 얼마나 효과적이고 안전한지는 앞으로 더 많은 연구를 통해 확인될 필요가 있다. 자베게판트의 임상시험에서는 미각 장애, 비강 불편감, 인후 자극감 등의 경미한 이상반응이 보고되었으며, 장기적인 비점막에 대한 영향은 아직 충분히 규명되지 않았다. 또한, CGRP가 비강 점막 혈관에 미치는 생리적 기능에 대한 이해도 제한적인 상황이다. 따라서 비강 제형 자베게판트의 효과와 안전성에 대한 종합적인 평가, 투여 대상 환자군의 최적화, 그리고 개별 맞춤 치료 전략의 수립은 향후 편두통 치료의 패러다임을 확장하는 데 있어 중요한 과제가 될 것이다. 참고문헌 1. Andrew Blumenfeld et al. “Hypervigilance, Allostatic Load, and Migraine Prevention: Antibodies to CGRP or Receptor” Neurol Ther. Volume 10, 469& 8211;497(2021). 2. Tessa de Vries et al. “Pharmacological treatment of migraine: CGRP and 5-HT beyond the triptans” Pharmacology & Therapeutics Volume 211, July 2020, Page 107528. 3. F A Russell et al. “Calcitonin gene-related peptide: physiology and pathophysiology” Physiol Rev 94: 1099& 8211;1142,(2014). 4. Boucherie et al. “Comparison of gepant effects at therapeutic plasma concentrations: connecting” The Journal of Headache and Pain (2024) 25:141. 5. Michael Thomas Eller et al. “Novel Calcitonin Gene-Related Peptide (CGRP) Interfering Migraine Therapies and Stroke& 8212;A Review” Int. J. Mol. Sci. 2024, 25(21), 11685. 6. Andrew F. Russo “ CALCITONIN GENE-RELATED PEPTIDE: A New Target for Migraine” Annu Rev Pharmacol Toxicol. 2015 ; 55: 533& 8211;552. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-07-11 06:47:54최병철 박사
화이자 비강분무제 급성 편두통 치료제 '자브즈프렛'7편: 비강분무 편두통 치료, 3세대 CGRP 수용체 길항제 자브즈프렛(Zavegepant) 자브즈프렛(Zavzpret& 9415;, zav-spret, 성분명: 자베게판트, Zavegepant, 화이자)은 3세대 칼시토닌 유전자 관련 펩타이드(calcitonin gene-related peptide, CGRP) 수용체 길항제로 2023년 3월 미국 FDA에서 편두통 급성치료에 승인을 받았다. 하지만 유럽 EMA에서는 아직 승인되지 않았다. 편두통은 전 세계적으로 높은 유병률을 보이는 신경혈관성 질환으로, 삶의 질 저하와 함께 사회경제적 부담을 초래하는 주요 질환 중 하나이다. 이러한 편두통의 병태생리에는 다양한 신경전달물질과 경로가 관여한다. 이에 따라 칼시토닌 유전자 관련 펩타이드(CGRP)의 중심적인 역할이 주목받고 있다. CGRP는 강력한 혈관확장 작용을 지닌 신경펩타이드로, 삼차신경혈관계(trigeminovascular system)의 활성화와 함께 방출된다. 이어 경막혈관의 확장, 혈관주변 염증(perivascular inflammation) 및 통각수용체를 활성화시켜 편두통을 유발한다. 이러한 CGRP를 표적으로 하는 약제로는 소분자 CGRP 수용체 길항제(Gepants)와 CGRP 수용체를 표적하는 단클론 항체(monoclonal Antibody)가 있다. 최초의 Gepant는 2019년 미국 FDA 승인을 받은 유브로게판트(Ubrogepant)이며, 이후, 리메게판트(Rimegepant), 아토게판트(Atogepant) 및 자베게판트(Zavegepant)가 승인되었다. 자베게판트는 편두통 급성치료제로 승인 근거가 된 3상 임상에서, 1차 평가변수인 투약 2시간 후 통증의 완전한 개선을 달성한 환자의 비율이 자베게판트군에서 24%, 위약군에서 15%였다. 편두통 완화 효과는 빠르면 투약 15분 만에 나타났으며, 경구제제에 비해 빠른 효과를 보였다. Gepant 계열 약제는 스테로이드를 기반으로 하지 않으며, CGRP 수용체를 선택적으로 차단한다. 이들은 기존 Triptan 계열 약제와 달리 혈관 평활근의 5-HT₁B 수용체를 자극하지 않아 직접적인 혈관수축을 유발하지 않으며, 심혈관계 질환자에게서도 비교적 안전한 치료 대안으로 간주된다. 이러한 약리학적 특성은 편두통 치료에 있어 비스테로이드성, 비혈관수축성 기전에 기반한 새로운 치료 전략을 가능하게 하였다. 편두통의 발생 기전은 무엇인가? 전통적으로는 혈관 확장이 편두통의 주요 원인으로 간주되었으나, 최근의 연구들은 신경계의 기능적 이상, 혈관 반응, 면역계 및 후성유전적 조절이 상호 작용하는 복합 질환임으로 설명하고 있다. 현대 편두통 기전의 핵심은 삼차신경혈관계(trigeminovascular system, TGVS)의 활성화이다. TGVS는 해부학적으로 경막 혈관을 지배하는 감각 신경들로 이루어져 있으며, 이 감각 신경들의 세포체는 삼차신경절(trigeminal ganglion)에 위치한다.(Figure 1) 기능적으로 TGVS는 혈관 및 경막의 감각 자극을 감지하고, 이 정보를 중추신경계로 전달하며, 동시에 칼시토닌 유전자 관련 펩타이드(calcitonin gene-related peptide, CGRP)와 같은 염증 매개 신경펩타이드를 방출하여 신경성 염증 및 통증 전달을 조절하는 역할을 수행한다. 이 체계가 활성화되면 CGRP의 분비가 증가하고, 경막혈관의 확장이 유도된다. 얼굴과 머리의 통증은 주로 삼차신경의 첫 번째 가지인 눈신경(ophthalmic division)의 통각 구심성 신경(nociceptive afferents)에 의해 매개된다. 경막 감각 신경(meningeal sensory afferents)이 활성화되면, 이 자극은 삼차신경 척수핵(trigeminal nucleus caudalis)로 전달되며, 이후 통증 지각에 관여하는 전방 뇌 구조물(rostral brain structures)까지 전달된다. 이 과정에서 삼차신경 말단에서 CGRP, Substance P, Neurokinin A와 같은 신경펩타이드가 방출되며, 혈관 확장과 함께 신경인성 염증(neurogenic inflammation)을 유발한다. 이러한 신경-혈관 반응은 말초 통각 수용기의 민감도를 증가시키고, 시간이 경과함에 따라 중추 감작(central sensitization)으로 진행되어 두통의 지속 시간과 통증 강도를 증가시킨다. 중추 감작은 시상, 대뇌피질, 삼차신경계 신경핵에서 일어나며, 이로 인해 광선공포증, 음향공포증, 피부 과민(allodynia)과 같은 감각 과민 증상이 동반된다. 또한 일부 환자에서 관찰되는 전조증상(aura)은 대뇌 피질에서 시작되는 피질 확산성 탈분극(cortical spreading depression, CSD)과 연관되며, 이는 시각피질에서부터 후두엽을 따라 진행되는 전기적 흥분 억제 현상으로 정의된다. CSD는 삼차신경계 자극과 혈관 반응을 촉진하며, 전조가 없는 환자에서도 유사한 신경생리학적 현상이 존재할 수 있음이 보고되고 있다. 따라서, 삼차신경 내에서 가장 풍부하게 발현되는 신경펩타이드는 CGRP이며, 이는 삼차신경절 뉴런의 약 35~50%에서 발현된다. CGRP는 편두통 발작 중 정맥 내 농도가 유의하게 증가함이 확인되면서 중요한 병태생리적 매개 인자로 주목받고 있다. CGRP는 혈관을 확장시키고, 비만세포로부터 히스타민 분비를 유도하며, 신경절 내 질산 생성도 촉진하는 역할을 한다. CGRP(Calcitonin gene-related peptide, 칼시토닌 유전자-관련 펩타이드)는 어떤 물질인가? CGRP는 1982년, 칼시토닌 유전자(CALCA)의 mRNA 대체 스플라이싱을 통해 신경조직에서 유래된 37개의 아미노산 잔기로 구성된 신경펩타이드로 처음 분리되었으며, α-CGRP로 명명되었다. 이후 CALCB 유전자로부터 유래되는 β-CGRP가 추가로 밝혀졌고, 인간에서는 이 두 아이소폼이 모두 존재한다. 이 중 병리적 의미에서 가장 주목받는 형태는 α-CGRP이며, 이는 특히 삼차신경 감각 신경계 및 통각 전달 경로에서 핵심적인 역할을 하는 것으로 알려져 있다. CGRP는 중추신경계(CNS)와 장신경계(enteric nervous system)에 광범위하게 발현되며, 수용체와의 결합을 위해 8~18번째 아미노산에 걸쳐 형성된 양친매성(양소수성) α-나선(amphiphilic α-helix) 구조를 가진다. CGRP 수용체는 조직별로 다양한 아형(subtypes)을 가지는 것으로 밝혀졌으며, 이는 약리학적 반응의 차이를 설명한다. 분자생물학적으로는 G 단백질 연결 수용체(GPCR) B 계열에 속하는 칼시토닌 유사 수용체(calcitonin-like receptor, CLR)가 RAMP(receptor activity-modifying protein)와 이합체를 형성하여 수용체의 기능적 특성이 결정된다. 예를 들어, CLR& 8211;RAMP1 복합체는 CGRP 수용체로, CLR& 8211;RAMP2 복합체는 아드레노메둘린(adrenomedullin) 수용체로 작용한다. 또한 RCP(receptor component protein)는 cAMP 신호전달 경로 활성화에 필수적인 요소로 작용한다. 편두통 병태생리에서 CGRP는 특히 삼차혈관계와 밀접하게 연관된다. 삼차신경절(trigeminal ganglion)에 위치한 감각성 위단극성 뉴런(pseudounipolar sensory neuron)은 두개내 혈관 및 경막(dura)을 지배하며, 중심축삭은 삼차경부 복합체(trigeminocervical complex)로 투사되어 시상(thalamus) 및 고차 대뇌 피질로 통각 정보를 전달한다. CGRP의 분비는 주로 Ca²& 8314;-의존적인 소포성 경로를 통해 이루어진다. 감각 신경 말단에 활동전위가 도달하면 전압의존성 칼슘 채널이 개방되고, 세포 내 Ca²& 8314; 농도가 급증한다. 이는 SNARE(soluble NSF attachment protein receptor) 복합체를 활성화시켜, CGRP가 저장된 소포가 세포막과 융합한 후, 외포작용(exocytosis)을 통해 CGRP가 분비된다. 이러한 기전을 표적으로 한 여러 치료 전략이 임상적으로 활용되고 있다. 예를 들어, 트립탄 계열 약물은 세로토닌 5-HT₁B/₁D 수용체를 자극하여 presynaptic 칼슘 유입을 차단함으로써 CGRP 분비를 억제한다. 또한 보툴리눔 톡신 A형은 SNARE 복합체의 핵심 구성요소인 SNAP-25를 절단하여 소포 융합 자체를 저해함으로써 CGRP의 방출을 차단한다. 그러나 최근 연구에서는 이러한 전통적인 Ca²& 8314; 및 SNARE 의존 경로와는 별개의 CGRP 분비 경로의 존재 가능성이 제기되고 있다. 특히 감각 신경의 근위 축삭 말단(proximal axon terminal)에서는 외포 경로에 의존하지 않는 CGRP 분비가 확인되었으며, 이 부위에서는 트립탄(Triptan)이나 보툴리눔 톡신(botulinum toxin)에 대한 반응성이 낮은 것으로 나타났다. 이러한 발견은 기존 치료제에 반응하지 않는 일부 편두통 환자의 존재를 설명하며, 단순한 분비 차단을 넘어, 수용체 수준에서의 CGRP 신호 전달 억제가 보다 효과적인 치료 전략이 될 수 있음을 시사한다. CGRP는 편두통에 어떤 영향을 미치는가? 삼차신경혈관계(TGVS)를 구성하는 비수초화 감각 C 섬유(unmyelinated sensory C fibers)는 주로 경막과 뇌혈관에 분포하며, 그 축삭은 척수 및 뇌간의 삼차신경 척수로핵(spinal trigeminal nucleus caudalis)까지 연장되어 시냅스를 형성한다. 이들 섬유는 CGRP를 풍부하게 발현하고 있으며, 편두통 발작 시 CGRP의 방출이 핵심 병태생리 기전이라는 가설을 뒷받침한다. 실제로 편두통 환자에서는 혈중 CGRP 농도가 유의하게 상승하며, 건강한 피험자에게 외인성 CGRP를 투여할 경우 편두통 유사 증상이 유발된다는 보고를 통해, CGRP의 병인적 역할이 점차 명확히 규명되고 있다. CGRP는 주로 혈관 평활근과 삼차신경 말단에 존재하는 CGRP 수용체(CGRP receptor, CGRP-R)를 통해 작용한다. 이러한 수용체는 중간 경막 동맥, 중대뇌동맥, 연질막 동맥, 천측 측두 동맥 등 주요 뇌혈관뿐만 아니라, 경막과 비강 부위를 지배하는 삼차신경 말단에도 분포하고 있어, CGRP가 말초에서 직접 작용하여 편두통을 유발함을 시사한다. 편두통 발작 시 CGRP는 삼차신경계의 다양한 부위(경막의 구심성 말단, 삼차신경절 내 세포체, 연수 및 척수로 투사되는 원심성 섬유)에서 방출된다. 이 과정은 신경성 염증과 통증 전달 경로의 활성을 유도하는 중요한 기전으로 작용한다. 특히 CGRP는 경막 내 비만세포(mast cells) 및 대식세포(macrophages)를 유인하고, 국소 염증 반응을 촉진하여 통증 유발 환경을 조성한다. 또한 CGRP는 삼차신경절 내 뉴런과 교세포(glial cells)를 활성화시켜 역행성 신호 전달(retrograde signaling)을 유도하고, 이는 말초 통각 수용기의 민감도를 증가시켜 말초 감작(peripheral sensitization)을 유발한다. 이러한 변화는 척수 배측각(dorsal horn)과 삼차신경 척수로핵에서의 중추 감작(central sensitization)으로 이어져, 통증 역치의 저하 및 과민 반응(hypersensitivity)을 유발하게 된다. 더 나아가, CGRP는 삼차신경절 내 위성 교세포(satellite glial cells)를 자극하여 염증성 사이토카인과 신경영양인자(예: BDNF)의 분비를 촉진하고, 이들 분비물은 다시 뉴런의 CGRP 발현을 증가시키는 파라크린(paracrine) 기전을 형성하여 삼차신경계의 흥분성과 감작을 증폭시킨다. CGRP는 혈액-뇌 장벽(BBB)을 직접 통과하지는 않지만, 말초에서의 작용을 통해 중추 통각 경로(시상, 대상회, 대뇌 피질 등)에 간접적으로 영향을 미치며, 삼차신경핵 후방부(nucleus caudalis)로의 투사를 통해 글루타메이트(glutamate) 방출을 증가시켜 통증 전달을 더욱 강화하는 것으로 알려져 있다. 편두통 치료제 중 국내에서 승인된 어떤 약제들이 있는가? 편두통 치료에는 다양한 약제가 사용되며, 급성기 치료에는 비스테로이드성 항염증제(NSAIDs)와 경구용 세로토닌(5-하이드록시트립타민) 수용체 1B/1D 작용제인 트립탄이 사용된다. 반면, 항경련제, 항우울제, 항고혈압제, 보툴리눔 독소 등의 약물은 편두통 예방 목적으로 사용된다. 이러한 약제 중 상당수는 편두통 치료를 위해 특별히 개발된 것이 아니며, 다양한 부작용을 유발할 수 있고 작용 기전도 명확하지 않다. 또한 복약 순응도의 저하와 잦은 치료 변경으로 인해 이들 약물의 효과적인 사용에는 한계가 있다. 1. 예방 치료토피라메이트(Topiramate)토피라메이트는 편두통 예방 치료의 1차 선택약제로 고려되며, 전간 치료에 사용하는 용량보다 낮은 1일 용량에서도 효과를 보인다. 이 약제는 삽화 편두통(episodic migraine)뿐만 아니라 만성 편두통 환자의 예방 치료에도 효과적인 것으로 입증되었으며, 약물 과용 두통이 동반된 경우에도 유용하게 사용될 수 있다. 가장 흔한 부작용은 손발 저림(paresthesia)이며, 이 외에도 집중력 저하, 피로, 식욕 감소, 구역, 설사, 감각 저하, 복통 등의 부작용이 나타날 수 있다. 장기간 투여 시 체중 감소와 신결석이 발생할 수 있다. 플루나리진(Flunarizine) 플루나리진은 칼슘채널차단제 중 비선택적 칼슘 통로 차단제로, 편두통 치료에 승인된 약물이다. 이 약제는 여러 임상시험에서 그 효과가 입증되었으며, 부작용으로는 체중 증가, 졸림, 구강 건조, 어지러움, 저혈압 등이 나타날 수 있다. 특히 장기간 투여 시 약물 유발 파킨슨 증후군(추체외로계 부작용)을 유발할 수 있으므로, 보행이 느려지거나 손떨림 증상이 발생하면 즉시 투약을 중단해야 한다. 보툴리눔 독소 A형(Botulinum toxin A, BoNT-A) 보툴리눔 독소 A형(botulinum neurotoxin type A, BoNT-A)은 강력한 신경독소로, 혐기성 세균인 Clostridium botulinum에 의해 생성된다. 이 독소는 신경근 접합부에서 아세틸콜린의 분비를 차단함으로써 이완성 근마비를 유발한다. BoNT-A는 미국 FDA 및 국내에서 만성 편두통의 예방 치료제로 승인되었으며, 기존의 예방 약물에 반응하지 않는 만성 편두통 환자에서 선택적 치료 옵션이 될 수 있다. BoNT-A는 수개월간 지속되는 일시적인 화학적 탈신경(chemodenervation)을 유도하여, 전신적 부작용 위험은 최소화하면서 국소적으로 근육, 한선, 수축근 등의 기능을 감소시키거나 억제한다. 이 약제는 최초로 원숭이 모델에서 사시의 비수술적 치료를 위한 연구 중에 임상 적용 가능성이 보고되었다. BoNT-A는 연접전 신경 종말에 결합하여 아세틸콜린 분비를 차단함으로써 사시, 안검경련, 편측 안면경련, 경부 근긴장이상 등 과도한 근수축과 관련된 질환에 효과적이다. 최근에는 편두통을 포함한 다양한 형태의 두통, 요부 통증, 근막통증 증후군 등의 치료에 적용되고 있으며, 이는 단순한 근육 이완에 따른 이차적 진통 효과를 넘어서는 추가적인 작용 기전이 있음을 시사한다. BoNT-A는 말초 구심성 신경 말단에서 CGRP, substance P, glutamate 등의 통각 매개 물질 분비를 억제함으로써, 중추 삼차신경혈관계의 감작(sensitization)을 차단하는 기전을 통해 편두통 치료 효과를 발휘하는 것으로 알려져 있다. 2. 급성기 치료 에르고타민(Ergotamine) 복합제 국내에서는 단일 성분의 Ergotamine 제제는 없으며, Ergotamine tartrate와 Caffeine의 복합제 형태로만 처방된다. 이 약제는 세로토닌 수용체인 5-HT₁ 및 5-HT₂ 수용체에 작용하여 혈관을 수축시키고, 경막의 신경성 염증을 억제하는 효과가 있다. 혈관 수축 및 평활근 수축 작용을 가지므로, 말초혈관질환, 관상동맥질환, 신장 또는 간 기능 이상, 임신, 조절되지 않는 고혈압 등의 기저 질환이 있는 환자에게는 사용을 피해야 한다. 경구 투여 시 흡수가 느리며, 구역, 구토, 복통, 손 저림, 설사 등의 위장관계 및 말초신경계 부작용이 나타날 수 있고, 드물게 사지 괴사와 같은 중대한 이상반응이 발생할 수 있다. 남용 시 약물 과용 두통(medication-overuse headache, MOH)으로 진행할 수 있으므로, 사용 빈도는 1주일에 2회 이하로 제한하는 것이 권장된다. 이 약제는 편두통 급성기 치료에서 작용 지속 시간이 길어 재발률이 낮기 때문에, Triptan 제제를 사용한 후 재발이 문제가 되는 경우 효과적인 대안이 될 수 있다. 그러나 구역 및 구토 등 부작용이 흔하고, 독성 및 오용의 위험이 더 높다. Triptan 제제와는 병용해서는 안 되며, Triptan 복용 후 12시간이 경과한 이후에만 안전하게 사용할 수 있다. Triptan제(5-HT1B/1D 수용체 작용제) Triptan 계열 약제에는 수마트립탄(Sumatriptan), 졸미트립탄(Zolmitriptan), 나라트립탄(Naratriptan), 프로바트립탄(Frovatriptan), 알모트립탄(Almotriptan) 등이 있으며, 경구제, 피하주사제, 비강 내 투여제 등 다양한 제형으로 제공된다. 이들 약제는 세로토닌 수용체인 5-HT₁B/₁D 수용체에 선택적으로 작용하여, 확장된 두개혈관을 수축시키고, 혈관 주위 삼차신경 말단에서 신경펩타이드의 방출 및 삼차신경원의 활성화를 억제함으로써 신경인성 염증반응을 차단한다. 이들 약제는 유사한 약리학적 기전을 공유하지만, 생체이용률(bioavailability), 혈중 반감기(half-life), 지방 친화도(lipophilicity), 약물상호작용(drug interactions) 등 약동학적 특성에서 차이를 보이므로, 각 환자의 편두통 양상에 따라 개별적으로 선택되어야 한다. 예를 들어, Tmax(최고 혈중농도에 도달하는 시간)가 짧을수록 약효 발현이 빠르고 급성기에 효과적이며, 반감기가 길수록 재발 빈도가 낮아지는 경향이 있다. Triptan 계열 약제는 모두 5-HT₁B/₁D 수용체에 선택적으로 작용하기 때문에, 기존의 비특이적 편두통 치료제에 비해 전신적 부작용이 적은 것이 장점이다. 그러나, 일시적으로 박동감, 저림, 비정상적인 감각, 흉부 압박감, 열감, 작열감, 냉감 등의 감각 이상 증상과 함께, 구역, 어지러움, 졸음, 피로감 등이 발생할 수 있다. 이들 약제는 심장 관상동맥의 수축을 유발할 수 있으므로, 허혈성 심질환(협심증, 심근경색, 심근 허혈 등), 심장판막 질환, 부정맥(특히 빈맥) 등의 심혈관 질환이 있는 환자에게는 투여하지 않는다. 또한, 관상동맥 질환의 위험인자(당뇨병, 고혈압, 고지혈증, 가족력, 흡연 등)를 보유한 환자에게는 주의하여 사용하거나 가능한 경우 다른 약제로 대체하는 것이 바람직하다. 또한, 에르고타민과 병용하거나 짧은 간격을 두고 투여하면 심각한 혈관 수축이 발생할 수 있으므로, 이들 약물과의 중복 투여는 피해야 한다. 아울러, SSRI(선택적 세로토닌 재흡수 억제제) 또는 SNRI(세로토닌-노르에피네프린 재흡수 억제제)를 복용 중인 환자에게는 세로토닌 증후군(serotonin syndrome) 발생 위험이 있으므로 주의가 필요하다. 이 증후군은 마비, 과다 반사, 운동 실조, 빈맥, 진전, 발한, 불안초조 등의 증상으로 나타날 수 있다. Ditan제(5-HT1F 수용체 작용제) 라스미디탄(Lasmiditan, 제품명: 레이보우정, Leyvow& 9415;)은 최초의 경구용 선택적 5-HT₁F 수용체 작용제(Ditan 계열)로, 현재 국내에서는 ‘전조 증상의 동반 여부와 관계없이 편두통의 급성 치료’ 적응증으로 승인되어 있다. 5-HT₁F 수용체는 삼차신경절, 삼차신경핵, 뇌혈관 등에 분포하며, 5-HT₁B 수용체와 달리 혈관 수축을 유발하지 않는 선택성을 가지기 때문에, Triptan 계열 약제에 비해 심혈관계 안전성이 높은 것이 특징이다. 또한, 5-HT₁F 수용체는 경막 주위에서의 신경인성 염증 억제와 삼차신경핵 내 신경세포 활성도 감소를 통해 항편두통 효과를 발휘한다. 라스미디탄은 두통 완화율 및 완전 관해율 측면에서 위약 대비 유의한 치료 효과를 보였으며, 기존 Triptan 계열 약제에 반응하지 않던 환자군에서도 효과가 입증되었다. 무엇보다 Triptan 계열에서 흔히 나타나는 혈관 수축에 의한 심혈관계 부작용의 위험이 현저히 낮은 것이 중요한 장점으로 평가된다. CGRP 관련 약제 편두통 발병 과정에서 CGRP의 역할에 대한 이해는 CGRP 및 그 수용체를 표적으로 하는 약물의 개발로 이어졌다. 여기에는 CGRP 수용체를 표적하는 단클론 항체들과 CGRP 수용체 길항제 계열약제(Gepants)가 있다.(Figure 3) 이들 약제는 표적 분자 및 치료 전략은 유사하지만, 약물 구조, 투여 방식, 작용 지속 시간 및 대사 경로 등에서 본질적인 차이를 보인다. 단클론 항체는 생물학적 제제로서 한 달 이상 작용할 수 있으며, 피하주사로 투여되며 면역학적 반응을 유발할 가능성이 있다. 반면 소분자 약제는 빠른 작용과 경구/비강 투여의 편의성을 바탕으로 급성기 치료에 적합하며, 간에서 대사되고 전신 반감기가 짧은 특징이 있다. 이들 약제는 Triptan과 작용 기전이 달라, 기존 약물에 반응이 없거나 부작용·금기가 있는 환자에서 대안으로 고려될 수 있다. CGRP 단클론 항체(monoclonal antibody, mAb)는 어떤 약제인가? CGRP는 말초뿐 아니라 중추신경계에서도 편두통의 유발 및 지속에 기여하는 신경펩타이드이다. 편두통 발작 시 환자의 혈중 및 타액 내 CGRP 농도가 유의하게 상승하는 것이 보고되었으며, 이러한 병태생리적 기전을 바탕으로 개발된 CGRP 표적 단클론 항체(mAb는 편두통 예방 치료에 새로운 전기를 마련한 치료 전략으로 주목받고 있다. 이들 단클론 항체는 분자량이 매우 커 혈액-뇌 장벽(BBB)을 거의 통과하지 못하며, 주로 경막, 뇌혈관, 삼차신경절 등 말초 삼차신경계 구조를 표적으로 작용한다. 이러한 특성은 중추신경계에 대한 비특이적 영향을 최소화하면서 병리적 말초 경로에 선택적으로 작용할 수 있는 기전을 제공하며, 이에 따라 중추 관련 부작용을 감소시킬 수 있다는 중요한 임상적 이점을 갖는다. 현재까지 개발된 CGRP 관련 항체는 크게 두 가지 계열로 나뉜다. CGRP 수용체를 표적으로 하는 에레누맙(Erenumab)은 수용체에 가역적으로 결합하여 리간드와의 결합을 차단하고, 반면 CGRP 리간드 자체를 중화하는 프레마네주맙(Fremanezumab), 갈카네주맙(Galcanezumab), 엡티네주맙(Eptinezumab)은 CGRP 펩타이드에 직접 결합하여 기능적 차단을 유도한다. 이들 약제는 모두 미국 FDA로부터 편두통 예방 치료제로 승인되었으며, 특히 에레누맙은 2018년, 만성 및 삽화성 편두통 모두에 대해 최초로 승인된 단클론 항체이다. 국내에서는 프레마네주맙(아조비& 9415;)과 갈카네주맙(앰갈리티& 9415;)이 편두통 예방 적응증으로 승인되어 사용되고 있다. 단클론 항체의 월 1회 또는 분기 1회 투여만으로도 치료 효과를 유지할 수 있다는 점이며, 이는 기존 예방 약제에 비해 복약 순응도 향상 및 지속적 관리의 용이성 측면에서 큰 이점을 제공한다. 또한, 높은 선택성과 긴 반감기를 기반으로 비특이적 신경계 억제 없이 표적 경로에 집중된 효과를 유도한다는 점에서 기존 예방제들과 차별화된다. CGRP는 강력한 혈관 확장 작용 외에도 혈류 조절, 염증 반응 조절, 조직 보호 등 다양한 생리적 기능에 관여한다. 일부 연구에서는 CGRP가 고혈압 상태에서 혈관을 보호하는 보상 기전으로 작용할 수 있으며, 이에 따라 고혈압 환자에서의 장기적 차단이 잠재적 위험이 될 수 있다는 우려가 제시되고 있다. 그럼에도 불구하고, 현재까지의 임상시험 결과는 이러한 항체 치료제가 Triptan 또는 CGRP 길항제와 비교해도 관상동맥 연축이나 심혈관계 중대한 부작용 없이 안전하게 사용 가능함을 보여주고 있다. 이처럼 CGRP 단클론 항체 치료제는 높은 표적 선택성, 낮은 투여 빈도, 우수한 안전성 프로파일을 바탕으로 편두통 예방 치료의 새로운 기준을 제시하고 있으며, 향후에는 장기적 안전성 평가 및 고위험군 환자에 대한 적용 가능성에 대한 후속 연구가 요구된다. CGRP 수용체 길항제(CGRP receptor antagonists)는 어떤 약제인가? 기존의 대부분 편두통 예방 치료제는 흥분성 신경전달물질(예: glutamate)의 방출을 억제하거나 신경세포의 흥분성을 낮추어 빠른 시냅스 전달(fast synaptic transmission)을 차단함으로써 효과를 나타낸다. 반면, CGRP 경로를 표적으로 하는 약제는 느린 신경조절(slow neuromodulation)에 관여하며, 신경활성도 자체를 조절함으로써 편두통의 발생을 억제하는 새로운 작용 기전을 가진다. CGRP는 일반적으로 세포 내 Ca²& 8314; 유입에 의해 활성화되는 SNARE 단백질 복합체를 통해 분비되며, 이는 소포의 세포막 도킹 및 융합을 통한 Ca²& 8314; 의존적 외포(exocytosis) 과정이다. Triptan 계열 약제는 Ca²& 8314; 신호전달을 억제하고, 보툴리눔 톡신 A형은 SNARE 복합체의 핵심인 SNAP-25 단백질을 절단하여 CGRP 분비를 차단한다. 그러나 일부 감각 신경 말단에서는 이와 무관한 비전형적 CGRP 분비 경로가 존재하는 것으로 보고되어, 기존 약제가 효과를 보이지 않는 일부 환자군의 기전을 설명하는 데 기여하고 있다. 이러한 한계를 극복하기 위해 개발된 것이 Gepant 계열의 약제들이다. Gepants는 소분자 CGRP 수용체 길항제로서, 주 수용체 복합체인 CLR:RAMP1(canonical CGRP receptor)에 대해 높은 친화도를 가지며, 아드레노메둘린 수용체(adrenomedullin receptors, CLR:RAMP2 또는 CLR:RAMP3)에는 거의 결합하지 않는다. 1세대 Gepant인 텔카게판트(Telcagepant)와 올세게판트(Olcegepant)는 CGRP 수용체에 대한 효능을 입증했으나, 간독성 문제와 제형 개발의 어려움으로 인해 상용화되지 못했다. 이후 개발된 2세대 gepants는 간 독성이 없고 경구용 제형으로 임상적 유용성이 높아졌다. 2세대 Gepant인 유브로게판트(Ubrogepant), 리메게판트(Rimegepant), 아토게판트(Atogepant)는 경구 투여 제형이며, 각각 급성 치료(유브로게판트), 예방 치료(아토게판트), 또는 두 가지 모두(리메게판트)를 위해 개발되었다. 이들 약제는 효과적이며 간 독성을 보이지 않는다. 미국 FDA는 2019년 우브로게판트(Ubrogepant)를 ‘급성 편두통 치료’, 2020년 리메가판트(Rimegepant)를 ‘편두통 예방 및 급성 치료’, 2021년 아토게판트(Atogepant)를 ‘편두통 예방’에 승인하였다. 국내에서는 리메게판트(Rimegepant, 제품명: 너텍 구강붕해정, Nurtec ODT& 9415;)는 ‘1. 성인에서의 전조증상을 수반하거나 수반하지 않는 편두통의 급성치료 2. 성인에서의 삽화성 편두통의 예방’, 아토게팜트(Atogepant, 제픔명: 아큅타, Aquipta& 9415;)는 ‘성인 18세 이상)에서의 편두통의 예방’에 승인되어 있다. 3세대 Gepant로 분류되는 자베게판트(Zavegepant)는 최초의 비강 분무형 CGRP 수용체 길항제로 개발되었으며, 2023년 3월 미국 FDA로부터 급성기 편두통 치료제로 승인되었다. 이 약제는 비강분무제형(nasal spray)으로 속효성을 장점으로 하며 리메가판트(Rimegepant)와 동일 회사 약제이다. ODT(Orally Disintegrating Tablet)는 경구 투여제형으로 편리성과 예방/치료의 이중 용도가 장점인 반면, 급성 발작 시 구토, 오심 등으로 경구 복용이 어려운 환자가 존재한다. 이에 반해 구강 흡수가 필요 없는 비강분무제는 급성기에서 더 빠르고 효과적으로 작용한다. 자베게판트는 어떤 약제인가? 자베게판트(Zavegepant, 제품명: 자브즈프렛 비강분무제, Zavzpret& 9415;)는 CGRP 수용체에 선택적으로 결합하는 3세대 소분자 비펩타이드형 길항제(small-molecule non-peptide antagonist)로, 비강 투여(intranasal administration)를 목적으로 개발된 최초의 Gepant 계열 약제이다. 자베게판트는 기존 Gepant 계열 약제들과 유사한 구조적 골격을 공유하지만, 비강용 스프레이(nasal spray) 제형으로 개발되어 속효성(rapid onset)을 극대화하기 위한 약물 전달 전략(drug delivery strategy)의 일환으로 설계되었다. 이는 특히 편두통 발작 시 구역 및 구토 증상으로 인해 경구 약물 복용이 어려운 환자군에서 유용한 치료 대안으로 평가된다. 전임상 연구에서는 자베게판트가 인간 세포막에 발현된 CGRP 수용체에 대한 강력한 결합 억제 활성을 나타냈으며, 또한 인간 두개내 동맥(intracranial artery)의 ex vivo 모델에서 CGRP 유도 혈관 확장을 완전하고 강력하게 억제하는 효과가 확인되었다. 자베게판트는 1회 투여량 10mg으로, 하루 1회 사용이 권장되며, 월 8회 초과 사용 시 안정성은 아직 확립되지 않았다. 따라서 사용 빈도에 대한 주의가 필요하다. 자베게판트의 약리 기전은? 자베게판트(Zavegepant)는 이 CGRP 수용체에 대해 고친화성(high affinity) 및 고선택성(high selectivity)을 나타내는 경쟁적 길항제(competitive antagonist)로, CGRP의 결합을 방해하여 해당 신호전달 경로(signal transduction pathway)를 차단한다. 수용체 차단 시, Gαs 단백질을 통한 아데닐산 고리화효소(adenylyl cyclase) 활성화가 저해되고, 이로 인한 세포내 cAMP 생성 감소는 혈관 확장을 억제하며, substance P, neurokinin A 등의 염증성 신경전달물질의 방출을 저해하는 효과를 나타낸다. 자베게판트는 기존의 경구용 Gepant 계열 약제와 달리, 비강 점막(nasal mucosa)을 통한 투과율이 우수하도록 설계되었다. 비강 분무 후 15~30분 이내에 혈중 최고 농도(Cmax)에 도달하며, 일회통과 대사(first-pass metabolism)를 회피함으로써 절대 생체이용률(bioavailability)이 높고, 보다 빠른 약효 발현이 가능하다. 또한 Gepant 계열 약제는 일반적으로 지용성(lipophilic)이 강해 체내 지방조직에 축적되는 경향이 있으며, 이로 인해 고체중 환자에서 유효 혈중 농도 감소 및 치료 반응 저하가 보고될 수 있다. 반면, 자베게판트는 비강 점막을 통한 국소 삼차신경 말단 전달이 가능하므로, 체중에 영향을 받지 않는 균일한 치료 효과가 기대된다. 자베게판트는 일부 혈액-뇌장벽(BBB)을 통과할 수 있는 것으로 알려져 있으며, 이에 따라 말초뿐 아니라 중추의 CGRP 수용체에도 작용 가능성이 제기되고 있다. 그러나 대부분의 약리 작용은 말초 삼차신경계 및 경막혈관계 수준에서 이루어진다. 혈장 단백 결합율은 중등도(moderate)이며, 체내 조직 분포(distribution)는 빠르고 광범위한 것으로 보고되었다. 자베게판트(ZAVZPRET& 9415;)의 허가임상은 어떠한가? 성인에서 전조(aura)의 유무와 관계없이 급성 편두통 치료를 위한 ZAVZPRET의 유효성은, 두 건의 무작위배정, 이중눈가림, 위약대조 임상시험(Study 1 및 Study 2)을 통해 입증되었다. 두 연구 모두에서, 환자들은 중등도에서 중증의 편두통 발작 발생 시 시험약을 투여하도록 지시받았으며, 구제 약물(예: NSAIDs, 아세트아미노펜, 항구토제)은 초기 투여 후 2시간 이후부터 허용되었다. 반면, Triptan 등 다른 형태의 구제 약물은 초기 투여 후 48시간 이내 사용이 제한되었다. Study 1 및 Study 2에서 각각 13.4% 및 13.6%의 환자가 연구 시작 당시 편두통 예방 약물을 복용 중이었으나, CGRP 경로에 작용하는 예방 치료제는 포함되지 않았다. Study 1에서는 환자들이 ZAVZPRET 10mg(n=623) 또는 위약(n=646)을 단회 투여받도록 무작위 배정되었다. ZAVZPRET의 유효성은 투여 후 2시간 시점에서의 두통 완전 소실(pain freedom)과 가장 성가신 증상(MBS, Most Bothersome Symptom) 소실이라는 공동 주요 평가변수(co-primary endpoints)에서 위약 대비 통계적으로 유의한 개선 효과를 보이며 입증되었다. 두통 완전 소실은 중등도 또는 중증의 두통이 무통 상태로 완화된 것으로 정의되며, MBS 소실은 환자가 사전에 보고한 가장 성가신 증상(예: 광공포증, 음향공포증, 오심) 중 해당 증상이 투여 2시간 후 소실된 경우로 정의되었다. 투약 직전 가장 흔한 MBS는 광공포증(photophobia, 55%), 오심(nausea, 28%), 음향공포증(phonophobia, 16%) 순으로 보고되었다. 결과적으로, Study 1에서 ZAVZPRET를 투여받은 환자군은 위약군에 비해 단일 투여 2시간 후 두통 완전 소실 및 MBS 소실을 달성한 비율이 통계적으로 유의하게 높았다(Table 2 참조). Study 1에서는 ZAVZPRET가 위약에 비해 다음과 같은 추가적인 유효성 평가 지표에서도 통계적으로 유의한 효과를 보였다: 투여 2시간 후 통증 완화, 투여 2시간 후 정상적인 기능 회복, 투여 2~48시간 동안 지속적인 통증 소실(Table 3 참조), 투여 2시간 후 음향과민 및 광과민 소실. 여기서 통증 완화(pain relief)는 편두통 통증의 강도가 중등도 또는 중증에서 경도 또는 무통 상태로 완화된 것을 의미한다. 또한, 투여 2시간 후 정상적인 기능 회복(normal function)에 대한 평가는 단일 항목 설문지를 통해 측정되었으며, 환자들은 아래 네 가지 중 하나를 선택하도록 하였다: 정상적인 기능(normal function), 경미한 기능 장애(mild impairment), 심한 기능 장애(severe impairment), 침상 안정이 필요한 상태(required bedrest). ZAVZPRET 10mg 투여 후 광공포증 및 음향공포증의 발생률은 위약에 비해 감소하였다. Study 2에서는 환자들이 ZAVZPRET 10mg(n=391) 또는 위약(n=401)을 단회 투여받도록 무작위 배정되었다. Study 2에서도 ZAVZPRET 10mg은 단일 투여 2시간 후 두통 완전 소실(pain freedom) 및 가장 성가신 증상(MBS: Most Bothersome Symptom) 소실이라는 공동 주요 평가변수에서 위약 대비 통계적으로 유의한 유효성을 보였다. 두통 완전 소실은 ZAVZPRET 투여군에서 22.5%, 위약군에서 15.5%의 환자에서 관찰되었으며, 통계적으로 유의한 차이를 보였다(p=0.011). MBS 소실은 ZAVZPRET 투여군에서 41.9%, 위약군에서 33.7%로 나타났으며, 역시 유의한 차이를 보였다(p=0.016). 투약 전 환자들이 보고한 가장 흔한 MBS는 광공포증(53%), 오심(31%), 음향공포증(15%) 순이었다. 자베게판트의 예상되는 쟁점은? Gepant 계열 약제는 심혈관계 부작용이 거의 없는 새로운 작용기전을 가지며, CGRP 수용체를 직접 차단함으로써 보다 선택적인 신경조절을 가능하게 한다. 이로 인해 Triptan 계열 약제의 사용이 제한되는 환자군에게 있어 안전하고 효과적인 대체 치료제이다. 이 중 자베게판트는 유일하게 비강 분무 제형(nasal spray)으로 개발된 약제로 주목받고 있다. 편두통 발작 시 자주 동반되는 구역감, 구토 등으로 인한 경구 약제 복용의 어려움을 극복할 수 있는 대안으로, 비강 점막을 통한 약물 전달은 빠른 흡수 및 작용 발현을 가능하게 하여, 급성기 치료에서 임상적으로 유의미한 이점을 제공할 수 있다. 그러나 이러한 비강 제형의 우월성에 대한 근거는 아직 제한적이다. 현재까지 Gepant 계열 약제 간의 직접 비교 임상시험(head-to-head trial)은 수행되지 않았으며, 약물동태학적 특성의 차이와 임상 반응성 간의 상관관계에 대한 연구 역시 부족하다. 특히 성별, 체질량지수(BMI), 유전적 요인 등 개별 환자 특성에 따라 이들 약제의 효과 및 부작용 프로파일이 어떻게 달라질 수 있는지에 대한 정보는 충분하지 않다. 자베게판트의 비강 분무 제형은 약물이 간에서 분해되거나 체중에 따라 흡수 속도가 달라지는 문제를 어느 정도 줄일 수 있는 장점이 있다. 그러나 실제 임상 현장에서 이 약제가 얼마나 효과적이고 안전한지는 앞으로 더 많은 연구를 통해 확인될 필요가 있다. 자베게판트의 임상시험에서는 미각 장애, 비강 불편감, 인후 자극감 등의 경미한 이상반응이 보고되었으며, 장기적인 비점막에 대한 영향은 아직 충분히 규명되지 않았다. 또한, CGRP가 비강 점막 혈관에 미치는 생리적 기능에 대한 이해도 제한적인 상황이다. 따라서 비강 제형 자베게판트의 효과와 안전성에 대한 종합적인 평가, 투여 대상 환자군의 최적화, 그리고 개별 맞춤 치료 전략의 수립은 향후 편두통 치료의 패러다임을 확장하는 데 있어 중요한 과제가 될 것이다. 참고문헌 1. Andrew Blumenfeld et al. “Hypervigilance, Allostatic Load, and Migraine Prevention: Antibodies to CGRP or Receptor” Neurol Ther. Volume 10, 469& 8211;497(2021). 2. Tessa de Vries et al. “Pharmacological treatment of migraine: CGRP and 5-HT beyond the triptans” Pharmacology & Therapeutics Volume 211, July 2020, Page 107528. 3. F A Russell et al. “Calcitonin gene-related peptide: physiology and pathophysiology” Physiol Rev 94: 1099& 8211;1142,(2014). 4. Boucherie et al. “Comparison of gepant effects at therapeutic plasma concentrations: connecting” The Journal of Headache and Pain (2024) 25:141. 5. Michael Thomas Eller et al. “Novel Calcitonin Gene-Related Peptide (CGRP) Interfering Migraine Therapies and Stroke& 8212;A Review” Int. J. Mol. Sci. 2024, 25(21), 11685. 6. Andrew F. Russo “ CALCITONIN GENE-RELATED PEPTIDE: A New Target for Migraine” Annu Rev Pharmacol Toxicol. 2015 ; 55: 533& 8211;552. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-07-11 06:47:54최병철 박사 -
 CMG제약 '나라필', ODF 기술력으로 시장 혁신 주도[데일리팜=황병우 기자] 국내 최초 필름형 편두통 치료제인 '나라필 구강용해필름'이 출시 후 빠른 효과와 복용 편의성을 앞세워 시장의 주목을 받고 있다. 편두통 환자는 다양한 상황에서 치료제를 복용해야 하는 만큼 치료 접근성이 제형의 혁신으로 한 단계 높아지고 있다는 평가다. 구강용해필름(ODF) 한 장으로 낮춘 복약 부담 나라필은 트립탄(triptan) 계열 편두통 치료 성분인 나라트립탄을 필름 형태로 제제화한 것으로, 세계 최초로 나라트립탄 성분을 구강에서 녹여 복용할 수 있게 만든 제품이다. 나라필 ODF의 가장 큰 장점은 복약 편의성이다. 기존 편두통 치료제들은 정제 또는 캡슐 형태로 물과 함께 삼켜야 했지만, 필름 제형은 언제 어디서든 간편하게 복용할 수 있다. 조세형 CMG제약 마케팅실 팀장은 "입에 넣고 녹이기만 하면 되기 때문에 별도의 물이 필요 없고, 필름이 빠르게 위장 운동성이 저하된 환자에게도 약물이 신속히 흡수된다"며 "증상 발생 초기에 약물을 투여하기 쉬워졌고, 환자들은 더 빠른 두통 완화 효과를 기대할 수 있다"고 설명했다. 얇은 필름을 물 없이 입안에 투여하면 순식간에 녹아 유효성분이 구강 점막을 통해 빠르게 흡수되므로, 기존 정제 복용 시 흔했던 구토나 메스꺼움 등의 부작용을 최소화하고 효과 발현 시간도 단축시킨다. 특히 편두통 발작 시 복통·구역 등 위장관 증상으로 알약을 삼키기 어려운 환자들도 필름 제형 덕분에 복약 부담을 크게 덜 수 있게 됐다. 주민경 신촌세브란스병원 신경과 교수는 "편두통에 대한 인식 증가로 약물 제형에 대한 다양한 니즈가 있었는데 나라필 ODF는 환자에게 필요한 제형"이라며 "파우치 사이즈로 지갑, 휴대폰케이스 등 휴대하기 편하고 물 없이도 쓴맛과 입 안에 잔여감이 없어 어디서든 복용할 수 있어 심리적 안정감을 줄 수 있다"고 평가했다. 또 조수진 동탄성심병원 신경과 교수는 "약을 먹는 시간의 차이가 더 많은 효과의 차이를 나타내므로 물 없이 복용하는 점이 더 많은 효과 기대한다"고 전했다. 나라필 ODF가 필요한 때 즉시 복용할 수 있는 손쉬운 투여 방식을 제공함으로써 치료 만족도를 높이고 있다는 시각이다. 나라필 ODF 제형의 핵심 'STARFILM'…특허기술로 차별화 나라필의 혁신 뒤에는 CMG제약의 독자적인 기술력이 자리하고 있다. CMG제약은 국내 제약사 중 가장 앞선 ODF 기술을 보유하고 있는 것으로 평가받는다. 국내 최초로 ODF 전용 생산라인을 구축하여 제형 개발부터 대량 생산까지 전 주기에 걸친 경쟁력을 갖추었으며, 이를 기반으로 다양한 필름형 제제 포트폴리오를 확장해오고 있다. 회사 측에 따르면, ODF 제형은 약물의 균일한 분산, 신속한 용해, 기계적 강도, 미각 마스킹 등 여러 요소를 동시에 충족해야 하는 고난도 기술이다. CMG제약은 자체 개발한 STARFILM 기술을 통해 이러한 난제를 해결했다. STARFILM은 각각 Smooth, Thin, Advanced Stability, Refreshing Taste의 약자로, 필름 제형을 부드럽고 유연하게 만들고, 종이처럼 얇게 구현하여 빠른 용해와 휴대성을 높였다. STARFILM 특허기술 덕분에 나라필 ODF는 필름 제형 특유의 쓴맛과 잔여감이 전혀 없으며, 환자가 쉽고 편하게 약물을 복용할 수 있다. 특히 쓴맛 차폐와 약물 안전성 기술 분야는 CMG제약이 국내에서 유일하게 특허를 보유하고 있는 영역으로, 경쟁사 대비 확실한 강점으로 꼽힌다. CMG제약은 이러한 기술력을 통해 고점도나 난용성 약물도 안정적으로 필름화할 수 있는 혼합·건조 공정을 확보했으며, 이를 바탕으로 국내외 시장에서 ODF 제형 기술 우수성을 인정받고 있다. 실제로 CMG제약은 동일 ODF 기술을 적용한 필름형 조현병 치료제 '메조피(구 데핍조, 성분명 아리피프라졸)'로 미국 식품의약국(FDA_ 품목허가를 획득하는 등 필름형 제제에 대한 글로벌 경쟁력도 입증했다. 조 팀장은 "회사의 ODF 기술력은 국내 제약사 중 압도적인 수준으로 기술의 독자성과 안정성을 바탕으로 환자가 더 편리하게 약물을 복용할 수 있도록 돕는 혁신 제형 개발에 집중하고 있다"고 강조했다. 삼일제약과 공동마케팅 시장 공략 드라이브 CMG제약은 나라필 ODF 출시와 함께 삼일제약과 전략적 공동마케팅을 진행하여 제품 확산에 시너지를 내고 있다. 유통·영업 역량을 갖춘 삼일제약과의 협력을 통해 출시 2년 차에 전년 대비 250% 이상의 매출 성장률을 기대할 정도로 가파른 상승세를 보이고 있으며, 현재 다수의 주요 대학병원에서 처방이 이루어지는 등 시장 안착에 성공했다. 이는 동일 성분의 다른 제형 경쟁품들 대비 가장 빠른 초기 침투율이라는 평가로, 나라필 ODF가 짧은 기간 내 점유율을 크게 확대했음을 보여준다. 조 팀장은 "기존 정제 대비 복약 순응도와 휴대성 측면에서 차별화된 장점이 의료진과 소비자 모두에게 긍정적인 피드백을 받았고, 이러한 특성이 실제 처방량 증가와 재처방률 향상으로 이어졌다"고 말했다. 회사는 향후에도 공동마케팅 시너지를 지속 확대하여 편두통 치료제 시장에서시장 지배력을 강화할 계획이다. 특히 CMG제약은 나라필 ODF를 시작으로 트립탄 계열 필름 제제 라인업을 확장하는 청사진도 제시했다. 나라필 ODF 출시를 시작으로 알모트립탄, 졸미트립탄 등 트립탄 계열 편두통 치료제를 ODF로 개발하는 '트립탄 ODF 패밀리' 전략을 구축해 편두통 치료제 시장 점유율 확대를 추진하고 있다. 조 팀장은 "CMG에서는 주요 상급병원 대상 편두통 환자에게서 ODF의 임상적 유용성을 확인하기 위한 추가 임상연구를 추가 임상연구를 계획하고 있다"며 "나라필 출시를 시작으로 알모트립탄, 졸미트립탄, 프로바트립탄 등 트립탄 계열의 편두통 치료제 ODF 단일제와 복합제 등 '트립탄 ODF 패밀리' 전략을 구축, 편두통 치료제 시장에서 점유율을 높일 예정이다"고 덧붙였다.2025-06-23 06:00:10황병우
CMG제약 '나라필', ODF 기술력으로 시장 혁신 주도[데일리팜=황병우 기자] 국내 최초 필름형 편두통 치료제인 '나라필 구강용해필름'이 출시 후 빠른 효과와 복용 편의성을 앞세워 시장의 주목을 받고 있다. 편두통 환자는 다양한 상황에서 치료제를 복용해야 하는 만큼 치료 접근성이 제형의 혁신으로 한 단계 높아지고 있다는 평가다. 구강용해필름(ODF) 한 장으로 낮춘 복약 부담 나라필은 트립탄(triptan) 계열 편두통 치료 성분인 나라트립탄을 필름 형태로 제제화한 것으로, 세계 최초로 나라트립탄 성분을 구강에서 녹여 복용할 수 있게 만든 제품이다. 나라필 ODF의 가장 큰 장점은 복약 편의성이다. 기존 편두통 치료제들은 정제 또는 캡슐 형태로 물과 함께 삼켜야 했지만, 필름 제형은 언제 어디서든 간편하게 복용할 수 있다. 조세형 CMG제약 마케팅실 팀장은 "입에 넣고 녹이기만 하면 되기 때문에 별도의 물이 필요 없고, 필름이 빠르게 위장 운동성이 저하된 환자에게도 약물이 신속히 흡수된다"며 "증상 발생 초기에 약물을 투여하기 쉬워졌고, 환자들은 더 빠른 두통 완화 효과를 기대할 수 있다"고 설명했다. 얇은 필름을 물 없이 입안에 투여하면 순식간에 녹아 유효성분이 구강 점막을 통해 빠르게 흡수되므로, 기존 정제 복용 시 흔했던 구토나 메스꺼움 등의 부작용을 최소화하고 효과 발현 시간도 단축시킨다. 특히 편두통 발작 시 복통·구역 등 위장관 증상으로 알약을 삼키기 어려운 환자들도 필름 제형 덕분에 복약 부담을 크게 덜 수 있게 됐다. 주민경 신촌세브란스병원 신경과 교수는 "편두통에 대한 인식 증가로 약물 제형에 대한 다양한 니즈가 있었는데 나라필 ODF는 환자에게 필요한 제형"이라며 "파우치 사이즈로 지갑, 휴대폰케이스 등 휴대하기 편하고 물 없이도 쓴맛과 입 안에 잔여감이 없어 어디서든 복용할 수 있어 심리적 안정감을 줄 수 있다"고 평가했다. 또 조수진 동탄성심병원 신경과 교수는 "약을 먹는 시간의 차이가 더 많은 효과의 차이를 나타내므로 물 없이 복용하는 점이 더 많은 효과 기대한다"고 전했다. 나라필 ODF가 필요한 때 즉시 복용할 수 있는 손쉬운 투여 방식을 제공함으로써 치료 만족도를 높이고 있다는 시각이다. 나라필 ODF 제형의 핵심 'STARFILM'…특허기술로 차별화 나라필의 혁신 뒤에는 CMG제약의 독자적인 기술력이 자리하고 있다. CMG제약은 국내 제약사 중 가장 앞선 ODF 기술을 보유하고 있는 것으로 평가받는다. 국내 최초로 ODF 전용 생산라인을 구축하여 제형 개발부터 대량 생산까지 전 주기에 걸친 경쟁력을 갖추었으며, 이를 기반으로 다양한 필름형 제제 포트폴리오를 확장해오고 있다. 회사 측에 따르면, ODF 제형은 약물의 균일한 분산, 신속한 용해, 기계적 강도, 미각 마스킹 등 여러 요소를 동시에 충족해야 하는 고난도 기술이다. CMG제약은 자체 개발한 STARFILM 기술을 통해 이러한 난제를 해결했다. STARFILM은 각각 Smooth, Thin, Advanced Stability, Refreshing Taste의 약자로, 필름 제형을 부드럽고 유연하게 만들고, 종이처럼 얇게 구현하여 빠른 용해와 휴대성을 높였다. STARFILM 특허기술 덕분에 나라필 ODF는 필름 제형 특유의 쓴맛과 잔여감이 전혀 없으며, 환자가 쉽고 편하게 약물을 복용할 수 있다. 특히 쓴맛 차폐와 약물 안전성 기술 분야는 CMG제약이 국내에서 유일하게 특허를 보유하고 있는 영역으로, 경쟁사 대비 확실한 강점으로 꼽힌다. CMG제약은 이러한 기술력을 통해 고점도나 난용성 약물도 안정적으로 필름화할 수 있는 혼합·건조 공정을 확보했으며, 이를 바탕으로 국내외 시장에서 ODF 제형 기술 우수성을 인정받고 있다. 실제로 CMG제약은 동일 ODF 기술을 적용한 필름형 조현병 치료제 '메조피(구 데핍조, 성분명 아리피프라졸)'로 미국 식품의약국(FDA_ 품목허가를 획득하는 등 필름형 제제에 대한 글로벌 경쟁력도 입증했다. 조 팀장은 "회사의 ODF 기술력은 국내 제약사 중 압도적인 수준으로 기술의 독자성과 안정성을 바탕으로 환자가 더 편리하게 약물을 복용할 수 있도록 돕는 혁신 제형 개발에 집중하고 있다"고 강조했다. 삼일제약과 공동마케팅 시장 공략 드라이브 CMG제약은 나라필 ODF 출시와 함께 삼일제약과 전략적 공동마케팅을 진행하여 제품 확산에 시너지를 내고 있다. 유통·영업 역량을 갖춘 삼일제약과의 협력을 통해 출시 2년 차에 전년 대비 250% 이상의 매출 성장률을 기대할 정도로 가파른 상승세를 보이고 있으며, 현재 다수의 주요 대학병원에서 처방이 이루어지는 등 시장 안착에 성공했다. 이는 동일 성분의 다른 제형 경쟁품들 대비 가장 빠른 초기 침투율이라는 평가로, 나라필 ODF가 짧은 기간 내 점유율을 크게 확대했음을 보여준다. 조 팀장은 "기존 정제 대비 복약 순응도와 휴대성 측면에서 차별화된 장점이 의료진과 소비자 모두에게 긍정적인 피드백을 받았고, 이러한 특성이 실제 처방량 증가와 재처방률 향상으로 이어졌다"고 말했다. 회사는 향후에도 공동마케팅 시너지를 지속 확대하여 편두통 치료제 시장에서시장 지배력을 강화할 계획이다. 특히 CMG제약은 나라필 ODF를 시작으로 트립탄 계열 필름 제제 라인업을 확장하는 청사진도 제시했다. 나라필 ODF 출시를 시작으로 알모트립탄, 졸미트립탄 등 트립탄 계열 편두통 치료제를 ODF로 개발하는 '트립탄 ODF 패밀리' 전략을 구축해 편두통 치료제 시장 점유율 확대를 추진하고 있다. 조 팀장은 "CMG에서는 주요 상급병원 대상 편두통 환자에게서 ODF의 임상적 유용성을 확인하기 위한 추가 임상연구를 추가 임상연구를 계획하고 있다"며 "나라필 출시를 시작으로 알모트립탄, 졸미트립탄, 프로바트립탄 등 트립탄 계열의 편두통 치료제 ODF 단일제와 복합제 등 '트립탄 ODF 패밀리' 전략을 구축, 편두통 치료제 시장에서 점유율을 높일 예정이다"고 덧붙였다.2025-06-23 06:00:10황병우 -
 SK케미칼, 편두통 라인업 확대…오리지널 조믹정 확보[데일리팜=이탁순 기자] SK케미칼이 편두통 치료제 라인업을 확대하며, 시장 경쟁력을 높이고 있다. 작년 국내 최초 수마트립탄+나프록센 복합제 '수벡스정'을 출시한 데 이어 6월부터는 졸미트립탄 성분 오리지널 '조믹정'까지 품으며 시장 강자로 떠오르고 있다. 25일 업계에 따르면 종전 아스트라제네카가 공급하는 조믹정은 양도·양수를 통해 6월부터 급여 권리도 SK케미칼이 가져온다. 조믹정은 글로벌 판권 이슈와 맞물려 국내에서도 작년 10월부터 아스트라제네카에서 SK케미칼로 판매권이 이동됐다. 이후 급여 양도·양수 절차도 진행돼 6월부로 국내 모든 권리가 SK케미칼로 귀속되는 것이다. 조믹정은 편두통 치료제를 시장을 이끌고 있는 트립탄 계열의 약제로, 아직 동일성분 제네릭이 없다는 장점이 있다. 작년 유비스트 기준 원외처방액은 34억원이다. 국내에서 트립탄 계열 성분은 나라트립탄, 수마트립탄, 알모트립탄, 졸미트립탄, 프로바트립탄 등이 있다. 이 가운데 글락소스미스클라인가 나라트립탄과 수마트립탄 오리지널약제인 나라믹정과 이미그란정을 통해 시장을 이끌고 있다. 두 약제의 작년 유비스트 기준 원외처방액 합계는 약 108억원이다. 이런 가운데 SK케미칼은 기존 프로바트립탄 성분 미가드정과 작년 출시한 유일 복합제 수벡스정, 이번에 졸미트립탄 오리지널 조믹정까지 확보하면서 글락소스미스클라인을 추격할 수 있는 라인업을 구성했다. 작년 미가드정과 수벡스정, 조믹정을 합친 유비스트 원외처방액은 약 61억원이다. 편두통은 뇌 주변 혈관 및 신경의 기능이상으로 심장이 뛰듯 욱신거리는 박동성 통증이 머리의 한쪽 또는 양쪽에서 발생하는 질환이다. 기존 트립탄 성분 치료제들은 신경전달물질인 세로토닌을 감소시켜 통증을 완화하는 기전을 갖고 있다. 작년 SK케미칼이 출시한 수벡스정은 수마트립탄 성분에 신경 염증을 억제하는 나프로센을 결합시켜 단일제 대비 높은 두통 완화 효과를 장점으로 갖고 있다. SK케미칼은 편두통 치료제 점유율을 2028년까지 30%로 끌어올린다는 계획인데, 이번 조믹정 확보로 목표를 조기 달성할 수 있다는 관측도 나온다.2025-05-25 16:22:39이탁순
SK케미칼, 편두통 라인업 확대…오리지널 조믹정 확보[데일리팜=이탁순 기자] SK케미칼이 편두통 치료제 라인업을 확대하며, 시장 경쟁력을 높이고 있다. 작년 국내 최초 수마트립탄+나프록센 복합제 '수벡스정'을 출시한 데 이어 6월부터는 졸미트립탄 성분 오리지널 '조믹정'까지 품으며 시장 강자로 떠오르고 있다. 25일 업계에 따르면 종전 아스트라제네카가 공급하는 조믹정은 양도·양수를 통해 6월부터 급여 권리도 SK케미칼이 가져온다. 조믹정은 글로벌 판권 이슈와 맞물려 국내에서도 작년 10월부터 아스트라제네카에서 SK케미칼로 판매권이 이동됐다. 이후 급여 양도·양수 절차도 진행돼 6월부로 국내 모든 권리가 SK케미칼로 귀속되는 것이다. 조믹정은 편두통 치료제를 시장을 이끌고 있는 트립탄 계열의 약제로, 아직 동일성분 제네릭이 없다는 장점이 있다. 작년 유비스트 기준 원외처방액은 34억원이다. 국내에서 트립탄 계열 성분은 나라트립탄, 수마트립탄, 알모트립탄, 졸미트립탄, 프로바트립탄 등이 있다. 이 가운데 글락소스미스클라인가 나라트립탄과 수마트립탄 오리지널약제인 나라믹정과 이미그란정을 통해 시장을 이끌고 있다. 두 약제의 작년 유비스트 기준 원외처방액 합계는 약 108억원이다. 이런 가운데 SK케미칼은 기존 프로바트립탄 성분 미가드정과 작년 출시한 유일 복합제 수벡스정, 이번에 졸미트립탄 오리지널 조믹정까지 확보하면서 글락소스미스클라인을 추격할 수 있는 라인업을 구성했다. 작년 미가드정과 수벡스정, 조믹정을 합친 유비스트 원외처방액은 약 61억원이다. 편두통은 뇌 주변 혈관 및 신경의 기능이상으로 심장이 뛰듯 욱신거리는 박동성 통증이 머리의 한쪽 또는 양쪽에서 발생하는 질환이다. 기존 트립탄 성분 치료제들은 신경전달물질인 세로토닌을 감소시켜 통증을 완화하는 기전을 갖고 있다. 작년 SK케미칼이 출시한 수벡스정은 수마트립탄 성분에 신경 염증을 억제하는 나프로센을 결합시켜 단일제 대비 높은 두통 완화 효과를 장점으로 갖고 있다. SK케미칼은 편두통 치료제 점유율을 2028년까지 30%로 끌어올린다는 계획인데, 이번 조믹정 확보로 목표를 조기 달성할 수 있다는 관측도 나온다.2025-05-25 16:22:39이탁순 -
 녹여먹는 편두통 치료제 '너텍', 적응증 확대 시도[데일리팜=이혜경 기자] 경구용 CGRP 수용체 길항제로 녹여 먹는 편두통 신약인 '너텍(리메제판트황산염)'이 적응증 확대를 위한 임상 3상에 들어간다. 식품의약품안전처는 지난 23일 한국화이자제약이 신청한 '18~45세 여성 시험대상자를 대상으로 위약과 비교한 리메제판트의 월경 편두통의 예방을 조사하는 중재적 유효성 및 안전성, 제3상, 이중 눈가림, 평행군 임상시험'을 승인했다. 지난 3월 신약으로 허가 받은 너텍구강붕해정75mg은 ▲성인에서의 전조증상을 수반하거나 수반하지 않는 편두통의 급성치료 ▲성인에서의 삽화성 편두통의 예방 등의 2개의 적응증을 확보했다. 여기에 월경성 편두통의 예방을 위한 효능·효과 확인을 위해 국내 18세 이상 65세 미만을 대상으로 3b상에 들어간다. 다국가 임상으로 진행되는 이번 3b상은 전 세계 470명에서 국내에서는 38명을 대상으로 세브란스병원, 동탄성심병원, 강북삼성병원, 이대서울병원, 을지대병원 등 5곳에서 진행된다. 너텍은 편두통 발생에 관여하는 것으로 알려진 칼시토닌 유전자 관련 펩타이드(CGRP)의 수용체를 타겟하는 1일 1회 경구용 CGRP 수용체 길항제로, CGRP를 표적해 발병 빈도와 강도를 낮추는 데 효과를 보인다. 국내에서는 지난해 국내 최초·유일의 경구용 CGRP 수용체 길항제로 '아큅타(아토제판트)를 출시했다. 너텍은 두 번째 경구용 CGRP 수용체 길항제 이지만 매일 복용하는 아큅타와 달리 48시간 효능·효과를 보여 이틀에 한 번 복용하도록 접근성이 개선됐다. 경구제 이외 그동안에는 CGRP 치료제는 주사제인 한국릴리의 '앰겔러티(갈카네주맙, 유전자재조합), 한국테바의 '아조비오토인젝터주(프레마네주맙,유전자재조합)' 등이 있었다. 하지만 국내에서는 월경성 편두통을 적응증으로 확보한 CGRP 치료제는 없다. 글락소스미스클라인의 '이미그란(수마트랍탄숙신산염)'이 ▲전조증상을 수반하거나 수반하지 않는 편두통의 조속한 완화 ▲여성의 생리주기와 관련한 편두통의 조속한 완화 등을 적응증으로 갖고 있다. 월경성 편두통(Menstrually Associated Migraine, MAM)은 여성의 생리주기와 관계되어 월경시기 전후에 나타나는 편두통을 의미한다. 월경성 편두통을 겪는 환자는 대부분 편두통 환자로 월경시기에 다른 시기보다 편두통이 빈번하게 나타나며 통증의 정도도 강한 것으로 나타나 있다. 약 60%의 여성이 월경 기간에 편두통이 빈번히 발생하는 것으로 돼 있어 편두통을 갖고 있는 여성 환자의 경우 월경성 편두통 인지를 확인해야 한다.2025-05-25 08:35:32이혜경
녹여먹는 편두통 치료제 '너텍', 적응증 확대 시도[데일리팜=이혜경 기자] 경구용 CGRP 수용체 길항제로 녹여 먹는 편두통 신약인 '너텍(리메제판트황산염)'이 적응증 확대를 위한 임상 3상에 들어간다. 식품의약품안전처는 지난 23일 한국화이자제약이 신청한 '18~45세 여성 시험대상자를 대상으로 위약과 비교한 리메제판트의 월경 편두통의 예방을 조사하는 중재적 유효성 및 안전성, 제3상, 이중 눈가림, 평행군 임상시험'을 승인했다. 지난 3월 신약으로 허가 받은 너텍구강붕해정75mg은 ▲성인에서의 전조증상을 수반하거나 수반하지 않는 편두통의 급성치료 ▲성인에서의 삽화성 편두통의 예방 등의 2개의 적응증을 확보했다. 여기에 월경성 편두통의 예방을 위한 효능·효과 확인을 위해 국내 18세 이상 65세 미만을 대상으로 3b상에 들어간다. 다국가 임상으로 진행되는 이번 3b상은 전 세계 470명에서 국내에서는 38명을 대상으로 세브란스병원, 동탄성심병원, 강북삼성병원, 이대서울병원, 을지대병원 등 5곳에서 진행된다. 너텍은 편두통 발생에 관여하는 것으로 알려진 칼시토닌 유전자 관련 펩타이드(CGRP)의 수용체를 타겟하는 1일 1회 경구용 CGRP 수용체 길항제로, CGRP를 표적해 발병 빈도와 강도를 낮추는 데 효과를 보인다. 국내에서는 지난해 국내 최초·유일의 경구용 CGRP 수용체 길항제로 '아큅타(아토제판트)를 출시했다. 너텍은 두 번째 경구용 CGRP 수용체 길항제 이지만 매일 복용하는 아큅타와 달리 48시간 효능·효과를 보여 이틀에 한 번 복용하도록 접근성이 개선됐다. 경구제 이외 그동안에는 CGRP 치료제는 주사제인 한국릴리의 '앰겔러티(갈카네주맙, 유전자재조합), 한국테바의 '아조비오토인젝터주(프레마네주맙,유전자재조합)' 등이 있었다. 하지만 국내에서는 월경성 편두통을 적응증으로 확보한 CGRP 치료제는 없다. 글락소스미스클라인의 '이미그란(수마트랍탄숙신산염)'이 ▲전조증상을 수반하거나 수반하지 않는 편두통의 조속한 완화 ▲여성의 생리주기와 관련한 편두통의 조속한 완화 등을 적응증으로 갖고 있다. 월경성 편두통(Menstrually Associated Migraine, MAM)은 여성의 생리주기와 관계되어 월경시기 전후에 나타나는 편두통을 의미한다. 월경성 편두통을 겪는 환자는 대부분 편두통 환자로 월경시기에 다른 시기보다 편두통이 빈번하게 나타나며 통증의 정도도 강한 것으로 나타나 있다. 약 60%의 여성이 월경 기간에 편두통이 빈번히 발생하는 것으로 돼 있어 편두통을 갖고 있는 여성 환자의 경우 월경성 편두통 인지를 확인해야 한다.2025-05-25 08:35:32이혜경 -
 자카비정 등 13개 품목 5월 약가인하…5개는 자진 조정[데일리팜=이탁순 기자] 5월 1일부터 약제급여목록에 있는 13개 품목의 상한금액이 인하된다. 이 가운데 5개 품목은 업체 자진 인하 신청에 따른 것이다. 28일 업계에 따르면 사용량-약가 연동 협상 체결로 자카비정 상한금액이 인하되는 등 5월 총 13개 품목의 약가가 하향 조정된다. 골수섬유증치료제 자카비정(록소리티닙인산염, 노바티스)은 사용량-약가 연동 협상 유형 나에 의해 상한금액이 인하된다. 유형(나) 협상의 경우 유형(가)에 의해 상한금액이 조정됐거나 유형(가) 협상을 하지 않고 최초 등재일 혹은 상한금액이 협상을 통해 조정된 날로부터 4년이 지난 동일제품군의 청구액이 전년도 청구액보다 60% 이상 증가했거나, 10% 이상 증가했으며 그 증가액이 50억원 이상인 경우 건강보험공단과 약가 협상을 통해 상한금액이 조정된다. 이에따라 자카비정5mg이 2만5962원에서 2만5339원으로, 자카비정10mg은 3만8943원에서 3만8398원으로, 자카비정15mg은 5만2199원에서 5만946원으로, 자카비정20mg은 5만2213원에서 5만960원으로 인하된다. 역형성 림프종 인산화효소(ALK)-양성 국소진행성 또는 전이성 비소세포폐암 1차 치료제로 급여가 확대된 로비큐아는 위험분담 계약 약제의 사용범위 확대에 따른 상한금액 조정 절차를 밟았다. 이에 로비큐아정25mg은 5만2819원에서 5만1234원으로, 로비큐아정100mg은 15만8457원에서 15만3703원으로 인하된다. 편두통치료제 나라트립탄 2개 품목은 가산 종료로 약가가 인하된다. 나라트립탄 구강붕해정 2.5mg 제품이 4개 이상 됐기 때문이다. 보건당국은 가산기간(1년)이 경과 후 기등재된 동일제제 회사수가 3개 이하로 가산이 유지 중인 상황에서 4개사 이상이 된 경우에는 곧바로 가산을 종료시킨다. 이에 씨엠지제약 나라필구강용해필름2.5mg이 2437원에서 2193원으로, 유유제약 나그란구강붕해정2.5mg이 2867원에서 2193원으로 인하된다. 이들 품목은 지난달 퍼스트제네릭 가산이 유지되기로 했으나, 한 달만에 동일제제가 진입하면서 가산이 종료된 케이스다. 업체의 자진인하 신청에 따라 상한금액이 인하되는 품목은 총 5개이다. 대웅바이오 쎄로타핀정 3개품목과 부광약품 아리플러스정, 현대약품 디엠듀오정이 그 주인공이다. 이에 쎄로타핀정25mg은 274원에서 230원으로, 쎄로타핀정100mg은 688원에서 544원으로, 쎄로타핀정200mg은 1012원에서 927원으로 인하된다. 또 아리플러스정은 3879원에서 2990원으로, 디엠듀오정은 3879원에서 3658원으로 조정된다. 아리플러스와 디엠듀오는 도네페질+메만틴 복합제로 지난 3월 급여 등재된 바 있다. 부광과 현대는 출시 2개월 만에 약가를 자진해 내린 것이다.2025-04-28 10:52:53이탁순
자카비정 등 13개 품목 5월 약가인하…5개는 자진 조정[데일리팜=이탁순 기자] 5월 1일부터 약제급여목록에 있는 13개 품목의 상한금액이 인하된다. 이 가운데 5개 품목은 업체 자진 인하 신청에 따른 것이다. 28일 업계에 따르면 사용량-약가 연동 협상 체결로 자카비정 상한금액이 인하되는 등 5월 총 13개 품목의 약가가 하향 조정된다. 골수섬유증치료제 자카비정(록소리티닙인산염, 노바티스)은 사용량-약가 연동 협상 유형 나에 의해 상한금액이 인하된다. 유형(나) 협상의 경우 유형(가)에 의해 상한금액이 조정됐거나 유형(가) 협상을 하지 않고 최초 등재일 혹은 상한금액이 협상을 통해 조정된 날로부터 4년이 지난 동일제품군의 청구액이 전년도 청구액보다 60% 이상 증가했거나, 10% 이상 증가했으며 그 증가액이 50억원 이상인 경우 건강보험공단과 약가 협상을 통해 상한금액이 조정된다. 이에따라 자카비정5mg이 2만5962원에서 2만5339원으로, 자카비정10mg은 3만8943원에서 3만8398원으로, 자카비정15mg은 5만2199원에서 5만946원으로, 자카비정20mg은 5만2213원에서 5만960원으로 인하된다. 역형성 림프종 인산화효소(ALK)-양성 국소진행성 또는 전이성 비소세포폐암 1차 치료제로 급여가 확대된 로비큐아는 위험분담 계약 약제의 사용범위 확대에 따른 상한금액 조정 절차를 밟았다. 이에 로비큐아정25mg은 5만2819원에서 5만1234원으로, 로비큐아정100mg은 15만8457원에서 15만3703원으로 인하된다. 편두통치료제 나라트립탄 2개 품목은 가산 종료로 약가가 인하된다. 나라트립탄 구강붕해정 2.5mg 제품이 4개 이상 됐기 때문이다. 보건당국은 가산기간(1년)이 경과 후 기등재된 동일제제 회사수가 3개 이하로 가산이 유지 중인 상황에서 4개사 이상이 된 경우에는 곧바로 가산을 종료시킨다. 이에 씨엠지제약 나라필구강용해필름2.5mg이 2437원에서 2193원으로, 유유제약 나그란구강붕해정2.5mg이 2867원에서 2193원으로 인하된다. 이들 품목은 지난달 퍼스트제네릭 가산이 유지되기로 했으나, 한 달만에 동일제제가 진입하면서 가산이 종료된 케이스다. 업체의 자진인하 신청에 따라 상한금액이 인하되는 품목은 총 5개이다. 대웅바이오 쎄로타핀정 3개품목과 부광약품 아리플러스정, 현대약품 디엠듀오정이 그 주인공이다. 이에 쎄로타핀정25mg은 274원에서 230원으로, 쎄로타핀정100mg은 688원에서 544원으로, 쎄로타핀정200mg은 1012원에서 927원으로 인하된다. 또 아리플러스정은 3879원에서 2990원으로, 디엠듀오정은 3879원에서 3658원으로 조정된다. 아리플러스와 디엠듀오는 도네페질+메만틴 복합제로 지난 3월 급여 등재된 바 있다. 부광과 현대는 출시 2개월 만에 약가를 자진해 내린 것이다.2025-04-28 10:52:53이탁순 -
 한미, '넬클리어' 제네릭 첫 허가...편두통 신약 '너텍' 승인[데일리팜=이혜경 기자] 한미약품이 일반약 손발톱 무좀 외용제 시장 경쟁에 뛰어들었습니다. 지난 2024년 허가 받고 급여 문제로 출시를 하지 않고 있는 코오롱제약의 '넬클리어외용액'의 첫 제네릭을 허가 받은 것입니다. 한미약품은 지난해 넬클리어외용액 제제특허에 도전장을 내밀면서, 제네릭 허가에 이미 도전장을 내민 바 있습니다. 지난달에는 편두통 치료와 예방목적으로 모두 쓰이는 '너텍구강붕해정75mg(리메제판트황산염)'이 신약으로 국내 허가를 받기도 했습니다. 식약처의 3월 의약품 허가 현황을 보면, 일반의약품 57개 품목, 전문의약품 71개 품목 등 128개 품목이 허가를 받았습니다. 식약처는 매달 의료제품 허가현황을 공개하고 있는데, 정보공개 대상은 신약, 자료제출의약품, 조건부 허가 의약품 등에 한정하고 있습니다. ◆일반의약품=올해 3월 허가(신고)된 일반약은 모두 57개 품목으로 나타났습니다. 제조법을 공인한 표준제조기준 품목이 37개 품목, 제네릭 등 기타품목이 16개 품목을 보였습니다. 자료제출의약품은 4개 품목으로 집계됐습니다. 한미약품 '무조날맥스외용액' (3월 10일, 제네릭) 한미약품이 코오롱제약의 손발톱 무좀치료제 일반의약품 '넬클리어외용액(테르비나핀)' 첫 제네릭을 허가 받았습니다. 지난 2023년 허가 받은 넬클리어외용액이 출시도 되기 전에 제네릭이 허가를 받으면서 벌써부터 경쟁을 예고한 상황입니다. 손발톱 무좀 외용제 시장은 동아에스티가 지난 2017년 출시한 '주블리아'가 시장점유율에서 압도적으로 1위를 기록하고 있지만, 넬클리어외용액이 일반약이면서 급여도전을 하고 있는 것으로 알려져 국내사들의 관심이 모아지고 있었습니다. 일반약 손발톱 무좀치료제 시장에서 발 빠르게 움직인 곳은 한미약품입니다. 한미약품은 지난해 넬클리어외용액을 상대로 제제특허 소극적권리범위확인심판 2건을 제기했습니다. 여기서 1건은 취하하고, '손발톱진균증을 치료하기 위한 국부 항진균 조성물’ 특허에 소극적 권리범위확인심판이 진행 중입니다. 한미약품에 이어 제뉴원사이언스 또한 넬클리어외용액 제네릭에 대한 허가 신청을 진행하고, 추가로 특허회피 청구를 진행한 것으로 알려졌습니다. 넬클리어외용액이 출시도 되기 전에, 이미 일반약 손발톱 무좀치료제 시장 경쟁이 뜨거워지고 있습니다. 한편 한미약품은 전문의약품으로 '무조날정(테르비나핀염산염)', 일반의약품으로는 '무조날크림', '무조날쿨크림', 무조날외용액1%', 무조날에스네일라카'에 이어 무조날맥스외용액까지 추가하면서 5개 제품을 보유하게 됐습니다. 동화약품 '판콜큐건조시럽' (3월 17일 허가, 표준제조기준) 동화약품이 감기약 '판콜' 브랜드 라인업을 확대하고 있습니다. 그동안 '판콜아이시럽', '판콜아이콜드시럽', '판콜에스내복액', 판콜에이내복액', '판콜케어내복액' 등의 판콜 브랜드가 허가 받은 가운데, 이번에 건조시럽을 추가했습니다. 동화약품 자체 매출 집계 기준으로 지난 2023년 판콜 브랜드의 매출액은 511억원을 기록했습니다. 1968년 출시한 동화약품 판콜은 해열과 진통 효과가 있는 아세트아미노펜 성분을 포함한 종합감기약으로, 고객 수요에 따라 다양한 제품군으로 구성됐습니다. 판콜큐건조시럽은 감기의 제증상(콧물, 코막힘, 재채기, 인후(목구멍)통, 가래, 오한(춥고 떨리는 증상), 발열, 두통, 관절통, 근육통)의 완화에 효능·효과를 보입니다. 만 15세 이상이 복용 가능하며, 1일 3회 1회 1포 식후 30분에 물에 녹여 복용합니다. 동화약품의 판콜에스는 지난 2023년, 2024년 2년 연속 감기약 시장 매출 1위를 달성할 만큼 효자 브랜드입니다. 의약품 시장조사기업 아이큐비아에 따르면 2023년 4분기부터 2024년 3분기까지 판콜에스는 누적 358억 매출을 기록했습니다. 이는 약 1430억원 규모 감기약 시장에서 시장점유율 약 25%를 차지하는 규모입니다. 대원제약 '대원쿠쿠르비트연질캡슐(쿠쿠르비트종자유엑스(15~25→1))' (3월 24일 허가, 제네릭) 대원제약이 쿠쿠르비트종자유엑스(서양호박씨오일 추출물) 성분의 일반의약품 전립선비대증 치료제 시장에 뛰어들었습니다. 현재 동일 성분으로 동국제약 '카리토포텐', 풍림무약 '쿠로스타연질캡슐', 유한양행 '카리포맨연질캡슐', 코스맥스파마 '레나토연질캡슐' 등이 허가 받은 상황입니다. 쿠쿠르비트종자유엑스는 불포화 지방산과 피토스테롤 등 다양한 약리 활성 성분이 함유된 생약 성분입니다. 쏘팔메토 성분이 함유된 건강기능식품의 기능성이 '전립선 건강의 유지에 도움을 줄 수 있음'인 점과 달리, 쿠쿠르비트종자유엑스는 불포화 지방산과 피토스테롤 등 다양한 약리 활성성분이 함유된 생약성분으로 유럽에서는 예로부터 요로 문제와 비뇨기 질환 치료에 사용해 왔다고 합니다. 동국제약이 지난 2022년 '카리토포텐'을 출시한지 6개월 만에 매출 30억을 돌파했고, 다음해 매출은 60억원을 기록하자 국내사들의 허가 도전이 이어지고 있습니다. ◆전문의약품=올해 3월 허가 받은 전문의약품은 모두 71개 품목으로 나타났습니다. 신약 3개 품목, 제네릭 등 기타 유형이 40개 품목을 차지했습니다. 의약품이나 염기, 제형 따위의 변화로 안전성, 유효성 심사를 받아 기존 약을 다르게 만든 자료제출의약품은 27개 품목으로 나타났습니다. 동광제약 '엠플로엠서방정' (3월 12일 허가, 자료제출의약품) 동광제약은 지난해 9월 SGLT-2 억제제 계열의 당뇨병치료제 '자디앙듀오(엠파글리플로진·메트포르민)'의 서방형 제인 '엠플로엠서방정10/1000mg'을 처음 허가 받은 이후, 올해 3월까지 총 4개 용량을 확보한 상태입니다. 동광제약은 올해 1월과 3월 엠플로엠서방정 25/1000mg, 5/1000mg, 12.5/1000mg 등 3개 용량을 추가했습니다. 서방형 제형은 약물이 치료 혈중 농도에 도달 후 일정시간 지속되면서 일반 제형 약물보다 복용횟수가 적다는 장점이 있습니다. 따라서 오리지널인 자디앙듀오의 용법은 1일 2회이지만, 엠플로엠서방정은 1일 1회로 복용편의성이 높아졌습니다. 현재 동광제약을 시작으로 동구바이오제약, 에이프로젠바이오로직스, 대원제약 등으로부터 총 11개 품목의 자디앙듀오 제네릭이 허가를 받았습니다. 자디앙듀오는 SGLT-2 억제제 '자디앙'과 메트포르민을 결합한 당뇨병 복합제로 SGLT-2 억제제와 다른 기전으로 혈당을 조절하는 만큼, 혈당을 더욱 효과적으로 관리할 수 있다는 특징이 있습니다. 하지만 아직 물질특허가 만료되지 않은 만큼, 곧바로 출시하기는 어려워 보입니다. 한국화이자제약 '너텍구강붕해정75mg' (3월 24일 허가, 신약) 편두통 치료와 예방목적으로 모두 쓰이는 '너텍구강붕해정75mg(리메제판트황산염)'이 신약으로 국내 허가를 받았습니다. 식약처는 너텍을 전조증상을 수반하거나 수반하지 않는 편두통의 급성 치료, 삽화성 편두통의 예방 등 적응증으로 허가했습니다. 너텍은 지난 2021년 미국에서 성인 급성 편두통 예방, 치료제로 승인된 유일한 경구용 CGRP 수용체 길항제로 이스라엘, 쿠웨이트, 아랍에미레이트, 유럽, 중국 등에서 경구용 편두통 급성 및 예방 목적 치료제로 허가 받은 품목입니다. 화이자는 2022년 5월 미국의 신경성 질환 전문 기업인 바이오헤븐을 116억 달러에 인수하면서 너텍과 칼시토닌 유전자 관련 펩타이드(CGRP) 저해제 '자게르판트' 등의 파이프라인을 확보하게 됐습니다. 너텍은 급성 편두통 환자의 통증을 1시간 내에 정상으로 회복 시키면 48시간까지 효능이 지속됩니다. 이 약은 물 없이 혀 밑에 투여하는 붕해정으로 복용성이 좋다는 평가입니다. 올해 1월 너텍이 중국에서 판매승인을 받았을 당시, 한국과 중국에서 함께 진행한 3상(NCT04574362) 결과가 기반이 된 것으로 알려졌습니다. 한국팜비오 '오라팡이지정' (3월 25일 허가, 자료제출의약품) 한국팜비오가 6년 만에 장정결제 '오라팡정'의 라인업을 확대했습니다. 기존 오라팡보다 알약 크기가 줄어든 오라팡이지정을 출시하면서 복용편의성을 높인다는 계획입니다. 오라팡정은 2019년에 발매된 알약 형태의 장정결제로 미국 식품의약국(FDA) 승인을 받은 3가지 황산염 성분에 장내 기포제거 효과가 있는 '시메티콘'을 포함시킨 것이 특징입니다. 장정결제는 대장내시경 검진 전 장을 비우기 위한 용도로 검진센터나 종합병원에서 사용되는데, 그동안 액제·산제로 물과 희석해 복용하던 시장에서 정제 형태인 오라팡이 출시되면서 국내사들의 관심이 늘어났습니다. 한국팜비오 이후 태준제약, 대웅제약, 인트로바이오파마, 비보존제약 등이 장정결제 정제를 개발하거나 허가를 받고 있는 추세입니다. 특히 후발 제약회사들이 오라팡보다 더 작은 알약의 '미니' 형태로 시장에 뛰어드는 것으로 확인되면서, 한국팜비오 또한 복용 편의성을 높인 오라팡이지정을 허가 받은 것으로 보입니다. 의약품 시장조사기관 아이큐비아에 따르면 오라팡정의 2023년 매출은 97억원으로, 2020년 22억원 대비 3년 새 4배 이상 늘어났습니다. 종근당바이오 '티엠버스주100단위' (3월 31일 허가, 자료제출의약품) 종근당은 자체 개발한 보툴리눔톡신 제제 '티엠버스주100단위(클로스트리디움보툴리눔독소A형)'를 허가 받았습니다. 티엠버스주는 유럽 소재의 연구기관으로부터 독점적으로 분양 받은 균주를 기반으로 개발됐으며, 중등증 및 중증의 미간주름의 치료를 적응증으로 하는 제품입니다. 미국 국립생물공학정보센터(NCBI)의 유전체 정보 데이터베이스인 GenBank에 공식 등록돼 균주의 출처가 명확하다는 평가입니다. 이 제품은 개발부터 제조공정 전반에 걸쳐 동물 유래 성분을 철저히 배제한 비동물성(비건) 공정을 도입해 안전성을 극대화했습니다. 기존 제품들이 동물성 원료로 잠재적인 감염 리스크나 알레르기 유발 가능성을 가지고 있는 것과 달리 티엠버스주는 균주 배양부터 완제품 생산까지 철저히 비동물성 원료와 부형제만을 사용해 안전성을 확보한 것이 특징입니다. 특히 사람혈청알부민(HSA)을 사용하는 일반적인 제조 방식에서 벗어나 비동물성 부형제를 채택해 혈액 유래 병원체 감염의 가능성을 최소화하여 동물성 성분에 민감한 환자 뿐 아니라 비건 소비자층까지 안전하고 폭넓게 사용할 수 있다고 합니다. 보령 '트루다파정5mg' (3월 31일 허가, 제네릭) 보령이 '포시가(다파글리플로진비스L-프롤린)' 제네릭 트루다파의 저함량을 허가 받으면서 제품의 점유율을 늘려나갈 것으로 보입니다. 그동안 포시가 제네릭 5mg으로 허가 받은 품목은 한미약품의 '다파론정'과 경동제약의 '다파진정' 2개 품목 뿐이었습니다. 보령은 한미, 경동에 이어 후발주자로 저함량의 포시가 제네릭을 내놓았지만, 현재 포시가 제네릭 시장의 국내 1위를 트루다파가 차지하고 있는 만큼 경쟁력을 확보했다는 분석입니다. 의약품시장조사기관 유비스트에 따르면 트루다파 제품군의 지난해 원외처방 실적은 47억원으로 다파글리플로진 단일제 및 다파글리플로진·메트포르민 복합제에 대한 제네릭 전체 시장 295억원 가운데 시장점유율 선두를 차지하고 있습니다. 보령은 당뇨병 치료제 시리즈로 '트루다파', '트루시타, '트루버디' 등을 선보이며 당뇨분야 시장 지배력을 높여가고 있습니다. 저함량의 경우 처음 SGLT2 억제제를 복용하는 환자에게 처방하기 좋은 옵션이 될 수 있을 것이란 분석입니다.2025-04-06 17:36:41이혜경
한미, '넬클리어' 제네릭 첫 허가...편두통 신약 '너텍' 승인[데일리팜=이혜경 기자] 한미약품이 일반약 손발톱 무좀 외용제 시장 경쟁에 뛰어들었습니다. 지난 2024년 허가 받고 급여 문제로 출시를 하지 않고 있는 코오롱제약의 '넬클리어외용액'의 첫 제네릭을 허가 받은 것입니다. 한미약품은 지난해 넬클리어외용액 제제특허에 도전장을 내밀면서, 제네릭 허가에 이미 도전장을 내민 바 있습니다. 지난달에는 편두통 치료와 예방목적으로 모두 쓰이는 '너텍구강붕해정75mg(리메제판트황산염)'이 신약으로 국내 허가를 받기도 했습니다. 식약처의 3월 의약품 허가 현황을 보면, 일반의약품 57개 품목, 전문의약품 71개 품목 등 128개 품목이 허가를 받았습니다. 식약처는 매달 의료제품 허가현황을 공개하고 있는데, 정보공개 대상은 신약, 자료제출의약품, 조건부 허가 의약품 등에 한정하고 있습니다. ◆일반의약품=올해 3월 허가(신고)된 일반약은 모두 57개 품목으로 나타났습니다. 제조법을 공인한 표준제조기준 품목이 37개 품목, 제네릭 등 기타품목이 16개 품목을 보였습니다. 자료제출의약품은 4개 품목으로 집계됐습니다. 한미약품 '무조날맥스외용액' (3월 10일, 제네릭) 한미약품이 코오롱제약의 손발톱 무좀치료제 일반의약품 '넬클리어외용액(테르비나핀)' 첫 제네릭을 허가 받았습니다. 지난 2023년 허가 받은 넬클리어외용액이 출시도 되기 전에 제네릭이 허가를 받으면서 벌써부터 경쟁을 예고한 상황입니다. 손발톱 무좀 외용제 시장은 동아에스티가 지난 2017년 출시한 '주블리아'가 시장점유율에서 압도적으로 1위를 기록하고 있지만, 넬클리어외용액이 일반약이면서 급여도전을 하고 있는 것으로 알려져 국내사들의 관심이 모아지고 있었습니다. 일반약 손발톱 무좀치료제 시장에서 발 빠르게 움직인 곳은 한미약품입니다. 한미약품은 지난해 넬클리어외용액을 상대로 제제특허 소극적권리범위확인심판 2건을 제기했습니다. 여기서 1건은 취하하고, '손발톱진균증을 치료하기 위한 국부 항진균 조성물’ 특허에 소극적 권리범위확인심판이 진행 중입니다. 한미약품에 이어 제뉴원사이언스 또한 넬클리어외용액 제네릭에 대한 허가 신청을 진행하고, 추가로 특허회피 청구를 진행한 것으로 알려졌습니다. 넬클리어외용액이 출시도 되기 전에, 이미 일반약 손발톱 무좀치료제 시장 경쟁이 뜨거워지고 있습니다. 한편 한미약품은 전문의약품으로 '무조날정(테르비나핀염산염)', 일반의약품으로는 '무조날크림', '무조날쿨크림', 무조날외용액1%', 무조날에스네일라카'에 이어 무조날맥스외용액까지 추가하면서 5개 제품을 보유하게 됐습니다. 동화약품 '판콜큐건조시럽' (3월 17일 허가, 표준제조기준) 동화약품이 감기약 '판콜' 브랜드 라인업을 확대하고 있습니다. 그동안 '판콜아이시럽', '판콜아이콜드시럽', '판콜에스내복액', 판콜에이내복액', '판콜케어내복액' 등의 판콜 브랜드가 허가 받은 가운데, 이번에 건조시럽을 추가했습니다. 동화약품 자체 매출 집계 기준으로 지난 2023년 판콜 브랜드의 매출액은 511억원을 기록했습니다. 1968년 출시한 동화약품 판콜은 해열과 진통 효과가 있는 아세트아미노펜 성분을 포함한 종합감기약으로, 고객 수요에 따라 다양한 제품군으로 구성됐습니다. 판콜큐건조시럽은 감기의 제증상(콧물, 코막힘, 재채기, 인후(목구멍)통, 가래, 오한(춥고 떨리는 증상), 발열, 두통, 관절통, 근육통)의 완화에 효능·효과를 보입니다. 만 15세 이상이 복용 가능하며, 1일 3회 1회 1포 식후 30분에 물에 녹여 복용합니다. 동화약품의 판콜에스는 지난 2023년, 2024년 2년 연속 감기약 시장 매출 1위를 달성할 만큼 효자 브랜드입니다. 의약품 시장조사기업 아이큐비아에 따르면 2023년 4분기부터 2024년 3분기까지 판콜에스는 누적 358억 매출을 기록했습니다. 이는 약 1430억원 규모 감기약 시장에서 시장점유율 약 25%를 차지하는 규모입니다. 대원제약 '대원쿠쿠르비트연질캡슐(쿠쿠르비트종자유엑스(15~25→1))' (3월 24일 허가, 제네릭) 대원제약이 쿠쿠르비트종자유엑스(서양호박씨오일 추출물) 성분의 일반의약품 전립선비대증 치료제 시장에 뛰어들었습니다. 현재 동일 성분으로 동국제약 '카리토포텐', 풍림무약 '쿠로스타연질캡슐', 유한양행 '카리포맨연질캡슐', 코스맥스파마 '레나토연질캡슐' 등이 허가 받은 상황입니다. 쿠쿠르비트종자유엑스는 불포화 지방산과 피토스테롤 등 다양한 약리 활성 성분이 함유된 생약 성분입니다. 쏘팔메토 성분이 함유된 건강기능식품의 기능성이 '전립선 건강의 유지에 도움을 줄 수 있음'인 점과 달리, 쿠쿠르비트종자유엑스는 불포화 지방산과 피토스테롤 등 다양한 약리 활성성분이 함유된 생약성분으로 유럽에서는 예로부터 요로 문제와 비뇨기 질환 치료에 사용해 왔다고 합니다. 동국제약이 지난 2022년 '카리토포텐'을 출시한지 6개월 만에 매출 30억을 돌파했고, 다음해 매출은 60억원을 기록하자 국내사들의 허가 도전이 이어지고 있습니다. ◆전문의약품=올해 3월 허가 받은 전문의약품은 모두 71개 품목으로 나타났습니다. 신약 3개 품목, 제네릭 등 기타 유형이 40개 품목을 차지했습니다. 의약품이나 염기, 제형 따위의 변화로 안전성, 유효성 심사를 받아 기존 약을 다르게 만든 자료제출의약품은 27개 품목으로 나타났습니다. 동광제약 '엠플로엠서방정' (3월 12일 허가, 자료제출의약품) 동광제약은 지난해 9월 SGLT-2 억제제 계열의 당뇨병치료제 '자디앙듀오(엠파글리플로진·메트포르민)'의 서방형 제인 '엠플로엠서방정10/1000mg'을 처음 허가 받은 이후, 올해 3월까지 총 4개 용량을 확보한 상태입니다. 동광제약은 올해 1월과 3월 엠플로엠서방정 25/1000mg, 5/1000mg, 12.5/1000mg 등 3개 용량을 추가했습니다. 서방형 제형은 약물이 치료 혈중 농도에 도달 후 일정시간 지속되면서 일반 제형 약물보다 복용횟수가 적다는 장점이 있습니다. 따라서 오리지널인 자디앙듀오의 용법은 1일 2회이지만, 엠플로엠서방정은 1일 1회로 복용편의성이 높아졌습니다. 현재 동광제약을 시작으로 동구바이오제약, 에이프로젠바이오로직스, 대원제약 등으로부터 총 11개 품목의 자디앙듀오 제네릭이 허가를 받았습니다. 자디앙듀오는 SGLT-2 억제제 '자디앙'과 메트포르민을 결합한 당뇨병 복합제로 SGLT-2 억제제와 다른 기전으로 혈당을 조절하는 만큼, 혈당을 더욱 효과적으로 관리할 수 있다는 특징이 있습니다. 하지만 아직 물질특허가 만료되지 않은 만큼, 곧바로 출시하기는 어려워 보입니다. 한국화이자제약 '너텍구강붕해정75mg' (3월 24일 허가, 신약) 편두통 치료와 예방목적으로 모두 쓰이는 '너텍구강붕해정75mg(리메제판트황산염)'이 신약으로 국내 허가를 받았습니다. 식약처는 너텍을 전조증상을 수반하거나 수반하지 않는 편두통의 급성 치료, 삽화성 편두통의 예방 등 적응증으로 허가했습니다. 너텍은 지난 2021년 미국에서 성인 급성 편두통 예방, 치료제로 승인된 유일한 경구용 CGRP 수용체 길항제로 이스라엘, 쿠웨이트, 아랍에미레이트, 유럽, 중국 등에서 경구용 편두통 급성 및 예방 목적 치료제로 허가 받은 품목입니다. 화이자는 2022년 5월 미국의 신경성 질환 전문 기업인 바이오헤븐을 116억 달러에 인수하면서 너텍과 칼시토닌 유전자 관련 펩타이드(CGRP) 저해제 '자게르판트' 등의 파이프라인을 확보하게 됐습니다. 너텍은 급성 편두통 환자의 통증을 1시간 내에 정상으로 회복 시키면 48시간까지 효능이 지속됩니다. 이 약은 물 없이 혀 밑에 투여하는 붕해정으로 복용성이 좋다는 평가입니다. 올해 1월 너텍이 중국에서 판매승인을 받았을 당시, 한국과 중국에서 함께 진행한 3상(NCT04574362) 결과가 기반이 된 것으로 알려졌습니다. 한국팜비오 '오라팡이지정' (3월 25일 허가, 자료제출의약품) 한국팜비오가 6년 만에 장정결제 '오라팡정'의 라인업을 확대했습니다. 기존 오라팡보다 알약 크기가 줄어든 오라팡이지정을 출시하면서 복용편의성을 높인다는 계획입니다. 오라팡정은 2019년에 발매된 알약 형태의 장정결제로 미국 식품의약국(FDA) 승인을 받은 3가지 황산염 성분에 장내 기포제거 효과가 있는 '시메티콘'을 포함시킨 것이 특징입니다. 장정결제는 대장내시경 검진 전 장을 비우기 위한 용도로 검진센터나 종합병원에서 사용되는데, 그동안 액제·산제로 물과 희석해 복용하던 시장에서 정제 형태인 오라팡이 출시되면서 국내사들의 관심이 늘어났습니다. 한국팜비오 이후 태준제약, 대웅제약, 인트로바이오파마, 비보존제약 등이 장정결제 정제를 개발하거나 허가를 받고 있는 추세입니다. 특히 후발 제약회사들이 오라팡보다 더 작은 알약의 '미니' 형태로 시장에 뛰어드는 것으로 확인되면서, 한국팜비오 또한 복용 편의성을 높인 오라팡이지정을 허가 받은 것으로 보입니다. 의약품 시장조사기관 아이큐비아에 따르면 오라팡정의 2023년 매출은 97억원으로, 2020년 22억원 대비 3년 새 4배 이상 늘어났습니다. 종근당바이오 '티엠버스주100단위' (3월 31일 허가, 자료제출의약품) 종근당은 자체 개발한 보툴리눔톡신 제제 '티엠버스주100단위(클로스트리디움보툴리눔독소A형)'를 허가 받았습니다. 티엠버스주는 유럽 소재의 연구기관으로부터 독점적으로 분양 받은 균주를 기반으로 개발됐으며, 중등증 및 중증의 미간주름의 치료를 적응증으로 하는 제품입니다. 미국 국립생물공학정보센터(NCBI)의 유전체 정보 데이터베이스인 GenBank에 공식 등록돼 균주의 출처가 명확하다는 평가입니다. 이 제품은 개발부터 제조공정 전반에 걸쳐 동물 유래 성분을 철저히 배제한 비동물성(비건) 공정을 도입해 안전성을 극대화했습니다. 기존 제품들이 동물성 원료로 잠재적인 감염 리스크나 알레르기 유발 가능성을 가지고 있는 것과 달리 티엠버스주는 균주 배양부터 완제품 생산까지 철저히 비동물성 원료와 부형제만을 사용해 안전성을 확보한 것이 특징입니다. 특히 사람혈청알부민(HSA)을 사용하는 일반적인 제조 방식에서 벗어나 비동물성 부형제를 채택해 혈액 유래 병원체 감염의 가능성을 최소화하여 동물성 성분에 민감한 환자 뿐 아니라 비건 소비자층까지 안전하고 폭넓게 사용할 수 있다고 합니다. 보령 '트루다파정5mg' (3월 31일 허가, 제네릭) 보령이 '포시가(다파글리플로진비스L-프롤린)' 제네릭 트루다파의 저함량을 허가 받으면서 제품의 점유율을 늘려나갈 것으로 보입니다. 그동안 포시가 제네릭 5mg으로 허가 받은 품목은 한미약품의 '다파론정'과 경동제약의 '다파진정' 2개 품목 뿐이었습니다. 보령은 한미, 경동에 이어 후발주자로 저함량의 포시가 제네릭을 내놓았지만, 현재 포시가 제네릭 시장의 국내 1위를 트루다파가 차지하고 있는 만큼 경쟁력을 확보했다는 분석입니다. 의약품시장조사기관 유비스트에 따르면 트루다파 제품군의 지난해 원외처방 실적은 47억원으로 다파글리플로진 단일제 및 다파글리플로진·메트포르민 복합제에 대한 제네릭 전체 시장 295억원 가운데 시장점유율 선두를 차지하고 있습니다. 보령은 당뇨병 치료제 시리즈로 '트루다파', '트루시타, '트루버디' 등을 선보이며 당뇨분야 시장 지배력을 높여가고 있습니다. 저함량의 경우 처음 SGLT2 억제제를 복용하는 환자에게 처방하기 좋은 옵션이 될 수 있을 것이란 분석입니다.2025-04-06 17:36:41이혜경 -
 한국애브비, 매출 2년새 2배↑...면역질환 신약 강세[데일리팜=손형민 기자] 면역질환 신약들을 앞세운 한국애브비의 매출이 2년새 2배가 증가한 것으로 나타났다. 한국애브비는 휴미라 후발 자가면역질환 신약인 스카이리치, 린버크로의 세대교체 작업을 성공적으로 진행하고 있다. 4일 금융감독원에 따르면 한국애브비의 작년 매출은 2023년 2347억원에서 지난해 3089억원을 기록하며 32% 증가했다. 같은 기간 영업이익은 115억원에서 147억원으로 27% 늘었다. 그간 한국애브비의 매출은 휴미라가 크게 좌지우지했다. 휴미라는 글로벌제약사 애브비가 개발한 자가면역치료제로 지난 2003년 미국에서 허가됐다. 이후 적응증, 허가국 확대를 거듭하며 2012년 글로벌 의약품 매출 1위를 기록하기도 했다. 휴미라는 류마티스관절염, 크론병, 궤양성대장염, 건선 등 15여개 자가면역질환 치료 영역에서 적응증을 보유하고 있다. 다만 휴미라 특허만료에 따라 바이오시밀러들과 적응증이 겹치는 후발 생물학적제제, 야누스키나제(JAK) 억제제가 등장하면서 매출은 감소세에 접어들었다. 시장조사기관 아이큐비아에 따르면 2020년 1040억원이었던 휴미라의 매출은 2022년부터 800억원대로 내려 앉았다. 이에 따라 한국애브비의 매출도 큰 변화가 없었다. 한국애브비는 2020년 1467억원을 올린 이후 2021년 1404억원, 2022년 1546억원을 기록하며 1000억원대 매출을 유지했다. 다만 2023년 린버크와 스카이리치가 국내 시장에 자리잡으며 한국애브비의 매출도 큰 폭으로 올랐다. 한국애브비는 2023년 매출 2347억원을 기록하며 전년 대비 52% 올랐다. 이 회사는 지난해 처음으로 매출 3000억원 이상을 기록하기도 했다. 한국애브비의 작년 매출 3089억원을 2년 전과 비교하면 100% 증가한 수치다. 린버크는 JAK1만 선택적으로 억제하는 기전을 가진 JAK 억제제로 한국에서 2020년 류마티스 관절염 치료제로 허가됐다. 이후 린버크는 2021년 아토피피부염 치료제로 승인됐으며, 2022년과 2023년 각각 궤양성 대장염과 크론병에 사용이 가능해졌다. 적응증을 추가 확보한 린버크의 매출은 상승세에 접어들었다. 시장조사기관 유비스트에 따르면 2021년 14억원에 머물렀던 린버크는 2022년 77억원을 기록하며 450% 늘었다. 린버크는 2023년 첫 100억원을 돌파한 이후 지난해에는 261억원을 기록하며 매출 신기록을 경신하고 있다. 한국애브비는 린버크뿐만 아니라 인터루킨(IL)-23을 타깃하는 생물학적제제 ‘스카이리치’의 성장세도 기대하고 있다. 스카이리치는 2019년 판상 건선 치료제로 허가된 이후 2022년 건선성관절염, 지난해에는 손발바닥 농포증 신약으로 국내 승인됐다. 시장조사기관 아이큐비아에 따르면 스카이리치의 매출도 가파른 상승세를 보이고 있다. 2021년 84억원을 기록한 스카이리치는 2022년과 2023년 각각 165억원과 276억원을 올리며 매출이 늘어나고 있다. 2023년 기준 린버크와 스카이리치의 매출 합계는 500억원 이상을 기록하고 있는 것으로 나타났다. 자가면역질환 분야에서 휴미라의 세대교체가 성공적으로 진행되고 있는 모양새다. 한국애브비는 후발 신약들도 기대하고 있다. 이 회사는 지난해 칼시토닌 유전자 관련 펩타이드(CGRP) 계열 신약 ‘아큅타’를 국내 허가받았다. 현재 이 시장에는 릴리의 앰겔러티와 테바의 아조비이 등장한 상황이다. 다만 아큅타는 경구제라는 강점이 있다. 또 한국애브비는 이중항체 신약 ‘엡킨리’도 지난해 국내 허가받았다. 엡킨리는 혈액암에서 발현되는 CD20·CD3를 타깃하는 이중항체로, 재발성 또는 불응성 미만성 거대 B세포 림프종(DLBCL) 치료제로 사용된다. 엡킨리는 글로벌 1/2상 EPCORE NHL-1 연구에서 전체 반응률(ORR) 62%를 보였다. 그중 완전반응(CR) 비율은 39%였다.2025-04-04 12:00:12손형민
한국애브비, 매출 2년새 2배↑...면역질환 신약 강세[데일리팜=손형민 기자] 면역질환 신약들을 앞세운 한국애브비의 매출이 2년새 2배가 증가한 것으로 나타났다. 한국애브비는 휴미라 후발 자가면역질환 신약인 스카이리치, 린버크로의 세대교체 작업을 성공적으로 진행하고 있다. 4일 금융감독원에 따르면 한국애브비의 작년 매출은 2023년 2347억원에서 지난해 3089억원을 기록하며 32% 증가했다. 같은 기간 영업이익은 115억원에서 147억원으로 27% 늘었다. 그간 한국애브비의 매출은 휴미라가 크게 좌지우지했다. 휴미라는 글로벌제약사 애브비가 개발한 자가면역치료제로 지난 2003년 미국에서 허가됐다. 이후 적응증, 허가국 확대를 거듭하며 2012년 글로벌 의약품 매출 1위를 기록하기도 했다. 휴미라는 류마티스관절염, 크론병, 궤양성대장염, 건선 등 15여개 자가면역질환 치료 영역에서 적응증을 보유하고 있다. 다만 휴미라 특허만료에 따라 바이오시밀러들과 적응증이 겹치는 후발 생물학적제제, 야누스키나제(JAK) 억제제가 등장하면서 매출은 감소세에 접어들었다. 시장조사기관 아이큐비아에 따르면 2020년 1040억원이었던 휴미라의 매출은 2022년부터 800억원대로 내려 앉았다. 이에 따라 한국애브비의 매출도 큰 변화가 없었다. 한국애브비는 2020년 1467억원을 올린 이후 2021년 1404억원, 2022년 1546억원을 기록하며 1000억원대 매출을 유지했다. 다만 2023년 린버크와 스카이리치가 국내 시장에 자리잡으며 한국애브비의 매출도 큰 폭으로 올랐다. 한국애브비는 2023년 매출 2347억원을 기록하며 전년 대비 52% 올랐다. 이 회사는 지난해 처음으로 매출 3000억원 이상을 기록하기도 했다. 한국애브비의 작년 매출 3089억원을 2년 전과 비교하면 100% 증가한 수치다. 린버크는 JAK1만 선택적으로 억제하는 기전을 가진 JAK 억제제로 한국에서 2020년 류마티스 관절염 치료제로 허가됐다. 이후 린버크는 2021년 아토피피부염 치료제로 승인됐으며, 2022년과 2023년 각각 궤양성 대장염과 크론병에 사용이 가능해졌다. 적응증을 추가 확보한 린버크의 매출은 상승세에 접어들었다. 시장조사기관 유비스트에 따르면 2021년 14억원에 머물렀던 린버크는 2022년 77억원을 기록하며 450% 늘었다. 린버크는 2023년 첫 100억원을 돌파한 이후 지난해에는 261억원을 기록하며 매출 신기록을 경신하고 있다. 한국애브비는 린버크뿐만 아니라 인터루킨(IL)-23을 타깃하는 생물학적제제 ‘스카이리치’의 성장세도 기대하고 있다. 스카이리치는 2019년 판상 건선 치료제로 허가된 이후 2022년 건선성관절염, 지난해에는 손발바닥 농포증 신약으로 국내 승인됐다. 시장조사기관 아이큐비아에 따르면 스카이리치의 매출도 가파른 상승세를 보이고 있다. 2021년 84억원을 기록한 스카이리치는 2022년과 2023년 각각 165억원과 276억원을 올리며 매출이 늘어나고 있다. 2023년 기준 린버크와 스카이리치의 매출 합계는 500억원 이상을 기록하고 있는 것으로 나타났다. 자가면역질환 분야에서 휴미라의 세대교체가 성공적으로 진행되고 있는 모양새다. 한국애브비는 후발 신약들도 기대하고 있다. 이 회사는 지난해 칼시토닌 유전자 관련 펩타이드(CGRP) 계열 신약 ‘아큅타’를 국내 허가받았다. 현재 이 시장에는 릴리의 앰겔러티와 테바의 아조비이 등장한 상황이다. 다만 아큅타는 경구제라는 강점이 있다. 또 한국애브비는 이중항체 신약 ‘엡킨리’도 지난해 국내 허가받았다. 엡킨리는 혈액암에서 발현되는 CD20·CD3를 타깃하는 이중항체로, 재발성 또는 불응성 미만성 거대 B세포 림프종(DLBCL) 치료제로 사용된다. 엡킨리는 글로벌 1/2상 EPCORE NHL-1 연구에서 전체 반응률(ORR) 62%를 보였다. 그중 완전반응(CR) 비율은 39%였다.2025-04-04 12:00:12손형민
오늘의 TOP 10
- 1알부민 과대광고 홈쇼핑 단속 '제로'…"식약처는 적극 나서야"
- 2'창고형 약국 약값체크' 앱까지 나왔다…약사들 아연실색
- 3'1조 돌파' 한미, 처방시장 선두 질주...대웅바이오 껑충
- 4상한가 3번·두 자릿수 상승 6번…현대약품의 '탈모' 랠리
- 5'마운자로', 당뇨병 급여 위한 약가협상 돌입 예고
- 6"대사질환 전반 정복"…GLP-1의 확장성은 현재진행형
- 7비보존제약, 유증 조달액 30%↓...CB 상환·배상금 부담↑
- 8복지부·진흥원, 혁신형 제약 집중 육성…"산업 생태계 전환"
- 9"잠자는 약사 권리 깨우고 싶어"…184건 민원에 담긴 의미
- 10동물 신약 2종 허가 문턱…대웅제약, 선두주자 굳힌다
-
순위상품명횟수
-
1타이레놀정500mg(10정)30,426
-
2판콜에스내복액16,732
-
3텐텐츄정(10정)13,671
-
4까스활명수큐액12,867
-
5판피린큐액12,851































![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)

![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)
![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/products/8eae7689-61be-4b71-9608-05364b05ea12.png)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202511/1763106585375.png)
![[아워팜] 혈행건강 히어로, 혈행건강 초임계 rTG 오메가3 프리미엄](https://i.baropharm.com/products/f724f191-7052-4ad5-bc92-cda889cf13a6.png)
