총 76건
-
 10년만의 급여옵션 '코센틱스', 화농성한선염 전략 바꾼다[데일리팜=어윤호 기자] 국내 화농성 한선염 치료환경이 '코센틱스' 보험급여 적용을 계기로 전환점을 맞고 있다.지난 2023년 12월, 한국노바티스의 인터루킨(IL)-17A억제제 코센틱스(세쿠키누맙)는 화농성한선염(HS, Hidradenitis suppurativa) 적응증을 확대, 약 8년 만의 새로운 생물학적제제 치료옵션으로 등극했다.하지만 최근까지 비급여로 머물러, 환자들이 실질적으로 선택할 수 있는 생물학적제제는 휴미라가 유일했다.허가 후 약 2년 뒤, 2025년 12월 1일부로 코센틱스가 성인 중증 화농성 한선염 환자 치료로 급여 기준을 설정하면서 사실상 약 10년 만에 국내 화농성한선염 시장에 새로운 기전의 급여 옵션을 갖추게 됐다.코센틱스의 급여 확대 과정은 순탄하지 않았다. 코센틱스는 2023년 12월 적응증 허가 후 곧바로 급여 신청을 제출했으나 외부적인 요인으로 급여 검토가 지연돼 회사 측의 자진철회 후, 2024년 11월 다시 급여 확대 신청을 제출했다.그러나 이후로도 국내의 약가 제도 변화, 최혜국 약가참조 정책(MFN, Most Favored Nations) 논의 등 여러 외부적 요인이 겹치며 진전에 어려움을 겪었지만, 대규모 글로벌 임상 데이터, 국제 가이드라인의 권고, 그리고 국내 환자들의 미충족 수요 등이 근거로 인정되면서 결국 재신청 1년 만에 급여 기준 확대에 성공했다.코센틱스는 기존 휴미라와 다른 기전으로 작용하는 약제라는 점도 눈 여겨 볼만 하다. 종양괴사인자(TNF-α, Tumor Necrosis Factor-alpha)를 차단해 염증 반응을 억제하는 휴미라와 달리, 코센틱스는 염증성 면역질환에 주요한 역할을 하는 IL-17A를 직접적으로 억제하는 기전으로 염증과 관련된 사이토카인과 케모카인 방출을 억제해 HS에서 농양과 염증성 병변을 줄여 주는 역할을 한다.즉 이러한 기전적 차이를 가진 새로운 약제의 치료 접근성이 개선됐다는 것은 치료 반응 양상과 내약성 측면에서 환자들에게 새로운 선택지를 제공할 뿐 아니라, 각 기전에 따른 임상적 특성, 환자의 건강 상태 및 동반질환 등을 종합적으로 고려해 보다 정교한 맞춤형 치료 계획을 수립할 수 있는 환경이 마련됐다는 점에서 의미가 있다.또 코센틱스의 급여 검토 과정에서 생물학적 제제의 급여 기준이 재정비되면서, 기존 중증 환자(Hurley 3 단계)에서만 적용되던 생물학적 제제 급여 범위가 Hurley 2 단계인 중등증에서 중증 사이의 환자까지 확대된 점 역시 고무적이다.급여 확대로 인한 또 하나의 변화는 환자 접근성과 치료 선택지 확대다. 산정특례 적용 시, 코센틱스 300mg의 1회 기준 환자 부담금은 11만3482원이다. 코센틱스는 치료 개시 첫 한달 동안은 매주 1회씩 투여하며, 이후부터 4주 간격으로 투여한다. 치료 시작한 첫 달을 제외한 치료 유지 기간에는 월 1회씩 한달 기준 11만3482원을 부담하게 된다.휴미라는 40mg 1회 기준 환자 부담금은 2만8640원으로, 매주 혹은 2주 간격으로 투여가 필요하다. 월 4회씩 한달 기준으로 11만4560원 수준이다. 치료 유지 기간에 환자 본인 부담금은 두 약제가 거의 동일한 수준으로, 환자는 큰 비용 부담 없이 기전이 다른 치료제를 선택 및 유지할 수 있게 됐다.장민수 대한여드름주사학회 총무이사(고신대학교복음병원 피부과 교수)는 "HS는 완치가 어려운 질환으로, 일반적인 치료에도 병의 경과에 호전이 없거나 증상이 갈수록 심해지는 경우가 있는데, 생물학적제제를 통해 체계적인 치료 계획을 수립한다면 전략적인 관리가 가능하다"고 설명했다.아울러 "그러나 작용 기전이 다른 다양한 생물학적 제제를 선택할 수 있는 건선, 아토피피부염 등과 달리, HS는 한가지 기전의 생물학적제제만 사용 가능해 그간 치료옵션 선택에 제한이 있었다. 코센틱스 급여 확대로 기존 치료로 반응이 불충분하거나 부작용으로 치료를 중단해야 했던 환자들의 치료 선택지가 보다 확대될 수 있게 됐다"고 덧붙였다.한편 코센틱스는 최근 발표된 SUNNY 연구의 4년(204주) 연장 연구 데이터에서도 52주차에 HiSCR를 달성한 환자에게 코센틱스를 꾸준히 투여했을 때 204주차 HiSCR 달성률이 83.2%로 나타나, 치료 시작 후 4년 시점까지 증상 개선 효과가 유지되는 것을 확인했다.2025-12-19 06:00:46어윤호 기자
10년만의 급여옵션 '코센틱스', 화농성한선염 전략 바꾼다[데일리팜=어윤호 기자] 국내 화농성 한선염 치료환경이 '코센틱스' 보험급여 적용을 계기로 전환점을 맞고 있다.지난 2023년 12월, 한국노바티스의 인터루킨(IL)-17A억제제 코센틱스(세쿠키누맙)는 화농성한선염(HS, Hidradenitis suppurativa) 적응증을 확대, 약 8년 만의 새로운 생물학적제제 치료옵션으로 등극했다.하지만 최근까지 비급여로 머물러, 환자들이 실질적으로 선택할 수 있는 생물학적제제는 휴미라가 유일했다.허가 후 약 2년 뒤, 2025년 12월 1일부로 코센틱스가 성인 중증 화농성 한선염 환자 치료로 급여 기준을 설정하면서 사실상 약 10년 만에 국내 화농성한선염 시장에 새로운 기전의 급여 옵션을 갖추게 됐다.코센틱스의 급여 확대 과정은 순탄하지 않았다. 코센틱스는 2023년 12월 적응증 허가 후 곧바로 급여 신청을 제출했으나 외부적인 요인으로 급여 검토가 지연돼 회사 측의 자진철회 후, 2024년 11월 다시 급여 확대 신청을 제출했다.그러나 이후로도 국내의 약가 제도 변화, 최혜국 약가참조 정책(MFN, Most Favored Nations) 논의 등 여러 외부적 요인이 겹치며 진전에 어려움을 겪었지만, 대규모 글로벌 임상 데이터, 국제 가이드라인의 권고, 그리고 국내 환자들의 미충족 수요 등이 근거로 인정되면서 결국 재신청 1년 만에 급여 기준 확대에 성공했다.코센틱스는 기존 휴미라와 다른 기전으로 작용하는 약제라는 점도 눈 여겨 볼만 하다. 종양괴사인자(TNF-α, Tumor Necrosis Factor-alpha)를 차단해 염증 반응을 억제하는 휴미라와 달리, 코센틱스는 염증성 면역질환에 주요한 역할을 하는 IL-17A를 직접적으로 억제하는 기전으로 염증과 관련된 사이토카인과 케모카인 방출을 억제해 HS에서 농양과 염증성 병변을 줄여 주는 역할을 한다.즉 이러한 기전적 차이를 가진 새로운 약제의 치료 접근성이 개선됐다는 것은 치료 반응 양상과 내약성 측면에서 환자들에게 새로운 선택지를 제공할 뿐 아니라, 각 기전에 따른 임상적 특성, 환자의 건강 상태 및 동반질환 등을 종합적으로 고려해 보다 정교한 맞춤형 치료 계획을 수립할 수 있는 환경이 마련됐다는 점에서 의미가 있다.또 코센틱스의 급여 검토 과정에서 생물학적 제제의 급여 기준이 재정비되면서, 기존 중증 환자(Hurley 3 단계)에서만 적용되던 생물학적 제제 급여 범위가 Hurley 2 단계인 중등증에서 중증 사이의 환자까지 확대된 점 역시 고무적이다.급여 확대로 인한 또 하나의 변화는 환자 접근성과 치료 선택지 확대다. 산정특례 적용 시, 코센틱스 300mg의 1회 기준 환자 부담금은 11만3482원이다. 코센틱스는 치료 개시 첫 한달 동안은 매주 1회씩 투여하며, 이후부터 4주 간격으로 투여한다. 치료 시작한 첫 달을 제외한 치료 유지 기간에는 월 1회씩 한달 기준 11만3482원을 부담하게 된다.휴미라는 40mg 1회 기준 환자 부담금은 2만8640원으로, 매주 혹은 2주 간격으로 투여가 필요하다. 월 4회씩 한달 기준으로 11만4560원 수준이다. 치료 유지 기간에 환자 본인 부담금은 두 약제가 거의 동일한 수준으로, 환자는 큰 비용 부담 없이 기전이 다른 치료제를 선택 및 유지할 수 있게 됐다.장민수 대한여드름주사학회 총무이사(고신대학교복음병원 피부과 교수)는 "HS는 완치가 어려운 질환으로, 일반적인 치료에도 병의 경과에 호전이 없거나 증상이 갈수록 심해지는 경우가 있는데, 생물학적제제를 통해 체계적인 치료 계획을 수립한다면 전략적인 관리가 가능하다"고 설명했다.아울러 "그러나 작용 기전이 다른 다양한 생물학적 제제를 선택할 수 있는 건선, 아토피피부염 등과 달리, HS는 한가지 기전의 생물학적제제만 사용 가능해 그간 치료옵션 선택에 제한이 있었다. 코센틱스 급여 확대로 기존 치료로 반응이 불충분하거나 부작용으로 치료를 중단해야 했던 환자들의 치료 선택지가 보다 확대될 수 있게 됐다"고 덧붙였다.한편 코센틱스는 최근 발표된 SUNNY 연구의 4년(204주) 연장 연구 데이터에서도 52주차에 HiSCR를 달성한 환자에게 코센틱스를 꾸준히 투여했을 때 204주차 HiSCR 달성률이 83.2%로 나타나, 치료 시작 후 4년 시점까지 증상 개선 효과가 유지되는 것을 확인했다.2025-12-19 06:00:46어윤호 기자 -
 겨울철 혈관을 지키는 힘…코엔자임Q10 실전 가이드여름에서 가을, 그리고 겨울로 들어서고 기온이 영하권으로 떨어지면서 가장 먼저 떠오르는 것은 약국을 찾는 시니어 분들의 혈관 건강이다.날씨가 추워지면 혈관이 수축되면서 혈압이 오를 수 있다는 것은 상식이지만, 실제 데이터는 더 구체적으로 경고 신호를 보낸다.연구 결과에 따르면 기온이 1 ℃ 내려갈 때마다 수축기 혈압은 약 1.3 mmHg, 이완기 혈압은 0.6 mmHg 상승하고, 혈액 점도도 증가해 심혈관에 부담이 커진다.이는 국내 사망원인 통계에서도 같은 경향이 보인다. 국가통계포털의 사망원인통계를 분석해 보면, 대표적인 심혈관 질환으로 인한 사망자 수가 날씨가 추워지는 12월과 1월에 평균 대비 약 10~15% 높게 집계된다. 이렇게 심혈관에 부담이 가중되는 겨울철, 심혈관 건강 관리, 항산화를 위한 약국의 기본 성분은 코엔자임Q10이다.그런데 코엔자임Q10 성분을 활용하다 보면 한 가지 의문이 들게 된다.'울혈성심부전에 사용되는 의약품 코엔자임Q10(유비데카레논)의 1일 복용량은 30 mg인데, 왜 건강기능식품의 1일섭취량은 90~100mg일까?'의약품으로서 코엔자임Q10의 근거먼저 일반의약품으로 울혈성심부전(경증~중등도)에 효능효과를 인정받은 제품은 '데카키논캡슐'로 유비데카레논 5mg 캡슐 제품이며, 하루 복용량으로 1회 10mg (2 캡슐)을 1일 3회, 총 30mg을 복용하도록 되어있다.해당 제품은 일본 에자이사(Eisai Co., Ltd.)의 원료 및 기술제휴를 바탕으로 생산된 제품으로 코엔자임큐텐의 울혈성심부전 효과가 입증된 임상이 일본에서 진행된 부분과 맞닿아 있다. 1972년 Hashiba 등은 환자 197명을 대상으로 한 연구(RCT)에서 매일 30mg의 코엔자임Q10을 투여해 개선 효과를 확인했고, Iwabuchi 등의 연구(RCT)에서도 38명의 심부전 환자에게 코엔자임Q10 30mg으로 유의한 개선이 확인됐다.이 결과를 바탕으로 일본에서 1974년에 Eisai사가 세계 최초로 심부전 치료제로 승인을 받게 되고 우리나라에 도입되면서 이 허가 사항을 동일하게 따르면서 울혈성심부전에 사용시 코엔자임Q10의 하루 복용량이 30mg으로 결정되었다. (의약품 표준제조기준상 비타민, 미네랄에 첨가할 수 있는 코엔자임Q10의 1일 최대 분량은 10mg) 건강기능식품으로서 코엔자임Q10의 근거 및 내용이후 대규모 인체적용시험에서 30mg을 넘는 용량에서 뚜렷한 효과가 보고되었다. 다수의 임상(인체적용) 시험에서 100mg 이상 섭취했을 때 혈중 코엔자임Q10의 농도가 항산화 및 혈압 조절 기능을 나타내기에 충분한 수준으로 상승함이 확인되었다.이런 결과들을 바탕으로 식품의약품안전처는 2006년 '항산화에 도움을 줄 수 있음', 2008년 '높은 혈압에 도움을 줄 수 있음'으로 코엔자임Q10 개별 인정형 원료의 기능성을 인정했다. 그리고 2010년에 개별인정형 원료에서 고시형원료로 전환 후 현재에 이르고 있다.[코엔자임Q10의 기능성 원료 정보]1) 기능성원료 정보 -기능성 내용: 항산화∙높은 혈압 감소에 도움을 줄 수 있음 -일일섭취량: 코엔자임Q10으로서 90 ~ 100mg 2) 제조 기준 및 규격-원재료: 아그로박테륨 투메파시엔스(Agrobacterium tumefaciens)파라콕커스 데니트리피칸스(Paracoccus denitrificans)슈도모나스 에루지노사(Pseudomonas aeruginosa) -제조방법: 원재료의 배양산물을 헥산, 아세톤, 이소프로필알코올, 초산에틸로 추출하고 이를 농축 또는 정제해 제조한다-기능성 성분의 함량: 코엔자임Q10이 980mg/g이상-최종 제품에는 표시량의 80 ~ 120%건강기능식품 기능성 원료도 의약품처럼 재평가를 받는다. 건강기능식품 기능성 원료 정기 재평가는 인정받은 지 10년이 지난 원료 중 매년 대상을 선정하여 재평가를 진행하며 코엔자임Q10의 경우 2022년에 재평가가 진행되었다. 재평가시 제출된 근거자료에 따라 추가된 코엔자임Q10 원료의 섭취 시 주의사항은 다음과 같다. -임산부: 임산부 대상 인체적용시험에서 이상 증상이 나타나지 않아 섭취 가능.-수유부: 섭취 경험 적고 안정성 데이터가 불충분. 캐나다의 경우 섭취 전 전문가와 상담할 것을 권고, 일본과 우리나라는 섭취를 피할 것으로 설정.-상호작용: 와파린과 코엔자임Q10의 병용시 임상 결과가 일관되지 않아 '전문가와 상담할 것'의 표기로 설정.약국 상담의 확장: 스타틴을 넘어 '혈관 관련 만성질환자' 모두에게코엔자임Q10은 스타틴 복용자뿐 아니라 고혈압, 당뇨, 이상지질혈증 등 혈관 관련 만성질환을 가진 환자에게 보충 옵션이 된다. 그 이유는 '항산화'와 '혈관 내피세포의 개선'에 있다.혈관 내피세포의 손상에 의해 혈관 관련 만성질환이 시작된다. 2012년 발표된 메타분석 결과에 따르면 코엔자임Q10의 보충은 혈관의 이완 능력을 나타내는 내피의존성 혈관 확장 지표가 유의미하게 개선됐다. 이는 코엔자임Q10이 혈관의 유연성을 회복시켜 혈압 조절과 혈행 개선에 직접적으로 효과를 나타낼 수 있고 혈관 내피세포 회복에 도움을 준다는 것을 의미한다.또한 코엔자임Q10은 만성질환자의 염증 지표를 낮추는데 도움을 줄 수 있다. 2017년 발표된 메타분석 결과에 따르면, 코엔자임Q10의 섭취는 체내 염증지표인 TNF-α와 IL-6가 유의미하게 감소했고, 다른 메타분석에서는 산화 스트레스 지표인 말론디알데하이드(Malondialdehyde, MDA)를 낮추고 총 항산화능(TAC)을 높이는 것이 확인되었다.물론, 스타틴 복용자에게는 코엔자임Q10이 필수적이다. 스타틴은 콜레스테롤 합성과 함께 코엔자임Q10 생합성 경로도 억제해 혈중 코엔자임Q10 농도를 감소시킬 수 있으므로 이를 보충해 주는 것이 필요하다.코엔자임Q10은 단순히 높은 혈압 감소에 도움을 주는 성분이 아니다. 높은 혈압 감소는물론이고 항염, 항산화와 혈관내피세포 보호에 도움을 주는 성분으로 심혈관 만성질환자들에게 우선적으로 권할 수 있는 영양소이다.참고문헌1)P. R. Woodhouse et al., Seasonal variation of blood pressure and its relationship to ambient temperature in an elderly population. J Hypertens, 11(11), 1993, 1267-74 2)P. R. Woodhouse et al., Seasonal variation of blood plasma fibrinogen and factor VII activity in the elderly: winter infections and death from cardiovascular disease, Lancet, 343, 1994, 435-4393)P. H. Langsjoen and A. M. Langsjoen, Overview of the use of CoQ10 in cardiovascular disease. Biofactors, 9, 1999, 273-2844)건강기능식품 기준 및 규격: 코엔자임Q105)2022년 건강기능식품 기능성 원료 재평가 결과보고서, 2022, 식품의약품안전처6)Junya Zhai et al., Effects of Coenzyme Q10 on makers of inflammation: A systematic review and meta-analysis. PLos One, 12(1), 2017, e01701727)Suming Dai et al., Effects of Coenzyme Q10 supplementation on biomarkers of oxidative stress in adults: A GRADE-assessed systematic review and updated meta-analysis of randomized controlled trials. Antioxidants, 11, 2022, 13608)Hua Qu et al., The effect of statin treatment on circulating CoQ10 concentrations: an updated meta-analysis of randomized controlled trials. Eur. J. Med. Res., 23(1), 2018, 57-672025-12-11 12:05:57데일리팜
겨울철 혈관을 지키는 힘…코엔자임Q10 실전 가이드여름에서 가을, 그리고 겨울로 들어서고 기온이 영하권으로 떨어지면서 가장 먼저 떠오르는 것은 약국을 찾는 시니어 분들의 혈관 건강이다.날씨가 추워지면 혈관이 수축되면서 혈압이 오를 수 있다는 것은 상식이지만, 실제 데이터는 더 구체적으로 경고 신호를 보낸다.연구 결과에 따르면 기온이 1 ℃ 내려갈 때마다 수축기 혈압은 약 1.3 mmHg, 이완기 혈압은 0.6 mmHg 상승하고, 혈액 점도도 증가해 심혈관에 부담이 커진다.이는 국내 사망원인 통계에서도 같은 경향이 보인다. 국가통계포털의 사망원인통계를 분석해 보면, 대표적인 심혈관 질환으로 인한 사망자 수가 날씨가 추워지는 12월과 1월에 평균 대비 약 10~15% 높게 집계된다. 이렇게 심혈관에 부담이 가중되는 겨울철, 심혈관 건강 관리, 항산화를 위한 약국의 기본 성분은 코엔자임Q10이다.그런데 코엔자임Q10 성분을 활용하다 보면 한 가지 의문이 들게 된다.'울혈성심부전에 사용되는 의약품 코엔자임Q10(유비데카레논)의 1일 복용량은 30 mg인데, 왜 건강기능식품의 1일섭취량은 90~100mg일까?'의약품으로서 코엔자임Q10의 근거먼저 일반의약품으로 울혈성심부전(경증~중등도)에 효능효과를 인정받은 제품은 '데카키논캡슐'로 유비데카레논 5mg 캡슐 제품이며, 하루 복용량으로 1회 10mg (2 캡슐)을 1일 3회, 총 30mg을 복용하도록 되어있다.해당 제품은 일본 에자이사(Eisai Co., Ltd.)의 원료 및 기술제휴를 바탕으로 생산된 제품으로 코엔자임큐텐의 울혈성심부전 효과가 입증된 임상이 일본에서 진행된 부분과 맞닿아 있다. 1972년 Hashiba 등은 환자 197명을 대상으로 한 연구(RCT)에서 매일 30mg의 코엔자임Q10을 투여해 개선 효과를 확인했고, Iwabuchi 등의 연구(RCT)에서도 38명의 심부전 환자에게 코엔자임Q10 30mg으로 유의한 개선이 확인됐다.이 결과를 바탕으로 일본에서 1974년에 Eisai사가 세계 최초로 심부전 치료제로 승인을 받게 되고 우리나라에 도입되면서 이 허가 사항을 동일하게 따르면서 울혈성심부전에 사용시 코엔자임Q10의 하루 복용량이 30mg으로 결정되었다. (의약품 표준제조기준상 비타민, 미네랄에 첨가할 수 있는 코엔자임Q10의 1일 최대 분량은 10mg) 건강기능식품으로서 코엔자임Q10의 근거 및 내용이후 대규모 인체적용시험에서 30mg을 넘는 용량에서 뚜렷한 효과가 보고되었다. 다수의 임상(인체적용) 시험에서 100mg 이상 섭취했을 때 혈중 코엔자임Q10의 농도가 항산화 및 혈압 조절 기능을 나타내기에 충분한 수준으로 상승함이 확인되었다.이런 결과들을 바탕으로 식품의약품안전처는 2006년 '항산화에 도움을 줄 수 있음', 2008년 '높은 혈압에 도움을 줄 수 있음'으로 코엔자임Q10 개별 인정형 원료의 기능성을 인정했다. 그리고 2010년에 개별인정형 원료에서 고시형원료로 전환 후 현재에 이르고 있다.[코엔자임Q10의 기능성 원료 정보]1) 기능성원료 정보 -기능성 내용: 항산화∙높은 혈압 감소에 도움을 줄 수 있음 -일일섭취량: 코엔자임Q10으로서 90 ~ 100mg 2) 제조 기준 및 규격-원재료: 아그로박테륨 투메파시엔스(Agrobacterium tumefaciens)파라콕커스 데니트리피칸스(Paracoccus denitrificans)슈도모나스 에루지노사(Pseudomonas aeruginosa) -제조방법: 원재료의 배양산물을 헥산, 아세톤, 이소프로필알코올, 초산에틸로 추출하고 이를 농축 또는 정제해 제조한다-기능성 성분의 함량: 코엔자임Q10이 980mg/g이상-최종 제품에는 표시량의 80 ~ 120%건강기능식품 기능성 원료도 의약품처럼 재평가를 받는다. 건강기능식품 기능성 원료 정기 재평가는 인정받은 지 10년이 지난 원료 중 매년 대상을 선정하여 재평가를 진행하며 코엔자임Q10의 경우 2022년에 재평가가 진행되었다. 재평가시 제출된 근거자료에 따라 추가된 코엔자임Q10 원료의 섭취 시 주의사항은 다음과 같다. -임산부: 임산부 대상 인체적용시험에서 이상 증상이 나타나지 않아 섭취 가능.-수유부: 섭취 경험 적고 안정성 데이터가 불충분. 캐나다의 경우 섭취 전 전문가와 상담할 것을 권고, 일본과 우리나라는 섭취를 피할 것으로 설정.-상호작용: 와파린과 코엔자임Q10의 병용시 임상 결과가 일관되지 않아 '전문가와 상담할 것'의 표기로 설정.약국 상담의 확장: 스타틴을 넘어 '혈관 관련 만성질환자' 모두에게코엔자임Q10은 스타틴 복용자뿐 아니라 고혈압, 당뇨, 이상지질혈증 등 혈관 관련 만성질환을 가진 환자에게 보충 옵션이 된다. 그 이유는 '항산화'와 '혈관 내피세포의 개선'에 있다.혈관 내피세포의 손상에 의해 혈관 관련 만성질환이 시작된다. 2012년 발표된 메타분석 결과에 따르면 코엔자임Q10의 보충은 혈관의 이완 능력을 나타내는 내피의존성 혈관 확장 지표가 유의미하게 개선됐다. 이는 코엔자임Q10이 혈관의 유연성을 회복시켜 혈압 조절과 혈행 개선에 직접적으로 효과를 나타낼 수 있고 혈관 내피세포 회복에 도움을 준다는 것을 의미한다.또한 코엔자임Q10은 만성질환자의 염증 지표를 낮추는데 도움을 줄 수 있다. 2017년 발표된 메타분석 결과에 따르면, 코엔자임Q10의 섭취는 체내 염증지표인 TNF-α와 IL-6가 유의미하게 감소했고, 다른 메타분석에서는 산화 스트레스 지표인 말론디알데하이드(Malondialdehyde, MDA)를 낮추고 총 항산화능(TAC)을 높이는 것이 확인되었다.물론, 스타틴 복용자에게는 코엔자임Q10이 필수적이다. 스타틴은 콜레스테롤 합성과 함께 코엔자임Q10 생합성 경로도 억제해 혈중 코엔자임Q10 농도를 감소시킬 수 있으므로 이를 보충해 주는 것이 필요하다.코엔자임Q10은 단순히 높은 혈압 감소에 도움을 주는 성분이 아니다. 높은 혈압 감소는물론이고 항염, 항산화와 혈관내피세포 보호에 도움을 주는 성분으로 심혈관 만성질환자들에게 우선적으로 권할 수 있는 영양소이다.참고문헌1)P. R. Woodhouse et al., Seasonal variation of blood pressure and its relationship to ambient temperature in an elderly population. J Hypertens, 11(11), 1993, 1267-74 2)P. R. Woodhouse et al., Seasonal variation of blood plasma fibrinogen and factor VII activity in the elderly: winter infections and death from cardiovascular disease, Lancet, 343, 1994, 435-4393)P. H. Langsjoen and A. M. Langsjoen, Overview of the use of CoQ10 in cardiovascular disease. Biofactors, 9, 1999, 273-2844)건강기능식품 기준 및 규격: 코엔자임Q105)2022년 건강기능식품 기능성 원료 재평가 결과보고서, 2022, 식품의약품안전처6)Junya Zhai et al., Effects of Coenzyme Q10 on makers of inflammation: A systematic review and meta-analysis. PLos One, 12(1), 2017, e01701727)Suming Dai et al., Effects of Coenzyme Q10 supplementation on biomarkers of oxidative stress in adults: A GRADE-assessed systematic review and updated meta-analysis of randomized controlled trials. Antioxidants, 11, 2022, 13608)Hua Qu et al., The effect of statin treatment on circulating CoQ10 concentrations: an updated meta-analysis of randomized controlled trials. Eur. J. Med. Res., 23(1), 2018, 57-672025-12-11 12:05:57데일리팜 -
 셀트리온, 자가면역질환 치료제 '코센틱스' 특허 공략 시동셀트리온이 노바티스의 자가면역질환 치료제 '코센틱스(세쿠키누맙)'의 특허에 도전장을 냈다.2일 제약업계에 따르면 셀트리온은 최근 코센틱스의 미등재 조성물특허 2건에 무효 심판을 청구했다.이와 관련 특허청에는 'IL-17 항체의 제약 제품 및 안정한 액체 조성물' 특허가 3건 등록돼 있다. 노바티스는 원출원 특허를 분할하는 방식으로 동일한 이름의 특허 3건을 등록했다. 이 가운데 셀트리온의 무효 도전 타깃이 된 특허는 원출원 특허를 제외한 분할 출원된 2건으로, 2035년 12월 만료된다.해당 특허는 코센틱스의 액체 제형에 관한 기술을 명시한다. 코센틱스의 프리필드시린지 혹은 오토인젝터 제형과 관련한 기술로 분석된다. 주사제로 개발된 코센틱스는 동결건조 분말, 프리필드시린지, 오토인젝터 등의 제형이 있다. 동결건조 분말보다는 프리필드시린지와 오토인젝터가 투약 편의성이 높다.셀트리온이 해당 특허의 무효화에 성공할 경우 국내에서 코센틱스 프리필드시린지·오토인젝터 제형의 발매가 가능해질 것으로 전망된다. 현재 노바티스는 국내에서 코센틱스의 프리필스시린지와 펜 제형을 판매 중이다.이밖에 코센틱스 특허로는 2028년 2월 만료되는 물질특허와 2031년 10월 만료되는 용도특허, 2035년 12월 만료되는 조성물특허가 등재돼 있다. 2035년 만료되는 특허는 이번에 무효 도전 타깃이 된 2건의 원출원 특허로, 셀트리온은 미등재 분할출원 특허 2건을 우선 무효화한 뒤 원출원 특허와 용도특허까지 공략할 것으로 예상된다. 이어 선행특허가 만료되는 시점에 맞춰 코센틱스 바이오시밀러를 발매할 것이란 전망이다.코센틱스는 TNF-a 억제제 계열 자가면역질환 치료제다. 인터루킨 17A(IL-17A)를 표적으로 하는 단일클론항체로, 면역계의 특정 염증 경로를 차단해 자가면역성 염증질환의 증상을 개선하는 기전이다. 주요 적응증은 판상 건선(성인·소아), 건선성 관절염(성인·소아), 축성 척추관절염(성인), 화농성 한선염(성인) 등이다.셀트리온은 코센틱스 바이오시밀러 개발을 위해 글로벌 임상3상을 진행 중이다. 올해 2월 유럽의약품청(EMA)로부터 코센틱스 바이오시밀러 CT-P55의 글로벌 임상3상 시험계획서(IND) 승인을 받았다.지난해 코센틱스는 전 세계에서 61억4100만 달러(약 8조6000억원)의 매출을 올렸다. 회사는 CT-P55 개발을 통해 자가면역질환 치료제 시장에서 영향력을 더욱 확대한다는 계획이다. 회사는 북미·유럽 등 주요 시장에 ▲램시마(인플릭시맙, 레미케이드 시밀러) ▲짐펜트라(인플릭시맙, 램시마 SC제형) ▲유플라이마(아달리무맙, 휴미라 시밀러) ▲스테키마(우스타키누맙, 스텔라라 시밀러) 등 다양한 자가면역질환 치료제를 판매 중이다.2025-12-02 12:08:47김진구 기자
셀트리온, 자가면역질환 치료제 '코센틱스' 특허 공략 시동셀트리온이 노바티스의 자가면역질환 치료제 '코센틱스(세쿠키누맙)'의 특허에 도전장을 냈다.2일 제약업계에 따르면 셀트리온은 최근 코센틱스의 미등재 조성물특허 2건에 무효 심판을 청구했다.이와 관련 특허청에는 'IL-17 항체의 제약 제품 및 안정한 액체 조성물' 특허가 3건 등록돼 있다. 노바티스는 원출원 특허를 분할하는 방식으로 동일한 이름의 특허 3건을 등록했다. 이 가운데 셀트리온의 무효 도전 타깃이 된 특허는 원출원 특허를 제외한 분할 출원된 2건으로, 2035년 12월 만료된다.해당 특허는 코센틱스의 액체 제형에 관한 기술을 명시한다. 코센틱스의 프리필드시린지 혹은 오토인젝터 제형과 관련한 기술로 분석된다. 주사제로 개발된 코센틱스는 동결건조 분말, 프리필드시린지, 오토인젝터 등의 제형이 있다. 동결건조 분말보다는 프리필드시린지와 오토인젝터가 투약 편의성이 높다.셀트리온이 해당 특허의 무효화에 성공할 경우 국내에서 코센틱스 프리필드시린지·오토인젝터 제형의 발매가 가능해질 것으로 전망된다. 현재 노바티스는 국내에서 코센틱스의 프리필스시린지와 펜 제형을 판매 중이다.이밖에 코센틱스 특허로는 2028년 2월 만료되는 물질특허와 2031년 10월 만료되는 용도특허, 2035년 12월 만료되는 조성물특허가 등재돼 있다. 2035년 만료되는 특허는 이번에 무효 도전 타깃이 된 2건의 원출원 특허로, 셀트리온은 미등재 분할출원 특허 2건을 우선 무효화한 뒤 원출원 특허와 용도특허까지 공략할 것으로 예상된다. 이어 선행특허가 만료되는 시점에 맞춰 코센틱스 바이오시밀러를 발매할 것이란 전망이다.코센틱스는 TNF-a 억제제 계열 자가면역질환 치료제다. 인터루킨 17A(IL-17A)를 표적으로 하는 단일클론항체로, 면역계의 특정 염증 경로를 차단해 자가면역성 염증질환의 증상을 개선하는 기전이다. 주요 적응증은 판상 건선(성인·소아), 건선성 관절염(성인·소아), 축성 척추관절염(성인), 화농성 한선염(성인) 등이다.셀트리온은 코센틱스 바이오시밀러 개발을 위해 글로벌 임상3상을 진행 중이다. 올해 2월 유럽의약품청(EMA)로부터 코센틱스 바이오시밀러 CT-P55의 글로벌 임상3상 시험계획서(IND) 승인을 받았다.지난해 코센틱스는 전 세계에서 61억4100만 달러(약 8조6000억원)의 매출을 올렸다. 회사는 CT-P55 개발을 통해 자가면역질환 치료제 시장에서 영향력을 더욱 확대한다는 계획이다. 회사는 북미·유럽 등 주요 시장에 ▲램시마(인플릭시맙, 레미케이드 시밀러) ▲짐펜트라(인플릭시맙, 램시마 SC제형) ▲유플라이마(아달리무맙, 휴미라 시밀러) ▲스테키마(우스타키누맙, 스텔라라 시밀러) 등 다양한 자가면역질환 치료제를 판매 중이다.2025-12-02 12:08:47김진구 기자 -
 방광암 면역치료 최초 IL-15 초작용제 '안크티바'안크티바(Anktiva®, 성분명: 노가펜데킨 알파 인바키셉트-pmln, nogapendekin alfa inbakicept-pmln, ImmunityBio)는 IL-15 초작용제(superagonist) 복합체로 개발된 최초의 방광 내 면역치료제다.2024년 4월 미국 FDA에서 유두종 유무와 관계없이 상피내암(CIS)을 동반한 BCG-불응성 비근육침윤성 방광암(non-muscle invasive bladder cancer, NMIBC) 성인 환자를 대상으로 BCG와 병용 사용하는 치료제로 승인됐다.방광암은 전 세계적으로 흔한 악성 종양 중 하나다. 국내에서도 발생 빈도가 높은 암종으로 알려져 있다. 이 중 약 75%는 비근육침윤성 방광암(NMIBC)으로 분류되며, 초기 치료는 대개 경요도 방광 종양 절제술(transurethral resection of bladder tumor, TURBT)로 시작된다.그러나 NMIBC는 60& 8211;70%의 재발률을 보이므로, TURBT 이후 방광 내 치료(intravesical therapy)가 질병의 재발을 억제하고 진행을 지연시키는 데 핵심적인 역할을 한다.현재 방광 내 치료는 크게 두 가지로 구분되며, 하나는 BCG 요법을 기반으로 하는 면역치료, 다른 하나는 미토마이신 C, 젬시타빈, 에피루비신, 독소루비신 등으로 구성되는 화학요법이다.BCG는 NMIBC의 표준 치료 중 하나이지만, 약 40%의 환자에서는 충분한 치료 효과를 보이지 못한다. 안크티바는 이러한 BCG-불응성 환자에서 방광 절제술을 피할 수 있는 새로운 치료 대안으로 개발됐다.IL-15는 NK 세포와 CD8& 8314; T 세포의 활성, 증식, 기억 형성에 관여하는 중요한 사이토카인이다. 안크티바는 IL-15 변형체와 IL-15Rα의 sushi(반복 단백질 구조) domain이 결합한 IL-15 초작용제(superagonist) 복합체를 통해 NK 세포, CD4& 8314; T 세포, CD8& 8314; T 세포의 활성을 강력하게 유도하며, 특히 종양 특이적 기억 T 세포 반응을 증폭시켜 항종양 면역반응을 강화한다.임상시험에서 BCG 유지요법과 함께 안크티바를 투여받은 77명의 환자 중 62%(95% CI, 51& 8211;73)가 완전관해에 도달했다. 이 반응은 일부 환자에서 최대 47개월까지 지속됐다. 완전관해가 12개월 이상 유지된 비율은 58%, 24개월 이상 유지된 비율은 40%였다.치료 스케줄은 방광 내 카테터를 통한 유도요법(6주간 주 1회) 후, 4, 7, 10, 13, 19개월째의 유지요법(각 3주간 주 1회)으로 구성된다. 3개월 시점에 완전 반응이 확인되지 않으면 두 번째 유도요법을 시행할 수 있으며, 25개월 이후에도 완전 반응이 지속되는 경우에는 25, 31, 37개월째에 추가 BCG 유지투여를 실시할 수 있다. 투여 시 약물 혼합액은 방광 내에 2시간 동안 유지한 뒤 배출한다.안크티바 치료에는 몇 가지 중요한 주의사항이 있다. 방광절제술을 지연함으로써 전이성 방광암으로 진행할 위험이 존재하며, 배아& 8211;태아 독성 가능성이 보고되어 가임기 여성은 치료 중과 마지막 투여 후 최소 1주일 동안 피임이 필요하다.흔하게 보고되는 이상반응으로는 배뇨곤란, 혈뇨, 빈뇨, 절박뇨, 요로감염, 근골격계 통증, 발열 및 오한 등이 있으며, 실험실 검사에서는 크레아티닌 상승과 칼륨 상승이 비교적 흔하게 관찰된다.방광암(Bladder Cancer)이란 무엇인가?방광암은 요로계에서 가장 흔히 발생하는 악성 종양 중 하나로, 소변을 저장하는 장기인 방광의 점막 상피세포에서 주로 기원한다.전 세계적으로 방광암은 발생률과 사망률 측면에서 중요한 건강 문제를 야기하고 있으며, 특히 남성에서 높은 발생 빈도를 보인다. 방광암의 발생에는 흡연이 가장 강력한 위험 요인으로 작용하는 것으로 알려져 있다. 이 외에도 직업적 발암물질 노출, 만성 요로 감염 및 요로 결석 등이 발병과 연관돼 있다.조직학적으로 방광암의 대다수는 요로상피암(urothelial carcinoma)으로, 전체 방광암의 약 90%를 차지한다. 요로상피암은 방광뿐 아니라 요관, 신우, 요도 등 요로 전반에 걸쳐 발생할 수 있는 특성을 지니고 있다.이 외에도 만성 자극이나 염증과 관련된 편평세포암(squamous cell carcinoma), 드물게 선종 양상의 조직학적 특징을 보이는 선암(adenocarcinoma), 그리고 고도로 공격적인 생물학적 특성을 나타내는 소세포암(small cell carcinoma) 등 다양한 형태가 존재한다. 이러한 조직형의 차이는 임상적 경과, 치료 전략 및 예후와 밀접하게 연관되어 있어 진단 시 정확한 병리학적 분류가 필수적이다.방광암의 병기 결정은 치료 방침 수립과 예후 평가에 있어 핵심적인 요소이다. 국제적으로 널리 사용되는 TNM 병기 체계는 종양의 침윤 정도(T), 국소 림프절 전이 여부(N), 및 원격 전이 여부(M)에 기반하여 병기를 구분한다.특히 방광벽의 근육층 침윤 여부는 임상적 의사결정에서 매우 중요한 기준으로 작용한다. 종양이 점막층에 국한된 Ta 병기, 상피 내에서 편평하게 확산되는 상피내암(carcinoma in situ, CIS), 그리고 점막하층을 침범하나 근육층에는 도달하지 않은 T1 병기는 비근침윤성 방광암(non& 8211;muscle invasive bladder cancer, NMIBC)으로 분류된다.반면, 종양이 방광 근육층을 침범하는 T2 병기부터는 근침윤성 방광암(muscle invasive bladder cancer, MIBC)으로 정의되며, 이후 주변 지방조직(T3) 및 인접 장기(T4)로의 침윤 여부에 따라 병기가 상승한다. 림프절 전이(N1& 8211;N3)와 원격 전이(M1)의 존재는 질병의 진행을 시사하며 전신적 치료 전략이 요구된다.Non& 8211;Muscle Invasive Bladder Cancer(NMIBC) and Muscle Invasive Bladder Cancer(출처: https://cgoncology.com/science/).이와 같이 방광암은 조직학적 이질성과 침윤 정도에 따른 이분화된 임상 양상을 보이며, 병기 및 조직형은 환자의 치료 선택과 예후에 결정적인 영향을 미친다.비근침윤성 방광암(Non& 8211;muscle invasive bladder cancer, NMIBC)은 무엇인가?비근육 침습성 방광암(NMIBC)은 새로 진단되는 방광암의 약 75%를 차지하며, 병변이 주로 요로상피의 표층(Ta), 점막하층(T1) 또는 상피내암(CIS)에 국한되는 질환이다.NMIBC는 즉각적으로 생명을 위협하는 경우는 드물지만, 높은 재발률과 적지 않은 진행 위험으로 인해 임상적으로 중요한 도전 과제로 여겨진다. 실제로 환자의 약 50~70%가 초기 치료 이후 재발을 경험하며, 최대 30%는 근육 침습성 또는 전이성 방광암으로 진행한다.수십 년 동안 고위험군 NMIBC 환자에서 경요도 방광 종양 절제술(transurethral resection of bladder tumor, TURBT) 후 시행되는 BCG(Bacillus Calmette& 8211;Gu& 233;rin) 치료는 재발과 진행을 효과적으로 억제하는 표준 치료로 자리매김해 왔다.그러나 BCG 치료의 임상적 이점에도 불구하고 약 40%의 환자에서 실패가 발생하며, 이 경우 추가적인 치료 전략이 필요하다. 이러한 환자군에서 전통적으로 가장 선호된 치료는 근치적 방광절제술(radical cystectomy)이었으나, 이 수술은 상당한 이환율과 삶의 질 저하를 초래하는 고난도 치료로, 실제 임상 적용에는 한계가 적지 않다.NMIBC의 위험도 분류& 8212;저위험군, 중간위험군, 고위험군& 8212;는 종양의 병기, 등급, 크기, 다초점성, 재발력 등의 임상·병리학적 지표를 종합해 이루어지며, 특히 고위험군 환자, 그중에서도 CIS 또는 T1 병변을 가진 환자는 진행 위험이 높아 보다 적극적인 치료가 요구된다.근치적 방광절제술은 BCG 불응 NMIBC에서 높은 질병 조절 효과를 보이지만, 그 침습성과 장기적인 기능 상실로 인해 방광을 보존하면서도 충분한 종양 조절을 달성할 수 있는 새로운 치료 전략의 필요성이 크게 대두되고 있다.이에 따라 면역관문억제제, 종양용해성 바이러스(oncolytic virus) 치료, 방광내 약물전달 플랫폼, 표적 치료제 등 다양한 신기술 기반 치료법이 개발되고 있으며, 이들 접근법은 방광 기능을 유지하면서도 지속적이고 임상적으로 의미 있는 치료 효과를 달성하는 것을 목표로 한다.최근 NMIBC 치료 환경은 과거와 달리 빠르게 확장되고 있으며, 새로운 약제의 등장, 기존 약물의 새로운 적응증 또는 약물 전달 방식의 진화, 그리고 완전히 새로운 치료 플랫폼의 출현 등 혁신적 변화가 지속되고 있다.초기에는 대부분의 신약 개발이 BCG 불응성 고위험군 NMIBC 환자를 대상으로 이루어졌으나, 점차 고위험군뿐 아니라 중간위험군 환자에서도 BCG와 직접 경쟁 가능한 후보 약제가 등장하면서 치료 선택지는 더욱 다양해지고 있다.비근침윤성 방광암(NMIBC)은 어떻게 치료하고, 치료 성적은 어떠한가?비근침윤성 방광암(NMIBC)은 대부분 경요도 방광 종양 절제술(TURBT) 후 시행되는 보조요법을 통해 관리된다. 이 질환의 임상적 특징은 높은 재발률과 상대적으로 낮은 진행률로 요약된다.실제로 5년 재발률은 50~70%에 이르며, 진행률은 10~20% 수준으로 보고된다. 이러한 자연경과는 단순 TURBT만으로는 장기적인 종양 조절이 어렵다는 점을 시사하며, 보조적 방광내 치료의 중요성을 부각시킨다.TURBT 직후 시행되는 단회 방광내 항암제 주입요법은 저위험군 및 일부 중위험군에서 재발률을 유의하게 낮추는 것으로 입증됐다. 특히 mitomycin C(MMC)는 절제 후 잔존 암세포를 제거하고 세포 재부착을 방지하는 작용을 통해 초기 재발 감소 전략의 표준요법으로 자리잡았다. 그러나 MMC를 포함한 기존 화학요법은 병변의 진행 억제 효과가 제한적이어서 고위험군에서는 단독 치료만으로는 충분하지 않다.고위험군 NMIBC, 특히 고등급 Ta/T1 병변 및 상피내암(CIS)의 경우 BCG 면역요법이 여전히 가장 강력하고 일관된 치료 효과를 제공한다. BCG의 초기 완전반응률은 유두종양에서 55~65%, CIS에서 70~75%로 보고되며, 재발 억제와 진행 위험 감소를 동시에 입증한 유일한 방광내 치료법이다.그럼에도 불구하고 전체 환자의 약 30~40%는 BCG에 초기 반응을 보이지 않는다. 초기 완전반응을 얻더라도 약 절반은 결국 재발한다. 여기에 장기화된 BCG 공급 부족 문제까지 겹치면서 고위험군 외의 환자에게 BCG 사용을 제한해야 하는 현실적인 어려움도 지속되고 있다.이러한 한계를 보완하기 위해 다양한 대체 전략이 개발되고 있다. Gemcitabine, Epirubicin, MMC 등 기존 항암제의 방광내 투여는 BCG 불응성 또는 BCG 금기 환자에서 활용되고 있으며, 특히 gemcitabine& 8211;docetaxel 병용요법은 BCG 불응 환자에서 1년 완전반응률 50~60%를 보이며 salvage therapy로 임상적 관심이 높아지고 있다.최근에는 방광보존 치료 옵션이 기존 면역요법을 넘어 유전자치료 영역으로까지 확장되고 있다. Nadofaragene firadenovec(Adstiladrin& 9415;)은 IFN-α2b 유전자를 방광 점막에 전달하여 국소 면역반응을 활성화하는 비증식성 아데노바이러스 벡터 기반 치료제로, 고위험 BCG 불응성 NMIBC에서 2022년 미국 FDA 승인을 받았다. 주요 임상시험에서는 3개월 완전반응률 53%, 12개월 지속반응률 24~30%가 보고되며, BCG 불응성 환자에서 새로운 치료 기전의 확립이라는 의의를 가진다.종합하면 NMIBC 치료 전략은 위험군에 따라 크게 달라지며, 저위험군에서는 TURBT와 단회 항암제 주입만으로도 비교적 양호한 성적을 기대할 수 있다. 반면 고위험군에서는 BCG를 중심으로 한 적극적 면역치료가 필수적이며, BCG 불응성 증가와 공급 제한 문제로 인해 새로운 치료제 개발이 더욱 활발히 이루어지고 있다.Bacillus Calmette-Gu& 233;rin(BCG)는 어떤 치료 방법인가?BCG는 1990년 미국 FDA에서 승인된 비특이적 면역요법으로, 비근육침윤성 방광암(NMIBC) 치료에 널리 사용돼 왔다.BCG의 항종양 효과는 Th1 중심의 면역 반응을 유도하는 기전에 기반한다. BCG가 요로상피세포에 부착되면 IL-1, IL-6, IL-8, TNF-α 등 다양한 사이토카인과 케모카인이 분비되며, 이로 인해 면역세포들이 방광 점막으로 집중된다. 이어서 대식세포, 호중구, 수지상세포 등 항원제시세포가 활성화되고, 변화된 사이토카인 환경 속에서 미성숙 CD4+ T 세포는 Th1 또는 Th2 세포로 분화한다.이 중 Th1 반응은 IFN-γ를 포함한 사이토카인 분비를 통해 BCG 치료 효과와 밀접히 연관되며, 반대로 IL-10을 중심으로 한 Th2 반응은 BCG 실패와 관련된다. 실제로 IL-10 억제 또는 IFN-γ 증가가 Th1 우세 상태를 유도하며, 이는 BCG 매개 종양 퇴행에 필수적인 요소로 알려져 있다.이처럼 BCG는 Th1 면역 반응을 활성화함으로써 방광암이 유발하는 면역 억제 환경을 극복하는 데 효과적이지만, 환자 예후를 더 향상시키기 위해서는 보다 강력한 면역조절 능력을 가진 새로운 치료제의 개발이 필요하다.특히 BCG에 반응하지 않는 NMIBC는 예후가 불량하고 전통적으로 치료 옵션이 제한적이었다. 고위험 BCG-불응성 질환의 경우 근치적 방광 절제술이 표준 치료로 권고되지만, 모든 환자가 수술을 감내할 수 있는 것은 아니다.임상시험 기준으로 BCG의 초기 완전반응률은 유두종양에서 약 55~65%, CIS에서 70~75% 수준이다. 그러나 전체 NMIBC 환자의 약 3분의 1은 BCG에 전혀 반응하지 않으며, 초기 반응을 보인 환자의 약 절반도 결국 재발하거나 진행을 경험한다.미국 FDA는 BCG-불응성 NMIBC를 다음과 같이 정의한다: ▲ 적절한 BCG 요법 후 12개월 이내 지속성 또는 재발성 CIS, 또는 재발성 Ta/T1 질환이 있는 경우(초기 유도 6회 중 ≥5회, 유지 3회 중 ≥2회 또는 2차 유도 6회 중 ≥2회 투여 완료를 ‘적절한 요법’으로 정의), ▲ 적절한 BCG 요법 후 6개월 이내 재발한 고등급 Ta/T1 질환, ▲ 유도요법 후 첫 평가에서 고등급 T1 질환이 확인된 경우이다.Bacillus Calmette-Gu& 233;rin(BCG)-불응성은 왜 일어나는가?BCG-불응성은 단일 요인보다는 종양 미세환경, 면역반응의 왜곡, 종양세포의 생물학적 저항성이 복합적으로 작용하여 발생한다. 일부 NMIBC는 이미 강한 면역억제 환경을 형성하고 있어, BCG가 유도하는 Th1 중심 면역 반응이 충분히 활성화되지 못한다.이들 종양에서는 IL-10과 TGF-β 같은 면역억제성 사이토카인이 증가하고, Treg와 MDSC가 축적되며, 종양세포의 PD-L1 발현도 높아져 T 세포 기능이 억제된다. 이러한 환경에서는 BCG가 방출시키는 사이토카인이 존재하더라도 Th1 분화보다는 Th2 또는 억제성 면역반응이 우세해져 IFN-γ 중심의 항종양 면역이 제대로 형성되지 않는다.또한 종양세포 자체가 BCG에 대한 내성을 가지는 경우도 있다. 상피세포 표면의 BCG 부착·내재화에 필요한 integrin 등 분자의 발현이 낮거나, BCG가 유도하는 세포사멸 신호(TRAIL, Fas 등)에 저항성을 나타내는 경우가 이에 해당한다. 일부 NMIBC는 특정 유전자 변이나 생존 신호의 과활성화로 인해 BCG 면역 반응에 본질적으로 둔감하다.여기에 고령, 기저질환, 면역노화 등 환자 요인이 더해지면 APC 활성 및 T 세포 반응성이 감소해 BCG가 충분한 면역 강화 효과를 내지 못한다. 균주 간 면역원성 차이, BCG 부족으로 인한 불충분한 치료 역시 면역반응 축적을 방해해 불응 위험을 높인다.결국 BCG 불응성은 종양 미세환경의 면역억제성, Th1 면역 활성화의 실패, 종양세포의 내재적 저항성, 그리고 숙주 면역 기능 저하가 상호 작용하여 나타나는 복합적 면역치료 실패 현상으로 이해된다. 이러한 이유로 BCG 불응성 NMIBC에서는 보다 강력한 면역조절 능력을 갖춘 새로운 치료 전략이 필요하다.인터루킨-15(IL-15)는 어떤 역할을 하는가?IL-15는 공통 γ사슬(γc) 사이토카인 패밀리에 속하는 면역 조절 인자로, 선천 면역과 적응 면역의 경계를 연결하며 항종양 면역을 강화하는 데 핵심적인 역할을 수행한다. IL-2, IL-4, IL-7, IL-9, IL-21과 함께 γc 계열을 이루는 IL-15는 특히 CD8+ T 세포와 자연살해(NK) 세포의 발달, 생존, 증식, 그리고 기능적 활성화 전반을 조절하는 중심적 사이토카인이다.Pleiotropic Effects of IL-15(출처: Cells 2023, 12, 1611).이러한 생물학적 중요성은 다양한 전임상·임상 연구에서 반복적으로 입증되어 왔으며, IL-15가 항암 면역을 유지하는 데 필수적인 조절자로 작용함을 뚜렷하게 보여준다.생리학적으로 IL-15는 IL-15 수용체 α(IL-15Rα)와 함께 이종이량체 형태로 합성된다. IL-15Rα는 자체적으로 신호 전달 기능을 갖고 있지는 않지만 IL-15에 높은 친화도로 결합하여 내질망에서 안정적인 복합체를 형성하고 이를 세포 표면까지 운반함으로써 생물학적 기능 발현을 위한 핵심적인 플랫폼을 제공한다.이 복합체는 생산 세포 표면에 제시된 뒤 인접한 수용 세포의 IL-2/IL-15Rβ와 공통 γ사슬과 결합하여 신호를 전달하는데, 이러한 ‘트랜스제시(trans-presentation)’는 IL-15 생물학을 규정하는 대표적 기전이자 IL-2와 구별되는 가장 특징적인 작동 방식이다.따라서 IL-15와 IL-15Rα는 단핵구, 대식세포, 수지상세포, 혈관내피세포, 골수 및 림프절의 기질세포 등 다양한 세포 유형에서 발현되며, 특히 수지상세포와 대식세포가 주요 생산자인 것으로 보고되었다. 이들 세포는 항원 제시뿐 아니라 IL-15 제시 기능을 통해 CD8+ T 세포와 NK 세포의 생존 신호를 제공함으로써 면역계의 항상성을 유지하는 데 기여한다.IL-15 초작용제(superagonist) 복합체는 무엇인가?최근 면역조절 치료제 개발은 기존 사이토카인 신호 경로를 선택적으로 증폭하여 항종양 면역 반응을 극대화하는 방향으로 진화하고 있으며, 그 중심에는 IL-15 경로 기반의 차세대 초작용제(superagonist) 기술이 있다.IL-15는 본래 NK 세포와 CD8& 8314; T 세포의 생존, 증식, 기억 형성에 핵심적인 사이토카인이지만, 생체 내 반감기가 짧고 수용체 결합 효율이 낮아 단독 활용에는 한계가 있었다.이러한 제약을 극복하기 위해 고안된 IL-15 초작용제 복합체는 IL-15의 생물학적 활성을 비약적으로 증폭하도록 설계된 구조적 혁신체로, 대표적인 예가 IL-15N72D 변형체와 IL-15Rα의 sushi 도메인을 융합한 노가펜데킨 알파 인바키셉트이다.IL-15N72D는 아스파라긴(N)에서 아스파트산(D)으로의 단일 아미노산 치환을 통해 수용체 친화성과 신호전달 강도를 향상시킨 기능적 변형체이며, IL-15Rα의 sushi 도메인 결합을 통해 자연적인 trans-presentation 기전을 모사하도록 설계되었다.이 두 구성요소는 IgG1 Fc 영역과 융합되어 약물의 안정성, 체내 반감기, 조직 내 지속 시간을 획기적으로 개선하며, 그 결과 NK 세포와 CD8& 8314; T 세포의 활성화 및 항종양 세포독성 반응을 장기간 유도하는 강력한 IL-15 신호 증폭체를 형성한다.이러한 기전은 기존 BCG 치료로 유도되는 국소 면역 반응을 효과적으로 증폭시키며, BCG-불응성 비근육침윤성 방광암에서 관찰되는 높은 완전관해율과 반응 지속성을 설명하는 면역학적 기반을 제공한다.결과적으로 IL-15 변형체와 IL-15Rα가 융합된 초작용제 플랫폼은 단순한 사이토카인 보충을 넘어, 정밀하게 설계된 면역 신호 조절을 통해 종양 미세환경 내에서 효과적인 항암 면역을 재활성화하려는 현대 면역항암제 개발의 중요한 패러다임을 제시한다노가펜데킨 알파 인바키셉트의 약리 기전은?노가펜데킨 알파 인바키셉트는 IL-15 돌연변이체(IL-15N72D)와 IL-15Rα를 융합한 복합체로, 자연 면역세포가 제공하는 IL-15 제시 기전을 모방한다. 이를 통해 CD8+ T 세포, NK 세포, 기억 T 세포의 증식·활성화를 강하게 유도하면서도, 면역억제성 조절 T 세포의 확장은 최소화한다.전임상 모델에서 방광 내 투여된 노가펜데킨 알파 인바키셉트는 단독 또는 BCG와 병용 시 BCG 단독보다 우수한 항종양 효과를 보였다. 또한 비융합(native) IL-15에 비해 림프조직 내 지속시간이 길고, 약동학적 안정성이 크게 향상되어 보다 강력하고 지속적인 항종양 면역반응을 유발한다.결과적으로 노가펜데킨 알파 인바키셉트는 IL-15 신호를 증폭해 킬러 T 세포 중심의 면역반응을 재가동시키는 기전적 특성을 기반으로, BCG-불응성 NMIBC에서 의미 있는 치료적 이점을 제공하는 IL-15 기반 면역증강제이다.Immune Effects of nogapendekin alfa inbakicept(출처: Cells 2023, 12, 1611).위 사진자료에 대해 설명하면, A. 노가펜데킨 알파 인바키셉트는 인간 IgG1 Fc와 융합된 IL15Rα에 결합된 돌연변이(N72D) 인간 IL-15로 구성된다. B. 노가펜데킨 알파 인바키셉트는 IL-15 수용체를 통해 순환 면역 세포에 결합한다. C. 노가펜데킨 알파 인바키셉트가 림프구에 결합하면 자연 살해(NK) 세포와 CD8+ T 세포 집단이 활성화된다되고 확장되어 고효과 CD56 dim 및 CD56 bright NK 세포와 중앙 기억 T 세포(TCM)가 확장된다. D. 비장 CD8+ T 세포 표면의 CXCR3가 상향 조절되면 종양 미세 환경(TME)으로 이동할 가능성이 높아집니다. 활성화된 NK 세포도 종양으로 이동한다. E. 활성화된 종양 침윤 CD8+ T 림프구(TIL)는 MHC 클래스 I 복합체가 제시하는 종양 관련 항원 에피토프를 인식하여 암세포를 인식한다. 활성화된 CD8+ T 세포와 NK 세포는 세포독성이 증가하여 암세포 사멸을 유도한다.CD8+ T 세포는 IFNγ 및 TNF& 9082;와 같은 Th1 사이토카인을 분비하여 염증성 TME를 촉진하고 과립구 및 단핵구 골수유래 억제 세포(MDSC)의 PD-L1을 상향 조절합니다. 노가펜데킨 알파 인바키셉트는 NK TIL이 TGF-β의 영향에 저항성을 갖도록 하고 항체 의존성 세포독성(ADCC)을 증가시킬 수 있도록 한다.노가펜데킨 알파 인바키셉트의 치료적 위치는?비근육침윤성 방광암(NMIBC)은 초기 치료로 경요도 방광종양절제술(TURBT)이 시행되지만, 재발률이 높고 병변이 지속·활성화되는 경우가 많아 반복적 치료가 필요하다. 특히 CIS를 동반한 고위험군에서는 BCG 치료가 표준으로 자리잡아 있으나, 충분한 BCG 노출에도 불구하고 재발·지속·진행이 나타나는 BCG-불응성 환자군이 적지 않다.이러한 환자에서 근치적 방광적출술(radical cystectomy)은 표준 치료로 권고되지만, 고령, 동반질환, 삶의 질 저하에 대한 우려, 환자 선호 등의 이유로 수술 적용이 어려운 경우가 많다. 이에 따라 방광을 보존하면서도 충분한 항종양 효과를 제공할 수 있는 새로운 치료 전략의 필요성이 지속적으로 제기되어 왔다.노가펜데킨 알파 인바키셉트는 IL-15/IL-15Rα 복합체 기반의 IL-15 초작동제로, CD8+ T 세포와 NK 세포의 증식·활성화를 강력하게 유도하는 면역 증강형 생물학적 제제이다. NMIBC에서 BCG 치료는 국소 면역활성에 의존하지만, BCG-불응성 환자에서는 방광 내 면역 미세환경의 소진, T/NK 세포 감소, BCG 반응 저하 등이 주요 병태생리로 지적된다.이러한 맥락에서 노가펜데킨 알파 인바키셉트는 고갈된 면역계를 다시 활성화하여 기존 BCG 효과를 강화하고, 단독 BCG로는 확보하기 어려운 항종양 면역반응을 확대하는 기전적 장점을 가진다.전신 면역관문억제제인 pembrolizumab(키트루다)은 일부 환자에서 의미 있는 완전반응을 유도하지만, 전신 면역 관련 부작용과 장기 치료에 따른 독성·비용 부담이 중요한 제약으로 남아 있다. 반면 노가펜데킨 알파 인바키셉트는 방광 내 국소 투여를 기반으로 하여 전신 독성이 극히 낮으며, 고령 또는 동반질환이 많은 실제 진료 환경에서 사용하기 용이하다.또한 바이러스 벡터를 이용하는 AAV 기반 유전자치료제(nadofaragene firadenovec)와 달리 벡터 노출에 따른 안전성 우려가 없고, 기존 BCG 치료 패턴과 자연스럽게 연계되어 임상적 채택성이 높다는 점도 장점이다.노가펜데킨 알파 인바키셉트의 임상적 의미는 단순한 반응률 개선을 넘어, BCG-불응성 CIS 환자에서 방광적출술을 지연하거나 회피할 수 있는 실질적 치료 대안을 제공한다는 데에 있다.실제 임상에서 의미 있는 완전반응률과 지속기간이 확인되었으며, 이는 방광적출술을 바로 시행하기 어려운 환자에게 중요한 시간적 여유와 치료 선택권을 제공한다. 전신 독성의 부담이 거의 없고, BCG 기반 면역작동 기전을 확장하는 방식이라는 점 또한 치료적 위치를 공고히 한다.노가펜데킨 알파 인바키셉트(ANKTIVA)의 허가임상은 어떠한가?ANKTIVA의 효능은 QUILT-3.032(NCT03022825) 시험에서 평가되었다. 이 연구는 경요도 방광종양절제술(TURBT) 이후 BCG에 반응하지 않는 고위험 비근육침윤성 방광암(NMIBC) 중 상피내암(CIS)을 동반한 성인 환자 77명을 대상으로 한 단일군, 다기관 임상시험이었다. 여기에는 Ta/T1 유두상 병변의 동반 여부와 상관없이 CIS를 가진 환자들이 포함되었다.BCG 불응성 고위험군 NMIBC의 CIS는, 충분한 BCG 치료를 완료한 후 12개월 이내에 CIS가 단독으로 또는 Ta/T1 병변과 함께 지속되거나 재발한 경우로 정의되었다. 충분한 BCG 치료는 초기 유도요법 6회 중 최소 5회를 투여하고, 이어서 유지요법 3회 중 최소 2회 또는 두 번째 유도요법 6회 중 최소 2회를 투여한 경우로 정의되었다.치료 전 Ta 또는 T1 병변 환자들은 절제가 가능한 모든 병변을 제거하기 위해 TURBT를 시행받았다. 절제, 소작 또는 전기소작이 불가능한 잔여 CIS는 허용되었다. 한편 근침윤성 방광암(T2~T4), 국소 진행성, 전이성 또는 방광 외부(요도, 요관, 신우) 침범이 있거나 그 병력이 있는 환자는 시험에서 제외되었다.환자들은 유도요법 동안 ANKTIVA 400mcg와 BCG를 주 1회, 6주 연속 투여받았다. 이후 질병이 없거나 저등급 질환을 가진 경우 4, 7, 10, 13, 19개월째에 3주 간격으로 주 1회 추가 투여를 받았다. 치료 3개월 시점에 CIS가 지속되거나 고등급 Ta 병변이 남아 있는 경우에는 두 번째 유도요법을 받을 수 있었다. 치료 25개월 시점에 완전반응(CR)이 유지되는 환자는 25, 31, 37개월째에 동일한 방식으로 추가 투여가 가능했다.종양 상태 평가는 최대 2년 동안 3개월마다 시행되었다. 24개월 이후의 반응 평가는 각 기관의 진료 기준에 따라 시행되었다. 치료 시작 후 첫 6개월 동안은 무작위 또는 방광경 유도 조직검사가 필수적으로 시행되었다. 주요 효능 평가지표는 어느 시점에서든 완전반응을 달성했는지와(방광경 검사 및 필요 시 TURBT/조직검사 결과 음성, 요세포검사 음성 기준) 그 반응의 지속기간이었다.등록 환자의 중앙 연령은 73세(범위 50~91세)였고, 86%가 남성이었다. 인종 분포는 백인 90%, 흑인 6%, 아시아인 1%, 아메리칸 인디언/알래스카 원주민 1%, 미상 1%였다. ECOG 수행능력은 0점이 83%, 1점이 17%였다.연구 등록 시 종양 특성은 CIS 단독 69%, CIS + Ta 병변 21%, CIS + T1(±Ta) 병변 10%였다. 기저 질환 상태는 불응성 43%, 재발성 57%였다. 이전 BCG 투여 횟수의 중앙값은 12회(범위 8~45회)였고, 13%는 분할 용량 BCG를 받은 경험이 있었다. 방광경 영상 방식은 백색광 57%, 청색광 또는 협대역 영상 40%, 미상 3%였다.효능 결과는 표 3에 제시되어 있으며, 전체 환자의 31%(24명)는 두 번째 유도요법을 받았다.노가펜데킨 알파 인바키셉트의 쟁점을 무엇인가?노가펜데킨 알파 인바키셉트는 IL-15의 생물학적 활성을 기반으로 설계된 차세대 면역작용제로, 고위험 BCG 불응성 비근침윤성 방광암(NMIBC) 치료에서 새로운 치료적 가능성을 제시하고 있다.IL-15는 CD8& 8314; T 세포와 NK 세포의 생존과 기능을 강화하는 핵심 사이토카인으로 알려져 있으나, 자연 상태의 IL-15는 짧은 반감기, 불안정한 구조, 수용체 결합의 가변성 등으로 인해 치료제로 활용하는 데 본질적인 제약이 존재해왔다.노가펜데킨 알파 인바키셉트는 IL-15와 IL-15Rα 수용체 도메인을 결합해 형성한 안정적 이종이량체 기반의 IL-15 초작용제로, 내재 IL-15에 비해 우수한 생체 내 안정성과 장기적 면역 활성 유도가 가능하다는 점에서 임상적 의미가 크다.특히 BCG 치료에 반응하지 않는 NMIBC 환자는 방광적출술이 표준 치료임에도 불구하고, 고령 및 동반질환 등으로 수술이 어려운 경우가 많아 실질적인 치료 공백이 존재해왔다. 이러한 점에서 BCG와 병용하여 국소 종양 미세환경을 재활성화할 수 있는 약제의 개발은 방광보존 전략을 확장할 수 있는 새로운 치료 패러다임이라 할 수 있다.노가펜데킨 알파 인바키셉트의 주요 장점은 BCG와 병용 시 강력한 상승효과를 보인다는 점이다. IL-15Rα와의 결합을 통해 강화된 생물학적 활성은 APC, NK 세포, CD8& 8314; T 세포의 집적과 기능을 촉진하여 항종양 면역반응을 증폭시키며, 이는 허가 근거가 된 QUILT-3.032 연구에서 3개월 완전반응률 53%, 12개월 반응 지속률 24~30%로 나타났다.이러한 치료 성적은 기존 BCG 불응 환자에서 보고된 방광내 요법의 성적을 상회하는 결과이며, 이 약제가 임상적으로 의미 있는 반응을 유도하는 면역치료제로 기능함을 보여준다.그러나 노가펜데킨 알파 인바키셉트는의 개발과 허가 과정에는 여러 한계와 도전이 병존한다. 가장 큰 문제는 근거 임상이 무작위 대조군이 없는 단일군(single-arm) 연구로 수행되었다는 점으로, 이는 약제의 효과를 BCG 재투여 효과와 명확히 구분하기 어렵게 만들며, 역사적 대조(historical control)와의 비교에서 발생할 수 있는 해석의 변이를 피하기 어렵다.또한 환자군 내 BCG 노출량, CIS 단독 여부, 종양 특성 등에서 이질성이 존재하여 반응률과 반응 지속성의 정확한 비교가 제한된다. 반응의 지속성 역시 완전반응을 보인 환자의 일부에서만 장기적으로 유지되는 경향이 관찰되었고, 12개월 이후 장기 추적자료는 아직 충분히 축적되지 않아 방광보존 전략의 장기적 안전성과 유효성에 대한 확정적 결론을 내리기 어렵다.더불어 치료효과의 기저에 있는 종양면역미세환경의 상태가 환자별로 크게 달라, 이 약제가 NK/T 세포 결핍 또는 극도로 억제된 미세환경을 충분히 회복시키지 못하는 경우가 존재할 것으로 예상되며, 이러한 점은 향후 바이오마커 기반 환자선택 전략의 필요성을 시사한다.이처럼 노가펜데킨 알파 인바키셉트는 IL-15 생물학을 임상적으로 구현한 최초의 치료제로서 BCG 불응성 NMIBC라는 미충족 의료수요 영역에서 실질적인 치료 옵션을 제공하고 있다.초기 반응률과 독성 프로파일은 고무적이지만, 단일군 연구 설계, 병용요법의 기여도 분리 문제, 반응 지속성의 제한, 장기 추적자료 부족 등은 여전히 해결해야 할 과제로 남아 있다.그럼에도 불구하고 노가펜데킨 알파 인바키셉트는 기존 치료제와는 차별화된 기전을 바탕으로 난치성 NMIBC에서 방광보존 전력을 확장할 수 있는 중요한 면역치료제로 자리매김할 가능성이 높으며, 향후 병용 전략, 내성 기전 규명, 예측 바이오마커 개발 등을 통해 그 임상적 가치가 더욱 강화될 것으로 기대된다.참고문헌 1. Grace Lui et al. “Exploiting an Interleukin-15 Heterodimeric Agonist (N803) for Effective Immunotherapy of Solid Malignancies” Cells 2023, 12(12), 1611. 3. Richard S et al. “Non& 8211;muscle-invasive Bladder Cancer: Overview and Contemporary Treatment Landscape of Neoadjuvant Chemoablative Therapies” Reviews in Urology, Vol. 22 No. 2 2020. 3. Jong Ho Park et al. “The Emerging Treatment of BCG (Bacillus Calmette-Gu& 233;rin)- Unresponsive Non& 8211;Muscle-Invasive Bladder Cancer“ Journal of Urologic Oncology 2024;22(3):246-255. 4. Aiman Waheed et al. “Nogapendekin alfa inbakicept-PMLN: first approval milestone for BCG-unresponsive noninvasive bladder cancer: editorial” Annals of Medicine & Surgery (2024) 86:6386& 8211;6388. 5. Brian L. Heiss et al. “FDA Approval Summary: Nogapendekin Alfa Inbakicept-pmln with BCG for BCG-unresponsive carcinoma in situ” Clin Cancer Res. 2025 October 15; 31(20): 4223& 8211;4229. 6. Vikram M et al. “Mechanism of action of nadofaragene firadenovec-vncg” Front. Oncol. 14:1359725. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-11-20 17:29:43최병철 박사
방광암 면역치료 최초 IL-15 초작용제 '안크티바'안크티바(Anktiva®, 성분명: 노가펜데킨 알파 인바키셉트-pmln, nogapendekin alfa inbakicept-pmln, ImmunityBio)는 IL-15 초작용제(superagonist) 복합체로 개발된 최초의 방광 내 면역치료제다.2024년 4월 미국 FDA에서 유두종 유무와 관계없이 상피내암(CIS)을 동반한 BCG-불응성 비근육침윤성 방광암(non-muscle invasive bladder cancer, NMIBC) 성인 환자를 대상으로 BCG와 병용 사용하는 치료제로 승인됐다.방광암은 전 세계적으로 흔한 악성 종양 중 하나다. 국내에서도 발생 빈도가 높은 암종으로 알려져 있다. 이 중 약 75%는 비근육침윤성 방광암(NMIBC)으로 분류되며, 초기 치료는 대개 경요도 방광 종양 절제술(transurethral resection of bladder tumor, TURBT)로 시작된다.그러나 NMIBC는 60& 8211;70%의 재발률을 보이므로, TURBT 이후 방광 내 치료(intravesical therapy)가 질병의 재발을 억제하고 진행을 지연시키는 데 핵심적인 역할을 한다.현재 방광 내 치료는 크게 두 가지로 구분되며, 하나는 BCG 요법을 기반으로 하는 면역치료, 다른 하나는 미토마이신 C, 젬시타빈, 에피루비신, 독소루비신 등으로 구성되는 화학요법이다.BCG는 NMIBC의 표준 치료 중 하나이지만, 약 40%의 환자에서는 충분한 치료 효과를 보이지 못한다. 안크티바는 이러한 BCG-불응성 환자에서 방광 절제술을 피할 수 있는 새로운 치료 대안으로 개발됐다.IL-15는 NK 세포와 CD8& 8314; T 세포의 활성, 증식, 기억 형성에 관여하는 중요한 사이토카인이다. 안크티바는 IL-15 변형체와 IL-15Rα의 sushi(반복 단백질 구조) domain이 결합한 IL-15 초작용제(superagonist) 복합체를 통해 NK 세포, CD4& 8314; T 세포, CD8& 8314; T 세포의 활성을 강력하게 유도하며, 특히 종양 특이적 기억 T 세포 반응을 증폭시켜 항종양 면역반응을 강화한다.임상시험에서 BCG 유지요법과 함께 안크티바를 투여받은 77명의 환자 중 62%(95% CI, 51& 8211;73)가 완전관해에 도달했다. 이 반응은 일부 환자에서 최대 47개월까지 지속됐다. 완전관해가 12개월 이상 유지된 비율은 58%, 24개월 이상 유지된 비율은 40%였다.치료 스케줄은 방광 내 카테터를 통한 유도요법(6주간 주 1회) 후, 4, 7, 10, 13, 19개월째의 유지요법(각 3주간 주 1회)으로 구성된다. 3개월 시점에 완전 반응이 확인되지 않으면 두 번째 유도요법을 시행할 수 있으며, 25개월 이후에도 완전 반응이 지속되는 경우에는 25, 31, 37개월째에 추가 BCG 유지투여를 실시할 수 있다. 투여 시 약물 혼합액은 방광 내에 2시간 동안 유지한 뒤 배출한다.안크티바 치료에는 몇 가지 중요한 주의사항이 있다. 방광절제술을 지연함으로써 전이성 방광암으로 진행할 위험이 존재하며, 배아& 8211;태아 독성 가능성이 보고되어 가임기 여성은 치료 중과 마지막 투여 후 최소 1주일 동안 피임이 필요하다.흔하게 보고되는 이상반응으로는 배뇨곤란, 혈뇨, 빈뇨, 절박뇨, 요로감염, 근골격계 통증, 발열 및 오한 등이 있으며, 실험실 검사에서는 크레아티닌 상승과 칼륨 상승이 비교적 흔하게 관찰된다.방광암(Bladder Cancer)이란 무엇인가?방광암은 요로계에서 가장 흔히 발생하는 악성 종양 중 하나로, 소변을 저장하는 장기인 방광의 점막 상피세포에서 주로 기원한다.전 세계적으로 방광암은 발생률과 사망률 측면에서 중요한 건강 문제를 야기하고 있으며, 특히 남성에서 높은 발생 빈도를 보인다. 방광암의 발생에는 흡연이 가장 강력한 위험 요인으로 작용하는 것으로 알려져 있다. 이 외에도 직업적 발암물질 노출, 만성 요로 감염 및 요로 결석 등이 발병과 연관돼 있다.조직학적으로 방광암의 대다수는 요로상피암(urothelial carcinoma)으로, 전체 방광암의 약 90%를 차지한다. 요로상피암은 방광뿐 아니라 요관, 신우, 요도 등 요로 전반에 걸쳐 발생할 수 있는 특성을 지니고 있다.이 외에도 만성 자극이나 염증과 관련된 편평세포암(squamous cell carcinoma), 드물게 선종 양상의 조직학적 특징을 보이는 선암(adenocarcinoma), 그리고 고도로 공격적인 생물학적 특성을 나타내는 소세포암(small cell carcinoma) 등 다양한 형태가 존재한다. 이러한 조직형의 차이는 임상적 경과, 치료 전략 및 예후와 밀접하게 연관되어 있어 진단 시 정확한 병리학적 분류가 필수적이다.방광암의 병기 결정은 치료 방침 수립과 예후 평가에 있어 핵심적인 요소이다. 국제적으로 널리 사용되는 TNM 병기 체계는 종양의 침윤 정도(T), 국소 림프절 전이 여부(N), 및 원격 전이 여부(M)에 기반하여 병기를 구분한다.특히 방광벽의 근육층 침윤 여부는 임상적 의사결정에서 매우 중요한 기준으로 작용한다. 종양이 점막층에 국한된 Ta 병기, 상피 내에서 편평하게 확산되는 상피내암(carcinoma in situ, CIS), 그리고 점막하층을 침범하나 근육층에는 도달하지 않은 T1 병기는 비근침윤성 방광암(non& 8211;muscle invasive bladder cancer, NMIBC)으로 분류된다.반면, 종양이 방광 근육층을 침범하는 T2 병기부터는 근침윤성 방광암(muscle invasive bladder cancer, MIBC)으로 정의되며, 이후 주변 지방조직(T3) 및 인접 장기(T4)로의 침윤 여부에 따라 병기가 상승한다. 림프절 전이(N1& 8211;N3)와 원격 전이(M1)의 존재는 질병의 진행을 시사하며 전신적 치료 전략이 요구된다.Non& 8211;Muscle Invasive Bladder Cancer(NMIBC) and Muscle Invasive Bladder Cancer(출처: https://cgoncology.com/science/).이와 같이 방광암은 조직학적 이질성과 침윤 정도에 따른 이분화된 임상 양상을 보이며, 병기 및 조직형은 환자의 치료 선택과 예후에 결정적인 영향을 미친다.비근침윤성 방광암(Non& 8211;muscle invasive bladder cancer, NMIBC)은 무엇인가?비근육 침습성 방광암(NMIBC)은 새로 진단되는 방광암의 약 75%를 차지하며, 병변이 주로 요로상피의 표층(Ta), 점막하층(T1) 또는 상피내암(CIS)에 국한되는 질환이다.NMIBC는 즉각적으로 생명을 위협하는 경우는 드물지만, 높은 재발률과 적지 않은 진행 위험으로 인해 임상적으로 중요한 도전 과제로 여겨진다. 실제로 환자의 약 50~70%가 초기 치료 이후 재발을 경험하며, 최대 30%는 근육 침습성 또는 전이성 방광암으로 진행한다.수십 년 동안 고위험군 NMIBC 환자에서 경요도 방광 종양 절제술(transurethral resection of bladder tumor, TURBT) 후 시행되는 BCG(Bacillus Calmette& 8211;Gu& 233;rin) 치료는 재발과 진행을 효과적으로 억제하는 표준 치료로 자리매김해 왔다.그러나 BCG 치료의 임상적 이점에도 불구하고 약 40%의 환자에서 실패가 발생하며, 이 경우 추가적인 치료 전략이 필요하다. 이러한 환자군에서 전통적으로 가장 선호된 치료는 근치적 방광절제술(radical cystectomy)이었으나, 이 수술은 상당한 이환율과 삶의 질 저하를 초래하는 고난도 치료로, 실제 임상 적용에는 한계가 적지 않다.NMIBC의 위험도 분류& 8212;저위험군, 중간위험군, 고위험군& 8212;는 종양의 병기, 등급, 크기, 다초점성, 재발력 등의 임상·병리학적 지표를 종합해 이루어지며, 특히 고위험군 환자, 그중에서도 CIS 또는 T1 병변을 가진 환자는 진행 위험이 높아 보다 적극적인 치료가 요구된다.근치적 방광절제술은 BCG 불응 NMIBC에서 높은 질병 조절 효과를 보이지만, 그 침습성과 장기적인 기능 상실로 인해 방광을 보존하면서도 충분한 종양 조절을 달성할 수 있는 새로운 치료 전략의 필요성이 크게 대두되고 있다.이에 따라 면역관문억제제, 종양용해성 바이러스(oncolytic virus) 치료, 방광내 약물전달 플랫폼, 표적 치료제 등 다양한 신기술 기반 치료법이 개발되고 있으며, 이들 접근법은 방광 기능을 유지하면서도 지속적이고 임상적으로 의미 있는 치료 효과를 달성하는 것을 목표로 한다.최근 NMIBC 치료 환경은 과거와 달리 빠르게 확장되고 있으며, 새로운 약제의 등장, 기존 약물의 새로운 적응증 또는 약물 전달 방식의 진화, 그리고 완전히 새로운 치료 플랫폼의 출현 등 혁신적 변화가 지속되고 있다.초기에는 대부분의 신약 개발이 BCG 불응성 고위험군 NMIBC 환자를 대상으로 이루어졌으나, 점차 고위험군뿐 아니라 중간위험군 환자에서도 BCG와 직접 경쟁 가능한 후보 약제가 등장하면서 치료 선택지는 더욱 다양해지고 있다.비근침윤성 방광암(NMIBC)은 어떻게 치료하고, 치료 성적은 어떠한가?비근침윤성 방광암(NMIBC)은 대부분 경요도 방광 종양 절제술(TURBT) 후 시행되는 보조요법을 통해 관리된다. 이 질환의 임상적 특징은 높은 재발률과 상대적으로 낮은 진행률로 요약된다.실제로 5년 재발률은 50~70%에 이르며, 진행률은 10~20% 수준으로 보고된다. 이러한 자연경과는 단순 TURBT만으로는 장기적인 종양 조절이 어렵다는 점을 시사하며, 보조적 방광내 치료의 중요성을 부각시킨다.TURBT 직후 시행되는 단회 방광내 항암제 주입요법은 저위험군 및 일부 중위험군에서 재발률을 유의하게 낮추는 것으로 입증됐다. 특히 mitomycin C(MMC)는 절제 후 잔존 암세포를 제거하고 세포 재부착을 방지하는 작용을 통해 초기 재발 감소 전략의 표준요법으로 자리잡았다. 그러나 MMC를 포함한 기존 화학요법은 병변의 진행 억제 효과가 제한적이어서 고위험군에서는 단독 치료만으로는 충분하지 않다.고위험군 NMIBC, 특히 고등급 Ta/T1 병변 및 상피내암(CIS)의 경우 BCG 면역요법이 여전히 가장 강력하고 일관된 치료 효과를 제공한다. BCG의 초기 완전반응률은 유두종양에서 55~65%, CIS에서 70~75%로 보고되며, 재발 억제와 진행 위험 감소를 동시에 입증한 유일한 방광내 치료법이다.그럼에도 불구하고 전체 환자의 약 30~40%는 BCG에 초기 반응을 보이지 않는다. 초기 완전반응을 얻더라도 약 절반은 결국 재발한다. 여기에 장기화된 BCG 공급 부족 문제까지 겹치면서 고위험군 외의 환자에게 BCG 사용을 제한해야 하는 현실적인 어려움도 지속되고 있다.이러한 한계를 보완하기 위해 다양한 대체 전략이 개발되고 있다. Gemcitabine, Epirubicin, MMC 등 기존 항암제의 방광내 투여는 BCG 불응성 또는 BCG 금기 환자에서 활용되고 있으며, 특히 gemcitabine& 8211;docetaxel 병용요법은 BCG 불응 환자에서 1년 완전반응률 50~60%를 보이며 salvage therapy로 임상적 관심이 높아지고 있다.최근에는 방광보존 치료 옵션이 기존 면역요법을 넘어 유전자치료 영역으로까지 확장되고 있다. Nadofaragene firadenovec(Adstiladrin& 9415;)은 IFN-α2b 유전자를 방광 점막에 전달하여 국소 면역반응을 활성화하는 비증식성 아데노바이러스 벡터 기반 치료제로, 고위험 BCG 불응성 NMIBC에서 2022년 미국 FDA 승인을 받았다. 주요 임상시험에서는 3개월 완전반응률 53%, 12개월 지속반응률 24~30%가 보고되며, BCG 불응성 환자에서 새로운 치료 기전의 확립이라는 의의를 가진다.종합하면 NMIBC 치료 전략은 위험군에 따라 크게 달라지며, 저위험군에서는 TURBT와 단회 항암제 주입만으로도 비교적 양호한 성적을 기대할 수 있다. 반면 고위험군에서는 BCG를 중심으로 한 적극적 면역치료가 필수적이며, BCG 불응성 증가와 공급 제한 문제로 인해 새로운 치료제 개발이 더욱 활발히 이루어지고 있다.Bacillus Calmette-Gu& 233;rin(BCG)는 어떤 치료 방법인가?BCG는 1990년 미국 FDA에서 승인된 비특이적 면역요법으로, 비근육침윤성 방광암(NMIBC) 치료에 널리 사용돼 왔다.BCG의 항종양 효과는 Th1 중심의 면역 반응을 유도하는 기전에 기반한다. BCG가 요로상피세포에 부착되면 IL-1, IL-6, IL-8, TNF-α 등 다양한 사이토카인과 케모카인이 분비되며, 이로 인해 면역세포들이 방광 점막으로 집중된다. 이어서 대식세포, 호중구, 수지상세포 등 항원제시세포가 활성화되고, 변화된 사이토카인 환경 속에서 미성숙 CD4+ T 세포는 Th1 또는 Th2 세포로 분화한다.이 중 Th1 반응은 IFN-γ를 포함한 사이토카인 분비를 통해 BCG 치료 효과와 밀접히 연관되며, 반대로 IL-10을 중심으로 한 Th2 반응은 BCG 실패와 관련된다. 실제로 IL-10 억제 또는 IFN-γ 증가가 Th1 우세 상태를 유도하며, 이는 BCG 매개 종양 퇴행에 필수적인 요소로 알려져 있다.이처럼 BCG는 Th1 면역 반응을 활성화함으로써 방광암이 유발하는 면역 억제 환경을 극복하는 데 효과적이지만, 환자 예후를 더 향상시키기 위해서는 보다 강력한 면역조절 능력을 가진 새로운 치료제의 개발이 필요하다.특히 BCG에 반응하지 않는 NMIBC는 예후가 불량하고 전통적으로 치료 옵션이 제한적이었다. 고위험 BCG-불응성 질환의 경우 근치적 방광 절제술이 표준 치료로 권고되지만, 모든 환자가 수술을 감내할 수 있는 것은 아니다.임상시험 기준으로 BCG의 초기 완전반응률은 유두종양에서 약 55~65%, CIS에서 70~75% 수준이다. 그러나 전체 NMIBC 환자의 약 3분의 1은 BCG에 전혀 반응하지 않으며, 초기 반응을 보인 환자의 약 절반도 결국 재발하거나 진행을 경험한다.미국 FDA는 BCG-불응성 NMIBC를 다음과 같이 정의한다: ▲ 적절한 BCG 요법 후 12개월 이내 지속성 또는 재발성 CIS, 또는 재발성 Ta/T1 질환이 있는 경우(초기 유도 6회 중 ≥5회, 유지 3회 중 ≥2회 또는 2차 유도 6회 중 ≥2회 투여 완료를 ‘적절한 요법’으로 정의), ▲ 적절한 BCG 요법 후 6개월 이내 재발한 고등급 Ta/T1 질환, ▲ 유도요법 후 첫 평가에서 고등급 T1 질환이 확인된 경우이다.Bacillus Calmette-Gu& 233;rin(BCG)-불응성은 왜 일어나는가?BCG-불응성은 단일 요인보다는 종양 미세환경, 면역반응의 왜곡, 종양세포의 생물학적 저항성이 복합적으로 작용하여 발생한다. 일부 NMIBC는 이미 강한 면역억제 환경을 형성하고 있어, BCG가 유도하는 Th1 중심 면역 반응이 충분히 활성화되지 못한다.이들 종양에서는 IL-10과 TGF-β 같은 면역억제성 사이토카인이 증가하고, Treg와 MDSC가 축적되며, 종양세포의 PD-L1 발현도 높아져 T 세포 기능이 억제된다. 이러한 환경에서는 BCG가 방출시키는 사이토카인이 존재하더라도 Th1 분화보다는 Th2 또는 억제성 면역반응이 우세해져 IFN-γ 중심의 항종양 면역이 제대로 형성되지 않는다.또한 종양세포 자체가 BCG에 대한 내성을 가지는 경우도 있다. 상피세포 표면의 BCG 부착·내재화에 필요한 integrin 등 분자의 발현이 낮거나, BCG가 유도하는 세포사멸 신호(TRAIL, Fas 등)에 저항성을 나타내는 경우가 이에 해당한다. 일부 NMIBC는 특정 유전자 변이나 생존 신호의 과활성화로 인해 BCG 면역 반응에 본질적으로 둔감하다.여기에 고령, 기저질환, 면역노화 등 환자 요인이 더해지면 APC 활성 및 T 세포 반응성이 감소해 BCG가 충분한 면역 강화 효과를 내지 못한다. 균주 간 면역원성 차이, BCG 부족으로 인한 불충분한 치료 역시 면역반응 축적을 방해해 불응 위험을 높인다.결국 BCG 불응성은 종양 미세환경의 면역억제성, Th1 면역 활성화의 실패, 종양세포의 내재적 저항성, 그리고 숙주 면역 기능 저하가 상호 작용하여 나타나는 복합적 면역치료 실패 현상으로 이해된다. 이러한 이유로 BCG 불응성 NMIBC에서는 보다 강력한 면역조절 능력을 갖춘 새로운 치료 전략이 필요하다.인터루킨-15(IL-15)는 어떤 역할을 하는가?IL-15는 공통 γ사슬(γc) 사이토카인 패밀리에 속하는 면역 조절 인자로, 선천 면역과 적응 면역의 경계를 연결하며 항종양 면역을 강화하는 데 핵심적인 역할을 수행한다. IL-2, IL-4, IL-7, IL-9, IL-21과 함께 γc 계열을 이루는 IL-15는 특히 CD8+ T 세포와 자연살해(NK) 세포의 발달, 생존, 증식, 그리고 기능적 활성화 전반을 조절하는 중심적 사이토카인이다.Pleiotropic Effects of IL-15(출처: Cells 2023, 12, 1611).이러한 생물학적 중요성은 다양한 전임상·임상 연구에서 반복적으로 입증되어 왔으며, IL-15가 항암 면역을 유지하는 데 필수적인 조절자로 작용함을 뚜렷하게 보여준다.생리학적으로 IL-15는 IL-15 수용체 α(IL-15Rα)와 함께 이종이량체 형태로 합성된다. IL-15Rα는 자체적으로 신호 전달 기능을 갖고 있지는 않지만 IL-15에 높은 친화도로 결합하여 내질망에서 안정적인 복합체를 형성하고 이를 세포 표면까지 운반함으로써 생물학적 기능 발현을 위한 핵심적인 플랫폼을 제공한다.이 복합체는 생산 세포 표면에 제시된 뒤 인접한 수용 세포의 IL-2/IL-15Rβ와 공통 γ사슬과 결합하여 신호를 전달하는데, 이러한 ‘트랜스제시(trans-presentation)’는 IL-15 생물학을 규정하는 대표적 기전이자 IL-2와 구별되는 가장 특징적인 작동 방식이다.따라서 IL-15와 IL-15Rα는 단핵구, 대식세포, 수지상세포, 혈관내피세포, 골수 및 림프절의 기질세포 등 다양한 세포 유형에서 발현되며, 특히 수지상세포와 대식세포가 주요 생산자인 것으로 보고되었다. 이들 세포는 항원 제시뿐 아니라 IL-15 제시 기능을 통해 CD8+ T 세포와 NK 세포의 생존 신호를 제공함으로써 면역계의 항상성을 유지하는 데 기여한다.IL-15 초작용제(superagonist) 복합체는 무엇인가?최근 면역조절 치료제 개발은 기존 사이토카인 신호 경로를 선택적으로 증폭하여 항종양 면역 반응을 극대화하는 방향으로 진화하고 있으며, 그 중심에는 IL-15 경로 기반의 차세대 초작용제(superagonist) 기술이 있다.IL-15는 본래 NK 세포와 CD8& 8314; T 세포의 생존, 증식, 기억 형성에 핵심적인 사이토카인이지만, 생체 내 반감기가 짧고 수용체 결합 효율이 낮아 단독 활용에는 한계가 있었다.이러한 제약을 극복하기 위해 고안된 IL-15 초작용제 복합체는 IL-15의 생물학적 활성을 비약적으로 증폭하도록 설계된 구조적 혁신체로, 대표적인 예가 IL-15N72D 변형체와 IL-15Rα의 sushi 도메인을 융합한 노가펜데킨 알파 인바키셉트이다.IL-15N72D는 아스파라긴(N)에서 아스파트산(D)으로의 단일 아미노산 치환을 통해 수용체 친화성과 신호전달 강도를 향상시킨 기능적 변형체이며, IL-15Rα의 sushi 도메인 결합을 통해 자연적인 trans-presentation 기전을 모사하도록 설계되었다.이 두 구성요소는 IgG1 Fc 영역과 융합되어 약물의 안정성, 체내 반감기, 조직 내 지속 시간을 획기적으로 개선하며, 그 결과 NK 세포와 CD8& 8314; T 세포의 활성화 및 항종양 세포독성 반응을 장기간 유도하는 강력한 IL-15 신호 증폭체를 형성한다.이러한 기전은 기존 BCG 치료로 유도되는 국소 면역 반응을 효과적으로 증폭시키며, BCG-불응성 비근육침윤성 방광암에서 관찰되는 높은 완전관해율과 반응 지속성을 설명하는 면역학적 기반을 제공한다.결과적으로 IL-15 변형체와 IL-15Rα가 융합된 초작용제 플랫폼은 단순한 사이토카인 보충을 넘어, 정밀하게 설계된 면역 신호 조절을 통해 종양 미세환경 내에서 효과적인 항암 면역을 재활성화하려는 현대 면역항암제 개발의 중요한 패러다임을 제시한다노가펜데킨 알파 인바키셉트의 약리 기전은?노가펜데킨 알파 인바키셉트는 IL-15 돌연변이체(IL-15N72D)와 IL-15Rα를 융합한 복합체로, 자연 면역세포가 제공하는 IL-15 제시 기전을 모방한다. 이를 통해 CD8+ T 세포, NK 세포, 기억 T 세포의 증식·활성화를 강하게 유도하면서도, 면역억제성 조절 T 세포의 확장은 최소화한다.전임상 모델에서 방광 내 투여된 노가펜데킨 알파 인바키셉트는 단독 또는 BCG와 병용 시 BCG 단독보다 우수한 항종양 효과를 보였다. 또한 비융합(native) IL-15에 비해 림프조직 내 지속시간이 길고, 약동학적 안정성이 크게 향상되어 보다 강력하고 지속적인 항종양 면역반응을 유발한다.결과적으로 노가펜데킨 알파 인바키셉트는 IL-15 신호를 증폭해 킬러 T 세포 중심의 면역반응을 재가동시키는 기전적 특성을 기반으로, BCG-불응성 NMIBC에서 의미 있는 치료적 이점을 제공하는 IL-15 기반 면역증강제이다.Immune Effects of nogapendekin alfa inbakicept(출처: Cells 2023, 12, 1611).위 사진자료에 대해 설명하면, A. 노가펜데킨 알파 인바키셉트는 인간 IgG1 Fc와 융합된 IL15Rα에 결합된 돌연변이(N72D) 인간 IL-15로 구성된다. B. 노가펜데킨 알파 인바키셉트는 IL-15 수용체를 통해 순환 면역 세포에 결합한다. C. 노가펜데킨 알파 인바키셉트가 림프구에 결합하면 자연 살해(NK) 세포와 CD8+ T 세포 집단이 활성화된다되고 확장되어 고효과 CD56 dim 및 CD56 bright NK 세포와 중앙 기억 T 세포(TCM)가 확장된다. D. 비장 CD8+ T 세포 표면의 CXCR3가 상향 조절되면 종양 미세 환경(TME)으로 이동할 가능성이 높아집니다. 활성화된 NK 세포도 종양으로 이동한다. E. 활성화된 종양 침윤 CD8+ T 림프구(TIL)는 MHC 클래스 I 복합체가 제시하는 종양 관련 항원 에피토프를 인식하여 암세포를 인식한다. 활성화된 CD8+ T 세포와 NK 세포는 세포독성이 증가하여 암세포 사멸을 유도한다.CD8+ T 세포는 IFNγ 및 TNF& 9082;와 같은 Th1 사이토카인을 분비하여 염증성 TME를 촉진하고 과립구 및 단핵구 골수유래 억제 세포(MDSC)의 PD-L1을 상향 조절합니다. 노가펜데킨 알파 인바키셉트는 NK TIL이 TGF-β의 영향에 저항성을 갖도록 하고 항체 의존성 세포독성(ADCC)을 증가시킬 수 있도록 한다.노가펜데킨 알파 인바키셉트의 치료적 위치는?비근육침윤성 방광암(NMIBC)은 초기 치료로 경요도 방광종양절제술(TURBT)이 시행되지만, 재발률이 높고 병변이 지속·활성화되는 경우가 많아 반복적 치료가 필요하다. 특히 CIS를 동반한 고위험군에서는 BCG 치료가 표준으로 자리잡아 있으나, 충분한 BCG 노출에도 불구하고 재발·지속·진행이 나타나는 BCG-불응성 환자군이 적지 않다.이러한 환자에서 근치적 방광적출술(radical cystectomy)은 표준 치료로 권고되지만, 고령, 동반질환, 삶의 질 저하에 대한 우려, 환자 선호 등의 이유로 수술 적용이 어려운 경우가 많다. 이에 따라 방광을 보존하면서도 충분한 항종양 효과를 제공할 수 있는 새로운 치료 전략의 필요성이 지속적으로 제기되어 왔다.노가펜데킨 알파 인바키셉트는 IL-15/IL-15Rα 복합체 기반의 IL-15 초작동제로, CD8+ T 세포와 NK 세포의 증식·활성화를 강력하게 유도하는 면역 증강형 생물학적 제제이다. NMIBC에서 BCG 치료는 국소 면역활성에 의존하지만, BCG-불응성 환자에서는 방광 내 면역 미세환경의 소진, T/NK 세포 감소, BCG 반응 저하 등이 주요 병태생리로 지적된다.이러한 맥락에서 노가펜데킨 알파 인바키셉트는 고갈된 면역계를 다시 활성화하여 기존 BCG 효과를 강화하고, 단독 BCG로는 확보하기 어려운 항종양 면역반응을 확대하는 기전적 장점을 가진다.전신 면역관문억제제인 pembrolizumab(키트루다)은 일부 환자에서 의미 있는 완전반응을 유도하지만, 전신 면역 관련 부작용과 장기 치료에 따른 독성·비용 부담이 중요한 제약으로 남아 있다. 반면 노가펜데킨 알파 인바키셉트는 방광 내 국소 투여를 기반으로 하여 전신 독성이 극히 낮으며, 고령 또는 동반질환이 많은 실제 진료 환경에서 사용하기 용이하다.또한 바이러스 벡터를 이용하는 AAV 기반 유전자치료제(nadofaragene firadenovec)와 달리 벡터 노출에 따른 안전성 우려가 없고, 기존 BCG 치료 패턴과 자연스럽게 연계되어 임상적 채택성이 높다는 점도 장점이다.노가펜데킨 알파 인바키셉트의 임상적 의미는 단순한 반응률 개선을 넘어, BCG-불응성 CIS 환자에서 방광적출술을 지연하거나 회피할 수 있는 실질적 치료 대안을 제공한다는 데에 있다.실제 임상에서 의미 있는 완전반응률과 지속기간이 확인되었으며, 이는 방광적출술을 바로 시행하기 어려운 환자에게 중요한 시간적 여유와 치료 선택권을 제공한다. 전신 독성의 부담이 거의 없고, BCG 기반 면역작동 기전을 확장하는 방식이라는 점 또한 치료적 위치를 공고히 한다.노가펜데킨 알파 인바키셉트(ANKTIVA)의 허가임상은 어떠한가?ANKTIVA의 효능은 QUILT-3.032(NCT03022825) 시험에서 평가되었다. 이 연구는 경요도 방광종양절제술(TURBT) 이후 BCG에 반응하지 않는 고위험 비근육침윤성 방광암(NMIBC) 중 상피내암(CIS)을 동반한 성인 환자 77명을 대상으로 한 단일군, 다기관 임상시험이었다. 여기에는 Ta/T1 유두상 병변의 동반 여부와 상관없이 CIS를 가진 환자들이 포함되었다.BCG 불응성 고위험군 NMIBC의 CIS는, 충분한 BCG 치료를 완료한 후 12개월 이내에 CIS가 단독으로 또는 Ta/T1 병변과 함께 지속되거나 재발한 경우로 정의되었다. 충분한 BCG 치료는 초기 유도요법 6회 중 최소 5회를 투여하고, 이어서 유지요법 3회 중 최소 2회 또는 두 번째 유도요법 6회 중 최소 2회를 투여한 경우로 정의되었다.치료 전 Ta 또는 T1 병변 환자들은 절제가 가능한 모든 병변을 제거하기 위해 TURBT를 시행받았다. 절제, 소작 또는 전기소작이 불가능한 잔여 CIS는 허용되었다. 한편 근침윤성 방광암(T2~T4), 국소 진행성, 전이성 또는 방광 외부(요도, 요관, 신우) 침범이 있거나 그 병력이 있는 환자는 시험에서 제외되었다.환자들은 유도요법 동안 ANKTIVA 400mcg와 BCG를 주 1회, 6주 연속 투여받았다. 이후 질병이 없거나 저등급 질환을 가진 경우 4, 7, 10, 13, 19개월째에 3주 간격으로 주 1회 추가 투여를 받았다. 치료 3개월 시점에 CIS가 지속되거나 고등급 Ta 병변이 남아 있는 경우에는 두 번째 유도요법을 받을 수 있었다. 치료 25개월 시점에 완전반응(CR)이 유지되는 환자는 25, 31, 37개월째에 동일한 방식으로 추가 투여가 가능했다.종양 상태 평가는 최대 2년 동안 3개월마다 시행되었다. 24개월 이후의 반응 평가는 각 기관의 진료 기준에 따라 시행되었다. 치료 시작 후 첫 6개월 동안은 무작위 또는 방광경 유도 조직검사가 필수적으로 시행되었다. 주요 효능 평가지표는 어느 시점에서든 완전반응을 달성했는지와(방광경 검사 및 필요 시 TURBT/조직검사 결과 음성, 요세포검사 음성 기준) 그 반응의 지속기간이었다.등록 환자의 중앙 연령은 73세(범위 50~91세)였고, 86%가 남성이었다. 인종 분포는 백인 90%, 흑인 6%, 아시아인 1%, 아메리칸 인디언/알래스카 원주민 1%, 미상 1%였다. ECOG 수행능력은 0점이 83%, 1점이 17%였다.연구 등록 시 종양 특성은 CIS 단독 69%, CIS + Ta 병변 21%, CIS + T1(±Ta) 병변 10%였다. 기저 질환 상태는 불응성 43%, 재발성 57%였다. 이전 BCG 투여 횟수의 중앙값은 12회(범위 8~45회)였고, 13%는 분할 용량 BCG를 받은 경험이 있었다. 방광경 영상 방식은 백색광 57%, 청색광 또는 협대역 영상 40%, 미상 3%였다.효능 결과는 표 3에 제시되어 있으며, 전체 환자의 31%(24명)는 두 번째 유도요법을 받았다.노가펜데킨 알파 인바키셉트의 쟁점을 무엇인가?노가펜데킨 알파 인바키셉트는 IL-15의 생물학적 활성을 기반으로 설계된 차세대 면역작용제로, 고위험 BCG 불응성 비근침윤성 방광암(NMIBC) 치료에서 새로운 치료적 가능성을 제시하고 있다.IL-15는 CD8& 8314; T 세포와 NK 세포의 생존과 기능을 강화하는 핵심 사이토카인으로 알려져 있으나, 자연 상태의 IL-15는 짧은 반감기, 불안정한 구조, 수용체 결합의 가변성 등으로 인해 치료제로 활용하는 데 본질적인 제약이 존재해왔다.노가펜데킨 알파 인바키셉트는 IL-15와 IL-15Rα 수용체 도메인을 결합해 형성한 안정적 이종이량체 기반의 IL-15 초작용제로, 내재 IL-15에 비해 우수한 생체 내 안정성과 장기적 면역 활성 유도가 가능하다는 점에서 임상적 의미가 크다.특히 BCG 치료에 반응하지 않는 NMIBC 환자는 방광적출술이 표준 치료임에도 불구하고, 고령 및 동반질환 등으로 수술이 어려운 경우가 많아 실질적인 치료 공백이 존재해왔다. 이러한 점에서 BCG와 병용하여 국소 종양 미세환경을 재활성화할 수 있는 약제의 개발은 방광보존 전략을 확장할 수 있는 새로운 치료 패러다임이라 할 수 있다.노가펜데킨 알파 인바키셉트의 주요 장점은 BCG와 병용 시 강력한 상승효과를 보인다는 점이다. IL-15Rα와의 결합을 통해 강화된 생물학적 활성은 APC, NK 세포, CD8& 8314; T 세포의 집적과 기능을 촉진하여 항종양 면역반응을 증폭시키며, 이는 허가 근거가 된 QUILT-3.032 연구에서 3개월 완전반응률 53%, 12개월 반응 지속률 24~30%로 나타났다.이러한 치료 성적은 기존 BCG 불응 환자에서 보고된 방광내 요법의 성적을 상회하는 결과이며, 이 약제가 임상적으로 의미 있는 반응을 유도하는 면역치료제로 기능함을 보여준다.그러나 노가펜데킨 알파 인바키셉트는의 개발과 허가 과정에는 여러 한계와 도전이 병존한다. 가장 큰 문제는 근거 임상이 무작위 대조군이 없는 단일군(single-arm) 연구로 수행되었다는 점으로, 이는 약제의 효과를 BCG 재투여 효과와 명확히 구분하기 어렵게 만들며, 역사적 대조(historical control)와의 비교에서 발생할 수 있는 해석의 변이를 피하기 어렵다.또한 환자군 내 BCG 노출량, CIS 단독 여부, 종양 특성 등에서 이질성이 존재하여 반응률과 반응 지속성의 정확한 비교가 제한된다. 반응의 지속성 역시 완전반응을 보인 환자의 일부에서만 장기적으로 유지되는 경향이 관찰되었고, 12개월 이후 장기 추적자료는 아직 충분히 축적되지 않아 방광보존 전략의 장기적 안전성과 유효성에 대한 확정적 결론을 내리기 어렵다.더불어 치료효과의 기저에 있는 종양면역미세환경의 상태가 환자별로 크게 달라, 이 약제가 NK/T 세포 결핍 또는 극도로 억제된 미세환경을 충분히 회복시키지 못하는 경우가 존재할 것으로 예상되며, 이러한 점은 향후 바이오마커 기반 환자선택 전략의 필요성을 시사한다.이처럼 노가펜데킨 알파 인바키셉트는 IL-15 생물학을 임상적으로 구현한 최초의 치료제로서 BCG 불응성 NMIBC라는 미충족 의료수요 영역에서 실질적인 치료 옵션을 제공하고 있다.초기 반응률과 독성 프로파일은 고무적이지만, 단일군 연구 설계, 병용요법의 기여도 분리 문제, 반응 지속성의 제한, 장기 추적자료 부족 등은 여전히 해결해야 할 과제로 남아 있다.그럼에도 불구하고 노가펜데킨 알파 인바키셉트는 기존 치료제와는 차별화된 기전을 바탕으로 난치성 NMIBC에서 방광보존 전력을 확장할 수 있는 중요한 면역치료제로 자리매김할 가능성이 높으며, 향후 병용 전략, 내성 기전 규명, 예측 바이오마커 개발 등을 통해 그 임상적 가치가 더욱 강화될 것으로 기대된다.참고문헌 1. Grace Lui et al. “Exploiting an Interleukin-15 Heterodimeric Agonist (N803) for Effective Immunotherapy of Solid Malignancies” Cells 2023, 12(12), 1611. 3. Richard S et al. “Non& 8211;muscle-invasive Bladder Cancer: Overview and Contemporary Treatment Landscape of Neoadjuvant Chemoablative Therapies” Reviews in Urology, Vol. 22 No. 2 2020. 3. Jong Ho Park et al. “The Emerging Treatment of BCG (Bacillus Calmette-Gu& 233;rin)- Unresponsive Non& 8211;Muscle-Invasive Bladder Cancer“ Journal of Urologic Oncology 2024;22(3):246-255. 4. Aiman Waheed et al. “Nogapendekin alfa inbakicept-PMLN: first approval milestone for BCG-unresponsive noninvasive bladder cancer: editorial” Annals of Medicine & Surgery (2024) 86:6386& 8211;6388. 5. Brian L. Heiss et al. “FDA Approval Summary: Nogapendekin Alfa Inbakicept-pmln with BCG for BCG-unresponsive carcinoma in situ” Clin Cancer Res. 2025 October 15; 31(20): 4223& 8211;4229. 6. Vikram M et al. “Mechanism of action of nadofaragene firadenovec-vncg” Front. Oncol. 14:1359725. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-11-20 17:29:43최병철 박사 -
 셀트리온, 미국 바이오기업 신약 2종 도입...계약금 114억[데일리팜=천승현 기자] 셀트리온은 미국 바이오기업 카이진(Kaigene)과 자가면역질환 항체 기반 신약 후보물질 2종에 대한 독점적 라이선스 계약을 체결했다고 4일 밝혔다.전체 계약 규모는 최대 7억4400만달러(약 1조620억원)다. 선급금은 800만달러(114억원), 개발 마일스톤은 최대 1억1100만달러(1584억원)로 책정됐다. 판매 마일스톤은 최대 6억2500만달러(8921억원)다. 상업화 성공시 매출에 따른 로열티는 순매출액의 5%-10%를 별도 지급하는 조건이다.계약에 따라 셀트리온은 카이진의 비임상 단계 파이프라인인 KG006의 중국, 일본을 제외한 독점적인 글로벌 개발 및 판매 권리를 갖는다. KG002의 전 세계 독점적인 글로벌 개발, 생산 및 판매 권리도 확보했다.미국 메릴랜드주에 소재한 카이진은 병인성 자가항체를 분해하는 기술인 PDEGTM(Pathogenic Antibody Degrader) 플랫폼을 활용한 다중 항체 신약 개발에 특화된 바이오기업이다. 자가면역질환 분야의 차세대 치료제 발굴에서 두각을 보이고 있다.셀트리온이 확보한 후보 물질은 태아 Fc 수용체(FcRn, Neonatal Fc Receptor) 기전을 기반으로 하는 자가면역질환치료제다. FcRn은 수용체 단백질로 체내 면역글로불린G(IgG)와 결합해 이들이 세포 내 소기관에서 분해되지 않고 재순환될 수 있도록 해 면역체계를 유지하는 데 도움을 준다. 해당 기전을 활용하면 자가면역질환 등 질병을 유발하는 병인성(pathogenic) 자가항체를 효과적으로 제거할 수 있어, 차세대 치료 전략으로 주목받고 있다.FcRn 억제제는 TNF-α 억제제와 인터루킨(IL) 억제제 이후 차세대 자가면역질환 치료 기전으로 떠오르고 있고, 다양한 적응증으로 확장 가능해 성장성도 높다는 게 회사 측 설명이다.셀트리온은 “이번 신규 파이프라인의 추가로 신약 개발 중심 체제를 한층 강화하게 됐다”라고 평가했다. 올해 초 발표한 항체약물접합체(ADC), 이중항체 등 다수의 파이프라인이 담긴 신약 개발 로드맵에 따라, 항암 신약 CT-P70, CT-P71은 이미 임상 1상에 진입하는 등 신약 개발이 순항 중이다. 여기에 자가면역질환 파이프라인을 추가, 항암 신약에 이어 포트폴리오를 다각화했다.셀트리온 관계자는 “2종의 신규 후보 물질 확보를 통해 셀트리온이 강점을 가지고 있는 자가면역질환 치료제 분야에서도 신약 개발에 돌입했다”라면서 “미충족 의료 수요를 해소하는 동시에 글로벌 의약품 시장 내 경쟁력과 영향력 확대에 최선의 노력을 기울일 방침”이라고 말했다.2025-11-04 09:30:20천승현
셀트리온, 미국 바이오기업 신약 2종 도입...계약금 114억[데일리팜=천승현 기자] 셀트리온은 미국 바이오기업 카이진(Kaigene)과 자가면역질환 항체 기반 신약 후보물질 2종에 대한 독점적 라이선스 계약을 체결했다고 4일 밝혔다.전체 계약 규모는 최대 7억4400만달러(약 1조620억원)다. 선급금은 800만달러(114억원), 개발 마일스톤은 최대 1억1100만달러(1584억원)로 책정됐다. 판매 마일스톤은 최대 6억2500만달러(8921억원)다. 상업화 성공시 매출에 따른 로열티는 순매출액의 5%-10%를 별도 지급하는 조건이다.계약에 따라 셀트리온은 카이진의 비임상 단계 파이프라인인 KG006의 중국, 일본을 제외한 독점적인 글로벌 개발 및 판매 권리를 갖는다. KG002의 전 세계 독점적인 글로벌 개발, 생산 및 판매 권리도 확보했다.미국 메릴랜드주에 소재한 카이진은 병인성 자가항체를 분해하는 기술인 PDEGTM(Pathogenic Antibody Degrader) 플랫폼을 활용한 다중 항체 신약 개발에 특화된 바이오기업이다. 자가면역질환 분야의 차세대 치료제 발굴에서 두각을 보이고 있다.셀트리온이 확보한 후보 물질은 태아 Fc 수용체(FcRn, Neonatal Fc Receptor) 기전을 기반으로 하는 자가면역질환치료제다. FcRn은 수용체 단백질로 체내 면역글로불린G(IgG)와 결합해 이들이 세포 내 소기관에서 분해되지 않고 재순환될 수 있도록 해 면역체계를 유지하는 데 도움을 준다. 해당 기전을 활용하면 자가면역질환 등 질병을 유발하는 병인성(pathogenic) 자가항체를 효과적으로 제거할 수 있어, 차세대 치료 전략으로 주목받고 있다.FcRn 억제제는 TNF-α 억제제와 인터루킨(IL) 억제제 이후 차세대 자가면역질환 치료 기전으로 떠오르고 있고, 다양한 적응증으로 확장 가능해 성장성도 높다는 게 회사 측 설명이다.셀트리온은 “이번 신규 파이프라인의 추가로 신약 개발 중심 체제를 한층 강화하게 됐다”라고 평가했다. 올해 초 발표한 항체약물접합체(ADC), 이중항체 등 다수의 파이프라인이 담긴 신약 개발 로드맵에 따라, 항암 신약 CT-P70, CT-P71은 이미 임상 1상에 진입하는 등 신약 개발이 순항 중이다. 여기에 자가면역질환 파이프라인을 추가, 항암 신약에 이어 포트폴리오를 다각화했다.셀트리온 관계자는 “2종의 신규 후보 물질 확보를 통해 셀트리온이 강점을 가지고 있는 자가면역질환 치료제 분야에서도 신약 개발에 돌입했다”라면서 “미충족 의료 수요를 해소하는 동시에 글로벌 의약품 시장 내 경쟁력과 영향력 확대에 최선의 노력을 기울일 방침”이라고 말했다.2025-11-04 09:30:20천승현 -
 아이엠바이오, IPO 시동...'이중항체 신약 기술수출 경험'[데일리팜=차지현 기자] 항체 신약개발 바이오텍 아이엠바이오로직스가 증시 입성을 위한 첫발을 내디뎠다. 코스닥 기술특례 상장을 위한 예비심사 청구서를 제출하면서다. 아이엠바이오로직스는 이달 초 상장전지분투자(프리IPO)를 마무리한 지 2주 만에 예심을 신청하면서 기업공개(IPO) 절차에 속도를 속도를 내는 분위기다.아이엠바이오로직스는 28일 한국거래소에 코스닥시장 상장 예심 청구서를 제출했다. 이 회사는 공모 예정 주식 200만주를 포함해 1479만280주를 상장할 계획이다. 주관사는 한국투자증권과 신한투자증권이다. 앞서 회사는 지난 8월 거래소 지정 전문 평가기관으로부터 각각 A 등급을 획득, 기술특례 상장을 위한 기술성 평가를 통과한 바 있다.아이엠바이오로직스는 2020년 HK이노엔(전 CJ헬스케어) 바이오부문장 출신 하경식 대표가 창업한 항체 기반 신약개발 바이오텍이다. 하 대표는 회사 창업 후 CJ헬스케어의 신산업 전략 수립 과정에서 개발이 중단된 옥스포티리간드(OX40L)와 종양괴사인자 알파(TNFα) 표적 이중항체 기술을 도입해 개발을 지속해왔다.이 회사는 창업 4년 만에 1조원대 기술수출 계약을 체결했다. 자가면역질환 이중항체 신약 후보물질 'IMB-101'(OXTIMA)이 그 주인공이다. 이 물질은 염증 반응을 유발하는 TNF-α와 면역세포 활성 신호인 OX40L을 동시에 억제함으로써 염증성 질환의 근본 원인을 제어하는 기전이다.아이엠바이오로직스는 지난해 6월 IMB-101을 미국 네비게이터 메디신에 1조3000억원 규모로 기술수출했다. 이어 2개월 뒤 IMB-101에 대해 중국 화동제약과 4309억원 규모 계약을 맺으며 연이은 기술수출 성과를 거뒀다.해당 계약은 아이엠바이오로직스가 개발을 주도하고 HK이노엔과 와이바이오로직스가 각각 핵심 기술을 제공한 3자 공동개발 구조로 체결됐다. HK이노엔은 X40L·TNF-α 표적 이중항체의 초기 기술 자산을 제공했고 와이바이오로직스는 항체 최적화와 발현 시스템 등 엔지니어링 기술 역량을 더했다.아이엠바이오로직스는 이 두 기술을 통합해 IMB-101으로 발전시켰고 기술수출 협상 전 과정을 주도한 것으로 알려진다. 이로써 세 회사는 기술수출로 발생하는 선급금(업프론트)와 경상 기술료(마일스톤), 상업화 성공 시 순매출에 따른 로열티 수익을 일정 비율로 배분하게 된다.아이엠바이오로직스 항체 플랫폼 개요 (자료: 아이엠바이오로직스) 아이엠바이오로직스는 이외에도 독자적인 연구개발 성과를 꾸준히 창출 중이다. 회사는 지난 8월 중국 바이오텍 진퀀텀과 다중결합(multivalent) 항체-약물접합체(ADC) 공동개발 계약을 맺었다. 아이엠바이오로직스의 다가결합 항체 백본 플랫폼 '이펜디'(ePENDY)에 진퀀텀의 페이로드와 링커 기술을 결합해 암세포 선택성과 약효를 높인 차세대 ADC를 개발하는 게 골자다.아이엠바이오로직스는 국내외 기관투자자로부터 총 792억원의 누적 투자금을 유치했다. 2021년 시드 투자 40억원과 시리즈A 130억원, 2023년 시리즈B 200억원을 통해 370억 원을 조달했다.특히 시리즈B 라운드에서는 리가켐바이오·알테오젠·펩트론 등 1세대 바이오기업이 출자한 IBK-솔리더스 바이오펀드로부터 투자를 받으면서 세대 간 오픈이노베이션 모델의 성공 사례로 주목받았다. 이어 회사는 이달 초 422억원 규모 프리IPO를 마무리했다. 프리IPO를 완료한 지 불과 2주 만에 코스닥 예심을 청구하며, 빠른 속도로 상장 절차에 돌입한 셈이다.아이엠바이오로직스는 상장을 통해 확보한 자금을 핵심 파이프라인의 임상 개발, ADC 연구 확장, 글로벌 기술이전 가속화, 해외 파트너십 확대에 투입할 예정이다. 이 회사는 지난해 매출 276억원, 영업이익 140억원을 기록했다. 같은 기간 순손실은 119억원으로 집계됐다.2025-10-29 12:00:39차지현
아이엠바이오, IPO 시동...'이중항체 신약 기술수출 경험'[데일리팜=차지현 기자] 항체 신약개발 바이오텍 아이엠바이오로직스가 증시 입성을 위한 첫발을 내디뎠다. 코스닥 기술특례 상장을 위한 예비심사 청구서를 제출하면서다. 아이엠바이오로직스는 이달 초 상장전지분투자(프리IPO)를 마무리한 지 2주 만에 예심을 신청하면서 기업공개(IPO) 절차에 속도를 속도를 내는 분위기다.아이엠바이오로직스는 28일 한국거래소에 코스닥시장 상장 예심 청구서를 제출했다. 이 회사는 공모 예정 주식 200만주를 포함해 1479만280주를 상장할 계획이다. 주관사는 한국투자증권과 신한투자증권이다. 앞서 회사는 지난 8월 거래소 지정 전문 평가기관으로부터 각각 A 등급을 획득, 기술특례 상장을 위한 기술성 평가를 통과한 바 있다.아이엠바이오로직스는 2020년 HK이노엔(전 CJ헬스케어) 바이오부문장 출신 하경식 대표가 창업한 항체 기반 신약개발 바이오텍이다. 하 대표는 회사 창업 후 CJ헬스케어의 신산업 전략 수립 과정에서 개발이 중단된 옥스포티리간드(OX40L)와 종양괴사인자 알파(TNFα) 표적 이중항체 기술을 도입해 개발을 지속해왔다.이 회사는 창업 4년 만에 1조원대 기술수출 계약을 체결했다. 자가면역질환 이중항체 신약 후보물질 'IMB-101'(OXTIMA)이 그 주인공이다. 이 물질은 염증 반응을 유발하는 TNF-α와 면역세포 활성 신호인 OX40L을 동시에 억제함으로써 염증성 질환의 근본 원인을 제어하는 기전이다.아이엠바이오로직스는 지난해 6월 IMB-101을 미국 네비게이터 메디신에 1조3000억원 규모로 기술수출했다. 이어 2개월 뒤 IMB-101에 대해 중국 화동제약과 4309억원 규모 계약을 맺으며 연이은 기술수출 성과를 거뒀다.해당 계약은 아이엠바이오로직스가 개발을 주도하고 HK이노엔과 와이바이오로직스가 각각 핵심 기술을 제공한 3자 공동개발 구조로 체결됐다. HK이노엔은 X40L·TNF-α 표적 이중항체의 초기 기술 자산을 제공했고 와이바이오로직스는 항체 최적화와 발현 시스템 등 엔지니어링 기술 역량을 더했다.아이엠바이오로직스는 이 두 기술을 통합해 IMB-101으로 발전시켰고 기술수출 협상 전 과정을 주도한 것으로 알려진다. 이로써 세 회사는 기술수출로 발생하는 선급금(업프론트)와 경상 기술료(마일스톤), 상업화 성공 시 순매출에 따른 로열티 수익을 일정 비율로 배분하게 된다.아이엠바이오로직스 항체 플랫폼 개요 (자료: 아이엠바이오로직스) 아이엠바이오로직스는 이외에도 독자적인 연구개발 성과를 꾸준히 창출 중이다. 회사는 지난 8월 중국 바이오텍 진퀀텀과 다중결합(multivalent) 항체-약물접합체(ADC) 공동개발 계약을 맺었다. 아이엠바이오로직스의 다가결합 항체 백본 플랫폼 '이펜디'(ePENDY)에 진퀀텀의 페이로드와 링커 기술을 결합해 암세포 선택성과 약효를 높인 차세대 ADC를 개발하는 게 골자다.아이엠바이오로직스는 국내외 기관투자자로부터 총 792억원의 누적 투자금을 유치했다. 2021년 시드 투자 40억원과 시리즈A 130억원, 2023년 시리즈B 200억원을 통해 370억 원을 조달했다.특히 시리즈B 라운드에서는 리가켐바이오·알테오젠·펩트론 등 1세대 바이오기업이 출자한 IBK-솔리더스 바이오펀드로부터 투자를 받으면서 세대 간 오픈이노베이션 모델의 성공 사례로 주목받았다. 이어 회사는 이달 초 422억원 규모 프리IPO를 마무리했다. 프리IPO를 완료한 지 불과 2주 만에 코스닥 예심을 청구하며, 빠른 속도로 상장 절차에 돌입한 셈이다.아이엠바이오로직스는 상장을 통해 확보한 자금을 핵심 파이프라인의 임상 개발, ADC 연구 확장, 글로벌 기술이전 가속화, 해외 파트너십 확대에 투입할 예정이다. 이 회사는 지난해 매출 276억원, 영업이익 140억원을 기록했다. 같은 기간 순손실은 119억원으로 집계됐다.2025-10-29 12:00:39차지현 -
보로노이, 미 기업에 자산 양도...2년 매출 공백 돌파구[데일리팜=차지현 기자] 보로노이가 자가면역질환 경구치료제 후보물질을 미국 파트너사에 양도했다. 지난해 체결한 옵션 계약의 후 계약 격으로, 이번 계약으로 회사가 기술력을 입증한 동시에 2년 반 동안 이어진 매출 공백을 끊을 발판을 마련했다는 점에서 의미가 있다는 평가다.작년 옵션 계약 후속 격, 디어필드 설립 안비아가 VRN04 개발 주도20일 금융감독원에 따르면 보로노이는 18일 미국 안비아 테라퓨틱스(Anvia Therapeutics)와 자가면역질환 경구치료제 후보물질 'VRN04' 프로그램 연구에 대한 자산 양도 계약을 체결했다.총 계약 규모는 최대 1450만달러(약 200억원)다. 보로노이는 반환 의무가 없는 선급금(업프론트)으로 안비아 보통주 200만주(41억원 상당)를 받는다.개발 단계에 따른 경상 기술료(마일스톤)는 최대 1150만달러(159억원) 수준이다. 보로노이는 첫 번째 마일스톤 달성 시 현금 350만달러(48억원)와 안비아 보통주 350만달러(약 48억원)를 지급받는다. 두 번째 마일스톤을 달성하면 안비아 보통주 450만달러(63억원)를 수령한다.상업화 이후 판매에 따른 로열티는 별도다. VRN04 프로그램이 성공적으로 상용화될 경우 보로노이는 순매출(Net Sales)의 3%를 일정 기간 동안 로열티로 받게 된다.이번 계약은 양사가 작년 체결한 옵션 계약의 후속 절차다. 앞서 보로노이는 지난해 8월 안비아와 VRN04 프로그램 연구에 대한 옵션 계약을 맺었다. 안비아가 보로노이에 추가 연구 자금을 지원하고 VRN04 프로그램에 대한 우선 협상·인수 옵션을 확보한다는 게 해당 계약의 골자다. 당시 보로노이는 옵션 계약 대가로 안비아 보통주 약 250만주(34억원 상당)를 확보한 바 있다.안비아는 보로노이의 추가 연구 성과와 데이터 패키지를 검토한 끝에 지난 4월 옵션 행사 의사를 공식적으로 통보했다. 이후 양측은 자산 양도 조건을 두고 협상에 나섰고 이번 계약을 본계약으로 전환하는 데 최종 합의한 것이다. 안비아는 보로노이로부터 VRN04을 양도받아 글로벌 임상 개발을 직접 추진할 예정이다.VRN04는 RIPK1 억제 기전 만성 염증성 질환 치료제 후보물질이다. 염증 유발 물질인 TNF-α 수용체의 염증 신호 전달을 세포 내부에서 억제하는 방식으로 항염 효과를 나타낸다. 기존의 TNF-α 항체 치료제와 달리 경구 복용이 가능하고 허혈성 뇌졸중 위험이 낮은 장점이 있다는 게 보로노이 측 설명이다.이번에 VRN04 프로그램을 인수한 안비아는 작년 5월 설립한 미국 뉴욕 소재 신생 법인이다. 미국 최대 헬스케어 전문 벤처캐피탈(VC) 디어필드(Deerfield)가 초기 설립을 주도한 기획형 바이오로 알려져 있다.기획바이오는 경험 많은 인력과 풍부한 자본을 바탕으로 회사를 설립한 뒤 지속해서 밸류업을 시켜나가는 모델이다. 디어필드는 총 관리 자산(AUM)이 146억달러에 달하는 VC로 200개 이상 비상장과 상장 헬스케어 기업에 투자 중이다. 뉴발렌트, 오스카 헬스, 바이아트리스 등이 디어필드 대표 포트폴리오다."글로벌 제약사 출신 경영진 기술력 인정"…주력 파이프라인 개발 박차이번 계약으로 보로노이는 보유 파이프라인 상업적 가치를 입증했다는 평가다. 안비아가 옵션을 행사하고 본 계약을 체결했다는 건 보로노이가 제공한 후보물질이 파트너사의 기준을 충족했고 보로노이의 신약발굴과 개발 역량이 성공적으로 검증받았다는 신호라는 해석이다.보로노이는 2년 반 동안 이어진 매출 공백을 끊고 새 수익 창출의 발판도 마련했다. 보로노이는 지난 2023년부터 올 1분기까지 매출 0원 상태를 지속했다. 보로노이는 신약개발 특성상 기술이전 기술료 외 안정적 수익원이 없는데 기존 기술이전을 체결한 유방암 치료제 후보물질 'VRN08'과 자가면역질환 치료제 후보물질 'VRN02' 등에 대한 권리가 반환되며 매출 공백이 생겼다.보로노이의 연매출 30억원 미만 기업에 대한 관리종목 지정 유예 종료 시점은 내년이었다. 이번 계약에 따라 회사는 마일스톤 달성 시 안비아 보통주 외에도 50억원 규모 현금을 확보하는 동시에 관리종목 리스크를 완화할 수도 있게 됐다.보통주를 기술이전 계약 대가로 수령함으로써 파트너사 가치 상승에 따른 평가 차익 가능성까지 남겼다는 점도 주목할 만하다. 기술이전 계약은 선급금과 마일스톤을 현금으로 지급하고 이후 제품 매출이 발생하면 일정 비율의 로열티를 더하는 구조가 일반적이다.반면 보로노이는 계약 대가의 상당 부분을 상대방 회사 보통주로 수령하는 방식을 꾸준히 활용해왔다. 보로노이는 과거 2020년 오릭 파마슈티컬즈과 비소세포폐암 치료제 후보물질 'VRN07'에 대한 기술이전 계약을 체결할 때 기술이전 대가 일부를 오릭 주식으로 수령했다. 또 2021년 프레시 트랙스 테라퓨틱스와 기술이전 계약에서도 업프론트 일부를 프레시 주식으로 받았다.이 같은 구조는 단기 현금 유입은 적지만 파트너사 성장에 따른 지분가치 상승 효과를 노릴 수 있다는 장점을 지닌다. 파트너사 주가가 향후 상승하거나 파트너사가 상장 또는 높은 가치로 매각될 경우 보로노이가 보유한 주식 가치도 함께 상승, 자산 재평가 이익을 얻을 수 있다는 얘기다. 6월 말 기준 보로노이는 오릭 39억원, 프레시 6300만원, 안비아 34억원 등 총 73억원을 장부가로 계상하고 있다.보로노이는 이번 성과를 기반으로 폐암 치료제 등 주력 파이프라인 개발에 더욱 속도를 낼 전망이다. 현재 보로노이에 주어진 과장 큰 과제는 EGFR C797S 돌연변이 표적 비소세포폐암 치료제 후보물질 'VRN11'의 임상 2상 진입이다.이는 지난 7월 보로노이가 500억원 규모로 발행한 전환사채(CB)에 달린 스텝업 조항 때문이다. 스텝업은 일정 기간 내 특정 조건을 달성하지 못할 경우 채권 이자율이 자동으로 올라가는 투자자 보호 장치다. 보로노이의 경우 발행일로부터 12개월 내 미국 식품의약국(FDA)과 유럽 의약품청(EMA)으로부터 VRN11 임상 2상 임상시험계획(IND) 승인을 받지 못하면 이자율이 연 2%에서 5%로 올라가는 조건이 포함됐다.보로노이 측은 "2024년 8월 인비아와 옵션 계약 체결 이후 파트너사가 필요로 하는 모든 기술적 요구사항을 만족하는 물질을 도출할 수 있어 기쁘다"고 했다. 이어 회사는 "금번에 계약을 체결한 안비아의 경영진은 제넨텍, 글락소스미스클라인(GSK) 등 글로벌 제약사 출신이 다수 포진한 곳"이라며 "이들의 높은 요구 조건을 만족시킬 수 있었다는 건 보로노이의 약물 설계 기술이 글로벌 경쟁력을 확보했다는 방증"이라고 했다.2025-09-20 06:16:34차지현
-
 한올, 기술수출 신약 임상 잰걸음...자가면역질환 경쟁력↑[데일리팜=손형민 기자] 한올바이오파마가 자가면역질환 신약 임상에 속도를 내고 있다. 이미 아르젠엑스, 존슨앤드존슨 등이 새로운 기전의 신약을 상용화에 성공한 상황에서 후발주자인 한올은 계열 내 최고 신약을 목표로 임상을 확대 중이다. 기존 신약의 단점을 보완해 일부 적응증에서는 계열 내 최초 신약 등극을 노린다.5일 관련 업계에 따르면 한올바이오파마 미국 파트너사 이뮤노반트는 최근 FcRn 억제제 바토클리맙(HL-161)의 그레이브스병 대상 임상 2상에서 치료 종료 후 6개월간 유지 효과에 대한 데이터를 발표했다.그레이브스병은 자가면역 질환의 일종으로, 자가면역 항체가 갑상선을 지속적으로 자극하여 갑상선호르몬을 과도하게 생성하게 하는 질병이다. 이로 인해 신진대사가 빨라지는 갑상선 기능 항진증이 발생하며, 눈 뒤 조직에 영향을 미쳐 안구 돌출 등의 증상이 나타기도 한다.임상 결과, 바토클리맙 치료 종료 후 환자의 약 80%에서 갑상선 호르몬 수치가 6개월간 정상 수준을 유지했다. 환자 중 절반은 약물 없이 안정적으로 유지됐으며, 나머지 환자도 저용량 항갑상선제만으로 조절 가능했다. 안전성과 내약성은 기존 연구 결과와 일관됐다.한올은 바토클리맙 외에도 차세대 FcRn 억제제 후보물질 아이메로프루바트로 그레이브스병 임상 2건을 진행 중이다. 2027년 탑라인 공개가 예정돼 있다.후발주자 한올, 계열 내 최고, 계열 내 최초 동시 목표아르젠엑스 '비브가트'현재 한올바이오파마가 개발 중인 FcRn 억제제 시장은 이미 아르젠엑스의 ‘비브가트’가 블록버스터 약물로 자리 잡으며 빠르게 확대 중이다. 비브가트는 2022년 미국 출시 이후 첫해 4억200만 달러, 2023년 12억 달러, 2024년 22억 달러 매출을 기록하며 시장에 안착했다. 또 존슨앤드존슨의 니포칼리맙도 최근 미국에서 승인을 받으며 경쟁이 본격화됐다.기존 자가면역질환 치료제는 휴미라, 레미케이드로 대표되는 종양괴사인자알파(TNF-α) 억제제가 시장을 장악하고 있지만, FcRn 억제제의 등장으로 경쟁 구도로 흘러가고 있다.FcRn 억제제는 면역글로불린G(IgG)의 방어수용체인 Fc 수용체(FcRn)를 차단하는 새로운 기전이다. 해당 기전은 질병을 유발하는 면역글로불린G 항체를 감소시키고 이를 재순환하는 과정을 차단한다. IgG 항체의 재활용을 차단해 자가면역 반응의 근본 원인을 제어하는 방식으로, 기존 약물 대비 정밀성과 확장성이 높다는 평가를 받고 있다.한올바이오파마는 2017년부터 해외 파트너십을 통해 글로벌 전략을 강화해왔다. 중국 하버바이오메드에는 바토클리맙 권리를, 미국 이뮤노반트에는 바토클리맙·아이메로프루바트 권리를 각각 이전했다. 하버바이오메드는 중화권, 이뮤노반트는 미국·유럽·중남미 등에서 개발을 이어간다.바토클리맙을 포함한 기존 FcRn 억제제들은 LDL-콜레스테롤과 알부민 수치 증가가 발생해 만성질환 환자들에게는 사용이 제한적라는 지적이다.이에 한올바이오파마는 차세대 FcRn 억제제인 아이메로프루바트에 기대를 걸고 있다. 아이메로프루바트는 기존 FcRn 항체 치료제와 달리 알부민, LDL-콜레스테롤 수치에 영향을 미치지 않는 것으로 나타났다.한올바이오파마 자가면역질환 신약 임상 현황(자료=한올바이오파마). 한올바이오파마는 바토클리맙을 통해 계열 내 최고 신약을, 아이메로프루바트로 계열 내 최초 신약 등극을 노리고 있다.현재 허가된 FcRn 억제제들은 모두 중증근무력증 치료로 허가된 바 있다. 바토클리맙은 중증근무력증 이외에도 그레이브스병, 갑상선안병증, 만성염증성다발성신경병증 등 4개 질환에서 임상이 진행되고 있다. 아이메로프루바트의 경우 위에 4가지 적응증에 류마티스관절염, 쇼그렌증후군에 대한 연구도 계속되고 있다.중국서 중증근무력증 임상 마치고 허가 신청…새로운 파트너와 협력 가능성도한올바이오파마가 자가면역질환 신약의 상업화를 가장 먼저 기대하고 있는 지역은 중국이다. 하버바이오메드는 지난 2023년 12월 임상3상을 마치고 허가 신청을 완료한 상황이다.임상 결과, 투약 12주차에 바토클리맙 340mg과 680mg 투여군 모두에서 위약군 대비 통계적으로 유의한 중증근무력증 일상생활 수행 능력 평가 척도인 ‘MG-ADL(Myasthenia Gravis-Activities of Daily Living)’점수 개선이 확인됐다.특히 고용량 투여군은 평균 -5.6점의 MG-ADL 개선을 보여, 위약군 -3.6점, 경쟁사 약물 대비 우월한 개선 폭을 입증했다. 중간 용량인 340mg 투여군도 -4.7점 개선을 기록했다.자료=한올바이오파마 IgG 감소율 역시 용량 의존적으로 뚜렷했다. 340mg 투여군은 평균 64% 감소, 680mg 투여군은 74% 감소를 보여, 아르젠엑스의 비브가트(61%), J&J의 니포칼리맙(69%) 대비 높은 억제 효과를 입증했다.환자 반응률(Response rate)에서도 경쟁 우위를 보였다. 12주차에 MG-ADL 반응률은 바토클리맙 680mg 투여군이 93%, 340mg 투여군이 81%로 나타났다. 비브가트는 78%, 니포칼리맙은 69%였다.이번 결과는 FcRn 억제제 계열 약물 가운데 MG-ADL 평균 5점 이상 개선을 달성한 최초 사례라는 점에서 의미가 있다. 바토클리맙은 IgG 감소율과 임상학적 효능 간의 일관된 상관관계를 다양한 적응증에서 보여주고 있어, 향후 자가면역질환 치료 전반으로 확장 가능성이 크다는 평가다.다만 상용화 이후에 대한 판권 관련 협의는 난항을 겪을 전망이다. 지난 1월 한올바이오파마는 하버바이오메드에 계약 해지를 통보했으며, 계약서의 해지 절차에 따라 뉴욕 국제상업회의소(ICC)에서의 중재가 개시됐다.한올바이오파마 관계자는 “중재과정에서 합의를 모색하고자 하지만 합의가 이뤄지지 않을 경우 중재 판정을 통해 바토클리맙의 사업권을 회수하고, 새로운 파트너와 함께 중화권 개발과 상업화를 가속할 것”이라고 전했다.2025-09-05 12:00:27손형민
한올, 기술수출 신약 임상 잰걸음...자가면역질환 경쟁력↑[데일리팜=손형민 기자] 한올바이오파마가 자가면역질환 신약 임상에 속도를 내고 있다. 이미 아르젠엑스, 존슨앤드존슨 등이 새로운 기전의 신약을 상용화에 성공한 상황에서 후발주자인 한올은 계열 내 최고 신약을 목표로 임상을 확대 중이다. 기존 신약의 단점을 보완해 일부 적응증에서는 계열 내 최초 신약 등극을 노린다.5일 관련 업계에 따르면 한올바이오파마 미국 파트너사 이뮤노반트는 최근 FcRn 억제제 바토클리맙(HL-161)의 그레이브스병 대상 임상 2상에서 치료 종료 후 6개월간 유지 효과에 대한 데이터를 발표했다.그레이브스병은 자가면역 질환의 일종으로, 자가면역 항체가 갑상선을 지속적으로 자극하여 갑상선호르몬을 과도하게 생성하게 하는 질병이다. 이로 인해 신진대사가 빨라지는 갑상선 기능 항진증이 발생하며, 눈 뒤 조직에 영향을 미쳐 안구 돌출 등의 증상이 나타기도 한다.임상 결과, 바토클리맙 치료 종료 후 환자의 약 80%에서 갑상선 호르몬 수치가 6개월간 정상 수준을 유지했다. 환자 중 절반은 약물 없이 안정적으로 유지됐으며, 나머지 환자도 저용량 항갑상선제만으로 조절 가능했다. 안전성과 내약성은 기존 연구 결과와 일관됐다.한올은 바토클리맙 외에도 차세대 FcRn 억제제 후보물질 아이메로프루바트로 그레이브스병 임상 2건을 진행 중이다. 2027년 탑라인 공개가 예정돼 있다.후발주자 한올, 계열 내 최고, 계열 내 최초 동시 목표아르젠엑스 '비브가트'현재 한올바이오파마가 개발 중인 FcRn 억제제 시장은 이미 아르젠엑스의 ‘비브가트’가 블록버스터 약물로 자리 잡으며 빠르게 확대 중이다. 비브가트는 2022년 미국 출시 이후 첫해 4억200만 달러, 2023년 12억 달러, 2024년 22억 달러 매출을 기록하며 시장에 안착했다. 또 존슨앤드존슨의 니포칼리맙도 최근 미국에서 승인을 받으며 경쟁이 본격화됐다.기존 자가면역질환 치료제는 휴미라, 레미케이드로 대표되는 종양괴사인자알파(TNF-α) 억제제가 시장을 장악하고 있지만, FcRn 억제제의 등장으로 경쟁 구도로 흘러가고 있다.FcRn 억제제는 면역글로불린G(IgG)의 방어수용체인 Fc 수용체(FcRn)를 차단하는 새로운 기전이다. 해당 기전은 질병을 유발하는 면역글로불린G 항체를 감소시키고 이를 재순환하는 과정을 차단한다. IgG 항체의 재활용을 차단해 자가면역 반응의 근본 원인을 제어하는 방식으로, 기존 약물 대비 정밀성과 확장성이 높다는 평가를 받고 있다.한올바이오파마는 2017년부터 해외 파트너십을 통해 글로벌 전략을 강화해왔다. 중국 하버바이오메드에는 바토클리맙 권리를, 미국 이뮤노반트에는 바토클리맙·아이메로프루바트 권리를 각각 이전했다. 하버바이오메드는 중화권, 이뮤노반트는 미국·유럽·중남미 등에서 개발을 이어간다.바토클리맙을 포함한 기존 FcRn 억제제들은 LDL-콜레스테롤과 알부민 수치 증가가 발생해 만성질환 환자들에게는 사용이 제한적라는 지적이다.이에 한올바이오파마는 차세대 FcRn 억제제인 아이메로프루바트에 기대를 걸고 있다. 아이메로프루바트는 기존 FcRn 항체 치료제와 달리 알부민, LDL-콜레스테롤 수치에 영향을 미치지 않는 것으로 나타났다.한올바이오파마 자가면역질환 신약 임상 현황(자료=한올바이오파마). 한올바이오파마는 바토클리맙을 통해 계열 내 최고 신약을, 아이메로프루바트로 계열 내 최초 신약 등극을 노리고 있다.현재 허가된 FcRn 억제제들은 모두 중증근무력증 치료로 허가된 바 있다. 바토클리맙은 중증근무력증 이외에도 그레이브스병, 갑상선안병증, 만성염증성다발성신경병증 등 4개 질환에서 임상이 진행되고 있다. 아이메로프루바트의 경우 위에 4가지 적응증에 류마티스관절염, 쇼그렌증후군에 대한 연구도 계속되고 있다.중국서 중증근무력증 임상 마치고 허가 신청…새로운 파트너와 협력 가능성도한올바이오파마가 자가면역질환 신약의 상업화를 가장 먼저 기대하고 있는 지역은 중국이다. 하버바이오메드는 지난 2023년 12월 임상3상을 마치고 허가 신청을 완료한 상황이다.임상 결과, 투약 12주차에 바토클리맙 340mg과 680mg 투여군 모두에서 위약군 대비 통계적으로 유의한 중증근무력증 일상생활 수행 능력 평가 척도인 ‘MG-ADL(Myasthenia Gravis-Activities of Daily Living)’점수 개선이 확인됐다.특히 고용량 투여군은 평균 -5.6점의 MG-ADL 개선을 보여, 위약군 -3.6점, 경쟁사 약물 대비 우월한 개선 폭을 입증했다. 중간 용량인 340mg 투여군도 -4.7점 개선을 기록했다.자료=한올바이오파마 IgG 감소율 역시 용량 의존적으로 뚜렷했다. 340mg 투여군은 평균 64% 감소, 680mg 투여군은 74% 감소를 보여, 아르젠엑스의 비브가트(61%), J&J의 니포칼리맙(69%) 대비 높은 억제 효과를 입증했다.환자 반응률(Response rate)에서도 경쟁 우위를 보였다. 12주차에 MG-ADL 반응률은 바토클리맙 680mg 투여군이 93%, 340mg 투여군이 81%로 나타났다. 비브가트는 78%, 니포칼리맙은 69%였다.이번 결과는 FcRn 억제제 계열 약물 가운데 MG-ADL 평균 5점 이상 개선을 달성한 최초 사례라는 점에서 의미가 있다. 바토클리맙은 IgG 감소율과 임상학적 효능 간의 일관된 상관관계를 다양한 적응증에서 보여주고 있어, 향후 자가면역질환 치료 전반으로 확장 가능성이 크다는 평가다.다만 상용화 이후에 대한 판권 관련 협의는 난항을 겪을 전망이다. 지난 1월 한올바이오파마는 하버바이오메드에 계약 해지를 통보했으며, 계약서의 해지 절차에 따라 뉴욕 국제상업회의소(ICC)에서의 중재가 개시됐다.한올바이오파마 관계자는 “중재과정에서 합의를 모색하고자 하지만 합의가 이뤄지지 않을 경우 중재 판정을 통해 바토클리맙의 사업권을 회수하고, 새로운 파트너와 함께 중화권 개발과 상업화를 가속할 것”이라고 전했다.2025-09-05 12:00:27손형민 -
 크론병 이어 궤양성 대장염까지...'툴리소키바트' 국내 3상[데일리팜=이혜경 기자] 크론병 등 염증성장질환(IBD) 치료제로 개발 중인 '툴리소키바트'가 국내에서 궤양성 대장염 환자를 대상으로 3상 임상에 들어간다.식품의약품안전처는 18일 한국엠에스디가 신청한 '크론병이나 궤양성 대장염을 앓고 있는 참가자를 대상으로 툴리소키바트(Tulisokibart)의 장기 안전성 및 유효성을 평가하기 위한 제3상 연장 임상시험'을 승인했다.툴리소키바트는 이미 국내에서 2건의 임상이 승인된 상태다. 지난 5월 '중등증 내지 중증의 활성 크론병을 앓고 있는 참가자'를 대상으로 3상 임상시험이 승인돼 환자 모집 중에 있고, 8월 4일에는 '방사선학적 축성 척추관절염(강직척추염) 참가자'를 대상으로 2b상의 승인이 완료됐다.이번 3상은 기존 중등증 크론병 환자 뿐 아니라 크론병이나 궤양성 대장염 환자까지 확대해 진행된다는데 의미가 있다.툴리소키바트는 장 염증, 섬유증과 관련된 새로운 표적인 TNF 유사 사이토카인1A(TL1A)를 타깃하는 단일클론항체로 염증성장질환(IBD)과 관련된 염증 경로를 억제하고 장 섬유증을 줄이는 데 도움을 줄 수 있는 것으로 알려진다.지난 5월 '소화기질환주간 연례학술대회(DDW 2025)'에서 공개된 중등도 및 중증 활동성 크론병 환자에서 정맥 투여하는 툴리소키바트 2상 임상 결과 12주간 유효성과 안전성을 입증했다. & 160;12주차에 반응한 환자를 대상으로 연장 연구를 진행한 결과에서는 50주차까지 지속적인 효과를 유지한 것으로 나타났다.MSD는 툴리소키바트가 궤양성대장염, 크론병, 전신성 경화증 관련 간질성 폐질환(SSc-ILD)을 포함한 면역 매개 염증성 질환 치료제가 될 것으로 기대하고 있다.2025-08-18 17:52:15이혜경
크론병 이어 궤양성 대장염까지...'툴리소키바트' 국내 3상[데일리팜=이혜경 기자] 크론병 등 염증성장질환(IBD) 치료제로 개발 중인 '툴리소키바트'가 국내에서 궤양성 대장염 환자를 대상으로 3상 임상에 들어간다.식품의약품안전처는 18일 한국엠에스디가 신청한 '크론병이나 궤양성 대장염을 앓고 있는 참가자를 대상으로 툴리소키바트(Tulisokibart)의 장기 안전성 및 유효성을 평가하기 위한 제3상 연장 임상시험'을 승인했다.툴리소키바트는 이미 국내에서 2건의 임상이 승인된 상태다. 지난 5월 '중등증 내지 중증의 활성 크론병을 앓고 있는 참가자'를 대상으로 3상 임상시험이 승인돼 환자 모집 중에 있고, 8월 4일에는 '방사선학적 축성 척추관절염(강직척추염) 참가자'를 대상으로 2b상의 승인이 완료됐다.이번 3상은 기존 중등증 크론병 환자 뿐 아니라 크론병이나 궤양성 대장염 환자까지 확대해 진행된다는데 의미가 있다.툴리소키바트는 장 염증, 섬유증과 관련된 새로운 표적인 TNF 유사 사이토카인1A(TL1A)를 타깃하는 단일클론항체로 염증성장질환(IBD)과 관련된 염증 경로를 억제하고 장 섬유증을 줄이는 데 도움을 줄 수 있는 것으로 알려진다.지난 5월 '소화기질환주간 연례학술대회(DDW 2025)'에서 공개된 중등도 및 중증 활동성 크론병 환자에서 정맥 투여하는 툴리소키바트 2상 임상 결과 12주간 유효성과 안전성을 입증했다. & 160;12주차에 반응한 환자를 대상으로 연장 연구를 진행한 결과에서는 50주차까지 지속적인 효과를 유지한 것으로 나타났다.MSD는 툴리소키바트가 궤양성대장염, 크론병, 전신성 경화증 관련 간질성 폐질환(SSc-ILD)을 포함한 면역 매개 염증성 질환 치료제가 될 것으로 기대하고 있다.2025-08-18 17:52:15이혜경 -
 TYK2억제제 개발 경쟁 가열…건선 치료 패러다임 바꿀까[데일리팜=손형민 기자] 최근 건선 치료제 시장에서 주사제를 중심으로 한 생물학적제제 개발이 주춤한 가운데, 경구용 신규 기전 치료옵션 개발이 활발해지고 있다. 기존 생물학적제제들이 이미 시장에 나온 약제들과 효과가 유사한 수준에 머무르면서 차별화된 데이터 확보에 어려움을 겪고 있기 때문이다. 반면 BMS의 소틱투 등장 이후 TYK2(Tyrosine Kinase 2) 억제제에 대한 제약업계의 관심이 집중되며 연구개발(R&D)이 가속화되고 있다.다케다 3상 긍정적…일본 가켄제약도 TYK2 억제제 확보12일 관련 업계에 따르면 다케다는 최근 신약후보물질 ‘자소시티닙’의 건선성 관절염 임상3상을 승인받고 연구를 진행 중이다.자소시티닙은 경구용 TYK2 억제제로 개발 중인 신약후보물질로, 다케다는 지난 2022년 미국 님버스 테라퓨틱스로부터 자소시티닙을 확보해 임상을 진행 중이다.TYK2는 인터루킨(IL)-23과 같은 여러 사이토카인 경로를 매개하며, IL-23은 IL-17을 포함한 전염증성 사이토카인의 생성을 유발해 각질형성세포의 증식과 표피 과증식을 촉진하게 되고 그 결과 건선을 일으키게 된다.BMS '소틱투'건선에는 종양괴사인자알파(TNF-α) 억제제, IL-억제제 등 다양한 치료옵션이 등장한 상황이다. 또 TYK2 억제제인 BMS의 소틱투 등 경구제가 등장하면서 환자 투여 편의성과 함께 치료 효과를 동시에 타깃할 수 있는 신약도 출시됐다. 소틱투는 성인 중등증-중증 판상 건선에서 최초로 승인된 TYK2 억제제다.기존 생물학적제제 중 IL-17 억제제의 경우 궤양성대장염이나 크론병과 같은 염증성장질환 악화와 경구 칸디다증에 대한 우려가 제기되기도 했다. IL-23 억제제는 두드러지는 이상반응은 없었지만 주사 부위에 통증이나 불편감과 상기도 감염에 대한 우려가 있다. 새로운 치료 옵션이 부각되는 이유 중 하나다.TYK2 억제제는 JAK 억제제와 달리 TYK2 단백질을 선택적으로 억제해 IL-12, IL-23, Type I 인터페론 경로의 신호전달만 차단하고, 면역 반응 조절과 함께 보다 안전한 치료가 가능하다는 점에서 주목받고 있다.그중 자소시티닙은 소틱투에 이어 가장 상용화에 가깝다고 평가받는다. 지난해 의학전문지 ‘JAMA’에 게재된 임상2b상에서 자소시티닙의 상용화 가능성이 확인됐다.이 연구는 259명의 참가자를 무작위로 배정하여 12주 동안 자소시티닙의 네 가지 일일 경구 용량(2mg, 5mg, 15mg 또는 30mg) 중 하나 또는 위약을 투여했다.임상 결과 자소시티닙은 용량 의존적 반응을 보였으며, 각 용량군에서 건선 중증도 지수(PASI) 75(피부 개선율 75% 이상)에 도달한 환자의 비율은 18%, 44%, 68%, 67%로 위약군 6%에 비해 높았다. 또 이 연구에서는 중대한 안전성 문제는 보고되지 않아 자소시티닙은 양호한 안전성 프로파일을 보였다.다케다는 건선 외 다른 적응증으로도 자소시티닙을 적극적으로 개발하고 있으며, 건선성 관절염 적응증 확보도 모색하고 있다. 또 다케다는 중등증에서 중증의 활성 크론병 및 궤양성 대장염에 대한 2상 연구를 진행 중이며, 전신성 홍반 루푸스에 대한 연구도 계획하고 있어 다른 면역 매개 질환에서도 자소시티닙의 잠재력을 모색하고 있다.HK이노엔, 가켄제약 등 아시아에서도 개발 이어나가국내를 비롯해 일본에서도 TYK2 억제제 신약에 대한 관심은 높다.일본 가켄제약은 최근 미국 생명공학회사 알루미스(Alumis)가 개발 중인 경구용 TYK2 억제제 ‘ESK-001’에 대해 일본 내 개발·제조 및 판권 라이선스 계약을 체결했다. 가켄제약은 일본에서 승인 신청 및 제품화, 필요 시 현지 임상과 개발을 담당할 예정이며, 알루미스는 일본을 포함한 다국가 공동 임상을 진행한다.올해 초 진행된 미국피부과학회 연례학술대회에서 공개된 내용에 따르면 중등증에서 중증의 판상 건선에 대해 ESK-001로 치료받은 환자들은 1년 동안 긍정적인 임상 반응을 경험했다.이 연구에서 80명의 환자가 52주차까지 1일 2회 ESK-001 40mg으로 치료를 받았다. 연구 결과를 자세히 살펴보면 PASI 90은 52주차 61.3%, 12주차 52.4%, PASI 100은 52주차 38.8%, 12주차 26.8%, 정적 PGA 0은 52주차 38.8%, 12주차 32.9%로 PASI 달성 비율이 52주차에 더 높게 나타났다.52주차까지 환자의 81.3%가 4 미만의 PASI를 경험했으며 61.3%는 0 또는 1의 DLQI(피부과 삶의 질 지수)를 보고했다.ESK-001 치료는 내약성도 양호했으며 16주 및 28주에 보고된 것과 비교해 새로운 안전성 신호를 나타내지 않았다.국내에서는 HK이노엔 임상 진입을 준비 중이다. HK이노엔은 지난해 5월 열린 미국피부과연구학회에서 알로스테릭 TYK2 저해제 'IN-121803'의 연구결과를 공개했다.'IN-121803'은 아데노신3인산(ATP) 결합부위를 공략하는 것이 아니라 TYK2 효소의 알로스테릭 결합부위를 공략해 면역, 염증 조절 단백질인 JAK 선택성을 극대화했다.HK이노엔에 따르면 현재 후보물질을 도출한 단계다. IN-121803은 FDA 승인 약물인 BMS의 듀크라바시티닙보다 JAK 선택성을 개선했고 다케다의 자소시티닙보다 더 높은 혈중 노출도와 효능을 보였다.HK이노엔은 비임상 연구를 마치는 대로 IN-121803의 임상1상시험계획(IND) 제출을 목표하고 있다.2025-08-12 12:00:45손형민
TYK2억제제 개발 경쟁 가열…건선 치료 패러다임 바꿀까[데일리팜=손형민 기자] 최근 건선 치료제 시장에서 주사제를 중심으로 한 생물학적제제 개발이 주춤한 가운데, 경구용 신규 기전 치료옵션 개발이 활발해지고 있다. 기존 생물학적제제들이 이미 시장에 나온 약제들과 효과가 유사한 수준에 머무르면서 차별화된 데이터 확보에 어려움을 겪고 있기 때문이다. 반면 BMS의 소틱투 등장 이후 TYK2(Tyrosine Kinase 2) 억제제에 대한 제약업계의 관심이 집중되며 연구개발(R&D)이 가속화되고 있다.다케다 3상 긍정적…일본 가켄제약도 TYK2 억제제 확보12일 관련 업계에 따르면 다케다는 최근 신약후보물질 ‘자소시티닙’의 건선성 관절염 임상3상을 승인받고 연구를 진행 중이다.자소시티닙은 경구용 TYK2 억제제로 개발 중인 신약후보물질로, 다케다는 지난 2022년 미국 님버스 테라퓨틱스로부터 자소시티닙을 확보해 임상을 진행 중이다.TYK2는 인터루킨(IL)-23과 같은 여러 사이토카인 경로를 매개하며, IL-23은 IL-17을 포함한 전염증성 사이토카인의 생성을 유발해 각질형성세포의 증식과 표피 과증식을 촉진하게 되고 그 결과 건선을 일으키게 된다.BMS '소틱투'건선에는 종양괴사인자알파(TNF-α) 억제제, IL-억제제 등 다양한 치료옵션이 등장한 상황이다. 또 TYK2 억제제인 BMS의 소틱투 등 경구제가 등장하면서 환자 투여 편의성과 함께 치료 효과를 동시에 타깃할 수 있는 신약도 출시됐다. 소틱투는 성인 중등증-중증 판상 건선에서 최초로 승인된 TYK2 억제제다.기존 생물학적제제 중 IL-17 억제제의 경우 궤양성대장염이나 크론병과 같은 염증성장질환 악화와 경구 칸디다증에 대한 우려가 제기되기도 했다. IL-23 억제제는 두드러지는 이상반응은 없었지만 주사 부위에 통증이나 불편감과 상기도 감염에 대한 우려가 있다. 새로운 치료 옵션이 부각되는 이유 중 하나다.TYK2 억제제는 JAK 억제제와 달리 TYK2 단백질을 선택적으로 억제해 IL-12, IL-23, Type I 인터페론 경로의 신호전달만 차단하고, 면역 반응 조절과 함께 보다 안전한 치료가 가능하다는 점에서 주목받고 있다.그중 자소시티닙은 소틱투에 이어 가장 상용화에 가깝다고 평가받는다. 지난해 의학전문지 ‘JAMA’에 게재된 임상2b상에서 자소시티닙의 상용화 가능성이 확인됐다.이 연구는 259명의 참가자를 무작위로 배정하여 12주 동안 자소시티닙의 네 가지 일일 경구 용량(2mg, 5mg, 15mg 또는 30mg) 중 하나 또는 위약을 투여했다.임상 결과 자소시티닙은 용량 의존적 반응을 보였으며, 각 용량군에서 건선 중증도 지수(PASI) 75(피부 개선율 75% 이상)에 도달한 환자의 비율은 18%, 44%, 68%, 67%로 위약군 6%에 비해 높았다. 또 이 연구에서는 중대한 안전성 문제는 보고되지 않아 자소시티닙은 양호한 안전성 프로파일을 보였다.다케다는 건선 외 다른 적응증으로도 자소시티닙을 적극적으로 개발하고 있으며, 건선성 관절염 적응증 확보도 모색하고 있다. 또 다케다는 중등증에서 중증의 활성 크론병 및 궤양성 대장염에 대한 2상 연구를 진행 중이며, 전신성 홍반 루푸스에 대한 연구도 계획하고 있어 다른 면역 매개 질환에서도 자소시티닙의 잠재력을 모색하고 있다.HK이노엔, 가켄제약 등 아시아에서도 개발 이어나가국내를 비롯해 일본에서도 TYK2 억제제 신약에 대한 관심은 높다.일본 가켄제약은 최근 미국 생명공학회사 알루미스(Alumis)가 개발 중인 경구용 TYK2 억제제 ‘ESK-001’에 대해 일본 내 개발·제조 및 판권 라이선스 계약을 체결했다. 가켄제약은 일본에서 승인 신청 및 제품화, 필요 시 현지 임상과 개발을 담당할 예정이며, 알루미스는 일본을 포함한 다국가 공동 임상을 진행한다.올해 초 진행된 미국피부과학회 연례학술대회에서 공개된 내용에 따르면 중등증에서 중증의 판상 건선에 대해 ESK-001로 치료받은 환자들은 1년 동안 긍정적인 임상 반응을 경험했다.이 연구에서 80명의 환자가 52주차까지 1일 2회 ESK-001 40mg으로 치료를 받았다. 연구 결과를 자세히 살펴보면 PASI 90은 52주차 61.3%, 12주차 52.4%, PASI 100은 52주차 38.8%, 12주차 26.8%, 정적 PGA 0은 52주차 38.8%, 12주차 32.9%로 PASI 달성 비율이 52주차에 더 높게 나타났다.52주차까지 환자의 81.3%가 4 미만의 PASI를 경험했으며 61.3%는 0 또는 1의 DLQI(피부과 삶의 질 지수)를 보고했다.ESK-001 치료는 내약성도 양호했으며 16주 및 28주에 보고된 것과 비교해 새로운 안전성 신호를 나타내지 않았다.국내에서는 HK이노엔 임상 진입을 준비 중이다. HK이노엔은 지난해 5월 열린 미국피부과연구학회에서 알로스테릭 TYK2 저해제 'IN-121803'의 연구결과를 공개했다.'IN-121803'은 아데노신3인산(ATP) 결합부위를 공략하는 것이 아니라 TYK2 효소의 알로스테릭 결합부위를 공략해 면역, 염증 조절 단백질인 JAK 선택성을 극대화했다.HK이노엔에 따르면 현재 후보물질을 도출한 단계다. IN-121803은 FDA 승인 약물인 BMS의 듀크라바시티닙보다 JAK 선택성을 개선했고 다케다의 자소시티닙보다 더 높은 혈중 노출도와 효능을 보였다.HK이노엔은 비임상 연구를 마치는 대로 IN-121803의 임상1상시험계획(IND) 제출을 목표하고 있다.2025-08-12 12:00:45손형민 -
 스텔라라·레미케이드 '흔들'...J&J, 후속 신약개발 집중[데일리팜=손형민 기자] 존슨앤드존슨(J&J)의 면역질환 블록버스터 신약 '스텔라라'와 '레미케이드'의 매출이 급격한 감소세에 접어들었다. 특허만료에 따라 바이오시밀러들이 시장에 속속 진입하면서 글로벌 매출이 큰 폭으로 줄었다. 존슨앤드존슨은 차세대 면역질환 치료제 개발에 박차를 가하며 대응에 나섰다.바이오시밀러 공세…오리지널 의약품 매출 대폭 감소존슨앤드존슨 '스텔라라'24일 존슨앤드존슨 글로벌 실적 자료에 따르면 스텔라라의 매출은 지난해 2분기 28억8500만 달러에서 올해 16억5300만 달러(약 2조2800억원)로 42.7% 급감했다. 스텔라라의 올해 상반기 매출은 32억7800만달러(약 4조5000억원)로 전년 동기 53억3600만달러보다 38.6% 감소했다.분기별로 살펴보면 스텔라라의 매출은 2023년 1분기 24억4400만 달러에서 같은 해 3분기 28억6400만 달러까지 증가하다, 2023년 4분기를 기점으로 감소세로 전환됐다. 올해 1분기 매출은 전 분기 대비 31% 하락한 16억2500만달러를 올렸다.스텔라라는 존슨앤드존슨이 개발한 인터루킨(IL)-12, 23 저해제 계열의 자가면역질환 치료제로, 판상 건선, 건선성 관절염, 크론병, 궤양성 대장염 등 다양한 적응증을 보유하고 있다. 다만 2023년 특허 만료 이후 암젠, 산도즈 등 글로벌제약사는 물론 삼성바이오에피스, 셀트리온, 동아에스티 등 국내사까지 바이오시밀러를 미국 시장에 출시하며 경쟁이 심화됐다.암젠은 2023년 11월 FDA로부터 스텔라라 바이오시밀러 '웨즐리나'의 승인을 획득했으며 이듬해 2분기부터 판매를 시작했다. 웨즐리나 출시로 미국 내 가격 경쟁이 본격화되자, 스텔라라의 매출이 줄어든 것으로 집계됐다. 존슨앤드존슨의 레미케이드 역시 매출 감소 흐름을 피하지 못했다.레미케이드의 매출은 지난해 2분기 4억6200만 달러에서 올해 4억5500만 달러(약 6000억원)로 1.5% 감소했다. 올해 상반기 기준 매출은 9억2200만 달러(약 1조3000억원)로 전년 동기 대비 11.5% 증가했지만, 2022년 상반기 13억1000만 달러와 비교하면 2년새 29.6% 줄었다.레미케이드는 종양괴사인자알파(TNF-α)라는 염증을 유발하는 사이토카인의 작용을 차단함으로써 염증성 질환의 치료 효과를 나타내는 면역억제제다. 이 치료제는 크론병, 궤양성 대장염, 류마티스 관절염 등 다양한 염증성 질환 치료에 사용된다.존슨앤드존슨 '레미케이드'레미케이드는 2016년 연매출 70억달러(약 10조원)를 넘겼지만, 이듬해 셀트리온 ‘렘시마’를 필두로 화이자의 ‘인플렉트라’, 암젠의 ‘엠바시’, 마일란의 ‘오기브라’, 삼성바이오에피스의 ‘레마로체’ 등 여러 바이오시밀러가 시장에 안착하면서 크게 위축됐다.특히 셀트리온은 피하주사 제형인 ‘짐펜트라’를 선보이고 가격을 30% 이상 낮추는 등 점유율을 확대에 나섰다. 이에 따라 오리지널 레미케이드의 매출은 2022년 3분기 이후 매출 6억 달러를 넘기지 못하고 있다. 2024년 4분기에는 3억5900만 달러까지 떨어졌다. 업계는 바이오시밀러의 가격 인하 경쟁과 급여 우선 전략이 레미케이드의 매출 하락을 가속화한 것으로 보고 있다.포스트 스텔라라·레미케이드 시대 대비 중…FcRn 등 신기전 전진배치존슨앤드존슨은 스텔라라와 레미케이드의 매출 공백을 메우기 위해 새로운 자가면역 치료제 개발에 주력하고 있다. 현재 회사는 ▲'니포칼리맙'(FcRn 억제제) ▲'JNJ-2113’(IL-23 억제제) ▲'JNJ-4804'(IL-23·TNF-α 억제제) 등을 통해 류마티스관절염·건선·염증성장질환 등에 대한 다양한 신약후보물질들의 임상을 진행하고 있다.니포칼리맙은 올해 5월 미국에서 중증근무력증 치료제로 허가됐다. 니포칼리맙은 면역글로불린G(IgG)의 방어수용체인 Fc 수용체(FcRn)를 차단하는 새로운 기전이다. 해당 기전은 질병을 유발하는 면역글로불린G 항체를 감소시키고 이를 재순환하는 과정을 차단한다. 니포칼리맙은 FcRn과 결합해 IgG 항체가 분해되지 않도록 한다.니포칼리맙은 임상3상 Vivacity-MG3 연구를 통해 기존 표준치료요법과 병용투여 했을 때 위약군 대비 효능을 확인했다. 임상에서 니포칼리맙은 중증근무력증 일상생활 수행 능력 평가 척도인 ''MG-ADL' 점수 4.70을 기록하며 통계적으로 유의한 결과를 확인했다. 또 니포칼리맙은 위약군 대비 중증근무력증 환자의 근육 강도와 기능을 개선한 것으로 나타났다.또 존슨앤드존슨은 최근 IL-23 억제제 ‘JNJ-2113’의 FDA 허가 신청을 완료했다. JNJ-2113은 IL-23 수용체를 선택적으로 차단하는 경구용 펩타이드 기반 치료제로, 스텔라라의 기전을 계승하면서 복약 편의성을 높였다.이 신약후보물질은 중등도~중증 판상 건선을 적응증으로 임상2b/3상 ‘FRONTIER 2’에서 피부 개선 효과와 내약성을 입증했다. 궤양성 대장염을 대상으로 한 임상2상 ‘ANTHEM-UC’ 연구도 병행 중이다.존슨앤드존슨은 JNJ-2113이 승인될 경우 최초의 경구용 IL-23 억제제로, 스텔라라 이후 면역질환 포트폴리오의 중심이 될 것으로 보고 있다.또 이 회사는 자가면역질환 신약후보물질 ‘JNJ-4804’에도 기대를 걸고 있다. JNJ-4804는 IL-23 억제제(트렘피어)와 TNF-α 억제제(심퍼니)를 고정 용량 병합한 이중작용 면역 치료제로, 궤양성대장염, 크론병, 건선관절염 등 다양한 자가면역질환 적응증을 타깃해 개발 중이다.존슨앤드존슨은 기존 단일기전 생물학적제제의 한계를 보완하는 전략으로, 복합 작용을 통해 염증 반응을 보다 광범위하게 억제하는 접근 방식으로 가져가고 있다. 현재 존슨앤드존슨은 JNJ-4804의 후기 임상 진입을 목표하고 있으며, 이를 통해 자가면역질환 시장에서의 파이프라인 다변화를 노리고 있다.2025-07-24 12:00:00손형민
스텔라라·레미케이드 '흔들'...J&J, 후속 신약개발 집중[데일리팜=손형민 기자] 존슨앤드존슨(J&J)의 면역질환 블록버스터 신약 '스텔라라'와 '레미케이드'의 매출이 급격한 감소세에 접어들었다. 특허만료에 따라 바이오시밀러들이 시장에 속속 진입하면서 글로벌 매출이 큰 폭으로 줄었다. 존슨앤드존슨은 차세대 면역질환 치료제 개발에 박차를 가하며 대응에 나섰다.바이오시밀러 공세…오리지널 의약품 매출 대폭 감소존슨앤드존슨 '스텔라라'24일 존슨앤드존슨 글로벌 실적 자료에 따르면 스텔라라의 매출은 지난해 2분기 28억8500만 달러에서 올해 16억5300만 달러(약 2조2800억원)로 42.7% 급감했다. 스텔라라의 올해 상반기 매출은 32억7800만달러(약 4조5000억원)로 전년 동기 53억3600만달러보다 38.6% 감소했다.분기별로 살펴보면 스텔라라의 매출은 2023년 1분기 24억4400만 달러에서 같은 해 3분기 28억6400만 달러까지 증가하다, 2023년 4분기를 기점으로 감소세로 전환됐다. 올해 1분기 매출은 전 분기 대비 31% 하락한 16억2500만달러를 올렸다.스텔라라는 존슨앤드존슨이 개발한 인터루킨(IL)-12, 23 저해제 계열의 자가면역질환 치료제로, 판상 건선, 건선성 관절염, 크론병, 궤양성 대장염 등 다양한 적응증을 보유하고 있다. 다만 2023년 특허 만료 이후 암젠, 산도즈 등 글로벌제약사는 물론 삼성바이오에피스, 셀트리온, 동아에스티 등 국내사까지 바이오시밀러를 미국 시장에 출시하며 경쟁이 심화됐다.암젠은 2023년 11월 FDA로부터 스텔라라 바이오시밀러 '웨즐리나'의 승인을 획득했으며 이듬해 2분기부터 판매를 시작했다. 웨즐리나 출시로 미국 내 가격 경쟁이 본격화되자, 스텔라라의 매출이 줄어든 것으로 집계됐다. 존슨앤드존슨의 레미케이드 역시 매출 감소 흐름을 피하지 못했다.레미케이드의 매출은 지난해 2분기 4억6200만 달러에서 올해 4억5500만 달러(약 6000억원)로 1.5% 감소했다. 올해 상반기 기준 매출은 9억2200만 달러(약 1조3000억원)로 전년 동기 대비 11.5% 증가했지만, 2022년 상반기 13억1000만 달러와 비교하면 2년새 29.6% 줄었다.레미케이드는 종양괴사인자알파(TNF-α)라는 염증을 유발하는 사이토카인의 작용을 차단함으로써 염증성 질환의 치료 효과를 나타내는 면역억제제다. 이 치료제는 크론병, 궤양성 대장염, 류마티스 관절염 등 다양한 염증성 질환 치료에 사용된다.존슨앤드존슨 '레미케이드'레미케이드는 2016년 연매출 70억달러(약 10조원)를 넘겼지만, 이듬해 셀트리온 ‘렘시마’를 필두로 화이자의 ‘인플렉트라’, 암젠의 ‘엠바시’, 마일란의 ‘오기브라’, 삼성바이오에피스의 ‘레마로체’ 등 여러 바이오시밀러가 시장에 안착하면서 크게 위축됐다.특히 셀트리온은 피하주사 제형인 ‘짐펜트라’를 선보이고 가격을 30% 이상 낮추는 등 점유율을 확대에 나섰다. 이에 따라 오리지널 레미케이드의 매출은 2022년 3분기 이후 매출 6억 달러를 넘기지 못하고 있다. 2024년 4분기에는 3억5900만 달러까지 떨어졌다. 업계는 바이오시밀러의 가격 인하 경쟁과 급여 우선 전략이 레미케이드의 매출 하락을 가속화한 것으로 보고 있다.포스트 스텔라라·레미케이드 시대 대비 중…FcRn 등 신기전 전진배치존슨앤드존슨은 스텔라라와 레미케이드의 매출 공백을 메우기 위해 새로운 자가면역 치료제 개발에 주력하고 있다. 현재 회사는 ▲'니포칼리맙'(FcRn 억제제) ▲'JNJ-2113’(IL-23 억제제) ▲'JNJ-4804'(IL-23·TNF-α 억제제) 등을 통해 류마티스관절염·건선·염증성장질환 등에 대한 다양한 신약후보물질들의 임상을 진행하고 있다.니포칼리맙은 올해 5월 미국에서 중증근무력증 치료제로 허가됐다. 니포칼리맙은 면역글로불린G(IgG)의 방어수용체인 Fc 수용체(FcRn)를 차단하는 새로운 기전이다. 해당 기전은 질병을 유발하는 면역글로불린G 항체를 감소시키고 이를 재순환하는 과정을 차단한다. 니포칼리맙은 FcRn과 결합해 IgG 항체가 분해되지 않도록 한다.니포칼리맙은 임상3상 Vivacity-MG3 연구를 통해 기존 표준치료요법과 병용투여 했을 때 위약군 대비 효능을 확인했다. 임상에서 니포칼리맙은 중증근무력증 일상생활 수행 능력 평가 척도인 ''MG-ADL' 점수 4.70을 기록하며 통계적으로 유의한 결과를 확인했다. 또 니포칼리맙은 위약군 대비 중증근무력증 환자의 근육 강도와 기능을 개선한 것으로 나타났다.또 존슨앤드존슨은 최근 IL-23 억제제 ‘JNJ-2113’의 FDA 허가 신청을 완료했다. JNJ-2113은 IL-23 수용체를 선택적으로 차단하는 경구용 펩타이드 기반 치료제로, 스텔라라의 기전을 계승하면서 복약 편의성을 높였다.이 신약후보물질은 중등도~중증 판상 건선을 적응증으로 임상2b/3상 ‘FRONTIER 2’에서 피부 개선 효과와 내약성을 입증했다. 궤양성 대장염을 대상으로 한 임상2상 ‘ANTHEM-UC’ 연구도 병행 중이다.존슨앤드존슨은 JNJ-2113이 승인될 경우 최초의 경구용 IL-23 억제제로, 스텔라라 이후 면역질환 포트폴리오의 중심이 될 것으로 보고 있다.또 이 회사는 자가면역질환 신약후보물질 ‘JNJ-4804’에도 기대를 걸고 있다. JNJ-4804는 IL-23 억제제(트렘피어)와 TNF-α 억제제(심퍼니)를 고정 용량 병합한 이중작용 면역 치료제로, 궤양성대장염, 크론병, 건선관절염 등 다양한 자가면역질환 적응증을 타깃해 개발 중이다.존슨앤드존슨은 기존 단일기전 생물학적제제의 한계를 보완하는 전략으로, 복합 작용을 통해 염증 반응을 보다 광범위하게 억제하는 접근 방식으로 가져가고 있다. 현재 존슨앤드존슨은 JNJ-4804의 후기 임상 진입을 목표하고 있으며, 이를 통해 자가면역질환 시장에서의 파이프라인 다변화를 노리고 있다.2025-07-24 12:00:00손형민 -
 삼성에피스, 바이오시밀러 글로벌 1등 도전장삼성바이오에피스 사옥[데일리팜=황병우 기자] 삼성바이오에피스가 10년 동안 10개의 바이오시밀러를 출시하는 이정표를 세우면서 영향력을 확장했다.지난 2015년 엔브렐 바이오시밀러인 에톨로체의 출시 이후 빠른 제품화 속도를 보이며 경쟁력을 입증하고 있다.특히 개발역량과 함께 직접판매로 전환한 품목에서도 안정적인 성과를 보이며 향후 인적분할 이후 경영 독립에서도 추진력을 얻을 것으로 전망된다.7월 오보덴스 출시로 국내 판매 제품 10개 돌파 이정표현재 삼성바이오에피스는 다양한 치료 분야의 바이오시밀러 포트폴리오를 확보하며 빠른 제품화 속도로 시장을 공략하고 있다.7월 골다공증 치료제 오보덴스(프롤리아 바이오시밀러, 성분명 데노수맙)를 출시해 국내에 판매하는 바이오시밀러 제품이 10종으로 늘어났다.자가면역질환·종양·안과·희귀질환·골질환 등 질환 영역 역시 균형 있게 포트폴리오화했다는 점에서 긍정적인 시너지를 내는 중이다.2012년 설립 이후 바이오시밀러 개발역량을 축적한 결과, 2024년 연 매출 1조5377억원을 기록하며 전년 대비 51% 성장했다.지난해의 경우 파트너십 제품의 마일스톤 수익이 크게 늘어나며 영업이익 역시 4354억원으로 전년 대비 112% 증가하며 역대 최대 실적을 보였다.삼성바이오에피스 국내 제품 판매 현황 특히 삼성바이오에피스의 시장 공략이 제품별로 직판과 파트너 협업이라는 이원화된 전략으로 특화했다는 점을 주목할만하다.대표적으로 자가면역질환 치료제 3종(에톨로체, 레마로체, 아달로체)은 2021년부터 2024년 초까지 유한양행과 마케팅 파트너십을 통해 판매했지만 2024년 초 유한양행과의 계약 종료 후 직접판매로 전환했다.이 과정에서 국내 영업 조직 신설 및 자체 주문 시스템을 개발하고 지오영과 제3자 물류 계약(3PL)을 체결하며 전국 유통망을 직접 운영할 수 있는 체계도 마련했다는 점에서 긍정적인 평가를 받고 있다.직접판매 전환은 단순한 유통구조 변화에 따른 수익성 개선 외에도, 제품 메시지의 주도권 확보나 의료진과의 커뮤니케이션 강화 등에서 시너지를 기대할 수 있기 때문이다.여기에 지난해 7월 출시한 스텔라라의 바이오시밀러 에피즈텍과 희귀질환 치료제인 에피스클리 역시 회사의 자체 마케팅 역량을 기반으로 직접판매를 실시하고 있다.'직접판매·파트너십' 투트랙 전략…협업모델 성과 주목다만 삼성바이오에피스가 모든 제품에서 직접판매 전환을 고려하는 것은 아니다. 질환군의 특성과 시장 진입 난이도에 따라 전략적 파트너십을 병행하고 있다.항암제의 경우 보령과의 협업을 통해 삼페넷(허셉틴 바이오시밀러), 온베브지(아바스틴 바이오시밀러)를 안정적으로 판매하고 있으며, 실제 온베브지는 2022년 205억원, 2023년 423억원, 2024년 518억원의 매출을 달성하는 등 꾸준한 성장세를 보였다. 또 안과질환 분야는 삼일제약을 통해 아멜리부(루센티스 바이오시밀러), 아필리부(아일리아 바이오시밀러)를 판매하며 전문성 기반의 판매 전략을 실행 중이다.7월 1일 출시한 삼성바이오에피스의 10번째 바이오시밀러 제품 오보덴스(프롤리아 바이오시밀러)는 한미약품과 공동판매 계약을 체결해 새로운 형태의 협업모델을 선보이기도 했다.양사가 마케팅 및 영업을 함께 수행하는 이번 파트너십은 삼성바이오에피스가 10년간 축적한 파트너십 경험과 직판 노하우가 융합된 사례로 평가받고 있다.삼성바이오에피스와 한미약품은 이번 협력을 바탕으로, 국내에서 1749억원 규모의 오리지널 의약품 시장 공략에 박차를 가할 계획이다.이상현 삼성바이오에피스 국내영업총괄 상무(SBKR팀장)는 "오보덴스는 합리적인 약가와 글로벌 규제 기관에서 인정받은 품질 경쟁력을 바탕으로, 단순한 오리지널 의약품의 대체제가 아닌 국내 골다공증 환자 치료에 더 의미 있는 대안이 될 수 있을 것으로 믿는다"고 말했다.삼성바이오에피스 10년 빅스텝 핵심 '인식변화'삼성바이오에피스의 지난 10년 동안 10개의 바이오시밀러 출시가 의미있는 이유는 단순한 매출 성장을 넘어 바이오시밀러에 대한 인식 전환이 이뤄졌기 때문이다.바이오시밀러의 시장 침투율이 지속적으로 상승하며 오리지널 의약품의 점유율을 대체해 나가고 있다.글로벌 시장조사기관 아이큐비아(IQVIA)에 따르면, 국내 바이오시밀러 점유율은 2022년 21%, 2023년 26%, 2024년 31%로 꾸준히 확대되고 있어 향후 시장 확대에 대한 기대감이 높다.서울 상급종합병원의 A 류마티스내과 교수는 "류마티스 관절염에서 여러 신약이 등장했지만, TNF 억제제가 여전히 중요한 처방 지위를 차지 한 상황에서 바이오시밀러의 역할도 충분하다"며 "바이오시밀러가 출시됐던 초기와 비교하면 국내뿐 아니라 글로벌 차원에서도 이제는 과거와 같은 처방 허들은 없어 보인다"고 밝혔다.이미 여러 분야에서 오리지널과 비교해 많은 처방 경험이 쌓이며 단순히 바이오시밀러이기 때문에 처방을 피하는 사례는 없다는 게 전문가들의 시각이다.삼성바이오에피스-셀트리온 제품 출시 정보 실제 국내 류마티스학회 심포지엄에서 발표된 자료에 따르면, 자가면역질환에 바이오시밀러 도입으로 실제 치료비용 절감과 치료 효과를 확인해 환자 접근성을 높였다고 보고되기도 했다.또 다른 서울 B 상급종합병원 소화기내과 교수는 "해외와 비교해 국내에서는 바이오시밀러의 비용 강점이 부각되지 않아 마케팅적 노력이 병행이 필요한 것은 사실"이라며 "그럼에도 바이오시밀러에 대한 낯섦이나 환자 선호도 측면의 인식은 과거와 달라졌음을 체감한다"고 강조했다.국내 점유율 한계는 과제…"약가 인센티브 및 인식개선 필요"한편, 국내 바이오시밀러의 점유율이 높아지고 있지만 여전히 유럽, 미국 등과 비교하면 국내 보급 속도는 더디다는 평가를 받고 있다.지난 1일 한국바이오협회가 발표한 자료에 따르면 오리지널인 휴미라는 점유율이 90% 이상을 유지하고 있고 레미케이드는 2016년부터 2022년까지 점유율이 60% 정도로 유지되는 중이다.바이오시밀러 출시 후 유럽 및 미국에서 휴미라와 레미케이드의 시장점유율을 조사한 결과, 미국보다 유럽에서 3년 이하의 단기간에 오리지널 의약품의 시장점유율이 50% 이하로 떨어진 것과 비교하면 대비되는 현상이다.IP5 국가(미국, 유럽, 중국, 한국, 일본) 중 가장 낮은 바이오시밀러 특허장벽을 구축한 것을 고려하면 약가제도나 인식에 따른 접근성의 한계가 여전히 있다는 의미다.이에 협회는 '한국 내 바이오시밀러 점유율이 낮은 이유 및 높일 방안' 보고서에서 ▲유럽식 참조가격제 도입을 통한 환자 체감 가격 격차 확대 ▲저가 처방 인센티브 등을 통한 환자& 8729;의료진 유인 강화 ▲환자& 8729;의료진 대상 안전성& 8729;효능 교육 프로그램 확대를 통한 바이오시밀러 인식개선 등을 핵심 해법으로 제시하기도 했다.정부·의료계·산업계가 이러한 지원책을 속도감 있게 이행한다면, 바이오시밀러의 사회적 가치인 국민 의료비 절감과 의료 접근성 증진은 더 높아질 수 있다는 시각이다.2025-07-10 06:00:01황병우
삼성에피스, 바이오시밀러 글로벌 1등 도전장삼성바이오에피스 사옥[데일리팜=황병우 기자] 삼성바이오에피스가 10년 동안 10개의 바이오시밀러를 출시하는 이정표를 세우면서 영향력을 확장했다.지난 2015년 엔브렐 바이오시밀러인 에톨로체의 출시 이후 빠른 제품화 속도를 보이며 경쟁력을 입증하고 있다.특히 개발역량과 함께 직접판매로 전환한 품목에서도 안정적인 성과를 보이며 향후 인적분할 이후 경영 독립에서도 추진력을 얻을 것으로 전망된다.7월 오보덴스 출시로 국내 판매 제품 10개 돌파 이정표현재 삼성바이오에피스는 다양한 치료 분야의 바이오시밀러 포트폴리오를 확보하며 빠른 제품화 속도로 시장을 공략하고 있다.7월 골다공증 치료제 오보덴스(프롤리아 바이오시밀러, 성분명 데노수맙)를 출시해 국내에 판매하는 바이오시밀러 제품이 10종으로 늘어났다.자가면역질환·종양·안과·희귀질환·골질환 등 질환 영역 역시 균형 있게 포트폴리오화했다는 점에서 긍정적인 시너지를 내는 중이다.2012년 설립 이후 바이오시밀러 개발역량을 축적한 결과, 2024년 연 매출 1조5377억원을 기록하며 전년 대비 51% 성장했다.지난해의 경우 파트너십 제품의 마일스톤 수익이 크게 늘어나며 영업이익 역시 4354억원으로 전년 대비 112% 증가하며 역대 최대 실적을 보였다.삼성바이오에피스 국내 제품 판매 현황 특히 삼성바이오에피스의 시장 공략이 제품별로 직판과 파트너 협업이라는 이원화된 전략으로 특화했다는 점을 주목할만하다.대표적으로 자가면역질환 치료제 3종(에톨로체, 레마로체, 아달로체)은 2021년부터 2024년 초까지 유한양행과 마케팅 파트너십을 통해 판매했지만 2024년 초 유한양행과의 계약 종료 후 직접판매로 전환했다.이 과정에서 국내 영업 조직 신설 및 자체 주문 시스템을 개발하고 지오영과 제3자 물류 계약(3PL)을 체결하며 전국 유통망을 직접 운영할 수 있는 체계도 마련했다는 점에서 긍정적인 평가를 받고 있다.직접판매 전환은 단순한 유통구조 변화에 따른 수익성 개선 외에도, 제품 메시지의 주도권 확보나 의료진과의 커뮤니케이션 강화 등에서 시너지를 기대할 수 있기 때문이다.여기에 지난해 7월 출시한 스텔라라의 바이오시밀러 에피즈텍과 희귀질환 치료제인 에피스클리 역시 회사의 자체 마케팅 역량을 기반으로 직접판매를 실시하고 있다.'직접판매·파트너십' 투트랙 전략…협업모델 성과 주목다만 삼성바이오에피스가 모든 제품에서 직접판매 전환을 고려하는 것은 아니다. 질환군의 특성과 시장 진입 난이도에 따라 전략적 파트너십을 병행하고 있다.항암제의 경우 보령과의 협업을 통해 삼페넷(허셉틴 바이오시밀러), 온베브지(아바스틴 바이오시밀러)를 안정적으로 판매하고 있으며, 실제 온베브지는 2022년 205억원, 2023년 423억원, 2024년 518억원의 매출을 달성하는 등 꾸준한 성장세를 보였다. 또 안과질환 분야는 삼일제약을 통해 아멜리부(루센티스 바이오시밀러), 아필리부(아일리아 바이오시밀러)를 판매하며 전문성 기반의 판매 전략을 실행 중이다.7월 1일 출시한 삼성바이오에피스의 10번째 바이오시밀러 제품 오보덴스(프롤리아 바이오시밀러)는 한미약품과 공동판매 계약을 체결해 새로운 형태의 협업모델을 선보이기도 했다.양사가 마케팅 및 영업을 함께 수행하는 이번 파트너십은 삼성바이오에피스가 10년간 축적한 파트너십 경험과 직판 노하우가 융합된 사례로 평가받고 있다.삼성바이오에피스와 한미약품은 이번 협력을 바탕으로, 국내에서 1749억원 규모의 오리지널 의약품 시장 공략에 박차를 가할 계획이다.이상현 삼성바이오에피스 국내영업총괄 상무(SBKR팀장)는 "오보덴스는 합리적인 약가와 글로벌 규제 기관에서 인정받은 품질 경쟁력을 바탕으로, 단순한 오리지널 의약품의 대체제가 아닌 국내 골다공증 환자 치료에 더 의미 있는 대안이 될 수 있을 것으로 믿는다"고 말했다.삼성바이오에피스 10년 빅스텝 핵심 '인식변화'삼성바이오에피스의 지난 10년 동안 10개의 바이오시밀러 출시가 의미있는 이유는 단순한 매출 성장을 넘어 바이오시밀러에 대한 인식 전환이 이뤄졌기 때문이다.바이오시밀러의 시장 침투율이 지속적으로 상승하며 오리지널 의약품의 점유율을 대체해 나가고 있다.글로벌 시장조사기관 아이큐비아(IQVIA)에 따르면, 국내 바이오시밀러 점유율은 2022년 21%, 2023년 26%, 2024년 31%로 꾸준히 확대되고 있어 향후 시장 확대에 대한 기대감이 높다.서울 상급종합병원의 A 류마티스내과 교수는 "류마티스 관절염에서 여러 신약이 등장했지만, TNF 억제제가 여전히 중요한 처방 지위를 차지 한 상황에서 바이오시밀러의 역할도 충분하다"며 "바이오시밀러가 출시됐던 초기와 비교하면 국내뿐 아니라 글로벌 차원에서도 이제는 과거와 같은 처방 허들은 없어 보인다"고 밝혔다.이미 여러 분야에서 오리지널과 비교해 많은 처방 경험이 쌓이며 단순히 바이오시밀러이기 때문에 처방을 피하는 사례는 없다는 게 전문가들의 시각이다.삼성바이오에피스-셀트리온 제품 출시 정보 실제 국내 류마티스학회 심포지엄에서 발표된 자료에 따르면, 자가면역질환에 바이오시밀러 도입으로 실제 치료비용 절감과 치료 효과를 확인해 환자 접근성을 높였다고 보고되기도 했다.또 다른 서울 B 상급종합병원 소화기내과 교수는 "해외와 비교해 국내에서는 바이오시밀러의 비용 강점이 부각되지 않아 마케팅적 노력이 병행이 필요한 것은 사실"이라며 "그럼에도 바이오시밀러에 대한 낯섦이나 환자 선호도 측면의 인식은 과거와 달라졌음을 체감한다"고 강조했다.국내 점유율 한계는 과제…"약가 인센티브 및 인식개선 필요"한편, 국내 바이오시밀러의 점유율이 높아지고 있지만 여전히 유럽, 미국 등과 비교하면 국내 보급 속도는 더디다는 평가를 받고 있다.지난 1일 한국바이오협회가 발표한 자료에 따르면 오리지널인 휴미라는 점유율이 90% 이상을 유지하고 있고 레미케이드는 2016년부터 2022년까지 점유율이 60% 정도로 유지되는 중이다.바이오시밀러 출시 후 유럽 및 미국에서 휴미라와 레미케이드의 시장점유율을 조사한 결과, 미국보다 유럽에서 3년 이하의 단기간에 오리지널 의약품의 시장점유율이 50% 이하로 떨어진 것과 비교하면 대비되는 현상이다.IP5 국가(미국, 유럽, 중국, 한국, 일본) 중 가장 낮은 바이오시밀러 특허장벽을 구축한 것을 고려하면 약가제도나 인식에 따른 접근성의 한계가 여전히 있다는 의미다.이에 협회는 '한국 내 바이오시밀러 점유율이 낮은 이유 및 높일 방안' 보고서에서 ▲유럽식 참조가격제 도입을 통한 환자 체감 가격 격차 확대 ▲저가 처방 인센티브 등을 통한 환자& 8729;의료진 유인 강화 ▲환자& 8729;의료진 대상 안전성& 8729;효능 교육 프로그램 확대를 통한 바이오시밀러 인식개선 등을 핵심 해법으로 제시하기도 했다.정부·의료계·산업계가 이러한 지원책을 속도감 있게 이행한다면, 바이오시밀러의 사회적 가치인 국민 의료비 절감과 의료 접근성 증진은 더 높아질 수 있다는 시각이다.2025-07-10 06:00:01황병우 -
 "TNF-α 억제제, 류마티스관절염 핵심 치료제 굳건"[데일리팜=황병우 기자] 류마티스 관절염은 관절에 염증을 일으켜 통증과 변형을 유발하는 만성 자가면역 질환으로 국내 유병률은 약 0.5~1%로 추정된다.최근에는 새로운 치료제가 개발되면서 질환에 대한 인식변화와 함께 조기 진단율도 높아지는 추세다.실제 최근 5년간 국내 류마티스 관절염 환자 수는 30% 이상 급증했으며, 특히 50세 이상 고령층 환자가 전체 환자의 79%를 차지할 정도로 고령화가 두드러지고 있다.이상헌 건국대병원 류마티스내과 교수결국 단순한 치료를 넘어 고령 환자에 대한 접근도 중요해진 상황. 관련분야 최신지견을 가진 이상헌 건국대병원 류마티스내과 교수는 증가하는 류마티스 관절염 고령 환자의 치료제 선택과 관리의 중요성을 강조했다.이 교수에 따르면 류마티스 관절염은 과거 불치병으로 인식됐지만 새로운 치료의 등장으로 인식이 전환되면서 조기 진단과 치료가 늘어나는 상태다.이 교수는 "류마티스 관절염도 치료할 수 있는 병이라는 메시지가 확산되면서 조기 진단율도 높아지고 있다"며 "예전에는 환자의 관절 상태를 육안으로만 확인했다면, 관절 초음파나 MRI 등 영상 진단 기술 발달로 조기 진단이 가능해졌다"고 말했다.또 다른 변화는 전반적인 인구 고령화와 함께 류마티스 관절염 환자 중 고령 환자의 비중도 늘어나고 있다는 점이다. 특히 고령 환자의 경우 젊은 환자와 비교해 합병증 등 다각도의 치료접근이 요구된다는 게 이 교수의 설명이다.그는 "기계도 오래 쓰면 기능이 떨어지듯 고령자는 여러 신체 기능이 저하되기 때문에 여러 동반 질환을 가지고 있는 경우가 많다"며 "심혈관질환, 뇌혈관질환, 당뇨병 등의 합병증이 흔하고 면역 기능도 떨어져 면역 치료제를 사용할 때 주의가 필요하다"고 강조했다.심퍼니IV 제형 출시 10년, GO-FURTHER 연구 주목류마티스 관절염 치료의 전환에 있어 빼놓고 이야기할 수 없는 것이 TNF(종양괴사인자)-α 억제제의 등장이다.류마티스 관절염 치료의 패러다임을 바꾼 치료제로 임상 현장에서 25년 이상 사용됐으며, 여전히 전체 환자의 약 70%를 효과적으로 치료할 수 있다는 평가를 받고 있다.이 교수는 "이후 개발된 다양한 기전의 치료제들은 TNF-α 억제제가 커버하지 못하는 환자를 위한 옵션으로 자리 잡았다. 그만큼 TNF 억제제는 여전히 류마티스 관절염의 핵심 치료제"라며 "특허 만료 이후 바이오시밀러 출시가 활발하게 이뤄지고 있는 치료제 역시 TNF-α 억제제"라고 밝혔다.이러한 TNF-α 억제제 중 하나인 심퍼니(골리무맙)는 2012년 국내에 피하주사(SC) 제형이 도입됐고, 2015년 5월에 보다 빠른 증상 개선과 긴 투여 간격과 의료진 모니터링의 용이성 등을 고려한 정맥주사(IV) 제형이 출시하며 공고한 영향력을 가지고 있다.이 교수는 "심퍼니 IV는 완전 인간 단일클론 항체로 개발된 TNF-α 억제제로 항체 순도 면에서 뛰어나 주입 관련 이상 반응이 현저히 줄었다"며 "인플릭시맙의 경우 투여에 2시간 정도가 소요되지만, 심퍼니는 약 30분이면 투여가 끝나고 투여 간격도 2개월에 한 번으로, 내원 횟수를 크게 줄일 수 있다는 강점이 있다"고 언급했다.특히 이 교수가 주목하는 부분은 최근 늘어나고 있는 고령의 류마티스 관절염에서 심퍼니가 가지는 강점이다.심퍼니의 GO-FURTHER 하위 분석 연구에 따르면 심퍼니 IV가 65세 이상 고령 환자군에서 더 많은 개선 효과를 보인 것으로 나타났다.구체적으로 GO-FURTHER 연구에 참여한 활동성 류마티스 관절염 환자를 65세 미만, 65세 이상 환자군으로 나눠 진행한 하위 분석 연구 결과, 심퍼니는 65세 이상 고령 환자에서 첫 6개월간 위약군 대비 높은 초기 증상 개선을 보였다.14주차에 ACR20을 달성한 환자군은 61.0%로 위약군(11.1%) 대비 약 6배 높았으며, 6개월 시점인 24주차에는 환자 중 69.5%가 ACR 20 반응에 도달하며 위약군(33.3%) 대비 유의미한 임상적 가치를 확인했다.이 교수는 "젊은 층과 비교했을 때 전반적인 수치 차이는 크지 않지만, 고위험군에서는 반응 속도나 반응률에서 더 의미 있는 차이를 보였다"며 "고령 환자들은 염증으로 인해 신체 기능이 떨어져 있는 경우가 많아 치료에 반응하면 개선 폭이 훨씬 크게 나타난다. 이런 점에서 고령 환자에게 심퍼니가 갖는 임상적 장점이 분명히 존재한다"고 분석했다.안전성 측면에서도 심퍼니 IV의 프로파일은 고령 환자군에서 새로운 우려를 보이지 않았다.그는 "일반적으로 70세 이상의 초고령 환자는 감염 위험이 커 어떤 약제를 쓰더라도 세심한 모니터링이 필요하다. 심퍼니의 고령 환자 안전성 데이터는 기존 보고와 대체로 일치하며, 주사 관련 부작용은 드물고 대부분 경미했다"고 전했다."치료 옵션 늘어난 류마티스 관절염…TNF-α 억제제 중심축"큰 틀에서 보면 류마티스 관절염 치료에서 다양한 기전의 신약들이 꾸준히 개발되면서 선택지도 다양해지고 있다.이와 관련해 이 교수는 TNF-α 억제제가 쌓아온 치료 경험과 안정성 데이터는 여전히 경쟁력을 가질 것으로 전망했다.이 교수는 "현재로서는 TNF-α 억제제가 류마티스 관절염 치료의 중심축으로 자리를 계속 유지할 것"이라며 "25년 이상 임상 경험이 축적되어 있고, 주요 부작용도 대부분 파악되어 있어 의사들이 처방 시 확신을 가질 수 있는 약제이기 때문이다"고 밝혔다.JAK 억제제 등 새로운 경구 치료제가 등장하고 있으나 장기 안전성에 대한 우려로 인해 현시점에서는 TNF-α 억제제가 가장 신뢰받는 치료 옵션이라는 게 그의 설명이다.이 교수는 "JAK 억제제는 효과가 뛰어나지만, 세포 내 신호 전달을 조절하는 기전인 만큼 암 발생 등 장기 안전성에 대한 우려가 있다"며 "이를 확인하려면 최소 5~10년 이상의 추가 데이터가 필요할 것"이라고 말했다.이와 함께 이 교수는 류마티스 관절염 치료와 관련해 환자별 '맞춤 치료'가 중요하다고 강조했다.그는 "대부분은 TNF-α 억제제를 1차 치료제로 우선 선택하지만, 환자에 따라 적합하지 않은 경우도 있다"며 "결핵 병력, 심부전 등 TNF-α 억제제 사용에 금기 요인이 있는 경우에는 다른 기전의 약제를 고려하게 된다"고 언급했다.결국 환자의 개별 상태와 위험 요인에 따라 최적의 약제를 선택하고, 필요시 교체 투여(switch)하는 전략이 중요하다는 것이다.끝으로 이 교수는 "치료제는 누구나 처방할 수 있지만, 고령화에 따른 합병증이나 동반 질환의 진행을 관리하고 부작용에 적절히 대처하는 데에는 전문 의료진의 경험과 지식이 필요할 것"이라며 "조기 치료를 통해 초기에 강력하게 염증을 차단하면 장기적으로 병이 재발하지 않고 관리될 수 있어, 빠른 치료를 통해 초기에 염증의 불씨를 끄는 것이 중요하다"고 덧붙였다.2025-07-01 06:00:01황병우
"TNF-α 억제제, 류마티스관절염 핵심 치료제 굳건"[데일리팜=황병우 기자] 류마티스 관절염은 관절에 염증을 일으켜 통증과 변형을 유발하는 만성 자가면역 질환으로 국내 유병률은 약 0.5~1%로 추정된다.최근에는 새로운 치료제가 개발되면서 질환에 대한 인식변화와 함께 조기 진단율도 높아지는 추세다.실제 최근 5년간 국내 류마티스 관절염 환자 수는 30% 이상 급증했으며, 특히 50세 이상 고령층 환자가 전체 환자의 79%를 차지할 정도로 고령화가 두드러지고 있다.이상헌 건국대병원 류마티스내과 교수결국 단순한 치료를 넘어 고령 환자에 대한 접근도 중요해진 상황. 관련분야 최신지견을 가진 이상헌 건국대병원 류마티스내과 교수는 증가하는 류마티스 관절염 고령 환자의 치료제 선택과 관리의 중요성을 강조했다.이 교수에 따르면 류마티스 관절염은 과거 불치병으로 인식됐지만 새로운 치료의 등장으로 인식이 전환되면서 조기 진단과 치료가 늘어나는 상태다.이 교수는 "류마티스 관절염도 치료할 수 있는 병이라는 메시지가 확산되면서 조기 진단율도 높아지고 있다"며 "예전에는 환자의 관절 상태를 육안으로만 확인했다면, 관절 초음파나 MRI 등 영상 진단 기술 발달로 조기 진단이 가능해졌다"고 말했다.또 다른 변화는 전반적인 인구 고령화와 함께 류마티스 관절염 환자 중 고령 환자의 비중도 늘어나고 있다는 점이다. 특히 고령 환자의 경우 젊은 환자와 비교해 합병증 등 다각도의 치료접근이 요구된다는 게 이 교수의 설명이다.그는 "기계도 오래 쓰면 기능이 떨어지듯 고령자는 여러 신체 기능이 저하되기 때문에 여러 동반 질환을 가지고 있는 경우가 많다"며 "심혈관질환, 뇌혈관질환, 당뇨병 등의 합병증이 흔하고 면역 기능도 떨어져 면역 치료제를 사용할 때 주의가 필요하다"고 강조했다.심퍼니IV 제형 출시 10년, GO-FURTHER 연구 주목류마티스 관절염 치료의 전환에 있어 빼놓고 이야기할 수 없는 것이 TNF(종양괴사인자)-α 억제제의 등장이다.류마티스 관절염 치료의 패러다임을 바꾼 치료제로 임상 현장에서 25년 이상 사용됐으며, 여전히 전체 환자의 약 70%를 효과적으로 치료할 수 있다는 평가를 받고 있다.이 교수는 "이후 개발된 다양한 기전의 치료제들은 TNF-α 억제제가 커버하지 못하는 환자를 위한 옵션으로 자리 잡았다. 그만큼 TNF 억제제는 여전히 류마티스 관절염의 핵심 치료제"라며 "특허 만료 이후 바이오시밀러 출시가 활발하게 이뤄지고 있는 치료제 역시 TNF-α 억제제"라고 밝혔다.이러한 TNF-α 억제제 중 하나인 심퍼니(골리무맙)는 2012년 국내에 피하주사(SC) 제형이 도입됐고, 2015년 5월에 보다 빠른 증상 개선과 긴 투여 간격과 의료진 모니터링의 용이성 등을 고려한 정맥주사(IV) 제형이 출시하며 공고한 영향력을 가지고 있다.이 교수는 "심퍼니 IV는 완전 인간 단일클론 항체로 개발된 TNF-α 억제제로 항체 순도 면에서 뛰어나 주입 관련 이상 반응이 현저히 줄었다"며 "인플릭시맙의 경우 투여에 2시간 정도가 소요되지만, 심퍼니는 약 30분이면 투여가 끝나고 투여 간격도 2개월에 한 번으로, 내원 횟수를 크게 줄일 수 있다는 강점이 있다"고 언급했다.특히 이 교수가 주목하는 부분은 최근 늘어나고 있는 고령의 류마티스 관절염에서 심퍼니가 가지는 강점이다.심퍼니의 GO-FURTHER 하위 분석 연구에 따르면 심퍼니 IV가 65세 이상 고령 환자군에서 더 많은 개선 효과를 보인 것으로 나타났다.구체적으로 GO-FURTHER 연구에 참여한 활동성 류마티스 관절염 환자를 65세 미만, 65세 이상 환자군으로 나눠 진행한 하위 분석 연구 결과, 심퍼니는 65세 이상 고령 환자에서 첫 6개월간 위약군 대비 높은 초기 증상 개선을 보였다.14주차에 ACR20을 달성한 환자군은 61.0%로 위약군(11.1%) 대비 약 6배 높았으며, 6개월 시점인 24주차에는 환자 중 69.5%가 ACR 20 반응에 도달하며 위약군(33.3%) 대비 유의미한 임상적 가치를 확인했다.이 교수는 "젊은 층과 비교했을 때 전반적인 수치 차이는 크지 않지만, 고위험군에서는 반응 속도나 반응률에서 더 의미 있는 차이를 보였다"며 "고령 환자들은 염증으로 인해 신체 기능이 떨어져 있는 경우가 많아 치료에 반응하면 개선 폭이 훨씬 크게 나타난다. 이런 점에서 고령 환자에게 심퍼니가 갖는 임상적 장점이 분명히 존재한다"고 분석했다.안전성 측면에서도 심퍼니 IV의 프로파일은 고령 환자군에서 새로운 우려를 보이지 않았다.그는 "일반적으로 70세 이상의 초고령 환자는 감염 위험이 커 어떤 약제를 쓰더라도 세심한 모니터링이 필요하다. 심퍼니의 고령 환자 안전성 데이터는 기존 보고와 대체로 일치하며, 주사 관련 부작용은 드물고 대부분 경미했다"고 전했다."치료 옵션 늘어난 류마티스 관절염…TNF-α 억제제 중심축"큰 틀에서 보면 류마티스 관절염 치료에서 다양한 기전의 신약들이 꾸준히 개발되면서 선택지도 다양해지고 있다.이와 관련해 이 교수는 TNF-α 억제제가 쌓아온 치료 경험과 안정성 데이터는 여전히 경쟁력을 가질 것으로 전망했다.이 교수는 "현재로서는 TNF-α 억제제가 류마티스 관절염 치료의 중심축으로 자리를 계속 유지할 것"이라며 "25년 이상 임상 경험이 축적되어 있고, 주요 부작용도 대부분 파악되어 있어 의사들이 처방 시 확신을 가질 수 있는 약제이기 때문이다"고 밝혔다.JAK 억제제 등 새로운 경구 치료제가 등장하고 있으나 장기 안전성에 대한 우려로 인해 현시점에서는 TNF-α 억제제가 가장 신뢰받는 치료 옵션이라는 게 그의 설명이다.이 교수는 "JAK 억제제는 효과가 뛰어나지만, 세포 내 신호 전달을 조절하는 기전인 만큼 암 발생 등 장기 안전성에 대한 우려가 있다"며 "이를 확인하려면 최소 5~10년 이상의 추가 데이터가 필요할 것"이라고 말했다.이와 함께 이 교수는 류마티스 관절염 치료와 관련해 환자별 '맞춤 치료'가 중요하다고 강조했다.그는 "대부분은 TNF-α 억제제를 1차 치료제로 우선 선택하지만, 환자에 따라 적합하지 않은 경우도 있다"며 "결핵 병력, 심부전 등 TNF-α 억제제 사용에 금기 요인이 있는 경우에는 다른 기전의 약제를 고려하게 된다"고 언급했다.결국 환자의 개별 상태와 위험 요인에 따라 최적의 약제를 선택하고, 필요시 교체 투여(switch)하는 전략이 중요하다는 것이다.끝으로 이 교수는 "치료제는 누구나 처방할 수 있지만, 고령화에 따른 합병증이나 동반 질환의 진행을 관리하고 부작용에 적절히 대처하는 데에는 전문 의료진의 경험과 지식이 필요할 것"이라며 "조기 치료를 통해 초기에 강력하게 염증을 차단하면 장기적으로 병이 재발하지 않고 관리될 수 있어, 빠른 치료를 통해 초기에 염증의 불씨를 끄는 것이 중요하다"고 덧붙였다.2025-07-01 06:00:01황병우 -
 PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대6편: 최초의 흡입형 PDE3/PDE4 이중 억제 COPD 치료제, 오투베어(Esifentrine)오투베어(Ohtuvayre& 9415;, OH-too-vare 성분명 엔시펜트린 흡입 현탁액, Esifentrine& 9415;, Verona Pharma)는 최초의 흡입용 PDE3/PDE4 효소 선택적 이중 억제제로서, 2024년 6월 미국 FDA에서 '성인 만성폐쇄성폐질환(chronic obstructive pulmonary disease, COPD) 환자의 유지요법제'에 승인되었으며, 유럽에서는 아직 승인되지 않았다. 현재 이 약제와 유사한 PDE4 억제제인 '닥사스(roflumilast)'는 '중증 COPD 환자의 급성 악화 빈도를 감소'에 승인된 약제로 미국 FDA 및 국내에서 소개되어 있다.이 약제는 기도와 폐 실질의 염증세포에서 cAMP 분해 효소인 PDE3 및 PDE4 효소를 선택적으로 억제함으로써, 기관지확장과 비스테로이드성 항염증 효과를 하나로 결합하여 높은 흡기 유속이나 복잡한 손-호흡 조정 없이 표준 제트 네블라이저를 통해 폐에 약물을 직접 전달되도록 설계되었다.이 cAMP 경로는 COPD의 병태 생리를 조절하는 내재적 항염증 기전으로 중요하게 작용하며, 이를 조절하는 약물학적 접근은 기존의 기관지 확장제나 흡입 스테로이드 기반 치료를 보완할 수 있는 새로운 치료 전략으로 자리매김하고 있다.오투베어의 미국 FDA 승인은 미국호흡기중환자 의학저널(American Journal of Respiratory and Critical Care Medicine)에 게재된 임상 3상 시험 ENHANCE의 결과를 포함한 광범위한 데이터를 기반으로 이뤄졌다.ENHANCE 임상시험에서 오투바이어는 단독요법으로 투여하거나 다른 유지요법과 함께 사용했을 때 폐 기능 개선을 포함한 임상적 이점을 제공한 것으로 입증되었다. 이는 중등도에서 중증의 COPD를 가지고 있는 광범위한 그룹에서 내약성이 우수하였다.오투바이어는 COPD 외에도 비-낭성섬유증 기관지확장증, 낭성섬유증, 천식, 기타 호흡기질환에 대한 치료제로 평가되고 있다. 또한 오투바이어와 지속성 항콜린제(LAMA)인 glycopyrrolate의 고정용량 복합제를 COPD 유지요법으로 개발 중이다.만성폐쇄성폐질환(Chronic obstructive pulmonary disease, COPD)은 어떤 질환인가? COPD는 기류 제한이 지속적으로 나타나는 진행성 호흡기 질환으로, 기도 및 폐 실질의 만성 염증과 그에 따른 폐기능 저하가 주요 병리학적 특징이다. 임상적으로는 호흡곤란, 만성 기침, 객담 등 다양한 증상이 발현되며, 반복적인 급성 악화는 삶의 질 저하뿐 아니라 사망률 증가와도 밀접하게 연관되어 있다. 전 세계적으로 COPD는 주요 사망 원인 중 하나로 보고되고 있으며, 고령화와 흡연율 증가에 따라 그 유병률은 지속적으로 상승하고 있다.COPD의 병태생리에는 대식세포(macrophages), 호중구(neutrophils), CD8+ T 림프구(cytotoxic T cells) 등 선천 및 후천 면역세포의 활성화가 중심적인 역할을 하며, 이들 면역세포는 다수의 염증 촉진성 사이토카인(IL-8, TNF-α 등), 프로테아제(matrix metalloproteinases), 그리고 활성산소종(reactive oxygen species)을 과도하게 분비한다. 이러한 염증 반응은 기도 리모델링, 점액 과분비, 폐포 구조의 파괴 및 폐 실질의 손상 등 병리적 변화를 유도하여 기류 제한을 지속시키는 주요 기전으로 작용한다.이러한 만성 염증 반응을 조절하기 위한 내재적 조절 기전 중 하나로 주목받는 것이 cyclic adenosine monophosphate(cAMP) 신호 전달 경로이다. cAMP는 adenylyl cyclase에 의해 생성되는 대표적인 이차 전령(second messenger)으로, 세포 내에서 protein kinase A(PKA) 및 Epac(Exchange Protein directly Activated by cAMP) 등의 하위 효과기를 통해 다양한 생리학적 반응을 매개한다.구체적으로, cAMP는 염증성 유전자 발현 억제, 항산화 반응 촉진, 섬모 운동 촉진, 점액 분비 감소 및 기관지 평활근의 이완 등을 유도함으로써 COPD 병태생리의 여러 측면을 동시에 조절할 수 있는 기능을 한다.그러나 COPD 환자에서는 염증세포 내에서 phosphodiesterase-4(PDE4)의 과발현으로 인해 cAMP가 병태적으로 분해되고, 그 농도가 비정상적으로 낮아지는 현상이 관찰된다. 이러한 기전은 항염 및 기관지 보호 효과를 저해하며, 결과적으로 만성 염증을 악화시키는 데 기여한다.Cyclic nucleotides(고리형 뉴클레오타이드)란 무엇인가? Cyclic nucleotides는 세포 내 신호전달 경로에서 이차 전령으로 작용하는 분자군으로, 다양한 생리학적 자극에 대한 세포 반응을 매개하는 데 중심적인 역할을 수행한다. 이들은 주로 ATP(adenosine triphosphate) 또는 GTP(guanosine triphosphate)로부터 유도되어 생성되며, 대표적인 형태로 cAMP(cyclic adenosine monophosphate)와 cGMP(cyclic guanosine monophosphate)가 있다.cAMP는 adenylyl cyclase(AC)의 촉매 작용에 의해 ATP로부터 생성되며, 이는 G 단백질 연결 수용체(G protein-coupled receptor, GPCR)의 활성화에 의해 유도된다. 이는반면, cGMP는 guanylyl cyclase(GC)에 의해 GTP로부터 유도되며, 이는 나트륨이뇨펩타이드(natriuretic peptides) 또는 산화질소(nitric oxide, NO)와 같은 세포외 신호에 의해 활성화된다. 이 두 경로는 상이한 생리적 자극과 수용체를 통해 선택적으로 작용하면서 세포 특이적 반응을 조절한다(Figure 1). 생성된 cAMP는 주로 PKA와 EPAC(exchange protein directly activated by cAMP, cAMP에 의해 직접 활성화되는 교환 단백질)을 통해 세포 기능을 조절한다. PKA는 대사 조절, 세포 분화, 증식, 생존 등 광범위한 생물학적 과정에 관여하며, EPAC은 integrin 매개 세포 부착, 세포 간 접합 형성, 분비(exocytosis), 인슐린 분비 등 PKA-비의존성 경로를 통해 다양한 세포 기능을 조절한다.특히, 세포 내 cAMP 농도가 상승하면 cAMP-의존성 PKA가 활성화된다. PKA는 두 개의 촉매 서브유닛(C)과 두 개의 조절 서브유닛(R)으로 이루어진 이종사량체(heterotetramer)로 구성되며, 평상시에는 비활성 상태로 존재한다. 그러다 cAMP가 R 서브유닛에 결합하면 촉매 서브유닛이 유리되어 다양한 표적 단백질을 인산화한다. 이 중 대표적인 인산화 표적은 CREB(cAMP response element binding protein)으로, 이는 대사 조절 및 세포 증식에 관여하는 유전자 발현을 조절하는 전사 인자이다.반면, 생성된 cGMP는 주로 PKG를 활성화시키며, 이는 세포 내 여러 표적 단백질을 인산화하여 평활근 수축 조절, 세포자멸사, 염증 반응, 시각 신호전달, 혈소판 응집 등 생리적 반응을 유도한다.이러한 cyclic nucleotide의 생물학적 활성을 종료시키는 주요 기전은 phosphodiesterase (PDE)에 의해 수행된다. PDE는 cAMP 및 cGMP를 각각 5’-AMP 또는 5’-GMP의 비고리형 형태로 분해함으로써 이차 전령 신호를 효과적으로 불활성화시킨다.cAMP 신호전달 경로는 어떤 역할을 하는가? cAMP는 1958년 Sutherland와 Rall에 의해 처음 발견된 이후, cAMP는 호르몬, 신경전달물질, 면역조절 인자 등 외부 자극에 의해 활성화되는 AC(adenyl cyclase)에 의해 ATP로부터 생성되는 고리형 뉴클레오타이드로 정의되었다.세포는 외부 환경으로부터의 자극에 신속하고 정밀하게 반응하기 위해 다양한 신호전달 시스템을 갖추고 있으며, 이에는 cAMP를 생성하는 AC가 존재한다. AC는 세포막에 존재하는 효소로, ATP를 cAMP로 전환하는 반응을 촉매하며, 이 과정은 GPCR의 활성화에 의해 주로 조절된다.GPCR은 세포막을 7회 통과하는 구조의 수용체로, 외부의 호르몬, 신경전달물질, 생리활성 분자 등의 리간드를 인식하여 이질삼합체 G 단백질(heterotrimeric G protein)을 활성화시킨다. 이때 GPCR은 Gs 단백과 결합하여 AC를 활성화하고, 이를 통해 세포 내 cAMP 생성을 유도한다. 반면 Gi 단백을 통해서는 AC 활성을 억제하여 cAMP 생성을 저해한다. 기도 조직에서 cAMP 농도의 증가는 평활근 이완과 염증 반응 억제를 유도하여, 천식을 포함한 폐쇄성 기도 질환의 병태생리 조절에 기여하는 것으로 알려져 있다.아울러, PKA는 세포 내 Ca²& 8314; 농도의 감소, Ca²& 8314;에 대한 민감도 저하, MLC 비의존 경로 조절 등 다양한 기전을 통해 기관지 확장 효과를 나타낸다. 또한, cAMP는 섬모 운동(ciliary motility)을 촉진하여 점액섬모 청소(mucociliary clearance)를 향상시키며, 이는 기도 내 분비물 제거와 염증 완화에 기여한다.이러한 이중 조절 메커니즘은 세포가 자극의 종류와 강도에 따라 cAMP 농도를 정밀하게 조절할 수 있게 하며, 하위 효과기인 PKA, EPAC 등을 통해 궁극적인 생리학적 반응으로 이어진다.cAMP 신호전달 경로의 특이성 및 세포 내 농도는 PDE에 의해 조절되며, PDE는 cAMP를 5’-AMP로 분해하여 신호를 종료시킨다. 특히 PDE4, PDE7, PDE8은 cAMP를 선택적으로 분해하는 isoform으로, 면역세포와 염증세포에 풍부하게 발현되어 있어 염증성 질환에서 중요한 조절 인자로 작용한다. 이에 따라 PDE4 억제제인 닥사스(roflumilast)는 cAMP 농도를 증가시켜 항염증 작용을 유도한다.따라서, cAMP 신호전달 경로는 외부 자극에 대한 세포의 신속하고 정밀한 반응을 유도하는 고차원적인 조절 기전이며, 그 구성 요소와 하위 경로를 표적으로 한 약리학적 개입은 염증성, 대사성, 심혈관성 질환을 포함한 다양한 병태에서 치료적 가능성을 제시한다.최근 연구들은 cAMP 의존성 신호전달 경로의 복잡성과 생물학적 중요성을 더욱 강조하고 있으며, 특히 기도 평활근(airway smooth muscle, ASM) 세포에서 β₂-아드레날린 수용체(β₂-adrenergic receptor, β₂AR)와 같은 GPCR의 활성이 이러한 경로를 중심으로 작동함이 밝혀졌다.Phosphodiesterase(PDE)는 무엇인가? PDE는 세포 내에서 cyclic nucleotide(cAMP 및 cGMP)의 3’,5’-고리형 인산 결합을 가수분해하여 각각 AMP(adenosine monophosphate) 또는 GTP(guanosine momophosphate)로 전환함으로써 이차 전령의 신호를 종료시키는 역할을 수행한다. PDE는 신호 전달의 시간적 지속성과 공간적 국소화, 그리고 신호의 강도 조절에 주요 생화학적 조절자(gatekeeper)로 기능하며, 이에 따라 다양한 생리 및 병리 현상의 미세 조절자로 작용한다.현재까지 확인된 PDE는 총 11개 계열(PDE1& 8211;PDE11)로 구성되며, 이들은 아미노산 서열, 기질 특이성, 약물 감수성, 조절 메커니즘 등의 차이에 따라 구분된다. 각 아형(family)은 서로 다른 조직 특이성 및 세포 내 소분획(localization)을 보이며, 동일한 기질(cAMP 또는 cGMP)에 작용하더라도 그 기능적 결과는 상이할 수 있다. 예를 들어, PDE4, PDE7, PDE8은 cAMP 특이적, PDE5, PDE6, PDE9는 cGMP 특이적, PDE1, PDE2, PDE3, PDE10, PDE11은 양쪽 기질 모두에 작용할 수 있다(Table 1). PDE의 활성 이상은 만성 염증성 질환, 심혈관 질환, 신경정신질환, 악성종양 등 다양한 질환의 병태생리와 밀접한 관련이 있으며, 특히 PDE3와 PDE4는 COPD와 같은 염증성 폐질환에서 병태생리학적 역할을 한다 .PDE3는 상대적으로 높은 cAMP 친화도를 가지며, PDE3A와 PDE3B의 두 아형으로 구분된다. PDE3A는 폐 상피세포, 혈관 내피세포, 기도 평활근세포(airway smooth muscle, ASM), 염증세포 등에서 발현되며, 특히 혈관 평활근세포에서 주요하게 존재하며 평활근 긴장도 조절에 관여한다. 반면, PDE3B는 지방세포, 간세포, 정자세포 등 대사 활성이 높은 조직뿐만 아니라 T세포 및 대식세포에서도 발현되어, 염증 반응 조절 및 대사 경로에 영향을 미친다.PDE4는 네 가지 유전자(PDE4A& 8211;D)와 다양한 스플라이싱 변이체로 구성되며, 호흡기계 조직을 포함한 다양한 기관에 광범위하게 분포한다. 특히 PDE4D는 인간 기도 평활근세포에서 cAMP 분해를 조절하는 주요 효소로 작용하며, PDE4 전체는 백혈구, 대식세포, 호중구 등 염증세포뿐 아니라 기도 상피세포 및 폐 신경계에도 발현되어 염증 반응의 조절자로 기능한다.임상 및 전임상 연구에 따르면, COPD 환자, 특히 흡연자에서 PDE4 발현이 유의하게 증가되어 있음이 보고되었으며, PDE4 억제를 통해 cAMP 농도를 증가시키는 것은 염증 촉진성 사이토카인의 발현 감소, 염증세포의 조직 내 침윤 억제 등 광범위한 항염증 효과를 유도하는 것으로 나타났다. 이러한 기전을 기반으로 PDE4 억제제 닥사스(roflumilast)는 ‘기관지확장제의 부가요법제로서, 증상악화 병력이 있고, 만성기관지염을 수반한 중증의 만성폐쇄성폐질환의 유지요법제’로 승인되어 있다.COPD에는 어떤 약제들을 사용하는가? COPD에 대한 약물 치료의 목적은 증상의 완화, 급성 악화의 예방, 신체활동 능력 향상 및 장기적인 예후 개선에 있다. 이에는 주로 흡입제에 기반하며, 기관지 확장제가 치료의 핵심이다.기관지확장제는 호흡기 질환에서 폐쇄된 기도를 확장시켜 기류를 개선하는 약제로, 천식과 COPD와 같은 기도 폐쇄성 질환에 사용된다. 이러한 약제는 기관지 평활근(bronchial smooth muscle)의 이완을 유도하여 기도 저항을 감소시키며, 환자의 증상을 완화하고 폐기능을 향상시키는 데 기여한다.기관지확장제는 작용 기전에 따라 크게 β2-아드레날린 수용체 작용제(β2-agonists), 항콜린제(Anticholinergics) 또는 무스카린 수용체 길항제(Muscarinic antagonists), 메틸잔틴계(Methylxanthines)가 있다.아울러 약물의 효과 및 부작용 등을 고려하여 흡입제를 주로 사용하며, 흡입기 종류는 크게 건조분말흡입기(dry power inhaler, DPI), 정량흡입기(metered dose inhaler, MDI)로 나뉘고, 다시 MDI는 가압 정량흡입기(pressurized metered dose inhaler, pMDI)와 연무형 흡입기(soft mist inhaler, SMI)로 나뉜다.pMDI는 다시 호흡 작동식 흡입기(breath-operated inhaler, BOI or breath-actuated inhale, BAI)와 비호흡 작동식 호흡기(Non-BOI)로 나뉘는데 호흡 작동식 흡입기는 아직 국내에 없다. 또한 분무기(nebulizer, 네불라이저)도 흡입제 치료에 속한다. 1) 베타-2 작용제(β2-agonists) β2-작용제는 기관지 평활근 세포에 발현된 β2-아드레날린 수용체에 선택적으로 결합하여 Gs 단백질을 통한 adenylyl cyclase 활성화, 이어지는 cAMP 농도 증가 및 PKA 활성화를 유도함으로써, 평활근 세포 내 칼슘 농도를 낮추고 근수축 관련 단백질들의 기능을 억제하여 기관지 확장을 유발한다. 또한 섬모운동 촉진 및 혈관 투과성 감소 등의 부수적 효과를 통해 기도 청소 기능 개선에도 기여할 수 있다.임상적으로 β2-작용제는 작용 시간에 따라 단시간 작용제(short-acting β2-agonists, SABA)와 장시간 작용제(long-acting β2-agonists, LABA)로 구분된다.SABA는 증상 완화를 위한 구제 치료(reliever therapy)로 사용되며, 대표적으로 살부타몰(Salbutamol)과 테르부탈린(Terbutaline)이 있다. SABA의 사용은 FEV1의 호전과 증상을 개선시킬 수 있다. SABA는 4-6시간 지속되고, LABA는 12시간 이상 지속되며, 규칙적인 LABA 사용을 하는 환자에서도 필요시 SABA 사용은 증상 완화에 도움이 될 수 있다.반면, LABA는 하루 12시간 이상 지속되는 작용시간을 가지며 천식의 유지 치료(controller therapy) 혹은 COPD의 증상 조절을 위한 병용 요법에 사용되며, 대표적으로 살메테롤(Salmeterol)과 포르모테롤(Formoterol)이 있다. 이들 약제는 폐기능과 삶의 질을 개선시키고 호흡곤란과 급성 악화와 입원의 빈도를 감소시키지만, 사망률이나 폐기능 감소 속도에는 영향을 주지 못한다.이 외에도 24시간 작용 지속 시간을 가진 초장시간 작용제(ultra-LABA)인 인다카테롤(Indacaterol), 올로다테롤(Olodaterol) 등이 COPD 치료에 활용되고 있다. 이들 약제는 호흡곤란과 악화위험을 감소시키고 삶의 질을 개선시킨다.이러한 β2-작용제는 그 효과의 빠른 발현과 우수한 증상 완화 효과로 인해 널리 사용되고 있으나, 단독 사용 시 특히 천식 환자에서 기도 염증을 충분히 조절하지 못하며 오히려 기전적 내성(tachyphylaxis)이나 염증 악화의 위험을 높일 수 있다는 우려도 제기되어 왔다. 이에 따라 ICS(흡입 스테로이드)와의 병용이 원칙이며, 한 기기 내 고정용량 복합제(FDC) 형태로 투여하는 방법이 표준화되고 있다.2) 항콜린제((Anticholinergics) 항콜린제는 기관지 평활근, 점액선, 혈관 등에 존재하는 무스카린 수용체(muscarinic receptor) 중 특히 M3 수용체에 선택적으로 작용하여, 아세틸콜린이 이 수용체에 결합하는 것을 차단함으로써 평활근 수축 및 점액 분비를 억제한다. 이로 인해 기도 저항이 감소하고 호흡 증상이 완화되며, COPD 환자의 폐기능 개선과 급성 악화 빈도 감소에 기여한다.항콜린제는 작용 지속 시간에 따라 단시간 작용 항무스카린제(short-acting muscarinic antagonists, SAMA)와 장시간 작용 항무스카린제(long-acting muscarinic antagonists, LAMA)로 분류된다.SAMA는 주로 단기 증상 완화에 사용되며, 대표적으로이프라트로피움(Ipratropium)와 옥시트로피움(Oxitropium)이 있다. 이들 약제는 M3 비선택적 억제로, 억제성 신경 수용체인 M2를 차단함으로써 잠재적으로 미주신경을 통해 기관지 수축을 유발시킬 수 있다.LAMA는 하루 1회 또는 2회 흡입으로 지속적인 기도 확장을 유지할 수 있어 COPD 유지 치료의 핵심 약제로 사용된다. 대표적으로 티오트로피움(Tiotropium), 글리코피로니움(Glycopyrronium), 우메클리디늄(Umeclidinium) 등이 있다. 이들 약제는 M3 선택적 억제로, M3 무스카린성 수용체에 대한 장시간의 결합 및 M2 무스카린성 수용체와의 빠른 해리를 통해 기관지 확장제의 효과 지속 시간을 연장시킨다.항콜린제는 β2-작용제와 병용할 경우 상호 보완적인 기전으로 기관지 확장 효과가 증대되며, 특히 COPD 환자에서는 LAMA + LABA 병용요법이 임상적으로 우월한 효과를 보인다.항콜린제는 흡입 제형으로 투여 시 전신 흡수가 거의 없어 안전성이 높고, 주요 부작용은 구강건조, 쓴맛, 드물게 요폐 등의 국소적 반응에 국한된다. 이로 인해 장기적인 유지 요법에 적합한 약제로 간주된다.3) 흡입스테로이드제(Inhaled corticosteroid, ICS) ICS는 합성된 글루코코르티코이드 계열 약제로, 폐로 직접 흡입되어 작용함으로써 전신 노출을 최소화하면서 강력한 항염 작용을 발휘한다. 세포 내 글루코코르티코이드 수용체(glucocorticoid receptor, GR)와 결합한 후 전사조절인자(transcriptional regulator)로 기능하여, 염증 유전자 발현을 억제하고 항염증 단백질 생성을 유도한다.특히 NF-κB, AP-1 등 주요 염증 촉진성 전사인자의 활성을 차단함으로써 IL-4, IL-5, IL-13 등 Th2 관련 사이토카인의 생성을 억제하며, 호산구(eosinophil) 및 비만세포(mast cell)의 기도 내 침윤과 활성을 감소시킨다.이러한 작용기전은 기관지 평활근의 수축성을 저하시켜 기도 과민 반응을 감소시키고, 상피세포의 장벽 기능 회복과 점액선의 과활성 억제를 통해 전반적인 기도 염증 조절에 기여한다.ICS는 흡입제 형태로 국소적으로 투여되어 전신 부작용을 최소화하면서 장기간 안전하게 사용 가능하다는 점에서 ICS는 천식 치료에 있어 핵심적인 치료제로 간주된다. 이는 단독 사용뿐 아니라 LABA 또는 LAMA와의 병용 요법이 표준화되었다.4) Phosphodiesterase-4(PDE4) 억제제 PDE4 억제제는 cAMP의 대사를 억제하여 세포내 cAMP 농도를 높이는데 이는 항 염증 효과를 나타내고 또한 호중구의 이동과 화학 주성을 억제하는 효과도 있다. 로플밀라스트(Roflumilast)는 선택적인 PDE4 억제제 중의 하나로 가래 호중구와 호산구를 감소키는 항염증 작용이 확인되어 PDE4억제제 중 COPD 치료제로 허가 받은 유일한 약제이다. 하루 한번 복용하는 경구용 약제로 기관지 확장제가 아니지만 FEV1과 삶의 질 향상효과가 있다.따라서, 단기간 작용시간을 가지는 SABA와 SAMA는 주로 증상이 갑자기 악화될 때 사용되며, LABA와 LAMA는 유지 치료의 중심으로 사용된다.5) 병용요법 이러한 약제들은 단독 혹은 병합 요법으로 사용되며, 특히 증상이 지속되거나 급성 악화가 반복되는 환자에서는 2제 요법(LABA + LAMA) 또는 ICS를 포함한 3제 요법(ICS + LABA + LAMA)이 권고된다.6) PDE4 억제제 PDE4 억제제는 흡입 치료 외에도 일부 환자에서는 경구용 약제가 보조적으로 사용된다. PDE4 억제제인 로플루밀라스트(roflumilast)는 만성 기관지염 양상을 보이며 급성 악화가 잦은 중증 환자에게 효과적이다. 또한 급성 악화 시에는 경구 스테로이드 및 항생제가 단기간 사용되며, 병원성 감염의 가능성을 고려해 적절히 투여된다.기관지 확장제는 어떤 약제인가? 기도 저항(Airway resistance)의 감소는 기도 자체의 내재적(intrinsic) 요인과 외재적(extrinsic) 요인 모두에 의해 조절되며, 그 주요 기전으로는 평활근 이완, 기관 및 세기관지 벽의 염증 감소, 기도 분비물의 감소 등이 있다.이 중 기도 평활근의 이완은 기관지 확장을 유도하기 위한 핵심 기전으로, 이는 두 가지 주요 약리학적 접근법을 통해 달성될 수 있다. β2-아드레날린 수용체(β2-AR)를 자극하는 β2-작용제(β2-agonist)의 직접적인 작용과 무스카린 수용체를 차단하여 아세틸콜린 신호 전달을 억제하는 항콜린제(antimuscarinic)의 간접적인 작용이다(Figure 2). 먼저, β2-작용제는 기도 평활근 세포, 특히 소기도(small airway)에 존재하는 β2-AR에 직접 결합함으로써 작용한다. 이 결합은 평활근 세포 내에서 AC(adenyl cyclase)를 활성화시켜 ATP로부터 cAMP가 생성시킨다.생성된 cAMP는 두 가지 주요 하위 효과기를 활성화시킨다. 이때 PKA는 평활근 긴장을 조절하는 단백질들을 인산화하여 이완을 유도하고, Epac는 PKA와는 독립적으로 평활근 이완을 유도한다. 또한, cAMP는 세포 내 칼슘을 격리(sequestration)함으로써 추가적으로 수축을 억제하고 평활근 이완을 촉진한다.다음, 항콜린제는 수축 작용을 하는 아세틸콜린(ACh)의 수용체 결합을 경쟁적으로 차단함으로써 간접적으로 평활근 이완을 유도한다. 기도 내 부교감신경 활성은 주로 M1 및 M3 무스카린 수용체를 통해 매개되며, 이들 수용체는 평활근 수축, 점액 분비, 섬모운동 증가를 유도한다. 반면, M2 수용체는 시냅스 전 말단에서 ACh의 방출을 억제하여 음성 되먹임 조절을 수행한다.COPD에서는 특히 콜린성 기도 긴장(cholinergic bronchomotor tone)이 병태생리에 중요한 역할을 하며, 기도 수축 및 점액 과다분비를 통해 기도 폐쇄를 악화시킨다. β2-작용제는 모든 기도 수준, 특히 COPD에 관여하는 소기도의 평활근 세포 표면의 β2-AR에 결합하여 작용한다. 반면, 무스카린 수용체 길항제는 기도 평활근의 M3 수용체를 차단함으로써 수축을 방지한다.비록 소기도에는 미주신경의 직접적인 분포가 부족하지만, COPD와 같은 질환에서는 비신경원성(non-neuronal) 아세틸콜린에 의해 무스카린 수용체가 활성화되는 것으로 알려져 있다. 따라서 항콜린제(무스카린 수용체 길항제)는 대기도와 소기도 모두에서 확장 효과를 나타낼 수 있다.따라서, β2-작용제와 항콜린제와의 복합요법(combination therapy)은 단독요법보다 기도 전 구간에 걸쳐 더 강력한 기관지 확장 효과를 제공할 수 있으며, 각 약물에 대한 환자 간(inter-patient) 및 환자 내(intra-patient) 반응의 이질성을 극복하는 데도 도움을 줄 수 있다. 나아가, 두 기전이 결합된 병용요법은 단순한 약물 투여 방식과 함께 신체활동 내성 증가, 일상 활동 수행 능력 향상, 삶의 질 개선에도 긍정적인 영향을 미친다.PDE 억제제에는 어떤 약제들이 있는가? PDE 억제제는 세포 내 cAMP 및 cGMP의 분해를 억제함으로써 해당 이차 전령의 농도를 증가시키고, 다양한 하위 신호경로인 PKA, PKG, EPAC, 이온 채널 등을 활성화시켜 생리적 반응을 조절한다.이러한 작용은 단일 경로에 국한되지 않고 염증, 혈류역학, 대사, 면역 및 신경전달 등 다양한 체계에 걸쳐 조절 효과를 나타내며, 이에 따라 PDE 억제제는 다기능성 치료 플랫폼으로 진화하고 있다.COPD에서는 PDE 억제를 통해 기도 평활근 이완 및 항염증 효과를 유도하는 치료 전략이 오래전부터 탐색되어 왔다.대표적으로 methylxanthine 계의 테오필린(Theophylline)은 비선택적 PDE 억제제(non-selective phosphodiesterase inhibitor) 로 기관지 확장 작용 외에 횡격막 근력 강화, 기관지 섬모운동 개선과 심박출량을 증가시키는 효과가 있다. 이러한 작용으로 인해 천식 및 COPD 치료에 오랫동안 사용되었으나, 치료역이 좁고 심혈관계 및 중추신경계 부작용이 자주 동반되어 임상 활용에 제한이 있다. 따라서 기관지확장 효과가 약해 흡입 기관지확장제 약물을 사용할 수 없는 상황에서만 제한적으로 사용한다.이에 따라 초기에 개발된 PDE4 선택적 억제제인 롤리프람(Rolipram)은 T 세포 및 대식세포에서의 cAMP 증가를 통해 염증성 사이토카인 분비를 억제하는 기전을 보였으나, 심각한 위장관계 부작용으로 인해 임상 개발이 중단되었다.이후 개발된 로플루밀라스트(Roflumilast)는 위장관계 부작용을 줄인 개선된 PDE4 억제제로, 2010년 미국 FDA에서 “기관지확장제 병용요법으로서, 급성 악화 병력이 있고 만성 기관지염을 수반한 중증 COPD 환자의 유지 치료” 적응증으로 승인되었으며, 유럽 EMA와 국내에도 승인을 받았다.전임상 연구에 따르면, 로플루밀라스트는 기관지 상피세포에서 글루코코르티코이드 수용체 α(GRα)의 전사활성을 증가시키고, 이는 덱사메타손(dexamethasone)의 항염 효과를 GRα 의존적으로 증강시키는 것으로 나타났다. 그러나 여전히 위장 불편감, 체중 감소 등의 부작용이 빈번히 보고되어, 국제 GOLD 가이드라인에서는 LABA, LAMA, ICS를 병용함에도 악화를 반복하는 환자에 한해 3차 치료제(third-line agent)로 제한적 사용을 권고하고 있다.한편, PDE3 역시 평활근세포에서 발현되어 기관지 수축성 조절에 관여하는데, PDE3 억제는 기관지 이완 효과를 유도한다.이에 따라 PDE3 및 PDE4를 동시에 억제함으로써 기관지 확장과 항염 작용을 동시에 달성하려는 전략이 제시되었다. 실제로 전임상 연구에서는 이중 억제제가 단일 억제제보다 더 우수하거나, 상가적 효과를 유도함을 입증한 바 있다.이러한 기전을 기반으로 최근 개발된 엔시펜트린(Ensifentrine)은 PDE3와 PDE4를 모두 억제하는 이중 작용 흡입제로, 기도 평활근 이완과 염증 반응 억제를 병행하는 새로운 기전의 약제가 개발되었다.엔시펜트린(Ensifentrine)는 어떤 약제인가? 엔시펜트린(Ensifentrine, 제품명 : 오투바이어 흡입 현탁액, Ohtuvayre& 9415;)은 PDE3/PDE4 이중 억제제로, 2024년 6월에 미국 FDA로부터 COPD 유지 치료제로 승인되었다. 이는 기관지 수축 및 염증 반응을 동시에 표적으로 삼는 새로운 치료 옵션으로, 기존의 PDE 억제제보다 내약성 및 효능 면에서 개선된 특성을 나타낸다.엔시펜트린의 기본 구조(parent molecule)는 trequinsin으로, 이는 다른 PDE 억제제들에 비해 기도 평활근에서 지속적인 기관지 확장 효과를 나타내며, 중간 수준의 PDE3 억제력과 약한 PDE4 억제력을 가진다.엔시펜트린은 흡입 현탁액(inhalation suspension) 제제로 Jet nebulizer를 ㅛㅏ용하는 기관지 확장제 및 항염증제이다. Jet nebulizer는 호흡기 약물 전달을 위한 대표적인 흡입 장치로, 압축 공기를 이용한 벤츄리(Venturi) 효과를 기반으로 액상 약물을 미세한 에어로졸 입자로 변환시키는 기전으로 작동한다. 이 장치는 폐 말단부위까지 약물을 직접 도달시키는 능력으로 인해 특히 COPD이나 급성 호흡곤란 환자에게 유용하며, 고령 환자, 소아, 또는 기도 협착 환자와 같이 흡입 조절이 어려운 대상군에게 효과적인 약물 전달 수단이라고 할 수 있다.엔시펜트린의 기관지 확장과 항염증 효과는 알레르기성 기관지 수축이 유도된 기니피그 모델 연구에서 기관지 폐포 세척액 및 비강 내 염증세포 침윤을 유의하게 감소시키는 효과가 확인되었다. 또한 항원 유도로 인한 호산구 이동은 흡입형 엔시펜트린 전처리 시 80% 이상 억제되었다.또한, 시험관 내 연구(in vitro)에서 낭성섬유증 전도 조절 단백(CFTR)을 자극하는 효과가 확인되었으며, 이는 기도의 점액섬모 청소 기능(mucociliary clearance)을 개선할 가능성을 보여주었다.엔시트린 허가사항 중 WARNINGS AND PRECAUTIONS에서 다음과 같이 안내하고 있다. 엔시펜트린 투여를 시작하기 전에, 의료진은 우울증 및/또는 자살 생각 또는 행동의 병력이 있는 환자에게서 엔시펜트린 치료의 이점과 위험을 신중히 평가해야 한다. 환자, 보호자 및 가족에게는 불면, 불안, 우울감, 자살 충동 또는 기타 기분 변화의 발생 또는 악화 여부를 주의 깊게 관찰할 필요성이 있음을 안내하고, 이러한 변화가 나타날 경우 즉시 의료진에게 연락할 것을 권고해야 한다. 이와 같은 사건이 발생한 경우, 의료진은 엔시펜트린 치료의 지속 여부에 대해 신중히 재평가해야 한다.엔시펜트린 치료는 정신과적 이상반응 증가와 관련이 있다. 임상시험에서 엔시펜트린를 투여받은 환자 중 자살 관련 이상반응이 보고되었으며, 그 중 자살 시도 1건 및 자살 사례 1건이 포함되었다. 또한, 통합된 24주 안전성 평가 인구집단에서 가장 흔하게 보고된 정신과적 이상반응은 다음과 같다:불면증은 엔시펜트린 3mg 투여군 6명(0.6%), 위약군 2명(0.3%)이었고, 불안은 엔시펜트린 3mg 투여군 2명(0.2%), 위약군 1명(0.2%)이었다. 우울 관련 반응(우울증, 주요우울증, 우울 기분을 동반한 적응장애 포함)은 엔시펜트린를 투여받은 환자 4명(0.4%)에서 발생하였으며, 위약 투여군에서는 보고되지 않았다.엔시펜트린의 약리 기전은? 엔시펜트린은 PDE3와 PDE4를 동시에 억제하는 이중 억제제로, 이러한 신호전달 경로의 조절을 통해 치료 효과를 유도하는 새로운 흡입형 저분자 약물이다. PDE3는 주로 cAMP를 가수분해하지만, cGMP도 기질로 사용할 수 있는 특성을 지니며, PDE4는 cAMP에 특이적으로 작용하는 효소이다.따라서 두 PDE를 동시에 억제함으로써 세포 내 cAMP 및 cGMP 농도가 모두 상승하게 되고, 이는 기도 평활근 이완, 항염작용, 점액 분비 감소 및 섬모 기능 강화 등 복합적인 생리학적 효과를 유도한다(Figure 3).특히 PDE3와 PDE4는 기도 평활근, 염증세포, 기관지 상피세포에 널리 발현되어 있어, 이들에 대한 동시 억제는 단일 PDE 억제보다 상승적 또는 시너지 효과를 유도할 수 있다. 이러한 작용 특성은 엔시펜트린이 기관지 확장, 기도 염증 조절, 점액섬모 청소 기능(mucociliary clearance)에 걸친 통합적 치료 효과를 발휘할 수 있다. 엔시펜트린(OHTUVAYRE& 9415;)의 허가 임상은 어떠한가? 엔시펜트의 유효성은 ENHANCE-1 및 ENHANCE-2의 24주간 무작위 배정, 이중눈가림, 위약 대조, 병렬군 임상시험을 통해 평가되었다. 이 두 연구에는 중등도에서 중증의 COPD를 가진 총 1,553명의 성인 환자가 등록되었다.ENHANCE-1에서는 763명의 환자가 등록되어 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 표준 제트 네불라이저를 통해 흡입하도록 배정되었다. 등록 시점에서 기관지 확장제 투여 후 예측 FEV1 평균은 52%(범위: 27~85%), FEV1/FVC 비율은 평균 0.52(범위: 0.22~0.71)였다. 또한, 전체 환자의 68%는 LAMA, LABA, 또는 LABA/ICS와 같은 병용 치료를 받고 있었으며, 각각 30%, 18%, 20%가 해당 약제를 사용하고 있었다.ENHANCE-2는 총 790명의 환자를 대상으로 동일한 방식으로 설계되었으며, 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 제트 네불라이저를 통해 하루 두 번 흡입하도록 배정하였다.등록 시점의 평균 예측 FEV1은 51%(범위: 23~81%)였고, FEV1/FVC 비율은 평균 0.52(범위: 0.24~0.71)였다. 이 연구에서도 55%의 환자가 병용 치료를 받고 있었으며, LAMA, LABA , LABA/ICS와 같이 병용 치료를 받고 있었으며, 각각 33%, 7%, 15%가 해당 약제를 사용하고 있었다.두 연구 모두에서 주요 평가변수였던 12주차 FEV₁의 시간-농도 곡선 면적(AUC& 8320;& 8211;12h)은 위약 대비 유의하게 개선되었다. ENHANCE-1 및 ENHANCE-2 연구에서는 모든 환자를 대상으로 베이스라인 시점과 12주차에 걸쳐 12시간 동안 연속 폐기능 검사(serial spirometry)가 수행되었다. ENHANCE-1의 12주차 연속 폐기능 검사 결과는 trough FEV1은 아침 투약 직전 마지막으로 측정된 FEV1 값으로 정의되었다.12주차 시점에서 위약 대비 평균 아침 trough FEV1의 개선치는 ENHANCE-1에서 35mL (95% 신뢰구간: 14, 68), ENHANCE-2에서는 49 mL(95% 신뢰구간: 19, 80)로 나타났으며, 이는 ENHANCE-1에서 통계적으로 유의하였으나, ENHANCE-2에서는 분석 단계(hierarchical testing) 상위 단계의 실패로 인해 통계적 유의성이 확보되지 않았다. St. George’s 호흡기 설문지(SGRQ)를 통해 두 시험에서 시행되었으며, SGRQ 반응률은 점수가 4점 이상 개선된 경우로 정의되었다. ENHANCE-1에서 24주차 시점의 SGRQ 반응률은 OHTUVAYRE 투여군에서 58.2%, 위약군에서 45.9%로 나타났고, 이에 대한 Odds Ratio는 1.49(95% CI: 1.07, 2.07)로 통계적 유의성이 있었다.반면, ENHANCE-2에서는 OHTUVAYRE 투여군의 반응률이 45.4%, 위약군이 50.3%였으며, Odds Ratio는 0.92(95% CI: 0.66, 1.29)로, 통계적 유의성은 나타나지 않았다.엔시펜트린의 예상되는 쟁점은 무엇인가? 현재까지의 COPD 치료 전략은 주로 기관지 확장제 및 항염증 흡입제에 기반하였으며, 증상 완화와 급성 악화의 예방을 목표로 했다.그러나 일부 환자에서는 기존 약물요법으로 충분한 치료 효과를 얻지 못하거나, 흡입기 사용에 대한 어려움으로 치료 순응도가 저하되는 문제가 지속적으로 제기되어 왔다.엔시펜트린은 이러한 한계를 극복하기 위해 개발된 약제로, PDE 3와 PDE4를 동시에 억제하는 최초의 흡입형 치료제이다. PDE3 억제를 통해 기관지 평활근을 이완시켜 기관지 확장 효과를 유도하고, PDE4 억제를 통해 염증세포에서의 사이토카인 분비 및 염증 반응을 억제함으로써 항염 효과를 나타낸다. 이러한 이중 작용은 단일 기전 약물에 비해 증상 개선 및 염증 조절에 있어 시너지 효과를 기대할 수 있다.엔시펜트린은 제트 네뷸라이저를 통해 투여되는 제형으로, 흡입기 사용이 어려운 고령 환자나 협조가 부족한 환자에게 유용한 대안이 될 수 있다. 또한 기존 유지 치료제(LABA, LAMA, ICS)와 병용 가능하며, 특히 기존 치료에 반응이 불충분한 환자에게 추가적인 임상적 혜택을 제공할 수 있다.다만, 단시간 작용성 기관지 확장제(SABA/SAMA)에 비해 작용 발현 속도가 느리기 때문에 급성 증상 완화에는 적합하지 않으며, 휴대성과 투여 시간(약 5& 8211;7분) 측면에서도 일상 생활에서 제한점이 존재한다.임상적으로는 두 건의 ENHANCE-1 및 ENHANCE-2 3상 무작위 위약 대조 시험을 통해 엔시펜트린의 유효성과 안전성이 평가되었다. ENHANCE-1에서는 폐기능 개선과 건강 관련 삶의 질 향상(예: SGRQ 점수)의 통계적 유의성이 입증되었으며, 탈락률도 낮아 근거 수준이 높은 연구로 간주된다. 반면 ENHANCE-2는 지역적 인구 구성의 차이 및 통계적 유의성 부족으로 인해 지원적 자료(supportive evidence)로 해석되었으며, 두 연구가 동일한 근거 수준으로 채택되지는 않았다.현재 엔시펜트린은 미국 FDA로부터 승인을 받았으나, 유럽 EMA에서는 정식 승인을 획득하지 못한 상태이다. 이와 같은 규제 환경은 약물의 글로벌 접근성 및 보급에 있어 중요한 장애가 되고 있다.결론적으로, 엔시펜트린은 기전적 이점을 바탕으로 기존 치료의 한계를 보완하고, 특정 환자군에서 치료 옵션의 다양성을 확대할 수 있는 약제로 평가된다. 향후 유럽 EMA 승인과 후속 임상 연구와 실제 임상에서의 사용 경험이 축적됨에 따라, 이중 PDE 억제제는 COPD 약물 치료의 새로운 전환점을 제시할 수 있을 것으로 기대해 본다.참고문헌 1. Isaac Levy et al. “Phosphodiesterase function and endocrine cells: links to human disease and roles in tumor development and treatment” Curr Opin Pharmacol. 2011;11(6):689& 8211;697. 2. Nardini et al. “COPD: maximization of bronchodilationMultidisciplinary Respiratory Medicine” 2014, 9:50. 3. James F Donohue et al. “Ensifentrine as a Novel, Inhaled Treatment for Patients with COPD“ International Journal of Chronic Obstructive Pulmonary Disease 2023:18. 4. Rinzhin T et al. “Advancing Obstructive Airway Disease Treatment: Dual PDE3/4 Inhibition as a Therapeutic Strategy“ Cells 2025, 14, 659. 5. Nicola A. Hanania, Bartolom& 233; R. Celli, ”Phosphodiesterase Inhibition as a Therapeutic Strategy for Chronic Obstructive Pulmonary Disease: Where We Have Been and What Lies Ahead“ Chronic Obstr Pulm Dis. 2025; 12(1): 82-92. 6. COPD 진료지침 대한결핵 및 호흡기학회 2024 개정. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-06-27 06:00:46최병철 박사
PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대6편: 최초의 흡입형 PDE3/PDE4 이중 억제 COPD 치료제, 오투베어(Esifentrine)오투베어(Ohtuvayre& 9415;, OH-too-vare 성분명 엔시펜트린 흡입 현탁액, Esifentrine& 9415;, Verona Pharma)는 최초의 흡입용 PDE3/PDE4 효소 선택적 이중 억제제로서, 2024년 6월 미국 FDA에서 '성인 만성폐쇄성폐질환(chronic obstructive pulmonary disease, COPD) 환자의 유지요법제'에 승인되었으며, 유럽에서는 아직 승인되지 않았다. 현재 이 약제와 유사한 PDE4 억제제인 '닥사스(roflumilast)'는 '중증 COPD 환자의 급성 악화 빈도를 감소'에 승인된 약제로 미국 FDA 및 국내에서 소개되어 있다.이 약제는 기도와 폐 실질의 염증세포에서 cAMP 분해 효소인 PDE3 및 PDE4 효소를 선택적으로 억제함으로써, 기관지확장과 비스테로이드성 항염증 효과를 하나로 결합하여 높은 흡기 유속이나 복잡한 손-호흡 조정 없이 표준 제트 네블라이저를 통해 폐에 약물을 직접 전달되도록 설계되었다.이 cAMP 경로는 COPD의 병태 생리를 조절하는 내재적 항염증 기전으로 중요하게 작용하며, 이를 조절하는 약물학적 접근은 기존의 기관지 확장제나 흡입 스테로이드 기반 치료를 보완할 수 있는 새로운 치료 전략으로 자리매김하고 있다.오투베어의 미국 FDA 승인은 미국호흡기중환자 의학저널(American Journal of Respiratory and Critical Care Medicine)에 게재된 임상 3상 시험 ENHANCE의 결과를 포함한 광범위한 데이터를 기반으로 이뤄졌다.ENHANCE 임상시험에서 오투바이어는 단독요법으로 투여하거나 다른 유지요법과 함께 사용했을 때 폐 기능 개선을 포함한 임상적 이점을 제공한 것으로 입증되었다. 이는 중등도에서 중증의 COPD를 가지고 있는 광범위한 그룹에서 내약성이 우수하였다.오투바이어는 COPD 외에도 비-낭성섬유증 기관지확장증, 낭성섬유증, 천식, 기타 호흡기질환에 대한 치료제로 평가되고 있다. 또한 오투바이어와 지속성 항콜린제(LAMA)인 glycopyrrolate의 고정용량 복합제를 COPD 유지요법으로 개발 중이다.만성폐쇄성폐질환(Chronic obstructive pulmonary disease, COPD)은 어떤 질환인가? COPD는 기류 제한이 지속적으로 나타나는 진행성 호흡기 질환으로, 기도 및 폐 실질의 만성 염증과 그에 따른 폐기능 저하가 주요 병리학적 특징이다. 임상적으로는 호흡곤란, 만성 기침, 객담 등 다양한 증상이 발현되며, 반복적인 급성 악화는 삶의 질 저하뿐 아니라 사망률 증가와도 밀접하게 연관되어 있다. 전 세계적으로 COPD는 주요 사망 원인 중 하나로 보고되고 있으며, 고령화와 흡연율 증가에 따라 그 유병률은 지속적으로 상승하고 있다.COPD의 병태생리에는 대식세포(macrophages), 호중구(neutrophils), CD8+ T 림프구(cytotoxic T cells) 등 선천 및 후천 면역세포의 활성화가 중심적인 역할을 하며, 이들 면역세포는 다수의 염증 촉진성 사이토카인(IL-8, TNF-α 등), 프로테아제(matrix metalloproteinases), 그리고 활성산소종(reactive oxygen species)을 과도하게 분비한다. 이러한 염증 반응은 기도 리모델링, 점액 과분비, 폐포 구조의 파괴 및 폐 실질의 손상 등 병리적 변화를 유도하여 기류 제한을 지속시키는 주요 기전으로 작용한다.이러한 만성 염증 반응을 조절하기 위한 내재적 조절 기전 중 하나로 주목받는 것이 cyclic adenosine monophosphate(cAMP) 신호 전달 경로이다. cAMP는 adenylyl cyclase에 의해 생성되는 대표적인 이차 전령(second messenger)으로, 세포 내에서 protein kinase A(PKA) 및 Epac(Exchange Protein directly Activated by cAMP) 등의 하위 효과기를 통해 다양한 생리학적 반응을 매개한다.구체적으로, cAMP는 염증성 유전자 발현 억제, 항산화 반응 촉진, 섬모 운동 촉진, 점액 분비 감소 및 기관지 평활근의 이완 등을 유도함으로써 COPD 병태생리의 여러 측면을 동시에 조절할 수 있는 기능을 한다.그러나 COPD 환자에서는 염증세포 내에서 phosphodiesterase-4(PDE4)의 과발현으로 인해 cAMP가 병태적으로 분해되고, 그 농도가 비정상적으로 낮아지는 현상이 관찰된다. 이러한 기전은 항염 및 기관지 보호 효과를 저해하며, 결과적으로 만성 염증을 악화시키는 데 기여한다.Cyclic nucleotides(고리형 뉴클레오타이드)란 무엇인가? Cyclic nucleotides는 세포 내 신호전달 경로에서 이차 전령으로 작용하는 분자군으로, 다양한 생리학적 자극에 대한 세포 반응을 매개하는 데 중심적인 역할을 수행한다. 이들은 주로 ATP(adenosine triphosphate) 또는 GTP(guanosine triphosphate)로부터 유도되어 생성되며, 대표적인 형태로 cAMP(cyclic adenosine monophosphate)와 cGMP(cyclic guanosine monophosphate)가 있다.cAMP는 adenylyl cyclase(AC)의 촉매 작용에 의해 ATP로부터 생성되며, 이는 G 단백질 연결 수용체(G protein-coupled receptor, GPCR)의 활성화에 의해 유도된다. 이는반면, cGMP는 guanylyl cyclase(GC)에 의해 GTP로부터 유도되며, 이는 나트륨이뇨펩타이드(natriuretic peptides) 또는 산화질소(nitric oxide, NO)와 같은 세포외 신호에 의해 활성화된다. 이 두 경로는 상이한 생리적 자극과 수용체를 통해 선택적으로 작용하면서 세포 특이적 반응을 조절한다(Figure 1). 생성된 cAMP는 주로 PKA와 EPAC(exchange protein directly activated by cAMP, cAMP에 의해 직접 활성화되는 교환 단백질)을 통해 세포 기능을 조절한다. PKA는 대사 조절, 세포 분화, 증식, 생존 등 광범위한 생물학적 과정에 관여하며, EPAC은 integrin 매개 세포 부착, 세포 간 접합 형성, 분비(exocytosis), 인슐린 분비 등 PKA-비의존성 경로를 통해 다양한 세포 기능을 조절한다.특히, 세포 내 cAMP 농도가 상승하면 cAMP-의존성 PKA가 활성화된다. PKA는 두 개의 촉매 서브유닛(C)과 두 개의 조절 서브유닛(R)으로 이루어진 이종사량체(heterotetramer)로 구성되며, 평상시에는 비활성 상태로 존재한다. 그러다 cAMP가 R 서브유닛에 결합하면 촉매 서브유닛이 유리되어 다양한 표적 단백질을 인산화한다. 이 중 대표적인 인산화 표적은 CREB(cAMP response element binding protein)으로, 이는 대사 조절 및 세포 증식에 관여하는 유전자 발현을 조절하는 전사 인자이다.반면, 생성된 cGMP는 주로 PKG를 활성화시키며, 이는 세포 내 여러 표적 단백질을 인산화하여 평활근 수축 조절, 세포자멸사, 염증 반응, 시각 신호전달, 혈소판 응집 등 생리적 반응을 유도한다.이러한 cyclic nucleotide의 생물학적 활성을 종료시키는 주요 기전은 phosphodiesterase (PDE)에 의해 수행된다. PDE는 cAMP 및 cGMP를 각각 5’-AMP 또는 5’-GMP의 비고리형 형태로 분해함으로써 이차 전령 신호를 효과적으로 불활성화시킨다.cAMP 신호전달 경로는 어떤 역할을 하는가? cAMP는 1958년 Sutherland와 Rall에 의해 처음 발견된 이후, cAMP는 호르몬, 신경전달물질, 면역조절 인자 등 외부 자극에 의해 활성화되는 AC(adenyl cyclase)에 의해 ATP로부터 생성되는 고리형 뉴클레오타이드로 정의되었다.세포는 외부 환경으로부터의 자극에 신속하고 정밀하게 반응하기 위해 다양한 신호전달 시스템을 갖추고 있으며, 이에는 cAMP를 생성하는 AC가 존재한다. AC는 세포막에 존재하는 효소로, ATP를 cAMP로 전환하는 반응을 촉매하며, 이 과정은 GPCR의 활성화에 의해 주로 조절된다.GPCR은 세포막을 7회 통과하는 구조의 수용체로, 외부의 호르몬, 신경전달물질, 생리활성 분자 등의 리간드를 인식하여 이질삼합체 G 단백질(heterotrimeric G protein)을 활성화시킨다. 이때 GPCR은 Gs 단백과 결합하여 AC를 활성화하고, 이를 통해 세포 내 cAMP 생성을 유도한다. 반면 Gi 단백을 통해서는 AC 활성을 억제하여 cAMP 생성을 저해한다. 기도 조직에서 cAMP 농도의 증가는 평활근 이완과 염증 반응 억제를 유도하여, 천식을 포함한 폐쇄성 기도 질환의 병태생리 조절에 기여하는 것으로 알려져 있다.아울러, PKA는 세포 내 Ca²& 8314; 농도의 감소, Ca²& 8314;에 대한 민감도 저하, MLC 비의존 경로 조절 등 다양한 기전을 통해 기관지 확장 효과를 나타낸다. 또한, cAMP는 섬모 운동(ciliary motility)을 촉진하여 점액섬모 청소(mucociliary clearance)를 향상시키며, 이는 기도 내 분비물 제거와 염증 완화에 기여한다.이러한 이중 조절 메커니즘은 세포가 자극의 종류와 강도에 따라 cAMP 농도를 정밀하게 조절할 수 있게 하며, 하위 효과기인 PKA, EPAC 등을 통해 궁극적인 생리학적 반응으로 이어진다.cAMP 신호전달 경로의 특이성 및 세포 내 농도는 PDE에 의해 조절되며, PDE는 cAMP를 5’-AMP로 분해하여 신호를 종료시킨다. 특히 PDE4, PDE7, PDE8은 cAMP를 선택적으로 분해하는 isoform으로, 면역세포와 염증세포에 풍부하게 발현되어 있어 염증성 질환에서 중요한 조절 인자로 작용한다. 이에 따라 PDE4 억제제인 닥사스(roflumilast)는 cAMP 농도를 증가시켜 항염증 작용을 유도한다.따라서, cAMP 신호전달 경로는 외부 자극에 대한 세포의 신속하고 정밀한 반응을 유도하는 고차원적인 조절 기전이며, 그 구성 요소와 하위 경로를 표적으로 한 약리학적 개입은 염증성, 대사성, 심혈관성 질환을 포함한 다양한 병태에서 치료적 가능성을 제시한다.최근 연구들은 cAMP 의존성 신호전달 경로의 복잡성과 생물학적 중요성을 더욱 강조하고 있으며, 특히 기도 평활근(airway smooth muscle, ASM) 세포에서 β₂-아드레날린 수용체(β₂-adrenergic receptor, β₂AR)와 같은 GPCR의 활성이 이러한 경로를 중심으로 작동함이 밝혀졌다.Phosphodiesterase(PDE)는 무엇인가? PDE는 세포 내에서 cyclic nucleotide(cAMP 및 cGMP)의 3’,5’-고리형 인산 결합을 가수분해하여 각각 AMP(adenosine monophosphate) 또는 GTP(guanosine momophosphate)로 전환함으로써 이차 전령의 신호를 종료시키는 역할을 수행한다. PDE는 신호 전달의 시간적 지속성과 공간적 국소화, 그리고 신호의 강도 조절에 주요 생화학적 조절자(gatekeeper)로 기능하며, 이에 따라 다양한 생리 및 병리 현상의 미세 조절자로 작용한다.현재까지 확인된 PDE는 총 11개 계열(PDE1& 8211;PDE11)로 구성되며, 이들은 아미노산 서열, 기질 특이성, 약물 감수성, 조절 메커니즘 등의 차이에 따라 구분된다. 각 아형(family)은 서로 다른 조직 특이성 및 세포 내 소분획(localization)을 보이며, 동일한 기질(cAMP 또는 cGMP)에 작용하더라도 그 기능적 결과는 상이할 수 있다. 예를 들어, PDE4, PDE7, PDE8은 cAMP 특이적, PDE5, PDE6, PDE9는 cGMP 특이적, PDE1, PDE2, PDE3, PDE10, PDE11은 양쪽 기질 모두에 작용할 수 있다(Table 1). PDE의 활성 이상은 만성 염증성 질환, 심혈관 질환, 신경정신질환, 악성종양 등 다양한 질환의 병태생리와 밀접한 관련이 있으며, 특히 PDE3와 PDE4는 COPD와 같은 염증성 폐질환에서 병태생리학적 역할을 한다 .PDE3는 상대적으로 높은 cAMP 친화도를 가지며, PDE3A와 PDE3B의 두 아형으로 구분된다. PDE3A는 폐 상피세포, 혈관 내피세포, 기도 평활근세포(airway smooth muscle, ASM), 염증세포 등에서 발현되며, 특히 혈관 평활근세포에서 주요하게 존재하며 평활근 긴장도 조절에 관여한다. 반면, PDE3B는 지방세포, 간세포, 정자세포 등 대사 활성이 높은 조직뿐만 아니라 T세포 및 대식세포에서도 발현되어, 염증 반응 조절 및 대사 경로에 영향을 미친다.PDE4는 네 가지 유전자(PDE4A& 8211;D)와 다양한 스플라이싱 변이체로 구성되며, 호흡기계 조직을 포함한 다양한 기관에 광범위하게 분포한다. 특히 PDE4D는 인간 기도 평활근세포에서 cAMP 분해를 조절하는 주요 효소로 작용하며, PDE4 전체는 백혈구, 대식세포, 호중구 등 염증세포뿐 아니라 기도 상피세포 및 폐 신경계에도 발현되어 염증 반응의 조절자로 기능한다.임상 및 전임상 연구에 따르면, COPD 환자, 특히 흡연자에서 PDE4 발현이 유의하게 증가되어 있음이 보고되었으며, PDE4 억제를 통해 cAMP 농도를 증가시키는 것은 염증 촉진성 사이토카인의 발현 감소, 염증세포의 조직 내 침윤 억제 등 광범위한 항염증 효과를 유도하는 것으로 나타났다. 이러한 기전을 기반으로 PDE4 억제제 닥사스(roflumilast)는 ‘기관지확장제의 부가요법제로서, 증상악화 병력이 있고, 만성기관지염을 수반한 중증의 만성폐쇄성폐질환의 유지요법제’로 승인되어 있다.COPD에는 어떤 약제들을 사용하는가? COPD에 대한 약물 치료의 목적은 증상의 완화, 급성 악화의 예방, 신체활동 능력 향상 및 장기적인 예후 개선에 있다. 이에는 주로 흡입제에 기반하며, 기관지 확장제가 치료의 핵심이다.기관지확장제는 호흡기 질환에서 폐쇄된 기도를 확장시켜 기류를 개선하는 약제로, 천식과 COPD와 같은 기도 폐쇄성 질환에 사용된다. 이러한 약제는 기관지 평활근(bronchial smooth muscle)의 이완을 유도하여 기도 저항을 감소시키며, 환자의 증상을 완화하고 폐기능을 향상시키는 데 기여한다.기관지확장제는 작용 기전에 따라 크게 β2-아드레날린 수용체 작용제(β2-agonists), 항콜린제(Anticholinergics) 또는 무스카린 수용체 길항제(Muscarinic antagonists), 메틸잔틴계(Methylxanthines)가 있다.아울러 약물의 효과 및 부작용 등을 고려하여 흡입제를 주로 사용하며, 흡입기 종류는 크게 건조분말흡입기(dry power inhaler, DPI), 정량흡입기(metered dose inhaler, MDI)로 나뉘고, 다시 MDI는 가압 정량흡입기(pressurized metered dose inhaler, pMDI)와 연무형 흡입기(soft mist inhaler, SMI)로 나뉜다.pMDI는 다시 호흡 작동식 흡입기(breath-operated inhaler, BOI or breath-actuated inhale, BAI)와 비호흡 작동식 호흡기(Non-BOI)로 나뉘는데 호흡 작동식 흡입기는 아직 국내에 없다. 또한 분무기(nebulizer, 네불라이저)도 흡입제 치료에 속한다. 1) 베타-2 작용제(β2-agonists) β2-작용제는 기관지 평활근 세포에 발현된 β2-아드레날린 수용체에 선택적으로 결합하여 Gs 단백질을 통한 adenylyl cyclase 활성화, 이어지는 cAMP 농도 증가 및 PKA 활성화를 유도함으로써, 평활근 세포 내 칼슘 농도를 낮추고 근수축 관련 단백질들의 기능을 억제하여 기관지 확장을 유발한다. 또한 섬모운동 촉진 및 혈관 투과성 감소 등의 부수적 효과를 통해 기도 청소 기능 개선에도 기여할 수 있다.임상적으로 β2-작용제는 작용 시간에 따라 단시간 작용제(short-acting β2-agonists, SABA)와 장시간 작용제(long-acting β2-agonists, LABA)로 구분된다.SABA는 증상 완화를 위한 구제 치료(reliever therapy)로 사용되며, 대표적으로 살부타몰(Salbutamol)과 테르부탈린(Terbutaline)이 있다. SABA의 사용은 FEV1의 호전과 증상을 개선시킬 수 있다. SABA는 4-6시간 지속되고, LABA는 12시간 이상 지속되며, 규칙적인 LABA 사용을 하는 환자에서도 필요시 SABA 사용은 증상 완화에 도움이 될 수 있다.반면, LABA는 하루 12시간 이상 지속되는 작용시간을 가지며 천식의 유지 치료(controller therapy) 혹은 COPD의 증상 조절을 위한 병용 요법에 사용되며, 대표적으로 살메테롤(Salmeterol)과 포르모테롤(Formoterol)이 있다. 이들 약제는 폐기능과 삶의 질을 개선시키고 호흡곤란과 급성 악화와 입원의 빈도를 감소시키지만, 사망률이나 폐기능 감소 속도에는 영향을 주지 못한다.이 외에도 24시간 작용 지속 시간을 가진 초장시간 작용제(ultra-LABA)인 인다카테롤(Indacaterol), 올로다테롤(Olodaterol) 등이 COPD 치료에 활용되고 있다. 이들 약제는 호흡곤란과 악화위험을 감소시키고 삶의 질을 개선시킨다.이러한 β2-작용제는 그 효과의 빠른 발현과 우수한 증상 완화 효과로 인해 널리 사용되고 있으나, 단독 사용 시 특히 천식 환자에서 기도 염증을 충분히 조절하지 못하며 오히려 기전적 내성(tachyphylaxis)이나 염증 악화의 위험을 높일 수 있다는 우려도 제기되어 왔다. 이에 따라 ICS(흡입 스테로이드)와의 병용이 원칙이며, 한 기기 내 고정용량 복합제(FDC) 형태로 투여하는 방법이 표준화되고 있다.2) 항콜린제((Anticholinergics) 항콜린제는 기관지 평활근, 점액선, 혈관 등에 존재하는 무스카린 수용체(muscarinic receptor) 중 특히 M3 수용체에 선택적으로 작용하여, 아세틸콜린이 이 수용체에 결합하는 것을 차단함으로써 평활근 수축 및 점액 분비를 억제한다. 이로 인해 기도 저항이 감소하고 호흡 증상이 완화되며, COPD 환자의 폐기능 개선과 급성 악화 빈도 감소에 기여한다.항콜린제는 작용 지속 시간에 따라 단시간 작용 항무스카린제(short-acting muscarinic antagonists, SAMA)와 장시간 작용 항무스카린제(long-acting muscarinic antagonists, LAMA)로 분류된다.SAMA는 주로 단기 증상 완화에 사용되며, 대표적으로이프라트로피움(Ipratropium)와 옥시트로피움(Oxitropium)이 있다. 이들 약제는 M3 비선택적 억제로, 억제성 신경 수용체인 M2를 차단함으로써 잠재적으로 미주신경을 통해 기관지 수축을 유발시킬 수 있다.LAMA는 하루 1회 또는 2회 흡입으로 지속적인 기도 확장을 유지할 수 있어 COPD 유지 치료의 핵심 약제로 사용된다. 대표적으로 티오트로피움(Tiotropium), 글리코피로니움(Glycopyrronium), 우메클리디늄(Umeclidinium) 등이 있다. 이들 약제는 M3 선택적 억제로, M3 무스카린성 수용체에 대한 장시간의 결합 및 M2 무스카린성 수용체와의 빠른 해리를 통해 기관지 확장제의 효과 지속 시간을 연장시킨다.항콜린제는 β2-작용제와 병용할 경우 상호 보완적인 기전으로 기관지 확장 효과가 증대되며, 특히 COPD 환자에서는 LAMA + LABA 병용요법이 임상적으로 우월한 효과를 보인다.항콜린제는 흡입 제형으로 투여 시 전신 흡수가 거의 없어 안전성이 높고, 주요 부작용은 구강건조, 쓴맛, 드물게 요폐 등의 국소적 반응에 국한된다. 이로 인해 장기적인 유지 요법에 적합한 약제로 간주된다.3) 흡입스테로이드제(Inhaled corticosteroid, ICS) ICS는 합성된 글루코코르티코이드 계열 약제로, 폐로 직접 흡입되어 작용함으로써 전신 노출을 최소화하면서 강력한 항염 작용을 발휘한다. 세포 내 글루코코르티코이드 수용체(glucocorticoid receptor, GR)와 결합한 후 전사조절인자(transcriptional regulator)로 기능하여, 염증 유전자 발현을 억제하고 항염증 단백질 생성을 유도한다.특히 NF-κB, AP-1 등 주요 염증 촉진성 전사인자의 활성을 차단함으로써 IL-4, IL-5, IL-13 등 Th2 관련 사이토카인의 생성을 억제하며, 호산구(eosinophil) 및 비만세포(mast cell)의 기도 내 침윤과 활성을 감소시킨다.이러한 작용기전은 기관지 평활근의 수축성을 저하시켜 기도 과민 반응을 감소시키고, 상피세포의 장벽 기능 회복과 점액선의 과활성 억제를 통해 전반적인 기도 염증 조절에 기여한다.ICS는 흡입제 형태로 국소적으로 투여되어 전신 부작용을 최소화하면서 장기간 안전하게 사용 가능하다는 점에서 ICS는 천식 치료에 있어 핵심적인 치료제로 간주된다. 이는 단독 사용뿐 아니라 LABA 또는 LAMA와의 병용 요법이 표준화되었다.4) Phosphodiesterase-4(PDE4) 억제제 PDE4 억제제는 cAMP의 대사를 억제하여 세포내 cAMP 농도를 높이는데 이는 항 염증 효과를 나타내고 또한 호중구의 이동과 화학 주성을 억제하는 효과도 있다. 로플밀라스트(Roflumilast)는 선택적인 PDE4 억제제 중의 하나로 가래 호중구와 호산구를 감소키는 항염증 작용이 확인되어 PDE4억제제 중 COPD 치료제로 허가 받은 유일한 약제이다. 하루 한번 복용하는 경구용 약제로 기관지 확장제가 아니지만 FEV1과 삶의 질 향상효과가 있다.따라서, 단기간 작용시간을 가지는 SABA와 SAMA는 주로 증상이 갑자기 악화될 때 사용되며, LABA와 LAMA는 유지 치료의 중심으로 사용된다.5) 병용요법 이러한 약제들은 단독 혹은 병합 요법으로 사용되며, 특히 증상이 지속되거나 급성 악화가 반복되는 환자에서는 2제 요법(LABA + LAMA) 또는 ICS를 포함한 3제 요법(ICS + LABA + LAMA)이 권고된다.6) PDE4 억제제 PDE4 억제제는 흡입 치료 외에도 일부 환자에서는 경구용 약제가 보조적으로 사용된다. PDE4 억제제인 로플루밀라스트(roflumilast)는 만성 기관지염 양상을 보이며 급성 악화가 잦은 중증 환자에게 효과적이다. 또한 급성 악화 시에는 경구 스테로이드 및 항생제가 단기간 사용되며, 병원성 감염의 가능성을 고려해 적절히 투여된다.기관지 확장제는 어떤 약제인가? 기도 저항(Airway resistance)의 감소는 기도 자체의 내재적(intrinsic) 요인과 외재적(extrinsic) 요인 모두에 의해 조절되며, 그 주요 기전으로는 평활근 이완, 기관 및 세기관지 벽의 염증 감소, 기도 분비물의 감소 등이 있다.이 중 기도 평활근의 이완은 기관지 확장을 유도하기 위한 핵심 기전으로, 이는 두 가지 주요 약리학적 접근법을 통해 달성될 수 있다. β2-아드레날린 수용체(β2-AR)를 자극하는 β2-작용제(β2-agonist)의 직접적인 작용과 무스카린 수용체를 차단하여 아세틸콜린 신호 전달을 억제하는 항콜린제(antimuscarinic)의 간접적인 작용이다(Figure 2). 먼저, β2-작용제는 기도 평활근 세포, 특히 소기도(small airway)에 존재하는 β2-AR에 직접 결합함으로써 작용한다. 이 결합은 평활근 세포 내에서 AC(adenyl cyclase)를 활성화시켜 ATP로부터 cAMP가 생성시킨다.생성된 cAMP는 두 가지 주요 하위 효과기를 활성화시킨다. 이때 PKA는 평활근 긴장을 조절하는 단백질들을 인산화하여 이완을 유도하고, Epac는 PKA와는 독립적으로 평활근 이완을 유도한다. 또한, cAMP는 세포 내 칼슘을 격리(sequestration)함으로써 추가적으로 수축을 억제하고 평활근 이완을 촉진한다.다음, 항콜린제는 수축 작용을 하는 아세틸콜린(ACh)의 수용체 결합을 경쟁적으로 차단함으로써 간접적으로 평활근 이완을 유도한다. 기도 내 부교감신경 활성은 주로 M1 및 M3 무스카린 수용체를 통해 매개되며, 이들 수용체는 평활근 수축, 점액 분비, 섬모운동 증가를 유도한다. 반면, M2 수용체는 시냅스 전 말단에서 ACh의 방출을 억제하여 음성 되먹임 조절을 수행한다.COPD에서는 특히 콜린성 기도 긴장(cholinergic bronchomotor tone)이 병태생리에 중요한 역할을 하며, 기도 수축 및 점액 과다분비를 통해 기도 폐쇄를 악화시킨다. β2-작용제는 모든 기도 수준, 특히 COPD에 관여하는 소기도의 평활근 세포 표면의 β2-AR에 결합하여 작용한다. 반면, 무스카린 수용체 길항제는 기도 평활근의 M3 수용체를 차단함으로써 수축을 방지한다.비록 소기도에는 미주신경의 직접적인 분포가 부족하지만, COPD와 같은 질환에서는 비신경원성(non-neuronal) 아세틸콜린에 의해 무스카린 수용체가 활성화되는 것으로 알려져 있다. 따라서 항콜린제(무스카린 수용체 길항제)는 대기도와 소기도 모두에서 확장 효과를 나타낼 수 있다.따라서, β2-작용제와 항콜린제와의 복합요법(combination therapy)은 단독요법보다 기도 전 구간에 걸쳐 더 강력한 기관지 확장 효과를 제공할 수 있으며, 각 약물에 대한 환자 간(inter-patient) 및 환자 내(intra-patient) 반응의 이질성을 극복하는 데도 도움을 줄 수 있다. 나아가, 두 기전이 결합된 병용요법은 단순한 약물 투여 방식과 함께 신체활동 내성 증가, 일상 활동 수행 능력 향상, 삶의 질 개선에도 긍정적인 영향을 미친다.PDE 억제제에는 어떤 약제들이 있는가? PDE 억제제는 세포 내 cAMP 및 cGMP의 분해를 억제함으로써 해당 이차 전령의 농도를 증가시키고, 다양한 하위 신호경로인 PKA, PKG, EPAC, 이온 채널 등을 활성화시켜 생리적 반응을 조절한다.이러한 작용은 단일 경로에 국한되지 않고 염증, 혈류역학, 대사, 면역 및 신경전달 등 다양한 체계에 걸쳐 조절 효과를 나타내며, 이에 따라 PDE 억제제는 다기능성 치료 플랫폼으로 진화하고 있다.COPD에서는 PDE 억제를 통해 기도 평활근 이완 및 항염증 효과를 유도하는 치료 전략이 오래전부터 탐색되어 왔다.대표적으로 methylxanthine 계의 테오필린(Theophylline)은 비선택적 PDE 억제제(non-selective phosphodiesterase inhibitor) 로 기관지 확장 작용 외에 횡격막 근력 강화, 기관지 섬모운동 개선과 심박출량을 증가시키는 효과가 있다. 이러한 작용으로 인해 천식 및 COPD 치료에 오랫동안 사용되었으나, 치료역이 좁고 심혈관계 및 중추신경계 부작용이 자주 동반되어 임상 활용에 제한이 있다. 따라서 기관지확장 효과가 약해 흡입 기관지확장제 약물을 사용할 수 없는 상황에서만 제한적으로 사용한다.이에 따라 초기에 개발된 PDE4 선택적 억제제인 롤리프람(Rolipram)은 T 세포 및 대식세포에서의 cAMP 증가를 통해 염증성 사이토카인 분비를 억제하는 기전을 보였으나, 심각한 위장관계 부작용으로 인해 임상 개발이 중단되었다.이후 개발된 로플루밀라스트(Roflumilast)는 위장관계 부작용을 줄인 개선된 PDE4 억제제로, 2010년 미국 FDA에서 “기관지확장제 병용요법으로서, 급성 악화 병력이 있고 만성 기관지염을 수반한 중증 COPD 환자의 유지 치료” 적응증으로 승인되었으며, 유럽 EMA와 국내에도 승인을 받았다.전임상 연구에 따르면, 로플루밀라스트는 기관지 상피세포에서 글루코코르티코이드 수용체 α(GRα)의 전사활성을 증가시키고, 이는 덱사메타손(dexamethasone)의 항염 효과를 GRα 의존적으로 증강시키는 것으로 나타났다. 그러나 여전히 위장 불편감, 체중 감소 등의 부작용이 빈번히 보고되어, 국제 GOLD 가이드라인에서는 LABA, LAMA, ICS를 병용함에도 악화를 반복하는 환자에 한해 3차 치료제(third-line agent)로 제한적 사용을 권고하고 있다.한편, PDE3 역시 평활근세포에서 발현되어 기관지 수축성 조절에 관여하는데, PDE3 억제는 기관지 이완 효과를 유도한다.이에 따라 PDE3 및 PDE4를 동시에 억제함으로써 기관지 확장과 항염 작용을 동시에 달성하려는 전략이 제시되었다. 실제로 전임상 연구에서는 이중 억제제가 단일 억제제보다 더 우수하거나, 상가적 효과를 유도함을 입증한 바 있다.이러한 기전을 기반으로 최근 개발된 엔시펜트린(Ensifentrine)은 PDE3와 PDE4를 모두 억제하는 이중 작용 흡입제로, 기도 평활근 이완과 염증 반응 억제를 병행하는 새로운 기전의 약제가 개발되었다.엔시펜트린(Ensifentrine)는 어떤 약제인가? 엔시펜트린(Ensifentrine, 제품명 : 오투바이어 흡입 현탁액, Ohtuvayre& 9415;)은 PDE3/PDE4 이중 억제제로, 2024년 6월에 미국 FDA로부터 COPD 유지 치료제로 승인되었다. 이는 기관지 수축 및 염증 반응을 동시에 표적으로 삼는 새로운 치료 옵션으로, 기존의 PDE 억제제보다 내약성 및 효능 면에서 개선된 특성을 나타낸다.엔시펜트린의 기본 구조(parent molecule)는 trequinsin으로, 이는 다른 PDE 억제제들에 비해 기도 평활근에서 지속적인 기관지 확장 효과를 나타내며, 중간 수준의 PDE3 억제력과 약한 PDE4 억제력을 가진다.엔시펜트린은 흡입 현탁액(inhalation suspension) 제제로 Jet nebulizer를 ㅛㅏ용하는 기관지 확장제 및 항염증제이다. Jet nebulizer는 호흡기 약물 전달을 위한 대표적인 흡입 장치로, 압축 공기를 이용한 벤츄리(Venturi) 효과를 기반으로 액상 약물을 미세한 에어로졸 입자로 변환시키는 기전으로 작동한다. 이 장치는 폐 말단부위까지 약물을 직접 도달시키는 능력으로 인해 특히 COPD이나 급성 호흡곤란 환자에게 유용하며, 고령 환자, 소아, 또는 기도 협착 환자와 같이 흡입 조절이 어려운 대상군에게 효과적인 약물 전달 수단이라고 할 수 있다.엔시펜트린의 기관지 확장과 항염증 효과는 알레르기성 기관지 수축이 유도된 기니피그 모델 연구에서 기관지 폐포 세척액 및 비강 내 염증세포 침윤을 유의하게 감소시키는 효과가 확인되었다. 또한 항원 유도로 인한 호산구 이동은 흡입형 엔시펜트린 전처리 시 80% 이상 억제되었다.또한, 시험관 내 연구(in vitro)에서 낭성섬유증 전도 조절 단백(CFTR)을 자극하는 효과가 확인되었으며, 이는 기도의 점액섬모 청소 기능(mucociliary clearance)을 개선할 가능성을 보여주었다.엔시트린 허가사항 중 WARNINGS AND PRECAUTIONS에서 다음과 같이 안내하고 있다. 엔시펜트린 투여를 시작하기 전에, 의료진은 우울증 및/또는 자살 생각 또는 행동의 병력이 있는 환자에게서 엔시펜트린 치료의 이점과 위험을 신중히 평가해야 한다. 환자, 보호자 및 가족에게는 불면, 불안, 우울감, 자살 충동 또는 기타 기분 변화의 발생 또는 악화 여부를 주의 깊게 관찰할 필요성이 있음을 안내하고, 이러한 변화가 나타날 경우 즉시 의료진에게 연락할 것을 권고해야 한다. 이와 같은 사건이 발생한 경우, 의료진은 엔시펜트린 치료의 지속 여부에 대해 신중히 재평가해야 한다.엔시펜트린 치료는 정신과적 이상반응 증가와 관련이 있다. 임상시험에서 엔시펜트린를 투여받은 환자 중 자살 관련 이상반응이 보고되었으며, 그 중 자살 시도 1건 및 자살 사례 1건이 포함되었다. 또한, 통합된 24주 안전성 평가 인구집단에서 가장 흔하게 보고된 정신과적 이상반응은 다음과 같다:불면증은 엔시펜트린 3mg 투여군 6명(0.6%), 위약군 2명(0.3%)이었고, 불안은 엔시펜트린 3mg 투여군 2명(0.2%), 위약군 1명(0.2%)이었다. 우울 관련 반응(우울증, 주요우울증, 우울 기분을 동반한 적응장애 포함)은 엔시펜트린를 투여받은 환자 4명(0.4%)에서 발생하였으며, 위약 투여군에서는 보고되지 않았다.엔시펜트린의 약리 기전은? 엔시펜트린은 PDE3와 PDE4를 동시에 억제하는 이중 억제제로, 이러한 신호전달 경로의 조절을 통해 치료 효과를 유도하는 새로운 흡입형 저분자 약물이다. PDE3는 주로 cAMP를 가수분해하지만, cGMP도 기질로 사용할 수 있는 특성을 지니며, PDE4는 cAMP에 특이적으로 작용하는 효소이다.따라서 두 PDE를 동시에 억제함으로써 세포 내 cAMP 및 cGMP 농도가 모두 상승하게 되고, 이는 기도 평활근 이완, 항염작용, 점액 분비 감소 및 섬모 기능 강화 등 복합적인 생리학적 효과를 유도한다(Figure 3).특히 PDE3와 PDE4는 기도 평활근, 염증세포, 기관지 상피세포에 널리 발현되어 있어, 이들에 대한 동시 억제는 단일 PDE 억제보다 상승적 또는 시너지 효과를 유도할 수 있다. 이러한 작용 특성은 엔시펜트린이 기관지 확장, 기도 염증 조절, 점액섬모 청소 기능(mucociliary clearance)에 걸친 통합적 치료 효과를 발휘할 수 있다. 엔시펜트린(OHTUVAYRE& 9415;)의 허가 임상은 어떠한가? 엔시펜트의 유효성은 ENHANCE-1 및 ENHANCE-2의 24주간 무작위 배정, 이중눈가림, 위약 대조, 병렬군 임상시험을 통해 평가되었다. 이 두 연구에는 중등도에서 중증의 COPD를 가진 총 1,553명의 성인 환자가 등록되었다.ENHANCE-1에서는 763명의 환자가 등록되어 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 표준 제트 네불라이저를 통해 흡입하도록 배정되었다. 등록 시점에서 기관지 확장제 투여 후 예측 FEV1 평균은 52%(범위: 27~85%), FEV1/FVC 비율은 평균 0.52(범위: 0.22~0.71)였다. 또한, 전체 환자의 68%는 LAMA, LABA, 또는 LABA/ICS와 같은 병용 치료를 받고 있었으며, 각각 30%, 18%, 20%가 해당 약제를 사용하고 있었다.ENHANCE-2는 총 790명의 환자를 대상으로 동일한 방식으로 설계되었으며, 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 제트 네불라이저를 통해 하루 두 번 흡입하도록 배정하였다.등록 시점의 평균 예측 FEV1은 51%(범위: 23~81%)였고, FEV1/FVC 비율은 평균 0.52(범위: 0.24~0.71)였다. 이 연구에서도 55%의 환자가 병용 치료를 받고 있었으며, LAMA, LABA , LABA/ICS와 같이 병용 치료를 받고 있었으며, 각각 33%, 7%, 15%가 해당 약제를 사용하고 있었다.두 연구 모두에서 주요 평가변수였던 12주차 FEV₁의 시간-농도 곡선 면적(AUC& 8320;& 8211;12h)은 위약 대비 유의하게 개선되었다. ENHANCE-1 및 ENHANCE-2 연구에서는 모든 환자를 대상으로 베이스라인 시점과 12주차에 걸쳐 12시간 동안 연속 폐기능 검사(serial spirometry)가 수행되었다. ENHANCE-1의 12주차 연속 폐기능 검사 결과는 trough FEV1은 아침 투약 직전 마지막으로 측정된 FEV1 값으로 정의되었다.12주차 시점에서 위약 대비 평균 아침 trough FEV1의 개선치는 ENHANCE-1에서 35mL (95% 신뢰구간: 14, 68), ENHANCE-2에서는 49 mL(95% 신뢰구간: 19, 80)로 나타났으며, 이는 ENHANCE-1에서 통계적으로 유의하였으나, ENHANCE-2에서는 분석 단계(hierarchical testing) 상위 단계의 실패로 인해 통계적 유의성이 확보되지 않았다. St. George’s 호흡기 설문지(SGRQ)를 통해 두 시험에서 시행되었으며, SGRQ 반응률은 점수가 4점 이상 개선된 경우로 정의되었다. ENHANCE-1에서 24주차 시점의 SGRQ 반응률은 OHTUVAYRE 투여군에서 58.2%, 위약군에서 45.9%로 나타났고, 이에 대한 Odds Ratio는 1.49(95% CI: 1.07, 2.07)로 통계적 유의성이 있었다.반면, ENHANCE-2에서는 OHTUVAYRE 투여군의 반응률이 45.4%, 위약군이 50.3%였으며, Odds Ratio는 0.92(95% CI: 0.66, 1.29)로, 통계적 유의성은 나타나지 않았다.엔시펜트린의 예상되는 쟁점은 무엇인가? 현재까지의 COPD 치료 전략은 주로 기관지 확장제 및 항염증 흡입제에 기반하였으며, 증상 완화와 급성 악화의 예방을 목표로 했다.그러나 일부 환자에서는 기존 약물요법으로 충분한 치료 효과를 얻지 못하거나, 흡입기 사용에 대한 어려움으로 치료 순응도가 저하되는 문제가 지속적으로 제기되어 왔다.엔시펜트린은 이러한 한계를 극복하기 위해 개발된 약제로, PDE 3와 PDE4를 동시에 억제하는 최초의 흡입형 치료제이다. PDE3 억제를 통해 기관지 평활근을 이완시켜 기관지 확장 효과를 유도하고, PDE4 억제를 통해 염증세포에서의 사이토카인 분비 및 염증 반응을 억제함으로써 항염 효과를 나타낸다. 이러한 이중 작용은 단일 기전 약물에 비해 증상 개선 및 염증 조절에 있어 시너지 효과를 기대할 수 있다.엔시펜트린은 제트 네뷸라이저를 통해 투여되는 제형으로, 흡입기 사용이 어려운 고령 환자나 협조가 부족한 환자에게 유용한 대안이 될 수 있다. 또한 기존 유지 치료제(LABA, LAMA, ICS)와 병용 가능하며, 특히 기존 치료에 반응이 불충분한 환자에게 추가적인 임상적 혜택을 제공할 수 있다.다만, 단시간 작용성 기관지 확장제(SABA/SAMA)에 비해 작용 발현 속도가 느리기 때문에 급성 증상 완화에는 적합하지 않으며, 휴대성과 투여 시간(약 5& 8211;7분) 측면에서도 일상 생활에서 제한점이 존재한다.임상적으로는 두 건의 ENHANCE-1 및 ENHANCE-2 3상 무작위 위약 대조 시험을 통해 엔시펜트린의 유효성과 안전성이 평가되었다. ENHANCE-1에서는 폐기능 개선과 건강 관련 삶의 질 향상(예: SGRQ 점수)의 통계적 유의성이 입증되었으며, 탈락률도 낮아 근거 수준이 높은 연구로 간주된다. 반면 ENHANCE-2는 지역적 인구 구성의 차이 및 통계적 유의성 부족으로 인해 지원적 자료(supportive evidence)로 해석되었으며, 두 연구가 동일한 근거 수준으로 채택되지는 않았다.현재 엔시펜트린은 미국 FDA로부터 승인을 받았으나, 유럽 EMA에서는 정식 승인을 획득하지 못한 상태이다. 이와 같은 규제 환경은 약물의 글로벌 접근성 및 보급에 있어 중요한 장애가 되고 있다.결론적으로, 엔시펜트린은 기전적 이점을 바탕으로 기존 치료의 한계를 보완하고, 특정 환자군에서 치료 옵션의 다양성을 확대할 수 있는 약제로 평가된다. 향후 유럽 EMA 승인과 후속 임상 연구와 실제 임상에서의 사용 경험이 축적됨에 따라, 이중 PDE 억제제는 COPD 약물 치료의 새로운 전환점을 제시할 수 있을 것으로 기대해 본다.참고문헌 1. Isaac Levy et al. “Phosphodiesterase function and endocrine cells: links to human disease and roles in tumor development and treatment” Curr Opin Pharmacol. 2011;11(6):689& 8211;697. 2. Nardini et al. “COPD: maximization of bronchodilationMultidisciplinary Respiratory Medicine” 2014, 9:50. 3. James F Donohue et al. “Ensifentrine as a Novel, Inhaled Treatment for Patients with COPD“ International Journal of Chronic Obstructive Pulmonary Disease 2023:18. 4. Rinzhin T et al. “Advancing Obstructive Airway Disease Treatment: Dual PDE3/4 Inhibition as a Therapeutic Strategy“ Cells 2025, 14, 659. 5. Nicola A. Hanania, Bartolom& 233; R. Celli, ”Phosphodiesterase Inhibition as a Therapeutic Strategy for Chronic Obstructive Pulmonary Disease: Where We Have Been and What Lies Ahead“ Chronic Obstr Pulm Dis. 2025; 12(1): 82-92. 6. COPD 진료지침 대한결핵 및 호흡기학회 2024 개정. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-06-27 06:00:46최병철 박사 -
 "강직성 척추염 치료 지형 변화…조기 진단이 열쇠"[데일리팜=황병우 기자] 강직성 척추염(Ankylosing spondylitis)은 과거 주로 젊은 남성에게 발생하는 질환으로 알려졌지만, 최근에는 여성이나 고령층에서도 진단율이 증가하는 추세다.질환에 대한 기존의 고정관념이 바뀌고 있으며, 다양한 연령에서 허리 통증 환자를 볼 때 강직성 척추염을 의심하는 적극적인 접근이 강조되고 있다.이원석 전주이지내과 원장데일리팜과 만난 이원석 전주이지내과 원장은 강직성 척추염 치료를 위한 조기 진단의 필요성과 장기적인 관리를 우선순위로 꼽았다.강직성 척추염은 만성 진행성 질환으로, 염증이 효과적으로 조절되지 않으면 척추 관절이 굳어져 운동 장애를 초래한다.이 원장은 "강직성 척추염이 젊은 남성에서 호발하는 건 맞지만 여성 환자나 고연령 환자에서 유병률과 진단율이 올라가는 상황"이라며 "질환 인식 개선과 홍보로 다양한 연령의 환자들이 병원을 찾아 염증성 요통에 대한 검사를 받기 시작한 결과"라고 설명했다.또 그는 "나이가 많은 환자의 허리 통증도 단순 노화로 치부되어 진단이 늦어지는 경우가 있다"면서 "아침에 뻣뻣하고 움직이면 호전되는 전형적인 염증성 요통 양상이 보인다면 강직성 척추염을 꼭 염두에 둬야 한다"고 말했다.결국 강직성 척추염을 초기에 발견해 적절히 치료하면 척추의 강직 진행을 늦추고 합병증을 예방할 수 있어 조기 진단이 강조되고 있다.이 원장은 "여전히 일부 의료진과 환자들은 강직성 척추염의 치료법이 마땅치 않다고 오해하거나, 소염진통제만으로 버티다가 전문 진료 시점을 놓치는 경우가 있다"며 "아침 강직 등 증상이 일반 요통과 다르다고 느껴지면 천장관절 X선을 촬영해 강직성 척추염 여부를 확인해보는 노력이 필요하다"고 전했다.실제 일부 강직성 척추염 환자의 경우 디스크나 협착증 치료에만 집중해 염증성 요통을 간과하면 진단이 늦어지기 쉽다는 게 이 원장의 의견.이 경우 척추 외 증상으로 포도막염이나 염증성 장질환, 건선 피부염 등이 동반되는 일도 있어, 관련 증상을 함께 문진하는 것이 조기 진단에 도움이 된다고 강조했다.강직성 척추염 치료에 있어 비약물적 치료, 특히 운동 요법의 중요성은 오래전부터 강조됐다.이 원장은 "모든 만성질환에서 운동이 중요하듯 강직성 척추염에서도 운동 치료는 기본이다. 환자들에게 규칙적으로 운동하는 생활습관을 들이도록 교육하는 것이 치료의 출발점"이라고 강조했다.젊은 환자와 고령 환자에 따라 운동에 대한 접근법이 다를 수 있지만, 핵심은 본인이 지속할 수 있는 운동을 매일 습관화가 필요하다는 의미다.그는 "운동 종류는 무엇이든 상관없으며, 본인이 재미있게 꾸준히 할 수 있는 운동을 찾는 게 중요하다"며 "하루 20~30분 정도 스트레칭을 포함한 코어 운동을 매일 하는 것을 권장한다. 중요한 건 특정 운동법보다 매일 하는 습관"이라고 조언했다."JAK 억제제 등장 치료 무기 다변화 의미"하지만 운동만으로 모든 질환이 치료하는 것이 불가능한 만큼 약물치료도 병행된다. NSAIDs(비스테로이드소염제)가 통증과 뻣뻣함 완화를 위한 1차 치료로 권고되며, 증상 조절이 어려운 경우 생물학적 제제와 JAK억제제 등의 치료제를 사용하게 된다.이 원장은 "JAK 억제제는 기존 TNF 억제제 등에 반응하지 않거나 내성이 생긴 환자에게 효과적이다"며 "기존 bDMARD 치료에 실패한 환자가 JAK 억제제로 넘어와 호전을 보였다"고 말했다.TNF-α 억제제 등 생물학제제는 효과가 뛰어나 많은 환자에서 1차 약제로 사용돼왔지만, 장기적으로 항체 형성으로 인한 약효 소실 문제가 있다.이 원장은 "JAK 억제제는 장기간 사용해도 항체가 생기지 않는 장점이 있다"며 "류마티스 관절염에서 10년 가까운 장기 데이터를 통해 안전성이 확인된 만큼, 강직성 척추염 분야에서도 강력한 새로운 치료 옵션이 하나 생긴 셈"이라고 평가했다.다만 현재 국내 보험 기준상 JAK 억제제는 2차 치료제로 분류되어 TNF 억제제 등 기존 요법에 실패한 경우에만 사용할 수 있다.그는 "지금은 TNF 억제제가 치료의 중심을 차지하고 있고, 당분간은 이러한 보수적 치료 전환이 이어지겠지만, 경구제라는 편의성과 우수한 효과에 대한 데이터가 쌓이면 향후 치료 패턴이 달라질 수도 있다"고 전망했다.실제 류마티스 관절염에서는 JAK 억제제가 처음엔 2차 약제로 도입되었다가 점차 1차 치료제 수준으로 활용도가 높아진 바 있다. 강직성 척추염 분야에서도 임상 근거 축적에 따라 장기적으로 1차 약제로 격상될 가능성이 있을 것으로 예측된다.강직성 척추염 치료에 신약이 속속 도입되면서 환자들의 치료 접근성도 개선되고 있다. 과거에는 새로운 생물학제제 치료를 위해 대형 의료기관을 찾는 경우가 많았지만, 최근에는 1차 의료기관에서도 대부분의 치료가 이루어지고 있다.이 원장은 "병력 청취와 혈액검사, 엑스선 검사 등 기본 검사들은 1차 의료기관에서도 모두 수행할 수 있으며, 진단에 필요한 MRI 검사 역시 인근 영상의학과와의 협업으로 정확하게 판독할 수 있다"고 밝혔다.치료 과정에서 입원이 필요한 경우는 드물기 때문에, 환자들은 대학병원과 동일한 수준의 치료를 지역 의료기관에서도 보다 편리하게 받을 수 있다는 것이 이 원장의 설명이다.그는 "환자 접근성이 좋은 개원가에서 환자를 진료하면 치료 지속성도 그만큼 높아지는 장점이 있다"며 "개원가에서도 최신 가이드라인을 빠르게 따라가며 새로운 약제를 적극 활용하고 있다"고 언급했다.끝으로 이 원장은 강직성 척추염은 고혈압이나 당뇨병처럼 장기 관리가 필요한 만성질환이라는 점을 강조했다.환자의 치료 순응도를 높이고, 전문의와 환자가 함께 하는 지속적인 관리 체계를 마련하는 것이 중요하다는 입장이다.이 원장은 "강직성 척추염은 환자가 질환을 잘 이해하고 꾸준히 관리하도록 만드는 것이 치료 성과를 좌우한다"며 "환자 스스로 자신의 병을 알고 생활습관을 관리하도록 돕는 것이 의료진의 책무"라고 전했다.그는 "강직성 척추염 환자는 염증성 장질환, 심혈관계 위험, 골다공증 등 다양한 합병증 위험이 높다"면서 "환자의 전신 건강을 꾸준히 관리해야 하고, 무엇보다 환자들이 초기에 류마티스 전문의를 만나 적절한 치료를 시작하는 것이 가장 중요하다"고 덧붙였다.2025-06-17 06:06:29황병우
"강직성 척추염 치료 지형 변화…조기 진단이 열쇠"[데일리팜=황병우 기자] 강직성 척추염(Ankylosing spondylitis)은 과거 주로 젊은 남성에게 발생하는 질환으로 알려졌지만, 최근에는 여성이나 고령층에서도 진단율이 증가하는 추세다.질환에 대한 기존의 고정관념이 바뀌고 있으며, 다양한 연령에서 허리 통증 환자를 볼 때 강직성 척추염을 의심하는 적극적인 접근이 강조되고 있다.이원석 전주이지내과 원장데일리팜과 만난 이원석 전주이지내과 원장은 강직성 척추염 치료를 위한 조기 진단의 필요성과 장기적인 관리를 우선순위로 꼽았다.강직성 척추염은 만성 진행성 질환으로, 염증이 효과적으로 조절되지 않으면 척추 관절이 굳어져 운동 장애를 초래한다.이 원장은 "강직성 척추염이 젊은 남성에서 호발하는 건 맞지만 여성 환자나 고연령 환자에서 유병률과 진단율이 올라가는 상황"이라며 "질환 인식 개선과 홍보로 다양한 연령의 환자들이 병원을 찾아 염증성 요통에 대한 검사를 받기 시작한 결과"라고 설명했다.또 그는 "나이가 많은 환자의 허리 통증도 단순 노화로 치부되어 진단이 늦어지는 경우가 있다"면서 "아침에 뻣뻣하고 움직이면 호전되는 전형적인 염증성 요통 양상이 보인다면 강직성 척추염을 꼭 염두에 둬야 한다"고 말했다.결국 강직성 척추염을 초기에 발견해 적절히 치료하면 척추의 강직 진행을 늦추고 합병증을 예방할 수 있어 조기 진단이 강조되고 있다.이 원장은 "여전히 일부 의료진과 환자들은 강직성 척추염의 치료법이 마땅치 않다고 오해하거나, 소염진통제만으로 버티다가 전문 진료 시점을 놓치는 경우가 있다"며 "아침 강직 등 증상이 일반 요통과 다르다고 느껴지면 천장관절 X선을 촬영해 강직성 척추염 여부를 확인해보는 노력이 필요하다"고 전했다.실제 일부 강직성 척추염 환자의 경우 디스크나 협착증 치료에만 집중해 염증성 요통을 간과하면 진단이 늦어지기 쉽다는 게 이 원장의 의견.이 경우 척추 외 증상으로 포도막염이나 염증성 장질환, 건선 피부염 등이 동반되는 일도 있어, 관련 증상을 함께 문진하는 것이 조기 진단에 도움이 된다고 강조했다.강직성 척추염 치료에 있어 비약물적 치료, 특히 운동 요법의 중요성은 오래전부터 강조됐다.이 원장은 "모든 만성질환에서 운동이 중요하듯 강직성 척추염에서도 운동 치료는 기본이다. 환자들에게 규칙적으로 운동하는 생활습관을 들이도록 교육하는 것이 치료의 출발점"이라고 강조했다.젊은 환자와 고령 환자에 따라 운동에 대한 접근법이 다를 수 있지만, 핵심은 본인이 지속할 수 있는 운동을 매일 습관화가 필요하다는 의미다.그는 "운동 종류는 무엇이든 상관없으며, 본인이 재미있게 꾸준히 할 수 있는 운동을 찾는 게 중요하다"며 "하루 20~30분 정도 스트레칭을 포함한 코어 운동을 매일 하는 것을 권장한다. 중요한 건 특정 운동법보다 매일 하는 습관"이라고 조언했다."JAK 억제제 등장 치료 무기 다변화 의미"하지만 운동만으로 모든 질환이 치료하는 것이 불가능한 만큼 약물치료도 병행된다. NSAIDs(비스테로이드소염제)가 통증과 뻣뻣함 완화를 위한 1차 치료로 권고되며, 증상 조절이 어려운 경우 생물학적 제제와 JAK억제제 등의 치료제를 사용하게 된다.이 원장은 "JAK 억제제는 기존 TNF 억제제 등에 반응하지 않거나 내성이 생긴 환자에게 효과적이다"며 "기존 bDMARD 치료에 실패한 환자가 JAK 억제제로 넘어와 호전을 보였다"고 말했다.TNF-α 억제제 등 생물학제제는 효과가 뛰어나 많은 환자에서 1차 약제로 사용돼왔지만, 장기적으로 항체 형성으로 인한 약효 소실 문제가 있다.이 원장은 "JAK 억제제는 장기간 사용해도 항체가 생기지 않는 장점이 있다"며 "류마티스 관절염에서 10년 가까운 장기 데이터를 통해 안전성이 확인된 만큼, 강직성 척추염 분야에서도 강력한 새로운 치료 옵션이 하나 생긴 셈"이라고 평가했다.다만 현재 국내 보험 기준상 JAK 억제제는 2차 치료제로 분류되어 TNF 억제제 등 기존 요법에 실패한 경우에만 사용할 수 있다.그는 "지금은 TNF 억제제가 치료의 중심을 차지하고 있고, 당분간은 이러한 보수적 치료 전환이 이어지겠지만, 경구제라는 편의성과 우수한 효과에 대한 데이터가 쌓이면 향후 치료 패턴이 달라질 수도 있다"고 전망했다.실제 류마티스 관절염에서는 JAK 억제제가 처음엔 2차 약제로 도입되었다가 점차 1차 치료제 수준으로 활용도가 높아진 바 있다. 강직성 척추염 분야에서도 임상 근거 축적에 따라 장기적으로 1차 약제로 격상될 가능성이 있을 것으로 예측된다.강직성 척추염 치료에 신약이 속속 도입되면서 환자들의 치료 접근성도 개선되고 있다. 과거에는 새로운 생물학제제 치료를 위해 대형 의료기관을 찾는 경우가 많았지만, 최근에는 1차 의료기관에서도 대부분의 치료가 이루어지고 있다.이 원장은 "병력 청취와 혈액검사, 엑스선 검사 등 기본 검사들은 1차 의료기관에서도 모두 수행할 수 있으며, 진단에 필요한 MRI 검사 역시 인근 영상의학과와의 협업으로 정확하게 판독할 수 있다"고 밝혔다.치료 과정에서 입원이 필요한 경우는 드물기 때문에, 환자들은 대학병원과 동일한 수준의 치료를 지역 의료기관에서도 보다 편리하게 받을 수 있다는 것이 이 원장의 설명이다.그는 "환자 접근성이 좋은 개원가에서 환자를 진료하면 치료 지속성도 그만큼 높아지는 장점이 있다"며 "개원가에서도 최신 가이드라인을 빠르게 따라가며 새로운 약제를 적극 활용하고 있다"고 언급했다.끝으로 이 원장은 강직성 척추염은 고혈압이나 당뇨병처럼 장기 관리가 필요한 만성질환이라는 점을 강조했다.환자의 치료 순응도를 높이고, 전문의와 환자가 함께 하는 지속적인 관리 체계를 마련하는 것이 중요하다는 입장이다.이 원장은 "강직성 척추염은 환자가 질환을 잘 이해하고 꾸준히 관리하도록 만드는 것이 치료 성과를 좌우한다"며 "환자 스스로 자신의 병을 알고 생활습관을 관리하도록 돕는 것이 의료진의 책무"라고 전했다.그는 "강직성 척추염 환자는 염증성 장질환, 심혈관계 위험, 골다공증 등 다양한 합병증 위험이 높다"면서 "환자의 전신 건강을 꾸준히 관리해야 하고, 무엇보다 환자들이 초기에 류마티스 전문의를 만나 적절한 치료를 시작하는 것이 가장 중요하다"고 덧붙였다.2025-06-17 06:06:29황병우 -
 셀트리온, 북미서 '스테키마' 소아용 제형 허가 획득[데일리팜=김진구 기자] 셀트리온은 미국 식품의약국(FDA)과 캐나다 보건부(Health Canada)로부터 자가면역질환 치료제 스텔라라(우스테키누맙) 바이오시밀러 ‘스테키마’의 45mg/0.5mL 바이알 제형에 대한 품목허가를 추가 획득했다고 16일 밝혔다.북미 지역에서 허가 받은 스테키마 45mg 바이알은 소아 환자를 대상으로 사용된다. 소아 환자의 경우, 성인 환자와 달리 몸무게에 비례해 미세한 약물 투여량 조절이 필요하기 때문에 저용량 바이알 제형으로 처방된다.셀트리온은 이번 45mg 바이알 허가 획득으로 기존 45mg/0.5mL와 90mg/1mL 프리필드시린지, 130mg/26mL 바이알 제형을 포함해 총 4가지 용량제형의 제품 라인업을 갖추게 됐다.셀트리온은 환자의 상태나 처방 용량별 맞춤 투약이 가능해지면서 스테키마의 제품 경쟁력 강화는 물론 제품 선호도 증가도 기대할 수 있게 됐다고 설명했다.스테키마는 지난해 7월과 12월 각각 캐나다와 미국에서 허가 승인을 획득했다. 이후 북미 공략에 착수해 글로벌 우스테키누맙 시장에 순조롭게 안착 중이다.최근엔 캐나다에서 소아 판상 건선(Pediatric plaque psoriasis) 적응증에 대한 허가를 추가 획득, 미국에 이어 캐나다서도 오리지널 제품이 보유한 전체 적응증(Full Label)으로 판매가 가능해졌다.미국에서는 전체 보험 시장에서 약 90% 규모를 차지하는 상위 5개 처방약급여관리업체(PBM) 가운데 두 곳과 계약을 체결해 커버리지를 확보했으며, 다른 PBM과의 협상도 진행 중이다.셀트리온은 북미 지역에서 판매하고 있던 램시마와 짐펜트라(램시마SC 미국 제품명), 유플라이마 등 기존 종양괴사인자(TNF-α) 억제제 제품군에 이어 스테키마가 속하는 인터루킨 억제제 시장 점유율도 점차 확대해 자가면역질환 시장 내 영향력을 한층 강화할 방침이다.의약품 시장조사기관인 아이큐비아에 따르면 2024년 기준 우스테키누맙 글로벌 시장 규모는 216억6515만 달러(약 30조3312억원)로 추산된다. 이 가운데 미국시장 규모는 167억381만 달러(약 23조3853억원), 캐나다 시장규모는 6억4781만 달러(약 9069억원) 규모다.2025-06-16 10:08:30김진구
셀트리온, 북미서 '스테키마' 소아용 제형 허가 획득[데일리팜=김진구 기자] 셀트리온은 미국 식품의약국(FDA)과 캐나다 보건부(Health Canada)로부터 자가면역질환 치료제 스텔라라(우스테키누맙) 바이오시밀러 ‘스테키마’의 45mg/0.5mL 바이알 제형에 대한 품목허가를 추가 획득했다고 16일 밝혔다.북미 지역에서 허가 받은 스테키마 45mg 바이알은 소아 환자를 대상으로 사용된다. 소아 환자의 경우, 성인 환자와 달리 몸무게에 비례해 미세한 약물 투여량 조절이 필요하기 때문에 저용량 바이알 제형으로 처방된다.셀트리온은 이번 45mg 바이알 허가 획득으로 기존 45mg/0.5mL와 90mg/1mL 프리필드시린지, 130mg/26mL 바이알 제형을 포함해 총 4가지 용량제형의 제품 라인업을 갖추게 됐다.셀트리온은 환자의 상태나 처방 용량별 맞춤 투약이 가능해지면서 스테키마의 제품 경쟁력 강화는 물론 제품 선호도 증가도 기대할 수 있게 됐다고 설명했다.스테키마는 지난해 7월과 12월 각각 캐나다와 미국에서 허가 승인을 획득했다. 이후 북미 공략에 착수해 글로벌 우스테키누맙 시장에 순조롭게 안착 중이다.최근엔 캐나다에서 소아 판상 건선(Pediatric plaque psoriasis) 적응증에 대한 허가를 추가 획득, 미국에 이어 캐나다서도 오리지널 제품이 보유한 전체 적응증(Full Label)으로 판매가 가능해졌다.미국에서는 전체 보험 시장에서 약 90% 규모를 차지하는 상위 5개 처방약급여관리업체(PBM) 가운데 두 곳과 계약을 체결해 커버리지를 확보했으며, 다른 PBM과의 협상도 진행 중이다.셀트리온은 북미 지역에서 판매하고 있던 램시마와 짐펜트라(램시마SC 미국 제품명), 유플라이마 등 기존 종양괴사인자(TNF-α) 억제제 제품군에 이어 스테키마가 속하는 인터루킨 억제제 시장 점유율도 점차 확대해 자가면역질환 시장 내 영향력을 한층 강화할 방침이다.의약품 시장조사기관인 아이큐비아에 따르면 2024년 기준 우스테키누맙 글로벌 시장 규모는 216억6515만 달러(약 30조3312억원)로 추산된다. 이 가운데 미국시장 규모는 167억381만 달러(약 23조3853억원), 캐나다 시장규모는 6억4781만 달러(약 9069억원) 규모다.2025-06-16 10:08:30김진구 -
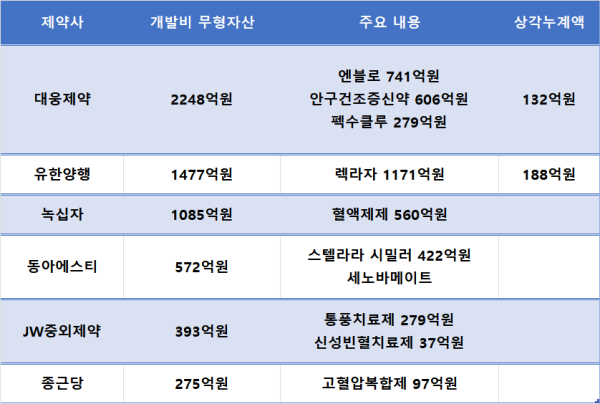 대웅 2248억·유한 1477억·녹십자 1085억...개발비 자산화↑[데일리팜=천승현 기자] 제약바이오기업들이 자산으로 인식한 연구개발비 규모가 점차적으로 확대되고 있다. 대웅제약은 자산으로 반영한 개발비가 2000억원을 넘어섰고 유한양행과 녹십자는 1000억원 이상의 개발비를 무형자산으로 인식했다. 렉라자, 엔블로, 알리글로 등 상업화 단계에 도달한 신약 과제는 상각이 시작되면서 무형자산 장부가액은 일부 감소했다.8일 금융감독원에 따르면 23일 금융감독원에 따르면 지난 1분기 말 기준 주요 상장 제약바이오기업 중 대웅제약, 유한양행, 녹십자 등이 자산으로 인식한 개발비가 1000억원이 넘는 것으로 나타났다.상업화에 근접한 과제에 투입한 R&D 비용이 많을수록 무형자산으로 인식할 수 있는 개발비가 커진다. 지난 2019년 금융감독원은 신약 등 R&D 과제의 기술적 실현 가능성이 있는 경우에만 회계 상 자산 처리가 가능하다는 기준을 설정했다. 금감원은 R&D비용의 자산화 가능 단계를 신약은 임상3상 개시, 바이오시밀러는 임상1상 승인으로 제시했다. 제네릭은 생동성시험 계획을 승인 받은 이후에 자산화 처리가 가능하다.2024년 1분기 말 기준 주요 제약사 개발비 무형자산(자료: 금융감독원) 지난 1분기 말 기준 대웅제약이 자산으로 반영한 개발비 규모가 2248억원으로 가장 많았다. 대웅제약은 신약 14개의 임상과제를 포함해 총 26건의 임상시험에 투입한 비용을 무형자산으로 인식했다. 다만 대웅제약은 상업화 단계에 도달한 임상비용 132억원을 손상처리하면서 개발비 무형자산 장부가액은 2116억원으로 집계됐다.대웅제약은 SGlT-2 억제제 계열의 당뇨신약 ‘엔블로'(성분명 이나보글리플로진)의 임상시험 6건에 투자한 개발비 741억원을 무형자산으로 인식했다. 엔블로는 2022년 12월 국내 개발 36번째 신약으로 허가 받았다.엔블로의 2제 병용요법 중국내 임상시험 비용 253억원을 자산으로 인식했고, 엔블로 인슐린 병용 적응증 추가 다국가 임상 3상비용에 194억원이 투입됐다. 대웅제약은 엔블로 3제 병용요법을 통한 복합제 개발 79억원의 임상비용 사용했다. 엔블로의 3상 단독요법 임상3상시험과 에 투입된 121억원과 2제 병용요법 복합제 개발비용 78억원을 자산화했다. 단독요법과 2제 병용요법 복합제는 개발이 완료되면서 각각 26억원과 13억원이 손상처리됐다.대웅제약은 자회사 한올바이오파마와 공동 개발 중인 안구건조증치료제 'HL036'의 개발비 무형자산이 606억원에 달했다. HL036은 한올바이오파마가 자체 개발한 레지스테인 원천기술을 이용해 TNF 수용체 절편을 분자 개량한 바이오신약이다. 한올바이오파마는 지난 2016년 대웅제약과 공동개발 계약을 체결하고 글로벌 임상을 함께 진행 중이다.대웅제약은 위식도역류질환 신약 펙수클루의 임상시험 4건에 투입한 개발비 중 279억원을 자산화했다. 펙수클루는 위벽에서 위산을 분비하는 양성자펌프를 가역적으로 차단하는 P-CAB 작용기전의 약물이다. 2021년 말 국내 허가를 받았고 2022년 판매를 시작했다. 펙수클루의 미란성 위식도역류질환 임상시험 비용은 44억원 자산으로 반영됐는데 개발이 완료되면서 9억원이 손상 처리됐다.유한양행은 지난 1분기 말 기준 무형자산으로 반영한 개발비는 총 1477억원으로 나타났다. 개발 완료로 188억원을 손상처리하면서 개발비 무형자산 장부가액은 1289억원으로 집계됐다.유한양행의 개발비 무형자산 중 항암신약 렉라자가 1171억원으로 79.3%를 차지했다. 렉라자는 2021년 1월 국내 개발 31호 신약으로 허가 받은 비소세포폐암 치료제다. 렉라자는 지난 2020년 4분기 처음으로 326억원의 개발비를 무형자산으로 인식했다. 임상3상시험이 본격적으로 시작되면서 개발비를 무형자산으로 반영했고 4년 3개월 동안에 845억원이 추가됐다.1분기 말 기준 렉라자의 개발비 무형자산 장부가액은 1049억원이다. 국내외 시장에서 상업화 단계에 진입하면서 총 122억원이 상각됐다. 지난 2023년 국내에서 단독투여 1차치료제 허가를 받았고 미국, 영국, 일본 등에서 아미반타맙과의 병용투여 허가를 승인받았다.녹십자는 1분기 말 기준 인식한 개발비 무형자산이 1085억원으로 나타났다. 혈액제제 알리글로의 개발비 자산화 규모가 560억원으로 가장 컸다. 알리글로는 혈장 분획으로부터 정제된 액상형 면역글로불린제제다. 선천성 면역결핍증, 면역성 혈소판감소증과 같은 1차성 면역결핍질환 치료에 사용된다.알리글로는 지난 2023년 12월 미국 식품의약품국(FDA) 허가를 받았다. 녹십자는 지난해 7월 알리글로의 초도 물량을 선적 완료하며 본격적인 판매에 나섰다. 녹십자의 혈액제제 개발비 무형자산은 작년 말 567억원에서 7억원 감소했다. 알리글로의 개발이 완료되면서 개발비 일부가 상각 처리됐다.동아에스티는 1분기 말 기준 총 572억원의 개발비를 무형자산으로 인식했다. 바이오시밀러 DMB-3115 개발비 422억원이 가장 큰 비중을 차지했다. DMB-3115는 스텔라라의 바이오시밀러 제품이다. 스텔라라는 얀센이 개발한 자가면역질환 치료제다. DMB-3115는 지난해 10월 FDA로부터 이뮬도사라는 상품명으로 판매허가를 승인받았고 유럽에서도 작년 12월 허가받았다. 동아에스티는 지난 2021년 이뮬도사의 임상3상 비용 134억원을 처음으로 무형자산으로 인식했다. 지난해 말 이뮬도사의 개발비 무형자산은 384억원으로 확대됐고 올해 들어 38억원이 추가로 인식됐다.동아에스티가 SK바이오팜으로부터 도입한 뇌전증신약 세노바메이트의 개발비 56억원도 무형자산으로 인식됐다. 동아에스티는 지난해 1월 SK바이오팜과 라이선싱 계약을 맺고 30개국의 허가·생산·판매 권리를 확보했다. 동아에스티가 SK바이오팜에 계약금 50억원을 지급했다.JW중외제약이 자산화한 개발비는 393억원으로 나타났다. 통풍 치료제 URC-102의 개발비가 279억원으로 가장 많았다. JW중외제약은 2022년 말부터 URC-102 임상3상시험을 진행하고 있다. URC-102는 요산이 우리 몸에 다시 흡수되도록 하는 요산 트랜스포터(URAT)-1을 억제하는 기전의 요산 배설 촉진제다.종근당은 1분기 말 기준 개발비 275억원을 자산화했다. 고혈압복합제 CKD-828의 임상비용 97억원이 자산으로 인식한 개발비 중 가장 큰 비중을 차지했다.2025-06-09 06:20:14천승현
대웅 2248억·유한 1477억·녹십자 1085억...개발비 자산화↑[데일리팜=천승현 기자] 제약바이오기업들이 자산으로 인식한 연구개발비 규모가 점차적으로 확대되고 있다. 대웅제약은 자산으로 반영한 개발비가 2000억원을 넘어섰고 유한양행과 녹십자는 1000억원 이상의 개발비를 무형자산으로 인식했다. 렉라자, 엔블로, 알리글로 등 상업화 단계에 도달한 신약 과제는 상각이 시작되면서 무형자산 장부가액은 일부 감소했다.8일 금융감독원에 따르면 23일 금융감독원에 따르면 지난 1분기 말 기준 주요 상장 제약바이오기업 중 대웅제약, 유한양행, 녹십자 등이 자산으로 인식한 개발비가 1000억원이 넘는 것으로 나타났다.상업화에 근접한 과제에 투입한 R&D 비용이 많을수록 무형자산으로 인식할 수 있는 개발비가 커진다. 지난 2019년 금융감독원은 신약 등 R&D 과제의 기술적 실현 가능성이 있는 경우에만 회계 상 자산 처리가 가능하다는 기준을 설정했다. 금감원은 R&D비용의 자산화 가능 단계를 신약은 임상3상 개시, 바이오시밀러는 임상1상 승인으로 제시했다. 제네릭은 생동성시험 계획을 승인 받은 이후에 자산화 처리가 가능하다.2024년 1분기 말 기준 주요 제약사 개발비 무형자산(자료: 금융감독원) 지난 1분기 말 기준 대웅제약이 자산으로 반영한 개발비 규모가 2248억원으로 가장 많았다. 대웅제약은 신약 14개의 임상과제를 포함해 총 26건의 임상시험에 투입한 비용을 무형자산으로 인식했다. 다만 대웅제약은 상업화 단계에 도달한 임상비용 132억원을 손상처리하면서 개발비 무형자산 장부가액은 2116억원으로 집계됐다.대웅제약은 SGlT-2 억제제 계열의 당뇨신약 ‘엔블로'(성분명 이나보글리플로진)의 임상시험 6건에 투자한 개발비 741억원을 무형자산으로 인식했다. 엔블로는 2022년 12월 국내 개발 36번째 신약으로 허가 받았다.엔블로의 2제 병용요법 중국내 임상시험 비용 253억원을 자산으로 인식했고, 엔블로 인슐린 병용 적응증 추가 다국가 임상 3상비용에 194억원이 투입됐다. 대웅제약은 엔블로 3제 병용요법을 통한 복합제 개발 79억원의 임상비용 사용했다. 엔블로의 3상 단독요법 임상3상시험과 에 투입된 121억원과 2제 병용요법 복합제 개발비용 78억원을 자산화했다. 단독요법과 2제 병용요법 복합제는 개발이 완료되면서 각각 26억원과 13억원이 손상처리됐다.대웅제약은 자회사 한올바이오파마와 공동 개발 중인 안구건조증치료제 'HL036'의 개발비 무형자산이 606억원에 달했다. HL036은 한올바이오파마가 자체 개발한 레지스테인 원천기술을 이용해 TNF 수용체 절편을 분자 개량한 바이오신약이다. 한올바이오파마는 지난 2016년 대웅제약과 공동개발 계약을 체결하고 글로벌 임상을 함께 진행 중이다.대웅제약은 위식도역류질환 신약 펙수클루의 임상시험 4건에 투입한 개발비 중 279억원을 자산화했다. 펙수클루는 위벽에서 위산을 분비하는 양성자펌프를 가역적으로 차단하는 P-CAB 작용기전의 약물이다. 2021년 말 국내 허가를 받았고 2022년 판매를 시작했다. 펙수클루의 미란성 위식도역류질환 임상시험 비용은 44억원 자산으로 반영됐는데 개발이 완료되면서 9억원이 손상 처리됐다.유한양행은 지난 1분기 말 기준 무형자산으로 반영한 개발비는 총 1477억원으로 나타났다. 개발 완료로 188억원을 손상처리하면서 개발비 무형자산 장부가액은 1289억원으로 집계됐다.유한양행의 개발비 무형자산 중 항암신약 렉라자가 1171억원으로 79.3%를 차지했다. 렉라자는 2021년 1월 국내 개발 31호 신약으로 허가 받은 비소세포폐암 치료제다. 렉라자는 지난 2020년 4분기 처음으로 326억원의 개발비를 무형자산으로 인식했다. 임상3상시험이 본격적으로 시작되면서 개발비를 무형자산으로 반영했고 4년 3개월 동안에 845억원이 추가됐다.1분기 말 기준 렉라자의 개발비 무형자산 장부가액은 1049억원이다. 국내외 시장에서 상업화 단계에 진입하면서 총 122억원이 상각됐다. 지난 2023년 국내에서 단독투여 1차치료제 허가를 받았고 미국, 영국, 일본 등에서 아미반타맙과의 병용투여 허가를 승인받았다.녹십자는 1분기 말 기준 인식한 개발비 무형자산이 1085억원으로 나타났다. 혈액제제 알리글로의 개발비 자산화 규모가 560억원으로 가장 컸다. 알리글로는 혈장 분획으로부터 정제된 액상형 면역글로불린제제다. 선천성 면역결핍증, 면역성 혈소판감소증과 같은 1차성 면역결핍질환 치료에 사용된다.알리글로는 지난 2023년 12월 미국 식품의약품국(FDA) 허가를 받았다. 녹십자는 지난해 7월 알리글로의 초도 물량을 선적 완료하며 본격적인 판매에 나섰다. 녹십자의 혈액제제 개발비 무형자산은 작년 말 567억원에서 7억원 감소했다. 알리글로의 개발이 완료되면서 개발비 일부가 상각 처리됐다.동아에스티는 1분기 말 기준 총 572억원의 개발비를 무형자산으로 인식했다. 바이오시밀러 DMB-3115 개발비 422억원이 가장 큰 비중을 차지했다. DMB-3115는 스텔라라의 바이오시밀러 제품이다. 스텔라라는 얀센이 개발한 자가면역질환 치료제다. DMB-3115는 지난해 10월 FDA로부터 이뮬도사라는 상품명으로 판매허가를 승인받았고 유럽에서도 작년 12월 허가받았다. 동아에스티는 지난 2021년 이뮬도사의 임상3상 비용 134억원을 처음으로 무형자산으로 인식했다. 지난해 말 이뮬도사의 개발비 무형자산은 384억원으로 확대됐고 올해 들어 38억원이 추가로 인식됐다.동아에스티가 SK바이오팜으로부터 도입한 뇌전증신약 세노바메이트의 개발비 56억원도 무형자산으로 인식됐다. 동아에스티는 지난해 1월 SK바이오팜과 라이선싱 계약을 맺고 30개국의 허가·생산·판매 권리를 확보했다. 동아에스티가 SK바이오팜에 계약금 50억원을 지급했다.JW중외제약이 자산화한 개발비는 393억원으로 나타났다. 통풍 치료제 URC-102의 개발비가 279억원으로 가장 많았다. JW중외제약은 2022년 말부터 URC-102 임상3상시험을 진행하고 있다. URC-102는 요산이 우리 몸에 다시 흡수되도록 하는 요산 트랜스포터(URAT)-1을 억제하는 기전의 요산 배설 촉진제다.종근당은 1분기 말 기준 개발비 275억원을 자산화했다. 고혈압복합제 CKD-828의 임상비용 97억원이 자산으로 인식한 개발비 중 가장 큰 비중을 차지했다.2025-06-09 06:20:14천승현 -
 원형탈모 치료제 '렉셀비', 세 번째 경구 JAK 억제제4편: 세 번째 경구 JAK 억제제, 원형탈모증 치료제 렉셀비(Deuruxolitinib)렉셀비(Leqselvi®, lek-sel-vee, 성분명: 듀룩소리티닙, Deuruxolitinib, Sun Pharma)는 미국 FDA로부터 2024년 7월에 성인 중증 원형탈모증(alopecia areata) 치료제로 승인되었다.이 약제는 세 번째 경구용 JAK(Janus kinase) 억제제로, 특히 JAK1과 JAK2를 선택적으로 억제하여 면역 반응을 조절함으로써 탈모를 유발하는 염증 경로를 차단한다. 현재 유럽 EMA에서는 승인되지 않았다.원형탈모증(Alopecia areata, AA)은 비반흔성(non-scarring) 자가면역성 탈모 질환으로, 주로 성장기(anagen phase)의 모낭(hair follicle)이 면역계의 표적이 되어 발생한다. 임상적으로는 국소성 탈모에서 전신 탈모(alopecia universalis)에 이르기까지 다양한 양상을 보인다.여러 연구들은 원형탈모증의 병태생리가 모낭 면역 특권(hair follicle immune privilege)의 붕괴와 밀접하게 연관되어 있음을 밝히며, 최근 이러한 병태생리에 기반한 JAK 억제제들이 개발되면서 치료 패러다임에 중요한 변화가 일어나고 있다.JAK는 원형탈모증의 염증 촉진성 사이토카인(pro-inflammatrory cytokines) 신호전달에서 핵심적인 역할을 하며, 이에 따라 JAK 억제제는 중증 원형탈모증 치료의 유망한 약물 계열로 부상하고 있다. 실제로 미국 FDA는 JAK 억제제인 바리시티닙(Baricitinib)과 리틀레시티닙(Ritlecitinib)을 중증 원형탈모증 치료제로 승인하였고, 국내에도 이미 소개되어 있다.이어 세 번째 경구용 JAK 억제제인 듀룩소리티닙은 JAK1과 JAK2를 선택적으로 억제하고 TYK2도 일부 억제함으로써 염증 반응을 조절하고, 림프구 기능을 부분적으로 유지하는 것이 특징이다. 특히 IFN-γ, IL-2, IL-6, IL-15 등의 광범위한 염증 촉진성 사이토카인에 작용하여, 면역 조절 효과를 극대화한다.듀룩소리티닙의 승인은 두 건의 다국적 3상 임상시험인 THRIVE-AA1 및 THRIVE-AA2를 근거로 이루어졌다. 이들 연구에서는 중증 원형탈모증 환자(두피 탈모 범위 ≥50%) 총 1,220명의 성인 환자를 대상으로 24주간 치료를 시행한 결과, 약 30%의 환자에서 두피 모발의 80% 이상이 회복(SALT 점수 ≤20)되는 유의미한 임상적 개선 효과가 확인되었다.사이토카인(Cytokine)이란 무엇인가?사이토카인은 면역세포를 비롯한 다양한 세포에 의해 생성되며, 주로 폴리펩타이드(polypeptide) 또는 당단백질(glycoprotein)의 형태로 존재하는 세포 간 신호 전달 분자이다.이들은 자가분비(autocrine) 및 측분비(paracrine) 경로를 통해 작용하면서 세포의 증식, 분화, 생존, 그리고 활성화와 같은 핵심 생물학적 과정을 정교하게 조절한다.사이토카인은 특정 세포군에 국한되지 않고, 면역세포뿐만 아니라 상피세포, 섬유아세포, 혈관내피세포 등 다양한 비면역세포에서도 발현될 수 있다. 이는 하나의 사이토카인이 여러 종류의 세포에 작용할 수 있으며, 서로 다른 사이토카인이 동일한 생물학적 효과를 유도하는 경우도 흔하게 관찰된다. 이러한 특성은 세포 간 신호 전달 경로를 복잡하고도 정교하게 구성하게 한다.사이토카인의 작용은 선천 및 후천 면역 반응의 조절뿐 아니라 염증 반응의 유도와 조절, 조직 재생( tissue regeneration), 생체 항상성(homeostasis)의 유지 등 다양한 생리적 과정에서 핵심적인 조절자 역할을 수행한다.사이토카인의 계열로는 인터루킨(interleukins, ILs), 인터페론(interferons, IFNs), 종양괴사인자(tumor necrosis factors, TNFs), 집락자극인자(colony-stimulating factors, CSFs), 케모카인(chemokines), 성장인자(growth factors) 등이 있으며, 이들은 각기 다른 수용체에 결합하여 세포 내 신호전달을 유도하고 세포의 기능적 운명을 결정짓는다.이들 사이토카인은 면역 반응의 시작, 유지, 해소에 관여하는 저분자 단백질로서, 면역세포 간의 신호 전달을 매개하는 주요 인자이다. 이들은 일반적으로 염증 촉진성(pro-inflammatory)과 염증 억제성(anti-inflammatory)으로 분류되며, 세포 내 신호전달, 면역세포의 활성화 상태, 조직 환경 등에 따라 상황 의존적으로 조절된다이러한 두 사이토카인 계열 간의 균형은 병원체 방어와 면역 항상성 유지에 결정적인 역할을 하며, 이 균형이 깨질 경우 자가면역 질환, 만성 염증 또는 면역 억제 상태로 이어질 수 있다.이 중 염증 촉진성 사이토카인은 선천면역 반응 초기 단계에서 빠르게 분비되어 병원체에 대한 방어를 유도하며, 항원제시세포(APC)의 활성화, T 세포 분화, 염증성 케모카인 생성 등을 매개한다. 대표적인 염증성 사이토카인으로는 IFN-γ, IL-1β, IL-6, TNF-α, IL-12, IL-15, IL-17, IL-23 등이 있다.반면, 염증 억제성 사이토카인은 염증 반응을 억제하거나 종결시키는 방향으로 작용하며, 면역 관용 유지 및 조직 복구에 관여한다. 대표적인 억제성 사이토카인으로는 TGF-β, IL-4, IL-10, IL-13, IL-27, IL-35 등이 있다.이와 같이, 두 사이토카인은 상호작용을 통해 면역 반응의 강도와 범위를 조절하며, 이들의 균형은 감염 방어와 자가면역 예방 사이에서 정교하게 조절된다.따라서, 사이토카인(리간드)이 해당 수용체에 결합하면, 수용체에 연계된 JAK가 활성화된다. 활성화된 JAK는 자가 티로신 잔기를 인산화하여 자신의 키나아제 활성을 증가시키며, 이어서 STAT 단백질을 인산화한다. 인산화된 STAT는 이형 혹은 동형 다이머(dimer)를 형성한 후 핵으로 이동하여, 표적 유전자의 전사(transcription)를 촉진한다(Figure 1). 사이토카인 수용체(Cytokine receptors)의 분류와 역할은? 사이토카인 수용체는 사이토카인과의 특이적인 결합을 통해 세포 내 신호 전달을 유도하는 막관통 단백질(transmembrane proteins)이다.사이토카인 수용체는 기능적으로는 결합하는 리간드의 종류에 따라 인터루킨 수용체, 인터페론 수용체, 종양괴사인자(TNF) 수용체, 케모카인 수용체, 조혈자극인자(CSF) 수용체, 성장인자 수용체 등으로 분류되며, 각각 특정한 세포 신호 경로를 통해 고유의 생리학적 효과를 매개한다.또한, 구조적 유사성과 진화적 상동성을 기준으로 분류하면, 크게 제1형 및 제2형 사이토카인 수용체, 케모카인 수용체 계열, TNF 수용체 초계열(superfamily), TGF-β 수용체 계열, 그리고 면역글로불린(Ig) 수용체 초계열로 나뉜다. 각 계열은 공통된 구조적 도메인 및 신호전달 기전을 공유하며, 세포의 운명 결정에 중요한 신호를 전달한다.이 중 제1형 사이토카인 수용체(Type I cytokine receptors)은 다양한 사이토카인에 반응하는 세포막 수용체로, 주로 인터루킨(IL)과 같은 사이토카인을 인식한다. 이 계열에는 IL-2(β-서브유닛), IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-12, GM-CSF, G-CSF, 에리스로포이에틴(EPO), LIF, CNTF, TPO(혈소판생성인자), 프로락틴, 성장호르몬 등의 수용체가 있다. 이들 수용체 대부분 JAK-STAT 경로를 통해 세포 내로 신호를 전달한다.또한, 제2형 사이토카인 수용체(Type II cytokine receptors)는 주로 인터페론 계열 및 일부 인터루킨 계열의 사이토카인을 인식하며, 제1형과는 기능적 구조 단위(motif)와 도메인의 구성 및 배열 방식에서 구조적 차이를 보인다. 이 계열에는 IFN-α, IFN-β, IFN-γ, IL-10, IL-22, Tissue factor 등이 있다. 이들 수용체는 리간드 결합 도메인에서 구조적 유사성을 가지며, JAK-STAT 경로를 통해 세포 내로 신호를 전달한다.JAK(Janus kinase)란 무엇인가? JAK는 세포막을 직접 관통하지 않는 비수용체형 티로신 단백질 키나아제((non-receptor tyrosine kinase)로, 사이토카인 수용체의 세포질 도메인에 결합해 세포 외부의 신호를 세포 내부로 전달하는 데 핵심적인 역할을 한다.JAK는 일반적으로 두 개의 기능적 도메인으로 구성되며, 하나는 기질의 인산화를 수행하는 tyrosine kinase 도메인이고, 다른 하나는 촉매 활성을 갖지 않는 pseudokinase 도메인이다. 이러한 이중적인 구조는 로마 신화에서 두 얼굴을 가진 신인 ‘야누스(Janus)’를 연상시키며, Janus kinase라는 명칭의 유래가 되었다.JAK는 단순한 키나아제 활성을 넘어, 수용체 복합체의 안정화, 수용체의 세포 내 이동 및 성숙 조절, 그리고 SOCS(suppressor of cytokine signaling)와 같은 음성 조절인자와의 상호작용을 통해 신호 전달을 정밀하게 조율하는 기능도 수행한다. 이에는 JAK1, JAK2, JAK3 그리고 TYK2로 구분된다.JAK1은 대부분의 조직에서 발현되며, Type I 인터페론 수용체(IFN-α, IFN-β 등), Type II 인터페론 수용체(IFN-γ), IL-6 계열 수용체, 그리고 γc(공통 감마사슬) 수용체와 연계되어 작용한다. 이러한 분자들과의 상호작용을 통해 JAK1은 면역 및 염증 반응의 조절에 중심적인 역할을 한다.JAK2는 다양한 조직에서 광범위하게 발현되며, erythropoietin(EPO), thrombopoietin(TPO), granulocyte colony-stimulating factor(G-CSF) 등 호르몬 유사 사이토카인의 수용체에 특이적으로 작용한다. 이러한 기능을 통해 JAK2는 조혈 및 배아 발생 과정에 필수적인 역할을 한다.JAK3는 주로 골수 및 림프계 조직(T 세포, B 세포, NK 세포 등)에서 특이적으로 발현되며, γc(공통 감마사슬)를 공유하는 IL-2, IL-4, IL-7, IL-9, IL-15, IL-21 수용체에 한정적으로 결합하여 림프구의 발달 및 항상성 유지에 관여한다.TYK2는 Type I 인터페론 수용체를 비롯하여 IL-12 및 IL-23 수용체의 신호 전달에 관여하며, 항바이러스 면역, Th1/Th17 관련 면역 반응, 자가면역 질환의 병태생리 조절에 핵심적인 역할을 한다.STAT(Signal transducer and activator of transcription)는 무엇인가? STAT은 세포 외부의 사이토카인 또는 성장인자 자극을 핵 내 유전자 전사로 연결하는 전사 조절 인자로서, JAK-STAT 경로의 주요 하위 신호 전달자로 기능한다. STAT 단백질은 면역 반응, 염증 조절, 세포 생존 및 분화 등 다양한 생리적 과정에 관여하며, 이들의 활성 이상은 자가면역질환, 염증성 질환, 종양 등의 병태생리와 밀접하게 연관되어 있다.현재까지 밝혀진 STAT은 총 7종(STAT1, STAT2, STAT3, STAT4, STAT5A, STAT5B, STAT6)으로 구성되며, 각 STAT 단백질은 특정 사이토카인 자극에 의해 선택적으로 인산화된 후 이합체(homodimer 또는 heterodimer)를 형성하여 핵으로 이동하고, 표적 유전자의 전사를 조절한다.각 JAK 단백질은 STAT1~4, STAT5A/B, STAT6 등 다양한 STAT 인자들과 선택적으로 결합하며, 이는 특정 리간드-수용체 조합에 따른 하위 신호 전달의 특이성을 매개하는 데 중요한 역할을 한다. 예를 들어, IL-4 수용체는 JAK1과 JAK3의 이종이합체를 형성하여 STAT6를 주로 활성화한다. 이러한 다양성은 사이토카인 신호의 선택성과 세포 특이적 반응을 정밀하게 조절하는 분자적 기반을 제공한다(Figure 2). 이처럼 JAK 계열 단백질은 면역, 염증, 조혈, 항바이러스 반응을 포함한 다양한 생리적·병리적 기능의 중심에서 핵심적 신호전달 플랫폼으로 작용하며, 이를 표적으로 하는 JAK 억제제는 자가면역질환, 염증성 질환, 혈액암 등에서 치료 전략으로 각광받고 있다.JAK-STAT(Janus kinase-Signal transducer and activator of transcription) 경로는 무엇인가?사이토카인과 성장인자는 JAK-STAT 신호 전달 경로를 활성화하는 주요 인자로, 진화적으로 잘 보존되어 있는 신호 체계이다. 이러한 경로는 점균류(slime mold)와 같은 단순한 진핵생물부터 인간에 이르기까지 다양한 생물에서 발견되며, 세포 간 의사소통을 가능하게 하기 위해 진화한 가장 초기의 신호 전달 기전 중 하나이다. 이후 이 경로는 다양한 세포 내 신호전달 기전과 함께 진화하면서, 특정 리간드에 반응하는 정교하고 특이적인 신호 전달 시스템으로 발전하게 되었다.JAK-STAT 경로는 유전자 발현을 정밀하게 조절하여 세포 기능의 다양성과 항상성을 유지하고, 세포 증식, 분화, 이동, 생존, 세포사멸 등 다양한 생물학적 현상을 조절한다. 이 경로는 자극의 종류와 세포 및 조직 환경에 따라 상이한 생리적 반응을 유도하며, 조혈, 면역세포 발달, 줄기세포 항상성, 개체 성장, 유선 발달 등 필수적인 생물학적 과정에서 핵심적인 기능을 담당한다.현재까지 50종 이상의 사이토카인 및 펩타이드 호르몬이 이 경로를 통해 신호를 전달하는 것으로 밝혀져 있으며, 이를 통해 세포 및 조직 수준에서의 반응에 유연성과 정밀성을 부여한다. 이 경로는 인터루킨(IL), 인터페론(IFN), 성장인자, 호르몬 등 다양한 리간드에 의해 활성화된다.JAK-STAT 경로의 활성화는 사이토카인이 세포막 사이토카인 수용체에 결합하면서 시작된다. 사이토카인 결합은 수용체에 결합된 JAK의 자가인산화 및 상호인산화(phosphorylation)를 유도하고, 이에 따라 수용체의 세포질 도메인 내 특정 티로신 잔기가 인산화된다.이 인산화 부위는 Src homology 2(SH2) 도메인을 가진 STAT 단백질의 도킹 부위로 작용하며, STAT은 이곳에 결합한 후 JAK에 의해 인산화되어 활성화된다. 활성화된 STAT은 수용체로부터 분리되어 동종 또는 이종 이합체(dimerization)를 형성한 뒤, 핵으로 이동하여 특정 DNA 서열에 결합함으로써 전사인자로서 유전자 발현을 조절한다(Figure 3). 모낭의 면역 특권(immune privilege, IP)이란 무엇인가? 모낭은 성장기(anagen phase) 동안 자가항원에 대한 면역 반응을 회피하기 위해 면역 특권(IP)이라는 국소적 면역억제 환경을 형성한다. 이는 MHC class I 및 II 분자의 발현 억제, 형질전환 성장인자(transforming growth factor-beta,TGF-β), 알파 멜라닌세포자극호르몬(alpha-melanocyte-stimulating hormone, α-MSH, IL-10 등의 면역조절 인자의 발현, 그리고 NK 및 T 세포 억제 인자의 작용을 통해 이루어진다.이러한 면역 특권은 외부 항원으로부터 모낭 줄기세포 및 멜라닌세포와 같은 면역학적으로 취약한 구조물을 보호하는 역할을 한다. 특히, 모낭 상피 줄기세포는 자가면역성 공격 중에도 보존되므로, 항염증 치료 후에도 모발 재생의 가능성을 보여준다.그러나 원형탈모증에서는 이러한 면역 특권이 국소적으로 붕괴되어 유도되는 자가면역 질환이다. 면역 특권의 손실은 세포독성 T 세포(cytotoxic T cell)의 한 종류인 CD8& 8314; NKG2D& 8314; T 세포(CD8& 8314; Natural Killer Group 2 Member D& 8314; T cell)의 모낭 침윤, IFN-γ 및 IL-15와 같은 염증 촉진성 사이토카인(pro-inflammatory cytokine)의 과발현, CXCR3& 8211;CXCL9/10 축을 통한 림프구 유입 등이 복합적으로 작용하여 모낭 파괴와 탈모가 유도된다(Figure 4). 요약하면, 원형탈모증에서 사이토카인은 자가면역 반응의 유도, 증폭, 유지에 핵심적인 역할을 하며, 특히 IFN-γ, IL-15, CXCL10 등의 염증 촉진성 사이토카인은 모낭 면역 특권 붕괴 및 세포독성 T 세포의 활성화를 매개한다. 반면, TGF-β 및 IL-10과 같은 염증 억제성 사이토카인의 감소는 이 균형을 더욱 악화시킨다. 이러한 사이토카인 네트워크는 JAK/STAT 신호전달 경로와 밀접히 연관되어 있어, 현재 JAK 억제제를 포함한 다양한 표적 치료제의 개발 근거로 활용되고 있다.현재 원형탈모증 치료제에는 어떤 약제를 사용하는가?원형탈모증은 흉터를 남기지 않는 자가면역성 탈모 질환으로, 모낭 수준에서의 만성 염증을 특징으로 한다. 임상적으로는 국소적이고 경계가 명확한 두피 병변부터 전신 및 두피의 광범위한 탈모에 이르기까지 다양한 양상으로 나타날 수 있다.현재 치료법은 두피 및 체모 침범 정도에 따라 달라지며, 경증의 경우 국소 도포제 및 병변 내 스테로이드 주사(intralesional corticosteroid injection)가 1차 치료로 사용되며, 중등도에서 중증의 경우 전신 면역억제제가 주요 치료법이다. 국소 스테로이드 주사는 두피나 눈썹 부위의 탈모 병변에 직접 주사할 수 있으며, 작은 병변에 가장 효과적인 치료법이다. 또한, 전신 스테로이드제(경구용)는 고용량으로 경구 투여하면 모발 재성장이 유도될 수 있으나, 치료 중단 시 탈모가 재발하는 경우가 많다.외용제로 디트라놀(Dithranol) 크림은 주로 건선(psoriasis) 치료에 사용되는 크림으로, 피부에 자극 반응을 유도함으로써 모발 성장 자극 효과가 보고된 바 있다. 또한 미녹시딜(Minoxidil) 로션은 탈모 부위에 도포하면 일부 환자에서 미세한 모발 성장을 유도할 수 있다.경구용 면역억제제(Sulfasalazine, Methotrexate, Cyclosporine, Azathioprine 등)는 면역 반응을 억제함으로써 기존 치료에 반응하지 않는 중증 원형탈모증 환자에서 제한적으로 사용된다.프로스타글란딘 유사체(Prostaglandin analogs)로 라타노프로스트(Latanoprost), 비마토프로스트(Bimatoprost) 등은 안약 형태 약물이 속눈썹 성장 효과를 보이는 것으로 알려져 있다.JAK 억제제(Baricitinib, Ritlecitinib 등)은 JAK-STAT 신호전달을 차단함으로써 자가면역 반응을 억제하는 작용을 한다.JAK 억제제는 무엇인가? 모낭 상피세포(Follicular epithelial cells)에 MHC class I 분자와 NKG2D 리간드(예: MICA, ULBP 계열)를 비정상적으로 과발현하면, 이는 CD8& 8314; NKG2D& 8314; T 세포에 의해 인식되어 면역학적 공격의 대상이 된다. 이들 세포는 항원 제시 또는 세포 스트레스 신호에 반응하여 모낭 상피세포와 면역 접합부(immune synapse)를 형성하고, 이를 통해 세포독성 반응을 유도한다.CD8& 8314; NKG2D& 8314; T 세포는 진피로 침윤하여 모낭 구부(hair follicle bulb) 부위에 분포화되며, IFN-γ를 분비한다. 이는 모낭 상피세포에 발현된 IFN-γ 수용체와 결합하여 JAK1/JAK2 의존적 경로를 활성화시킨다. 이러한 자극은 모낭의 면역 특권을 붕괴시키고, 모발 주기의 퇴행기(catagen phase)로의 전환을 유도한다.동시에, IFN-γ 자극은 모낭 상피세포로 하여금 IL-15를 생성하도록 유도하며, 이 역시 JAK1 및 JAK2 경로를 통해 매개된다. 분비된 IL-15는 CD8& 8314; T 세포의 IL-15 수용체에 결합하고, JAK1/JAK3 경로를 통해 추가적으로 IFN-γ 생성을 촉진함으로써, 염증 촉진성 양성 피드백 루프가 증폭된다. 이 루프는 모낭 상피세포의 MHC class I과 NKG2D 리간드(MICA, ULBP-3 등)의 발현을 더욱 촉진하며, 지속적인 자가면역적 공격을 유도하여 원형탈모증의 병태생리에 중심적인 역할을 한다.따라서, IFN-γ는 MHC 분자 및 NKG2D 리간드의 비정상적인 발현을 유도함으로써 면역계에 의한 인식을 촉진하며, IL-15는 자가반응성 기억 T 세포(autoreactive memory T cell)의 생존과 증식을 조절하여 염증 반응을 지속시킨다. 이러한 면역 특권의 병리적 붕괴를 표적으로 하는 치료 전략의 가능성을 전임상 및 임상 연구들에서 제시해왔다.이에, 토파시티닙(Tofacitinib)은 주로 JAK1 및 JAK3를, 룩소리티닙)Ruxolitinib과 바리시티닙(Baricitinib)은 JAK1 및 JAK2를 선택적으로 억제함으로써, 해당 신호전달 경로의 다양한 단계를 차단할 수 있다. 이들 JAK 억제제는 염증 축진성 사이토카인 신호와 면역 활성화 루프를 차단하여, 원형탈모증에서의 염증 반응을 억제하고 모낭 파괴를 완화시키는 기전을 가진 것으로 보고되고 있다(Figure 5). 즉, 이러한 경로의 차단은 면역 특권을 부분적으로 복원하고, 염증세포의 침윤을 억제함으로써 치료적 효과를 보이는 것으로 보고되었다. JAK 억제제는 이러한 염증 신호를 억제함으로써 모낭의 자가면역 공격을 차단하고, 모발 재성장을 유도하는 표적 치료제로 주목받고 있다.현재 국내에서 승인된 JAK 억제제는? 현재 '바리시티닙(Baricitinib, Olumiant®, 릴리)', '리틀레시티닙(Ritlecitinib, Litfulo®, 화이자)'이 중증 원형탈모증(AA) 치료제로 승인되었다. 이들 약제는 모두 모낭 주변의 사이토카인 폭풍을 진정시켜 면역 매개 탈모를 억제하고, 모발 재성장을 촉진하는 기전을 공유한다. 이로써 JAK 억제제는 AA의 치료에 있어 새로운 치료 패러다임으로 자리 잡고 있다.먼저, 바리시티닙은 JAK1/2 억제제로, 2022년 미국 FDA 및 유럽 EMA, 2023년 한국 식약처로부터 성인 중증 원형탈모증 치료제로 승인받았다. 이 약제는 JAK1/2를 억제함으로써 IFN 계열 및 IL-6 등 광범위한 염증 촉진성 사이토카인의 신호전달을 차단한다.이 약제는 3상 BRAVE-AA1 및 BRAVE-AA2 임상시험의 결과를 기반으로 허가되었다. 총 1,200명의 성인을 대상으로 36주간 투여 후 평가한 결과, 4 mg 투여군의 35∼38%가 SALT 점수 ≤20(두피 모발 80% 이상 회복)을 달성하였으며, 이는 위약군(3∼6%) 대비 유의미한 차이를 보였다. 2 mg 투여군도 위약군에 비해 우월한 반응률(19∼23%)을 나타냈으나, 4 mg 투여군보다는 효과가 낮았다. 주된 이상반응은 상기도 감염, 두통, 여드름 등이었으며, 심각한 이상반응 발생률은 낮게 보고되었다.다음, 리틀레시티닙은 JAK3 및 TEC 계열 선택적 억제제로, 2023년 미국 및 유럽에서, 2024년 9월에는 국내에서 12세 이상 청소년 및 성인을 대상으로 한 중증 원형탈모증 치료제로 승인되었다. 이 이 야제는 JAK3 및 TEC를 억제함으로써 IL-2, IL-15 등 γc 공유 수용체 계열 사이토카인의 신호를 선택적으로 조절한다.이 약제는 ALLEGRO 2b/3상 및 ALLEGRO-LT 장기 추적 연구를 통해 임상적 근거가 확보되었으며, ALLEGRO 2b/3상에서는 총 718명의 환자를 대상으로 리틀레시티닙 50 mg 1일 1회 투여 시 24주 후 SALT 점수 ≤20 도달율이 23%로, 위약군(1.6%) 대비 우수하였다. 흔한 이상반응으로는 두통, 설사, 여드름, 발진 등이 있었고, 중대한 이상반응의 빈도는 낮고 대조군과 유사하였다.이러한 결과는 JAK 억제제가 중증 원형탈모증 치료에서 염증 촉진성 사이토카인 경로의 차단을 통해 염증 반응을 조절하고, 이는 모발 재생을 유도하는 효과적인 치료제로 볼 수 있다.듀룩솔리티닙은 어떤 약제인가? 듀룩솔리티닙(제품명: Leqselvi®, Sun Pharma)은 선택적 JAK 1/2 억제제로, 2024년 7월 미국 FDA로부터 ‘성인 중증 원형탈모증’ 치료제로 승인되었다. 이 약제는 기존 JAK 억제제인 룩솔리티닙(Ruxolitinib)의 중수소화 유사체(deuterated analog)로 개발되었으며, 중수소 치환을 통해 약물의 대사적 안정성 및 약동학적 특성을 개선한 것이 특징이다.중수소화(deuteration)는 기존 약물의 특정 수소(H)를 중수소(D)로 대체하는 동등한 생물학적 특성을 갖는 원자 치환 방식으로, 산화적 대사 반응을 늦춰 약물의 반감기를 연장하고, 혈중 농도 변동성을 감소시키며, 유해 대사체 생성을 억제할 수 있다. 이에 따라 이 약제는 구조적으로는 룩솔리티닙과 유사하지만, 약물 노출 유지 및 복용 효율성 측면에서 향상된 약동학적 이점을 갖는 2세대 JAK 억제제로 평가된다.전임상 연구에 따르면, 듀룩솔리티닙은 JAK1, JAK2 및 TYK2에 대해 높은 억제 활성을 나타내며, JAK3에 대해서는 상대적으로 낮은 억제력을 보인다. 하지만 이들 효소에 대한 선택적 억제가 임상 효과에 어떤 기여를 하는지에 대해서는 아직 명확한 인과관계가 확립되지 않았다.임상 적용 시, 듀룩솔리티닙은 다른 JAK 억제제, 생물학적 제제, 사이클로스포린 및 강력한 면역억제제와의 병용은 권장되지 않으며, 단독요법으로의 사용이 권장된다.이 약제는 중대한 감염, 악성 종양, 심혈관 질환, 혈전증 등의 발생 위험이 동반될 수 있어 주의가 필요하다. 이에 따라, 치료 전 잠복 결핵 및 B형 간염 검사, CYP2C9 유전자형 분석이 필요하며, 치료 도중 정기적인 간기능, 혈액학적 검사, 감염 모니터링이 요구된다.듀룩솔리티닙의 기전은? 원형탈모증(AA)의 병인 및 병태생리는 아직 완전히 규명되지 않았으나, 모낭의 면역 특권의 붕괴가 초기 변화로 작용하고, 이후 노출된 자가항원이 자가반응성 CD8& 8314; T 세포에 의해 인지되면서 면역반응이 유도되는 기전이 주요한 병리 과정이다. 듀룩솔리티닙의 약리 기전은 첫째, 이 약제는 JAK1과 JAK2를 선택적으로 억제함으로써, 다양한 염증 촉진성 사이토카인(예: IFN-γ, IL-2, IL-6, IL-15 등)의 신호전달을 차단하여 염증 반응을 감소시키고 모발 성장을 증진시킨다. 이러한 사이토카인들은 AA의 병태생리에서 중심적인 역할을 하며, T 세포의 활성화, 자연살해세포(NK cell)의 기능 조절, 모낭 주변의 염증 유도에 관여한다.특히, IFN-γ는 IFN-γ 수용체와 결합하여 모낭의 MHC class I 및 II 발현을 증가시켜 면역 특권을 붕괴시키며, 자가 반응성 CD8& 8314; T 세포의 공격을 유도한다. 이 약제는 IFN-γ 수용체 하위의 JAK1/JAK2를 억제함으로써 이러한 과정을 차단한다(Figure 6). 둘째, 이 약제는 JAK-STAT 경로 차단을 통해 MHC 분자의 발현을 감소시키고, 면역세포인 CD8& 8314; T 세포의 모낭 접근성을 차단하여 모낭의 면역 특권을 회복시킨다. 이는 자가면역 반응을 완화시키는 데 핵심적이다.셋째, 이 약제는 PD-1(programmed death-1)의 발현을 증가시켜 과활성화된 T 세포의 기능을 억제한다. PD-1은 T 세포의 기능적 소진(T-cell exhaustion)을 유도하는 대표적인 억제 수용체로, 지속적인 자가면역 반응을 억제하는 데 관여한다.넷째, 이 약제는 전임상 모델에서 진피유두세포(human dermal papilla cells)에서 Wnt/β-catenin 경로를 활성화하여 모낭의 성장기(anagen) 재진입을 유도함이 확인되었다. 또한 이 경로를 공유함으로써, 모낭 재생 및 탈모 회복 효과를 병행하는 치료적 우위를 갖는다.듀룩솔리티닙의 허가임상은? 듀룩솔리티닙(LEQSELVI)의 THRIVE-AA1과 2는 다기관, 무작위배정, 이중맹검, 위약 대조 3상 임상시험으로 6개월 이상 두피 탈모가 50% 이상인 성인 원형탈모증 환자 총 1,209명을 대상으로 평가하였다. 시험 대상자들은 24주 동안 이 약제 8mg을 하루 2회, 12mg을 하루 2회, 그리고 위약을 투여받았다.현재 승인된 용량은 8mg 하루 2회이며, 12mg 용량은 승인되지 않았다.베이스 라인에서 환자들의 평균 현재 탈모 에피소드 기간은 약 4년이었으며, 전체의 59%가 '완전 또는 거의 완전한 두피 탈모(두피 탈모 ≥ 95%) 상태였다. 치료군 간 통합된 기저 SALT(Severity of Alopecia Tool, 탈모 중증도 평가척도) 점수는 평균 85.9∼88.6 범위였고, 현재 탈모 에피소드의 평균 지속 기간은 3.7∼3.9년이었다. 이 외에도, 약 73%는 눈썹 탈모가, 70%는 속눈썹 탈모가 있었다.두 임상시험의 1차 평가 변수는 24주 시점에서 SALT 점수 ≤ 20(즉, 두피 모발이 80% 이상 회복된 상태)에 도달한 피험자의 비율이었다. 주요 2차 평가 변수에는 다음이 포함되었다:24주차 SPRO(Satisfaction of Hair Patient- Reported Outcome, 환자 만족도 자기보고 결과)에서 “만족” 또는 “매우 만족”이라고 응답한 비율 8, 12, 16, 20주차에 SALT 점수 ≤ 20을 달성한 피험자의 비율 24주 치료가 종료된 후, 환자들은 장기 연장 연구에 등록할 수 있는 자격이 주어졌다.두피 탈모 평가는 SALT 점수를 기준으로 이루어졌다. 24주 시점에서, 이 약제 8mg을 하루 두 번 복용한 환자군은 위약군에 비해 SALT ≤ 20(두피 모발 80% 이상 회복) 및 SALT ≤ 10(두피 모발 90% 이상 회복)에 도달한 비율이 더 높았다.Clinical Response at Week 24 in Adult Subjects with Severe AA in Trials AA-1 and AA-2 어떤 쟁점이 있는가? 듀룩솔리티닙은 룩솔리티닙(Ruxolitinib)의 중수소화 유도체로 개발된 선택적 JAK1/2 억제제이며, 동일한 표적 선택성을 유지하면서도 약동학적 특성 개선을 목표로 설계되었다. 이 약제는 IFN-γ, IL-15 등 염증 촉진성 사이토카인의 신호 전달을 차단함으로써 모낭에 대한 면역학적 공격을 억제하고, 탈모 진행을 늦추며 모발 재생을 유도한다.국내에 소개된 JAK 억제제 중 바리시티닙은 최초로 승인된 중증 원형탈모증 치료제로, JAK1/2 억제를 통해 자가면역 질환 전반에 적용 가능하지만, 장기 복용에 따른 심혈관계 이상 및 악성종양 발생 위험 등 안전성 우려가 지속적으로 제기되어 왔다.이에 듀룩솔리티닙은 이러한 기존 약물과 달리 2세대 JAK 억제제로서, 특히 8mg 1일 2회 투여 시 우수한 치료 반응을 보였다. 바리시티닙과 리틀레시티닙이 1일 1회 복용 방식인 반면, 듀룩솔리티닙은 1일 2회 복용이 권장되어 혈중 농도 유지와 반응률 개선에는 이점이 있지만, 복약 순응도 측면에서는 불리할 수 있다.임상 유효성(SALT score ≤20 도달률) 측면에서, 바리시티닙 4mg은 36주 후 약 35∼38%, 2mg은 19∼23%, 위약군은 3∼6%, 리틀레시티닙 50mg은 24주 후 23%, 위약군은 1.6%였다. 반면, 듀룩솔리티닙 8mg은 24주 후 약 30%, 위약군은 1% 미만으로 유의한 차이를 나타냈다.추가해서, 듀룩솔리티닙의 경우 고용량(12mg)의 효과는 더 높았으나, 해당 용량은 미국 FDA 승인 대상에서 제외되었으며, 24주 시점의 자료만으로는 장기 안전성과 지속적 유효성을 판단하기에는 제한적이므로, 향후 보완 임상자료 확보가 필요할 것으로 보인다. 8mg 경우에도 감염, 악성 종양, 심혈관 질환, 혈전증 등의 발생 위험이 동반될 수 있어 주의가 필요하다한편, 듀룩솔리티닙의 개발사인 Sun Pharma는 룩솔리티닙의 원 개발사인 Incyte로부터 특허 침해 소송에 직면하였으나, 2025년 4월 9일 미국 연방순회항소법원이 예비 금지 명령을 해제함으로써, 미국 내 시판이 가능해졌다.참고로, 룩솔리티닙은 현재 외용제로 개발되어 2021년 아토피 피부염, 2022년 백반증 치료제로 FDA 승인을 받았으나, 원형탈모증에 대해서는 제한적 효과로 인해 승인되지 않았다.이러한 결과는 듀룩솔리티닙이 룩솔리티닙 대비 구조적 차별성과 약동학적 개선을 기반으로 중증 원형탈모증 치료에서 유의미한 치료 옵션이 될 수 있음을 시사한다.현 상황에서 듀룩솔리티닙은 아직 유럽 EMA의 승인을 받지 않은 상태이다. 따라서 유럽 시장 진입을 위한 추가 임상 데이터와 장기 안전성 자료 확보, 그리고 규제기관의 평가 결과를 주의 깊게 지켜볼 필요가 있다.향후 미국 FDA에서 12mg에 대한 추가 승인 및 유럽 EMA 승인까지 이루어진다면, 국내에서도 긍정적으로 판단될 것으로 예상하며, 이는 중증 원형탈모증 치료 전략의 다양성을 확대하는 데 기여할 것으로 기대된다.참고문헌& 8203; 1. Maddison Lensing, Ali Jabbari “An overview of JAK/STAT pathways and JAK inhibition in alopecia areata” Front Immunol. 2022 Aug 30;13:955035. 2. Melinda Gooderham “Small molecules: an overview of emerging therapeutic options in the treatment of psoriasis“ Skin Therapy Letter 2013;18(7):1-4 3. Michael D. Howell, Fiona I. Kuo, Paul A. Smith ”Targeting the Janus Kinase Family in Autoimmune Skin Diseases“ Front. Immunol. 10:2342(2019). 4. Chen Xue, Qinfan Yao, Xinyu Gu, Qingmiao Shi, et al. “Evolving cognition of the JAK-STAT signaling pathway: autoimmune disorders and cancer“ Signal Transduction and Targeted Therapy 2023;8:204). 5. Dante Dahabreh, Seungyeon Jung, Yael Renert-Yuval, et al. “Alopecia Areata: Current Treatments and New Directions” Am J Clin Dermatol. 2023;24(6):886-912 6. Dagmar Gotthardt, Jana Trifinopoulos, Veronika Sexl and Eva Maria Putz “ JAK/STAT Cytokine Signaling at the Crossroad of NK Cell Development and Maturation” Front. Immunol. 2019;10:2590. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-05-30 06:40:26최병철 박사
원형탈모 치료제 '렉셀비', 세 번째 경구 JAK 억제제4편: 세 번째 경구 JAK 억제제, 원형탈모증 치료제 렉셀비(Deuruxolitinib)렉셀비(Leqselvi®, lek-sel-vee, 성분명: 듀룩소리티닙, Deuruxolitinib, Sun Pharma)는 미국 FDA로부터 2024년 7월에 성인 중증 원형탈모증(alopecia areata) 치료제로 승인되었다.이 약제는 세 번째 경구용 JAK(Janus kinase) 억제제로, 특히 JAK1과 JAK2를 선택적으로 억제하여 면역 반응을 조절함으로써 탈모를 유발하는 염증 경로를 차단한다. 현재 유럽 EMA에서는 승인되지 않았다.원형탈모증(Alopecia areata, AA)은 비반흔성(non-scarring) 자가면역성 탈모 질환으로, 주로 성장기(anagen phase)의 모낭(hair follicle)이 면역계의 표적이 되어 발생한다. 임상적으로는 국소성 탈모에서 전신 탈모(alopecia universalis)에 이르기까지 다양한 양상을 보인다.여러 연구들은 원형탈모증의 병태생리가 모낭 면역 특권(hair follicle immune privilege)의 붕괴와 밀접하게 연관되어 있음을 밝히며, 최근 이러한 병태생리에 기반한 JAK 억제제들이 개발되면서 치료 패러다임에 중요한 변화가 일어나고 있다.JAK는 원형탈모증의 염증 촉진성 사이토카인(pro-inflammatrory cytokines) 신호전달에서 핵심적인 역할을 하며, 이에 따라 JAK 억제제는 중증 원형탈모증 치료의 유망한 약물 계열로 부상하고 있다. 실제로 미국 FDA는 JAK 억제제인 바리시티닙(Baricitinib)과 리틀레시티닙(Ritlecitinib)을 중증 원형탈모증 치료제로 승인하였고, 국내에도 이미 소개되어 있다.이어 세 번째 경구용 JAK 억제제인 듀룩소리티닙은 JAK1과 JAK2를 선택적으로 억제하고 TYK2도 일부 억제함으로써 염증 반응을 조절하고, 림프구 기능을 부분적으로 유지하는 것이 특징이다. 특히 IFN-γ, IL-2, IL-6, IL-15 등의 광범위한 염증 촉진성 사이토카인에 작용하여, 면역 조절 효과를 극대화한다.듀룩소리티닙의 승인은 두 건의 다국적 3상 임상시험인 THRIVE-AA1 및 THRIVE-AA2를 근거로 이루어졌다. 이들 연구에서는 중증 원형탈모증 환자(두피 탈모 범위 ≥50%) 총 1,220명의 성인 환자를 대상으로 24주간 치료를 시행한 결과, 약 30%의 환자에서 두피 모발의 80% 이상이 회복(SALT 점수 ≤20)되는 유의미한 임상적 개선 효과가 확인되었다.사이토카인(Cytokine)이란 무엇인가?사이토카인은 면역세포를 비롯한 다양한 세포에 의해 생성되며, 주로 폴리펩타이드(polypeptide) 또는 당단백질(glycoprotein)의 형태로 존재하는 세포 간 신호 전달 분자이다.이들은 자가분비(autocrine) 및 측분비(paracrine) 경로를 통해 작용하면서 세포의 증식, 분화, 생존, 그리고 활성화와 같은 핵심 생물학적 과정을 정교하게 조절한다.사이토카인은 특정 세포군에 국한되지 않고, 면역세포뿐만 아니라 상피세포, 섬유아세포, 혈관내피세포 등 다양한 비면역세포에서도 발현될 수 있다. 이는 하나의 사이토카인이 여러 종류의 세포에 작용할 수 있으며, 서로 다른 사이토카인이 동일한 생물학적 효과를 유도하는 경우도 흔하게 관찰된다. 이러한 특성은 세포 간 신호 전달 경로를 복잡하고도 정교하게 구성하게 한다.사이토카인의 작용은 선천 및 후천 면역 반응의 조절뿐 아니라 염증 반응의 유도와 조절, 조직 재생( tissue regeneration), 생체 항상성(homeostasis)의 유지 등 다양한 생리적 과정에서 핵심적인 조절자 역할을 수행한다.사이토카인의 계열로는 인터루킨(interleukins, ILs), 인터페론(interferons, IFNs), 종양괴사인자(tumor necrosis factors, TNFs), 집락자극인자(colony-stimulating factors, CSFs), 케모카인(chemokines), 성장인자(growth factors) 등이 있으며, 이들은 각기 다른 수용체에 결합하여 세포 내 신호전달을 유도하고 세포의 기능적 운명을 결정짓는다.이들 사이토카인은 면역 반응의 시작, 유지, 해소에 관여하는 저분자 단백질로서, 면역세포 간의 신호 전달을 매개하는 주요 인자이다. 이들은 일반적으로 염증 촉진성(pro-inflammatory)과 염증 억제성(anti-inflammatory)으로 분류되며, 세포 내 신호전달, 면역세포의 활성화 상태, 조직 환경 등에 따라 상황 의존적으로 조절된다이러한 두 사이토카인 계열 간의 균형은 병원체 방어와 면역 항상성 유지에 결정적인 역할을 하며, 이 균형이 깨질 경우 자가면역 질환, 만성 염증 또는 면역 억제 상태로 이어질 수 있다.이 중 염증 촉진성 사이토카인은 선천면역 반응 초기 단계에서 빠르게 분비되어 병원체에 대한 방어를 유도하며, 항원제시세포(APC)의 활성화, T 세포 분화, 염증성 케모카인 생성 등을 매개한다. 대표적인 염증성 사이토카인으로는 IFN-γ, IL-1β, IL-6, TNF-α, IL-12, IL-15, IL-17, IL-23 등이 있다.반면, 염증 억제성 사이토카인은 염증 반응을 억제하거나 종결시키는 방향으로 작용하며, 면역 관용 유지 및 조직 복구에 관여한다. 대표적인 억제성 사이토카인으로는 TGF-β, IL-4, IL-10, IL-13, IL-27, IL-35 등이 있다.이와 같이, 두 사이토카인은 상호작용을 통해 면역 반응의 강도와 범위를 조절하며, 이들의 균형은 감염 방어와 자가면역 예방 사이에서 정교하게 조절된다.따라서, 사이토카인(리간드)이 해당 수용체에 결합하면, 수용체에 연계된 JAK가 활성화된다. 활성화된 JAK는 자가 티로신 잔기를 인산화하여 자신의 키나아제 활성을 증가시키며, 이어서 STAT 단백질을 인산화한다. 인산화된 STAT는 이형 혹은 동형 다이머(dimer)를 형성한 후 핵으로 이동하여, 표적 유전자의 전사(transcription)를 촉진한다(Figure 1). 사이토카인 수용체(Cytokine receptors)의 분류와 역할은? 사이토카인 수용체는 사이토카인과의 특이적인 결합을 통해 세포 내 신호 전달을 유도하는 막관통 단백질(transmembrane proteins)이다.사이토카인 수용체는 기능적으로는 결합하는 리간드의 종류에 따라 인터루킨 수용체, 인터페론 수용체, 종양괴사인자(TNF) 수용체, 케모카인 수용체, 조혈자극인자(CSF) 수용체, 성장인자 수용체 등으로 분류되며, 각각 특정한 세포 신호 경로를 통해 고유의 생리학적 효과를 매개한다.또한, 구조적 유사성과 진화적 상동성을 기준으로 분류하면, 크게 제1형 및 제2형 사이토카인 수용체, 케모카인 수용체 계열, TNF 수용체 초계열(superfamily), TGF-β 수용체 계열, 그리고 면역글로불린(Ig) 수용체 초계열로 나뉜다. 각 계열은 공통된 구조적 도메인 및 신호전달 기전을 공유하며, 세포의 운명 결정에 중요한 신호를 전달한다.이 중 제1형 사이토카인 수용체(Type I cytokine receptors)은 다양한 사이토카인에 반응하는 세포막 수용체로, 주로 인터루킨(IL)과 같은 사이토카인을 인식한다. 이 계열에는 IL-2(β-서브유닛), IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-12, GM-CSF, G-CSF, 에리스로포이에틴(EPO), LIF, CNTF, TPO(혈소판생성인자), 프로락틴, 성장호르몬 등의 수용체가 있다. 이들 수용체 대부분 JAK-STAT 경로를 통해 세포 내로 신호를 전달한다.또한, 제2형 사이토카인 수용체(Type II cytokine receptors)는 주로 인터페론 계열 및 일부 인터루킨 계열의 사이토카인을 인식하며, 제1형과는 기능적 구조 단위(motif)와 도메인의 구성 및 배열 방식에서 구조적 차이를 보인다. 이 계열에는 IFN-α, IFN-β, IFN-γ, IL-10, IL-22, Tissue factor 등이 있다. 이들 수용체는 리간드 결합 도메인에서 구조적 유사성을 가지며, JAK-STAT 경로를 통해 세포 내로 신호를 전달한다.JAK(Janus kinase)란 무엇인가? JAK는 세포막을 직접 관통하지 않는 비수용체형 티로신 단백질 키나아제((non-receptor tyrosine kinase)로, 사이토카인 수용체의 세포질 도메인에 결합해 세포 외부의 신호를 세포 내부로 전달하는 데 핵심적인 역할을 한다.JAK는 일반적으로 두 개의 기능적 도메인으로 구성되며, 하나는 기질의 인산화를 수행하는 tyrosine kinase 도메인이고, 다른 하나는 촉매 활성을 갖지 않는 pseudokinase 도메인이다. 이러한 이중적인 구조는 로마 신화에서 두 얼굴을 가진 신인 ‘야누스(Janus)’를 연상시키며, Janus kinase라는 명칭의 유래가 되었다.JAK는 단순한 키나아제 활성을 넘어, 수용체 복합체의 안정화, 수용체의 세포 내 이동 및 성숙 조절, 그리고 SOCS(suppressor of cytokine signaling)와 같은 음성 조절인자와의 상호작용을 통해 신호 전달을 정밀하게 조율하는 기능도 수행한다. 이에는 JAK1, JAK2, JAK3 그리고 TYK2로 구분된다.JAK1은 대부분의 조직에서 발현되며, Type I 인터페론 수용체(IFN-α, IFN-β 등), Type II 인터페론 수용체(IFN-γ), IL-6 계열 수용체, 그리고 γc(공통 감마사슬) 수용체와 연계되어 작용한다. 이러한 분자들과의 상호작용을 통해 JAK1은 면역 및 염증 반응의 조절에 중심적인 역할을 한다.JAK2는 다양한 조직에서 광범위하게 발현되며, erythropoietin(EPO), thrombopoietin(TPO), granulocyte colony-stimulating factor(G-CSF) 등 호르몬 유사 사이토카인의 수용체에 특이적으로 작용한다. 이러한 기능을 통해 JAK2는 조혈 및 배아 발생 과정에 필수적인 역할을 한다.JAK3는 주로 골수 및 림프계 조직(T 세포, B 세포, NK 세포 등)에서 특이적으로 발현되며, γc(공통 감마사슬)를 공유하는 IL-2, IL-4, IL-7, IL-9, IL-15, IL-21 수용체에 한정적으로 결합하여 림프구의 발달 및 항상성 유지에 관여한다.TYK2는 Type I 인터페론 수용체를 비롯하여 IL-12 및 IL-23 수용체의 신호 전달에 관여하며, 항바이러스 면역, Th1/Th17 관련 면역 반응, 자가면역 질환의 병태생리 조절에 핵심적인 역할을 한다.STAT(Signal transducer and activator of transcription)는 무엇인가? STAT은 세포 외부의 사이토카인 또는 성장인자 자극을 핵 내 유전자 전사로 연결하는 전사 조절 인자로서, JAK-STAT 경로의 주요 하위 신호 전달자로 기능한다. STAT 단백질은 면역 반응, 염증 조절, 세포 생존 및 분화 등 다양한 생리적 과정에 관여하며, 이들의 활성 이상은 자가면역질환, 염증성 질환, 종양 등의 병태생리와 밀접하게 연관되어 있다.현재까지 밝혀진 STAT은 총 7종(STAT1, STAT2, STAT3, STAT4, STAT5A, STAT5B, STAT6)으로 구성되며, 각 STAT 단백질은 특정 사이토카인 자극에 의해 선택적으로 인산화된 후 이합체(homodimer 또는 heterodimer)를 형성하여 핵으로 이동하고, 표적 유전자의 전사를 조절한다.각 JAK 단백질은 STAT1~4, STAT5A/B, STAT6 등 다양한 STAT 인자들과 선택적으로 결합하며, 이는 특정 리간드-수용체 조합에 따른 하위 신호 전달의 특이성을 매개하는 데 중요한 역할을 한다. 예를 들어, IL-4 수용체는 JAK1과 JAK3의 이종이합체를 형성하여 STAT6를 주로 활성화한다. 이러한 다양성은 사이토카인 신호의 선택성과 세포 특이적 반응을 정밀하게 조절하는 분자적 기반을 제공한다(Figure 2). 이처럼 JAK 계열 단백질은 면역, 염증, 조혈, 항바이러스 반응을 포함한 다양한 생리적·병리적 기능의 중심에서 핵심적 신호전달 플랫폼으로 작용하며, 이를 표적으로 하는 JAK 억제제는 자가면역질환, 염증성 질환, 혈액암 등에서 치료 전략으로 각광받고 있다.JAK-STAT(Janus kinase-Signal transducer and activator of transcription) 경로는 무엇인가?사이토카인과 성장인자는 JAK-STAT 신호 전달 경로를 활성화하는 주요 인자로, 진화적으로 잘 보존되어 있는 신호 체계이다. 이러한 경로는 점균류(slime mold)와 같은 단순한 진핵생물부터 인간에 이르기까지 다양한 생물에서 발견되며, 세포 간 의사소통을 가능하게 하기 위해 진화한 가장 초기의 신호 전달 기전 중 하나이다. 이후 이 경로는 다양한 세포 내 신호전달 기전과 함께 진화하면서, 특정 리간드에 반응하는 정교하고 특이적인 신호 전달 시스템으로 발전하게 되었다.JAK-STAT 경로는 유전자 발현을 정밀하게 조절하여 세포 기능의 다양성과 항상성을 유지하고, 세포 증식, 분화, 이동, 생존, 세포사멸 등 다양한 생물학적 현상을 조절한다. 이 경로는 자극의 종류와 세포 및 조직 환경에 따라 상이한 생리적 반응을 유도하며, 조혈, 면역세포 발달, 줄기세포 항상성, 개체 성장, 유선 발달 등 필수적인 생물학적 과정에서 핵심적인 기능을 담당한다.현재까지 50종 이상의 사이토카인 및 펩타이드 호르몬이 이 경로를 통해 신호를 전달하는 것으로 밝혀져 있으며, 이를 통해 세포 및 조직 수준에서의 반응에 유연성과 정밀성을 부여한다. 이 경로는 인터루킨(IL), 인터페론(IFN), 성장인자, 호르몬 등 다양한 리간드에 의해 활성화된다.JAK-STAT 경로의 활성화는 사이토카인이 세포막 사이토카인 수용체에 결합하면서 시작된다. 사이토카인 결합은 수용체에 결합된 JAK의 자가인산화 및 상호인산화(phosphorylation)를 유도하고, 이에 따라 수용체의 세포질 도메인 내 특정 티로신 잔기가 인산화된다.이 인산화 부위는 Src homology 2(SH2) 도메인을 가진 STAT 단백질의 도킹 부위로 작용하며, STAT은 이곳에 결합한 후 JAK에 의해 인산화되어 활성화된다. 활성화된 STAT은 수용체로부터 분리되어 동종 또는 이종 이합체(dimerization)를 형성한 뒤, 핵으로 이동하여 특정 DNA 서열에 결합함으로써 전사인자로서 유전자 발현을 조절한다(Figure 3). 모낭의 면역 특권(immune privilege, IP)이란 무엇인가? 모낭은 성장기(anagen phase) 동안 자가항원에 대한 면역 반응을 회피하기 위해 면역 특권(IP)이라는 국소적 면역억제 환경을 형성한다. 이는 MHC class I 및 II 분자의 발현 억제, 형질전환 성장인자(transforming growth factor-beta,TGF-β), 알파 멜라닌세포자극호르몬(alpha-melanocyte-stimulating hormone, α-MSH, IL-10 등의 면역조절 인자의 발현, 그리고 NK 및 T 세포 억제 인자의 작용을 통해 이루어진다.이러한 면역 특권은 외부 항원으로부터 모낭 줄기세포 및 멜라닌세포와 같은 면역학적으로 취약한 구조물을 보호하는 역할을 한다. 특히, 모낭 상피 줄기세포는 자가면역성 공격 중에도 보존되므로, 항염증 치료 후에도 모발 재생의 가능성을 보여준다.그러나 원형탈모증에서는 이러한 면역 특권이 국소적으로 붕괴되어 유도되는 자가면역 질환이다. 면역 특권의 손실은 세포독성 T 세포(cytotoxic T cell)의 한 종류인 CD8& 8314; NKG2D& 8314; T 세포(CD8& 8314; Natural Killer Group 2 Member D& 8314; T cell)의 모낭 침윤, IFN-γ 및 IL-15와 같은 염증 촉진성 사이토카인(pro-inflammatory cytokine)의 과발현, CXCR3& 8211;CXCL9/10 축을 통한 림프구 유입 등이 복합적으로 작용하여 모낭 파괴와 탈모가 유도된다(Figure 4). 요약하면, 원형탈모증에서 사이토카인은 자가면역 반응의 유도, 증폭, 유지에 핵심적인 역할을 하며, 특히 IFN-γ, IL-15, CXCL10 등의 염증 촉진성 사이토카인은 모낭 면역 특권 붕괴 및 세포독성 T 세포의 활성화를 매개한다. 반면, TGF-β 및 IL-10과 같은 염증 억제성 사이토카인의 감소는 이 균형을 더욱 악화시킨다. 이러한 사이토카인 네트워크는 JAK/STAT 신호전달 경로와 밀접히 연관되어 있어, 현재 JAK 억제제를 포함한 다양한 표적 치료제의 개발 근거로 활용되고 있다.현재 원형탈모증 치료제에는 어떤 약제를 사용하는가?원형탈모증은 흉터를 남기지 않는 자가면역성 탈모 질환으로, 모낭 수준에서의 만성 염증을 특징으로 한다. 임상적으로는 국소적이고 경계가 명확한 두피 병변부터 전신 및 두피의 광범위한 탈모에 이르기까지 다양한 양상으로 나타날 수 있다.현재 치료법은 두피 및 체모 침범 정도에 따라 달라지며, 경증의 경우 국소 도포제 및 병변 내 스테로이드 주사(intralesional corticosteroid injection)가 1차 치료로 사용되며, 중등도에서 중증의 경우 전신 면역억제제가 주요 치료법이다. 국소 스테로이드 주사는 두피나 눈썹 부위의 탈모 병변에 직접 주사할 수 있으며, 작은 병변에 가장 효과적인 치료법이다. 또한, 전신 스테로이드제(경구용)는 고용량으로 경구 투여하면 모발 재성장이 유도될 수 있으나, 치료 중단 시 탈모가 재발하는 경우가 많다.외용제로 디트라놀(Dithranol) 크림은 주로 건선(psoriasis) 치료에 사용되는 크림으로, 피부에 자극 반응을 유도함으로써 모발 성장 자극 효과가 보고된 바 있다. 또한 미녹시딜(Minoxidil) 로션은 탈모 부위에 도포하면 일부 환자에서 미세한 모발 성장을 유도할 수 있다.경구용 면역억제제(Sulfasalazine, Methotrexate, Cyclosporine, Azathioprine 등)는 면역 반응을 억제함으로써 기존 치료에 반응하지 않는 중증 원형탈모증 환자에서 제한적으로 사용된다.프로스타글란딘 유사체(Prostaglandin analogs)로 라타노프로스트(Latanoprost), 비마토프로스트(Bimatoprost) 등은 안약 형태 약물이 속눈썹 성장 효과를 보이는 것으로 알려져 있다.JAK 억제제(Baricitinib, Ritlecitinib 등)은 JAK-STAT 신호전달을 차단함으로써 자가면역 반응을 억제하는 작용을 한다.JAK 억제제는 무엇인가? 모낭 상피세포(Follicular epithelial cells)에 MHC class I 분자와 NKG2D 리간드(예: MICA, ULBP 계열)를 비정상적으로 과발현하면, 이는 CD8& 8314; NKG2D& 8314; T 세포에 의해 인식되어 면역학적 공격의 대상이 된다. 이들 세포는 항원 제시 또는 세포 스트레스 신호에 반응하여 모낭 상피세포와 면역 접합부(immune synapse)를 형성하고, 이를 통해 세포독성 반응을 유도한다.CD8& 8314; NKG2D& 8314; T 세포는 진피로 침윤하여 모낭 구부(hair follicle bulb) 부위에 분포화되며, IFN-γ를 분비한다. 이는 모낭 상피세포에 발현된 IFN-γ 수용체와 결합하여 JAK1/JAK2 의존적 경로를 활성화시킨다. 이러한 자극은 모낭의 면역 특권을 붕괴시키고, 모발 주기의 퇴행기(catagen phase)로의 전환을 유도한다.동시에, IFN-γ 자극은 모낭 상피세포로 하여금 IL-15를 생성하도록 유도하며, 이 역시 JAK1 및 JAK2 경로를 통해 매개된다. 분비된 IL-15는 CD8& 8314; T 세포의 IL-15 수용체에 결합하고, JAK1/JAK3 경로를 통해 추가적으로 IFN-γ 생성을 촉진함으로써, 염증 촉진성 양성 피드백 루프가 증폭된다. 이 루프는 모낭 상피세포의 MHC class I과 NKG2D 리간드(MICA, ULBP-3 등)의 발현을 더욱 촉진하며, 지속적인 자가면역적 공격을 유도하여 원형탈모증의 병태생리에 중심적인 역할을 한다.따라서, IFN-γ는 MHC 분자 및 NKG2D 리간드의 비정상적인 발현을 유도함으로써 면역계에 의한 인식을 촉진하며, IL-15는 자가반응성 기억 T 세포(autoreactive memory T cell)의 생존과 증식을 조절하여 염증 반응을 지속시킨다. 이러한 면역 특권의 병리적 붕괴를 표적으로 하는 치료 전략의 가능성을 전임상 및 임상 연구들에서 제시해왔다.이에, 토파시티닙(Tofacitinib)은 주로 JAK1 및 JAK3를, 룩소리티닙)Ruxolitinib과 바리시티닙(Baricitinib)은 JAK1 및 JAK2를 선택적으로 억제함으로써, 해당 신호전달 경로의 다양한 단계를 차단할 수 있다. 이들 JAK 억제제는 염증 축진성 사이토카인 신호와 면역 활성화 루프를 차단하여, 원형탈모증에서의 염증 반응을 억제하고 모낭 파괴를 완화시키는 기전을 가진 것으로 보고되고 있다(Figure 5). 즉, 이러한 경로의 차단은 면역 특권을 부분적으로 복원하고, 염증세포의 침윤을 억제함으로써 치료적 효과를 보이는 것으로 보고되었다. JAK 억제제는 이러한 염증 신호를 억제함으로써 모낭의 자가면역 공격을 차단하고, 모발 재성장을 유도하는 표적 치료제로 주목받고 있다.현재 국내에서 승인된 JAK 억제제는? 현재 '바리시티닙(Baricitinib, Olumiant®, 릴리)', '리틀레시티닙(Ritlecitinib, Litfulo®, 화이자)'이 중증 원형탈모증(AA) 치료제로 승인되었다. 이들 약제는 모두 모낭 주변의 사이토카인 폭풍을 진정시켜 면역 매개 탈모를 억제하고, 모발 재성장을 촉진하는 기전을 공유한다. 이로써 JAK 억제제는 AA의 치료에 있어 새로운 치료 패러다임으로 자리 잡고 있다.먼저, 바리시티닙은 JAK1/2 억제제로, 2022년 미국 FDA 및 유럽 EMA, 2023년 한국 식약처로부터 성인 중증 원형탈모증 치료제로 승인받았다. 이 약제는 JAK1/2를 억제함으로써 IFN 계열 및 IL-6 등 광범위한 염증 촉진성 사이토카인의 신호전달을 차단한다.이 약제는 3상 BRAVE-AA1 및 BRAVE-AA2 임상시험의 결과를 기반으로 허가되었다. 총 1,200명의 성인을 대상으로 36주간 투여 후 평가한 결과, 4 mg 투여군의 35∼38%가 SALT 점수 ≤20(두피 모발 80% 이상 회복)을 달성하였으며, 이는 위약군(3∼6%) 대비 유의미한 차이를 보였다. 2 mg 투여군도 위약군에 비해 우월한 반응률(19∼23%)을 나타냈으나, 4 mg 투여군보다는 효과가 낮았다. 주된 이상반응은 상기도 감염, 두통, 여드름 등이었으며, 심각한 이상반응 발생률은 낮게 보고되었다.다음, 리틀레시티닙은 JAK3 및 TEC 계열 선택적 억제제로, 2023년 미국 및 유럽에서, 2024년 9월에는 국내에서 12세 이상 청소년 및 성인을 대상으로 한 중증 원형탈모증 치료제로 승인되었다. 이 이 야제는 JAK3 및 TEC를 억제함으로써 IL-2, IL-15 등 γc 공유 수용체 계열 사이토카인의 신호를 선택적으로 조절한다.이 약제는 ALLEGRO 2b/3상 및 ALLEGRO-LT 장기 추적 연구를 통해 임상적 근거가 확보되었으며, ALLEGRO 2b/3상에서는 총 718명의 환자를 대상으로 리틀레시티닙 50 mg 1일 1회 투여 시 24주 후 SALT 점수 ≤20 도달율이 23%로, 위약군(1.6%) 대비 우수하였다. 흔한 이상반응으로는 두통, 설사, 여드름, 발진 등이 있었고, 중대한 이상반응의 빈도는 낮고 대조군과 유사하였다.이러한 결과는 JAK 억제제가 중증 원형탈모증 치료에서 염증 촉진성 사이토카인 경로의 차단을 통해 염증 반응을 조절하고, 이는 모발 재생을 유도하는 효과적인 치료제로 볼 수 있다.듀룩솔리티닙은 어떤 약제인가? 듀룩솔리티닙(제품명: Leqselvi®, Sun Pharma)은 선택적 JAK 1/2 억제제로, 2024년 7월 미국 FDA로부터 ‘성인 중증 원형탈모증’ 치료제로 승인되었다. 이 약제는 기존 JAK 억제제인 룩솔리티닙(Ruxolitinib)의 중수소화 유사체(deuterated analog)로 개발되었으며, 중수소 치환을 통해 약물의 대사적 안정성 및 약동학적 특성을 개선한 것이 특징이다.중수소화(deuteration)는 기존 약물의 특정 수소(H)를 중수소(D)로 대체하는 동등한 생물학적 특성을 갖는 원자 치환 방식으로, 산화적 대사 반응을 늦춰 약물의 반감기를 연장하고, 혈중 농도 변동성을 감소시키며, 유해 대사체 생성을 억제할 수 있다. 이에 따라 이 약제는 구조적으로는 룩솔리티닙과 유사하지만, 약물 노출 유지 및 복용 효율성 측면에서 향상된 약동학적 이점을 갖는 2세대 JAK 억제제로 평가된다.전임상 연구에 따르면, 듀룩솔리티닙은 JAK1, JAK2 및 TYK2에 대해 높은 억제 활성을 나타내며, JAK3에 대해서는 상대적으로 낮은 억제력을 보인다. 하지만 이들 효소에 대한 선택적 억제가 임상 효과에 어떤 기여를 하는지에 대해서는 아직 명확한 인과관계가 확립되지 않았다.임상 적용 시, 듀룩솔리티닙은 다른 JAK 억제제, 생물학적 제제, 사이클로스포린 및 강력한 면역억제제와의 병용은 권장되지 않으며, 단독요법으로의 사용이 권장된다.이 약제는 중대한 감염, 악성 종양, 심혈관 질환, 혈전증 등의 발생 위험이 동반될 수 있어 주의가 필요하다. 이에 따라, 치료 전 잠복 결핵 및 B형 간염 검사, CYP2C9 유전자형 분석이 필요하며, 치료 도중 정기적인 간기능, 혈액학적 검사, 감염 모니터링이 요구된다.듀룩솔리티닙의 기전은? 원형탈모증(AA)의 병인 및 병태생리는 아직 완전히 규명되지 않았으나, 모낭의 면역 특권의 붕괴가 초기 변화로 작용하고, 이후 노출된 자가항원이 자가반응성 CD8& 8314; T 세포에 의해 인지되면서 면역반응이 유도되는 기전이 주요한 병리 과정이다. 듀룩솔리티닙의 약리 기전은 첫째, 이 약제는 JAK1과 JAK2를 선택적으로 억제함으로써, 다양한 염증 촉진성 사이토카인(예: IFN-γ, IL-2, IL-6, IL-15 등)의 신호전달을 차단하여 염증 반응을 감소시키고 모발 성장을 증진시킨다. 이러한 사이토카인들은 AA의 병태생리에서 중심적인 역할을 하며, T 세포의 활성화, 자연살해세포(NK cell)의 기능 조절, 모낭 주변의 염증 유도에 관여한다.특히, IFN-γ는 IFN-γ 수용체와 결합하여 모낭의 MHC class I 및 II 발현을 증가시켜 면역 특권을 붕괴시키며, 자가 반응성 CD8& 8314; T 세포의 공격을 유도한다. 이 약제는 IFN-γ 수용체 하위의 JAK1/JAK2를 억제함으로써 이러한 과정을 차단한다(Figure 6). 둘째, 이 약제는 JAK-STAT 경로 차단을 통해 MHC 분자의 발현을 감소시키고, 면역세포인 CD8& 8314; T 세포의 모낭 접근성을 차단하여 모낭의 면역 특권을 회복시킨다. 이는 자가면역 반응을 완화시키는 데 핵심적이다.셋째, 이 약제는 PD-1(programmed death-1)의 발현을 증가시켜 과활성화된 T 세포의 기능을 억제한다. PD-1은 T 세포의 기능적 소진(T-cell exhaustion)을 유도하는 대표적인 억제 수용체로, 지속적인 자가면역 반응을 억제하는 데 관여한다.넷째, 이 약제는 전임상 모델에서 진피유두세포(human dermal papilla cells)에서 Wnt/β-catenin 경로를 활성화하여 모낭의 성장기(anagen) 재진입을 유도함이 확인되었다. 또한 이 경로를 공유함으로써, 모낭 재생 및 탈모 회복 효과를 병행하는 치료적 우위를 갖는다.듀룩솔리티닙의 허가임상은? 듀룩솔리티닙(LEQSELVI)의 THRIVE-AA1과 2는 다기관, 무작위배정, 이중맹검, 위약 대조 3상 임상시험으로 6개월 이상 두피 탈모가 50% 이상인 성인 원형탈모증 환자 총 1,209명을 대상으로 평가하였다. 시험 대상자들은 24주 동안 이 약제 8mg을 하루 2회, 12mg을 하루 2회, 그리고 위약을 투여받았다.현재 승인된 용량은 8mg 하루 2회이며, 12mg 용량은 승인되지 않았다.베이스 라인에서 환자들의 평균 현재 탈모 에피소드 기간은 약 4년이었으며, 전체의 59%가 '완전 또는 거의 완전한 두피 탈모(두피 탈모 ≥ 95%) 상태였다. 치료군 간 통합된 기저 SALT(Severity of Alopecia Tool, 탈모 중증도 평가척도) 점수는 평균 85.9∼88.6 범위였고, 현재 탈모 에피소드의 평균 지속 기간은 3.7∼3.9년이었다. 이 외에도, 약 73%는 눈썹 탈모가, 70%는 속눈썹 탈모가 있었다.두 임상시험의 1차 평가 변수는 24주 시점에서 SALT 점수 ≤ 20(즉, 두피 모발이 80% 이상 회복된 상태)에 도달한 피험자의 비율이었다. 주요 2차 평가 변수에는 다음이 포함되었다:24주차 SPRO(Satisfaction of Hair Patient- Reported Outcome, 환자 만족도 자기보고 결과)에서 “만족” 또는 “매우 만족”이라고 응답한 비율 8, 12, 16, 20주차에 SALT 점수 ≤ 20을 달성한 피험자의 비율 24주 치료가 종료된 후, 환자들은 장기 연장 연구에 등록할 수 있는 자격이 주어졌다.두피 탈모 평가는 SALT 점수를 기준으로 이루어졌다. 24주 시점에서, 이 약제 8mg을 하루 두 번 복용한 환자군은 위약군에 비해 SALT ≤ 20(두피 모발 80% 이상 회복) 및 SALT ≤ 10(두피 모발 90% 이상 회복)에 도달한 비율이 더 높았다.Clinical Response at Week 24 in Adult Subjects with Severe AA in Trials AA-1 and AA-2 어떤 쟁점이 있는가? 듀룩솔리티닙은 룩솔리티닙(Ruxolitinib)의 중수소화 유도체로 개발된 선택적 JAK1/2 억제제이며, 동일한 표적 선택성을 유지하면서도 약동학적 특성 개선을 목표로 설계되었다. 이 약제는 IFN-γ, IL-15 등 염증 촉진성 사이토카인의 신호 전달을 차단함으로써 모낭에 대한 면역학적 공격을 억제하고, 탈모 진행을 늦추며 모발 재생을 유도한다.국내에 소개된 JAK 억제제 중 바리시티닙은 최초로 승인된 중증 원형탈모증 치료제로, JAK1/2 억제를 통해 자가면역 질환 전반에 적용 가능하지만, 장기 복용에 따른 심혈관계 이상 및 악성종양 발생 위험 등 안전성 우려가 지속적으로 제기되어 왔다.이에 듀룩솔리티닙은 이러한 기존 약물과 달리 2세대 JAK 억제제로서, 특히 8mg 1일 2회 투여 시 우수한 치료 반응을 보였다. 바리시티닙과 리틀레시티닙이 1일 1회 복용 방식인 반면, 듀룩솔리티닙은 1일 2회 복용이 권장되어 혈중 농도 유지와 반응률 개선에는 이점이 있지만, 복약 순응도 측면에서는 불리할 수 있다.임상 유효성(SALT score ≤20 도달률) 측면에서, 바리시티닙 4mg은 36주 후 약 35∼38%, 2mg은 19∼23%, 위약군은 3∼6%, 리틀레시티닙 50mg은 24주 후 23%, 위약군은 1.6%였다. 반면, 듀룩솔리티닙 8mg은 24주 후 약 30%, 위약군은 1% 미만으로 유의한 차이를 나타냈다.추가해서, 듀룩솔리티닙의 경우 고용량(12mg)의 효과는 더 높았으나, 해당 용량은 미국 FDA 승인 대상에서 제외되었으며, 24주 시점의 자료만으로는 장기 안전성과 지속적 유효성을 판단하기에는 제한적이므로, 향후 보완 임상자료 확보가 필요할 것으로 보인다. 8mg 경우에도 감염, 악성 종양, 심혈관 질환, 혈전증 등의 발생 위험이 동반될 수 있어 주의가 필요하다한편, 듀룩솔리티닙의 개발사인 Sun Pharma는 룩솔리티닙의 원 개발사인 Incyte로부터 특허 침해 소송에 직면하였으나, 2025년 4월 9일 미국 연방순회항소법원이 예비 금지 명령을 해제함으로써, 미국 내 시판이 가능해졌다.참고로, 룩솔리티닙은 현재 외용제로 개발되어 2021년 아토피 피부염, 2022년 백반증 치료제로 FDA 승인을 받았으나, 원형탈모증에 대해서는 제한적 효과로 인해 승인되지 않았다.이러한 결과는 듀룩솔리티닙이 룩솔리티닙 대비 구조적 차별성과 약동학적 개선을 기반으로 중증 원형탈모증 치료에서 유의미한 치료 옵션이 될 수 있음을 시사한다.현 상황에서 듀룩솔리티닙은 아직 유럽 EMA의 승인을 받지 않은 상태이다. 따라서 유럽 시장 진입을 위한 추가 임상 데이터와 장기 안전성 자료 확보, 그리고 규제기관의 평가 결과를 주의 깊게 지켜볼 필요가 있다.향후 미국 FDA에서 12mg에 대한 추가 승인 및 유럽 EMA 승인까지 이루어진다면, 국내에서도 긍정적으로 판단될 것으로 예상하며, 이는 중증 원형탈모증 치료 전략의 다양성을 확대하는 데 기여할 것으로 기대된다.참고문헌& 8203; 1. Maddison Lensing, Ali Jabbari “An overview of JAK/STAT pathways and JAK inhibition in alopecia areata” Front Immunol. 2022 Aug 30;13:955035. 2. Melinda Gooderham “Small molecules: an overview of emerging therapeutic options in the treatment of psoriasis“ Skin Therapy Letter 2013;18(7):1-4 3. Michael D. Howell, Fiona I. Kuo, Paul A. Smith ”Targeting the Janus Kinase Family in Autoimmune Skin Diseases“ Front. Immunol. 10:2342(2019). 4. Chen Xue, Qinfan Yao, Xinyu Gu, Qingmiao Shi, et al. “Evolving cognition of the JAK-STAT signaling pathway: autoimmune disorders and cancer“ Signal Transduction and Targeted Therapy 2023;8:204). 5. Dante Dahabreh, Seungyeon Jung, Yael Renert-Yuval, et al. “Alopecia Areata: Current Treatments and New Directions” Am J Clin Dermatol. 2023;24(6):886-912 6. Dagmar Gotthardt, Jana Trifinopoulos, Veronika Sexl and Eva Maria Putz “ JAK/STAT Cytokine Signaling at the Crossroad of NK Cell Development and Maturation” Front. Immunol. 2019;10:2590. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-05-30 06:40:26최병철 박사 -
 정우신약 콘드로티, 1천억대 관절염 시장 도전장[데일리팜=노병철 기자] 정우신약이 최근 퇴행성관절염치료제 콘드로티정(ChondroT)에 대한 임상3상 IND 승인을 획득하며 제품 상용화 기대감이 고조되고 있다.콘드로티정은 18종의 한약재로 구성된 강활제통음을 기성 10종 한의서 문헌연구와 바이오 인포메틱스 기법을 이용해 4개의 후보군을 선정, 각각 실험실·동물실험 연구를 통해 가장 효과가 높은 5종의 한약재로 구성한 천연물의약품이다.정우신약은 임상실험을 통해 해당 약물이 MMP-1을 억제함으로써 연골세포를 보호하고, COX-2, iNOS의 발현을 억제해 프로스타글란딘을 억제하고, 염증성 사이토카인 TNF-α, IL-6, IL-1β의 분비를 제어함으로써 연골세포 보호효과와 항염증작용이 있는 것이 특징인 약리기전을 갖고 있다.동물모델에서도 안전성과 유효성을 확인, 인도메타신으로 유발된 흰쥐의 위장장애에 대해서도 위점막손상을 감소시키는 것으로 관찰됐다.정우신약은 콘드로티정의 염증성 관절질환 예방 또는 치료용 한약재 추출물 및 그 제조방법의 특허권자로 등록, 골관절염 치료제로서 2017~2019년까지 임상 2상-a를 실시해 최적의 용량군을 찾고 이에 대한 안전성과 유효성을 확인한 바 있다.아울러 이 약물은 2021년 한국보건산업진흥원 한의기반융합기수개발사업 '새로운 한약제제 신규 적응증 발굴 임상2상' 연구과제에 선정, 정부지원금 12억5000만원의 연구과제비를 지원받아 임상2상-b를 수행했다.한의기반융합기술개발사업은 보건복지부의 한의약진흥사업으로 기존 처방 중 신규 효능군 개발·새로운 조성 및 임상시험을 통한 우수한 한약제제를 개발하기 위한 국책과제다.콘드로티정 임상2상 결과 데이터. 이 약물의 휴식·활동 시 통증변수는 베이스라인 대비 100mm Pain VAS(시각 아날로그 평가척도) 변화량 차이가 약 15이상을 나타냈다. 박은경 정우신약 연구소장은 "관절염과 관련된 천연물의약품 상당수 시장에 출시돼 있지만 콘드로티정은 추출용매로서 알코올 성분을 사용하지 않고 PW(정제수) 추출로 제조된 주성분으로서 차별점을 가진다"고 밝혔다.정우채 정우신약 총괄기획실장도 "정우신약은 콘드로티정이 조인스정, 신바로정, 레일라정 뒤를 이을 천연물의약품으로서 고령화 시대에 맞는 국민의 건강에 기여할 수 있도록 연구개발에 아낌없는 투자를 진행해 나갈 것"이라고 말했다.콘드로티정은 임상2상 결과가 대조약 대비 안전·유효성 등 모든 평가변수에서 유의한 평가 결과를 얻었다.주요 평가변수로서 휴식·활동 시의 통증변수는 베이스라인 대비 100mm Pain VAS(시각 아날로그 평가척도) 변화량 차이가 약 15이상을 나타냈다.임상 2상(b)에서도 AE(이상반응)·SAE(중대이상반응) 등의 사례가 나타나지 않았으며, 26주 경구반복투여 독성시험 결과 또한 적합으로 확인되어 천연물의 장점이 두드러졌다.한편 이번 임상3상 IND 승인으로 국내 중·대형제약사들은 정우신약과의 공동개발 제안이 이어지고 있으며, 향후 3년 내 제품화를 목표로 하고 있다.2025-05-09 06:00:22노병철
정우신약 콘드로티, 1천억대 관절염 시장 도전장[데일리팜=노병철 기자] 정우신약이 최근 퇴행성관절염치료제 콘드로티정(ChondroT)에 대한 임상3상 IND 승인을 획득하며 제품 상용화 기대감이 고조되고 있다.콘드로티정은 18종의 한약재로 구성된 강활제통음을 기성 10종 한의서 문헌연구와 바이오 인포메틱스 기법을 이용해 4개의 후보군을 선정, 각각 실험실·동물실험 연구를 통해 가장 효과가 높은 5종의 한약재로 구성한 천연물의약품이다.정우신약은 임상실험을 통해 해당 약물이 MMP-1을 억제함으로써 연골세포를 보호하고, COX-2, iNOS의 발현을 억제해 프로스타글란딘을 억제하고, 염증성 사이토카인 TNF-α, IL-6, IL-1β의 분비를 제어함으로써 연골세포 보호효과와 항염증작용이 있는 것이 특징인 약리기전을 갖고 있다.동물모델에서도 안전성과 유효성을 확인, 인도메타신으로 유발된 흰쥐의 위장장애에 대해서도 위점막손상을 감소시키는 것으로 관찰됐다.정우신약은 콘드로티정의 염증성 관절질환 예방 또는 치료용 한약재 추출물 및 그 제조방법의 특허권자로 등록, 골관절염 치료제로서 2017~2019년까지 임상 2상-a를 실시해 최적의 용량군을 찾고 이에 대한 안전성과 유효성을 확인한 바 있다.아울러 이 약물은 2021년 한국보건산업진흥원 한의기반융합기수개발사업 '새로운 한약제제 신규 적응증 발굴 임상2상' 연구과제에 선정, 정부지원금 12억5000만원의 연구과제비를 지원받아 임상2상-b를 수행했다.한의기반융합기술개발사업은 보건복지부의 한의약진흥사업으로 기존 처방 중 신규 효능군 개발·새로운 조성 및 임상시험을 통한 우수한 한약제제를 개발하기 위한 국책과제다.콘드로티정 임상2상 결과 데이터. 이 약물의 휴식·활동 시 통증변수는 베이스라인 대비 100mm Pain VAS(시각 아날로그 평가척도) 변화량 차이가 약 15이상을 나타냈다. 박은경 정우신약 연구소장은 "관절염과 관련된 천연물의약품 상당수 시장에 출시돼 있지만 콘드로티정은 추출용매로서 알코올 성분을 사용하지 않고 PW(정제수) 추출로 제조된 주성분으로서 차별점을 가진다"고 밝혔다.정우채 정우신약 총괄기획실장도 "정우신약은 콘드로티정이 조인스정, 신바로정, 레일라정 뒤를 이을 천연물의약품으로서 고령화 시대에 맞는 국민의 건강에 기여할 수 있도록 연구개발에 아낌없는 투자를 진행해 나갈 것"이라고 말했다.콘드로티정은 임상2상 결과가 대조약 대비 안전·유효성 등 모든 평가변수에서 유의한 평가 결과를 얻었다.주요 평가변수로서 휴식·활동 시의 통증변수는 베이스라인 대비 100mm Pain VAS(시각 아날로그 평가척도) 변화량 차이가 약 15이상을 나타냈다.임상 2상(b)에서도 AE(이상반응)·SAE(중대이상반응) 등의 사례가 나타나지 않았으며, 26주 경구반복투여 독성시험 결과 또한 적합으로 확인되어 천연물의 장점이 두드러졌다.한편 이번 임상3상 IND 승인으로 국내 중·대형제약사들은 정우신약과의 공동개발 제안이 이어지고 있으며, 향후 3년 내 제품화를 목표로 하고 있다.2025-05-09 06:00:22노병철 -
 "치료옵션 부족한 화농성 한선염, 정책지원 필요"[데일리팜=황병우 기자] "화농성 한선염은 완치가 어려워 장기적인 치료가 필요하다. 희귀질환인 만큼 환자 수가 적고 치료 혜택이 확실한 질환에 대해서는 급여와 산정특례를 동시에 지원함으로서 치료 접근성을 높이는 것이 바람직하다."화농성 한선염은 현재까지 정확한 원인이나 병인이 완전히 밝혀지지 않은 질환으로 국내에서는 1% 미만의 유병률을 보이는 희귀질환이다.국내 화농성 한선염 환자 수는 2022년 기준 약 1만명 정도로 추산되는데, 이는 이미 병변이 반복적으로 발생하고 피부 아래에서 트랙이 형성되면서 명확하게 진단받은 환자만을 포함한다.TNF-α 억제제가 급여가 적용되는 치료옵션으로 있지만 치료 실패와 부작용 등의 상황을 고려했을 때 선택지가 제한적인 상황이다.고주연 한양대학교병원 피부과 교수 관련분야 최신지견을 가진 고주연 한양대학교병원 피부과 교수는 화농성 한선염 치료환경에서 옵션 확대를 통한 접근성 강화의 필요성을 강조했다.화농성 한선염은 피부밑의 피지와 관련된 조직 주변 곳곳에 종기가 발생한다. 일반적인 종기와는 달리 병변들이 서로 연결되어 일명 '트랙'이라고 불리는 통로를 형성한다는 특징이 있다.크게 ▲염증이 지속적으로 발생하는 활동성(Active) ▲더이상 염증이 발생하지 않는 비활성(Inactive) 등으로 구분하지만 질환 상태를 활동성과 비활성으로 명확하게 구분하기는 어렵다.고주연 교수는 "같은 환자라도 어떤 시기에는 매우 활동성이 높고, 다른 시기에는 상태가 안정적으로 개개인의 상태에 따라 사용하는 약제나 치료법도 달라질 수 있다"며 "활동성의 경우 겨드랑이 등에 발생하는 염증으로 심한 통증을 느끼고 이 경우 염증 발생 횟수를 낮추는 것이 치료의 목표다"고 설명했다.그는 이어 "경증-중등증 환자가 대학병원까지 오는 경우는 많지 않고, 1~2개 부위에 증상이 나타나는 경증 환자는 주로 개인병원에서 치료받는다"라며 "경증 환자에서 중증 진행 가능성을 파악하는 게 중요한데, 재발 빈도가 높을수록 중증 진행 가능성이 높다고 본다"고 밝혔다.치료옵션 제한된 화농성 한선염, IL-17 등장 불구 사용 허들화농성 한선염의 기본적인 치료는 환자가 통증을 느끼는 부위를 절개해 내부의 염증을 제거하는 I&D(Incision and Drainage)가 있다.여기에 항생제를 약 3개월간 투약해 염증을 가라앉히고, 재발 우려가 크다면 여드름 치료에 쓰이는 피지 억제제를 사용하기도 한다.다만 이러한 치료법은 중증에서는 염증이 충분히 조절되지 않아 생물학적제제를 사용하게 된다. 현재로서는 보험급여가 적용되는 TNF-α 억제제인 휴미라(아달리무맙)가 존재한다.이외에도 아직 급여는 적용되지 않고 있지만 인터루킨-17(IL-17) 억제제인 코센틱스(세누키누맙)가 2015년 휴미라 허가 이후 약 8년 만에 국내에 허가가 이뤄진 상태다.고 교수는 "보험급여가 적용되는 TNF-α 억제제는 염증을 광범위하게 차단한다는 장점이 있지만, 우리 몸에 필요로 하는 염증 반응까지 차단할 수 있다는 한계도 있다"며 "IL-17 억제제는 TNF-α 억제제 대비 보다 표적화된 기전으로, 유사한 수준의 치료 효과와 더 우수한 안전성을 보인다"고 말했다.해외와 국내 가이드라인을 봤을 때도 TNF-α 억제제와 IL-17 억제제 모두 동일한 선상인 1차 치료 옵션으로 권고되는 중이다. 경구 약제로 충분한 치료 효과를 보지 못하는 경우, 두 가지 허가된 생물학적제제 중 하나를 선택할 수 있다.이에 대해 고 교수는 "국내에서 TNF-α 억제제가 보험급여가 적용된 지 5년이 넘었지만, 실제 진료 현장에서 사용하는 환자는 많지 않다. TNF-α 억제제는 염증을 폭넓게 억제하는 기전으로 부작용의 우려가 존재하는데, 이런 부분을 설명하면 환자들이 선뜻 사용하려고 하지 않기 때문이다"고 설명했다.실제 치료에서도 IL-17 억제제(코센틱스)를 투여한 환자의 경우, 1년 반 동안 치료를 지속하며 삶의 질이 매우 상승했다는 게 고 교수의 평가. 이전에는 증상이 심해 수술을 받고 팔을 제대로 움직이지 못할 정도였지만, 치료 후 증상이 현저히 개선됐으며 항생제 등 다른 약제 사용도 25% 수준으로 감소했다.고 교수는 "코센틱스는 글로벌 임상에서 HiSCR 50을 달성한 환자가 약 60%로 나타났다. 증상이 50% 이상 개선된 환자가 전체의 60%라는 의미로, 증상이 50% 개선됐다고 하면 높지 않다고 생각할 수 있는데, 실제로는 굉장히 좋아지는 것이다"고 전했다.이어 그는 "화농성 한선염은 젊은 나이에 생겨 오래 관리를 해야하는 질환이기 때문에 부작용이 적은 약제로 제어하는 것이 가장 좋은 방법이다. 이런 측면에서 현재까지는 코센틱스가 좋은 옵션이라고 생각된다"고 언급했다."희귀난치성 질환 화농성 한선염…제한 없는 산정특례 지원 필요"다만 IL-17 억제제인 코센틱스의 사용에도 제약이 있다. 급여가 적용되는 휴미라와 달리 코센티스는 아직 급여가 적용되지 않기 때문이다.실제 한국노바티스는 지난해 11월 코센티스의 화농성 한선염에 대한 급여 확대를 신청했지만 아직까지 보장성 확대 논의는 답보상태에 있는 것으로 알려졌다.고 교수는 "IL-17 억제제는 이미 건선에서 사용 경험이 풍부한 약제인 만큼 코센틱스를 보다 선호하는 경향이 있지만, 비급여이기 때문에 적극적으로 사용하기는 어려운 상황"이라며 "현재는 TNF-α 억제제를 사용하다가 충분한 효과를 보지 못하는 경우, 코센틱스를 사용하려면 굉장히 높은 비용을 부담해야 한다"고 언급했다.특히 고 교수는 약가 등 현실적인 상황을 고려해 생물학적제제 내에서도 치료차수를 구분하는 것도 고려할 수 있지만 의학적 관점에서는 부작용이 적은 방법을 선택하는 고민이 필요하다고 강조했다.그는 "TNF-α 억제제를 1차로 사용하고 효과를 보지 못하는 경우 후속 치료로 코센틱스를 사용하도록 하는 것이 대안이 될 수 있으나, 의학적으로 이상적인 접근이라고 할 수 없다"며 "장기적으로는 결국 두 치료제가 동일한 선상에서 사용될 수 있도록 급여를 적용하는 것이 바람직하다"고 말했다.이와 함께 고 교수는 희귀난치성 질환인 화농성 한선염에 산정특례를 적용하는 정책적 지원이 필요하다고 강조했다.현재 화농성 한선염은 중증도를 구분해 중증 환자에게만 제한적으로 산정특례와 보험급여 혜택을 적용받고 있지만 전체 환자 수가 1만명 정도로 많지 않고, 그 중 중증 환자는 천 명 미만으로 추정되는 상황에서 급여와 산정특례를 동시에 적용해도 재정에 큰 부담이 없을 것이라는 제언이다.고 교수는 "화농성 한선염과 같이 환자 수가 적고 치료 혜택이 확실한 질환에 대해서는 급여와 산정특례를 동시에 지원함으로서 치료 접근성을 높이는 것이 필요하다"며 "급여와 산정특례가 동시 적용되더라도 실제 코센틱스를 사용하게 될 환자는 연간 수십 명 이내로 예상된다"고 밝혔다.끝으로 그는 "현재 화농성 한선염 치료에 효과적인 약제들이 계속해서 등장하고 있고, 앞으로도 더 좋은 약제들이 개발될 것이다. 환자들이 희망을 잃지 않고, 반드시 의료진과 적극적으로 상의하고 치료에 나섰으면 하는 바람이다"고 덧붙였다.2025-04-30 06:00:11황병우
"치료옵션 부족한 화농성 한선염, 정책지원 필요"[데일리팜=황병우 기자] "화농성 한선염은 완치가 어려워 장기적인 치료가 필요하다. 희귀질환인 만큼 환자 수가 적고 치료 혜택이 확실한 질환에 대해서는 급여와 산정특례를 동시에 지원함으로서 치료 접근성을 높이는 것이 바람직하다."화농성 한선염은 현재까지 정확한 원인이나 병인이 완전히 밝혀지지 않은 질환으로 국내에서는 1% 미만의 유병률을 보이는 희귀질환이다.국내 화농성 한선염 환자 수는 2022년 기준 약 1만명 정도로 추산되는데, 이는 이미 병변이 반복적으로 발생하고 피부 아래에서 트랙이 형성되면서 명확하게 진단받은 환자만을 포함한다.TNF-α 억제제가 급여가 적용되는 치료옵션으로 있지만 치료 실패와 부작용 등의 상황을 고려했을 때 선택지가 제한적인 상황이다.고주연 한양대학교병원 피부과 교수 관련분야 최신지견을 가진 고주연 한양대학교병원 피부과 교수는 화농성 한선염 치료환경에서 옵션 확대를 통한 접근성 강화의 필요성을 강조했다.화농성 한선염은 피부밑의 피지와 관련된 조직 주변 곳곳에 종기가 발생한다. 일반적인 종기와는 달리 병변들이 서로 연결되어 일명 '트랙'이라고 불리는 통로를 형성한다는 특징이 있다.크게 ▲염증이 지속적으로 발생하는 활동성(Active) ▲더이상 염증이 발생하지 않는 비활성(Inactive) 등으로 구분하지만 질환 상태를 활동성과 비활성으로 명확하게 구분하기는 어렵다.고주연 교수는 "같은 환자라도 어떤 시기에는 매우 활동성이 높고, 다른 시기에는 상태가 안정적으로 개개인의 상태에 따라 사용하는 약제나 치료법도 달라질 수 있다"며 "활동성의 경우 겨드랑이 등에 발생하는 염증으로 심한 통증을 느끼고 이 경우 염증 발생 횟수를 낮추는 것이 치료의 목표다"고 설명했다.그는 이어 "경증-중등증 환자가 대학병원까지 오는 경우는 많지 않고, 1~2개 부위에 증상이 나타나는 경증 환자는 주로 개인병원에서 치료받는다"라며 "경증 환자에서 중증 진행 가능성을 파악하는 게 중요한데, 재발 빈도가 높을수록 중증 진행 가능성이 높다고 본다"고 밝혔다.치료옵션 제한된 화농성 한선염, IL-17 등장 불구 사용 허들화농성 한선염의 기본적인 치료는 환자가 통증을 느끼는 부위를 절개해 내부의 염증을 제거하는 I&D(Incision and Drainage)가 있다.여기에 항생제를 약 3개월간 투약해 염증을 가라앉히고, 재발 우려가 크다면 여드름 치료에 쓰이는 피지 억제제를 사용하기도 한다.다만 이러한 치료법은 중증에서는 염증이 충분히 조절되지 않아 생물학적제제를 사용하게 된다. 현재로서는 보험급여가 적용되는 TNF-α 억제제인 휴미라(아달리무맙)가 존재한다.이외에도 아직 급여는 적용되지 않고 있지만 인터루킨-17(IL-17) 억제제인 코센틱스(세누키누맙)가 2015년 휴미라 허가 이후 약 8년 만에 국내에 허가가 이뤄진 상태다.고 교수는 "보험급여가 적용되는 TNF-α 억제제는 염증을 광범위하게 차단한다는 장점이 있지만, 우리 몸에 필요로 하는 염증 반응까지 차단할 수 있다는 한계도 있다"며 "IL-17 억제제는 TNF-α 억제제 대비 보다 표적화된 기전으로, 유사한 수준의 치료 효과와 더 우수한 안전성을 보인다"고 말했다.해외와 국내 가이드라인을 봤을 때도 TNF-α 억제제와 IL-17 억제제 모두 동일한 선상인 1차 치료 옵션으로 권고되는 중이다. 경구 약제로 충분한 치료 효과를 보지 못하는 경우, 두 가지 허가된 생물학적제제 중 하나를 선택할 수 있다.이에 대해 고 교수는 "국내에서 TNF-α 억제제가 보험급여가 적용된 지 5년이 넘었지만, 실제 진료 현장에서 사용하는 환자는 많지 않다. TNF-α 억제제는 염증을 폭넓게 억제하는 기전으로 부작용의 우려가 존재하는데, 이런 부분을 설명하면 환자들이 선뜻 사용하려고 하지 않기 때문이다"고 설명했다.실제 치료에서도 IL-17 억제제(코센틱스)를 투여한 환자의 경우, 1년 반 동안 치료를 지속하며 삶의 질이 매우 상승했다는 게 고 교수의 평가. 이전에는 증상이 심해 수술을 받고 팔을 제대로 움직이지 못할 정도였지만, 치료 후 증상이 현저히 개선됐으며 항생제 등 다른 약제 사용도 25% 수준으로 감소했다.고 교수는 "코센틱스는 글로벌 임상에서 HiSCR 50을 달성한 환자가 약 60%로 나타났다. 증상이 50% 이상 개선된 환자가 전체의 60%라는 의미로, 증상이 50% 개선됐다고 하면 높지 않다고 생각할 수 있는데, 실제로는 굉장히 좋아지는 것이다"고 전했다.이어 그는 "화농성 한선염은 젊은 나이에 생겨 오래 관리를 해야하는 질환이기 때문에 부작용이 적은 약제로 제어하는 것이 가장 좋은 방법이다. 이런 측면에서 현재까지는 코센틱스가 좋은 옵션이라고 생각된다"고 언급했다."희귀난치성 질환 화농성 한선염…제한 없는 산정특례 지원 필요"다만 IL-17 억제제인 코센틱스의 사용에도 제약이 있다. 급여가 적용되는 휴미라와 달리 코센티스는 아직 급여가 적용되지 않기 때문이다.실제 한국노바티스는 지난해 11월 코센티스의 화농성 한선염에 대한 급여 확대를 신청했지만 아직까지 보장성 확대 논의는 답보상태에 있는 것으로 알려졌다.고 교수는 "IL-17 억제제는 이미 건선에서 사용 경험이 풍부한 약제인 만큼 코센틱스를 보다 선호하는 경향이 있지만, 비급여이기 때문에 적극적으로 사용하기는 어려운 상황"이라며 "현재는 TNF-α 억제제를 사용하다가 충분한 효과를 보지 못하는 경우, 코센틱스를 사용하려면 굉장히 높은 비용을 부담해야 한다"고 언급했다.특히 고 교수는 약가 등 현실적인 상황을 고려해 생물학적제제 내에서도 치료차수를 구분하는 것도 고려할 수 있지만 의학적 관점에서는 부작용이 적은 방법을 선택하는 고민이 필요하다고 강조했다.그는 "TNF-α 억제제를 1차로 사용하고 효과를 보지 못하는 경우 후속 치료로 코센틱스를 사용하도록 하는 것이 대안이 될 수 있으나, 의학적으로 이상적인 접근이라고 할 수 없다"며 "장기적으로는 결국 두 치료제가 동일한 선상에서 사용될 수 있도록 급여를 적용하는 것이 바람직하다"고 말했다.이와 함께 고 교수는 희귀난치성 질환인 화농성 한선염에 산정특례를 적용하는 정책적 지원이 필요하다고 강조했다.현재 화농성 한선염은 중증도를 구분해 중증 환자에게만 제한적으로 산정특례와 보험급여 혜택을 적용받고 있지만 전체 환자 수가 1만명 정도로 많지 않고, 그 중 중증 환자는 천 명 미만으로 추정되는 상황에서 급여와 산정특례를 동시에 적용해도 재정에 큰 부담이 없을 것이라는 제언이다.고 교수는 "화농성 한선염과 같이 환자 수가 적고 치료 혜택이 확실한 질환에 대해서는 급여와 산정특례를 동시에 지원함으로서 치료 접근성을 높이는 것이 필요하다"며 "급여와 산정특례가 동시 적용되더라도 실제 코센틱스를 사용하게 될 환자는 연간 수십 명 이내로 예상된다"고 밝혔다.끝으로 그는 "현재 화농성 한선염 치료에 효과적인 약제들이 계속해서 등장하고 있고, 앞으로도 더 좋은 약제들이 개발될 것이다. 환자들이 희망을 잃지 않고, 반드시 의료진과 적극적으로 상의하고 치료에 나섰으면 하는 바람이다"고 덧붙였다.2025-04-30 06:00:11황병우
오늘의 TOP 10
- 1'또 창고형' 광주 2곳 개설 움직임…대형마트에도 입점
- 2환자 6% 줄었는데 진료건수 60% 증가...소청과의 역설
- 3보령, 6개월새 5배 뛴 바이젠셀 지분 절반 매각
- 4연말 절세 전략만으론 부족…약국 세무조사 리스크 커진다
- 5충북 국립소방병원 진료 시작...약국은 2곳 개업
- 6위탁 제네릭 5년새 94%↓...규제 강화에 진입 억제
- 7에임드, 상장 3주 만에 몸값 6배↑…유한 평가액 1천억 돌파
- 8동아ST, 로봇수술 '베르시우스' 허가 신청…중소병원 공략 시동
- 9또 터진 의료인 흉기 협박 범죄...의협 "강력한 처벌해야"
- 10PNH 신약 속속 추가…기전·투여 편의성 경쟁구도 확대
-
상품명최고최저평균
-
케토톱플라스타(34매)13,00013,00013,000
-
게보린(10정)4,0003,0003,620
-
노스카나겔(20g)22,00018,00020,703
-
베나치오에프액(75ml)1,0008001,000
-
비코그린에스(20정)5,0004,0004,417















![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[위고비] 직거래 최저가](https://cdn.platpharm.co.kr/2025/12/2512020211090000013.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
