총 4건
-
 화상투약기 13개 약효군 추가 확대, 전문가 회의 재개[데일리팜=강혜경 기자] 화상투약기 취급 약효군 확대를 놓고 전문가 회의가 재개되면서 급물살을 탈지 관심이 쏠린다. 데일리팜 취재를 종합해 보면 국무조정실은 19일 규제부처인 보건복지부와 주무부처인 과학기술정보통신부, 전문가인 약대교수 등이 참석한 가운데 전문가 회의를 개최했다. 이날 회의에서도 13개 약효군을 추가로 확대하는 데 대해서는 합의를 이루지 못한 것으로 파악됐다. 신청기업인 쓰리알코리아는 종전 ▲해열·진통·소염제 ▲진경제 ▲안과용제 ▲항히스타민제 ▲진해거담제 ▲정장제 ▲하제 ▲제산제 ▲진토제 ▲화농성 질환용제 ▲진통·진양·수렴·소염제 등 11개 약효군에 더해 ▲건위소화제 ▲기타의 소화기관용약 ▲기타의 순환계용약(청심원제) ▲외피용제 ▲외피용 살균소독제 ▲사전피임제 ▲치과구강용제 ▲이비과용제 ▲수면유도제 ▲기타화학 요법제 ▲기생성 피부질환용제 ▲이담제 ▲소화성 궤양용제 등을 추가 확대해 줄 것을 요청했다. 신산업규제혁신위원회 역시 '심야·공휴일 시간에 국민의 의약품 접근성이 개선될 수 있고, 특히 긴급 응급상황에서도 쉽게 일반의약품을 구매할 수 있으며 안전상비의약품은 편의점에서도 판매되고 있다는 점 등을 고려할 때 판매 대상 약효군 확대를 통해 국민편익 증대가 기대되므로 기업이 요청한 13개의 약효군 확대를 수용해 줄 것'을 해당 규제특례위원회에 권고했다. 하지만 복지부가 13개 약효군 확대에 대한 이견을 제시하면서, 이를 조정하기 위한 부처간 재논의가 이뤄지고 있는 것. 복지부는 13개 약효군이 아닌 5개 약효군에 대한 부분 허용안을 제시하고 있는 것으로 알려졌다. 국조실 관계자는 "복지부가 약효군별로, 특정품목에 대해서는 일반의약품임에도 불구하고 안전성 우려가 된다는 의견을 제시해 전문가 회의에서 관련한 논의가 이뤄졌다. 신청 업체에 자료 보완을 요청했으며, 전문가 검토를 거쳐 재논의 하자는 데 우선 의견이 모아졌다"며 "다음 번 회의는 일련의 검토 과정을 거쳐 진행될 예정"이라고 말했다. 국조실은 5월 16일에도 규제개혁위원회를 열어 앞서 제시됐던 권고사항과 추가 권고사항 등에 대해 논의한 바 있다. 쓰리알코리아는 심의위 권고안을 놓고 이행이 지지부진 한 데 대해 불만을 표하고 있다. 회사 관계자는 "심의위에서 13개 약효군을 추가 확대하도록 결론이 났음에도 불구하고 복지부의 반대로 지지부진한 상황"이라고 불편을 기색을 보였다. 약사회는 "추가 회의까지 2~3주 정도 시간이 소요될 것으로 전망된다. 약사회는 대면원칙을 훼손하는 화상투약기에 대해 강력히 반대하는 바이며, 보건의료분야를 규제샌드박스 대상에서 제외해야 한다는 입장"이라며 "의약품과 환자 안전을 최우선으로 해야 하는 의료분야 특성상 부작용과 안전성 문제가 충분히 검토되지 않은 채 상용화되는 규제샌드박스 제도를 재검토해야 한다"고 촉구했다.2025-06-23 17:26:21강혜경
화상투약기 13개 약효군 추가 확대, 전문가 회의 재개[데일리팜=강혜경 기자] 화상투약기 취급 약효군 확대를 놓고 전문가 회의가 재개되면서 급물살을 탈지 관심이 쏠린다. 데일리팜 취재를 종합해 보면 국무조정실은 19일 규제부처인 보건복지부와 주무부처인 과학기술정보통신부, 전문가인 약대교수 등이 참석한 가운데 전문가 회의를 개최했다. 이날 회의에서도 13개 약효군을 추가로 확대하는 데 대해서는 합의를 이루지 못한 것으로 파악됐다. 신청기업인 쓰리알코리아는 종전 ▲해열·진통·소염제 ▲진경제 ▲안과용제 ▲항히스타민제 ▲진해거담제 ▲정장제 ▲하제 ▲제산제 ▲진토제 ▲화농성 질환용제 ▲진통·진양·수렴·소염제 등 11개 약효군에 더해 ▲건위소화제 ▲기타의 소화기관용약 ▲기타의 순환계용약(청심원제) ▲외피용제 ▲외피용 살균소독제 ▲사전피임제 ▲치과구강용제 ▲이비과용제 ▲수면유도제 ▲기타화학 요법제 ▲기생성 피부질환용제 ▲이담제 ▲소화성 궤양용제 등을 추가 확대해 줄 것을 요청했다. 신산업규제혁신위원회 역시 '심야·공휴일 시간에 국민의 의약품 접근성이 개선될 수 있고, 특히 긴급 응급상황에서도 쉽게 일반의약품을 구매할 수 있으며 안전상비의약품은 편의점에서도 판매되고 있다는 점 등을 고려할 때 판매 대상 약효군 확대를 통해 국민편익 증대가 기대되므로 기업이 요청한 13개의 약효군 확대를 수용해 줄 것'을 해당 규제특례위원회에 권고했다. 하지만 복지부가 13개 약효군 확대에 대한 이견을 제시하면서, 이를 조정하기 위한 부처간 재논의가 이뤄지고 있는 것. 복지부는 13개 약효군이 아닌 5개 약효군에 대한 부분 허용안을 제시하고 있는 것으로 알려졌다. 국조실 관계자는 "복지부가 약효군별로, 특정품목에 대해서는 일반의약품임에도 불구하고 안전성 우려가 된다는 의견을 제시해 전문가 회의에서 관련한 논의가 이뤄졌다. 신청 업체에 자료 보완을 요청했으며, 전문가 검토를 거쳐 재논의 하자는 데 우선 의견이 모아졌다"며 "다음 번 회의는 일련의 검토 과정을 거쳐 진행될 예정"이라고 말했다. 국조실은 5월 16일에도 규제개혁위원회를 열어 앞서 제시됐던 권고사항과 추가 권고사항 등에 대해 논의한 바 있다. 쓰리알코리아는 심의위 권고안을 놓고 이행이 지지부진 한 데 대해 불만을 표하고 있다. 회사 관계자는 "심의위에서 13개 약효군을 추가 확대하도록 결론이 났음에도 불구하고 복지부의 반대로 지지부진한 상황"이라고 불편을 기색을 보였다. 약사회는 "추가 회의까지 2~3주 정도 시간이 소요될 것으로 전망된다. 약사회는 대면원칙을 훼손하는 화상투약기에 대해 강력히 반대하는 바이며, 보건의료분야를 규제샌드박스 대상에서 제외해야 한다는 입장"이라며 "의약품과 환자 안전을 최우선으로 해야 하는 의료분야 특성상 부작용과 안전성 문제가 충분히 검토되지 않은 채 상용화되는 규제샌드박스 제도를 재검토해야 한다"고 촉구했다.2025-06-23 17:26:21강혜경 -
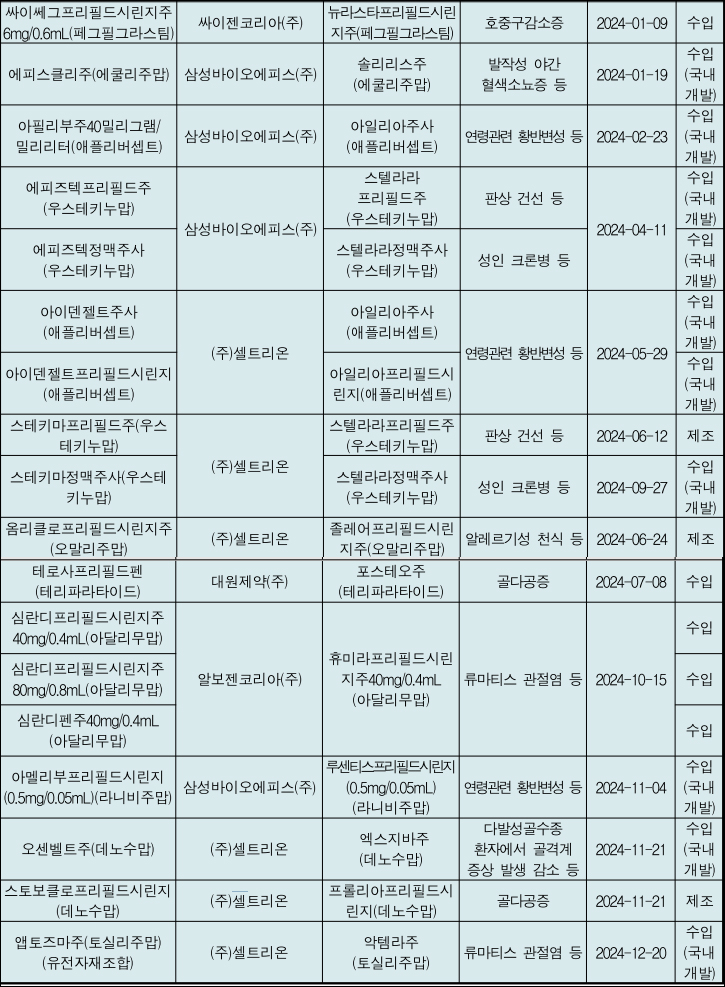 바이오시밀러 역대 최다 허가...셀트리온·삼바 장악[데일리팜=이혜경 기자] 지난해 동등생물의약품(바이오시밀러)으로 총 18개 품목(10개 성분)이 허가 되면서, 2012년 최초 품목허가 이래 가장 많이 허가된 것으로 나타났다. 이 중 절반 이상인 7개 성분 13품목이 국내 개발 품목이며, 2024년까지 허가된 총 72개 품목(35개 성분) 중 52개 품목(24개 성분)이 국내 개발 품목으로 약 72%를 차지하고 있다. 또한 18개 품목 가운데 8개 품목은 셀트리온이 5개 품목은 삼성바이오에피스로 대부분의 바이오시밀러는 2개 업체가 허가를 장악하고 있었 허가 비중을 차지하고 있다. 특허 만료를 앞둔 원개발사의 품목이 다수 있어 국내 기업의 동등생물의약품 개발이 활발히 지속될 것으로 기대된다. 식품의약품안전처(처장 오유경)는 2024년 의약품, 의약외품, 의료기기의 허가·인증·신고 등 현황을 담은 허가보고서를 29일 발간했다. 보고서를 보면 2024년 의약품은 총 1197품목이 허가·신고된 것으로 나타났다. 전체 품목 중 허가품목이 566품목(47.3%)이고 신고품목이 631품목(52.7%)으로 신고품목이 허가품목 대비 높은 비율을 차지했으며 전년도 대비 허가 품목수는 319품목이 감소하고 신고 품목 수는 167품목 증가했다. 완제의약품은 1,132품목(81.6%), 원료의약품은 65품목(4.7%), 한약재는 190품목(13.7%)으로 완제의약품 중 전문의약품은 48.6%(550품목), 일반의약품은 51.4%(582품목)로 전문의약품의 비율은 낮아지고 일반의약품의 비율은 증가한 것으로 나타났다. 지난해 신규 허가& 8228;지정된 신약은 총 23품목으로 화학의약품 11품목(제조 2품목, 수입 9품목), 생물의약품 12품목(수입 12품목)이었으며, 첨단바이오의약품과 한약(생약)제제로서 허가된 신약은 없었다. 19개 신약 성분이 포함된 신약이 허가·지정됐으며 화학의약품 10개 성분, 생물의약품 9개 성분이다. 국내 제조 신약(2품목, 2성분)에 비해 수입 신약(21품목, 17성분)의 허가 품목수 및 성분 수가 더 많은 비중을 차지해 신물질 대부분이 수입 신약으로 개발되었음을 알 수 있다. 국내 개발 신약은 매년 1~2품목(2015년, 2021년도에는5품목)씩 꾸준히 허가됐으나 2023년에는 없었으며, 2024년에 허가된 국내 개발신약은 1품목이었다. 2024년 주요 허가 동향으로 ▲희귀의약품 허가 증가세 지속 ▲‘순환계용약’이 가장 큰 비중 ▲동등생물의약품(바이오시밀러) 역대 최다 허가 등이다. 희귀의약품은 지난해보다 2개 품목이 증가한 총 26개 성분, 39품목이 허가됐으며, 이 중 급성 골수성 백혈병 치료제 등 항악성종양제가 16품목으로 가장 많다. 이에 따라 희귀 난치질환으로 고통받는 환자들의 치료 접근성이 더욱 높아질 것으로 기대된다. 지난해 허가·신고된 완제의약품을 약효군별로 살펴보면, 해열·진통·소염제 등 신경계용의약품(19.3%), 고혈압치료제 등 순환계용의약품(18.9%), 당뇨병치료제 등 대사성의약품(14.8%), 해열& 8228;진통& 8228;7소염제 등 신경계용의약품(14.0%), 위궤양치료제 등 소화기관용의약품 및 항바이러스제 등 외피용약(6.8%), 항히스타민제 등 알레르기용약(5.4%) 순으로 나타났다. 특히 은행엽건조엑스 등을 주성분으로 하는 순환계용약이 총 161품목으로 가장 많이 허가됐고, 해열·진통·소염제(146품목)과 당뇨병용제(127품목), 기타 비타민제(99품목), 항악성종양제(39품목)가 뒤를 이었다. 제네릭의약품 등 허가·신고 품목 수는 2023년 대비 다소 증가한 총 845품목이었다. 이는 2021년 7월부터 동일한 임상시험자료를 다른 품목에 사용할 수 있는 횟수를 3회로 제한한 효과로 보이며, 최근 3년간 유사한 수준인 것으로 볼 때 제도가 안정적으로 정착한 것으로 보인다. 지난해 자료제출의약품의 허가 현황(개량신약 3품목 제외)을 살펴보면, 제조 173품목(94.5%), 수입 10품목(5.5%)으로 제조품목이 높은 비중을 차지했으며, 허가심사유형별로는 새로운 조성 또는 함량 증감 의약품 42.7%(78품목)이 가장 많은 품목을 보였다. 그 다음으로 새로운 제형 39.9%(73품목) 의약품 순이었다. 새로운 염 또는 이성체 등으로 허가된 화학의약품은 제조 27품목으로 허가됐으며, 기허가 당뇨병용제인 리나글립틴을 리나글립틴베실산염으로 개발한 품목이22품목(81.5%), 시타글립틴인산염수화물을 시타글립틴염산염으로 개발한 품목이 2품목(7.4%)으로 당뇨병용제가 가장 많은 비율(88.9%)을 차지했다.2025-04-29 11:17:38이혜경
바이오시밀러 역대 최다 허가...셀트리온·삼바 장악[데일리팜=이혜경 기자] 지난해 동등생물의약품(바이오시밀러)으로 총 18개 품목(10개 성분)이 허가 되면서, 2012년 최초 품목허가 이래 가장 많이 허가된 것으로 나타났다. 이 중 절반 이상인 7개 성분 13품목이 국내 개발 품목이며, 2024년까지 허가된 총 72개 품목(35개 성분) 중 52개 품목(24개 성분)이 국내 개발 품목으로 약 72%를 차지하고 있다. 또한 18개 품목 가운데 8개 품목은 셀트리온이 5개 품목은 삼성바이오에피스로 대부분의 바이오시밀러는 2개 업체가 허가를 장악하고 있었 허가 비중을 차지하고 있다. 특허 만료를 앞둔 원개발사의 품목이 다수 있어 국내 기업의 동등생물의약품 개발이 활발히 지속될 것으로 기대된다. 식품의약품안전처(처장 오유경)는 2024년 의약품, 의약외품, 의료기기의 허가·인증·신고 등 현황을 담은 허가보고서를 29일 발간했다. 보고서를 보면 2024년 의약품은 총 1197품목이 허가·신고된 것으로 나타났다. 전체 품목 중 허가품목이 566품목(47.3%)이고 신고품목이 631품목(52.7%)으로 신고품목이 허가품목 대비 높은 비율을 차지했으며 전년도 대비 허가 품목수는 319품목이 감소하고 신고 품목 수는 167품목 증가했다. 완제의약품은 1,132품목(81.6%), 원료의약품은 65품목(4.7%), 한약재는 190품목(13.7%)으로 완제의약품 중 전문의약품은 48.6%(550품목), 일반의약품은 51.4%(582품목)로 전문의약품의 비율은 낮아지고 일반의약품의 비율은 증가한 것으로 나타났다. 지난해 신규 허가& 8228;지정된 신약은 총 23품목으로 화학의약품 11품목(제조 2품목, 수입 9품목), 생물의약품 12품목(수입 12품목)이었으며, 첨단바이오의약품과 한약(생약)제제로서 허가된 신약은 없었다. 19개 신약 성분이 포함된 신약이 허가·지정됐으며 화학의약품 10개 성분, 생물의약품 9개 성분이다. 국내 제조 신약(2품목, 2성분)에 비해 수입 신약(21품목, 17성분)의 허가 품목수 및 성분 수가 더 많은 비중을 차지해 신물질 대부분이 수입 신약으로 개발되었음을 알 수 있다. 국내 개발 신약은 매년 1~2품목(2015년, 2021년도에는5품목)씩 꾸준히 허가됐으나 2023년에는 없었으며, 2024년에 허가된 국내 개발신약은 1품목이었다. 2024년 주요 허가 동향으로 ▲희귀의약품 허가 증가세 지속 ▲‘순환계용약’이 가장 큰 비중 ▲동등생물의약품(바이오시밀러) 역대 최다 허가 등이다. 희귀의약품은 지난해보다 2개 품목이 증가한 총 26개 성분, 39품목이 허가됐으며, 이 중 급성 골수성 백혈병 치료제 등 항악성종양제가 16품목으로 가장 많다. 이에 따라 희귀 난치질환으로 고통받는 환자들의 치료 접근성이 더욱 높아질 것으로 기대된다. 지난해 허가·신고된 완제의약품을 약효군별로 살펴보면, 해열·진통·소염제 등 신경계용의약품(19.3%), 고혈압치료제 등 순환계용의약품(18.9%), 당뇨병치료제 등 대사성의약품(14.8%), 해열& 8228;진통& 8228;7소염제 등 신경계용의약품(14.0%), 위궤양치료제 등 소화기관용의약품 및 항바이러스제 등 외피용약(6.8%), 항히스타민제 등 알레르기용약(5.4%) 순으로 나타났다. 특히 은행엽건조엑스 등을 주성분으로 하는 순환계용약이 총 161품목으로 가장 많이 허가됐고, 해열·진통·소염제(146품목)과 당뇨병용제(127품목), 기타 비타민제(99품목), 항악성종양제(39품목)가 뒤를 이었다. 제네릭의약품 등 허가·신고 품목 수는 2023년 대비 다소 증가한 총 845품목이었다. 이는 2021년 7월부터 동일한 임상시험자료를 다른 품목에 사용할 수 있는 횟수를 3회로 제한한 효과로 보이며, 최근 3년간 유사한 수준인 것으로 볼 때 제도가 안정적으로 정착한 것으로 보인다. 지난해 자료제출의약품의 허가 현황(개량신약 3품목 제외)을 살펴보면, 제조 173품목(94.5%), 수입 10품목(5.5%)으로 제조품목이 높은 비중을 차지했으며, 허가심사유형별로는 새로운 조성 또는 함량 증감 의약품 42.7%(78품목)이 가장 많은 품목을 보였다. 그 다음으로 새로운 제형 39.9%(73품목) 의약품 순이었다. 새로운 염 또는 이성체 등으로 허가된 화학의약품은 제조 27품목으로 허가됐으며, 기허가 당뇨병용제인 리나글립틴을 리나글립틴베실산염으로 개발한 품목이22품목(81.5%), 시타글립틴인산염수화물을 시타글립틴염산염으로 개발한 품목이 2품목(7.4%)으로 당뇨병용제가 가장 많은 비율(88.9%)을 차지했다.2025-04-29 11:17:38이혜경 -
 전문약 비중 76% 육박..."상시 재분류 시스템 필요"지난 2000년 의약분업 당시 의약품 재분류로 전문의약품 비율이 일반의약품을 역전한 이후, 전문약의 허가가 꾸준히 증가하고 있는 것으로 나타났다. 10월 30일 식품의약품안전처 허가 기준 전체 의약품은 3만6916개 품목으로 전문약 2만8007개(75.9%), 일반약 8909개(24.1%)로 집계됐다. 지난해 의약품 생산·수입 실적 역시 전문약 30조6159억원(88.2%), 4조890억원(11.8%)으로 일반약 생산규모는 매년 하락 추세를 보이고 있다. 미국, 영국 등 해외의 경우 상시적인 의약품 간 재분류를 통해 의료비용을 절감하고 의약품 오남용을 방지하고 있지만, 우리나라는 적극적인 재분류 시스템이 없어 규제당국인 식품의약품안전처 내부에 조직을 신설·개편하고 재분류 검토 요청 주체를 지금보다 확대해야 한다는 지적이 나왔다. 전문·일반약 재분류, 정부조직 신설·요청주체 확대 필요=전문·일반약 재분류 활성화가 건강보험재정 지속가능성 강화 효과와 함께 환자의 안전하고 효율적인 의약품 복용 환경 마련에 긍정적이란 점에 정부, 제약사, 보건의료인, 소비자 등 이해관계자들의 공감대 형성과 협력도 필요하다는 제언이다. 2일 김윤 더불어민주당 의원과 데일리팜이 공동개최한 '전문약/일반약 재분류 체계 선진화 국회 토론회'에서 발제를 맡은 권경희 동국대학교약학대학 교수는 이 같이 밝혔다. 우리나라는 의약분업이 이뤄진 2000년 이후 현재까지 전문·일반약 재분류가 단 세 차례에 그쳐 비교적 소극적인 상황이다. 구체적으로 2000년 의약분업 당시 의약품재평가가 이뤄졌고, 2012년 안전상비약 신설과 함께 이뤄진 의약품재평가에서 총 504품목이 재분류 결정됐다. 2021년에는 일반약 프레드니솔론발레로아세테이트 크림제 분류를 놓고 이의가 제기되면서 신청품목을 포함해 동일성분 16개 품목이 전문약으로 분류됐다. 먼저 권 교수는 전문약·일반약 재분류가 국내·외 의약품 시장에서 주요한 이슈로 떠오르고 있다고 소개했다. 특히 시판 후 안전성·유효성 데이터를 기반으로 의약품을 주기적으로 재평가하고 재분류 할 수 있어야 한다고 진단했다. 무엇보다 효과가 우수하고 안전한 일반약 공급은 지속가능한 보건의료체계 유지를 위해 필수적이라고 했다. 이에 영국, 미국, 일본 등 해외 선진국의 의약품 재분류 시스템을 살펴 우리나라도 재분류 체계를 선진화하고 활성화하자는 게 권 교수 견해다. 의약품 재분류 활성화, 해법은=권 교수는 의약품 재분류 활성화 해법으로 전문·일반약 재분류 시 세분화된 분류 체계를 제공해야 유연한 재분류가 가능할 것으로 분석했다. 권 교수는 "안전성 우려가 높은 약에 대해 단계적으로 소비자 접근성을 확대할 수 있는 여지를 제공할 수 있다"면서 "점진적 변화를 통한 약물 오남용·부작용 등 부정 영향을 최소화하고 재분류에 대한 정치적이고 사회적인 수용성이 증가한다"고 피력했다. 아울러 규제당국에 독립적인 재분류 논의기구를 신설하거나 활성화 할 필요성도 제기했다. 식약처 중앙약사심의위원회를 활성화하거나 일본 평가검토회의, 미국 NDAC와 같은 의약품 재분류 별도 기구 신설을 고민해야 한다는 것이다. 특히 재분류 검토 요청 주체를 현행 제약사를 넘어 소비자, 학회, 관련 단체 등으로 넓히는 부분도 고려하라고 했다. 재분류 관련 단계적 검토 절차를 도입하고 제약사의 적극적인 참여 의지 고취도 재분류 활성화를 촉진할 것으로 봤다. 권 교수는 "전문·일반약 재분류 논의 활성화와 투명성 확보를 위한 방안을 마련해야한다. 독립적인 논의기구를 신설하거나 활성화하는 게 방편"이라며 "대중과 이해관계자 의견을 수렴하는 공청회 등 절차를 도입하고 재분류 요청 주체를 지금보다 확대하는 것도 방안이 될 수 있다"고 설명했다. 이어 "논의 결과를 대중에 공개해 투명성과 공개성을 강화하고 다양한 재분류 관련 단계적 검토로 정책 수용성을 높일 수 있다"며 "제약사는 처방시장을 선호하는데서 그치지 말고 재분류 참여 의지를 제고해 새 시장을 개척하고 더 넓은 소비자 기반을 확보하는 것을 고려해야 한다"고 부연했다. 2012년 분류 재평가로 전체 의약품의 1.3% 분류 전환=이어 주제발표를 맡은 김상봉 식약처 의약품안전국장은 '의약품 전문/일반 분류 규정 및 현황'을 소개했다. 국내 허가 받은 의약품 분류는 의약품의 품목허가를 받거나 신고를 하고자 하는 자가 전문약 또는 일반약으로 구분해 신청하면 심사를 거쳐 이뤄진다. 분류 변경은 의사, 치과의사 및 약사 관련 단체, 소비자 단체에서 의약품 분류신청서를 제출해 분류에 이의를 제기할 경우 진행된다. 하지만 우리나라에서 의약품 분류 변경이 이뤄진 건 단 2건이다. 지난 2000년 의약분업 당시 재분류와 2012년 일반약에서 전문약으로 전환된 '프레드니솔론발레로아세테이트크림제' 뿐이다. 김 국장의 자료를 보면 2000년 5월 재분류는 1999년 5월 10일 시민사회단체 중재로 의료계, 약계가 의약분업 시행방안에 대해 합의하면서 이뤄졌다. 중앙약사심의위원회에 의료계 추천 4명, 약계 추천 4명, 보건경제학자 1명, 소비자·시민단체 2명, 보건산업진흥원 1명, 의료보험자단체 1명 등 13명으로 '의약품분류위원회(위원장 이평수)'를 상설화 했다. 중앙약심 의약품분류소분과위원회 전체회의 2차례, 서면 의견조회 1차례 등을 거쳐 272개 성분을 제외한 의약품의 재분류를 결정했다. 하지만 중앙약심 소위원회 4차 회의에서 의료계가 불참하면서, 복지부는 272개 성분의 쟁점 품목에 대한 분류원칙과 약효군별 분류기준 방향성에 대해 보건전문가의 자문을 받아 최종안을 마련했다. 지난 2012년 8월 분류재평가는 국민들이 안전하고 합리적으로 의약품을 사용할 수 있도록 추진됐으며, 당시 식약청 내 의사, 약사, 변호사 등으로 의약품재분류TF(총30명)을 별도로 구성했다. 의약품 재분류(안)에 대해 심의한 의약품분류소분과위원회는 전문가 8명, 공익대표 4명으로 구성됐으며 최종 504개 품목의 분류전환이 결정됐다. 일반약에서 전문약으로 262개, 전문약에서 일반약으로 200개, 효능효과에 따라 동시분류 42개품목이 전환됐다. 하지만 이는 전체 의약품의 1.3% 뿐이었다.2024-12-02 10:50:27이정환·이혜경
전문약 비중 76% 육박..."상시 재분류 시스템 필요"지난 2000년 의약분업 당시 의약품 재분류로 전문의약품 비율이 일반의약품을 역전한 이후, 전문약의 허가가 꾸준히 증가하고 있는 것으로 나타났다. 10월 30일 식품의약품안전처 허가 기준 전체 의약품은 3만6916개 품목으로 전문약 2만8007개(75.9%), 일반약 8909개(24.1%)로 집계됐다. 지난해 의약품 생산·수입 실적 역시 전문약 30조6159억원(88.2%), 4조890억원(11.8%)으로 일반약 생산규모는 매년 하락 추세를 보이고 있다. 미국, 영국 등 해외의 경우 상시적인 의약품 간 재분류를 통해 의료비용을 절감하고 의약품 오남용을 방지하고 있지만, 우리나라는 적극적인 재분류 시스템이 없어 규제당국인 식품의약품안전처 내부에 조직을 신설·개편하고 재분류 검토 요청 주체를 지금보다 확대해야 한다는 지적이 나왔다. 전문·일반약 재분류, 정부조직 신설·요청주체 확대 필요=전문·일반약 재분류 활성화가 건강보험재정 지속가능성 강화 효과와 함께 환자의 안전하고 효율적인 의약품 복용 환경 마련에 긍정적이란 점에 정부, 제약사, 보건의료인, 소비자 등 이해관계자들의 공감대 형성과 협력도 필요하다는 제언이다. 2일 김윤 더불어민주당 의원과 데일리팜이 공동개최한 '전문약/일반약 재분류 체계 선진화 국회 토론회'에서 발제를 맡은 권경희 동국대학교약학대학 교수는 이 같이 밝혔다. 우리나라는 의약분업이 이뤄진 2000년 이후 현재까지 전문·일반약 재분류가 단 세 차례에 그쳐 비교적 소극적인 상황이다. 구체적으로 2000년 의약분업 당시 의약품재평가가 이뤄졌고, 2012년 안전상비약 신설과 함께 이뤄진 의약품재평가에서 총 504품목이 재분류 결정됐다. 2021년에는 일반약 프레드니솔론발레로아세테이트 크림제 분류를 놓고 이의가 제기되면서 신청품목을 포함해 동일성분 16개 품목이 전문약으로 분류됐다. 먼저 권 교수는 전문약·일반약 재분류가 국내·외 의약품 시장에서 주요한 이슈로 떠오르고 있다고 소개했다. 특히 시판 후 안전성·유효성 데이터를 기반으로 의약품을 주기적으로 재평가하고 재분류 할 수 있어야 한다고 진단했다. 무엇보다 효과가 우수하고 안전한 일반약 공급은 지속가능한 보건의료체계 유지를 위해 필수적이라고 했다. 이에 영국, 미국, 일본 등 해외 선진국의 의약품 재분류 시스템을 살펴 우리나라도 재분류 체계를 선진화하고 활성화하자는 게 권 교수 견해다. 의약품 재분류 활성화, 해법은=권 교수는 의약품 재분류 활성화 해법으로 전문·일반약 재분류 시 세분화된 분류 체계를 제공해야 유연한 재분류가 가능할 것으로 분석했다. 권 교수는 "안전성 우려가 높은 약에 대해 단계적으로 소비자 접근성을 확대할 수 있는 여지를 제공할 수 있다"면서 "점진적 변화를 통한 약물 오남용·부작용 등 부정 영향을 최소화하고 재분류에 대한 정치적이고 사회적인 수용성이 증가한다"고 피력했다. 아울러 규제당국에 독립적인 재분류 논의기구를 신설하거나 활성화 할 필요성도 제기했다. 식약처 중앙약사심의위원회를 활성화하거나 일본 평가검토회의, 미국 NDAC와 같은 의약품 재분류 별도 기구 신설을 고민해야 한다는 것이다. 특히 재분류 검토 요청 주체를 현행 제약사를 넘어 소비자, 학회, 관련 단체 등으로 넓히는 부분도 고려하라고 했다. 재분류 관련 단계적 검토 절차를 도입하고 제약사의 적극적인 참여 의지 고취도 재분류 활성화를 촉진할 것으로 봤다. 권 교수는 "전문·일반약 재분류 논의 활성화와 투명성 확보를 위한 방안을 마련해야한다. 독립적인 논의기구를 신설하거나 활성화하는 게 방편"이라며 "대중과 이해관계자 의견을 수렴하는 공청회 등 절차를 도입하고 재분류 요청 주체를 지금보다 확대하는 것도 방안이 될 수 있다"고 설명했다. 이어 "논의 결과를 대중에 공개해 투명성과 공개성을 강화하고 다양한 재분류 관련 단계적 검토로 정책 수용성을 높일 수 있다"며 "제약사는 처방시장을 선호하는데서 그치지 말고 재분류 참여 의지를 제고해 새 시장을 개척하고 더 넓은 소비자 기반을 확보하는 것을 고려해야 한다"고 부연했다. 2012년 분류 재평가로 전체 의약품의 1.3% 분류 전환=이어 주제발표를 맡은 김상봉 식약처 의약품안전국장은 '의약품 전문/일반 분류 규정 및 현황'을 소개했다. 국내 허가 받은 의약품 분류는 의약품의 품목허가를 받거나 신고를 하고자 하는 자가 전문약 또는 일반약으로 구분해 신청하면 심사를 거쳐 이뤄진다. 분류 변경은 의사, 치과의사 및 약사 관련 단체, 소비자 단체에서 의약품 분류신청서를 제출해 분류에 이의를 제기할 경우 진행된다. 하지만 우리나라에서 의약품 분류 변경이 이뤄진 건 단 2건이다. 지난 2000년 의약분업 당시 재분류와 2012년 일반약에서 전문약으로 전환된 '프레드니솔론발레로아세테이트크림제' 뿐이다. 김 국장의 자료를 보면 2000년 5월 재분류는 1999년 5월 10일 시민사회단체 중재로 의료계, 약계가 의약분업 시행방안에 대해 합의하면서 이뤄졌다. 중앙약사심의위원회에 의료계 추천 4명, 약계 추천 4명, 보건경제학자 1명, 소비자·시민단체 2명, 보건산업진흥원 1명, 의료보험자단체 1명 등 13명으로 '의약품분류위원회(위원장 이평수)'를 상설화 했다. 중앙약심 의약품분류소분과위원회 전체회의 2차례, 서면 의견조회 1차례 등을 거쳐 272개 성분을 제외한 의약품의 재분류를 결정했다. 하지만 중앙약심 소위원회 4차 회의에서 의료계가 불참하면서, 복지부는 272개 성분의 쟁점 품목에 대한 분류원칙과 약효군별 분류기준 방향성에 대해 보건전문가의 자문을 받아 최종안을 마련했다. 지난 2012년 8월 분류재평가는 국민들이 안전하고 합리적으로 의약품을 사용할 수 있도록 추진됐으며, 당시 식약청 내 의사, 약사, 변호사 등으로 의약품재분류TF(총30명)을 별도로 구성했다. 의약품 재분류(안)에 대해 심의한 의약품분류소분과위원회는 전문가 8명, 공익대표 4명으로 구성됐으며 최종 504개 품목의 분류전환이 결정됐다. 일반약에서 전문약으로 262개, 전문약에서 일반약으로 200개, 효능효과에 따라 동시분류 42개품목이 전환됐다. 하지만 이는 전체 의약품의 1.3% 뿐이었다.2024-12-02 10:50:27이정환·이혜경 -
 "독일·캐나다 약가 비교 모순투성이"…이유있는 불만[데일리팜=김진구 기자] 정부와 제약업계는 해외약가 비교 재평가의 구체적인 시행 방안을 두고 작년 말부터 10차례 논의를 진행했다. 그러나 양 측은 끝내 합의점을 찾지 못했다. 공식적으로 정부·업계가 참여한 TF팀은 해산됐다. 마지막까지 독일과 캐나다의 약가가 이슈였다. 제약업계에선 정부가 입맛대로 독일·캐나다 약가 참조 방식을 결정했다는 비판을 제기한다. 근본적으로는 비교대상 국가와 약가제도에 큰 차이가 있음에도, 정부가 건보재정 절감을 위해 비교 재평가를 강행한다는 비판도 나온다. "정부 입맛대로 독일·캐나다 약가 참조…비교 형평성 떨어져" 24일 제약업계에 따르면 각 기업 약가 담당자(MA)들은 특히 독일·캐나다와의 약가 비교에 비판의 목소리를 높인다. 이들은 "정부가 입맛대로 독일·캐나다 약가 참조방식을 결정했기 때문"이라고 입을 모은다. 같은 국가라도 다양한 약가가 공존한다. 공장에서 출하된 시점의 가격, 환율·세금이 적용된 가격, 유통마진이나 약국마진이 더해진 가격, 환자 본인부담이 적용된 가격과 최종 소비자가 구입하는 가격 등이다. 가장 저렴한 공장출하 가격과 가장 비싼 소비자구입 가격은 차이가 적지 않다. 어떤 가격을 참조하느냐에 따라 한국약가에 미치는 영향도 클 수도, 작을 수도 있는 셈이다. 제약업계의 비판은 여기서 시작한다. 정부가 입맛대로 독일·캐나다의 가장 낮은 약가를 끌어와 한국과 비교하고 약가인하의 근거로 삼는다는 것이다. 참조가격제를 시행 중인 독일에선 정부가 특정 성분군의 참조가격을 정하고 나머지를 환급한다. 예를 들어 A약제의 참조가격을 100원으로 정했다면, 제약사가 180원에 판매하는 의약품에서 100원까지만 급여를 적용하고 나머지 80원은 환자가 본인부담하는 식이다. 이때 100원이라는 참조가격은 'FB(고정상환금액)' 혹은 'EB(협상상환금액)'로 표현된다. 정부는 이를 '공적급여 가격'으로 해석하고 이번 외국약가 비교 재평가에 활용한다는 방침이다. 반면 제약업계에선 180원에 해당하는 '약국판매가격(UVP)' 혹은 '소비자가격(RRP)'를 적용해야 한다는 주장을 펼친다. 한국의 경우 약제 보험급여 상한금액에 환자 본인부담이 포함된 형태다. 이를 독일 약가와 비교하려면 당연히 환자 본인부담이 포함된 약국판매 가격과 비교해야 한다는 게 제약업계의 주장이다. 환자 본인부담이 제외된 공적급여 가격과 비교할 경우 형평성이 떨어진다는 것이다. 공적급여 가격과 약국판매 가격 간 차이가 상당하다는 점은 제약업계가 강하게 반발하는 또 다른 이유다. '발사르탄(80mg)+히드로클로로티아지드(12.5mg)' 복합제를 예로 들면, 독일의 공적급여 가격은 24.2유로인 데 비해 약국판매 가격은 103.9유로다. 같은 약물임에도 두 약가에 4배 이상의 차이가 난다. 제약업계에선 약국판매 가격 대신 공적급여 가격을 적용할 경우 약가 수준이 전반적으로 20~40% 가량 낮아질 것으로 계산한다. 캐나다의 경우도 마찬가지다. 정부는 공적급여 가격의 일종인 '정부환급액(MOH)'을 참조한다는 계획인데, 이에 대해 제약업계에선 환자 본인부담이 포함된 '의약품 혜택 가격(DBP)'을 참조해야 한다고 맞서고 있다. 환자 본인부담이 반영되지 않은 캐나다의 공적급여 가격과 환자 본인부담이 반영된 한국의 보험 상한가를 동일선상에 두고 비교하는 것은 옳지 않다는 주장이다. MA 10명 중 9명 "독일·캐나다 약가 참조방식 문제 있다" 설문결과 실제로 데일리팜이 약가담당자(MA) 75명을 상대로 진행한 설문조사에 따르면, 이들은 정부가 제시한 외국약가 비교 재평가(안) 가운데 '해외약가 자료의 대표성·신뢰성'에 가장 큰 문제가 있다고 응답했다. 특히 독일·캐나다의 약가 참조 방식에 문제가 있다는 게 이들의 공통된 문제인식이다. 설문에 참여한 75명 가운데 66명(88%)이 이같이 답했다. 약가담당 실무진 10명 중 9명은 한국의 약가와 비교 대상이 되는 약가를 산출하는 방식에 문제가 있다고 답한 셈이다. 이어 '조정기준 산정 방식'에 문제가 있다는 응답이 38명(51%)으로 나타났다. 정부는 현재 A8(일본·프랑스·독일·이탈리아·스위스·영국·캐나다·미국) 국가에서 최고가와 최저가를 제외하고 나머지 6개국 약가를 조정평균가로 계산하는 방식을 도입할 계획인데, 여기에 문제가 있다는 응답이다. 이밖에 '3년 단위의 재평가 적용 주기' 29명(39%), '올 연말로 예상되는 재평가 시행 시점' 25명(33%), '비교대상 국가 선정' 23명(31%), '약효군별 차등 재평가 시기 적용' 13명(17%), '비교대상 약제 선정 기준' 8명(11%), '재평가 제외대상 범위' 7명(9%) 등의 순이었다. 신약은 8개국 대상 vs 특허만료약은 6개국 대상…'이중잣대' 논란도 정부가 특허만료 의약품과 신약 간에 이중잣대를 적용한다는 비판도 나온다. 현재 정부는 신약의 요양급여 적정성 평가 과정에서 외국약가를 참조하고 있다. 이때 참조 기준은 '약가책자 가격에 공장도 출하율을 적용한 뒤, 환율·부가가치세·유통거래폭을 반영하는 방식'이다. 이를 독일 약가에 적용하면 공적급여 가격이 아닌, 약국판매 가격이 해당한다. 실제 신약의 급여 적정성 평가 땐 약국판매 가격을 참조한다. 그러나 특허만료 의약품에 대한 외국약가 비교 재평가에선 약국판매 가격이 아닌 공적급여 가격을 참조하겠다는 게 정부 방침이다. 동일하게 외국과 약가를 비교하는데 참조하는 방식은 다른 모순적인 상황이 발생하고 있다고 제약업계 관계자들은 입을 모은다. A8국가 중 최고가와 최저가를 제외한 나머지 6개국의 조정평균가를 구하는 방식에 대해서도 신약과 특허만료약 간 이중잣대를 적용한다는 비판의 목소리가 높다. 현행 신약 등재 규정에선 최고가·최저가 제외 없이 'A8 국가의 조정평균가'를 참조한다. 반면 외국약가 비교 재평가에선 느닷없이 최고가·최저가를 제외하는 방안이 도입됐다는 게 업계의 주장이다. 이에 대해 정부는 8개국을 전부 포함해서 조정평균가를 구할 경우 왜곡이 심하다는 점을 근거로 제시한다. 반면 제약업계에선 인위적으로 독일·캐나다 약가를 매우 낮게 설정한 상태에서 최고가·최저가 국가를 하나씩 제외하면 전반적인 약가인하 폭이 더욱 커질 것이란 우려를 제기한다. 최고가 국가로 미국이 제외되고 최저가 국가로 독일과 캐나다 중 한 곳이 제외되더라도, 여전히 독일·캐나다 중 한 곳이 남게 되므로 약가가 크게 낮아질 것이란 우려다. 결국 정부가 특허만료 의약품의 약가를 크게 낮추기 위한 목적으로 모순투성이의 방법을 동원했다는 게 제약업계의 비판이다. 독일·캐나다의 약가 참조 기준을 전례 없이 설정한 것도, A8국가의 약가 중 최고가·최저가를 제외하는 것도 이러한 의도에서 비롯된 게 아니냐는 비판이다. "제도·환경 다른데도 약가 비교 강행…근거도 정당성도 없다" 근본적으로는 A8 국가와 보험·급여제도가 다름에도 약가 비교와 인하를 강행한다는 비판의 목소리가 나온다. 비교대상 8개국은 보험·급여제도가 천차만별이다. 기본적인 의약품 급여 등재 방식부터 다르다. 한국을 포함해 미국, 스위스, 프랑스, 이탈리아, 캐나다는 선별 급여 방식의 포지티브 리스트(Positive List)로 운영된다. 반면 영국과 독일, 일본은 네거티브 리스트(Negative List)로 의약품을 등재한다. 제네릭 정책으로 가면 차이가 더욱 확연하다. 제네릭 약가 결정 방식이나 참조가격제 시행 여부, 약가 인하율, 제네릭 사용 권장 정책 등은 국가별로 제각각이다. 독일은 참조가격제를 기반으로 제네릭 약가제도를 운영하고 있다. 동시에 제네릭 처방을 촉진하기 위해 대체조제 의무화, 의사의 제네릭 처방목표액 제도 등을 운영한다. 약가뿐 아니라 제네릭 사용량을 늘리는 방식으로 약제비를 낮추는 구조다. 대체조제 의무화에 따라 독일 약사는 의사가 처방한 의약품을 동일 성분·용량·제형 중 가장 저렴한 3개 의약품 중 하나로 대체조제할 의무가 있다. 또한 의사의 환자당 평균 처방비용 목표를 설정하고, 이 목표를 넘어서면 감사를 받거나 초과분의 일부를 지불하는 등의 제도도 운영 중이다. 한 제약업계 관계자는 "약가를 인하하는 방식만으로 건강보험 재정 부담을 낮추는 데는 한계가 있다"며 "정부는 약가인하 일변도 정책이 아니라, 제네릭 사용 장려 등 다양한 각도에서 사후관리 종합 대책을 마련해야 한다"고 강조했다. 그는 이어 "나라별로 사회경제적 환경과 보험·약가 제도가 크게 다름에도 이는 고려하지 않고 약가만을 비교하고 인하하는 것은 정당성도 근거도 부족하다"며 "이대로 외국약가 비교 재평가를 강행할 경우 업계 반발이 상당할 것"이라고 꼬집었다.2024-07-24 06:20:31김진구
"독일·캐나다 약가 비교 모순투성이"…이유있는 불만[데일리팜=김진구 기자] 정부와 제약업계는 해외약가 비교 재평가의 구체적인 시행 방안을 두고 작년 말부터 10차례 논의를 진행했다. 그러나 양 측은 끝내 합의점을 찾지 못했다. 공식적으로 정부·업계가 참여한 TF팀은 해산됐다. 마지막까지 독일과 캐나다의 약가가 이슈였다. 제약업계에선 정부가 입맛대로 독일·캐나다 약가 참조 방식을 결정했다는 비판을 제기한다. 근본적으로는 비교대상 국가와 약가제도에 큰 차이가 있음에도, 정부가 건보재정 절감을 위해 비교 재평가를 강행한다는 비판도 나온다. "정부 입맛대로 독일·캐나다 약가 참조…비교 형평성 떨어져" 24일 제약업계에 따르면 각 기업 약가 담당자(MA)들은 특히 독일·캐나다와의 약가 비교에 비판의 목소리를 높인다. 이들은 "정부가 입맛대로 독일·캐나다 약가 참조방식을 결정했기 때문"이라고 입을 모은다. 같은 국가라도 다양한 약가가 공존한다. 공장에서 출하된 시점의 가격, 환율·세금이 적용된 가격, 유통마진이나 약국마진이 더해진 가격, 환자 본인부담이 적용된 가격과 최종 소비자가 구입하는 가격 등이다. 가장 저렴한 공장출하 가격과 가장 비싼 소비자구입 가격은 차이가 적지 않다. 어떤 가격을 참조하느냐에 따라 한국약가에 미치는 영향도 클 수도, 작을 수도 있는 셈이다. 제약업계의 비판은 여기서 시작한다. 정부가 입맛대로 독일·캐나다의 가장 낮은 약가를 끌어와 한국과 비교하고 약가인하의 근거로 삼는다는 것이다. 참조가격제를 시행 중인 독일에선 정부가 특정 성분군의 참조가격을 정하고 나머지를 환급한다. 예를 들어 A약제의 참조가격을 100원으로 정했다면, 제약사가 180원에 판매하는 의약품에서 100원까지만 급여를 적용하고 나머지 80원은 환자가 본인부담하는 식이다. 이때 100원이라는 참조가격은 'FB(고정상환금액)' 혹은 'EB(협상상환금액)'로 표현된다. 정부는 이를 '공적급여 가격'으로 해석하고 이번 외국약가 비교 재평가에 활용한다는 방침이다. 반면 제약업계에선 180원에 해당하는 '약국판매가격(UVP)' 혹은 '소비자가격(RRP)'를 적용해야 한다는 주장을 펼친다. 한국의 경우 약제 보험급여 상한금액에 환자 본인부담이 포함된 형태다. 이를 독일 약가와 비교하려면 당연히 환자 본인부담이 포함된 약국판매 가격과 비교해야 한다는 게 제약업계의 주장이다. 환자 본인부담이 제외된 공적급여 가격과 비교할 경우 형평성이 떨어진다는 것이다. 공적급여 가격과 약국판매 가격 간 차이가 상당하다는 점은 제약업계가 강하게 반발하는 또 다른 이유다. '발사르탄(80mg)+히드로클로로티아지드(12.5mg)' 복합제를 예로 들면, 독일의 공적급여 가격은 24.2유로인 데 비해 약국판매 가격은 103.9유로다. 같은 약물임에도 두 약가에 4배 이상의 차이가 난다. 제약업계에선 약국판매 가격 대신 공적급여 가격을 적용할 경우 약가 수준이 전반적으로 20~40% 가량 낮아질 것으로 계산한다. 캐나다의 경우도 마찬가지다. 정부는 공적급여 가격의 일종인 '정부환급액(MOH)'을 참조한다는 계획인데, 이에 대해 제약업계에선 환자 본인부담이 포함된 '의약품 혜택 가격(DBP)'을 참조해야 한다고 맞서고 있다. 환자 본인부담이 반영되지 않은 캐나다의 공적급여 가격과 환자 본인부담이 반영된 한국의 보험 상한가를 동일선상에 두고 비교하는 것은 옳지 않다는 주장이다. MA 10명 중 9명 "독일·캐나다 약가 참조방식 문제 있다" 설문결과 실제로 데일리팜이 약가담당자(MA) 75명을 상대로 진행한 설문조사에 따르면, 이들은 정부가 제시한 외국약가 비교 재평가(안) 가운데 '해외약가 자료의 대표성·신뢰성'에 가장 큰 문제가 있다고 응답했다. 특히 독일·캐나다의 약가 참조 방식에 문제가 있다는 게 이들의 공통된 문제인식이다. 설문에 참여한 75명 가운데 66명(88%)이 이같이 답했다. 약가담당 실무진 10명 중 9명은 한국의 약가와 비교 대상이 되는 약가를 산출하는 방식에 문제가 있다고 답한 셈이다. 이어 '조정기준 산정 방식'에 문제가 있다는 응답이 38명(51%)으로 나타났다. 정부는 현재 A8(일본·프랑스·독일·이탈리아·스위스·영국·캐나다·미국) 국가에서 최고가와 최저가를 제외하고 나머지 6개국 약가를 조정평균가로 계산하는 방식을 도입할 계획인데, 여기에 문제가 있다는 응답이다. 이밖에 '3년 단위의 재평가 적용 주기' 29명(39%), '올 연말로 예상되는 재평가 시행 시점' 25명(33%), '비교대상 국가 선정' 23명(31%), '약효군별 차등 재평가 시기 적용' 13명(17%), '비교대상 약제 선정 기준' 8명(11%), '재평가 제외대상 범위' 7명(9%) 등의 순이었다. 신약은 8개국 대상 vs 특허만료약은 6개국 대상…'이중잣대' 논란도 정부가 특허만료 의약품과 신약 간에 이중잣대를 적용한다는 비판도 나온다. 현재 정부는 신약의 요양급여 적정성 평가 과정에서 외국약가를 참조하고 있다. 이때 참조 기준은 '약가책자 가격에 공장도 출하율을 적용한 뒤, 환율·부가가치세·유통거래폭을 반영하는 방식'이다. 이를 독일 약가에 적용하면 공적급여 가격이 아닌, 약국판매 가격이 해당한다. 실제 신약의 급여 적정성 평가 땐 약국판매 가격을 참조한다. 그러나 특허만료 의약품에 대한 외국약가 비교 재평가에선 약국판매 가격이 아닌 공적급여 가격을 참조하겠다는 게 정부 방침이다. 동일하게 외국과 약가를 비교하는데 참조하는 방식은 다른 모순적인 상황이 발생하고 있다고 제약업계 관계자들은 입을 모은다. A8국가 중 최고가와 최저가를 제외한 나머지 6개국의 조정평균가를 구하는 방식에 대해서도 신약과 특허만료약 간 이중잣대를 적용한다는 비판의 목소리가 높다. 현행 신약 등재 규정에선 최고가·최저가 제외 없이 'A8 국가의 조정평균가'를 참조한다. 반면 외국약가 비교 재평가에선 느닷없이 최고가·최저가를 제외하는 방안이 도입됐다는 게 업계의 주장이다. 이에 대해 정부는 8개국을 전부 포함해서 조정평균가를 구할 경우 왜곡이 심하다는 점을 근거로 제시한다. 반면 제약업계에선 인위적으로 독일·캐나다 약가를 매우 낮게 설정한 상태에서 최고가·최저가 국가를 하나씩 제외하면 전반적인 약가인하 폭이 더욱 커질 것이란 우려를 제기한다. 최고가 국가로 미국이 제외되고 최저가 국가로 독일과 캐나다 중 한 곳이 제외되더라도, 여전히 독일·캐나다 중 한 곳이 남게 되므로 약가가 크게 낮아질 것이란 우려다. 결국 정부가 특허만료 의약품의 약가를 크게 낮추기 위한 목적으로 모순투성이의 방법을 동원했다는 게 제약업계의 비판이다. 독일·캐나다의 약가 참조 기준을 전례 없이 설정한 것도, A8국가의 약가 중 최고가·최저가를 제외하는 것도 이러한 의도에서 비롯된 게 아니냐는 비판이다. "제도·환경 다른데도 약가 비교 강행…근거도 정당성도 없다" 근본적으로는 A8 국가와 보험·급여제도가 다름에도 약가 비교와 인하를 강행한다는 비판의 목소리가 나온다. 비교대상 8개국은 보험·급여제도가 천차만별이다. 기본적인 의약품 급여 등재 방식부터 다르다. 한국을 포함해 미국, 스위스, 프랑스, 이탈리아, 캐나다는 선별 급여 방식의 포지티브 리스트(Positive List)로 운영된다. 반면 영국과 독일, 일본은 네거티브 리스트(Negative List)로 의약품을 등재한다. 제네릭 정책으로 가면 차이가 더욱 확연하다. 제네릭 약가 결정 방식이나 참조가격제 시행 여부, 약가 인하율, 제네릭 사용 권장 정책 등은 국가별로 제각각이다. 독일은 참조가격제를 기반으로 제네릭 약가제도를 운영하고 있다. 동시에 제네릭 처방을 촉진하기 위해 대체조제 의무화, 의사의 제네릭 처방목표액 제도 등을 운영한다. 약가뿐 아니라 제네릭 사용량을 늘리는 방식으로 약제비를 낮추는 구조다. 대체조제 의무화에 따라 독일 약사는 의사가 처방한 의약품을 동일 성분·용량·제형 중 가장 저렴한 3개 의약품 중 하나로 대체조제할 의무가 있다. 또한 의사의 환자당 평균 처방비용 목표를 설정하고, 이 목표를 넘어서면 감사를 받거나 초과분의 일부를 지불하는 등의 제도도 운영 중이다. 한 제약업계 관계자는 "약가를 인하하는 방식만으로 건강보험 재정 부담을 낮추는 데는 한계가 있다"며 "정부는 약가인하 일변도 정책이 아니라, 제네릭 사용 장려 등 다양한 각도에서 사후관리 종합 대책을 마련해야 한다"고 강조했다. 그는 이어 "나라별로 사회경제적 환경과 보험·약가 제도가 크게 다름에도 이는 고려하지 않고 약가만을 비교하고 인하하는 것은 정당성도 근거도 부족하다"며 "이대로 외국약가 비교 재평가를 강행할 경우 업계 반발이 상당할 것"이라고 꼬집었다.2024-07-24 06:20:31김진구
오늘의 TOP 10
- 1'알부민' 음료는 상술ᆢ"혈중 알부민 수치와 관계 없다"
- 2올해 급여재평가 성분 공개 임박...선정 기준도 변화
- 3"미래 먹거리 잡아라"…M&A로 보는 글로벌 R&D 방향성
- 4식약처, 대규모 가이드라인 개발…외부연구 통해 42건 마련
- 5"창고형 노하우 전수"...메가팩토리약국 체인 설립 이유는?
- 6케이캡, 4조 미국 시장 진출 '성큼'…K-신약 흥행 시험대
- 7월세 1억원도 황금알 낳는 거위?…서울 명동 약국가 호황
- 8로수젯·케이캡 2천억, 리바로젯 1천억...K-신약 전성기
- 9"독감환자에게 약만 주시나요?"…약국의 호흡기 위생 습관
- 10생필품 배달원된 MR...판결문에 드러난 리베이트 백태
-
순위상품명횟수
-
1타이레놀정500mg(10정)30,426
-
2판콜에스내복액16,732
-
3텐텐츄정(10정)13,671
-
4까스활명수큐액12,867
-
5판피린큐액12,851





























![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)

![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/products/8eae7689-61be-4b71-9608-05364b05ea12.png)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[아워팜] 혈행건강 히어로, 혈행건강 초임계 rTG 오메가3 프리미엄](https://i.baropharm.com/products/f724f191-7052-4ad5-bc92-cda889cf13a6.png)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202511/1763106585375.png)
