총 42건
-
 R&D 성과에도 지배구조 개편은 난항…고심 깊은 오스코텍[데일리팜=차지현 기자] 오스코텍은 국내 바이오 산업에서 의미 있는 역사를 쓴 기업이다. 국내 기업 가운데 최초로 미국 식품의약국(FDA) 허가 항암신약을 배출했다. 최근에는 글로벌 빅파마와 대형 기술수출 성과를 거두며 새로운 현금 창출원을 확보했다. 차세대 플랫폼 기반 중장기 파이프라인 역시 구체화 단계에 들어섰다. 그럼에도 주가는 정체돼 있다. 현재 오스코텍의 시가총액은 1조8000억원대. 상용화 신약과 글로벌 기술수출 이력을 모두 갖춘 기업이라는 점을 고려하면 현재 주가 수준은 보수적이라는 평가다. 시장에서는 지배구조와 자본 전략의 불확실성이 해소돼야 주가가 성과를 반영할 수 있을 것이라는 분석이 나온다. "1~2년에 1건 이상 L/O 목표…외부 조달 없이 재무적 자립 달성" 오스코텍은 최근 투자자 대상 행사(Investor Day)를 열고 향후 회사의 성장 전략을 공유했다. 외부 자금 조달에 의존하지 않고 연구개발(R&D)을 지속할 수 있는 구조를 구축하겠다는 구상이다. 회사는 이미 상업화 단계에 진입한 항암신약과 글로벌 기술수출 성과를 통해 발생하는 수익 흐름을 기반으로 R&D 투자를 과거 대비 연평균 두 배 이상 확대하고 1~2년 주기 추가 기술수출을 통해 재무적 자립도를 높이겠다는 목표다. 이날 회사는 2025년 말 보유 현금을 출발점으로 향후 3년간 가용 현금을 현재의 세 배 이상으로 확대할 수 있다고 강조했다. 지난해 9월 말 연결기준 오스코텍의 현금성 자산은 약 149억원이다. 작년 상반기 회사는 영업활동으로만 155억원가량 현금이 유입됐다. 3분기에는 R&D 집행 등으로 일부 유출이 있었지만 3분기 누적 기준 75억원 이상 현금창출을 유지 중이다. 연말 보유 현금을 150억원 안팎으로 가정하면 회사가 언급한 '세 배 이상'은 중기적으로 최소 400억~500억원대 현금 규모를 염두에 둔 발언으로 해석된다. 먼저 오스코텍은 '렉라자'(레이저티닙)와 알츠하이머병 치료제 후보물질 'ADEL-Y01'을 안정적인 현금 창출원으로 제시했다. 렉라자는 국산 31호 신약이자 국내 첫 FDA 허가 항암신약이다. 오스코텍은 2010년 초 자회사 제노스코와 함께 후보물질을 개발해 2015년 전임상 직전 단계에서 유한양행에 기술수출했다. 이후 유한양행이 2018년 11월 얀센바이오테크에 렉라자를 다시 기술수출하면서 수익을 분배받게 됐다. 오스코텍은 유한양행이 얀센바이오테크로부터 확보한 레이저티닙 기술료 수익 중 40%를 받는다. 이를 오스코텍과 자회사 제노스코가 절반씩 나눠 갖는 구조다. 여기에 렉라자 미국 판매에 따른 로열티 수익까지 더해지면서 렉라자 기술료와 로열티가 오스코텍 매출의 핵심 축으로 자리 잡았다. 지난해 연결기준 3분기 누적 오스코텍 매출은 209억원 수준으로 이 가운데 기술수출 수익이 63%(131억원), 로열티 수익이 26%(54억원)을 차지한다. 특히 회사는 렉라자 수익 전망을 시장 기대치보다 보수적으로 산정했다는 입장이다. 이와 관련 신동준 오스코텍 전무(CFO)는 "렉라자 매출과 기술료 전망은 시장 컨센서스보다 30% 이상 보수적으로 반영한 수치"라며 "실제 처방 확대 속도와 글로벌 시장 침투 수준에 따라 중장기적으로는 연간 수익 규모가 단계적으로 확대될 여지가 충분하다"고 말했다. ADEL-Y01 역시 오스코텍의 수익 기반을 넓히는 또 다른 축이 될 전망이다. 회사는 지난해 말 국내 아델과 공동개발 중인 알츠하이머병 치료제 후보물질 ADEL-Y01을 글로벌 제약사 사노피에 이전했다. 계약은 반환 의무가 없는 선급금(업프론트) 8000만달러(1176억원)를 포함해 최대 10억4000만달러(약 1조5000억원) 규모다. 이 가운데 오스코텍은 계약 주체인 아델로부터 약 47%에 해당하는 3760만달러(553억원)를 배분받는다. 향후 발생하는 개발·허가·상업화 마일스톤과 로열티도 동일한 수익 배분 구조를 적용한다. 단기 기술수출이 가능성이 큰 파이프라인으로 제노스코의 특발성 폐섬유증(IPF) 치료제 후보물질 'GNS-3545'와 섬유화 치료제 후보물질 'OCT-648' 등을 제시했다. 회사는 이들 자산을 임상 진입 단계에서 조기 기술수출을 추진하는 전략 파이프라인으로 분류하고 상업화 부담을 최소화하면서 현금 유입을 확보한다는 구상이다. 이와 함께 항내성 항암제와 분해제항체접합체(DAC·Degrader Antibody Conjugate) 플랫폼은 회사 성장을 이끌 차세대 R&D 축으로 제시했다. 오스코텍은 2030년까지 항내성 항암제 분야에서 최소 2건 이상 조기 기술수출을 달성한다는 포부다. 주가 발목 잡는 지배구조 리스크…인수 재원 마련·주주 설득 관건 하지만 회사가 제시한 이 같은 재무적 자립 구상에도 불구하고 오스코텍 주가는 정체돼 있다. 현재 오스코텍 주가는 4만원 후반대로 52주 최고가 6만6000원 대비 약 30% 낮다. 8일 종가 기준 시가총액은 1조8192억원으로 코스닥 시총 순위 43위에 머물러 있다. 미국 FDA 허가 신약을 보유한 데다 글로벌 빅파마 기술수출로 안정적인 기술료 수익을 창출하는 바이오 기업이라는 점을 감안하면 기업가치가 보수적으로 책정됐다는 평가다. 시장에서는 지배구조 불확실성과 자본 전략을 둘러싼 논란이 오스코텍 주가 발목을 잡고 있다고 보고 있다. 오스코텍은 현재 제노스코를 완전 자회사로 편입하는 과정에서 주주와 다방면으로 갈등을 겪는 중이다. 제노스코는 코스닥 상장을 추진해왔으나 중복상장 논란이 불거지면서 기업공개(IPO) 계획이 사실상 무산됐다. 이에 오스코텍은 제노스코를 100% 자회사로 편입하는 지배구조 재편을 추진하겠다고 발표한 상태다. 문제는 이 지분을 얼마에 사들이느냐다. 작년 3분기 말 기준 오스코텍은 제노스코 지분 59.1%를 보유하고 있다. 이를 100%로 끌어올리기 위해서는 잔여 지분 약 40.9%를 추가로 매입해야 한다. 이 과정에서 모회사 주주와 자회사 주주 간 시각차가 극명하게 갈리고 있다. 오스코텍 주주 측이 제시하는 제노스코 적정 기업가치는 약 7000억원 수준인 반면, 제노스코 주주 측은 1조~1조4000억원까지 평가하고 있다. 이에 따라 잔여 지분 인수에 필요한 자금 규모는 최소 3000억원에서 최대 6000억원 이상까지 벌어진 상황이다. 오스코텍은 대규모 유상증자 없이 전략적 투자자(SI)·재무적 투자자(FI)를 유치해 제노스코 잔여 지분 인수 재원을 마련하겠다는 방침이다. 이를 위해 발행가능주식 총수를 확대하는 정관 변경을 추진, 제3자 배정 유상증자를 통한 자금 조달 여력을 확보하고자 했다. 그러나 해당 안건은 지난해 임시 주주총회에서 주주 반대에 부딪혀 부결되면서 무산됐다. 제노스코를 완전 자회사화하기 위한 자금 조달 경로가 막히면서 지배구조 재편 구상 자체가 사실상 원점에서 다시 검토되는 상황에 놓인 셈이다. 결국 오스코텍의 기업가치가 R&D 성과에 걸맞게 재평가되기 위해서는 제노스코 완전 자회사화에 대한 명확한 해법과 자본 조달 경로를 먼저 제시해야 한다는 분석이 나온다. 실제 투자자 행사 질의응답에서도 제노스코 100% 자회사화를 위한 자금 마련 방안과 주주 가치 희석, 주당순이익(EPS) 영향에 대한 질문이 집중됐다. 이에 대해 회사 측은 제노스코 지분 매입을 위해 SI나 FI를 유치해 자본을 마련한다는 기본 원칙에는 변함이 없다는 입장을 거듭 밝혔다. 신 전무는 "이를 통해 확보한 자금은 제노스코 지분 매입에만 사용하고 투자자의 경영권 참여 범위나 조건은 향후 주주와 소통을 통해 결정할 것"이라면서 "주주 가치 희석에 대한 우려에 대해서도 충분한 논의와 공감대 형성을 전제로 접근하겠다"고 했다. 다만 구체적인 자금 조달 시점과 규모, 제노스코 밸류에이션에 대한 수치는 여전히 제시하지 않았다. 신 전무는 "현재로서는 구체적인 숫자나 일정에 대해 말하기 어렵다"면서 "자금 조달과 밸류에이션 모두 주주와 충분한 논의와 합의가 선행돼야 할 사안"이라고 말했다. 일각에서는 제노스코 완전 자회사화가 이뤄지지 않은 상태에서 운영 통합부터 추진하는 현재 방식이 비용 부담만 키울 수 있다는 우려도 제기된다. 오스코텍은 제노스코를 100% 자회사로 편입한 뒤 양사의 연구 전문성을 유지하면서 운영과 글로벌 전략은 통합하는 '듀얼 허브' 모델을 구축할 계획이다. 항내성 항암제는 오스코텍이, DAC 플랫폼은 제노스코가 각각 중심이 돼 개발하되 임상 전략과 사업개발(BD), 글로벌 네트워크는 공동으로 수행해 효율성을 높이겠다는 전략이다. 그러나 제노스코에 대한 지배력이 완전히 확보되지 않은 상황에서 인력·조직·글로벌 네트워크를 먼저 통합할 경우 비용은 증가하는 반면 의사결정 통제력은 제한될 수 있다는 게 일부 오스코텍 주주의 우려다. 주주환원 정책을 둘러싼 시각차도 남아 있다. 주주들 사이에서는 상업화 신약과 기술수출을 통해 안정적인 수익 기반이 마련된 만큼 배당이나 자사주 매입·소각 등 보다 명확한 주주환원책을 제시해야 한다는 요구가 나온다. 특히 지배구조 개편과 자회사 편입 과정에서 주주 부담이 불가피한 만큼 이에 상응하는 환원 원칙이 병행돼야 한다는 게 일부 주주의 주장이다. 반면 오스코텍 측은 현재 성장 단계에 있는 바이오텍으로서는 현금 배당보다 R&D 재투자를 통해 기업가치를 키우는 것이 우선이라는 입장이다. 신 전무는 "무조건 자금을 소진하는 것이 아니라 장기적으로 주주 가치를 높이는 방향을 고민한 결과 현재로서는 R&D 투자가 최선"이라면서도 "주주 요구가 커질 경우 자사주 매입 등 탄력적인 자본 운용도 논의할 수 있다"고 했다.2026-01-09 06:00:47차지현 기자
R&D 성과에도 지배구조 개편은 난항…고심 깊은 오스코텍[데일리팜=차지현 기자] 오스코텍은 국내 바이오 산업에서 의미 있는 역사를 쓴 기업이다. 국내 기업 가운데 최초로 미국 식품의약국(FDA) 허가 항암신약을 배출했다. 최근에는 글로벌 빅파마와 대형 기술수출 성과를 거두며 새로운 현금 창출원을 확보했다. 차세대 플랫폼 기반 중장기 파이프라인 역시 구체화 단계에 들어섰다. 그럼에도 주가는 정체돼 있다. 현재 오스코텍의 시가총액은 1조8000억원대. 상용화 신약과 글로벌 기술수출 이력을 모두 갖춘 기업이라는 점을 고려하면 현재 주가 수준은 보수적이라는 평가다. 시장에서는 지배구조와 자본 전략의 불확실성이 해소돼야 주가가 성과를 반영할 수 있을 것이라는 분석이 나온다. "1~2년에 1건 이상 L/O 목표…외부 조달 없이 재무적 자립 달성" 오스코텍은 최근 투자자 대상 행사(Investor Day)를 열고 향후 회사의 성장 전략을 공유했다. 외부 자금 조달에 의존하지 않고 연구개발(R&D)을 지속할 수 있는 구조를 구축하겠다는 구상이다. 회사는 이미 상업화 단계에 진입한 항암신약과 글로벌 기술수출 성과를 통해 발생하는 수익 흐름을 기반으로 R&D 투자를 과거 대비 연평균 두 배 이상 확대하고 1~2년 주기 추가 기술수출을 통해 재무적 자립도를 높이겠다는 목표다. 이날 회사는 2025년 말 보유 현금을 출발점으로 향후 3년간 가용 현금을 현재의 세 배 이상으로 확대할 수 있다고 강조했다. 지난해 9월 말 연결기준 오스코텍의 현금성 자산은 약 149억원이다. 작년 상반기 회사는 영업활동으로만 155억원가량 현금이 유입됐다. 3분기에는 R&D 집행 등으로 일부 유출이 있었지만 3분기 누적 기준 75억원 이상 현금창출을 유지 중이다. 연말 보유 현금을 150억원 안팎으로 가정하면 회사가 언급한 '세 배 이상'은 중기적으로 최소 400억~500억원대 현금 규모를 염두에 둔 발언으로 해석된다. 먼저 오스코텍은 '렉라자'(레이저티닙)와 알츠하이머병 치료제 후보물질 'ADEL-Y01'을 안정적인 현금 창출원으로 제시했다. 렉라자는 국산 31호 신약이자 국내 첫 FDA 허가 항암신약이다. 오스코텍은 2010년 초 자회사 제노스코와 함께 후보물질을 개발해 2015년 전임상 직전 단계에서 유한양행에 기술수출했다. 이후 유한양행이 2018년 11월 얀센바이오테크에 렉라자를 다시 기술수출하면서 수익을 분배받게 됐다. 오스코텍은 유한양행이 얀센바이오테크로부터 확보한 레이저티닙 기술료 수익 중 40%를 받는다. 이를 오스코텍과 자회사 제노스코가 절반씩 나눠 갖는 구조다. 여기에 렉라자 미국 판매에 따른 로열티 수익까지 더해지면서 렉라자 기술료와 로열티가 오스코텍 매출의 핵심 축으로 자리 잡았다. 지난해 연결기준 3분기 누적 오스코텍 매출은 209억원 수준으로 이 가운데 기술수출 수익이 63%(131억원), 로열티 수익이 26%(54억원)을 차지한다. 특히 회사는 렉라자 수익 전망을 시장 기대치보다 보수적으로 산정했다는 입장이다. 이와 관련 신동준 오스코텍 전무(CFO)는 "렉라자 매출과 기술료 전망은 시장 컨센서스보다 30% 이상 보수적으로 반영한 수치"라며 "실제 처방 확대 속도와 글로벌 시장 침투 수준에 따라 중장기적으로는 연간 수익 규모가 단계적으로 확대될 여지가 충분하다"고 말했다. ADEL-Y01 역시 오스코텍의 수익 기반을 넓히는 또 다른 축이 될 전망이다. 회사는 지난해 말 국내 아델과 공동개발 중인 알츠하이머병 치료제 후보물질 ADEL-Y01을 글로벌 제약사 사노피에 이전했다. 계약은 반환 의무가 없는 선급금(업프론트) 8000만달러(1176억원)를 포함해 최대 10억4000만달러(약 1조5000억원) 규모다. 이 가운데 오스코텍은 계약 주체인 아델로부터 약 47%에 해당하는 3760만달러(553억원)를 배분받는다. 향후 발생하는 개발·허가·상업화 마일스톤과 로열티도 동일한 수익 배분 구조를 적용한다. 단기 기술수출이 가능성이 큰 파이프라인으로 제노스코의 특발성 폐섬유증(IPF) 치료제 후보물질 'GNS-3545'와 섬유화 치료제 후보물질 'OCT-648' 등을 제시했다. 회사는 이들 자산을 임상 진입 단계에서 조기 기술수출을 추진하는 전략 파이프라인으로 분류하고 상업화 부담을 최소화하면서 현금 유입을 확보한다는 구상이다. 이와 함께 항내성 항암제와 분해제항체접합체(DAC·Degrader Antibody Conjugate) 플랫폼은 회사 성장을 이끌 차세대 R&D 축으로 제시했다. 오스코텍은 2030년까지 항내성 항암제 분야에서 최소 2건 이상 조기 기술수출을 달성한다는 포부다. 주가 발목 잡는 지배구조 리스크…인수 재원 마련·주주 설득 관건 하지만 회사가 제시한 이 같은 재무적 자립 구상에도 불구하고 오스코텍 주가는 정체돼 있다. 현재 오스코텍 주가는 4만원 후반대로 52주 최고가 6만6000원 대비 약 30% 낮다. 8일 종가 기준 시가총액은 1조8192억원으로 코스닥 시총 순위 43위에 머물러 있다. 미국 FDA 허가 신약을 보유한 데다 글로벌 빅파마 기술수출로 안정적인 기술료 수익을 창출하는 바이오 기업이라는 점을 감안하면 기업가치가 보수적으로 책정됐다는 평가다. 시장에서는 지배구조 불확실성과 자본 전략을 둘러싼 논란이 오스코텍 주가 발목을 잡고 있다고 보고 있다. 오스코텍은 현재 제노스코를 완전 자회사로 편입하는 과정에서 주주와 다방면으로 갈등을 겪는 중이다. 제노스코는 코스닥 상장을 추진해왔으나 중복상장 논란이 불거지면서 기업공개(IPO) 계획이 사실상 무산됐다. 이에 오스코텍은 제노스코를 100% 자회사로 편입하는 지배구조 재편을 추진하겠다고 발표한 상태다. 문제는 이 지분을 얼마에 사들이느냐다. 작년 3분기 말 기준 오스코텍은 제노스코 지분 59.1%를 보유하고 있다. 이를 100%로 끌어올리기 위해서는 잔여 지분 약 40.9%를 추가로 매입해야 한다. 이 과정에서 모회사 주주와 자회사 주주 간 시각차가 극명하게 갈리고 있다. 오스코텍 주주 측이 제시하는 제노스코 적정 기업가치는 약 7000억원 수준인 반면, 제노스코 주주 측은 1조~1조4000억원까지 평가하고 있다. 이에 따라 잔여 지분 인수에 필요한 자금 규모는 최소 3000억원에서 최대 6000억원 이상까지 벌어진 상황이다. 오스코텍은 대규모 유상증자 없이 전략적 투자자(SI)·재무적 투자자(FI)를 유치해 제노스코 잔여 지분 인수 재원을 마련하겠다는 방침이다. 이를 위해 발행가능주식 총수를 확대하는 정관 변경을 추진, 제3자 배정 유상증자를 통한 자금 조달 여력을 확보하고자 했다. 그러나 해당 안건은 지난해 임시 주주총회에서 주주 반대에 부딪혀 부결되면서 무산됐다. 제노스코를 완전 자회사화하기 위한 자금 조달 경로가 막히면서 지배구조 재편 구상 자체가 사실상 원점에서 다시 검토되는 상황에 놓인 셈이다. 결국 오스코텍의 기업가치가 R&D 성과에 걸맞게 재평가되기 위해서는 제노스코 완전 자회사화에 대한 명확한 해법과 자본 조달 경로를 먼저 제시해야 한다는 분석이 나온다. 실제 투자자 행사 질의응답에서도 제노스코 100% 자회사화를 위한 자금 마련 방안과 주주 가치 희석, 주당순이익(EPS) 영향에 대한 질문이 집중됐다. 이에 대해 회사 측은 제노스코 지분 매입을 위해 SI나 FI를 유치해 자본을 마련한다는 기본 원칙에는 변함이 없다는 입장을 거듭 밝혔다. 신 전무는 "이를 통해 확보한 자금은 제노스코 지분 매입에만 사용하고 투자자의 경영권 참여 범위나 조건은 향후 주주와 소통을 통해 결정할 것"이라면서 "주주 가치 희석에 대한 우려에 대해서도 충분한 논의와 공감대 형성을 전제로 접근하겠다"고 했다. 다만 구체적인 자금 조달 시점과 규모, 제노스코 밸류에이션에 대한 수치는 여전히 제시하지 않았다. 신 전무는 "현재로서는 구체적인 숫자나 일정에 대해 말하기 어렵다"면서 "자금 조달과 밸류에이션 모두 주주와 충분한 논의와 합의가 선행돼야 할 사안"이라고 말했다. 일각에서는 제노스코 완전 자회사화가 이뤄지지 않은 상태에서 운영 통합부터 추진하는 현재 방식이 비용 부담만 키울 수 있다는 우려도 제기된다. 오스코텍은 제노스코를 100% 자회사로 편입한 뒤 양사의 연구 전문성을 유지하면서 운영과 글로벌 전략은 통합하는 '듀얼 허브' 모델을 구축할 계획이다. 항내성 항암제는 오스코텍이, DAC 플랫폼은 제노스코가 각각 중심이 돼 개발하되 임상 전략과 사업개발(BD), 글로벌 네트워크는 공동으로 수행해 효율성을 높이겠다는 전략이다. 그러나 제노스코에 대한 지배력이 완전히 확보되지 않은 상황에서 인력·조직·글로벌 네트워크를 먼저 통합할 경우 비용은 증가하는 반면 의사결정 통제력은 제한될 수 있다는 게 일부 오스코텍 주주의 우려다. 주주환원 정책을 둘러싼 시각차도 남아 있다. 주주들 사이에서는 상업화 신약과 기술수출을 통해 안정적인 수익 기반이 마련된 만큼 배당이나 자사주 매입·소각 등 보다 명확한 주주환원책을 제시해야 한다는 요구가 나온다. 특히 지배구조 개편과 자회사 편입 과정에서 주주 부담이 불가피한 만큼 이에 상응하는 환원 원칙이 병행돼야 한다는 게 일부 주주의 주장이다. 반면 오스코텍 측은 현재 성장 단계에 있는 바이오텍으로서는 현금 배당보다 R&D 재투자를 통해 기업가치를 키우는 것이 우선이라는 입장이다. 신 전무는 "무조건 자금을 소진하는 것이 아니라 장기적으로 주주 가치를 높이는 방향을 고민한 결과 현재로서는 R&D 투자가 최선"이라면서도 "주주 요구가 커질 경우 자사주 매입 등 탄력적인 자본 운용도 논의할 수 있다"고 했다.2026-01-09 06:00:47차지현 기자 -
 "편의점약 품목수 확대...주기적인 재분류 필요"[데일리팜=강혜경 기자]상황과 수요를 반영하지 못하는 안전상비의약품 제도를 즉각 개정해 품목 수 지정 조문은 삭제하고, 주기적인 재분류에 대한 강제성을 부여하기 위해 법률에서 언급할 필요가 있다는 제언이 도출됐다. 건강보험 재정 효율화와 의료접근성 향상, 자가투약 활성화 관점에서 수동적으로 운용되고 있는 의약품 재분류 역시 안전성·유효성·실사용 데이터에 기반한 상시·주기적 재평가 체계로 전환이 필요하다는 연구가 국회미래연구원 보고서에 실렸다. 인구센터 허종호 연구위원은 '일반의약품 및 약국외 판매의약품 확대 방안' 보고서에서 안전상비약과 재분류 한계를 지적했다. 일반약 가운데 '안전상비약' 13개 품목이 편의점 판매 대상으로 운영되고 있으나, 품목 지정 후 10년 넘게 품목 수의 변동이 이뤄진 바 없어 변화된 상황과 수요를 반영하지 못하고 있다고 지적했다. 또한 주요 선진국이 처방의약품에서 비처방의약품으로의 전환과 자가투약 확대를 통해 의료비·약품비 압력을 완화하고 있음에도 우리나라 재분류는 2020년, 2012년, 2021년 세 차례에 그치며 매우 수동적으로 운용되고 있다는 지적이다. 약품비 매년 증가…인구 고령화에 따른 약품비 부담 심화 허종호 연구위원은 연구 배경 및 필요성에서 "의약품의 합리적인 분류는 국민 보건 향상에 기여할 뿐만 아니라 의료보험 재정에도 영향을 미치는 정책"이라며 "선진국은 일종 요건을 충족하는 처방의약품을 비처방의약품(일반의약품 및 약국 외 판매의약품)으로 전환하는 방식으로 비처방의약품을 통한 자가투약을 점진적으로 확대·활성화하는 방향이 뚜렷한 데 반해 국내 의약품 (재)분류 시스템은 건강보험 재정 효율성 측면은 물론 의약품 접근성과 자가투약 측면에서도 매우 미흡하다"고 꼬집었다. 2000년 의약분업을 위한 분류 이후 2012년 8월에야 대규모 재분류 작업이 한 차례 실시됐으나 그 이후 13년이 지난 현재까지 재분류가 이뤄진 바 없으며, 전문의약품과 일반의약품 간의 (재)분류 뿐만 아니라 (재)분류 규정 내에 약국외 판매의약품에 대한 논의 자체는 아예 배제돼 있다는 것이다. 때문에 해열·진통제, 감기약, 소화제, 파스 등 13개 품목이 편의점 판매 대상으로 운영되고 있으나 품목 지정 후 10년이 넘게 지나도록 품목 수의 변동이 이뤄진 바 없어 변화된 상황과 수요를 반영하지 못하고 있는 것 또한 문제라는 것. 연구진은 급증하는 건강보험 약품비 지출을 감안하면 약품 재분류의 필요성은 더욱 커지고 있다고 강조했다. 2011년 총진료비는 47.4조원에서 2024년 119.2조원으로 매년 꾸준히 증가하고 있으며, 특히 65세 이상 노인 인구의 약품 청구액은 2011년 5.2조원에서 2024년 14.0조원으로 증가하는 등 노인 약품비 청구 비중은 2011년 39.7%에서 2024년 51.7%로 꾸준히 상승했다는 설명이다. 미국·일본 셀프메디케이션 강조…의료비 절감 효과 뚜렷 연구진은 미국을 비롯한 선진국의 경우 일반의약품의 비율이 매우 높고 일반의약품 슈퍼판매 제도 등 소비자의 접근성을 강화하는 방향으로 진행되고 있어 환자의 자가투약과 관련된 의약품 영역이 점점 넓어지고 있다고 판단했다. 미국의 경우 라타딘, 세티리진, 페폭사티딘 등 2세대 항히스타민제를 슈퍼·드럭스토어에서 OTC로 구매할 수 있다. 해외 선진국에서는 안전성 및 효능에 대한 자료가 확립된 품목의 경우 허가·승인 절차를 간소화함으로써 일반의약품의 시장 진출을 용이하게 하고 있다. 일본 역시 급속한 고령화와 이에 따른 의료비 증가에 대응하기 위해 셀프메디케이션을 중요한 보건의료 정책 수단으로 도입, 의료용 의약품을 단계적으로 일반용 의약품으로 전환하는 Switch OTC 제도를 운영하고 있다. 또한 2017년부터 셀프 메디케이션 세제(Self-Medication Tax System) 제도를 도입해 건강검진이나 예방접종 등을 통해 건강유지·증진활동을 수행한 납세자가 Rx-to-OTC Switch 의약품 및 일부 일반용 의약품을 연간 1만2000엔 이상 초과 구입한 경우 초과분(최대 8만8000엔)을 종합소득세에서 공제받을 수 있도록 함으로써 개인의 자가투약을 촉진하고 공적 의료보험 재정의 지속가능성을 제고하는 재정적 인센티브로 기능한다는 평가다. 프랑스는 외래 급여 의약품에 대해 최초 등재 후 5년 마다 정기적인 재평가를 법적으로 의무화한 대표적인 국가로, 재평가를 통해 보험 급여 유지 여부와 급여율을 체계적으로 조정하고 있다. 약제의 의료적 가치와 기존 치료 대비 추가적 의료적 가치를 평가해 '불충분'으로 판정된 약제는 원칙적으로 외래 급여 목록에서 제외되며, '약함'으로 평가된 약제에 대해서도 급여율 인하나 급여 범위 제한이 이뤄진다. 이러한 과정에서 급여에서 제외된 약제는 가격 규제에서 벗어나 자유 가격제로 전환되고, 상당수 품목이 일반의약품으로 소비자의 자가구매 영역에서 취급되면서 공적 보험 재정 부담에서 점진적으로 이탈하게 된다는 것. 3분류 체계 정리, 일반의약품·약국외 판매의약품 확대 정책적 개선 방안에서 연구진은 3분류 체계 정리를 선행 조건으로 제시했다. 약사법 개정 등을 통해 전문의약품, 일반의약품, 약국외 판매 의약품의 세 가지 분류를 법률 차원에서 명확하고 일관되게 규정할 필요가 있다는 주장이다. 현재 각 분류에 대한 정의와 기준은 법령과 행정규칙에 산발적으로 흩어져 있어 규범 체계의 예측 가능성과 투명성을 저해하는 만큼 각 분류의 기본 원칙과 범위를 일관되고 연속성 있게 법률에서 명시할 필요가 있다는 것이다. 이 때 분류 체계의 기준을 '처방 필요 여부'와 '판매 가능 장소'로 이원화해 보다 직관적인 구조로 개설계할 필요가 있으며, 감기약·소화제·소염진통제 등 일반약으로도 충분한 경증질환에 대해 건강보험이 적용되는 처방약은 비급여화를 통해 처방의존성을 낮추고 불필요한 외래 방문을 줄여 재정 비효율을 줄일 수 있다는 기대다. 특히 품목명 20개로 고정돼 있으면서 10년 동안 한 번도 개정되지 않은 약국외 판매의약품에 대해서는 즉각적인 법 개정이 필요한데 구체적으로는 안전상비의약품의 품목 수 지정 조문은 삭제하고, 주기적인 재분류에 대한 강제성을 부여하기 위해 법률에서 언급할 필요가 있다는 설명이다. 주기적인 재평가 및 재분류 범위 확대를 통한 일반의약품, 약국외 판매의약품 확대도 제시됐다. 현재처럼 이의 제기 시에만 작동하는 수동적 구조에서 벗어나 보건의료 환경 변화에 능동적으로 대응하는 상시·주기적 시스템으로 전환될 필요가 있다는 주장이다. 아울러 향후 인구구조 변화로 인한 인구소멸지역이나 지방 농촌지역의 경우 약국을 통한 의약품 접근성에 한계가 있을 것으로 예상할 수 있는 바, 이런 경우를 대비해서도 약국외 판매 의약품 확대는 검토돼야 할 부분이라는 설명이다. 다만 자가투약 확대가 안전성 저하로 이어지지 않도록 재분류 과정에서 복약지도가 특히 중요한 질환·약제는 약사 상담을 전제로 한 비처방군(약국 전용 비처방의약품)으로 관리하는 등 세분화된 분류와 위험기반 관리가 병행돼야 한다는 것이다. 연구진은 정책 부작용을 최소화하기 위한 보완적 정책 시행 필요성도 강조했다. 정책적 관점에서 자가투약은 분명한 이점과 잠재적 위험을 동시에 내포하는 만큼 체계적인 보완 장치가 요구된다는 것이다. 특히 항생제나 강력한 진통제와 같은 고위험 의약품에 대해서는 오남용 관리체계와 더불어 명료한 라벨과 이해하기 쉬운 환자용 설명서 제공, 약사의 복약상담 의무화, 대중광고·온라인 마케팅에 대한 엄격한 규제가 필수적으로 수반될 필요가 있다는 견해다. 궁극적으로는 이러한 안전장치를 포함한 제도·교육·규제 패키지를 설계함으로써 자가투약이 기존 의료체계를 대체하는 것이 아니라 상호보완적으로 작동하도록 유도해야 한다고 덧붙였다.2025-12-31 12:07:20강혜경 기자
"편의점약 품목수 확대...주기적인 재분류 필요"[데일리팜=강혜경 기자]상황과 수요를 반영하지 못하는 안전상비의약품 제도를 즉각 개정해 품목 수 지정 조문은 삭제하고, 주기적인 재분류에 대한 강제성을 부여하기 위해 법률에서 언급할 필요가 있다는 제언이 도출됐다. 건강보험 재정 효율화와 의료접근성 향상, 자가투약 활성화 관점에서 수동적으로 운용되고 있는 의약품 재분류 역시 안전성·유효성·실사용 데이터에 기반한 상시·주기적 재평가 체계로 전환이 필요하다는 연구가 국회미래연구원 보고서에 실렸다. 인구센터 허종호 연구위원은 '일반의약품 및 약국외 판매의약품 확대 방안' 보고서에서 안전상비약과 재분류 한계를 지적했다. 일반약 가운데 '안전상비약' 13개 품목이 편의점 판매 대상으로 운영되고 있으나, 품목 지정 후 10년 넘게 품목 수의 변동이 이뤄진 바 없어 변화된 상황과 수요를 반영하지 못하고 있다고 지적했다. 또한 주요 선진국이 처방의약품에서 비처방의약품으로의 전환과 자가투약 확대를 통해 의료비·약품비 압력을 완화하고 있음에도 우리나라 재분류는 2020년, 2012년, 2021년 세 차례에 그치며 매우 수동적으로 운용되고 있다는 지적이다. 약품비 매년 증가…인구 고령화에 따른 약품비 부담 심화 허종호 연구위원은 연구 배경 및 필요성에서 "의약품의 합리적인 분류는 국민 보건 향상에 기여할 뿐만 아니라 의료보험 재정에도 영향을 미치는 정책"이라며 "선진국은 일종 요건을 충족하는 처방의약품을 비처방의약품(일반의약품 및 약국 외 판매의약품)으로 전환하는 방식으로 비처방의약품을 통한 자가투약을 점진적으로 확대·활성화하는 방향이 뚜렷한 데 반해 국내 의약품 (재)분류 시스템은 건강보험 재정 효율성 측면은 물론 의약품 접근성과 자가투약 측면에서도 매우 미흡하다"고 꼬집었다. 2000년 의약분업을 위한 분류 이후 2012년 8월에야 대규모 재분류 작업이 한 차례 실시됐으나 그 이후 13년이 지난 현재까지 재분류가 이뤄진 바 없으며, 전문의약품과 일반의약품 간의 (재)분류 뿐만 아니라 (재)분류 규정 내에 약국외 판매의약품에 대한 논의 자체는 아예 배제돼 있다는 것이다. 때문에 해열·진통제, 감기약, 소화제, 파스 등 13개 품목이 편의점 판매 대상으로 운영되고 있으나 품목 지정 후 10년이 넘게 지나도록 품목 수의 변동이 이뤄진 바 없어 변화된 상황과 수요를 반영하지 못하고 있는 것 또한 문제라는 것. 연구진은 급증하는 건강보험 약품비 지출을 감안하면 약품 재분류의 필요성은 더욱 커지고 있다고 강조했다. 2011년 총진료비는 47.4조원에서 2024년 119.2조원으로 매년 꾸준히 증가하고 있으며, 특히 65세 이상 노인 인구의 약품 청구액은 2011년 5.2조원에서 2024년 14.0조원으로 증가하는 등 노인 약품비 청구 비중은 2011년 39.7%에서 2024년 51.7%로 꾸준히 상승했다는 설명이다. 미국·일본 셀프메디케이션 강조…의료비 절감 효과 뚜렷 연구진은 미국을 비롯한 선진국의 경우 일반의약품의 비율이 매우 높고 일반의약품 슈퍼판매 제도 등 소비자의 접근성을 강화하는 방향으로 진행되고 있어 환자의 자가투약과 관련된 의약품 영역이 점점 넓어지고 있다고 판단했다. 미국의 경우 라타딘, 세티리진, 페폭사티딘 등 2세대 항히스타민제를 슈퍼·드럭스토어에서 OTC로 구매할 수 있다. 해외 선진국에서는 안전성 및 효능에 대한 자료가 확립된 품목의 경우 허가·승인 절차를 간소화함으로써 일반의약품의 시장 진출을 용이하게 하고 있다. 일본 역시 급속한 고령화와 이에 따른 의료비 증가에 대응하기 위해 셀프메디케이션을 중요한 보건의료 정책 수단으로 도입, 의료용 의약품을 단계적으로 일반용 의약품으로 전환하는 Switch OTC 제도를 운영하고 있다. 또한 2017년부터 셀프 메디케이션 세제(Self-Medication Tax System) 제도를 도입해 건강검진이나 예방접종 등을 통해 건강유지·증진활동을 수행한 납세자가 Rx-to-OTC Switch 의약품 및 일부 일반용 의약품을 연간 1만2000엔 이상 초과 구입한 경우 초과분(최대 8만8000엔)을 종합소득세에서 공제받을 수 있도록 함으로써 개인의 자가투약을 촉진하고 공적 의료보험 재정의 지속가능성을 제고하는 재정적 인센티브로 기능한다는 평가다. 프랑스는 외래 급여 의약품에 대해 최초 등재 후 5년 마다 정기적인 재평가를 법적으로 의무화한 대표적인 국가로, 재평가를 통해 보험 급여 유지 여부와 급여율을 체계적으로 조정하고 있다. 약제의 의료적 가치와 기존 치료 대비 추가적 의료적 가치를 평가해 '불충분'으로 판정된 약제는 원칙적으로 외래 급여 목록에서 제외되며, '약함'으로 평가된 약제에 대해서도 급여율 인하나 급여 범위 제한이 이뤄진다. 이러한 과정에서 급여에서 제외된 약제는 가격 규제에서 벗어나 자유 가격제로 전환되고, 상당수 품목이 일반의약품으로 소비자의 자가구매 영역에서 취급되면서 공적 보험 재정 부담에서 점진적으로 이탈하게 된다는 것. 3분류 체계 정리, 일반의약품·약국외 판매의약품 확대 정책적 개선 방안에서 연구진은 3분류 체계 정리를 선행 조건으로 제시했다. 약사법 개정 등을 통해 전문의약품, 일반의약품, 약국외 판매 의약품의 세 가지 분류를 법률 차원에서 명확하고 일관되게 규정할 필요가 있다는 주장이다. 현재 각 분류에 대한 정의와 기준은 법령과 행정규칙에 산발적으로 흩어져 있어 규범 체계의 예측 가능성과 투명성을 저해하는 만큼 각 분류의 기본 원칙과 범위를 일관되고 연속성 있게 법률에서 명시할 필요가 있다는 것이다. 이 때 분류 체계의 기준을 '처방 필요 여부'와 '판매 가능 장소'로 이원화해 보다 직관적인 구조로 개설계할 필요가 있으며, 감기약·소화제·소염진통제 등 일반약으로도 충분한 경증질환에 대해 건강보험이 적용되는 처방약은 비급여화를 통해 처방의존성을 낮추고 불필요한 외래 방문을 줄여 재정 비효율을 줄일 수 있다는 기대다. 특히 품목명 20개로 고정돼 있으면서 10년 동안 한 번도 개정되지 않은 약국외 판매의약품에 대해서는 즉각적인 법 개정이 필요한데 구체적으로는 안전상비의약품의 품목 수 지정 조문은 삭제하고, 주기적인 재분류에 대한 강제성을 부여하기 위해 법률에서 언급할 필요가 있다는 설명이다. 주기적인 재평가 및 재분류 범위 확대를 통한 일반의약품, 약국외 판매의약품 확대도 제시됐다. 현재처럼 이의 제기 시에만 작동하는 수동적 구조에서 벗어나 보건의료 환경 변화에 능동적으로 대응하는 상시·주기적 시스템으로 전환될 필요가 있다는 주장이다. 아울러 향후 인구구조 변화로 인한 인구소멸지역이나 지방 농촌지역의 경우 약국을 통한 의약품 접근성에 한계가 있을 것으로 예상할 수 있는 바, 이런 경우를 대비해서도 약국외 판매 의약품 확대는 검토돼야 할 부분이라는 설명이다. 다만 자가투약 확대가 안전성 저하로 이어지지 않도록 재분류 과정에서 복약지도가 특히 중요한 질환·약제는 약사 상담을 전제로 한 비처방군(약국 전용 비처방의약품)으로 관리하는 등 세분화된 분류와 위험기반 관리가 병행돼야 한다는 것이다. 연구진은 정책 부작용을 최소화하기 위한 보완적 정책 시행 필요성도 강조했다. 정책적 관점에서 자가투약은 분명한 이점과 잠재적 위험을 동시에 내포하는 만큼 체계적인 보완 장치가 요구된다는 것이다. 특히 항생제나 강력한 진통제와 같은 고위험 의약품에 대해서는 오남용 관리체계와 더불어 명료한 라벨과 이해하기 쉬운 환자용 설명서 제공, 약사의 복약상담 의무화, 대중광고·온라인 마케팅에 대한 엄격한 규제가 필수적으로 수반될 필요가 있다는 견해다. 궁극적으로는 이러한 안전장치를 포함한 제도·교육·규제 패키지를 설계함으로써 자가투약이 기존 의료체계를 대체하는 것이 아니라 상호보완적으로 작동하도록 유도해야 한다고 덧붙였다.2025-12-31 12:07:20강혜경 기자 -
 ADC, 폐암서 새 가능성 확인…잇단 실패 이후 첫 성과[데일리팜=손형민 기자] TROP-2를 표적한 항체약물접합체(ADC)가 비소세포폐암에서 새로운 가능성을 확인했다. 트로델비, 다트로웨이 등 주요 신약들이 폐암 임상에서 잇따라 고배를 마신 가운데, 이번 성과가 TROP-2 ADC 재평가의 분기점이 될 수 있을지 주목된다. 29일 관련 업계에 따르면 MSD의 파트너사인 중국 켈룬바이오텍은 최근 TROP-2 표적 항체약물접합체(ADC) '사시투주맙 티루모테칸'과 면역항암제 '키트루다(펨브롤리주맙)' 병용요법으로 비소세포폐암(NSCLC) 1차 치료 임상 3상에서 유의미한 성과를 확보했다. MSD는 지난 2022년 켈룬바이오텍으로부터 ADC 후보물질 사시투주맙 티모루테칸을 도입한 바 있다. 사시투주맙 티루모테칸은 ▲TROP2 표적 단클론 항체인 사시투주맙 ▲토포이소머레이스1(TOP1) 억제 계열의 페이로드 ▲가수분해가 가능한 신규 링커로 구성된 ADC다. 평균 약물-항체 비율(DAR)은 약 7.4로, 비교적 높은 페이로드 탑재를 통해 종양 내 약물 전달 효율을 끌어올린 것이 특징이다. 이번 결과는 중국에서 진행 중인 임상 3상 OptiTROP-Lung05 연구의 중간 분석에서 도출됐다. OptiTROP-Lung05는 PD-L1 발현 종양비율(TPS) 1% 이상인 이전 치료 경험이 없는 비소세포폐암 환자를 대상으로, 사시투주맙 티루모테칸과 키트루다 병용요법을 키트루다 단독요법과 비교 평가하는 연구다. 켈룬에 따르면 이번 중간 분석에서 1차 평가변수인 무진행생존기간(PFS) 개선을 충족했으며, 전체생존(OS)에서도 긍정적인 경향이 관찰됐다. 켈룬은 중국 규제당국과 폐암 적응증에 대한 허가 가능성에 대한 논의를 진행할 계획이다. 이번 성과는 ADC와 면역항암제 병용요법이 1차 비소세포폐암 임상 3상에서 1차 평가변수를 충족한 첫 사례라는 점에서 의미가 크다. 다만 연구 설계상 비교군이 키트루다 단독요법이라는 점은 해석에 주의가 필요하다는 지적도 나온다. 현재 글로벌 표준치료는 키트루다+항암화학요법 병용이 주를 이루고 있어 향후 병용 화학요법과의 직접 비교 데이터가 확보돼야 임상적 위치를 명확히 할 수 있다는 분석도 나온다. 켈룬과 MSD는 사시투주맙 티루모테칸의 폐암 적응증 확대를 공격적으로 추진하고 있다. 실제로 해당 ADC는 최근 중국에서 EGFR 변이 비소세포폐암 2차 치료 적응증으로 허가를 획득하며, 중국 내에서만 세 번째 적응증을 확보했다. 해당 적응증 역시 임상 3상에서 화학요법 대비 PFS와 OS를 모두 개선한 결과를 바탕으로 승인됐다. 다만 OptiTROP-Lung05는 중국 환자만을 대상으로 진행된 연구인 만큼, 미국이나 글로벌 1차 폐암 치료 환경을 직접적으로 반영하기에는 한계가 있다. 이에 따라 MSD는 글로벌 개발 전략을 별도로 전개 중이다. MSD는 현재 사시투주맙 티루모테칸을 대상으로 10건 이상의 허가 목적(registrational) 임상을 진행하고 있으며, 이 중 5건은 글로벌 3상이다. 아직까지는 키트루다+항암화학요법을 직접 비교군으로 설정한 1차 폐암 임상에 대해서는 공식적인 계획을 밝히지 않았다. 보다 정교한 환자군을 겨냥한 임상도 병행되고 있다. MSD가 주도하는 TroFuse-007 연구는 PD-L1 TPS 50% 이상인 1차 비소세포폐암 환자를 대상으로, 키트루다 단독요법 대비 사시투주맙 티루모테칸 병용의 유효성을 평가하고 있다. 이 환자군은 기존에도 항암화학요법 병용의 추가 효과가 제한적인 집단으로 분류돼, ADC 병용 전략의 차별성이 시험대에 오를 전망이다. MSD와 켈룬은 사시투주맙 티루모테칸을 TROP-2 ADC 계열의 '워크호스(workhorse)'로 키운다는 전략 아래 개발 속도를 끌어올리고 있다. MSD는 최근 사시투주맙 티루모테칸 개발 자금을 확보하기 위해 블랙스톤과 최대 7억 달러 규모의 로열티 계약을 체결하기도 했다. 폐암서 개발 난항 겪었던 TROP-2 ADC 사시투주맙 티루모테칸의 임상 성과에도 불구하고, 업계에서는 TROP-2 ADC가 폐암에서 일관된 생존 혜택을 입증할 수 있을지에 대해서는 여전히 검증이 필요하다는 시각이 지배적이다. 실제로 앞서 길리어드와 아스트라제네카·다이이찌산쿄의 TROP-2 ADC들이 폐암 임상에서 잇따라 고배를 마신 만큼, 사시투주맙 티루모테칸 역시 기존 실패의 벽을 완전히 넘을 수 있을지가 향후 관건이 될 전망이다. TROP-2는 삼중음성유방암을 포함한 다양한 상피 유래 고형암에서 과발현되는 세포막 단백질로, 종양의 증식·침윤·전이에 관여하는 것으로 알려져 있다. TROP-2 ADC는 이 단백질을 발현하는 암세포에 선택적으로 결합해, 세포 내부로 세포독성 물질을 전달하는 방식으로 항암 효과를 유도한다. 다만, TROP-2 ADC들은 유방암에서는 속속 효과를 나타내며 허가를 획득한 것과 달리 폐암에서는 유효성 입증에 거듭 실패한 바 있다. 길리어드의 TROP-2 ADC '트로델비(사시투주맙 고비테칸)'는 TNBC 치료에서 생존 이점을 입증하며 글로벌 블록버스터로 자리 잡았지만, 폐암에서는 동일한 성과를 재현하지 못했다. EVOKE-01로 명명된 임상 3상 연구는 이전 치료를 받은 4기 전이성 비소세포폐암 환자를 대상으로 트로델비와 도세탁셀을 비교 평가했으며, 1차 평가변수는 전체생존(OS)이었다. 결과적으로 트로델비는 OS에서 통계적 유의성을 확보하지 못했고, 일부 하위 지표에서 유효성 경향만 확인하는 데 그쳤다. 길리어드는 해당 결과를 바탕으로 폐암 적응증 확대 전략을 사실상 중단했다. 아스트라제네카와 다이이찌산쿄 역시 비슷한 난관을 겪었다. 양사가 공동 개발한 '다르토웨이(다토포타맙 데룩스테칸)'는 ;엔허투(트라스투주맙 데룩스테칸)'로 ADC 시장을 재편한 다이이찌산쿄의 두 번째 야심작으로 평가받았지만, 폐암 임상에서 기대만큼의 성과를 내지 못했다. 임상 3상 TROPION-Lung01 연구는 이전 치료를 받은 진행성·전이성 비소세포폐암 환자를 대상으로 다토포타맙과 도세탁셀을 1대1로 비교했다. 연구 결과, 무진행생존(PFS)에서는 일부 환자군에서 개선이 관찰됐으나, OS에서 유의미한 차이를 입증하는 데 실패했다. 특히 비편평(non-squamous) 환자군에서만 제한적인 효과가 나타나면서, 광범위한 적응증 확장에는 한계가 드러났다. 이 결과를 토대로 양사는 미국에 이어 유럽에서도 허가 신청을 철회했다. 규제당국과의 사전 협의 과정에서 임상적 유의성이 불충분하다는 판단이 내려진 것이다. 이후 아스트라제네카와 다이이찌산쿄는 바이오마커 기반 환자 선별 전략을 새롭게 검토하며, 표적치료제와의 병용 가능성도 확인 중이다. 이 실패를 두고 유방암에서의 성공 공식을 폐암에 그대로 적용한 한계라는 평가도 나온다. 폐암은 종양 내 이질성이 크고, TROP-2 발현 정도와 치료 반응 간의 상관관계가 유방암만큼 명확하지 않다는 점이 주요 원인으로 지목된다. 여기에 반복 투여 시 누적 독성 관리 역시 부담으로 작용했다는 분석이다. 결과적으로 TROP-2 ADC는 모든 고형암으로 확장 가능한 범용 플랫폼이라는 초기 기대와 달리, 적응증별로 성패가 극명하게 갈리는 영역임이 확인되고 있다. 이런 상황에서 최근 사시투주맙 티루모테칸이 중국에서 유효성을 확보한 결과는 TROP-2 ADC의 새 가능성을 증명한 사례로 평가된다.2025-12-29 06:00:45손형민 기자
ADC, 폐암서 새 가능성 확인…잇단 실패 이후 첫 성과[데일리팜=손형민 기자] TROP-2를 표적한 항체약물접합체(ADC)가 비소세포폐암에서 새로운 가능성을 확인했다. 트로델비, 다트로웨이 등 주요 신약들이 폐암 임상에서 잇따라 고배를 마신 가운데, 이번 성과가 TROP-2 ADC 재평가의 분기점이 될 수 있을지 주목된다. 29일 관련 업계에 따르면 MSD의 파트너사인 중국 켈룬바이오텍은 최근 TROP-2 표적 항체약물접합체(ADC) '사시투주맙 티루모테칸'과 면역항암제 '키트루다(펨브롤리주맙)' 병용요법으로 비소세포폐암(NSCLC) 1차 치료 임상 3상에서 유의미한 성과를 확보했다. MSD는 지난 2022년 켈룬바이오텍으로부터 ADC 후보물질 사시투주맙 티모루테칸을 도입한 바 있다. 사시투주맙 티루모테칸은 ▲TROP2 표적 단클론 항체인 사시투주맙 ▲토포이소머레이스1(TOP1) 억제 계열의 페이로드 ▲가수분해가 가능한 신규 링커로 구성된 ADC다. 평균 약물-항체 비율(DAR)은 약 7.4로, 비교적 높은 페이로드 탑재를 통해 종양 내 약물 전달 효율을 끌어올린 것이 특징이다. 이번 결과는 중국에서 진행 중인 임상 3상 OptiTROP-Lung05 연구의 중간 분석에서 도출됐다. OptiTROP-Lung05는 PD-L1 발현 종양비율(TPS) 1% 이상인 이전 치료 경험이 없는 비소세포폐암 환자를 대상으로, 사시투주맙 티루모테칸과 키트루다 병용요법을 키트루다 단독요법과 비교 평가하는 연구다. 켈룬에 따르면 이번 중간 분석에서 1차 평가변수인 무진행생존기간(PFS) 개선을 충족했으며, 전체생존(OS)에서도 긍정적인 경향이 관찰됐다. 켈룬은 중국 규제당국과 폐암 적응증에 대한 허가 가능성에 대한 논의를 진행할 계획이다. 이번 성과는 ADC와 면역항암제 병용요법이 1차 비소세포폐암 임상 3상에서 1차 평가변수를 충족한 첫 사례라는 점에서 의미가 크다. 다만 연구 설계상 비교군이 키트루다 단독요법이라는 점은 해석에 주의가 필요하다는 지적도 나온다. 현재 글로벌 표준치료는 키트루다+항암화학요법 병용이 주를 이루고 있어 향후 병용 화학요법과의 직접 비교 데이터가 확보돼야 임상적 위치를 명확히 할 수 있다는 분석도 나온다. 켈룬과 MSD는 사시투주맙 티루모테칸의 폐암 적응증 확대를 공격적으로 추진하고 있다. 실제로 해당 ADC는 최근 중국에서 EGFR 변이 비소세포폐암 2차 치료 적응증으로 허가를 획득하며, 중국 내에서만 세 번째 적응증을 확보했다. 해당 적응증 역시 임상 3상에서 화학요법 대비 PFS와 OS를 모두 개선한 결과를 바탕으로 승인됐다. 다만 OptiTROP-Lung05는 중국 환자만을 대상으로 진행된 연구인 만큼, 미국이나 글로벌 1차 폐암 치료 환경을 직접적으로 반영하기에는 한계가 있다. 이에 따라 MSD는 글로벌 개발 전략을 별도로 전개 중이다. MSD는 현재 사시투주맙 티루모테칸을 대상으로 10건 이상의 허가 목적(registrational) 임상을 진행하고 있으며, 이 중 5건은 글로벌 3상이다. 아직까지는 키트루다+항암화학요법을 직접 비교군으로 설정한 1차 폐암 임상에 대해서는 공식적인 계획을 밝히지 않았다. 보다 정교한 환자군을 겨냥한 임상도 병행되고 있다. MSD가 주도하는 TroFuse-007 연구는 PD-L1 TPS 50% 이상인 1차 비소세포폐암 환자를 대상으로, 키트루다 단독요법 대비 사시투주맙 티루모테칸 병용의 유효성을 평가하고 있다. 이 환자군은 기존에도 항암화학요법 병용의 추가 효과가 제한적인 집단으로 분류돼, ADC 병용 전략의 차별성이 시험대에 오를 전망이다. MSD와 켈룬은 사시투주맙 티루모테칸을 TROP-2 ADC 계열의 '워크호스(workhorse)'로 키운다는 전략 아래 개발 속도를 끌어올리고 있다. MSD는 최근 사시투주맙 티루모테칸 개발 자금을 확보하기 위해 블랙스톤과 최대 7억 달러 규모의 로열티 계약을 체결하기도 했다. 폐암서 개발 난항 겪었던 TROP-2 ADC 사시투주맙 티루모테칸의 임상 성과에도 불구하고, 업계에서는 TROP-2 ADC가 폐암에서 일관된 생존 혜택을 입증할 수 있을지에 대해서는 여전히 검증이 필요하다는 시각이 지배적이다. 실제로 앞서 길리어드와 아스트라제네카·다이이찌산쿄의 TROP-2 ADC들이 폐암 임상에서 잇따라 고배를 마신 만큼, 사시투주맙 티루모테칸 역시 기존 실패의 벽을 완전히 넘을 수 있을지가 향후 관건이 될 전망이다. TROP-2는 삼중음성유방암을 포함한 다양한 상피 유래 고형암에서 과발현되는 세포막 단백질로, 종양의 증식·침윤·전이에 관여하는 것으로 알려져 있다. TROP-2 ADC는 이 단백질을 발현하는 암세포에 선택적으로 결합해, 세포 내부로 세포독성 물질을 전달하는 방식으로 항암 효과를 유도한다. 다만, TROP-2 ADC들은 유방암에서는 속속 효과를 나타내며 허가를 획득한 것과 달리 폐암에서는 유효성 입증에 거듭 실패한 바 있다. 길리어드의 TROP-2 ADC '트로델비(사시투주맙 고비테칸)'는 TNBC 치료에서 생존 이점을 입증하며 글로벌 블록버스터로 자리 잡았지만, 폐암에서는 동일한 성과를 재현하지 못했다. EVOKE-01로 명명된 임상 3상 연구는 이전 치료를 받은 4기 전이성 비소세포폐암 환자를 대상으로 트로델비와 도세탁셀을 비교 평가했으며, 1차 평가변수는 전체생존(OS)이었다. 결과적으로 트로델비는 OS에서 통계적 유의성을 확보하지 못했고, 일부 하위 지표에서 유효성 경향만 확인하는 데 그쳤다. 길리어드는 해당 결과를 바탕으로 폐암 적응증 확대 전략을 사실상 중단했다. 아스트라제네카와 다이이찌산쿄 역시 비슷한 난관을 겪었다. 양사가 공동 개발한 '다르토웨이(다토포타맙 데룩스테칸)'는 ;엔허투(트라스투주맙 데룩스테칸)'로 ADC 시장을 재편한 다이이찌산쿄의 두 번째 야심작으로 평가받았지만, 폐암 임상에서 기대만큼의 성과를 내지 못했다. 임상 3상 TROPION-Lung01 연구는 이전 치료를 받은 진행성·전이성 비소세포폐암 환자를 대상으로 다토포타맙과 도세탁셀을 1대1로 비교했다. 연구 결과, 무진행생존(PFS)에서는 일부 환자군에서 개선이 관찰됐으나, OS에서 유의미한 차이를 입증하는 데 실패했다. 특히 비편평(non-squamous) 환자군에서만 제한적인 효과가 나타나면서, 광범위한 적응증 확장에는 한계가 드러났다. 이 결과를 토대로 양사는 미국에 이어 유럽에서도 허가 신청을 철회했다. 규제당국과의 사전 협의 과정에서 임상적 유의성이 불충분하다는 판단이 내려진 것이다. 이후 아스트라제네카와 다이이찌산쿄는 바이오마커 기반 환자 선별 전략을 새롭게 검토하며, 표적치료제와의 병용 가능성도 확인 중이다. 이 실패를 두고 유방암에서의 성공 공식을 폐암에 그대로 적용한 한계라는 평가도 나온다. 폐암은 종양 내 이질성이 크고, TROP-2 발현 정도와 치료 반응 간의 상관관계가 유방암만큼 명확하지 않다는 점이 주요 원인으로 지목된다. 여기에 반복 투여 시 누적 독성 관리 역시 부담으로 작용했다는 분석이다. 결과적으로 TROP-2 ADC는 모든 고형암으로 확장 가능한 범용 플랫폼이라는 초기 기대와 달리, 적응증별로 성패가 극명하게 갈리는 영역임이 확인되고 있다. 이런 상황에서 최근 사시투주맙 티루모테칸이 중국에서 유효성을 확보한 결과는 TROP-2 ADC의 새 가능성을 증명한 사례로 평가된다.2025-12-29 06:00:45손형민 기자 -
 "아뎀파스, PDE5i 반응 불충분 환자에 효과적 대안"[데일리팜=손형민 기자] "폐동맥고혈압의 궁극적인 치료 목표는 저위험군에 도달해 이를 유지하는 것이다. 그 목표에 미치지 못하거나 위험도가 충분히 낮아지지 않았다면 빠른 치료 전략 전환이 필수다." PDE5 억제제에 충분한 반응을 보이지 않는 폐동맥고혈압 환자에서 sGC 자극제 바이엘의 '아뎀파스(리오시구앗)'로의 전환이 현실적인 치료 전략으로 부상하고 있다. 국내에서도 최근 급여 기준이 신설되며, 단독요법 후 순차적 병용요법 중심이던 치료 흐름에 변화의 계기가 마련됐다는 평가가 나온다. 밸레리 맥러플린(Vallerie McLaughlin) 미국 미시간대학교 병원 심장내과 교수와 정욱진 가천대 길병원 심장내과 교수는 최근 데일리팜과 만난 자리에서 폐동맥고혈압 치료에서 아뎀파스의 임상적 활용 가능성을 강조했다. 폐동맥압이 비정상적으로 높아지는 폐고혈압은 원인에 따라 5개 군으로 나뉜다. 이 가운데 1군인 폐동맥고혈압(PAH)과 4군인 만성 혈전색전성 폐고혈압(CTEPH) 은 전체 폐고혈압 환자의 각각 약 3%에 불과한 희귀질환으로 분류된다. 호흡곤란, 피로, 어지럼증 등 비특이적 증상으로 시작되는 경우가 많아 환자가 이를 나이 탓으로 넘기거나, 1차 의료기관에서 다른 질환으로 오인되면서 진단이 지연되는 사례도 적지 않다. 폐동맥고혈압은 적절한 치료가 이뤄지지 않을 경우 2~3년 내 사망할 수 있는 중증 질환으로 알려져 있다. 국내에서는 의료진 인식 변화와 조기 발견 노력, 우심도관삽입술 시행 확대 등이 맞물리며 환자 수가 증가해 왔지만, 치료 환경은 글로벌 가이드라인과 일정 부분 괴리를 보인다는 지적도 나온다. 글로벌 가이드라인이 치료 초기부터 엔도텔린 수용체 차단제(ERA)와 PDE5 억제제(PDE5i) 병용요법을 권고하는 것과 달리, 국내에서는 여전히 단독요법으로 시작해 순차적으로 약제를 추가해나가는 치료 전략이 흔하게 적용되고 있기 때문이다. 폐동맥고혈압 치료제는 작용 기전에 따라 ▲엔도텔린 경로 표적치료제(ERA) ▲산화질소 경로 표적치료제(PDE5 억제제, sGC 자극제) ▲프로스타사이클린 유사체(PCA) ▲프로스타글라딘 수용체 작용제(PRA) 등으로 나뉜다. 글로벌 가이드라인에서는 초기부터 ERA와 PDE5 억제제 병용요법을 권고하고, 반응이 불충분할 경우 PCA나 PRA 등 다른 기전의 약제를 추가하는 방식으로 치료를 확장한다. 이는 여러 병태생리 경로를 동시에 표적해 치료 효과를 극대화하려는 전략이다. 반면 국내에서는 ERA 단독요법으로 치료를 시작한 뒤 반응이 부족할 경우 PDE5 억제제를 추가하고, 이후에도 개선이 없을 경우 PCA나 PRA를 병용하는 방식이 주로 적용돼 왔다. 그러나 연구에 따르면 ERA와 PDE5 억제제 병용에도 불구하고 일부 환자에서는 PDE5 억제제에 대한 반응 부족이나 내약성 문제로 임상적 악화가 발생하는 것으로 보고됐다. 이러한 상황에서 sGC 자극제인 '아뎀파스(리오시구앗)'는 PDE5 억제제를 대체할 수 있는 치료 옵션으로 주목받고 있다. 실제로 PDE5 억제제 치료에도 임상 반응이 불충분한 성인 증상성 폐동맥고혈압 환자를 대상으로 한 REPLACE 연구에서, PDE5 억제제를 아뎀파스로 전환한 환자군은 기존 PDE5 억제제 유지군 대비 24주 시점의 임상적 개선 도달률이 2.78배 높았고, 임상 악화 발생 위험은 90% 감소했다. 이러한 근거를 바탕으로 2022년 ESC/ERS (유럽심장학회/유럽호흡기학회) 폐고혈압 치료 가이드라인에서도 ERA와 PDE5 억제제 병용에도 치료 목표에 도달하지 못한 환자에서 PDE5 억제제를 sGC 자극제로 전환할 것을 권고하고 있다. 이에 따라 국내에서도 올해 6월부터 아뎀파스의 급여 기준이 신설됐다. WHO 기능분류 2~3단계의 폐동맥고혈압 환자(WHO Group 1) 가운데 ▲ERA 및/또는 PDE5 억제제에 반응이 충분하지 않거나 ▲ERA와 PDE5 억제제 모두에 금기인 경우 급여 투여가 인정된다. 이는 3제 병용요법으로 넘어가기 전, 환자 상태를 개선할 수 있는 새로운 치료 전략으로 활용될 수 있을 것으로 기대된다. 이 같은 변화 속에서 두 교수는 "폐고혈압은 의심이 출발점"이라며 "조기 진단의 중요성과 함께, 치료 목표를 저위험군에 도달·유지하는 데 두고 환자 반응에 따라 치료 전략을 유연하게 조정해야 한다"고 강조했다. Q. 폐동맥고혈압의 주요 증상 및 원인과 함께 폐동맥고혈압의 심각성에 대해 설명 부탁드린다. 밸레리 맥러플린 교수: 폐동맥고혈압은 운동이나 활동 시 호흡곤란이 두드러지게 나타난다. 환자마다 시점의 차이는 있지만 공통적으로 호흡곤란을 경험하게 된다. 실제로 많은 환자들이 호흡곤란을 주된 이유로 병원을 찾는다. 이외에도 피로감, 어지럼증, 흉통, 하지 부종 등이 발생한다. 이러한 증상은 비특이적이며, 다른 질환에서도 흔히 나타날 수 있어 진단이 지연되는 경우가 많다. 폐동맥고혈압은 희귀질환이다. 명확한 원인을 찾지 못하는 특발성인 경우도 있으나, 유전적 요인, 특정 약물 복용이나 식습관 등이 있으며, 결체조직(connective tissue) 질환, 간 질환, 심부전 등에 의해 발생하기도 한다. 정욱진 교수: 폐동맥고혈압의 대표적인 증상은 계단이나 언덕을 오를 때 나타나는 호흡곤란이다. 평지에서는 숨이 차지 않지만 계단이나 언덕을 조금만 올라가도 숨이 차는 양상이 두드러진다. 폐동맥고혈압 진단이 지연되는 이유는 피로감, 어지럼증, 흉통 등 증상이 비특이적이기 때문이다. 폐동맥고혈압은 다양한 치료제가 개발되며 치료를 통해 조절 가능한 질환이 되고 있지만, 여전히 예후가 좋지 않다는 특성이 있다. 따라서 전문 의료진의 신속한 진료를 통해 정확한 진단과 적절한 치료를 받는 것이 무엇보다 중요하다. Q. 미국과 한국의 폐동맥고혈압 치료 환경은 어떠한가? 밸레리 맥러플린 교수: 미국에서는 13종의 폐동맥고혈압 치료제가 이미 FDA 승인을 받아 사용이 가능하며, 실제로 많은 환자들이 엔도텔린 경로 표적치료제(ERA), 프로스타사이클린 경로 표적치료제(PCA, PRA), 일산화질소 경로 표적치료제(PDE5 억제제, sGC 자극제) 등 다앙한 계열의 약제를 사용하고 있다. 고위험군으로 분류될 경우 보다 집중적인 치료가 필요하다. 고위험군은 정맥투여 프로스타사이클린 경로 표적치료제를 투여하면서 엔도텔린 경로 표적치료제나 일산화질소 경로 표적치료제를 병행하는 3제 요법까지 고려할 수 있다. 중간 위험군이나 저위험군 환자들은 경구 제제를 기반으로 한 2제 요법을 시행하며, ERA나 일산화질소 경로 표적치료제인 PDE-5 억제제, sGC 자극제 등이 활용된다. 이러한 초기 치료는 첫 단계에 불과하다. 치료 시작 후 3~4개월이 지나면 객관적 평가 도구를 통해 환자의 위험도를 주기적으로 재평가해야 한다. 치료 목표에 도달했다면 기존 치료를 유지하면 되지만, 위험도가 충분히 낮아지지 않았다면 치료 강도를 높여야 한다. 3제 병용요법이나 기존에 사용하던 PDE-5 억제제를 sGC 자극제로 교체하는 전략을 고려할 수 있다. 이후에도 재평가 과정을 반복하며, 궁극적인 치료 목표는 환자를 저위험군에 도달하게 하고 그 상태를 지속적으로 유지하는 것이다. 정욱진 교수: 전 세계적으로는 1995년 에포프로스테놀이 출시되면서 폐동맥고혈압 치료제 개발이 본격화되었다. 국내에서는 2005년 바이엘의 벤타비스(일로프로스트)가 급여 적용 되면서 비로소 치료제를 제대로 사용할 수 있게 되었다. 과거에는 환자 상태가 악화되면 약제를 추가하는 방식으로 치료가 이루어졌다. 그러나 폐동맥고혈압은 완치가 어려운 질환이기 때문에 상태가 나빠진 후 치료 강도를 높이는 접근은 매우 위험하며 사망률을 낮추는 데도 충분하지 않다. 이에 최근의 치료 전략은 목표 지향적으로 초기부터 위험도를 낮춰 저위험군 상태로 도달하게 하고, 그 상태를 유지하는 것에 초점을 두는 가이드라인 기반 약물치료(GDMT) 원칙을 따른다. 환자를 저위험군으로 유도하는 동시에, 혈역학적 지표를 가능한 한 정상에 가까운 수준으로 조절하는 것도 중요한 치료 목표다. 최소 목표는 평균 폐동맥압 40 mmHg, 폐혈관저항 4 Wood units 이하를 유지하며 저위험군 상태를 지속하는 것이며, 일부 환자는 평균 폐동맥압 20 mmHg, 폐혈관저항 2 Wood units와 같이 정상에 가까운 수준까지 도달하기도 한다 주사 치료는 전체 환자의 약 10% 에서만 필요하며, 대다수 환자는 경구 약제만으로도 혈역학적 목표에 도달할 수 있다. Q. 임상 현장에서 느끼는 치료 상의 어려움이 있다면 말씀 부탁드린다. 정욱진 교수: 치료 과정에서의 어려움은 국내에 도입되지 않은 약제가 여전히 존재한다는 점이다. 전 세계적으로 13종의 약제가 사용되고 있으나, 그 중 4종은 국내에 도입되지 않았다. 도입된 약제 중에서도 일부는 보험급여가 적용되지 않아 접근성이 제한되고 있다. 국립암정보센터에 따르면 우리나라의 전체 암 5년 생존율(2018년~2022년)은 약 72.9%이며, 폐동맥고혈압의 5년 생존율은 71.9%로 나타났다. 폐동맥고혈압은 암보다 낮은 예후를 보이는 질환이라는 점에서 정부 지원이 필수적이다. 폐동맥고혈압 환자 중 일부만이 산정특례 대상자에 해당하며, 그마저도 특발성 폐동맥고혈압(IPAH)에 한정되어 있다. 폐동맥고혈압은 보험 지원 없이는 치료가 사실상 불가능한 고비용 질환이다. 따라서 특발성 폐동맥고혈압뿐만 아니라 다른 원인에 의해 발생하는 폐동맥고혈압에도 정확한 분류와 함께 특례 지원을 확대할 필요가 있다. 일반적으로 우리나라에서의 폐동맥고혈압 치료는 ERA를 먼저 사용하고, 반응이 충분하지 않을 경우 PDE-5 억제제를 추가하는 방식으로 진행된다. 그러나 PDE-5 억제제에 반응이 충분하지 않은 환자들을 위한 그 다음 대체제가 없었고, 국내에는 정맥투여 제제가 도입되지 않았기 때문에 피하주사 및 흡입 제형의 프로스타사이클린 경로 표적치료제를 사용하고 있었다. 이번에 급여권에 진입한 아뎀파스는 sGC 자극제로, 적은 용량으로도 강한 혈관 확장 효과를 나타내기 때문에 PDE-5 억제제에 반응하지 않는 환자까지 치료할 수 있는 강력한 옵션으로 평가된다. PDE-5 억제제 반응이 낮은 경우 바로 아뎀파스로 전환할 수 있으며, PDE-5 억제제 금기 상황에서도 사용가능하기 때문에, 임상적으로 매우 유용한 치료 옵션이 생겼다는 점에서 중요한 의미를 갖는다. Q. 미국에서는 아뎀파스가 이미 오랜기간 임상 현장에서 사용되고 있다. 임상적 가치를 평가한다면? 밸레리 맥러플린 교수: 아뎀파스는 미국에서 10년 전부터 폐동맥고혈압 치료제로 사용되어오면서 오랜 기간 충분한 임상 데이터를 확보했다. 아뎀파스는 체내 일산화질소 수준과 무관하게 cGMP 생성을 직접 촉진하는 약제다. PDE-5 억제제와 달리 일산화질소(NO)에 비의존적으로, NO라는 전구 물질이 없어도 혈관 확장 반응을 유도해 폐동맥고혈압 치료 효과를 낸다. 아뎀파스는 위약 대비 치료 효능 및 안전성을 확인한 PATENT 임상 연구에서 위약군 대비 6분 보행검사 등 운동 능력과 폐혈관 저항, NT-proBNP를 포함한 심혈관 지표에서 유의한 개선이 확인됐다. 또한 REPLACE 임상 연구에서는 기존에 ERA와 PDE-5 억제제를 병용하던 환자들을 두 그룹으로 나누어, 한 그룹은 기존 치료를 유지하고 다른 그룹은 PDE-5 억제제를 아뎀파스로 교체한 치료 효과를 비교했다. 연구 결과 아뎀파스로의 전환 투여 시의 임상적 개선 도달률이 PDE-5 억제제 유지 투여군보다 2.78배 유의하게 높게 나타났다. 치료제가 제한적으로 도입되어 있는 한국의 상황을 고려할 때, PDE-5 억제제에 충분한 반응을 보이지 않는다면 아뎀파스로 대체하는 방식이 효과적인 대안이 될 수 있다. Q. 아뎀파스의 CTEPH 치료 적응증에서의 활용 가치는 어떠한가? 정욱진 교수: 아뎀파스는 만성 혈전색전성 폐고혈압(CTEPH) 환자에게 사용할 수 있는 유일한 약제로, 이미 10년 전부터 전 세계적으로 사용되어 왔다. 그러나 국내에서는 급여가 적용되지 않아 환자의 접근성이 낮은 상황이다. CTEPH 환자 수는 폐동맥고혈압 환자와 거의 비슷한 수준으로 추정되지만, 수술이나 시술을 시행하는 등 실제로 치료를 받고 있는 환자는 약 300~400명 정도에 그치고 있다. 아뎀파스는 CTEPH 환자 중에서도 시술 후 폐동맥압이 잔존하거나, 수술 또는 시술이 불가능한 환자들에게 도움이 된다. 아뎀파스는 명확한 임상 근거가 있는 약제인만큼, KCD 코드를 신설하고 보험 급여를 통해 접근성을 보장할 필요가 있다. 학회에서도 국회, 심평원과 논의를 이어갈 예정이다. 밸레리 맥러플린 교수: 아뎀파스는 미국 FDA로부터 승인 받은 유일한 CTEPH 치료제로, 실제 임상 현장에서 10년 전부터 사용되고 있다. 아뎀파스는 CTEPH 환자 중 폐색 부위의 혈관이 지나치게 작아 폐동맥 내막절제술이나 풍선확장술과 같은 수술 또는 시술이 불가능하거나, 시술 후 폐동맥압이 잔존하는 환자에게 사용할 수 있는 약제이다. 폐동맥 내막절제술을 시행한 환자들 중에서도 수술 후 폐동맥압이 충분히 낮아지지 않고 높은 상태로 지속되는 경우가 있다. 압력이 과도하게 높게 유지되면 예후에 부정적인 영향을 미치기 때문에, 수술 후 6개월 시점에 우도관삽입술을 통해 폐동맥압을 다시 평가하고 있다. 영국 연구 결과에 따르면, 수술 후 평균 폐동맥압이 35mmHg 이하로 감소하지 않는 환자는 예후가 매우 불량한 것으로 알려져 있다. 이러한 환자들에게는 아뎀파스를 사용하여 폐동맥압을 낮추는 조치를 시행하고 있다. 이와 더불어 풍선확장술을 앞둔 환자가 아뎀파스를 먼저 투여하면 수술 위험도를 낮출 수 있다는 연구 결과도 있다. 이러한 근거를 바탕으로 다양한 유형의 CTEPH 환자들에게 아뎀파스를 적극적으로 활용하고 있으며, 임상 경험도 성공적이다. Q. 수술이나 시술이 불가한 CTEPH 환자에게는 어떤 치료 방법을 적용하고 있는지? 정욱진 교수: 일부 환자들은 비급여로 PDE-5 억제제를 사용하고 있으나, 이는 아뎀파스를 사용할 수 없기 때문에 발생하고 있는 치료 공백이라고 볼 수 있다. CTEPH에 대한 KCD 코드 신설과 보험 적용을 조속히 추진해야 하는 이유다. 밸레리 맥러플린 교수: ERA 계열 약물도 과거 CTEPH 환자를 대상으로 연구가 진행되었으나, 성공적이지 못했다. 아뎀파스만이 CTEPH에서 유의한 치료 효과를 입증했고, 다른 대체 약제가 없는 상황이기 때문에 그 필요성이 더욱 절실하다. Q. 폐고혈압 치료 환경 개선을 위한 제언이 있다면? 밸레리 맥러플린 교수: 질환에 대한 인지도를 높이는 것이 무엇보다 중요하다. 폐고혈압은 증상이 매우 비특이적이어서 진단이 지연되는 경우가 많기 때문이다. 이 과정에서 언론의 역할도 중요하다. 폐고혈압을 의심할 수 있는 주요 증상 등의 정보를 국민에게 효과적으로 전달한다면 조기 진단과 치료에 큰 도움이 될 것이다. 전문가들이 이미 탄탄한 진료 네트워크를 구축하고 있는 만큼, 전문 의료기관들이 폐고혈압 전문 진료센터로서 중심 역할을 수행하길 바란다. 이를 통해 1차 의료기관에서 의심 환자를 조기에 발견하고 신속히 의뢰할 수 있는 효율적인 협진 체계가 마련될 수 있을 것이다. 의료진은 환자가 병원을 방문할 때마다 적절한 위험도 평가를 시행하고, 필요한 경우 치료를 단계적으로 강화하여 위험도를 낮추고 장기적인 사망률을 줄여야 한다. 정욱진 교수: 국내에서는 우선 약제 도입의 확대가 필요하다. 새로운 약제가 도입되고, 이를 가이드라인에 따라 적절히 사용하는 것이 치료 향상에 매우 중요하다. 그리고 폐고혈압 전문 센터 지정 운영이 필요하다. 소위 'Center of Excellence'라고 부르는 전문 센터의 지정 여부는 치료 성과에 큰 차이를 만든다. 따라서 정부 차원의 지원이 반드시 필요하다. 폐동맥고혈압뿐 아니라 다섯 개 군 전체를 아우르는 폐고혈압 전문센터가 마련되어야 한다는 점을 강조하고 싶다. '폐, 미리 캠페인'을 지속 진행하며 국민, 의료진, 정부의 폐고혈압 인식 개선을 위해 노력하고, 신약의 국내 도입을 위해 제약사 및 정부와의 논의를 지속할 계획이다. 국내 환자 맞춤형 치료 환경 구축을 위한 데이터 수집 및 연구 역시 진행 중에 있어, 폐동맥고혈압을 포함한 전체 폐고혈압 치료 환경 개선을 위한 활동도 꾸준히 전개할 예정이다.2025-12-22 06:00:45손형민 기자
"아뎀파스, PDE5i 반응 불충분 환자에 효과적 대안"[데일리팜=손형민 기자] "폐동맥고혈압의 궁극적인 치료 목표는 저위험군에 도달해 이를 유지하는 것이다. 그 목표에 미치지 못하거나 위험도가 충분히 낮아지지 않았다면 빠른 치료 전략 전환이 필수다." PDE5 억제제에 충분한 반응을 보이지 않는 폐동맥고혈압 환자에서 sGC 자극제 바이엘의 '아뎀파스(리오시구앗)'로의 전환이 현실적인 치료 전략으로 부상하고 있다. 국내에서도 최근 급여 기준이 신설되며, 단독요법 후 순차적 병용요법 중심이던 치료 흐름에 변화의 계기가 마련됐다는 평가가 나온다. 밸레리 맥러플린(Vallerie McLaughlin) 미국 미시간대학교 병원 심장내과 교수와 정욱진 가천대 길병원 심장내과 교수는 최근 데일리팜과 만난 자리에서 폐동맥고혈압 치료에서 아뎀파스의 임상적 활용 가능성을 강조했다. 폐동맥압이 비정상적으로 높아지는 폐고혈압은 원인에 따라 5개 군으로 나뉜다. 이 가운데 1군인 폐동맥고혈압(PAH)과 4군인 만성 혈전색전성 폐고혈압(CTEPH) 은 전체 폐고혈압 환자의 각각 약 3%에 불과한 희귀질환으로 분류된다. 호흡곤란, 피로, 어지럼증 등 비특이적 증상으로 시작되는 경우가 많아 환자가 이를 나이 탓으로 넘기거나, 1차 의료기관에서 다른 질환으로 오인되면서 진단이 지연되는 사례도 적지 않다. 폐동맥고혈압은 적절한 치료가 이뤄지지 않을 경우 2~3년 내 사망할 수 있는 중증 질환으로 알려져 있다. 국내에서는 의료진 인식 변화와 조기 발견 노력, 우심도관삽입술 시행 확대 등이 맞물리며 환자 수가 증가해 왔지만, 치료 환경은 글로벌 가이드라인과 일정 부분 괴리를 보인다는 지적도 나온다. 글로벌 가이드라인이 치료 초기부터 엔도텔린 수용체 차단제(ERA)와 PDE5 억제제(PDE5i) 병용요법을 권고하는 것과 달리, 국내에서는 여전히 단독요법으로 시작해 순차적으로 약제를 추가해나가는 치료 전략이 흔하게 적용되고 있기 때문이다. 폐동맥고혈압 치료제는 작용 기전에 따라 ▲엔도텔린 경로 표적치료제(ERA) ▲산화질소 경로 표적치료제(PDE5 억제제, sGC 자극제) ▲프로스타사이클린 유사체(PCA) ▲프로스타글라딘 수용체 작용제(PRA) 등으로 나뉜다. 글로벌 가이드라인에서는 초기부터 ERA와 PDE5 억제제 병용요법을 권고하고, 반응이 불충분할 경우 PCA나 PRA 등 다른 기전의 약제를 추가하는 방식으로 치료를 확장한다. 이는 여러 병태생리 경로를 동시에 표적해 치료 효과를 극대화하려는 전략이다. 반면 국내에서는 ERA 단독요법으로 치료를 시작한 뒤 반응이 부족할 경우 PDE5 억제제를 추가하고, 이후에도 개선이 없을 경우 PCA나 PRA를 병용하는 방식이 주로 적용돼 왔다. 그러나 연구에 따르면 ERA와 PDE5 억제제 병용에도 불구하고 일부 환자에서는 PDE5 억제제에 대한 반응 부족이나 내약성 문제로 임상적 악화가 발생하는 것으로 보고됐다. 이러한 상황에서 sGC 자극제인 '아뎀파스(리오시구앗)'는 PDE5 억제제를 대체할 수 있는 치료 옵션으로 주목받고 있다. 실제로 PDE5 억제제 치료에도 임상 반응이 불충분한 성인 증상성 폐동맥고혈압 환자를 대상으로 한 REPLACE 연구에서, PDE5 억제제를 아뎀파스로 전환한 환자군은 기존 PDE5 억제제 유지군 대비 24주 시점의 임상적 개선 도달률이 2.78배 높았고, 임상 악화 발생 위험은 90% 감소했다. 이러한 근거를 바탕으로 2022년 ESC/ERS (유럽심장학회/유럽호흡기학회) 폐고혈압 치료 가이드라인에서도 ERA와 PDE5 억제제 병용에도 치료 목표에 도달하지 못한 환자에서 PDE5 억제제를 sGC 자극제로 전환할 것을 권고하고 있다. 이에 따라 국내에서도 올해 6월부터 아뎀파스의 급여 기준이 신설됐다. WHO 기능분류 2~3단계의 폐동맥고혈압 환자(WHO Group 1) 가운데 ▲ERA 및/또는 PDE5 억제제에 반응이 충분하지 않거나 ▲ERA와 PDE5 억제제 모두에 금기인 경우 급여 투여가 인정된다. 이는 3제 병용요법으로 넘어가기 전, 환자 상태를 개선할 수 있는 새로운 치료 전략으로 활용될 수 있을 것으로 기대된다. 이 같은 변화 속에서 두 교수는 "폐고혈압은 의심이 출발점"이라며 "조기 진단의 중요성과 함께, 치료 목표를 저위험군에 도달·유지하는 데 두고 환자 반응에 따라 치료 전략을 유연하게 조정해야 한다"고 강조했다. Q. 폐동맥고혈압의 주요 증상 및 원인과 함께 폐동맥고혈압의 심각성에 대해 설명 부탁드린다. 밸레리 맥러플린 교수: 폐동맥고혈압은 운동이나 활동 시 호흡곤란이 두드러지게 나타난다. 환자마다 시점의 차이는 있지만 공통적으로 호흡곤란을 경험하게 된다. 실제로 많은 환자들이 호흡곤란을 주된 이유로 병원을 찾는다. 이외에도 피로감, 어지럼증, 흉통, 하지 부종 등이 발생한다. 이러한 증상은 비특이적이며, 다른 질환에서도 흔히 나타날 수 있어 진단이 지연되는 경우가 많다. 폐동맥고혈압은 희귀질환이다. 명확한 원인을 찾지 못하는 특발성인 경우도 있으나, 유전적 요인, 특정 약물 복용이나 식습관 등이 있으며, 결체조직(connective tissue) 질환, 간 질환, 심부전 등에 의해 발생하기도 한다. 정욱진 교수: 폐동맥고혈압의 대표적인 증상은 계단이나 언덕을 오를 때 나타나는 호흡곤란이다. 평지에서는 숨이 차지 않지만 계단이나 언덕을 조금만 올라가도 숨이 차는 양상이 두드러진다. 폐동맥고혈압 진단이 지연되는 이유는 피로감, 어지럼증, 흉통 등 증상이 비특이적이기 때문이다. 폐동맥고혈압은 다양한 치료제가 개발되며 치료를 통해 조절 가능한 질환이 되고 있지만, 여전히 예후가 좋지 않다는 특성이 있다. 따라서 전문 의료진의 신속한 진료를 통해 정확한 진단과 적절한 치료를 받는 것이 무엇보다 중요하다. Q. 미국과 한국의 폐동맥고혈압 치료 환경은 어떠한가? 밸레리 맥러플린 교수: 미국에서는 13종의 폐동맥고혈압 치료제가 이미 FDA 승인을 받아 사용이 가능하며, 실제로 많은 환자들이 엔도텔린 경로 표적치료제(ERA), 프로스타사이클린 경로 표적치료제(PCA, PRA), 일산화질소 경로 표적치료제(PDE5 억제제, sGC 자극제) 등 다앙한 계열의 약제를 사용하고 있다. 고위험군으로 분류될 경우 보다 집중적인 치료가 필요하다. 고위험군은 정맥투여 프로스타사이클린 경로 표적치료제를 투여하면서 엔도텔린 경로 표적치료제나 일산화질소 경로 표적치료제를 병행하는 3제 요법까지 고려할 수 있다. 중간 위험군이나 저위험군 환자들은 경구 제제를 기반으로 한 2제 요법을 시행하며, ERA나 일산화질소 경로 표적치료제인 PDE-5 억제제, sGC 자극제 등이 활용된다. 이러한 초기 치료는 첫 단계에 불과하다. 치료 시작 후 3~4개월이 지나면 객관적 평가 도구를 통해 환자의 위험도를 주기적으로 재평가해야 한다. 치료 목표에 도달했다면 기존 치료를 유지하면 되지만, 위험도가 충분히 낮아지지 않았다면 치료 강도를 높여야 한다. 3제 병용요법이나 기존에 사용하던 PDE-5 억제제를 sGC 자극제로 교체하는 전략을 고려할 수 있다. 이후에도 재평가 과정을 반복하며, 궁극적인 치료 목표는 환자를 저위험군에 도달하게 하고 그 상태를 지속적으로 유지하는 것이다. 정욱진 교수: 전 세계적으로는 1995년 에포프로스테놀이 출시되면서 폐동맥고혈압 치료제 개발이 본격화되었다. 국내에서는 2005년 바이엘의 벤타비스(일로프로스트)가 급여 적용 되면서 비로소 치료제를 제대로 사용할 수 있게 되었다. 과거에는 환자 상태가 악화되면 약제를 추가하는 방식으로 치료가 이루어졌다. 그러나 폐동맥고혈압은 완치가 어려운 질환이기 때문에 상태가 나빠진 후 치료 강도를 높이는 접근은 매우 위험하며 사망률을 낮추는 데도 충분하지 않다. 이에 최근의 치료 전략은 목표 지향적으로 초기부터 위험도를 낮춰 저위험군 상태로 도달하게 하고, 그 상태를 유지하는 것에 초점을 두는 가이드라인 기반 약물치료(GDMT) 원칙을 따른다. 환자를 저위험군으로 유도하는 동시에, 혈역학적 지표를 가능한 한 정상에 가까운 수준으로 조절하는 것도 중요한 치료 목표다. 최소 목표는 평균 폐동맥압 40 mmHg, 폐혈관저항 4 Wood units 이하를 유지하며 저위험군 상태를 지속하는 것이며, 일부 환자는 평균 폐동맥압 20 mmHg, 폐혈관저항 2 Wood units와 같이 정상에 가까운 수준까지 도달하기도 한다 주사 치료는 전체 환자의 약 10% 에서만 필요하며, 대다수 환자는 경구 약제만으로도 혈역학적 목표에 도달할 수 있다. Q. 임상 현장에서 느끼는 치료 상의 어려움이 있다면 말씀 부탁드린다. 정욱진 교수: 치료 과정에서의 어려움은 국내에 도입되지 않은 약제가 여전히 존재한다는 점이다. 전 세계적으로 13종의 약제가 사용되고 있으나, 그 중 4종은 국내에 도입되지 않았다. 도입된 약제 중에서도 일부는 보험급여가 적용되지 않아 접근성이 제한되고 있다. 국립암정보센터에 따르면 우리나라의 전체 암 5년 생존율(2018년~2022년)은 약 72.9%이며, 폐동맥고혈압의 5년 생존율은 71.9%로 나타났다. 폐동맥고혈압은 암보다 낮은 예후를 보이는 질환이라는 점에서 정부 지원이 필수적이다. 폐동맥고혈압 환자 중 일부만이 산정특례 대상자에 해당하며, 그마저도 특발성 폐동맥고혈압(IPAH)에 한정되어 있다. 폐동맥고혈압은 보험 지원 없이는 치료가 사실상 불가능한 고비용 질환이다. 따라서 특발성 폐동맥고혈압뿐만 아니라 다른 원인에 의해 발생하는 폐동맥고혈압에도 정확한 분류와 함께 특례 지원을 확대할 필요가 있다. 일반적으로 우리나라에서의 폐동맥고혈압 치료는 ERA를 먼저 사용하고, 반응이 충분하지 않을 경우 PDE-5 억제제를 추가하는 방식으로 진행된다. 그러나 PDE-5 억제제에 반응이 충분하지 않은 환자들을 위한 그 다음 대체제가 없었고, 국내에는 정맥투여 제제가 도입되지 않았기 때문에 피하주사 및 흡입 제형의 프로스타사이클린 경로 표적치료제를 사용하고 있었다. 이번에 급여권에 진입한 아뎀파스는 sGC 자극제로, 적은 용량으로도 강한 혈관 확장 효과를 나타내기 때문에 PDE-5 억제제에 반응하지 않는 환자까지 치료할 수 있는 강력한 옵션으로 평가된다. PDE-5 억제제 반응이 낮은 경우 바로 아뎀파스로 전환할 수 있으며, PDE-5 억제제 금기 상황에서도 사용가능하기 때문에, 임상적으로 매우 유용한 치료 옵션이 생겼다는 점에서 중요한 의미를 갖는다. Q. 미국에서는 아뎀파스가 이미 오랜기간 임상 현장에서 사용되고 있다. 임상적 가치를 평가한다면? 밸레리 맥러플린 교수: 아뎀파스는 미국에서 10년 전부터 폐동맥고혈압 치료제로 사용되어오면서 오랜 기간 충분한 임상 데이터를 확보했다. 아뎀파스는 체내 일산화질소 수준과 무관하게 cGMP 생성을 직접 촉진하는 약제다. PDE-5 억제제와 달리 일산화질소(NO)에 비의존적으로, NO라는 전구 물질이 없어도 혈관 확장 반응을 유도해 폐동맥고혈압 치료 효과를 낸다. 아뎀파스는 위약 대비 치료 효능 및 안전성을 확인한 PATENT 임상 연구에서 위약군 대비 6분 보행검사 등 운동 능력과 폐혈관 저항, NT-proBNP를 포함한 심혈관 지표에서 유의한 개선이 확인됐다. 또한 REPLACE 임상 연구에서는 기존에 ERA와 PDE-5 억제제를 병용하던 환자들을 두 그룹으로 나누어, 한 그룹은 기존 치료를 유지하고 다른 그룹은 PDE-5 억제제를 아뎀파스로 교체한 치료 효과를 비교했다. 연구 결과 아뎀파스로의 전환 투여 시의 임상적 개선 도달률이 PDE-5 억제제 유지 투여군보다 2.78배 유의하게 높게 나타났다. 치료제가 제한적으로 도입되어 있는 한국의 상황을 고려할 때, PDE-5 억제제에 충분한 반응을 보이지 않는다면 아뎀파스로 대체하는 방식이 효과적인 대안이 될 수 있다. Q. 아뎀파스의 CTEPH 치료 적응증에서의 활용 가치는 어떠한가? 정욱진 교수: 아뎀파스는 만성 혈전색전성 폐고혈압(CTEPH) 환자에게 사용할 수 있는 유일한 약제로, 이미 10년 전부터 전 세계적으로 사용되어 왔다. 그러나 국내에서는 급여가 적용되지 않아 환자의 접근성이 낮은 상황이다. CTEPH 환자 수는 폐동맥고혈압 환자와 거의 비슷한 수준으로 추정되지만, 수술이나 시술을 시행하는 등 실제로 치료를 받고 있는 환자는 약 300~400명 정도에 그치고 있다. 아뎀파스는 CTEPH 환자 중에서도 시술 후 폐동맥압이 잔존하거나, 수술 또는 시술이 불가능한 환자들에게 도움이 된다. 아뎀파스는 명확한 임상 근거가 있는 약제인만큼, KCD 코드를 신설하고 보험 급여를 통해 접근성을 보장할 필요가 있다. 학회에서도 국회, 심평원과 논의를 이어갈 예정이다. 밸레리 맥러플린 교수: 아뎀파스는 미국 FDA로부터 승인 받은 유일한 CTEPH 치료제로, 실제 임상 현장에서 10년 전부터 사용되고 있다. 아뎀파스는 CTEPH 환자 중 폐색 부위의 혈관이 지나치게 작아 폐동맥 내막절제술이나 풍선확장술과 같은 수술 또는 시술이 불가능하거나, 시술 후 폐동맥압이 잔존하는 환자에게 사용할 수 있는 약제이다. 폐동맥 내막절제술을 시행한 환자들 중에서도 수술 후 폐동맥압이 충분히 낮아지지 않고 높은 상태로 지속되는 경우가 있다. 압력이 과도하게 높게 유지되면 예후에 부정적인 영향을 미치기 때문에, 수술 후 6개월 시점에 우도관삽입술을 통해 폐동맥압을 다시 평가하고 있다. 영국 연구 결과에 따르면, 수술 후 평균 폐동맥압이 35mmHg 이하로 감소하지 않는 환자는 예후가 매우 불량한 것으로 알려져 있다. 이러한 환자들에게는 아뎀파스를 사용하여 폐동맥압을 낮추는 조치를 시행하고 있다. 이와 더불어 풍선확장술을 앞둔 환자가 아뎀파스를 먼저 투여하면 수술 위험도를 낮출 수 있다는 연구 결과도 있다. 이러한 근거를 바탕으로 다양한 유형의 CTEPH 환자들에게 아뎀파스를 적극적으로 활용하고 있으며, 임상 경험도 성공적이다. Q. 수술이나 시술이 불가한 CTEPH 환자에게는 어떤 치료 방법을 적용하고 있는지? 정욱진 교수: 일부 환자들은 비급여로 PDE-5 억제제를 사용하고 있으나, 이는 아뎀파스를 사용할 수 없기 때문에 발생하고 있는 치료 공백이라고 볼 수 있다. CTEPH에 대한 KCD 코드 신설과 보험 적용을 조속히 추진해야 하는 이유다. 밸레리 맥러플린 교수: ERA 계열 약물도 과거 CTEPH 환자를 대상으로 연구가 진행되었으나, 성공적이지 못했다. 아뎀파스만이 CTEPH에서 유의한 치료 효과를 입증했고, 다른 대체 약제가 없는 상황이기 때문에 그 필요성이 더욱 절실하다. Q. 폐고혈압 치료 환경 개선을 위한 제언이 있다면? 밸레리 맥러플린 교수: 질환에 대한 인지도를 높이는 것이 무엇보다 중요하다. 폐고혈압은 증상이 매우 비특이적이어서 진단이 지연되는 경우가 많기 때문이다. 이 과정에서 언론의 역할도 중요하다. 폐고혈압을 의심할 수 있는 주요 증상 등의 정보를 국민에게 효과적으로 전달한다면 조기 진단과 치료에 큰 도움이 될 것이다. 전문가들이 이미 탄탄한 진료 네트워크를 구축하고 있는 만큼, 전문 의료기관들이 폐고혈압 전문 진료센터로서 중심 역할을 수행하길 바란다. 이를 통해 1차 의료기관에서 의심 환자를 조기에 발견하고 신속히 의뢰할 수 있는 효율적인 협진 체계가 마련될 수 있을 것이다. 의료진은 환자가 병원을 방문할 때마다 적절한 위험도 평가를 시행하고, 필요한 경우 치료를 단계적으로 강화하여 위험도를 낮추고 장기적인 사망률을 줄여야 한다. 정욱진 교수: 국내에서는 우선 약제 도입의 확대가 필요하다. 새로운 약제가 도입되고, 이를 가이드라인에 따라 적절히 사용하는 것이 치료 향상에 매우 중요하다. 그리고 폐고혈압 전문 센터 지정 운영이 필요하다. 소위 'Center of Excellence'라고 부르는 전문 센터의 지정 여부는 치료 성과에 큰 차이를 만든다. 따라서 정부 차원의 지원이 반드시 필요하다. 폐동맥고혈압뿐 아니라 다섯 개 군 전체를 아우르는 폐고혈압 전문센터가 마련되어야 한다는 점을 강조하고 싶다. '폐, 미리 캠페인'을 지속 진행하며 국민, 의료진, 정부의 폐고혈압 인식 개선을 위해 노력하고, 신약의 국내 도입을 위해 제약사 및 정부와의 논의를 지속할 계획이다. 국내 환자 맞춤형 치료 환경 구축을 위한 데이터 수집 및 연구 역시 진행 중에 있어, 폐동맥고혈압을 포함한 전체 폐고혈압 치료 환경 개선을 위한 활동도 꾸준히 전개할 예정이다.2025-12-22 06:00:45손형민 기자 -
 위탁 제네릭 약가 최대 30% 깎인다...제약사들 '날벼락'지난 2012년 도입된 제네릭 약가산정 기준 53.55%가 14년 만에 사라진다. 정부는 제네릭 약가 최고가를 특허 전 오리지널 의약품의 40%대로 인하하는 방안을 공식화했다. 5년 전 장착한 최고가 요건 2건 모두 개편 약가제도에서 더욱 강력한 인하 장치로 작동한다. 제네릭 허가를 위한 생물학적동등성시험을 실시하지 않은 제네릭은 현행보다 최대 약가가 30% 가량 낮아질 전망이다. 기등재 의약품에 개편 약가제도를 적용하면서 약가 인하를 모면하기 위한 생동성시험을 수행하는 기현상이 또 다시 펼쳐질 것으로 예상된다. 제약업계는 제네릭 약가 인하에 따른 수익성 악화로 투자 재원 고갈에 따른 신약 개발 활동마저 위축될 수 있다는 우려를 내놓는다. 정부, 내년 7월부터 제네릭 상한가 기준 53.55%→40%대...제약사들 반발 1일 업계에 따르면 제약업계는 정부가 최근 발표한 약가제도 개편방안에서 제네릭 약가 인하가 막대한 손실을 초래할 것을 우려한다. 보건복지부가 지난달 28일 건강보험정책심의위원회에 보고한 약가제도 개선방안에는 제네릭과 특허만료 의약품의 약가산정률을 53.55%에서 40%대로 낮추는 방안이 담겼다. 지난 2012년부터 적용 중인 현행 약가제도에서 제네릭은 최초 등재시 특허만료 전 오리지널 의약품의 59.5%까지 약가를 받는 가산이 부여되고 1년 후에는 상한가가 53.55%로 내려간다. 특허만료 신약도 제네릭과 마찬가지로 특허만료 전의 53.55% 수준로 인하된다. 내년 7월 시행 예정인 개편 약가제도에서는 특허만료 의약품과 제네릭 모두 특허만료 신약의 53.55%에서 40%대로 내려간다. 최초 등재되는 제네릭이 1년 동안 59.5%로 일률적으로 부여받았던 가산이 폐지되고 R&D 투자 성과에 따라 가산율이 차등 적용된다. 가산율은 최초 등재 제네릭을 보유한 업체의 요건에 따라 55%에서 68%로 적용된다. 가산 기간은 현행 1년에서 3년 이상으로 확대된다. 제네릭의 약가 가산 기간 동안 오리지널 의약품의 가격은 특허 만료 전 70%로 종전과 동일하다. 이에 따라 지난 2012년 제네릭 약가제도에서 처음 선보인 ‘53.55%’가 14년 만에 사라질 예정이다. 2012년 약가제도 개편으로 제네릭 의약품의 산정 기준은 신약 특허만료 전 가격 68%에서 59.5%를 거쳐 53.55%로 설정되는 구조가 설정됐다. 새로운 제네릭 약가산정 기준은 40%에서 45% 미만으로 설정될 가능성이 크다. 복지부는 개편 약가제도를 보고하면서 기등재 의약품의 약가 조정 일정 방안을 제시했는데 현재 제네릭 약가가 45~50% 수준에서 설정된 제품은 2027년 약가 조정에 착수하고 2029년 40%대로 인하하겠다고 공표했다. 현재 제네릭 약가가 45%인 제품도 약가 조정 대상으로 분류된 것은 제네릭 약가기준이 45%를 초과할 수 없다는 얘기가 된다. 정부가 새로운 제네릭 산정기준을 40%대로 못 박으면서 개편 약가제도에서 나올수 있는 가장 낮은 약가는 40%다. 복지부는 “높은 제네릭 약가로 국내 기업의 복제약 의존도가 높다”라면서 “R&D 활성화를 통한 선순환 혁신 생태계조성을 위해서는 가치에 대한 적정 보상이 균형을 이루는 약가제도로 개편이 시급하다”라고 설명했다. 제네릭 약가기준 45% 설정시 인하율 최소 16%...40% 설정시 최대 33.8% 인하 제네릭 약가기준이 53.55%에서 45%로 설정되면 산술적으로 제네릭 최고가격이 16.0% 인하되는 것으로 계산된다. 개편 기준이 40%로 결정되면 53.55원이 40원으로 내려가기 때문에 종전 보다 제네릭 최고가는 인하율은 25.3%로 커진다. 제네릭 1개 제품의 수익률이 20% 이상 내려간다는 점에서 제약사들이 체감하는 손실은 매우 클 수 밖에 없다. 정부가 개편 약가제도에서 2020년부터 적용한 최고가 충족 요건을 유지하면서 미충족 요건에 따른 인하율이 더욱 확대된다. 최고가 요건을 충족하지 못하는 제네릭의 약가는 더욱 떨어진다는 의미다. 난 2020년 7월부터 개편 약가제도에 따라 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다. 한 가지 요건이 충족되지 않을 때마다 상한가는 15%씩 내려간다. 2개 요건 모두 충족하지 못하면 27.75% 인하되는 구조다. 15% 인하율을 적용하면 제네릭 최고가 산정 기준 53.55%가 1개 요건 미충족시 45.52%, 2개 요건 미충족시 38.69%로 내려가는 구조다. 개편 약가제도에서 최고가 요건 미충족시 적용되는 인하율은 15%에서 20%로 확대된다. 제네릭 산정 기준이 45%로 결정될 경우 최고가 요건 1개 미충족 제네릭은 36%, 2개 미충족 제네릭은 28.8%로 낮아진다. 제네릭 산정 기준이 40%로 설정되면 기준요건 미충족 1개 제네릭은 32.0%, 2개 모두 미충족한 제네릭은 25.9%로 산정기준이 더욱 내려간다. 이때 최고가 요건 1개 미충족 제네릭의 약가는 현행보다 20.9% 인하되고 2개 미충족의 인하율은 25.6%다. 제네릭 최고가 요건 중 등록 원료 의약품 기준은 대부분 충족한다. 다만 생동성시험 수행 여부에 따라 약가가 차등 부여되는 경우가 많다. 개편 제네릭 산정 기준이 40%로 설정됐을 때 생동성시험을 수행하지 않고 다른 업체에 위탁 제조를 맡긴 제네릭은 산정 기준이 특허 만료 전 신약의 32.0%를 넘을 수 있다. 현행 54.52%와 비교하면 29.7% 내려가는 것으로 계산된다. 이때 지난 2020년 최고가 요건 도입 이전과 비교하면 제네릭 약가는 40% 이상(53.55%→32.00%) 깎이는 셈이 된다. 최고가 요건 2건 미충족 제네릭의 상한가 기준은 25.6%로 현행 38.69%보다 33.8% 인하된다. 제네릭 의존도 높은 중소제약사 직격탄...계단형 확대 적용도 손실↑ 업계에서는 혁신형제약기업이 포함되지 않거나 R&D 성과가 부진해 약가 가산을 받지 못하는 제약사들은 타격이 클 수 밖에 없는 실정이다. 제네릭 의존도가 높은 중소제약사들은 치명적인 손실이 불가피할 전망이다. 올해 3분기 누적 기준 매출 상위 40곳의 급여의약품 중심 전통제약사의 평균 영업이익률은 6.3%로 집계됐다. 5년 전 6.6%와 비교하면 0.3%포인트 하락했다. 제네릭의 약가 30% 인하는 해당 제품의 수익성 30% 하락을 의미한다. 정부의 R&D 투자 확대 유도라는 명분과는 달리 제네릭 약가인하로 R&D 투자 위축과 인력 감축으로 이어질 수 있다는 위기감이 벌써부터 나오는 배경이다. 제약사 한 관계자는 “반복되는 약가인하로 영업이익률이 급감하는 상황에서 캐시카우 역할을 하는 제네릭 약가가 크게 낮아지면 R&D 투자는 더욱 위축될 수 밖에 없다”라면서 “이미 많은 기업들이 비용 절감을 목표로 영업대행업체(CSO)를 활용하는 상황에서 인력 감축 움직임은 더욱 확산하게 될 것이다”라고 우려했다. 복지부는 개편 약가제도에도 5년 전 도입한 최고가 요건의 확대 적용을 공식화했다. 이에 따라 제약사들 기등재 제네릭의 약가 유지를 위해 생동성시험을 수행하면서 펼쳐지는 사회적 비용 낭비가 또 다시 반복될 것이라는 우려도 제기된다. 5년 전 제네릭 약가제도가 전면 개편되면서 2023년 9월과 지난해 3월 두 차례에 걸쳐 제네릭 8000여개 품목의 약가가 인하됐다. 2023년 9월 5일부터 제네릭 7355개 품목의 약가가 최대 28.6% 인하됐다. 지난 2020년부터 추진한 제네릭 약가재평가의 1차 결과다. 지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 올해 2월말까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다. 제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 제약사들은 약가인하를 회피하기 위해 기허가 제네릭 제품에 대해서도 생동성시험에 착수하는 기현상이 펼쳐졌다. 제제 연구를 통해 제네릭을 만들어 생동성시험을 진행하고 동등 결과를 얻어내면 변경 허가를 통해 약가인하를 회피하는 전략이다. 이때 위탁제조를 자사 제조로 전환하면서 허가변경을 통해 ‘생동성시험 실시’ 요건을 충족하고 약가인하를 모면하는 방식이다. 지난 2018년 생동성시험 승인 건수는 178건을 기록했는데 2020년 323건으로 2년 만에 81.4% 증가했고 2021년에는 505건으로 3년 전보다 3배 가량 확대됐다. 제네릭 허가와 무관한 약가유지용 생동성시험이 크게 늘었고 사회적 비용 낭비를 초래했다는 비판이 쏟아졌다. 개편 약가제도에서 생동성시험 미수행 제네릭의 약가가 더욱 낮아지기 때문에 제약사들의 약가 유지를 위한 생동성시험 수행 움직임은 더욱 확산할 것으로 예상된다. 계단형 약가 인하가 더욱 강화된다는 점도 제약사들의 부담 요소로 지목된다. 복지부는 개편 약가제도에서 동일 제제 11번째 품목 등재시부터 퍼스트 제네릭이 산정된 약가에서 5%포인트씩 감액한 약가를 부여하겠다는 방침을 제시했다. 2020년 도입된 계단형 약가제도에 따라 기등재 동일제품이 20개가 넘을 경우 후발주자로 진입하는 제네릭은 약가가 15% 낮아진다. 개편 약가제도에서는 21번째보다 더욱 줄어든 11번째부터 계단형 약가제도가 적용되기 때문에 제네릭 제품들이 더 빨리 계단형 약가제도에 노출되는 구조다. 제네릭 개발 순위가 가장 빨라도 약가 산정기준이 종전보다 크게 내려가는데 계단형 약가제도가 일찍 적용됨에 따라 제네릭 후발주자의 약가는 큰 폭으로 떨어질 수 밖에 없다. 정부는 최초 제네릭이 진입할 때 10개 이상 제품이 등재되면 계단형 약가인하 준하는 상정 기준을 적용하겠다는 방침을 제시했다. 제약사 11곳 이상이 퍼스트제네릭을 동시에 등재하면 1년 뒤 11번째 품목 약가로 일괄 산정되는 구조다. 기존에는 11개의 퍼스트제네릭이 53.55%의 최고가를 받았지만 산정기준이 40%로 낮아질 경우 11개의 퍼스트제네릭은 등재 1년 만에 35% 수준으로 폭락하게 된다. 제약사 한 관계자는 “계단형약가제도의 강화 적용으로 퍼스트제네릭을 개발했더라도 계단형 적용으로 약가가 크게 내려가는 상황이 속출할 수 있다”라면서 “약가기준도 내려가면서 계단형 적용 시기가 촉진되면 제네릭 약가인하에 따른 손실은 기하급수로 커질 수 밖에 없다”라고 토로했다. 주요 제약단체들도 정부의 약가 개편에 적극 저항하겠다는 움직임을 보이고 있다. 한국제약바이오협회는 최근 한국바이오의약품협회, 한국의약품수출입협회, 한국신약개발연구조합, 한국제약협동조합 등과 약가제도 개편 관련 국내 제약바이오산업계 차원의 공동 대응을 위한 ‘산업 발전을 위한 약가제도 개편 비상대책위원회(비대위) 구성을 결의했다. 비대위원회는 ▲기획정책위원회 ▲대외협력위원회 ▲국민소통위원회 등 3 개 분과를 중심으로 신속 대응 체계를 가동키로 했다. 비대위는 지난 30일 “약가 산정기준을 개선안대로 대폭 낮출 경우 기업의 R&D 투자와 고용을 위한 핵심 재원이 줄어들어 신약개발 지연, 설비 투자 축소, 글로벌 경쟁력 후퇴로 이어질 수 있다”라면서 “제약바이오 강국 도약의 골든타임인 지금 이 시점에서 추가적인 약가인하는 기업의 연구개발 및 인프라 투자, 우수 인력 확보 등 산업 경쟁력을 심각하게 약화시킬 것이다”라고 비판했다.2025-12-01 06:06:25천승현 기자
위탁 제네릭 약가 최대 30% 깎인다...제약사들 '날벼락'지난 2012년 도입된 제네릭 약가산정 기준 53.55%가 14년 만에 사라진다. 정부는 제네릭 약가 최고가를 특허 전 오리지널 의약품의 40%대로 인하하는 방안을 공식화했다. 5년 전 장착한 최고가 요건 2건 모두 개편 약가제도에서 더욱 강력한 인하 장치로 작동한다. 제네릭 허가를 위한 생물학적동등성시험을 실시하지 않은 제네릭은 현행보다 최대 약가가 30% 가량 낮아질 전망이다. 기등재 의약품에 개편 약가제도를 적용하면서 약가 인하를 모면하기 위한 생동성시험을 수행하는 기현상이 또 다시 펼쳐질 것으로 예상된다. 제약업계는 제네릭 약가 인하에 따른 수익성 악화로 투자 재원 고갈에 따른 신약 개발 활동마저 위축될 수 있다는 우려를 내놓는다. 정부, 내년 7월부터 제네릭 상한가 기준 53.55%→40%대...제약사들 반발 1일 업계에 따르면 제약업계는 정부가 최근 발표한 약가제도 개편방안에서 제네릭 약가 인하가 막대한 손실을 초래할 것을 우려한다. 보건복지부가 지난달 28일 건강보험정책심의위원회에 보고한 약가제도 개선방안에는 제네릭과 특허만료 의약품의 약가산정률을 53.55%에서 40%대로 낮추는 방안이 담겼다. 지난 2012년부터 적용 중인 현행 약가제도에서 제네릭은 최초 등재시 특허만료 전 오리지널 의약품의 59.5%까지 약가를 받는 가산이 부여되고 1년 후에는 상한가가 53.55%로 내려간다. 특허만료 신약도 제네릭과 마찬가지로 특허만료 전의 53.55% 수준로 인하된다. 내년 7월 시행 예정인 개편 약가제도에서는 특허만료 의약품과 제네릭 모두 특허만료 신약의 53.55%에서 40%대로 내려간다. 최초 등재되는 제네릭이 1년 동안 59.5%로 일률적으로 부여받았던 가산이 폐지되고 R&D 투자 성과에 따라 가산율이 차등 적용된다. 가산율은 최초 등재 제네릭을 보유한 업체의 요건에 따라 55%에서 68%로 적용된다. 가산 기간은 현행 1년에서 3년 이상으로 확대된다. 제네릭의 약가 가산 기간 동안 오리지널 의약품의 가격은 특허 만료 전 70%로 종전과 동일하다. 이에 따라 지난 2012년 제네릭 약가제도에서 처음 선보인 ‘53.55%’가 14년 만에 사라질 예정이다. 2012년 약가제도 개편으로 제네릭 의약품의 산정 기준은 신약 특허만료 전 가격 68%에서 59.5%를 거쳐 53.55%로 설정되는 구조가 설정됐다. 새로운 제네릭 약가산정 기준은 40%에서 45% 미만으로 설정될 가능성이 크다. 복지부는 개편 약가제도를 보고하면서 기등재 의약품의 약가 조정 일정 방안을 제시했는데 현재 제네릭 약가가 45~50% 수준에서 설정된 제품은 2027년 약가 조정에 착수하고 2029년 40%대로 인하하겠다고 공표했다. 현재 제네릭 약가가 45%인 제품도 약가 조정 대상으로 분류된 것은 제네릭 약가기준이 45%를 초과할 수 없다는 얘기가 된다. 정부가 새로운 제네릭 산정기준을 40%대로 못 박으면서 개편 약가제도에서 나올수 있는 가장 낮은 약가는 40%다. 복지부는 “높은 제네릭 약가로 국내 기업의 복제약 의존도가 높다”라면서 “R&D 활성화를 통한 선순환 혁신 생태계조성을 위해서는 가치에 대한 적정 보상이 균형을 이루는 약가제도로 개편이 시급하다”라고 설명했다. 제네릭 약가기준 45% 설정시 인하율 최소 16%...40% 설정시 최대 33.8% 인하 제네릭 약가기준이 53.55%에서 45%로 설정되면 산술적으로 제네릭 최고가격이 16.0% 인하되는 것으로 계산된다. 개편 기준이 40%로 결정되면 53.55원이 40원으로 내려가기 때문에 종전 보다 제네릭 최고가는 인하율은 25.3%로 커진다. 제네릭 1개 제품의 수익률이 20% 이상 내려간다는 점에서 제약사들이 체감하는 손실은 매우 클 수 밖에 없다. 정부가 개편 약가제도에서 2020년부터 적용한 최고가 충족 요건을 유지하면서 미충족 요건에 따른 인하율이 더욱 확대된다. 최고가 요건을 충족하지 못하는 제네릭의 약가는 더욱 떨어진다는 의미다. 난 2020년 7월부터 개편 약가제도에 따라 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다. 한 가지 요건이 충족되지 않을 때마다 상한가는 15%씩 내려간다. 2개 요건 모두 충족하지 못하면 27.75% 인하되는 구조다. 15% 인하율을 적용하면 제네릭 최고가 산정 기준 53.55%가 1개 요건 미충족시 45.52%, 2개 요건 미충족시 38.69%로 내려가는 구조다. 개편 약가제도에서 최고가 요건 미충족시 적용되는 인하율은 15%에서 20%로 확대된다. 제네릭 산정 기준이 45%로 결정될 경우 최고가 요건 1개 미충족 제네릭은 36%, 2개 미충족 제네릭은 28.8%로 낮아진다. 제네릭 산정 기준이 40%로 설정되면 기준요건 미충족 1개 제네릭은 32.0%, 2개 모두 미충족한 제네릭은 25.9%로 산정기준이 더욱 내려간다. 이때 최고가 요건 1개 미충족 제네릭의 약가는 현행보다 20.9% 인하되고 2개 미충족의 인하율은 25.6%다. 제네릭 최고가 요건 중 등록 원료 의약품 기준은 대부분 충족한다. 다만 생동성시험 수행 여부에 따라 약가가 차등 부여되는 경우가 많다. 개편 제네릭 산정 기준이 40%로 설정됐을 때 생동성시험을 수행하지 않고 다른 업체에 위탁 제조를 맡긴 제네릭은 산정 기준이 특허 만료 전 신약의 32.0%를 넘을 수 있다. 현행 54.52%와 비교하면 29.7% 내려가는 것으로 계산된다. 이때 지난 2020년 최고가 요건 도입 이전과 비교하면 제네릭 약가는 40% 이상(53.55%→32.00%) 깎이는 셈이 된다. 최고가 요건 2건 미충족 제네릭의 상한가 기준은 25.6%로 현행 38.69%보다 33.8% 인하된다. 제네릭 의존도 높은 중소제약사 직격탄...계단형 확대 적용도 손실↑ 업계에서는 혁신형제약기업이 포함되지 않거나 R&D 성과가 부진해 약가 가산을 받지 못하는 제약사들은 타격이 클 수 밖에 없는 실정이다. 제네릭 의존도가 높은 중소제약사들은 치명적인 손실이 불가피할 전망이다. 올해 3분기 누적 기준 매출 상위 40곳의 급여의약품 중심 전통제약사의 평균 영업이익률은 6.3%로 집계됐다. 5년 전 6.6%와 비교하면 0.3%포인트 하락했다. 제네릭의 약가 30% 인하는 해당 제품의 수익성 30% 하락을 의미한다. 정부의 R&D 투자 확대 유도라는 명분과는 달리 제네릭 약가인하로 R&D 투자 위축과 인력 감축으로 이어질 수 있다는 위기감이 벌써부터 나오는 배경이다. 제약사 한 관계자는 “반복되는 약가인하로 영업이익률이 급감하는 상황에서 캐시카우 역할을 하는 제네릭 약가가 크게 낮아지면 R&D 투자는 더욱 위축될 수 밖에 없다”라면서 “이미 많은 기업들이 비용 절감을 목표로 영업대행업체(CSO)를 활용하는 상황에서 인력 감축 움직임은 더욱 확산하게 될 것이다”라고 우려했다. 복지부는 개편 약가제도에도 5년 전 도입한 최고가 요건의 확대 적용을 공식화했다. 이에 따라 제약사들 기등재 제네릭의 약가 유지를 위해 생동성시험을 수행하면서 펼쳐지는 사회적 비용 낭비가 또 다시 반복될 것이라는 우려도 제기된다. 5년 전 제네릭 약가제도가 전면 개편되면서 2023년 9월과 지난해 3월 두 차례에 걸쳐 제네릭 8000여개 품목의 약가가 인하됐다. 2023년 9월 5일부터 제네릭 7355개 품목의 약가가 최대 28.6% 인하됐다. 지난 2020년부터 추진한 제네릭 약가재평가의 1차 결과다. 지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 올해 2월말까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다. 제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 제약사들은 약가인하를 회피하기 위해 기허가 제네릭 제품에 대해서도 생동성시험에 착수하는 기현상이 펼쳐졌다. 제제 연구를 통해 제네릭을 만들어 생동성시험을 진행하고 동등 결과를 얻어내면 변경 허가를 통해 약가인하를 회피하는 전략이다. 이때 위탁제조를 자사 제조로 전환하면서 허가변경을 통해 ‘생동성시험 실시’ 요건을 충족하고 약가인하를 모면하는 방식이다. 지난 2018년 생동성시험 승인 건수는 178건을 기록했는데 2020년 323건으로 2년 만에 81.4% 증가했고 2021년에는 505건으로 3년 전보다 3배 가량 확대됐다. 제네릭 허가와 무관한 약가유지용 생동성시험이 크게 늘었고 사회적 비용 낭비를 초래했다는 비판이 쏟아졌다. 개편 약가제도에서 생동성시험 미수행 제네릭의 약가가 더욱 낮아지기 때문에 제약사들의 약가 유지를 위한 생동성시험 수행 움직임은 더욱 확산할 것으로 예상된다. 계단형 약가 인하가 더욱 강화된다는 점도 제약사들의 부담 요소로 지목된다. 복지부는 개편 약가제도에서 동일 제제 11번째 품목 등재시부터 퍼스트 제네릭이 산정된 약가에서 5%포인트씩 감액한 약가를 부여하겠다는 방침을 제시했다. 2020년 도입된 계단형 약가제도에 따라 기등재 동일제품이 20개가 넘을 경우 후발주자로 진입하는 제네릭은 약가가 15% 낮아진다. 개편 약가제도에서는 21번째보다 더욱 줄어든 11번째부터 계단형 약가제도가 적용되기 때문에 제네릭 제품들이 더 빨리 계단형 약가제도에 노출되는 구조다. 제네릭 개발 순위가 가장 빨라도 약가 산정기준이 종전보다 크게 내려가는데 계단형 약가제도가 일찍 적용됨에 따라 제네릭 후발주자의 약가는 큰 폭으로 떨어질 수 밖에 없다. 정부는 최초 제네릭이 진입할 때 10개 이상 제품이 등재되면 계단형 약가인하 준하는 상정 기준을 적용하겠다는 방침을 제시했다. 제약사 11곳 이상이 퍼스트제네릭을 동시에 등재하면 1년 뒤 11번째 품목 약가로 일괄 산정되는 구조다. 기존에는 11개의 퍼스트제네릭이 53.55%의 최고가를 받았지만 산정기준이 40%로 낮아질 경우 11개의 퍼스트제네릭은 등재 1년 만에 35% 수준으로 폭락하게 된다. 제약사 한 관계자는 “계단형약가제도의 강화 적용으로 퍼스트제네릭을 개발했더라도 계단형 적용으로 약가가 크게 내려가는 상황이 속출할 수 있다”라면서 “약가기준도 내려가면서 계단형 적용 시기가 촉진되면 제네릭 약가인하에 따른 손실은 기하급수로 커질 수 밖에 없다”라고 토로했다. 주요 제약단체들도 정부의 약가 개편에 적극 저항하겠다는 움직임을 보이고 있다. 한국제약바이오협회는 최근 한국바이오의약품협회, 한국의약품수출입협회, 한국신약개발연구조합, 한국제약협동조합 등과 약가제도 개편 관련 국내 제약바이오산업계 차원의 공동 대응을 위한 ‘산업 발전을 위한 약가제도 개편 비상대책위원회(비대위) 구성을 결의했다. 비대위원회는 ▲기획정책위원회 ▲대외협력위원회 ▲국민소통위원회 등 3 개 분과를 중심으로 신속 대응 체계를 가동키로 했다. 비대위는 지난 30일 “약가 산정기준을 개선안대로 대폭 낮출 경우 기업의 R&D 투자와 고용을 위한 핵심 재원이 줄어들어 신약개발 지연, 설비 투자 축소, 글로벌 경쟁력 후퇴로 이어질 수 있다”라면서 “제약바이오 강국 도약의 골든타임인 지금 이 시점에서 추가적인 약가인하는 기업의 연구개발 및 인프라 투자, 우수 인력 확보 등 산업 경쟁력을 심각하게 약화시킬 것이다”라고 비판했다.2025-12-01 06:06:25천승현 기자 -
 2년 전 8천개 인하했는데...제약산업 발목잡는 약가 정책[데일리팜=천승현 기자] 제약사들은 정부의 반복된 약가인하 기조 정책이 산업 생태계를 위협하는 가장 큰 요인이라고 지적한다. 제약사들은 5년 전 약가제도 전면 개편으로 수천개 의약품의 약가가 인하되면서 적잖은 손실을 감수했다. 뇌기능개선제 ‘콜린알포세레이트’ 임상재평가에 실패하면 기존 판매 금액도 환수한다는 압박에 많게는 수백억원 규모의 보이지 않는 부채를 떠안은 실정이다. 정부의 급여재평가로 주력 캐시카우가 속속 퇴출되면서 지속적으로 예상치 못한 손실을 감수하는 현실이다. 최근에는 고환율로 원가 부담마저 커지면서 원가 압박이 커지는 상황에서 제네릭 약가가 또 다시 내려가면 기업 생존마저 위협받는다는 볼멘소리가 나온다. 2020년 약가제도 개편 이후 8천여개 약가인하..."정부 정책, 지속적 손실 야기" 제약사들이 정부의 약가제도 개편 움직임에 강한 저항을 갖는다. 정부 정책이 약가인하와 급여 삭제를 집중적으로 겨냥하면서 지속적으로 제약사들의 손실을 가중시킨다는 이유에서다. 5년 전 제네릭 약가제도가 전면 개편되면서 2023년 9월과 지난해 3월 두 차례에 걸쳐 제네릭 8000여개 품목의 약가가 인하됐다. 2023년 9월 5일부터 제네릭 7355개 품목의 약가가 최대 28.6% 인하됐다. 지난 2020년부터 추진한 제네릭 약가재평가의 1차 결과다. 지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 올해 2월말까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다. 제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 개편 약가제도에서 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다. 한 가지 요건이 충족되지 않을 때마다 상한가는 15%씩 내려간다. 2개 요건 모두 충족하지 못하면 27.75% 인하되는 구조다. 당시 일부 제품은 기준 요건 2가지 미충족에 사용량 약가연동제에 따른 약가인하가 중복되면서 인하율이 27.75%를 초과했다. 이때 총 179개 업체가 약가인하로 손실이 불가피했다. 한국휴텍스제약이 154개 품목이 약가인하 대상에 포함됐다. 하나제약과 대웅바이오가 각각 122개, 104개 품목이 약가가 내려갔고 일화는 101개 품목의 상한가가 인하됐다. 마더스제약, 셀트리온제약, 삼성제약, 한국글로벌제약, 이연제약, 메디카코리아, 보령바이오파마, 대한뉴팜, 동국제약, 아주약품, 건일바이오팜, 제일약품, 한국유니온제약, 동구바이오제약 등이 약가인하 제품이 80개가 넘었다. 지난해 3월에는 제네릭 약가재평가의 두 번째 결과로 의약품 948개 품목의 약가가 최대 27.9% 떨어졌다. 제네릭 약가재평가 대상 중 주사제와 같은 무균제제 등 동등성시험 대상으로 새롭게 편입된 의약품에 대해 작년 3월 추가로 약가인하가 시행됐다. 제네릭 약가재평가 2차 결과 제약사 156개 업체가 약가인하 의약품을 보유했다. 삼천당제약과 이연제약이 각각 23개 품목으로 가장 많았다. 국제약품과 신풍제약은 각각 21개 품목이 약가인하 대상에 포함됐다. 한국휴텍스제약은 19개 품목의 약가가 인하됐고 유니메드제약은 16개 품목이 인하 대상으로 분류됐다. 2020년 7월 개편 약가인하가 시행됐고 기등재 의약품에도 새 약가제도로 적용하면서 4년 만에 총 8303개 품목의 약가가 떨어진 셈이다. 업계 한 관계자는 “약가제도 개편으로 불과 2년 전에 수천개 품목의 약가가 인하됐는데 또 다시 제도를 개편하는 이유를 납득할 수 없다"라고 비판했다. 4년간 급여재평가로 6개 성분 퇴출...제약사들, 캐시카우 상실로 실적 타격 제약사들은 정부의 재평가 정책으로 지속적으로 수익성 하락 변수가 발생했다. 지난 2021년부터 4년 동안 진행한 급여 적정성 평가 결과 총 6개 품목이 건강보험 급여가 취소되면서 제약사들의 손실이 현실화했다. 보건당국은 지난 2021년 급여재평가 결과 실리마린과 빌베리건조엑스는 급여적정성이 없는 것으로 결론 나면서 건강보험 급여 삭제가 결정됐다. 실리마린은 독성간질환, 간세포보호, 만성간염, 간경변 등에 사용되는 일반의약품이다. 빌베리건조엑스는 당뇨병에 의한 망막변성 및 눈의 혈관장애 개선에 사용되는 약물이다. 지난 2020년 기준 실리마린과 빌베리건조엑스는 각각 275억원, 287억원 규모의 외래 처방시장을 형성했다. 지난 2022년부터 급여재평가 결과 스트렙토키나제·스트렙토도르나제(스트렙토제제), 옥시라세탐, 아세틸엘카르니틴 등의 성분에 대해 전 품목 급여 삭제가 결정됐다. 이중 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 식약처의 임상재평가를 통과하지 못하면서 처방 시장이 소멸했다. 지난 2020년 기준 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 총 732억원의 처방시장을 형성했다. 지난해 급여재평가 결과 급여 삭제가 결정된 이토프리드도 처방 시장이 사라졌다. 이토프리드는 복부팽만, 상복부통, 식욕부진, 속쓰림, 구역, 구토 등 기능성소화불량으로 인한 소화기증상에 사용되는 의약품이다. 이토프리드는 지난해 221억원의 처방시장을 나타냈다. 매 분기 50억원대 처방시장을 형성했는데 올해 2월부터 소멸했다. 제약사들은 록소프로펜의 급여 축소로 인한 손실도 감수한 상황이다. 록소프로펜은 ▲만성 류마티스관절염, 골관절염(퇴행관절염), 요통, 견관절주위염, 경견완증후군 등의 소염·진통 ▲수술 후, 외상 후 및 발치 후의 소염·진통 ▲급성 상기도염의 해열·진통 등에 사용되는 약물이다. 급성 상기도염의 해열·진통’ 적응증에 대해 급여 적정성이 없다고 결론 내리고 지난해부터 급여가 삭제됐다. 록소프로펜은 지난 2021년 724억원의 처방시장을 형성했는데 2022년 1035억원으로 43.0% 치솟았고 2023년에는 1135억원으로 확대됐다. 지난해 록소프로펜 성분 외래 처방시장 규모는 총 833억원으로 전년대비 26.7% 감소하며 급여 축소 직격탄을 맞았다. 록소프로펜은 2023년 4분기 307억원의 처방액을 기록했는데 올해 들어 1분기 208억원, 2분기와 3분기에는 202억원, 204억원으로 쪼그라들었다. 콜린알포 환수 대비 부채 인식...“정부 정책에 실적 손실 현실화” 제약사들은 뇌기능개선제 ‘콜린알포세레이트’(콜린제제)의 임상재평가가 끝나지 않았는데도 이미 임상 실패를 가정한 부채를 인식한 상황이다. 정부 정책으로 가상 부채를 회계에 반영하는 이례적인 현상이다. 금융감독원에 따르면 종근당, 대웅바이오, 한미약품, 알리코제약, 동구바이오제약, 국제약품, 동광약품, 경동제약, 제뉴파마, 동국제약, 환인제약 등이 콜린제제 임상실패를 대비한 환수 금액 추정치를 미리 부채 항목 등에 반영한 것으로 나타났다. 콜린제제의 임상시험 실패시 발생할 수 있는 최악의 시나리오를 대비해 사전 대책 마련 움직임이다. 수익의 일부를 부채로 인식하면서 추후 일시적으로 발생할 수 있는 거액의 환수에 따른 피해를 최소화하겠다는 의도다. 일부 실적 공백을 감수하면서 임상 실패를 대비한 막대한 손실을 분산시키겠다는 고육책이다. 콜린제제는 효능 논란이 불거지자 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사들은 재평가 임상시험에 착수했다. 지난 2020년 복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 만약 제약사들의 콜린제제 재평가 임상시험이 실패로 결론나면 보건당국에 임상시험 기간 동안 올린 처방액 20%를 되돌려줘야 하는 상황이다. 종근당은 지난 3분기 말 기준 비유동부채 항목에 환불부채 520억원을 인식했다. 회사 측은 “콜린알포세레이트제제의 유효성 입증을 위한 임상재평가 실패시 건강보험공단에 납부할 추정금액을 환불부채로 인식했다”라고 설명했다. 콜린제제 판매로 발생한 수익의 일부를 추후 환불할 것으로 예상되는 부채로 미리 인식했다는 의미다. 대웅바이오는 콜린제제 임상재평가 실패시 납부할 금액 추정치를 장기선수금으로 인식한다. 선수금은 상품이나 서비스를 제공하기 전에 미리 받은 금액 부채에 해당한다. 지난해 말 대웅바이오의 기타비유동부채 중 장기선수금은 666억원에 달했다. 동구바이오제약은 비유동부채 중 기타 비유동부채 항목에 콜린제제 환수액을 사전에 인식했다. 3분기 말 동구바이오제약의 기타 비유동부채는 139억원으로 설정됐다. 동구바이오제약은 “국민건강보험공단과의 '콜린알포세레이트'의 처방액의 일부 환수조건에 합의했으며 납부할 추정금액이 포함돼 있다. 임상재평가 결과에 따라 환수금액은 변동될 수 있다”라고 제시했다. 알리코제약은 비유동부채 중 장기 환불부채에 콜린제제 환수금액 추정치를 선반영하고 있다. 알리코제약은 지난 9월 말 기준 비유동부채 장기환불부채 113억원을 인식했다. 한미약품은 지난 상반기 말 기준 비유동부채 항목 중 계약부채 및 환불부채 35억원을 인식했다. 한미약품은 “콜리네이트연질캡슐 임상재평가 실패 시 국민건강보험공단으로 납부해야 할 금액 추정치에 해당한다”고 설명했다. 국제약품은 비유동충당부채에 콜린제제 환수금액을 미리 반영했다. 국제약품은 “콜린알포세레이트 제제의 임상 재평가 실패시 처방액의 일정금액을 건강보험공단에서 환수 조치한다. 이에 회사는 납부해야 할 금액을 추정해 반영하고 있다”라고 소개했다. 지난 9월말 기준 국제약품의 비유동충당부채는 47억원 반영됐다. 동광제약, 경동제약, 제뉴파마, 동국제약, 환인제약 등도 수십억원 규모의 콜린제제 환수금액을 사전에 부채 항목 등에 선인식했다. 콜린제제의 지난해 콜린제제의 외래 처방금액은 6123억원으로 집계됐다. 올해 3분기 누적 처방 시장 규모는 4419억원으로 나타났다. 최근 시장 성장세는 주춤했지만 여전히 3개월 처방액이 1500억원에 육박하는 초대형 시장을 형성했다. 만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 계산이 나온다. 이 경우 제약사들의 환수 금액은 5000억원 이상으로 추산된다. 제약사 입장에선 실적 손실을 감수하면서도 콜린제제의 수익금 일부를 미리 반영하면서 최악의 상황을 대비할 수 밖에 없는 처지다. 제약사들은 콜린제제의 허가가 효력을 유지하는 상황에서 재평가 임상시험 실패로 막대한 금액을 부담하는 것은 납득하기 어렵다는 인식이 팽배하다. 고환율로 원가 부담 가중...제약사들 “약가인하시 치명적 타격 불가피” 제약사들은 최근 고환율로 원가 부담에 가중되는 상황에서 제네릭 약가기준이 더욱 낮아지면 치명적인 손실을 초래할 것이란 우려가 팽배하다. 지난 25일 서울 외환시장에서 원·달러 환율은 1472.9원을 기록했다. 지난해 10월 2일 1306.9원과 비교하면 1년 만에 13.1% 상승했다. 원달러 환율은 달러당 1500원 선을 위협할 정도로 최근 고공행진이 이어지고 있다. 원화 가치 하락은 제약사들의 원가 상승 압박으로 이어진다. 제약사들은 의약품의 핵심 원자재인 원료의약품의 수입 의존도가 높아 원달러 환율 상승은 원가 인상으로 직결된다. 국내 기업의 수입 의존도가 가장 높은 중국 원료의약품을 구매할 때에도 달러를 사용하기 때문에 원달러 환율 상승의 영향을 받을 수밖에 없다. 수입 규모가 큰 인도산 원료의약품도 달러로 거래가 이뤄지는 것으로 전해졌다. 지난해 원료의약품 자급도는 31.4%로 2023년 25.4%보다 6%포인트 상승했다. 작년 평균 원 달러 환율 1367원을 적용해 계산한 값이다. 자급도는 국내 생산 제품이 전체 시장에서 차지하는 비율을 말한다. 국내 시장 규모(생산-수출+수입)에서 국내 생산 제품의 국내 사용량(생산-수출)의 비중이다. 국내 원료의약품 자급도는 2020년 36.5%를 기록한 이후 2021년 24.4%, 2022년 11.9%로 급감했는데 2023년 25.4%로 3년 만에 반등했고 2년 연속 상승세를 이어갔다. 지난해 원료의약품 자급도는 전년대비 반등했지만 국내 사용 69.6%가 수입 제품이라는 점에서 여전히 수입 원료의약품 의존도가 높다는 지적이 나온다. 국내 기업의 원료의약품 생산 규모가 매년 증가하고 있지만 원가 절감을 위해 저렴한 수입 제품을 사용하면서 낮은 자급도가 고착화했다. 정부의 반복된 약가인하 정책이 제약사들의 저렴한 수입 원료의약품 사용 동력으로 작용한다는 지적이 꾸준히 제기됐다. 달러 강세는 수출이 많은 원료의약품 업체에도 영향을 미칠 수 있다. 국내 기업은 기초 물질을 수입·가공해 원료의약품을 생산한 이후 해외에 수출하는 사례가 많다는 게 업계 관계자들의 설명이다. 원달러 상승으로 기초 물질 수입 가격이 상승하면 국내 생산 원료의약품의 원가도 열악해지는 구조다. 최근 달러 초강세로 제약사들은 더욱 원가 압박에 시달리고 있지만 다른 소비재와는 달리 완제의약품의 가격을 올릴 수도 없어 체감하는 걱정은 더욱 크다. 건강보험 의약품의 보험상한가는 원가 가격이 상승하더라도 제약사가 자발적으로 보험상한가를 인상할 수 없는 구조다. 퇴장방지의약품에 한해 정부가 원가 보전 차원에서 보험약가를 올려줄 수 있다. 다른 약물에 비해 가격이 낮아 품절이 빈번하게 발생하거나 원가 압박으로 제약사가 생산·수입을 기피해 임상진료에 지장을 초래하는 의약품은 퇴장방지의약품으로 지정될 수 있다. 업계 한 관계자는 “최근 고환율로 원가 압박이 감당하기 힘든 수준으로 거세지는 상황이다”라면서 “지난 몇 년간 약가 규제로 수익성이 크게 악화했는데 또 다시 제네릭 약가기준이 낮아지면 제약사들은 기업 존폐마저 걱정해야 하는 처지다”라고 토로했다.약가제도 개편과 위기의 제약업계(2)2025-11-26 06:13:36천승현
2년 전 8천개 인하했는데...제약산업 발목잡는 약가 정책[데일리팜=천승현 기자] 제약사들은 정부의 반복된 약가인하 기조 정책이 산업 생태계를 위협하는 가장 큰 요인이라고 지적한다. 제약사들은 5년 전 약가제도 전면 개편으로 수천개 의약품의 약가가 인하되면서 적잖은 손실을 감수했다. 뇌기능개선제 ‘콜린알포세레이트’ 임상재평가에 실패하면 기존 판매 금액도 환수한다는 압박에 많게는 수백억원 규모의 보이지 않는 부채를 떠안은 실정이다. 정부의 급여재평가로 주력 캐시카우가 속속 퇴출되면서 지속적으로 예상치 못한 손실을 감수하는 현실이다. 최근에는 고환율로 원가 부담마저 커지면서 원가 압박이 커지는 상황에서 제네릭 약가가 또 다시 내려가면 기업 생존마저 위협받는다는 볼멘소리가 나온다. 2020년 약가제도 개편 이후 8천여개 약가인하..."정부 정책, 지속적 손실 야기" 제약사들이 정부의 약가제도 개편 움직임에 강한 저항을 갖는다. 정부 정책이 약가인하와 급여 삭제를 집중적으로 겨냥하면서 지속적으로 제약사들의 손실을 가중시킨다는 이유에서다. 5년 전 제네릭 약가제도가 전면 개편되면서 2023년 9월과 지난해 3월 두 차례에 걸쳐 제네릭 8000여개 품목의 약가가 인하됐다. 2023년 9월 5일부터 제네릭 7355개 품목의 약가가 최대 28.6% 인하됐다. 지난 2020년부터 추진한 제네릭 약가재평가의 1차 결과다. 지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 올해 2월말까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다. 제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 개편 약가제도에서 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다. 한 가지 요건이 충족되지 않을 때마다 상한가는 15%씩 내려간다. 2개 요건 모두 충족하지 못하면 27.75% 인하되는 구조다. 당시 일부 제품은 기준 요건 2가지 미충족에 사용량 약가연동제에 따른 약가인하가 중복되면서 인하율이 27.75%를 초과했다. 이때 총 179개 업체가 약가인하로 손실이 불가피했다. 한국휴텍스제약이 154개 품목이 약가인하 대상에 포함됐다. 하나제약과 대웅바이오가 각각 122개, 104개 품목이 약가가 내려갔고 일화는 101개 품목의 상한가가 인하됐다. 마더스제약, 셀트리온제약, 삼성제약, 한국글로벌제약, 이연제약, 메디카코리아, 보령바이오파마, 대한뉴팜, 동국제약, 아주약품, 건일바이오팜, 제일약품, 한국유니온제약, 동구바이오제약 등이 약가인하 제품이 80개가 넘었다. 지난해 3월에는 제네릭 약가재평가의 두 번째 결과로 의약품 948개 품목의 약가가 최대 27.9% 떨어졌다. 제네릭 약가재평가 대상 중 주사제와 같은 무균제제 등 동등성시험 대상으로 새롭게 편입된 의약품에 대해 작년 3월 추가로 약가인하가 시행됐다. 제네릭 약가재평가 2차 결과 제약사 156개 업체가 약가인하 의약품을 보유했다. 삼천당제약과 이연제약이 각각 23개 품목으로 가장 많았다. 국제약품과 신풍제약은 각각 21개 품목이 약가인하 대상에 포함됐다. 한국휴텍스제약은 19개 품목의 약가가 인하됐고 유니메드제약은 16개 품목이 인하 대상으로 분류됐다. 2020년 7월 개편 약가인하가 시행됐고 기등재 의약품에도 새 약가제도로 적용하면서 4년 만에 총 8303개 품목의 약가가 떨어진 셈이다. 업계 한 관계자는 “약가제도 개편으로 불과 2년 전에 수천개 품목의 약가가 인하됐는데 또 다시 제도를 개편하는 이유를 납득할 수 없다"라고 비판했다. 4년간 급여재평가로 6개 성분 퇴출...제약사들, 캐시카우 상실로 실적 타격 제약사들은 정부의 재평가 정책으로 지속적으로 수익성 하락 변수가 발생했다. 지난 2021년부터 4년 동안 진행한 급여 적정성 평가 결과 총 6개 품목이 건강보험 급여가 취소되면서 제약사들의 손실이 현실화했다. 보건당국은 지난 2021년 급여재평가 결과 실리마린과 빌베리건조엑스는 급여적정성이 없는 것으로 결론 나면서 건강보험 급여 삭제가 결정됐다. 실리마린은 독성간질환, 간세포보호, 만성간염, 간경변 등에 사용되는 일반의약품이다. 빌베리건조엑스는 당뇨병에 의한 망막변성 및 눈의 혈관장애 개선에 사용되는 약물이다. 지난 2020년 기준 실리마린과 빌베리건조엑스는 각각 275억원, 287억원 규모의 외래 처방시장을 형성했다. 지난 2022년부터 급여재평가 결과 스트렙토키나제·스트렙토도르나제(스트렙토제제), 옥시라세탐, 아세틸엘카르니틴 등의 성분에 대해 전 품목 급여 삭제가 결정됐다. 이중 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 식약처의 임상재평가를 통과하지 못하면서 처방 시장이 소멸했다. 지난 2020년 기준 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 총 732억원의 처방시장을 형성했다. 지난해 급여재평가 결과 급여 삭제가 결정된 이토프리드도 처방 시장이 사라졌다. 이토프리드는 복부팽만, 상복부통, 식욕부진, 속쓰림, 구역, 구토 등 기능성소화불량으로 인한 소화기증상에 사용되는 의약품이다. 이토프리드는 지난해 221억원의 처방시장을 나타냈다. 매 분기 50억원대 처방시장을 형성했는데 올해 2월부터 소멸했다. 제약사들은 록소프로펜의 급여 축소로 인한 손실도 감수한 상황이다. 록소프로펜은 ▲만성 류마티스관절염, 골관절염(퇴행관절염), 요통, 견관절주위염, 경견완증후군 등의 소염·진통 ▲수술 후, 외상 후 및 발치 후의 소염·진통 ▲급성 상기도염의 해열·진통 등에 사용되는 약물이다. 급성 상기도염의 해열·진통’ 적응증에 대해 급여 적정성이 없다고 결론 내리고 지난해부터 급여가 삭제됐다. 록소프로펜은 지난 2021년 724억원의 처방시장을 형성했는데 2022년 1035억원으로 43.0% 치솟았고 2023년에는 1135억원으로 확대됐다. 지난해 록소프로펜 성분 외래 처방시장 규모는 총 833억원으로 전년대비 26.7% 감소하며 급여 축소 직격탄을 맞았다. 록소프로펜은 2023년 4분기 307억원의 처방액을 기록했는데 올해 들어 1분기 208억원, 2분기와 3분기에는 202억원, 204억원으로 쪼그라들었다. 콜린알포 환수 대비 부채 인식...“정부 정책에 실적 손실 현실화” 제약사들은 뇌기능개선제 ‘콜린알포세레이트’(콜린제제)의 임상재평가가 끝나지 않았는데도 이미 임상 실패를 가정한 부채를 인식한 상황이다. 정부 정책으로 가상 부채를 회계에 반영하는 이례적인 현상이다. 금융감독원에 따르면 종근당, 대웅바이오, 한미약품, 알리코제약, 동구바이오제약, 국제약품, 동광약품, 경동제약, 제뉴파마, 동국제약, 환인제약 등이 콜린제제 임상실패를 대비한 환수 금액 추정치를 미리 부채 항목 등에 반영한 것으로 나타났다. 콜린제제의 임상시험 실패시 발생할 수 있는 최악의 시나리오를 대비해 사전 대책 마련 움직임이다. 수익의 일부를 부채로 인식하면서 추후 일시적으로 발생할 수 있는 거액의 환수에 따른 피해를 최소화하겠다는 의도다. 일부 실적 공백을 감수하면서 임상 실패를 대비한 막대한 손실을 분산시키겠다는 고육책이다. 콜린제제는 효능 논란이 불거지자 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사들은 재평가 임상시험에 착수했다. 지난 2020년 복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 만약 제약사들의 콜린제제 재평가 임상시험이 실패로 결론나면 보건당국에 임상시험 기간 동안 올린 처방액 20%를 되돌려줘야 하는 상황이다. 종근당은 지난 3분기 말 기준 비유동부채 항목에 환불부채 520억원을 인식했다. 회사 측은 “콜린알포세레이트제제의 유효성 입증을 위한 임상재평가 실패시 건강보험공단에 납부할 추정금액을 환불부채로 인식했다”라고 설명했다. 콜린제제 판매로 발생한 수익의 일부를 추후 환불할 것으로 예상되는 부채로 미리 인식했다는 의미다. 대웅바이오는 콜린제제 임상재평가 실패시 납부할 금액 추정치를 장기선수금으로 인식한다. 선수금은 상품이나 서비스를 제공하기 전에 미리 받은 금액 부채에 해당한다. 지난해 말 대웅바이오의 기타비유동부채 중 장기선수금은 666억원에 달했다. 동구바이오제약은 비유동부채 중 기타 비유동부채 항목에 콜린제제 환수액을 사전에 인식했다. 3분기 말 동구바이오제약의 기타 비유동부채는 139억원으로 설정됐다. 동구바이오제약은 “국민건강보험공단과의 '콜린알포세레이트'의 처방액의 일부 환수조건에 합의했으며 납부할 추정금액이 포함돼 있다. 임상재평가 결과에 따라 환수금액은 변동될 수 있다”라고 제시했다. 알리코제약은 비유동부채 중 장기 환불부채에 콜린제제 환수금액 추정치를 선반영하고 있다. 알리코제약은 지난 9월 말 기준 비유동부채 장기환불부채 113억원을 인식했다. 한미약품은 지난 상반기 말 기준 비유동부채 항목 중 계약부채 및 환불부채 35억원을 인식했다. 한미약품은 “콜리네이트연질캡슐 임상재평가 실패 시 국민건강보험공단으로 납부해야 할 금액 추정치에 해당한다”고 설명했다. 국제약품은 비유동충당부채에 콜린제제 환수금액을 미리 반영했다. 국제약품은 “콜린알포세레이트 제제의 임상 재평가 실패시 처방액의 일정금액을 건강보험공단에서 환수 조치한다. 이에 회사는 납부해야 할 금액을 추정해 반영하고 있다”라고 소개했다. 지난 9월말 기준 국제약품의 비유동충당부채는 47억원 반영됐다. 동광제약, 경동제약, 제뉴파마, 동국제약, 환인제약 등도 수십억원 규모의 콜린제제 환수금액을 사전에 부채 항목 등에 선인식했다. 콜린제제의 지난해 콜린제제의 외래 처방금액은 6123억원으로 집계됐다. 올해 3분기 누적 처방 시장 규모는 4419억원으로 나타났다. 최근 시장 성장세는 주춤했지만 여전히 3개월 처방액이 1500억원에 육박하는 초대형 시장을 형성했다. 만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 계산이 나온다. 이 경우 제약사들의 환수 금액은 5000억원 이상으로 추산된다. 제약사 입장에선 실적 손실을 감수하면서도 콜린제제의 수익금 일부를 미리 반영하면서 최악의 상황을 대비할 수 밖에 없는 처지다. 제약사들은 콜린제제의 허가가 효력을 유지하는 상황에서 재평가 임상시험 실패로 막대한 금액을 부담하는 것은 납득하기 어렵다는 인식이 팽배하다. 고환율로 원가 부담 가중...제약사들 “약가인하시 치명적 타격 불가피” 제약사들은 최근 고환율로 원가 부담에 가중되는 상황에서 제네릭 약가기준이 더욱 낮아지면 치명적인 손실을 초래할 것이란 우려가 팽배하다. 지난 25일 서울 외환시장에서 원·달러 환율은 1472.9원을 기록했다. 지난해 10월 2일 1306.9원과 비교하면 1년 만에 13.1% 상승했다. 원달러 환율은 달러당 1500원 선을 위협할 정도로 최근 고공행진이 이어지고 있다. 원화 가치 하락은 제약사들의 원가 상승 압박으로 이어진다. 제약사들은 의약품의 핵심 원자재인 원료의약품의 수입 의존도가 높아 원달러 환율 상승은 원가 인상으로 직결된다. 국내 기업의 수입 의존도가 가장 높은 중국 원료의약품을 구매할 때에도 달러를 사용하기 때문에 원달러 환율 상승의 영향을 받을 수밖에 없다. 수입 규모가 큰 인도산 원료의약품도 달러로 거래가 이뤄지는 것으로 전해졌다. 지난해 원료의약품 자급도는 31.4%로 2023년 25.4%보다 6%포인트 상승했다. 작년 평균 원 달러 환율 1367원을 적용해 계산한 값이다. 자급도는 국내 생산 제품이 전체 시장에서 차지하는 비율을 말한다. 국내 시장 규모(생산-수출+수입)에서 국내 생산 제품의 국내 사용량(생산-수출)의 비중이다. 국내 원료의약품 자급도는 2020년 36.5%를 기록한 이후 2021년 24.4%, 2022년 11.9%로 급감했는데 2023년 25.4%로 3년 만에 반등했고 2년 연속 상승세를 이어갔다. 지난해 원료의약품 자급도는 전년대비 반등했지만 국내 사용 69.6%가 수입 제품이라는 점에서 여전히 수입 원료의약품 의존도가 높다는 지적이 나온다. 국내 기업의 원료의약품 생산 규모가 매년 증가하고 있지만 원가 절감을 위해 저렴한 수입 제품을 사용하면서 낮은 자급도가 고착화했다. 정부의 반복된 약가인하 정책이 제약사들의 저렴한 수입 원료의약품 사용 동력으로 작용한다는 지적이 꾸준히 제기됐다. 달러 강세는 수출이 많은 원료의약품 업체에도 영향을 미칠 수 있다. 국내 기업은 기초 물질을 수입·가공해 원료의약품을 생산한 이후 해외에 수출하는 사례가 많다는 게 업계 관계자들의 설명이다. 원달러 상승으로 기초 물질 수입 가격이 상승하면 국내 생산 원료의약품의 원가도 열악해지는 구조다. 최근 달러 초강세로 제약사들은 더욱 원가 압박에 시달리고 있지만 다른 소비재와는 달리 완제의약품의 가격을 올릴 수도 없어 체감하는 걱정은 더욱 크다. 건강보험 의약품의 보험상한가는 원가 가격이 상승하더라도 제약사가 자발적으로 보험상한가를 인상할 수 없는 구조다. 퇴장방지의약품에 한해 정부가 원가 보전 차원에서 보험약가를 올려줄 수 있다. 다른 약물에 비해 가격이 낮아 품절이 빈번하게 발생하거나 원가 압박으로 제약사가 생산·수입을 기피해 임상진료에 지장을 초래하는 의약품은 퇴장방지의약품으로 지정될 수 있다. 업계 한 관계자는 “최근 고환율로 원가 압박이 감당하기 힘든 수준으로 거세지는 상황이다”라면서 “지난 몇 년간 약가 규제로 수익성이 크게 악화했는데 또 다시 제네릭 약가기준이 낮아지면 제약사들은 기업 존폐마저 걱정해야 하는 처지다”라고 토로했다.약가제도 개편과 위기의 제약업계(2)2025-11-26 06:13:36천승현 -
 실속 없는 실적...제네릭 약가인하, 일자리 감소로[데일리팜=김진구·차지현 기자] 정부가 대대적인 제네릭 약가제도 개편에 나선다. 현행 53.55%인 제네릭 약가 산정률을 40% 이하로 낮추는 것이 골자다. 동시에 R&D에 적극 투자하는 기업에는 약가우대를 적용한다는 방침이다. 제약업계에선 위기감이 고조되고 있다. 2012년 단행된 일괄약가인하를 넘어서는 충격이 불가피하다는 전망까지 나온다. 정부의 지속적인 약가 압박과 부쩍 높아진 원가 부담으로 업계 전반의 사업 수익성이 크게 떨어진 상황에서, 이번 조치가 시행될 경우 급여 의약품 중심 전통제약사 상당수가 실질적인 ‘생존 리스크’와 대면하게 될 것이란 우려다. 일각에서는 파장이 단순한 실적 악화에 그치지 않을 것이란 비판도 존재한다. 수익성 저하로 R&D 투자 여력이 빠르게 고갈되고, 고용시장 위축과 영업조직 축소 등 산업 기반 자체가 흔들릴 수 있다는 지적이다. 제네릭 약가 산정률 ‘53.55%→40%’ 추진…“일괄약가인하 넘어서는 충격 불가피” 25일 제약업계에 따르면 정부는 제네릭 약가 산정률 조정을 포함해 건강보험 제도 전반의 대대적인 개편에 나선다. 대강의 시간표도 나왔다. 오는 28일 건강보험정책심의위원회에 개편 방향을 보고한다. 이후 논의를 거쳐 내년 2월 의결, 내년 7월 시행이 유력하게 점쳐진다. 이 가운데 업계의 최대 관심은 제네릭 약가제도 개편이다. 정부는 53.55%인 현행 제네릭 약가 산정률이 과도한 것으로 판단한다. 이에 제네릭 약가 산정률을 40%로 낮추는 방안을 검토 중이다. 이 시나리오대로면 기존에 1000원에 판매하던 제네릭을 앞으로는 747원 이하로 판매해야 한다. 제네릭 수익성이 즉시 25% 이상 줄어드는 셈이다. 일각에선 '40% 미만'이 될 것이란 전망도 나온다. 향후 3년간 매년 6~7%씩 낮춰, 결국 35% 수준이 되는 시나리오다. 이땐 제네릭 수익성이 3년에 걸쳐 약 35% 감소한다는 계산이 나온다. 정부는 채찍과 함께 당근도 준비했다. 제약사의 ‘혁신성’에 기반해 약가를 우대한다는 내용이다. 구체적으로는 ▲혁신형 제약사 중 R&D 투자 성과가 우수한 업체(상위 20%) ▲나머지 혁신형 제약사 ▲비혁신형 제약사 중 R&D 투자가 많은 업체 ▲국가필수약·퇴장방지약 등 안정공급 기여 제약사 등에 약가우대를 차등 적용하는 방안이 거론된다. 우대 기준을 충족하면 제네릭 약가 산정률 인하 이전, 즉 ‘현행 수준’의 약가를 일정 기간 유지하는 식의 보전을 받게 될 가능성이 크다. 다만 적용 기간은 3년으로 제한되는 것으로 알려졌다. 3년이 지나면 우대 여부와 관계 없이 40% 안팎의 산정률이 일괄 적용되는 셈이다. 새 약가제도가 기존 등재 제네릭에 소급 적용될지 여부도 초미의 관심사다. 제네릭 약가 산정률이 40% 수준으로 확정될 경우, 인하폭은 2012년 일괄약가인하 당시의 14.45%포인트(68%→53.55%)를 넘어선다. 일괄약가인하를 뛰어넘는 파장이 예상되는 대목이다. 한 제약업계 관계자는 “정부의 의도는 선명하다. 제네릭 위주 제약사엔 채찍을, 혁신에 투자하는 제약사엔 당근을 주겠다는 것”이라며 “다만 채찍은 과도하고 당근은 부족하다. 특히 약가우대 기간이 3년으로 제한되는 등 ‘시한부 우대’에 대한 우려가 크다. 3년이 지나면 신약 R&D와 의약품 안정공급 투자 의지가 꺾이게 될 것으로 우려된다”고 지적했다. 비급여 중심 제약사 영업익 311% 증가…전통 제약은 33% 증가 그쳐 업계에선 급여 의약품 중심 제약사를 중심으로 상당한 충격이 불가피할 것이란 우려가 커지는 분위기다. 실제 제네릭 의약품에 크게 의존하는 중견·중소 제약사는 최근 5년 새 수익성이 급격히 악화했다. 여기서 엎친데 덮친 격으로 제네릭 약가가 추가로 인하될 경우 존립 자체가 흔들릴 수 있다는 지적이다. 금융감독원에 따르면 국내 주요 상장 제약바이오 기업의 2020년과 2025년 3분기 누적 실적을 비교한 결과 비급여 의약품 중심 기업은 압도적인 성장세를 기록한 반면 급여 의약품 중심 제약사는 수익성이 크게 후퇴한 것으로 드러났다. 이번 조사는 국내 제약바이오 업계 실적 상위 상장사 50개사를 대상으로 진행됐다. 이 중 비급여 의약품 중심 기업군은 보툴리눔톡신·필러·의료기기·위탁개발생산(CDMO) 등 건강보험 급여와 무관한 시장에서 매출 대부분을 올리는 10개사로 구성했다. 급여 의약품 중심 기업군은 전문의약품·제네릭·처방 기반 급여 매출 비중이 높은 40개 전통 제약사로 분류해 비교·분석했다. 올 3분기 누적 기준 전체 50개사의 평균 매출은 5441억원으로 5년 전보다 73.0% 증가했다. 같은 기간 평균 영업이익은 306억원에서 804억원으로 162.7% 늘었다. 영업이익률은 9.7%에서 14.8%로 5.0%포인트 상승했다. 전반적으로 실적이 개선된 것처럼 보이지만 기업군별로 나눠보면 양상은 크게 달라진다. 급여 의약품 중심 전통 제약사는 40개사 매출은 3071억원에서 4314억원으로 40.5% 증가했다. 영업이익은 204억원에서 272억원으로 33.9% 늘었다. 수치상으로는 증가했지만, 전체 평균 증가율을 고려하면 크게 뒤처진 수준으로 사실상 성장 정체 구간에 머물러 있다는 평가다. 일양약품은 2020년 3분기 누적 매출이 2563억원에서 올 3분기 1935억원으로 24.5% 감소했다. 같은 기간 영업이익은 258억원에서 44억원으로 -82.9%나 급감했다. 일양약품은 항궤양제 '놀텍'과 백혈병 치료제 '라도티닙'(슈펙트) 등 급여 의약품 중심 포트폴리오를 보유한 전통 제약사다. 매출 구성을 보면 3분기 매출의 약 40%가 급여 의약품에서 발생했다. 제일약품도 2020년 3분기 누적 매출 5184억원에서 올 3분기 4354억원으로 외형이 크게 뒷걸음질쳤다. 제일약품은 위식도역류 치료제 '자큐보', 고지혈증 치료제 '리피토플러스', 고혈압·순환기·소화기 계열 전문의약품 등을 보유 중이다. 이 회사는 매출 기반이 급여 전문약에 지나치게 집중돼 급여 의약품 비중이 80%를 넘는다. 비급여 의약품 중심 기업이 같은 기간 영업이익을 세 배 이상 키우며 성장을 이어간 것과 비교하면 급여 중심사의 부진이 더욱 두드러진다. 휴젤·파마리서치·삼성바이오로직스 등 비급여 중심 기업 10개사의 평균 매출은 2020년 3분기 누적 3438억원에서 올 3분기 누적 9947억원으로 189.3% 증가했다. 영업이익은 716억원에서 2930억원으로 309.2% 급증했다. 휴젤은 보툴리눔톡신·필러 중심 고마진 포트폴리오를 기반으로 비약적으로 성장한 대표 기업이다. 보툴리눔 톡신제 '보툴렉스'와 히알루론산(HA) 필러 '더채움'이 대표 제품이다. 올 3분기 이 회사 매출은 3060억원으로 5년 전 대비 113.1% 증가했고 영업이익은 502억원에서 1430억원으로 184% 급증했다. 재생의학 기반 연어·복어 DNA(PN·PDRN) 주사제와 에스테틱 의료기기를 주력으로 하는 파마리서치도 최근 5년간 비급여 기업 중 가장 가파른 성장세를 보인 업체 중 하나다. 매출은 2020년 3분기 775억원에서 올 3분기 3929억원으로 407% 증가했고 영업이익은 221억원에서 1625억원으로 7배 이상 증가했다. PN·PDRN 피부재생 시술 확산과 의료기기·화장품 부문의 급격한 성장, 해외 매출 증가가 맞물리며 실적 증가세를 이끌었다는 분석이다. 위탁개발생산(CDMO) 업체 삼성바이오로직스는 비급여 기업 중 외형 측면에서 사실상 시장을 압도하는 존재일 뿐만 아니라 급여 의약품 중심 제약사와는 비교 자체가 어려울 만큼 외형과 성장 속도에서 격차를 벌린 기업이다. 삼성바이오로직스 매출은 2020년 3분기 7895억원에서 올 3분기 4조2484억원으로 438.1% 증가했고 영업이익은 2,002억원에서 1조6911억원으로 745% 급증했다. 결국 소수 비급여 대형 기업의 급격한 외형 확장이 전체 실적 평균을 끌어올리면서 산업 전반이 성장한 것처럼 보이는 '착시 효과'가 발생했다고 볼 수 있는 셈이다. 영업이익률을 놓고 보면 비급여 의약품 중심 업체와 급여 의약품 중심 업체 간 온도차가 더욱 극명하다. 비급여 의약품 중심 기업의 평균 영업이익률은 2020년 20.8%에서 2025년 29.5%로 증가, 고마진 사업 구조가 더 공고해졌다. 반면 급여 의존도가 높은 전통 제약사의 평균 영업이익률은 같은 기간 6.6%에서 6.3%로 떨어지면서 수익성이 되레 후퇴한 것으로 나타났다. 비급여 의약품 대표 기업인 휴젤의 경우 올 3분기 누적 기준 영업이익률이 46.7%에 달한다. 이는 매출 절반 가까이를 이익으로 남기는 구조라는 얘기다. 이 같은 초고수익 구조는 급여 의약품 중심 기업에서는 찾아보기 어렵다. 매출 1위인 유한양행만 보더라도 올해 3분기 누적 기준 매출이 1조6406억원에 달하지만 영업이익률은 4%대에 머무른다. 유한양행은 국내 제약사 중 가장 큰 외형을 갖고 있는 데다 국내 첫 미국 식품의약국(FDA) 허가 항암신약 '렉라자'(레이저티닙)를 보유했음에도 한 자릿수 초반의 수익성에 머물고 있는 것이다. 수익성 악화에 영업직 내보내고 CSO 전환…"약가 인하 시 생존 위태 급여 의약품 중심 제약사 내부에서도 양극화 현상이 뚜렷하게 나타났다. 급여 의약품 중심 제약사 가운데 상위 20개사의 평균 매출은 2020년 3분기 3495억원에서 2025년 3분기 5074억원으로 45.2% 증가했지만 하위 20개사는 2647억원에서 3554억원으로 34.3% 증가하는 데 머물렀다. 수익성 측면에서는 격차가 한층 뚜렷해진다. 상위 20개사는 영업이익이 2020년 3분기 254억원에서 올 3분기 477억원으로 88.1% 증가했다. 그러나 같은 기간 하위 20개사는 153억원에서 68억원으로 55.5% 감소했다. 급여 의약품 중심 제약사 가운데 영업이익률 10% 이상을 기록한 기업은 2020년 14곳에서 올해 9곳으로 줄어들며 고수익 구조를 유지하는 기업이 크게 감소했다. 전체 40개 급여 중심 제약사 중 절반이 넘는 21곳(52.5%)은 5년 전보다 영업이익이 오히려 감소한 것으로 나타났고 이 가운데 3곳은 올해 3분기 누적 기준 영업적자를 기록했다. 하위권 기업의 평균 영업이익률 역시 5.8%에서 1.9%로 추락해 수익 기반이 거의 무너진 상태다. 특히 급여 의약품 중심 제약사 중 하위권 업체의 경우 영업이익률이 1%대에 그치거나 1%에도 미치지 못하는 곳이 수두룩했다. 동화약품·광동제약·경보제약·알리코제약·삼천당제약 등 기업이 1%대 영업이익률을 기록했다. 이들 기업의 경우 100원을 팔아도 1원조차 남기기 어려운 구조라는 얘기다. HLB제약(0.2%)과 동아에스티(0.6%)는 영업이익률이 1% 아래로 떨어졌다. 수익성이 한 자릿수 초반까지 무너진 업체가 늘어나는 가운데 한독·대원제약·삼일제약 등 적자 기업까지 증가하면서 급여 의약품 중심 제약사의 수익성 둔화 속도가 업계가 우려한 수준을 넘어섰다는 분석이 나온다. 수익성 급락에 직면한 중견·중소 제약사들은 비용 구조를 재편하며 생존을 모색 중이다. 이들 기업은 고정비 부담이 큰 정규직 영업사원(MR) 조직 유지가 어려워진 데 따라 조직 규모 감축에 나섰고 그 빈자리를 판매 실적 기반으로 수수료를 지급하는 CSO로 빠르게 전환하는 움직임이 확산하고 있다. CSO는 제약사가 직접 MR을 고용하지 않고 영업을 외부 조직에 위탁하는 방식으로 급여·4대보험·차량·교육·관리비 등 고정 인건비를 통째로 덜어낼 수 있는 구조다. 다만 외부 인력에 의존하는 만큼 영업 품질 저하나 컴플라이언스 리스크가 뒤따를 수 있다는 한계도 존재한다. 그럼에도 기업들은 CSO 활용을 생존을 위한 불가피한 선택으로 받아들이고 있는 것이다. 이런 상황에서 정부가 제네릭 약가 추가 인하와 기준요건 강화, 급여 적정성 재평가 확대 등을 다시 추진하면서 업계의 위기감은 더욱 고조되는 분위기다. 정부는 제네릭 약가를 일괄적으로 낮추고 급여 적정성 재평가 범위를 확대하는 약가 개편안을 추진 중이다. 제네릭 약가를 추가로 인하하고 급여 기준을 촘촘하게 재정비해 건강보험 재정 절감 효과를 극대화하겠다는 구상이다. 업계에서는 산업 전반의 수익성이 이미 급격히 떨어진 상황에서 약가가 한 번 더 떨어지면 매출 원천 자체가 흔들릴 수밖에 없다는 우려가 제기된다. 정부가 내세우는 건강보험 재정 안정화라는 명분에 비해 실제 현장에서 제조 기반 약화와 고용 축소 등 부작용이 더 클 수 있다는 점에서 업계 반발이 커지고 있다. 특히 정규직 생산·영업 인력을 줄이고 외부 인력으로 대체하는 흐름이 가속화하면서 약가 인하가 결국 제약산업의 일자리 감소로 직결될 것이라는 위기감도 커지고 있다. 실제 현장에서는 약가·원가 압박이 고용 축소로 직결되는 흐름이 명확하게 관찰된다. 주요 중소 제약사의 인력 변동을 분석한 결과 서울제약은 2020년 3분기 201명에서 올해 3분기 87명으로 56.7% 감소하며 절반 이하 수준으로 축소됐다. 서울제약은 자체 영업조직을 대폭 줄이고 CSO 단독 영업 체제로 전환한 대표적 사례다. 명문제약도 같은 기간 522명에서 305명으로 약 41.6% 줄었고 일성신약 역시 226명에서 182명으로 19.5% 감소하며 축소 기조를 이어가고 있다. 국제약품 역시 직원 수가 2020년 상반기 435명에서 올해 상반기 260명으로 40% 가까이 감소했다. 이들 기업은 모두 현재 CSO와 자체 영업조직을 병행하는 구조로, 고정 인건비 부담을 줄이기 위해 MR 축소와 CSO 활용 비중 확대를 동시에 진행 중이다. 무엇보다 이번 약가 인하는 중소 제약사에 직격탄이 될 것이라는 지적이다. 이들 기업은 고정비 비중이 높은 제네릭 사업에 집중돼 있어 제품 단가가 조금만 떨어져도 영업이익이 즉각 훼손되는 구조다. 동일 성분 제네릭이 수십 종씩 경쟁하는 과당 경쟁 시장에서는 약가가 소폭만 내려가도 거래처 확보, 유통 마진, 약국 공급, GMP 규제 등 각종 비용을 감당하기 어려워지기 때문이다. 업계 한 관계자는 "최근 제네릭 중심 제약사들은 치솟는 원가 구조와 약가인하로 수익성이 사실상 붕괴된 수준이다"라면서 "이런 구조적 취약성 속에서 추가로 약가가 떨어지면 중소 기업은 더 이상 대응 여력이 없다"라고 토로했다.약가제도 개편과 위기의 제약업계(1)2025-11-25 06:20:22차지현
실속 없는 실적...제네릭 약가인하, 일자리 감소로[데일리팜=김진구·차지현 기자] 정부가 대대적인 제네릭 약가제도 개편에 나선다. 현행 53.55%인 제네릭 약가 산정률을 40% 이하로 낮추는 것이 골자다. 동시에 R&D에 적극 투자하는 기업에는 약가우대를 적용한다는 방침이다. 제약업계에선 위기감이 고조되고 있다. 2012년 단행된 일괄약가인하를 넘어서는 충격이 불가피하다는 전망까지 나온다. 정부의 지속적인 약가 압박과 부쩍 높아진 원가 부담으로 업계 전반의 사업 수익성이 크게 떨어진 상황에서, 이번 조치가 시행될 경우 급여 의약품 중심 전통제약사 상당수가 실질적인 ‘생존 리스크’와 대면하게 될 것이란 우려다. 일각에서는 파장이 단순한 실적 악화에 그치지 않을 것이란 비판도 존재한다. 수익성 저하로 R&D 투자 여력이 빠르게 고갈되고, 고용시장 위축과 영업조직 축소 등 산업 기반 자체가 흔들릴 수 있다는 지적이다. 제네릭 약가 산정률 ‘53.55%→40%’ 추진…“일괄약가인하 넘어서는 충격 불가피” 25일 제약업계에 따르면 정부는 제네릭 약가 산정률 조정을 포함해 건강보험 제도 전반의 대대적인 개편에 나선다. 대강의 시간표도 나왔다. 오는 28일 건강보험정책심의위원회에 개편 방향을 보고한다. 이후 논의를 거쳐 내년 2월 의결, 내년 7월 시행이 유력하게 점쳐진다. 이 가운데 업계의 최대 관심은 제네릭 약가제도 개편이다. 정부는 53.55%인 현행 제네릭 약가 산정률이 과도한 것으로 판단한다. 이에 제네릭 약가 산정률을 40%로 낮추는 방안을 검토 중이다. 이 시나리오대로면 기존에 1000원에 판매하던 제네릭을 앞으로는 747원 이하로 판매해야 한다. 제네릭 수익성이 즉시 25% 이상 줄어드는 셈이다. 일각에선 '40% 미만'이 될 것이란 전망도 나온다. 향후 3년간 매년 6~7%씩 낮춰, 결국 35% 수준이 되는 시나리오다. 이땐 제네릭 수익성이 3년에 걸쳐 약 35% 감소한다는 계산이 나온다. 정부는 채찍과 함께 당근도 준비했다. 제약사의 ‘혁신성’에 기반해 약가를 우대한다는 내용이다. 구체적으로는 ▲혁신형 제약사 중 R&D 투자 성과가 우수한 업체(상위 20%) ▲나머지 혁신형 제약사 ▲비혁신형 제약사 중 R&D 투자가 많은 업체 ▲국가필수약·퇴장방지약 등 안정공급 기여 제약사 등에 약가우대를 차등 적용하는 방안이 거론된다. 우대 기준을 충족하면 제네릭 약가 산정률 인하 이전, 즉 ‘현행 수준’의 약가를 일정 기간 유지하는 식의 보전을 받게 될 가능성이 크다. 다만 적용 기간은 3년으로 제한되는 것으로 알려졌다. 3년이 지나면 우대 여부와 관계 없이 40% 안팎의 산정률이 일괄 적용되는 셈이다. 새 약가제도가 기존 등재 제네릭에 소급 적용될지 여부도 초미의 관심사다. 제네릭 약가 산정률이 40% 수준으로 확정될 경우, 인하폭은 2012년 일괄약가인하 당시의 14.45%포인트(68%→53.55%)를 넘어선다. 일괄약가인하를 뛰어넘는 파장이 예상되는 대목이다. 한 제약업계 관계자는 “정부의 의도는 선명하다. 제네릭 위주 제약사엔 채찍을, 혁신에 투자하는 제약사엔 당근을 주겠다는 것”이라며 “다만 채찍은 과도하고 당근은 부족하다. 특히 약가우대 기간이 3년으로 제한되는 등 ‘시한부 우대’에 대한 우려가 크다. 3년이 지나면 신약 R&D와 의약품 안정공급 투자 의지가 꺾이게 될 것으로 우려된다”고 지적했다. 비급여 중심 제약사 영업익 311% 증가…전통 제약은 33% 증가 그쳐 업계에선 급여 의약품 중심 제약사를 중심으로 상당한 충격이 불가피할 것이란 우려가 커지는 분위기다. 실제 제네릭 의약품에 크게 의존하는 중견·중소 제약사는 최근 5년 새 수익성이 급격히 악화했다. 여기서 엎친데 덮친 격으로 제네릭 약가가 추가로 인하될 경우 존립 자체가 흔들릴 수 있다는 지적이다. 금융감독원에 따르면 국내 주요 상장 제약바이오 기업의 2020년과 2025년 3분기 누적 실적을 비교한 결과 비급여 의약품 중심 기업은 압도적인 성장세를 기록한 반면 급여 의약품 중심 제약사는 수익성이 크게 후퇴한 것으로 드러났다. 이번 조사는 국내 제약바이오 업계 실적 상위 상장사 50개사를 대상으로 진행됐다. 이 중 비급여 의약품 중심 기업군은 보툴리눔톡신·필러·의료기기·위탁개발생산(CDMO) 등 건강보험 급여와 무관한 시장에서 매출 대부분을 올리는 10개사로 구성했다. 급여 의약품 중심 기업군은 전문의약품·제네릭·처방 기반 급여 매출 비중이 높은 40개 전통 제약사로 분류해 비교·분석했다. 올 3분기 누적 기준 전체 50개사의 평균 매출은 5441억원으로 5년 전보다 73.0% 증가했다. 같은 기간 평균 영업이익은 306억원에서 804억원으로 162.7% 늘었다. 영업이익률은 9.7%에서 14.8%로 5.0%포인트 상승했다. 전반적으로 실적이 개선된 것처럼 보이지만 기업군별로 나눠보면 양상은 크게 달라진다. 급여 의약품 중심 전통 제약사는 40개사 매출은 3071억원에서 4314억원으로 40.5% 증가했다. 영업이익은 204억원에서 272억원으로 33.9% 늘었다. 수치상으로는 증가했지만, 전체 평균 증가율을 고려하면 크게 뒤처진 수준으로 사실상 성장 정체 구간에 머물러 있다는 평가다. 일양약품은 2020년 3분기 누적 매출이 2563억원에서 올 3분기 1935억원으로 24.5% 감소했다. 같은 기간 영업이익은 258억원에서 44억원으로 -82.9%나 급감했다. 일양약품은 항궤양제 '놀텍'과 백혈병 치료제 '라도티닙'(슈펙트) 등 급여 의약품 중심 포트폴리오를 보유한 전통 제약사다. 매출 구성을 보면 3분기 매출의 약 40%가 급여 의약품에서 발생했다. 제일약품도 2020년 3분기 누적 매출 5184억원에서 올 3분기 4354억원으로 외형이 크게 뒷걸음질쳤다. 제일약품은 위식도역류 치료제 '자큐보', 고지혈증 치료제 '리피토플러스', 고혈압·순환기·소화기 계열 전문의약품 등을 보유 중이다. 이 회사는 매출 기반이 급여 전문약에 지나치게 집중돼 급여 의약품 비중이 80%를 넘는다. 비급여 의약품 중심 기업이 같은 기간 영업이익을 세 배 이상 키우며 성장을 이어간 것과 비교하면 급여 중심사의 부진이 더욱 두드러진다. 휴젤·파마리서치·삼성바이오로직스 등 비급여 중심 기업 10개사의 평균 매출은 2020년 3분기 누적 3438억원에서 올 3분기 누적 9947억원으로 189.3% 증가했다. 영업이익은 716억원에서 2930억원으로 309.2% 급증했다. 휴젤은 보툴리눔톡신·필러 중심 고마진 포트폴리오를 기반으로 비약적으로 성장한 대표 기업이다. 보툴리눔 톡신제 '보툴렉스'와 히알루론산(HA) 필러 '더채움'이 대표 제품이다. 올 3분기 이 회사 매출은 3060억원으로 5년 전 대비 113.1% 증가했고 영업이익은 502억원에서 1430억원으로 184% 급증했다. 재생의학 기반 연어·복어 DNA(PN·PDRN) 주사제와 에스테틱 의료기기를 주력으로 하는 파마리서치도 최근 5년간 비급여 기업 중 가장 가파른 성장세를 보인 업체 중 하나다. 매출은 2020년 3분기 775억원에서 올 3분기 3929억원으로 407% 증가했고 영업이익은 221억원에서 1625억원으로 7배 이상 증가했다. PN·PDRN 피부재생 시술 확산과 의료기기·화장품 부문의 급격한 성장, 해외 매출 증가가 맞물리며 실적 증가세를 이끌었다는 분석이다. 위탁개발생산(CDMO) 업체 삼성바이오로직스는 비급여 기업 중 외형 측면에서 사실상 시장을 압도하는 존재일 뿐만 아니라 급여 의약품 중심 제약사와는 비교 자체가 어려울 만큼 외형과 성장 속도에서 격차를 벌린 기업이다. 삼성바이오로직스 매출은 2020년 3분기 7895억원에서 올 3분기 4조2484억원으로 438.1% 증가했고 영업이익은 2,002억원에서 1조6911억원으로 745% 급증했다. 결국 소수 비급여 대형 기업의 급격한 외형 확장이 전체 실적 평균을 끌어올리면서 산업 전반이 성장한 것처럼 보이는 '착시 효과'가 발생했다고 볼 수 있는 셈이다. 영업이익률을 놓고 보면 비급여 의약품 중심 업체와 급여 의약품 중심 업체 간 온도차가 더욱 극명하다. 비급여 의약품 중심 기업의 평균 영업이익률은 2020년 20.8%에서 2025년 29.5%로 증가, 고마진 사업 구조가 더 공고해졌다. 반면 급여 의존도가 높은 전통 제약사의 평균 영업이익률은 같은 기간 6.6%에서 6.3%로 떨어지면서 수익성이 되레 후퇴한 것으로 나타났다. 비급여 의약품 대표 기업인 휴젤의 경우 올 3분기 누적 기준 영업이익률이 46.7%에 달한다. 이는 매출 절반 가까이를 이익으로 남기는 구조라는 얘기다. 이 같은 초고수익 구조는 급여 의약품 중심 기업에서는 찾아보기 어렵다. 매출 1위인 유한양행만 보더라도 올해 3분기 누적 기준 매출이 1조6406억원에 달하지만 영업이익률은 4%대에 머무른다. 유한양행은 국내 제약사 중 가장 큰 외형을 갖고 있는 데다 국내 첫 미국 식품의약국(FDA) 허가 항암신약 '렉라자'(레이저티닙)를 보유했음에도 한 자릿수 초반의 수익성에 머물고 있는 것이다. 수익성 악화에 영업직 내보내고 CSO 전환…"약가 인하 시 생존 위태 급여 의약품 중심 제약사 내부에서도 양극화 현상이 뚜렷하게 나타났다. 급여 의약품 중심 제약사 가운데 상위 20개사의 평균 매출은 2020년 3분기 3495억원에서 2025년 3분기 5074억원으로 45.2% 증가했지만 하위 20개사는 2647억원에서 3554억원으로 34.3% 증가하는 데 머물렀다. 수익성 측면에서는 격차가 한층 뚜렷해진다. 상위 20개사는 영업이익이 2020년 3분기 254억원에서 올 3분기 477억원으로 88.1% 증가했다. 그러나 같은 기간 하위 20개사는 153억원에서 68억원으로 55.5% 감소했다. 급여 의약품 중심 제약사 가운데 영업이익률 10% 이상을 기록한 기업은 2020년 14곳에서 올해 9곳으로 줄어들며 고수익 구조를 유지하는 기업이 크게 감소했다. 전체 40개 급여 중심 제약사 중 절반이 넘는 21곳(52.5%)은 5년 전보다 영업이익이 오히려 감소한 것으로 나타났고 이 가운데 3곳은 올해 3분기 누적 기준 영업적자를 기록했다. 하위권 기업의 평균 영업이익률 역시 5.8%에서 1.9%로 추락해 수익 기반이 거의 무너진 상태다. 특히 급여 의약품 중심 제약사 중 하위권 업체의 경우 영업이익률이 1%대에 그치거나 1%에도 미치지 못하는 곳이 수두룩했다. 동화약품·광동제약·경보제약·알리코제약·삼천당제약 등 기업이 1%대 영업이익률을 기록했다. 이들 기업의 경우 100원을 팔아도 1원조차 남기기 어려운 구조라는 얘기다. HLB제약(0.2%)과 동아에스티(0.6%)는 영업이익률이 1% 아래로 떨어졌다. 수익성이 한 자릿수 초반까지 무너진 업체가 늘어나는 가운데 한독·대원제약·삼일제약 등 적자 기업까지 증가하면서 급여 의약품 중심 제약사의 수익성 둔화 속도가 업계가 우려한 수준을 넘어섰다는 분석이 나온다. 수익성 급락에 직면한 중견·중소 제약사들은 비용 구조를 재편하며 생존을 모색 중이다. 이들 기업은 고정비 부담이 큰 정규직 영업사원(MR) 조직 유지가 어려워진 데 따라 조직 규모 감축에 나섰고 그 빈자리를 판매 실적 기반으로 수수료를 지급하는 CSO로 빠르게 전환하는 움직임이 확산하고 있다. CSO는 제약사가 직접 MR을 고용하지 않고 영업을 외부 조직에 위탁하는 방식으로 급여·4대보험·차량·교육·관리비 등 고정 인건비를 통째로 덜어낼 수 있는 구조다. 다만 외부 인력에 의존하는 만큼 영업 품질 저하나 컴플라이언스 리스크가 뒤따를 수 있다는 한계도 존재한다. 그럼에도 기업들은 CSO 활용을 생존을 위한 불가피한 선택으로 받아들이고 있는 것이다. 이런 상황에서 정부가 제네릭 약가 추가 인하와 기준요건 강화, 급여 적정성 재평가 확대 등을 다시 추진하면서 업계의 위기감은 더욱 고조되는 분위기다. 정부는 제네릭 약가를 일괄적으로 낮추고 급여 적정성 재평가 범위를 확대하는 약가 개편안을 추진 중이다. 제네릭 약가를 추가로 인하하고 급여 기준을 촘촘하게 재정비해 건강보험 재정 절감 효과를 극대화하겠다는 구상이다. 업계에서는 산업 전반의 수익성이 이미 급격히 떨어진 상황에서 약가가 한 번 더 떨어지면 매출 원천 자체가 흔들릴 수밖에 없다는 우려가 제기된다. 정부가 내세우는 건강보험 재정 안정화라는 명분에 비해 실제 현장에서 제조 기반 약화와 고용 축소 등 부작용이 더 클 수 있다는 점에서 업계 반발이 커지고 있다. 특히 정규직 생산·영업 인력을 줄이고 외부 인력으로 대체하는 흐름이 가속화하면서 약가 인하가 결국 제약산업의 일자리 감소로 직결될 것이라는 위기감도 커지고 있다. 실제 현장에서는 약가·원가 압박이 고용 축소로 직결되는 흐름이 명확하게 관찰된다. 주요 중소 제약사의 인력 변동을 분석한 결과 서울제약은 2020년 3분기 201명에서 올해 3분기 87명으로 56.7% 감소하며 절반 이하 수준으로 축소됐다. 서울제약은 자체 영업조직을 대폭 줄이고 CSO 단독 영업 체제로 전환한 대표적 사례다. 명문제약도 같은 기간 522명에서 305명으로 약 41.6% 줄었고 일성신약 역시 226명에서 182명으로 19.5% 감소하며 축소 기조를 이어가고 있다. 국제약품 역시 직원 수가 2020년 상반기 435명에서 올해 상반기 260명으로 40% 가까이 감소했다. 이들 기업은 모두 현재 CSO와 자체 영업조직을 병행하는 구조로, 고정 인건비 부담을 줄이기 위해 MR 축소와 CSO 활용 비중 확대를 동시에 진행 중이다. 무엇보다 이번 약가 인하는 중소 제약사에 직격탄이 될 것이라는 지적이다. 이들 기업은 고정비 비중이 높은 제네릭 사업에 집중돼 있어 제품 단가가 조금만 떨어져도 영업이익이 즉각 훼손되는 구조다. 동일 성분 제네릭이 수십 종씩 경쟁하는 과당 경쟁 시장에서는 약가가 소폭만 내려가도 거래처 확보, 유통 마진, 약국 공급, GMP 규제 등 각종 비용을 감당하기 어려워지기 때문이다. 업계 한 관계자는 "최근 제네릭 중심 제약사들은 치솟는 원가 구조와 약가인하로 수익성이 사실상 붕괴된 수준이다"라면서 "이런 구조적 취약성 속에서 추가로 약가가 떨어지면 중소 기업은 더 이상 대응 여력이 없다"라고 토로했다.약가제도 개편과 위기의 제약업계(1)2025-11-25 06:20:22차지현 -
 내년 307개 주사제 등 무균제제 동등성 재평가 본격화[데일리팜=이탁순 기자] 의약품 동등성 의무화 품목 확대에 따라 내년부터 기허가 무균제제에 대한 동등성 재평가가 본격화된다. 3년에 걸쳐 무균제제 재평가가 진행되는 가운데 내년에는 307개 품목이 대상으로 선정됐다. 아세트아미노펜 등 주사제가 포함돼 있고, 휴온스가 21개 품목으로 가장 많았다. 식품의약품안전처는 20일 '2026년도 의약품 동등성 재평가 실시' 내용과 대상을 공고했다. 대상 품목은 기허가 품목 중 용액주사제(분류번호 100, 200)로, 동등성 미입증 103개사 307개 품목이다. 지난 7월 사전 예시된 품목 386개 중 대조약 공고, 동등성 기입증 품목은 제외됐다. 대상품목으로 선정된 제약사는 품목별로 승인된 계획서에 따라 생물학적동등성시험 결과보고서(생체외 시험 대상인 경우에는 이화학적등성성시험 등 생체외 시험 결과보고서)를 제출해야 한다. 재평가 신청서 및 생물학적동등성시험 계획서는 내년 3월 31일까지, 재평가 신청서 및 이화확적동등성시험 등 생체외 시험 결과보고서는 내년 6월 30일까지, 생물학적동등성시험 결과보고서는 내년 12월 31일까지 제출해야 한다. 생물학적동등성시험 또는 생체외 시험을 이미 완료한 업체는 결과보고서를 내년 3월 31일까지 제출하라고 식약처는 지시했다. 내년 대상품목인 용액주사제는 대부분 이화학적동등성시험 결과보고서를 제출할 것으로 전망된다. 이화학적동등성시험은 대조약과 시험약의 제형을 고려한 pH, 비중 또는 밀도, 삼투압, 점도 등 물리화학적 특성이 동등한 수준임을 입증하기 위해 실시하는 생체 외 시험(in vitro)이다. 주사제, 점안제, 점이제로 원료약품의 종류 및 농도가 이미 허가 신고사항과 동일한 제제는 이화학적동등성시험 자료로 생물학적동등성 시험 자료나 비교 임상시험성적에 관한 자료를 갈음할 수 있다. 동등성 재평가는 식약처가 지난 2023년 10월부터 모든 전문의약품에 대해 동등성 입증을 의무화하면서 기허가 품목을 대상으로 진행되고 있다. 2023~2025년 경구용제(정제, 시럽제 등), 2026~2028년 무균제제(주사제, 점안제, 안연고제), 2029~2030년 흡입제, 외용제 등에 대해 순차적으로 진행된다. 내년 재평가 대상 품목을 보면, 아세트아미노펜 주사제가 16개 등으로 나타났다. 분류번호 100번(신경계감각기관용약)과 200번(기관계용약)의 품목들이다. 업체별로 보면, 휴온스가 21개, 제일제약이 19개, 하나제약 13개, 동광제약 12개 순으로 대상이 많았다. 식약처는 "타당한 사유 없이 제출일까지 재평가 신청서와 재평가에 필요한 자료를 제출하지 않는 경우 '약사법 제33조, 제42조 및 제76조'에 따라 행정처분 조치하겠다"고 밝혔다.2025-11-21 10:16:33이탁순
내년 307개 주사제 등 무균제제 동등성 재평가 본격화[데일리팜=이탁순 기자] 의약품 동등성 의무화 품목 확대에 따라 내년부터 기허가 무균제제에 대한 동등성 재평가가 본격화된다. 3년에 걸쳐 무균제제 재평가가 진행되는 가운데 내년에는 307개 품목이 대상으로 선정됐다. 아세트아미노펜 등 주사제가 포함돼 있고, 휴온스가 21개 품목으로 가장 많았다. 식품의약품안전처는 20일 '2026년도 의약품 동등성 재평가 실시' 내용과 대상을 공고했다. 대상 품목은 기허가 품목 중 용액주사제(분류번호 100, 200)로, 동등성 미입증 103개사 307개 품목이다. 지난 7월 사전 예시된 품목 386개 중 대조약 공고, 동등성 기입증 품목은 제외됐다. 대상품목으로 선정된 제약사는 품목별로 승인된 계획서에 따라 생물학적동등성시험 결과보고서(생체외 시험 대상인 경우에는 이화학적등성성시험 등 생체외 시험 결과보고서)를 제출해야 한다. 재평가 신청서 및 생물학적동등성시험 계획서는 내년 3월 31일까지, 재평가 신청서 및 이화확적동등성시험 등 생체외 시험 결과보고서는 내년 6월 30일까지, 생물학적동등성시험 결과보고서는 내년 12월 31일까지 제출해야 한다. 생물학적동등성시험 또는 생체외 시험을 이미 완료한 업체는 결과보고서를 내년 3월 31일까지 제출하라고 식약처는 지시했다. 내년 대상품목인 용액주사제는 대부분 이화학적동등성시험 결과보고서를 제출할 것으로 전망된다. 이화학적동등성시험은 대조약과 시험약의 제형을 고려한 pH, 비중 또는 밀도, 삼투압, 점도 등 물리화학적 특성이 동등한 수준임을 입증하기 위해 실시하는 생체 외 시험(in vitro)이다. 주사제, 점안제, 점이제로 원료약품의 종류 및 농도가 이미 허가 신고사항과 동일한 제제는 이화학적동등성시험 자료로 생물학적동등성 시험 자료나 비교 임상시험성적에 관한 자료를 갈음할 수 있다. 동등성 재평가는 식약처가 지난 2023년 10월부터 모든 전문의약품에 대해 동등성 입증을 의무화하면서 기허가 품목을 대상으로 진행되고 있다. 2023~2025년 경구용제(정제, 시럽제 등), 2026~2028년 무균제제(주사제, 점안제, 안연고제), 2029~2030년 흡입제, 외용제 등에 대해 순차적으로 진행된다. 내년 재평가 대상 품목을 보면, 아세트아미노펜 주사제가 16개 등으로 나타났다. 분류번호 100번(신경계감각기관용약)과 200번(기관계용약)의 품목들이다. 업체별로 보면, 휴온스가 21개, 제일제약이 19개, 하나제약 13개, 동광제약 12개 순으로 대상이 많았다. 식약처는 "타당한 사유 없이 제출일까지 재평가 신청서와 재평가에 필요한 자료를 제출하지 않는 경우 '약사법 제33조, 제42조 및 제76조'에 따라 행정처분 조치하겠다"고 밝혔다.2025-11-21 10:16:33이탁순 -
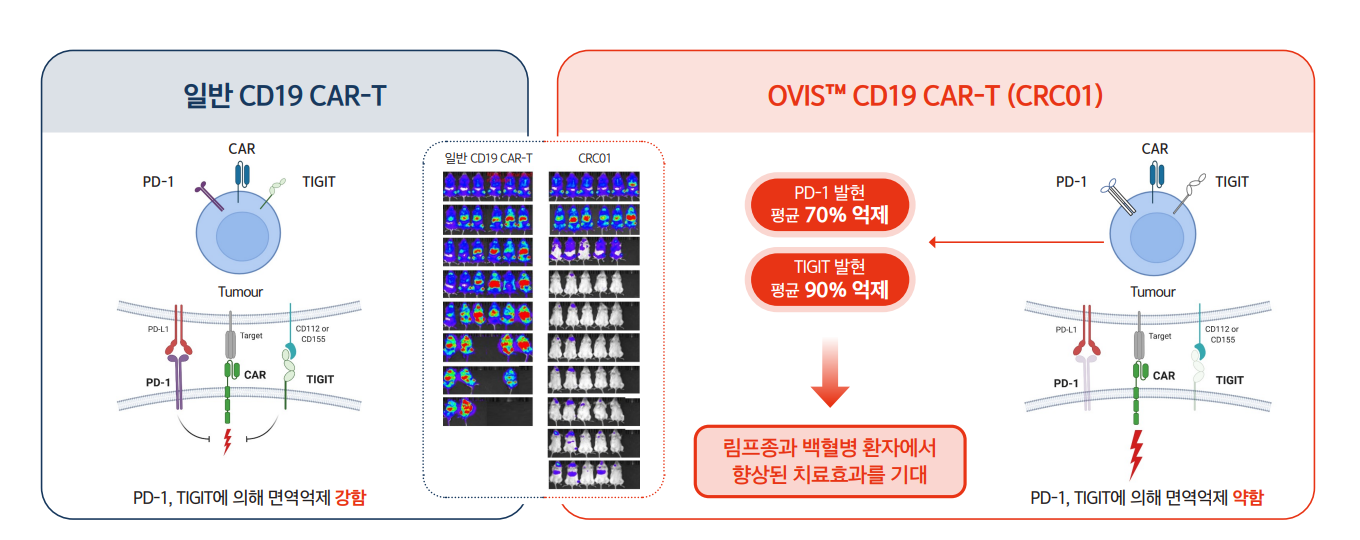 큐로셀, CAR-T 신약 개발 매진...올해 430억 조달[데일리팜=차지현 기자] 키메릭항원수용체 T세포(CAR-T) 치료제 개발 기업 큐로셀이 100억원 규모 전환사채(CB)를 발행한다. 올 초 330억원 규모 CB를 발행한 지 7개월 만에 또다시 자금 조달에 나섰다. 국산 CAR-T 치료제 상업화를 앞두고 대규모 지출이 발생하면서 재무 부담이 커진 데 따른 결정으로 풀이된다. 19일 금융감독원에 따르면 큐로셀은 지난 17일 이사회를 열고 3회차 무기명식 이권부 무보증 사모 CB 발행을 의결했다. CB는 주식과 채권의 성격을 모두 지닌 주식연계채권이다. 채권자가 회사에 돈을 빌려주고 이자를 받다가 주가가 오르면 주식으로 전환할 수 있다. 이번에 큐로셀이 발행하는 CB는 100억원 규모다. 하나벤처스가 운용하는 하나테크밸류업펀드2호가 물량을 인수하는 형태다. 해당 CB의 표면이자율은 0%, 만기이자율은 1%다. CB 전환가액은 4만1950원으로, CB 발행을 결정한 17일 큐로셀 종가 4만1900원보다 소폭 높다. 큐로셀은 2016년 설립된 세포유전자치료제 개발 기업이다. CAR-T 기술과 면역관문억제제 기술을 융합한 OVIS 플랫폼을 기반으로 차세대 CAR-T 치료제를 개발 중이다. 대표 파이프라인 '안발셀'(제품명 림가토)은 국내 최초 식품의약품안전처 임상 승인을 획득한 제품으로 작년 말 식약처에 품목허가 신청 후 연내 출시를 목표로 하고 있다. 큐로셀의 자금 조달은 올해 들어서만 두 번째다. 앞서 큐로셀은 지난 2월 330억원 규모 CB 발행을 결정했다. 이는 상장 당시 모집한 공모액 320억원을 웃도는 수준이다. 이번에 발행하는 CB까지 합하면 큐로셀은 코스닥 상장 이후 불과 2년도 채 되지 않아 430억원에 달하는 외부 투자를 추가 유치한 셈이다. 큐로셀이 CB 발행을 연이어 추진하는 배경에는 유동성 부족이 있다. 6월 말 기준 이 회사가 보유한 유동자산은 현금성자산 92억원을 포함해 325억원에 그친다. 반면 유동부채는 736억 원으로 집계됐다. 단기적으로 갚아야 할 빚이 당장 동원할 수 있는 자산보다 두 배 이상 많다는 얘기다. 재무구조도 취약하다. 매출이 전무한 상황에서 림가토 상업화 준비로 인해 각종 제반 비용이 늘면서 적자 폭이 지속해서 증가한 탓이다. 큐로셀은 올 상반기 연결기준 영업손실 184억원, 당기순손실 175억원을 기록했다. 전년 동기 대비 영업손실은 약 20억원 늘었고 순손실은 12억원가량 증가했다. 순손실이 이어지면서 결손금 규모도 불어났다. 큐로셀의 6월 말 기준 누적결손금은 2178억원에 달한다. 결손금이 자본을 갉아먹으면서 2023년 12월 말 591억원이었던 자본총계는 올 6월 말 294억원으로 반토막났다. 같은 시기 큐로셀 자본금은 72억원으로 현재 순손실 추세가 이어질 경우 1년 내 자본총계가 소진돼 자본잠식에 빠질 수 있는 상황이었다. 큐로셀은 지난 7월 자산재평가를 통해 재무구조 개선 효과를 꾀했지만 순손실 누적 규모가 워낙 커 그 효과는 제한적이었다. 큐로셀은 대전 유성구 구룡동 817-2에 위치한 본사 토지와 건물에 대한 자산재평가를 실시, 재평가잉여금으로 172억원을 인식했다. 자산재평가란 기업이 보유한 유형자산의 장부가치를 시장가치에 맞춰 조정하는 절차로 현금흐름에는 변화가 없지만 자본잠식 우려를 덜어주는 효과가 있다. 결과적으로 큐로셀은 이번 CB 발행으로 단기적으로 허가와 상업화 준비를 위한 현금을 확보하는 동시에 장기적으로 자본잠식 우려도 덜 수 있게 됐다. CB는 이자 지급과 원금 상환 의무가 있는 채권의 성격을 지니기 때문에 발행 시 회계상 부채로 분류된다. 하지만 향후 투자가가 CB를 주식으로 전환하면 해당 채권은 부채에서 소멸되고 그만큼 자본이 증가하게 된다. 재무 안정성을 강화한 큐로셀은 림카토주 상업화와 함께 파이프라인 확장에도 속도를 낼 계획이다. 큐로셀은 3회차 CB 사용 목적에서 루푸스 신염 치료제 개발에 45억원, T세포 림프종 치료제에 40억원, 바이러스 벡터 내재화에 15억원을 배정했다. 앞서 발행한 2회차 CB의 경우 안발셀 적응증 확장에 140억원, 신규 CAR-T 치료제 개발에 120억원 등을 투입하겠다고 제시한 바 있다.2025-09-19 12:00:04차지현
큐로셀, CAR-T 신약 개발 매진...올해 430억 조달[데일리팜=차지현 기자] 키메릭항원수용체 T세포(CAR-T) 치료제 개발 기업 큐로셀이 100억원 규모 전환사채(CB)를 발행한다. 올 초 330억원 규모 CB를 발행한 지 7개월 만에 또다시 자금 조달에 나섰다. 국산 CAR-T 치료제 상업화를 앞두고 대규모 지출이 발생하면서 재무 부담이 커진 데 따른 결정으로 풀이된다. 19일 금융감독원에 따르면 큐로셀은 지난 17일 이사회를 열고 3회차 무기명식 이권부 무보증 사모 CB 발행을 의결했다. CB는 주식과 채권의 성격을 모두 지닌 주식연계채권이다. 채권자가 회사에 돈을 빌려주고 이자를 받다가 주가가 오르면 주식으로 전환할 수 있다. 이번에 큐로셀이 발행하는 CB는 100억원 규모다. 하나벤처스가 운용하는 하나테크밸류업펀드2호가 물량을 인수하는 형태다. 해당 CB의 표면이자율은 0%, 만기이자율은 1%다. CB 전환가액은 4만1950원으로, CB 발행을 결정한 17일 큐로셀 종가 4만1900원보다 소폭 높다. 큐로셀은 2016년 설립된 세포유전자치료제 개발 기업이다. CAR-T 기술과 면역관문억제제 기술을 융합한 OVIS 플랫폼을 기반으로 차세대 CAR-T 치료제를 개발 중이다. 대표 파이프라인 '안발셀'(제품명 림가토)은 국내 최초 식품의약품안전처 임상 승인을 획득한 제품으로 작년 말 식약처에 품목허가 신청 후 연내 출시를 목표로 하고 있다. 큐로셀의 자금 조달은 올해 들어서만 두 번째다. 앞서 큐로셀은 지난 2월 330억원 규모 CB 발행을 결정했다. 이는 상장 당시 모집한 공모액 320억원을 웃도는 수준이다. 이번에 발행하는 CB까지 합하면 큐로셀은 코스닥 상장 이후 불과 2년도 채 되지 않아 430억원에 달하는 외부 투자를 추가 유치한 셈이다. 큐로셀이 CB 발행을 연이어 추진하는 배경에는 유동성 부족이 있다. 6월 말 기준 이 회사가 보유한 유동자산은 현금성자산 92억원을 포함해 325억원에 그친다. 반면 유동부채는 736억 원으로 집계됐다. 단기적으로 갚아야 할 빚이 당장 동원할 수 있는 자산보다 두 배 이상 많다는 얘기다. 재무구조도 취약하다. 매출이 전무한 상황에서 림가토 상업화 준비로 인해 각종 제반 비용이 늘면서 적자 폭이 지속해서 증가한 탓이다. 큐로셀은 올 상반기 연결기준 영업손실 184억원, 당기순손실 175억원을 기록했다. 전년 동기 대비 영업손실은 약 20억원 늘었고 순손실은 12억원가량 증가했다. 순손실이 이어지면서 결손금 규모도 불어났다. 큐로셀의 6월 말 기준 누적결손금은 2178억원에 달한다. 결손금이 자본을 갉아먹으면서 2023년 12월 말 591억원이었던 자본총계는 올 6월 말 294억원으로 반토막났다. 같은 시기 큐로셀 자본금은 72억원으로 현재 순손실 추세가 이어질 경우 1년 내 자본총계가 소진돼 자본잠식에 빠질 수 있는 상황이었다. 큐로셀은 지난 7월 자산재평가를 통해 재무구조 개선 효과를 꾀했지만 순손실 누적 규모가 워낙 커 그 효과는 제한적이었다. 큐로셀은 대전 유성구 구룡동 817-2에 위치한 본사 토지와 건물에 대한 자산재평가를 실시, 재평가잉여금으로 172억원을 인식했다. 자산재평가란 기업이 보유한 유형자산의 장부가치를 시장가치에 맞춰 조정하는 절차로 현금흐름에는 변화가 없지만 자본잠식 우려를 덜어주는 효과가 있다. 결과적으로 큐로셀은 이번 CB 발행으로 단기적으로 허가와 상업화 준비를 위한 현금을 확보하는 동시에 장기적으로 자본잠식 우려도 덜 수 있게 됐다. CB는 이자 지급과 원금 상환 의무가 있는 채권의 성격을 지니기 때문에 발행 시 회계상 부채로 분류된다. 하지만 향후 투자가가 CB를 주식으로 전환하면 해당 채권은 부채에서 소멸되고 그만큼 자본이 증가하게 된다. 재무 안정성을 강화한 큐로셀은 림카토주 상업화와 함께 파이프라인 확장에도 속도를 낼 계획이다. 큐로셀은 3회차 CB 사용 목적에서 루푸스 신염 치료제 개발에 45억원, T세포 림프종 치료제에 40억원, 바이러스 벡터 내재화에 15억원을 배정했다. 앞서 발행한 2회차 CB의 경우 안발셀 적응증 확장에 140억원, 신규 CAR-T 치료제 개발에 120억원 등을 투입하겠다고 제시한 바 있다.2025-09-19 12:00:04차지현 -
 올드드럭의 이유있는 기지개...은행엽 처방시장 '껑충'[데일리팜=천승현 기자] 은행엽제제의 처방 시장이 지속적으로 커지고 있다. 지난 5년간 외래 처방시장이 60% 이상 확대됐다. 고령화에 따른 노인 인구 증가로 치매성 증상 치료 수요가 높아졌다는 분석이다. 뇌기능개선제 콜린알포세레이트(콜린제제)의 임상재평가 실패와 급여 축소 등을 대비해 대체 약물로 육성하려는 제약사들의 공략도 시장 확장의 요인으로 지목된다. 14일 의약품 조사기관 유비스트에 따르면 지난 상반기 은행엽건조엑스 성분 의약품의 외래 처방시장 규모는 406억원으로 전년동기보다 14.5% 증가했다. 은행엽건조엑스 처방액은 1분기 195억원으로 전년대비 12.4% 늘었고 2분기에는 211억원으로 16.6% 증가하며 꾸준한 성장세를 나타냈다. 은행엽건조엑스는 이명(귀울림), 두통, 기억력감퇴, 집중력장애, 우울감, 어지러움 등의 치매성증상을 수반하는 기질성 뇌기능장애의 치료 등에 사용되는 일반의약품이다. 건강보험 급여 적용으로 처방 시장에서도 광범위하게 처방된다. 은행엽건조엑스는 지난 1991년 첫 제품 기넥신에프가 허가받은지 30년이 넘었지만 최근 성장세가 가팔랐다. 지난 2분기 은행엽건조엑스의 처방액은 역대 최대 규모다. 2020년 2분기 128억원과 비교하면 지난 5년간 64.4% 치솟았다. 고령화로 인한 노인 인구 증가로 기억력감퇴 등 뇌기능장애 용도 수요가 증가하면서 은행엽건조엑스 처방 시장이 지속적으로 확대된 것으로 분석된다. 뇌기능개선제로 가장 많이 사용되는 콜린제제의 시장 철수를 대비해 제약사들이 은행엽건조엑스 처방 시장을 적극 공략하면서 시장 규모가 커졌다는 진단도 나온다. 콜린제제는 효능 논란이 불거지자 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사들은 재평가 임상시험에 착수했다. 콜린제제의 임상재평가는 종근당과 대웅바이오의 주도로 진행 중이다. 종근당이 퇴행성 경도인지장애와 혈관성 경도인지장애 임상시험을 각각 수행하고, 대웅바이오가 치매 환자 대상 임상시험을 진행하는 방식이다. 종근당이 진행하는 경도인지장애 환자 대상 임상시험의 경우 종료시한이 3년 9개월로 설정됐다. 대웅바이오의 알츠하이머 환자 대상 임상시험의 경우 4년 6개월 이내에 마무리해야 한다. 종근당의 퇴행성 경도인지장애 재평가 임상의 경우 2025년 3월 종료가 예정됐다. 식약처는 혈관성 경도인지장애의 임상시험 결과보고서 자료 제출 기한을 1년 3개월 연장했다. 퇴행성 경도인지장애와 알츠하이머 임상재평가는 각각 2년 연장됐다. 이르면 내년 하반기부터 순차적으로 임상시험 적응증에 대한 적합 여부가 판가름날 전망이다. 콜린제제의 시장 철수 우려가 확산하기 시작하면서 은행엽건조엑스의 처방 시장 성장세는 더욱 높아졌다. 은행엽건조엑스는 지난 2023년 1분기 처방액이 158억원으로 전 분기보다 0.5% 감소한 이후 지난해 4분기까지 7분기 연속 신기록을 경신하며 상승세를 지속했다. 지난 1분기 처방액이 195억원으로 전 분기보다 2.7% 감소했지만 2분기에 상승세를 되찾으며 역대 처음으로 분기 처방액 200억원을 넘어섰다. SK케미칼의 기넥신에프는 상반기 처방금액이 153억원으로 전년보다 11.8% 증가했다. 기넥신에프는 2022년 2분기 처방액 57억원에서 3년 만에 38.8% 확대됐다. 유유제약의 타나민은 상반기 처방액이 68억원으로 작년 같은 기간보다 10.7% 늘었다. 타나민은 1분기 처방액이 33억원으로 전년보다 9.9% 증가했고 2분기에는 35억원으로 11.3%의 성장률을 나타냈다. 콜린제제의 급여 축소 예고도 은행엽건조엑스의 처방 증가 요인으로 지목된다. 보건복지부는 2020년 8월 콜린제제의 새로운 급여 기준 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다. 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용이다. 제약사들은 콜린제제 급여 축소의 부당함을 따지는 취소 소송을 제기했다. 소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다. 종근당 그룹은 지난 3월 대법원 최종 판결에서 고배를 들었다. 종근당 그룹은 지난 2022년 7월 1심에서 패소 판결을 받았고 항소심에서도 지난해 5월 기각 판결이 내려졌다. 종근당 등은 지난해 6월 상고심을 제기했고 대법원에서도 기각 판결이 내려졌다. 종근당 등의 콜린제제 급여축소 취소소송이 최종 패소했지만 급여축소 효력이 즉각 발생하지 않은 상태다. 대웅바이오 그룹이 인용 판결을 받은 집행정지가 여전히 유효하기 때문이다. 대웅바이오 그룹은 2심 선고일부터 30일까지 급여축소 효력 집행정지 판결을 받은 바 있다. 서울고등법원은 오는 21일 대웅바이오 그룹의 급여축소 최소소송 항소심을 선고할 예정이다. 향후 대웅바이오 그룹의 2심 재판부에서도 변론 재개 이후 종근당 그룹의 대법원 판결과 같은 취지의 선고를 결정하는 시나리오가 유력하다. 대웅바이오 그룹이 항소심에서 패소 판결이 결정되면 급여 축소가 시행될 가능성이 제기된다. 콜린제제의 급여 축소 시행으로 환자들의 약값 부담이 커지면 처방 기피로 이어질 수 있어 상대적으로 저렴한 은행엽건조엑스의 수요가 더욱 커질 것이란 전망도 나온다. 은행엽건조엑스는 최대 용량 240mg의 보험상한가가 185원에 불과하다. 은행엽건조엑스 최소 용량 40mg의 최저가는 52원이다. 제약사들은 최근 들어 은행엽건조엑스 시장이 새롭게 진출하는 분위기다. 올해 들어 건일바이오팜, 한미약품, 신일제약, 환인제약, 일동제약, 동아제약, 한풍제약, 코오롱제약, 중헌제약, 메딕스제약, 한국팜비오 등이 은행엽건조엑스제제를 신규 허가받았다. 은행엽건조엑스는 정부의 급여재평가에서 생존하면서 추후 급여 삭제 리스크는 낮은 상태다. 은행엽건조엑스는 지난 2021년 급여재평가 대상으로 분류됐다. 보건복지부는 ▲포도씨추출물비티스비니페라(포도씨 및 포도엽 추출물) ▲아보카도-소야 ▲은행엽건조엑스 ▲빌베리건조엑스 ▲실리마린(밀크씨슬추출물) 등 5개 성분 의약품에 대해 급여 적정성을 따지는 재평가를 추진하겠다는 방침을 발표했다. 은행엽엑스는 경구제와 주사제의 해외 등재현황이 달라 급여재평가 진행 여부에 대한 논란이 제기됐다. 경구제는 독일과 스위스에 등재됐는데 주사제는 해외에서 등재된 국가가 없다. 청구액 5억원 규모인 주사제는 2종 모두 품목허가를 취하했고 경구제는 해외 등재국가가 있다는 이유로 급여재평가 대상에서 제외됐다.2025-08-14 12:00:53천승현
올드드럭의 이유있는 기지개...은행엽 처방시장 '껑충'[데일리팜=천승현 기자] 은행엽제제의 처방 시장이 지속적으로 커지고 있다. 지난 5년간 외래 처방시장이 60% 이상 확대됐다. 고령화에 따른 노인 인구 증가로 치매성 증상 치료 수요가 높아졌다는 분석이다. 뇌기능개선제 콜린알포세레이트(콜린제제)의 임상재평가 실패와 급여 축소 등을 대비해 대체 약물로 육성하려는 제약사들의 공략도 시장 확장의 요인으로 지목된다. 14일 의약품 조사기관 유비스트에 따르면 지난 상반기 은행엽건조엑스 성분 의약품의 외래 처방시장 규모는 406억원으로 전년동기보다 14.5% 증가했다. 은행엽건조엑스 처방액은 1분기 195억원으로 전년대비 12.4% 늘었고 2분기에는 211억원으로 16.6% 증가하며 꾸준한 성장세를 나타냈다. 은행엽건조엑스는 이명(귀울림), 두통, 기억력감퇴, 집중력장애, 우울감, 어지러움 등의 치매성증상을 수반하는 기질성 뇌기능장애의 치료 등에 사용되는 일반의약품이다. 건강보험 급여 적용으로 처방 시장에서도 광범위하게 처방된다. 은행엽건조엑스는 지난 1991년 첫 제품 기넥신에프가 허가받은지 30년이 넘었지만 최근 성장세가 가팔랐다. 지난 2분기 은행엽건조엑스의 처방액은 역대 최대 규모다. 2020년 2분기 128억원과 비교하면 지난 5년간 64.4% 치솟았다. 고령화로 인한 노인 인구 증가로 기억력감퇴 등 뇌기능장애 용도 수요가 증가하면서 은행엽건조엑스 처방 시장이 지속적으로 확대된 것으로 분석된다. 뇌기능개선제로 가장 많이 사용되는 콜린제제의 시장 철수를 대비해 제약사들이 은행엽건조엑스 처방 시장을 적극 공략하면서 시장 규모가 커졌다는 진단도 나온다. 콜린제제는 효능 논란이 불거지자 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사들은 재평가 임상시험에 착수했다. 콜린제제의 임상재평가는 종근당과 대웅바이오의 주도로 진행 중이다. 종근당이 퇴행성 경도인지장애와 혈관성 경도인지장애 임상시험을 각각 수행하고, 대웅바이오가 치매 환자 대상 임상시험을 진행하는 방식이다. 종근당이 진행하는 경도인지장애 환자 대상 임상시험의 경우 종료시한이 3년 9개월로 설정됐다. 대웅바이오의 알츠하이머 환자 대상 임상시험의 경우 4년 6개월 이내에 마무리해야 한다. 종근당의 퇴행성 경도인지장애 재평가 임상의 경우 2025년 3월 종료가 예정됐다. 식약처는 혈관성 경도인지장애의 임상시험 결과보고서 자료 제출 기한을 1년 3개월 연장했다. 퇴행성 경도인지장애와 알츠하이머 임상재평가는 각각 2년 연장됐다. 이르면 내년 하반기부터 순차적으로 임상시험 적응증에 대한 적합 여부가 판가름날 전망이다. 콜린제제의 시장 철수 우려가 확산하기 시작하면서 은행엽건조엑스의 처방 시장 성장세는 더욱 높아졌다. 은행엽건조엑스는 지난 2023년 1분기 처방액이 158억원으로 전 분기보다 0.5% 감소한 이후 지난해 4분기까지 7분기 연속 신기록을 경신하며 상승세를 지속했다. 지난 1분기 처방액이 195억원으로 전 분기보다 2.7% 감소했지만 2분기에 상승세를 되찾으며 역대 처음으로 분기 처방액 200억원을 넘어섰다. SK케미칼의 기넥신에프는 상반기 처방금액이 153억원으로 전년보다 11.8% 증가했다. 기넥신에프는 2022년 2분기 처방액 57억원에서 3년 만에 38.8% 확대됐다. 유유제약의 타나민은 상반기 처방액이 68억원으로 작년 같은 기간보다 10.7% 늘었다. 타나민은 1분기 처방액이 33억원으로 전년보다 9.9% 증가했고 2분기에는 35억원으로 11.3%의 성장률을 나타냈다. 콜린제제의 급여 축소 예고도 은행엽건조엑스의 처방 증가 요인으로 지목된다. 보건복지부는 2020년 8월 콜린제제의 새로운 급여 기준 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다. 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용이다. 제약사들은 콜린제제 급여 축소의 부당함을 따지는 취소 소송을 제기했다. 소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다. 종근당 그룹은 지난 3월 대법원 최종 판결에서 고배를 들었다. 종근당 그룹은 지난 2022년 7월 1심에서 패소 판결을 받았고 항소심에서도 지난해 5월 기각 판결이 내려졌다. 종근당 등은 지난해 6월 상고심을 제기했고 대법원에서도 기각 판결이 내려졌다. 종근당 등의 콜린제제 급여축소 취소소송이 최종 패소했지만 급여축소 효력이 즉각 발생하지 않은 상태다. 대웅바이오 그룹이 인용 판결을 받은 집행정지가 여전히 유효하기 때문이다. 대웅바이오 그룹은 2심 선고일부터 30일까지 급여축소 효력 집행정지 판결을 받은 바 있다. 서울고등법원은 오는 21일 대웅바이오 그룹의 급여축소 최소소송 항소심을 선고할 예정이다. 향후 대웅바이오 그룹의 2심 재판부에서도 변론 재개 이후 종근당 그룹의 대법원 판결과 같은 취지의 선고를 결정하는 시나리오가 유력하다. 대웅바이오 그룹이 항소심에서 패소 판결이 결정되면 급여 축소가 시행될 가능성이 제기된다. 콜린제제의 급여 축소 시행으로 환자들의 약값 부담이 커지면 처방 기피로 이어질 수 있어 상대적으로 저렴한 은행엽건조엑스의 수요가 더욱 커질 것이란 전망도 나온다. 은행엽건조엑스는 최대 용량 240mg의 보험상한가가 185원에 불과하다. 은행엽건조엑스 최소 용량 40mg의 최저가는 52원이다. 제약사들은 최근 들어 은행엽건조엑스 시장이 새롭게 진출하는 분위기다. 올해 들어 건일바이오팜, 한미약품, 신일제약, 환인제약, 일동제약, 동아제약, 한풍제약, 코오롱제약, 중헌제약, 메딕스제약, 한국팜비오 등이 은행엽건조엑스제제를 신규 허가받았다. 은행엽건조엑스는 정부의 급여재평가에서 생존하면서 추후 급여 삭제 리스크는 낮은 상태다. 은행엽건조엑스는 지난 2021년 급여재평가 대상으로 분류됐다. 보건복지부는 ▲포도씨추출물비티스비니페라(포도씨 및 포도엽 추출물) ▲아보카도-소야 ▲은행엽건조엑스 ▲빌베리건조엑스 ▲실리마린(밀크씨슬추출물) 등 5개 성분 의약품에 대해 급여 적정성을 따지는 재평가를 추진하겠다는 방침을 발표했다. 은행엽엑스는 경구제와 주사제의 해외 등재현황이 달라 급여재평가 진행 여부에 대한 논란이 제기됐다. 경구제는 독일과 스위스에 등재됐는데 주사제는 해외에서 등재된 국가가 없다. 청구액 5억원 규모인 주사제는 2종 모두 품목허가를 취하했고 경구제는 해외 등재국가가 있다는 이유로 급여재평가 대상에서 제외됐다.2025-08-14 12:00:53천승현 -
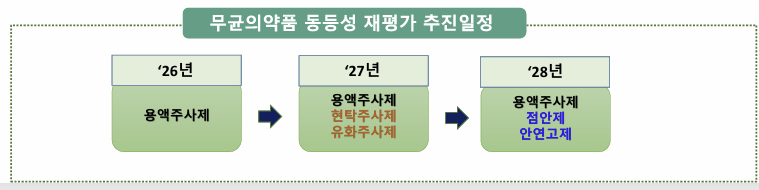 내년 무균제제 재평가, 용액주사제 386품목 사전안내[데일리팜=이혜경 기자] 식품의약품안전처가 내년부터 향후 3년 동안 진행할 의약품 동등성 재평가 품목을 사전 안내했다. 23일 식약처는 '의약품 재평가 실시에 관한 규정' 등에 따라 의약품 동등성 재평가를 추진 중에 있다면서 2026년부터 2028년까지 실시되는 품목을 사전 안내한다고 밝혔다. 내년부터는 무균제제 의약품에 대한 재평가가 진행되며, 생동시험과 이동시험법 확립 기간을 고려해 시험법이 확립된 제형부터 단계적으로 적용된다. 추진일정을 보면 내년에는 용액주사제(분류번호 100, 200)를 대상으로 하고, 2027년에는 용액주사제(분류번호 400(431 제외), 600, 700, 800), 현탁/유화주사제, 2028년에는 용액주사제(분류번호 300, 431), 점안제, 안연고제 등의 순으로 진행된다. 분류번호에 따라 100(신경계감각기관용약), 200(기관계용약), 300(대사성약), 400(조직세포기능용약), 431(방사성의약품), 600(항병원생물성약), 700(주목적이 치료가 아닌 약), 800(마약) 등이 있다. 구체적인 사전예시 품목수를 보면 2026년 386품목, 2027년 401품목, 2028년 747품목이 대상이 된다. 여기에 식약처는 내년에 한해 이동시험결과 제출기한을 당해년도 1분기(3월)에서 2분기(6월)로 연장할 계획이다. 또한 업계 사전 재평가 준비를 위해 재평가 일정 예측성을 강화하도록 3개년 재평가 대상 품목을 당초 전년도 12월에서 10월로 단축해 발표하게 된다. 한편 앞서 진행된 의약품 동등성 재평가의 경우 지난 2023년 진행된 정제(나정)의 경우 264개 품목을 대상으로 진행돼 154개 품목이 적합 판정을 받아 완료됐다. 다만 2024년 시행된 정제(필름코팅정)의 경우 464개 품목을 대상으로 진행 중(95%)이며, 올해 시행된 캡슐제/시럽제 및 액제는 390개 품목을 대상으로 진행 중(52%)이다.2025-07-24 09:39:25이혜경
내년 무균제제 재평가, 용액주사제 386품목 사전안내[데일리팜=이혜경 기자] 식품의약품안전처가 내년부터 향후 3년 동안 진행할 의약품 동등성 재평가 품목을 사전 안내했다. 23일 식약처는 '의약품 재평가 실시에 관한 규정' 등에 따라 의약품 동등성 재평가를 추진 중에 있다면서 2026년부터 2028년까지 실시되는 품목을 사전 안내한다고 밝혔다. 내년부터는 무균제제 의약품에 대한 재평가가 진행되며, 생동시험과 이동시험법 확립 기간을 고려해 시험법이 확립된 제형부터 단계적으로 적용된다. 추진일정을 보면 내년에는 용액주사제(분류번호 100, 200)를 대상으로 하고, 2027년에는 용액주사제(분류번호 400(431 제외), 600, 700, 800), 현탁/유화주사제, 2028년에는 용액주사제(분류번호 300, 431), 점안제, 안연고제 등의 순으로 진행된다. 분류번호에 따라 100(신경계감각기관용약), 200(기관계용약), 300(대사성약), 400(조직세포기능용약), 431(방사성의약품), 600(항병원생물성약), 700(주목적이 치료가 아닌 약), 800(마약) 등이 있다. 구체적인 사전예시 품목수를 보면 2026년 386품목, 2027년 401품목, 2028년 747품목이 대상이 된다. 여기에 식약처는 내년에 한해 이동시험결과 제출기한을 당해년도 1분기(3월)에서 2분기(6월)로 연장할 계획이다. 또한 업계 사전 재평가 준비를 위해 재평가 일정 예측성을 강화하도록 3개년 재평가 대상 품목을 당초 전년도 12월에서 10월로 단축해 발표하게 된다. 한편 앞서 진행된 의약품 동등성 재평가의 경우 지난 2023년 진행된 정제(나정)의 경우 264개 품목을 대상으로 진행돼 154개 품목이 적합 판정을 받아 완료됐다. 다만 2024년 시행된 정제(필름코팅정)의 경우 464개 품목을 대상으로 진행 중(95%)이며, 올해 시행된 캡슐제/시럽제 및 액제는 390개 품목을 대상으로 진행 중(52%)이다.2025-07-24 09:39:25이혜경 -
 식약처, 건강기능식품 원료 기준·규격 강화 추진[데일리팜=이혜경 기자] 식품의약품안전처(처장 오유경)는 가르시니아캄보지아 추출물 등 일부 기능성 원료의 기준·규격을 강화하고 아연 등 건강기능식품 영양성분 제조에 사용 가능한 원료를 확대하는 내용 등을 담은 '건강기능식품의 기준 및 규격' 일부개정안을 23일 행정예고한다고 밝혔다. 이번 개정안은 국내 건강기능식품 산업의 활성화를 위해 합리적인 규제개선을 추진하는 한편, 건강기능식품 기능성 원료 재평가 결과를 반영하여 제조 및 섭취 시 주의사항을 신설하는 등 안전관리 강화를 위한 목적이다. 주요 개정 내용을 보면 ▲건강기능식품 기능성 원료 재평가 결과를 반영한 제조 ·섭취 시 주의사항 ▲건강기능식품 영양성분(아연·철) 제조 시 사용할 수 있는 원료 확대 등 규제 개선 ▲알로에 겔 제품 규격(요오드 전분 반응) 신설 등이다. 기능성 원료 재평가 결과 가르시니아캄보지아 추출물은 녹차추출물 등 체지방 감소 기능성을 가진 다른 원료와 함께 섭취할 경우 이상사례가 발생할 우려가 있는 것으로 나타났다. 따라서 가르시니아캄보지아 추출물을 제조할 때는 체지방 감소 기능성을 가진 다른 기능성 원료와 함께 제조하는 것을 금지하는 주의사항을 신설하고, 체지방 감소 기능성의 건강기능식품과 함께 섭취를 피하도록 하는 주의사항도 마련한다. 또한, 기능성 원료에 민감할 수 있는 연령층에 대한 주의 당부와 이상사례 보고 관리 강화를 위해 기능성 원료 섭취 시 주의해야 할 사항도 추가한다. Codex 등 국제기구나 외국에서는 영양성분의 원료로 사용하고 있는 '구연산아연(Zinc Citrate)'과 '당산제이철(Ferric Saccharate)'을 국내에서도 사용할 수 있도록 개정하여 영업자의 편의성을 강화한다. 아울러 개별인정형으로 인정받았던 유단백가수분해물의 기능성인 수면의 질 개선을 영업자 누구나 사용할 수 있는 고시형으로 전환해 관련 산업 활성화를 도모한다. 고시형 유단백가수분해물의 기능성의 경우 현행 스트레스로 인한 긴장 완화에 도움을 줄 수 있다고 돼 있지만 개정을 통해 스트레스로 인한 긴장 완화에 도움을 줄 수 있음, 수면의 질 개선에 도움을 줄 수 있다고 변경할 계획이다. 알로에 겔은 알로에 베라의 잎으로 제조해 지표성분인 총 다당체의 규격에 적합하게 관리하도록 규정하고 있으나, 다당체가 많이 함유된 전분류 등의 저가 원료를 혼합하여 제조할 우려가 있어, 관리 강화의 필요성이 있었다. 따라서 알로에 겔 원료 제품에 전분류 사용을 규제하기 위해 요오드 전분 반응(음성) 규격을 신설한다. 식약처는 앞으로도 안전하고 다양한 건강기능식품이 소비자에게 제공될 수 있도록 국민의 안전을 최우선으로 하는 한편, 건강기능식품 산업의 활성화를 위해 변화하는 유통·소비 환경에 맞춰 기준·규격 등을 합리적으로 개선할 예정이다. 자세한 내용은 식약처 홈페이지(www.mfds.go.kr> 법령·자료> 입법/행정예고)에서 확인할 수 있으며, 개정안에 대한 의견은 2025년 9월 22일까지 제출할 수 있다.2025-07-23 11:09:15이혜경
식약처, 건강기능식품 원료 기준·규격 강화 추진[데일리팜=이혜경 기자] 식품의약품안전처(처장 오유경)는 가르시니아캄보지아 추출물 등 일부 기능성 원료의 기준·규격을 강화하고 아연 등 건강기능식품 영양성분 제조에 사용 가능한 원료를 확대하는 내용 등을 담은 '건강기능식품의 기준 및 규격' 일부개정안을 23일 행정예고한다고 밝혔다. 이번 개정안은 국내 건강기능식품 산업의 활성화를 위해 합리적인 규제개선을 추진하는 한편, 건강기능식품 기능성 원료 재평가 결과를 반영하여 제조 및 섭취 시 주의사항을 신설하는 등 안전관리 강화를 위한 목적이다. 주요 개정 내용을 보면 ▲건강기능식품 기능성 원료 재평가 결과를 반영한 제조 ·섭취 시 주의사항 ▲건강기능식품 영양성분(아연·철) 제조 시 사용할 수 있는 원료 확대 등 규제 개선 ▲알로에 겔 제품 규격(요오드 전분 반응) 신설 등이다. 기능성 원료 재평가 결과 가르시니아캄보지아 추출물은 녹차추출물 등 체지방 감소 기능성을 가진 다른 원료와 함께 섭취할 경우 이상사례가 발생할 우려가 있는 것으로 나타났다. 따라서 가르시니아캄보지아 추출물을 제조할 때는 체지방 감소 기능성을 가진 다른 기능성 원료와 함께 제조하는 것을 금지하는 주의사항을 신설하고, 체지방 감소 기능성의 건강기능식품과 함께 섭취를 피하도록 하는 주의사항도 마련한다. 또한, 기능성 원료에 민감할 수 있는 연령층에 대한 주의 당부와 이상사례 보고 관리 강화를 위해 기능성 원료 섭취 시 주의해야 할 사항도 추가한다. Codex 등 국제기구나 외국에서는 영양성분의 원료로 사용하고 있는 '구연산아연(Zinc Citrate)'과 '당산제이철(Ferric Saccharate)'을 국내에서도 사용할 수 있도록 개정하여 영업자의 편의성을 강화한다. 아울러 개별인정형으로 인정받았던 유단백가수분해물의 기능성인 수면의 질 개선을 영업자 누구나 사용할 수 있는 고시형으로 전환해 관련 산업 활성화를 도모한다. 고시형 유단백가수분해물의 기능성의 경우 현행 스트레스로 인한 긴장 완화에 도움을 줄 수 있다고 돼 있지만 개정을 통해 스트레스로 인한 긴장 완화에 도움을 줄 수 있음, 수면의 질 개선에 도움을 줄 수 있다고 변경할 계획이다. 알로에 겔은 알로에 베라의 잎으로 제조해 지표성분인 총 다당체의 규격에 적합하게 관리하도록 규정하고 있으나, 다당체가 많이 함유된 전분류 등의 저가 원료를 혼합하여 제조할 우려가 있어, 관리 강화의 필요성이 있었다. 따라서 알로에 겔 원료 제품에 전분류 사용을 규제하기 위해 요오드 전분 반응(음성) 규격을 신설한다. 식약처는 앞으로도 안전하고 다양한 건강기능식품이 소비자에게 제공될 수 있도록 국민의 안전을 최우선으로 하는 한편, 건강기능식품 산업의 활성화를 위해 변화하는 유통·소비 환경에 맞춰 기준·규격 등을 합리적으로 개선할 예정이다. 자세한 내용은 식약처 홈페이지(www.mfds.go.kr> 법령·자료> 입법/행정예고)에서 확인할 수 있으며, 개정안에 대한 의견은 2025년 9월 22일까지 제출할 수 있다.2025-07-23 11:09:15이혜경 -
 무균제제 동등성 재평가, 용액주사제부터 추진[데일리팜=이혜경 기자] 내년 시행을 앞둔 무균의약품 동등성 재평가는 시험법이 확립된 제형부터 단계적으로 시행될 전망이다. 식품의약품안전처는 15일 오후 2시 건설공제조합 대회의실에서 '2025년 의약품 재평가 정책설명회'를 열고 내년도 무균의약품 동등성 재평가 추진일정에 대해 발표했다. 이날 발표 내용을 보면 식약처는 성분(제형)별 특이성을 고려해 2026년 용액주사제를 시행으로 2027년 현탁·유화주사제, 2028년 점안제·안연고제 등의 순으로 무균제제 재평가를 실시하기로 했다. 정명훈 의약품평가과 사무관은 "2026년부터 시행되는 무균의약품 동등성 재평가의 원칙은 시험법이 확립된 제형부터 적용하는 것"이라며 "맑은 용액주사제가 먼저 진행되지만, 품목수가 많아 효능·효과별로 3년의 기간동안 분할해서 재평가를 추진한다"고 밝혔다. 용액주사제의 경우 2026년부터 2028년까지 3년동안 재평가를 진행하게 되는데 효능·효과에 따른 분류번호에 따라 2026년 100(신경계감각기관용약), 200(기관계용약)에 대한 재평가를 진행한 이후, 2027년 400(조직세포기능용약), 600(항병원생물성약), 700(주목적이 치료가 아닌 약), 800(마약) 및 2028년 300(대사성약), 431(방사성의약품) 등의 순으로 분류됐다. 용액주사제 이외 생동시험과 이동시험법 확립 기간을 고려해 현탁·유화주사제는 2027년에, 점안제·안연고제는 2028년에 재평가가 진행된다. 정 사무관은 "지난 5월부터 무균제제 제조수입자를 대상으로 업계로부터 전문가를 추천 받아 분야별 협의체를 구성해 3~4번 가량 회의를 통해 애로사항을 청취하고 최종 지원방안 및 추진방안을 마련했다"며 "무균제제의 경우 대부분 이동시험을 진행하다보니 특별한 제형은 제제 개선 고민부터 해야 한다는 의견이 있어 시험법을 새롭게 확립해야 하는 제제에 대해 재평가 시기를 조정한 것"이라고 설명했다. 전문가 협의체에서는 시험법 뿐 아니라 대조약 관련된 업계 애로사항도 지적됐다. 정 사무관은 "기허가 품목 동등성 입증을 위해서는 성분, 제형, 제제에 대한 대표 대조약이 있어야 생동시험 및 이동시험을 시작할 수 있다"며 "지금부터라도 미리 준비해서 각 제약회사들의 대상품목에 대조약이 있는지 빠르게 확인해야 한다"고 설명했다. 지난 2023년부터 재평가를 시행한 결과, 경구제의 경우 대조약을 신청하는데 최대 1년 이상 소요되는 품목도 있었기 때문이다. 정 사무관은 "대조약 지정신청에 대해서 사전 준비를 철저히 해달라"며 "대조약 수급곤란으로 단기간에 동등성 시험용 3배치 확보가 어렵다는 의견이 많이 있었다"고 언급했다. 이에 식약처는 제약사 간 대조약 수급정도 공유 지원 및 대조약 지정신청을 진행할 계획이다. 정 사무관은 "대조약 수요 제약사가 제약바이오협회 등을 통해 대조약 수급이 어렵다고 요청하면, 협회가 공급정보를 추려서 공급사에 전달할 계획"이라고 했다. 특히 그동안 대조약 지정회사에 자율로 맡겼던 대조약 관리 규제가 강화된다. 정 사무관은 "대조약 회사 자율에 맡기다 보니 생산실적이 없거나 방치 상태로 두는 대조약이 보인다"며 "수요자의 수급이 어렵다는 점이 감지되면 새로운 대조약 지정 신청 절차를 밟을 예정이다. 공급이 안되면 대조약 지정이 변경될 수 있으니, 공급사의 경우 대조약이 지정됐다고 해서 재평가 제외라고 생각하지 말아달라"고 강조했다. 이날 참석한 김상봉 의약품안전국장은 "제네릭 의약품 품질을 높이고 국민 안전을 보장하기 위해 2023년 10월부터 동등성 재평가가 모든 전문의약품으로 확대됐다"며 "2026년부터 2028년까지 무균의약품 대상 재평가를 추진할 계획으로, 제도가 안정적이고 효율적으로 운영될 수 있도록 민관협력이 필요하다"고 강조했다. 한편 식약처는 내년에 한해 이동시험결과 제출기한을 당해년도 1분기(3월)에서 2분기(6월)로 연장할 계획이다. 업계 사전 재평가 준비를 위해 재평가 일정 예측성을 강화하도록 3개년 재평가 대상 품목을 당초 전년도 12월에서 10월로 단축해 발표하게 된다.2025-07-15 16:55:01이혜경
무균제제 동등성 재평가, 용액주사제부터 추진[데일리팜=이혜경 기자] 내년 시행을 앞둔 무균의약품 동등성 재평가는 시험법이 확립된 제형부터 단계적으로 시행될 전망이다. 식품의약품안전처는 15일 오후 2시 건설공제조합 대회의실에서 '2025년 의약품 재평가 정책설명회'를 열고 내년도 무균의약품 동등성 재평가 추진일정에 대해 발표했다. 이날 발표 내용을 보면 식약처는 성분(제형)별 특이성을 고려해 2026년 용액주사제를 시행으로 2027년 현탁·유화주사제, 2028년 점안제·안연고제 등의 순으로 무균제제 재평가를 실시하기로 했다. 정명훈 의약품평가과 사무관은 "2026년부터 시행되는 무균의약품 동등성 재평가의 원칙은 시험법이 확립된 제형부터 적용하는 것"이라며 "맑은 용액주사제가 먼저 진행되지만, 품목수가 많아 효능·효과별로 3년의 기간동안 분할해서 재평가를 추진한다"고 밝혔다. 용액주사제의 경우 2026년부터 2028년까지 3년동안 재평가를 진행하게 되는데 효능·효과에 따른 분류번호에 따라 2026년 100(신경계감각기관용약), 200(기관계용약)에 대한 재평가를 진행한 이후, 2027년 400(조직세포기능용약), 600(항병원생물성약), 700(주목적이 치료가 아닌 약), 800(마약) 및 2028년 300(대사성약), 431(방사성의약품) 등의 순으로 분류됐다. 용액주사제 이외 생동시험과 이동시험법 확립 기간을 고려해 현탁·유화주사제는 2027년에, 점안제·안연고제는 2028년에 재평가가 진행된다. 정 사무관은 "지난 5월부터 무균제제 제조수입자를 대상으로 업계로부터 전문가를 추천 받아 분야별 협의체를 구성해 3~4번 가량 회의를 통해 애로사항을 청취하고 최종 지원방안 및 추진방안을 마련했다"며 "무균제제의 경우 대부분 이동시험을 진행하다보니 특별한 제형은 제제 개선 고민부터 해야 한다는 의견이 있어 시험법을 새롭게 확립해야 하는 제제에 대해 재평가 시기를 조정한 것"이라고 설명했다. 전문가 협의체에서는 시험법 뿐 아니라 대조약 관련된 업계 애로사항도 지적됐다. 정 사무관은 "기허가 품목 동등성 입증을 위해서는 성분, 제형, 제제에 대한 대표 대조약이 있어야 생동시험 및 이동시험을 시작할 수 있다"며 "지금부터라도 미리 준비해서 각 제약회사들의 대상품목에 대조약이 있는지 빠르게 확인해야 한다"고 설명했다. 지난 2023년부터 재평가를 시행한 결과, 경구제의 경우 대조약을 신청하는데 최대 1년 이상 소요되는 품목도 있었기 때문이다. 정 사무관은 "대조약 지정신청에 대해서 사전 준비를 철저히 해달라"며 "대조약 수급곤란으로 단기간에 동등성 시험용 3배치 확보가 어렵다는 의견이 많이 있었다"고 언급했다. 이에 식약처는 제약사 간 대조약 수급정도 공유 지원 및 대조약 지정신청을 진행할 계획이다. 정 사무관은 "대조약 수요 제약사가 제약바이오협회 등을 통해 대조약 수급이 어렵다고 요청하면, 협회가 공급정보를 추려서 공급사에 전달할 계획"이라고 했다. 특히 그동안 대조약 지정회사에 자율로 맡겼던 대조약 관리 규제가 강화된다. 정 사무관은 "대조약 회사 자율에 맡기다 보니 생산실적이 없거나 방치 상태로 두는 대조약이 보인다"며 "수요자의 수급이 어렵다는 점이 감지되면 새로운 대조약 지정 신청 절차를 밟을 예정이다. 공급이 안되면 대조약 지정이 변경될 수 있으니, 공급사의 경우 대조약이 지정됐다고 해서 재평가 제외라고 생각하지 말아달라"고 강조했다. 이날 참석한 김상봉 의약품안전국장은 "제네릭 의약품 품질을 높이고 국민 안전을 보장하기 위해 2023년 10월부터 동등성 재평가가 모든 전문의약품으로 확대됐다"며 "2026년부터 2028년까지 무균의약품 대상 재평가를 추진할 계획으로, 제도가 안정적이고 효율적으로 운영될 수 있도록 민관협력이 필요하다"고 강조했다. 한편 식약처는 내년에 한해 이동시험결과 제출기한을 당해년도 1분기(3월)에서 2분기(6월)로 연장할 계획이다. 업계 사전 재평가 준비를 위해 재평가 일정 예측성을 강화하도록 3개년 재평가 대상 품목을 당초 전년도 12월에서 10월로 단축해 발표하게 된다.2025-07-15 16:55:01이혜경 -
 외국약가 비교 재평가 재추진 되나...제약업계 '촉각'[데일리팜=김진구 기자] 외국약가 비교 재평가가 올 하반기 다시 추진될 수 있다는 관측이 제기되면서 제약바이오업계의 긴장감이 높아지는 모습이다. 협의체 논의안이 그대로 반영될 경우 대규모 약가 인하로 이어질 수 있다는 점에서 업계는 민감한 반응을 보이고 있다. 올해 시행한다던 외국약가 비교 재평가…추진 일정 오리무중 4일 제약업계에 따르면 올 하반기 외국약가 비교 재평가 재추진 가능성이 제기된다. 복지부 장관 임명으로 조직 정비가 마무리되면 외국약가 비교 재평가 논의가 재추진될 것이란 전망이다. 이재명 정부는 정은경(60) 전 질병관리청장을 복지부장관 후보로 지명했다. 이미 1·2차관의 임명이 마무리된 상태로, 정 후보자가 청문회를 통과해 장관으로 정식 임명되면 복지부 조직 정비가 대부분 마무리된다. 이를 계기로 복지부가 작년 말 계엄사태 이후 사실상 ‘올스톱’ 상태인 정책들을 재추진하는 데 속도를 낼 것이란 전망이 나온다. 외국약가 비교 재평가 논의는 2023년 말 본격화했다. 정부는 제약업계가 참여한 실무협의체(TF)를 꾸리고 작년 7월까지 총 10차례의 간담회가 진행됐다. 간담회에선 외국약가 참조 기준, 재평가 대상, 시행 시점 등을 논의했다. A8 국가(미국·일본·독일·영국·프랑스·스위스·이탈리아·캐나다) 중 최고가와 최저가를 제외한 6개국의 조정평균가격에 맞춰 국내 약가를 인하하기로 했다. 인하 대상은 약제급여목록에 등재된 2만2920개 의약품으로, 이를 3개 분류로 나눠 3년 주기로 재평가를 반복한다는 데 합의했다. 끝까지 간극을 좁히지 못한 부분도 있다. 독일과 캐나다의 약가참조 방식이다. 결국 제약업계는 마지막 간담회 이후 독일·캐나다 약가참조 기준 변경, 약가인하율 50% 감면 등을 정부에 최종 제안했다. 당초 정부는 작년 말까지 최종안을 발표하고, 올해 상반기 재평가를 진행한다는 방침이었다. 이어 올해 하반기부터는 본격적인 약가 조정에 들어간다는 계획을 세웠다. 그러나 작년 말 계엄사태 이후로 모든 논의가 중단됐다. 이후 대통령 탄핵과 조기 대선 등으로 이러한 상태가 최근까지 지속됐다. 한 제약업계 관계자는 “작년 마지막 간담회 이후로 공식적으로나 비공식적으로나 외국약가 비교 재평가와 관련한 논의는 없었던 것으로 안다”며 “새 보험약제과장이 발령됐지만 상황은 마찬가지”라고 말했다. '통합 사후관리 방안 포함'부터 '독일·캐나다 제외'까지 다양한 시나리오 제기 제약업계에선 관련 논의가 재추진되는 것 자체에 부담을 느끼는 모양새다. 한 업계 관계자는 “불문명한 상황이 지속되는 게 답답하긴 하지만, 시행 일정이 확정된 것보다는 낫다”며 “내심 논의가 중단된 상태가 오래가기를 바라는 분위기”라고 말했다. 추진 일정과 내용이 오리무중인 상황에서 다양한 시나리오가 제기된다. 일각에선 외국약가 비교 재평가 추진 계획이 통합 사후관리 방안에 포함돼 원점에서 재논의될 것이란 전망이 나온다. 이재명 대통령이 약가 사후관리 통합·선진화를 공약했다는 점에서 이러한 전망이 힘을 얻는다. 또한 정부가 제약업계의 반발을 일부 수용할 것이란 전망도 복지부 안팎에서 제기된다. 독일·캐나다 약가 참조방식에 대한 제약업계의 반발을 일부 수용해, 두 국가를 빼거나 혹은 참조방식을 바꿀 것이란 전망이다. 반면 정부가 기존 방침대로 재평가를 강행할 것이란 전망도 동시에 제기된다. 이 경우 제약업계에 적잖은 피해가 예상된다는 점에서 큰 반발이 예상된다. 한 제약업계 관계자는 “다양한 현안에 대한 논의가 모두 중단된 상태다. 현재로선 언제 어떤 방식으로 재개될지 예측하기 어렵다”며 “다만 올 하반기엔 어떤 식으로든 논의가 재개될 것으로 보인다”고 말했다. 그는 “그중에서도 외국약가 비교 재평가에 대한 우려가 크다”며 “기존 논의 내용대로 외국약가 비교 재평가가 이뤄질 경우 피해가 매우 클 것으로 예상된다. 정부가 이를 재추진한다면 제약업계와의 논의에 다시 한 번 나서야 한다”고 말했다. 독일·캐나다 약가 참조방식 비판 목소리↑…재추진 시 반발 불가피 제약업계는 정부의 외국약가 비교 재평가 방침에 꾸준히 반대 입장을 밝혀오고 있다. 정부 입맛대로 특정 시점의 약가를 끌고 와 한국과 비교하고 이를 약가인하의 근거로 삼기 때문이라는 비판이다. 같은 국가라도 시점마다 약가가 다르다. 공장에서 출하된 시점의 가격, 환율·세금이 적용된 가격, 유통마진이나 약국마진이 더해진 가격, 환자 본인부담이 적용된 가격과 최종 소비자가 구입하는 가격 등이다. 가장 저렴한 공장출하 가격과 가장 비싼 소비자구입 가격은 차이가 적지 않다. 어떤 가격을 참조하느냐에 따라 한국약가에 미치는 영향도 클 수도, 작을 수도 있는 구조다. 특히 독일과 캐나다의 약가를 참조하는 방식에 대한 비판 여론이 높다. 참조가격제를 시행 중인 독일에선 정부가 특정 성분군의 참조가격을 정하고 나머지를 환급한다. 예를 들어 A약제의 참조가격을 100원으로 정했다면, 제약사가 180원에 판매하는 의약품에서 100원까지만 급여를 적용하고 나머지 80원은 환자가 본인부담하는 식이다. 이때 100원이라는 참조가격은 'FB(고정상환금액)' 혹은 'EB(협상상환금액)'로 표현된다. 정부는 이를 '공적급여 가격'으로 해석하고 외국약가 비교 재평가에 활용한다는 방침이다. 반면 제약업계에선 180원에 해당하는 '약국판매가격(UVP)' 혹은 '소비자가격(RRP)'를 적용해야 한다는 주장을 펼친다. 한국의 경우 약제 보험급여 상한금액에 환자 본인부담이 포함된 형태다. 이를 독일 약가와 비교하려면 당연히 환자 본인부담이 포함된 약국판매 가격과 비교해야 한다는 게 제약업계의 주장이다. 환자 본인부담이 제외된 공적급여 가격과 비교할 경우 형평성이 떨어진다는 것이다. 캐나다의 경우도 마찬가지다. 정부는 공적급여 가격의 일종인 '정부환급액(MOH)'을 참조한다는 계획인데, 이에 대해 제약업계에선 환자 본인부담이 포함된 '의약품 혜택 가격(DBP)'을 참조해야 한다고 맞서고 있다. 환자 본인부담이 반영되지 않은 캐나다의 공적급여 가격과 환자 본인부담이 반영된 한국의 보험 상한가를 동일선상에 두고 비교하는 것은 옳지 않다는 주장이다. 또한 외국약가 비교 재평가가 3년 주기로 반복된다는 데 대한 우려도 제기된다. 대규모 약가인하가 일회성에 그치지 않고 3년마다 반복될 경우 중장기적으로는 다양한 부작용을 일으킬 것이란 우려 때문이다. 재평가는 3년에 걸쳐 진행된다. 1년차엔 위장관용약·고혈압치료제·항생제 6467개 품목, 2년차엔 고지혈증치료제·호흡기계용약·정신신경계용약·당뇨병용약·근골격계질환치료제 8076개 품목, 3년차엔 진통제·비뇨생식기관용제·항혈전제·피부질환용제·항암제 등 7972개 품목이 각각 대상이다. 3년차까지 일정이 완료되면 다시 1년차로 돌아가 재평가가 다시 진행된다. 매 3년마다 외국과의 비교를 통한 약가인하가 반복되는 구조다. 반복적인 재평가로 국내 약가 수준이 전반적으로 낮아지면 다국적제약사가 한국에 신약을 발매하지 않는 '코리아 패싱' 사례가 늘어날 수 있다는 전망이 나온다. 국내제약사의 경우도 낮아진 약가로 인해 신약 연구개발 동력이 저하될 것이란 우려가 제기된다.이재명 정부 약가정책 방향은?2025-07-04 06:20:04김진구
외국약가 비교 재평가 재추진 되나...제약업계 '촉각'[데일리팜=김진구 기자] 외국약가 비교 재평가가 올 하반기 다시 추진될 수 있다는 관측이 제기되면서 제약바이오업계의 긴장감이 높아지는 모습이다. 협의체 논의안이 그대로 반영될 경우 대규모 약가 인하로 이어질 수 있다는 점에서 업계는 민감한 반응을 보이고 있다. 올해 시행한다던 외국약가 비교 재평가…추진 일정 오리무중 4일 제약업계에 따르면 올 하반기 외국약가 비교 재평가 재추진 가능성이 제기된다. 복지부 장관 임명으로 조직 정비가 마무리되면 외국약가 비교 재평가 논의가 재추진될 것이란 전망이다. 이재명 정부는 정은경(60) 전 질병관리청장을 복지부장관 후보로 지명했다. 이미 1·2차관의 임명이 마무리된 상태로, 정 후보자가 청문회를 통과해 장관으로 정식 임명되면 복지부 조직 정비가 대부분 마무리된다. 이를 계기로 복지부가 작년 말 계엄사태 이후 사실상 ‘올스톱’ 상태인 정책들을 재추진하는 데 속도를 낼 것이란 전망이 나온다. 외국약가 비교 재평가 논의는 2023년 말 본격화했다. 정부는 제약업계가 참여한 실무협의체(TF)를 꾸리고 작년 7월까지 총 10차례의 간담회가 진행됐다. 간담회에선 외국약가 참조 기준, 재평가 대상, 시행 시점 등을 논의했다. A8 국가(미국·일본·독일·영국·프랑스·스위스·이탈리아·캐나다) 중 최고가와 최저가를 제외한 6개국의 조정평균가격에 맞춰 국내 약가를 인하하기로 했다. 인하 대상은 약제급여목록에 등재된 2만2920개 의약품으로, 이를 3개 분류로 나눠 3년 주기로 재평가를 반복한다는 데 합의했다. 끝까지 간극을 좁히지 못한 부분도 있다. 독일과 캐나다의 약가참조 방식이다. 결국 제약업계는 마지막 간담회 이후 독일·캐나다 약가참조 기준 변경, 약가인하율 50% 감면 등을 정부에 최종 제안했다. 당초 정부는 작년 말까지 최종안을 발표하고, 올해 상반기 재평가를 진행한다는 방침이었다. 이어 올해 하반기부터는 본격적인 약가 조정에 들어간다는 계획을 세웠다. 그러나 작년 말 계엄사태 이후로 모든 논의가 중단됐다. 이후 대통령 탄핵과 조기 대선 등으로 이러한 상태가 최근까지 지속됐다. 한 제약업계 관계자는 “작년 마지막 간담회 이후로 공식적으로나 비공식적으로나 외국약가 비교 재평가와 관련한 논의는 없었던 것으로 안다”며 “새 보험약제과장이 발령됐지만 상황은 마찬가지”라고 말했다. '통합 사후관리 방안 포함'부터 '독일·캐나다 제외'까지 다양한 시나리오 제기 제약업계에선 관련 논의가 재추진되는 것 자체에 부담을 느끼는 모양새다. 한 업계 관계자는 “불문명한 상황이 지속되는 게 답답하긴 하지만, 시행 일정이 확정된 것보다는 낫다”며 “내심 논의가 중단된 상태가 오래가기를 바라는 분위기”라고 말했다. 추진 일정과 내용이 오리무중인 상황에서 다양한 시나리오가 제기된다. 일각에선 외국약가 비교 재평가 추진 계획이 통합 사후관리 방안에 포함돼 원점에서 재논의될 것이란 전망이 나온다. 이재명 대통령이 약가 사후관리 통합·선진화를 공약했다는 점에서 이러한 전망이 힘을 얻는다. 또한 정부가 제약업계의 반발을 일부 수용할 것이란 전망도 복지부 안팎에서 제기된다. 독일·캐나다 약가 참조방식에 대한 제약업계의 반발을 일부 수용해, 두 국가를 빼거나 혹은 참조방식을 바꿀 것이란 전망이다. 반면 정부가 기존 방침대로 재평가를 강행할 것이란 전망도 동시에 제기된다. 이 경우 제약업계에 적잖은 피해가 예상된다는 점에서 큰 반발이 예상된다. 한 제약업계 관계자는 “다양한 현안에 대한 논의가 모두 중단된 상태다. 현재로선 언제 어떤 방식으로 재개될지 예측하기 어렵다”며 “다만 올 하반기엔 어떤 식으로든 논의가 재개될 것으로 보인다”고 말했다. 그는 “그중에서도 외국약가 비교 재평가에 대한 우려가 크다”며 “기존 논의 내용대로 외국약가 비교 재평가가 이뤄질 경우 피해가 매우 클 것으로 예상된다. 정부가 이를 재추진한다면 제약업계와의 논의에 다시 한 번 나서야 한다”고 말했다. 독일·캐나다 약가 참조방식 비판 목소리↑…재추진 시 반발 불가피 제약업계는 정부의 외국약가 비교 재평가 방침에 꾸준히 반대 입장을 밝혀오고 있다. 정부 입맛대로 특정 시점의 약가를 끌고 와 한국과 비교하고 이를 약가인하의 근거로 삼기 때문이라는 비판이다. 같은 국가라도 시점마다 약가가 다르다. 공장에서 출하된 시점의 가격, 환율·세금이 적용된 가격, 유통마진이나 약국마진이 더해진 가격, 환자 본인부담이 적용된 가격과 최종 소비자가 구입하는 가격 등이다. 가장 저렴한 공장출하 가격과 가장 비싼 소비자구입 가격은 차이가 적지 않다. 어떤 가격을 참조하느냐에 따라 한국약가에 미치는 영향도 클 수도, 작을 수도 있는 구조다. 특히 독일과 캐나다의 약가를 참조하는 방식에 대한 비판 여론이 높다. 참조가격제를 시행 중인 독일에선 정부가 특정 성분군의 참조가격을 정하고 나머지를 환급한다. 예를 들어 A약제의 참조가격을 100원으로 정했다면, 제약사가 180원에 판매하는 의약품에서 100원까지만 급여를 적용하고 나머지 80원은 환자가 본인부담하는 식이다. 이때 100원이라는 참조가격은 'FB(고정상환금액)' 혹은 'EB(협상상환금액)'로 표현된다. 정부는 이를 '공적급여 가격'으로 해석하고 외국약가 비교 재평가에 활용한다는 방침이다. 반면 제약업계에선 180원에 해당하는 '약국판매가격(UVP)' 혹은 '소비자가격(RRP)'를 적용해야 한다는 주장을 펼친다. 한국의 경우 약제 보험급여 상한금액에 환자 본인부담이 포함된 형태다. 이를 독일 약가와 비교하려면 당연히 환자 본인부담이 포함된 약국판매 가격과 비교해야 한다는 게 제약업계의 주장이다. 환자 본인부담이 제외된 공적급여 가격과 비교할 경우 형평성이 떨어진다는 것이다. 캐나다의 경우도 마찬가지다. 정부는 공적급여 가격의 일종인 '정부환급액(MOH)'을 참조한다는 계획인데, 이에 대해 제약업계에선 환자 본인부담이 포함된 '의약품 혜택 가격(DBP)'을 참조해야 한다고 맞서고 있다. 환자 본인부담이 반영되지 않은 캐나다의 공적급여 가격과 환자 본인부담이 반영된 한국의 보험 상한가를 동일선상에 두고 비교하는 것은 옳지 않다는 주장이다. 또한 외국약가 비교 재평가가 3년 주기로 반복된다는 데 대한 우려도 제기된다. 대규모 약가인하가 일회성에 그치지 않고 3년마다 반복될 경우 중장기적으로는 다양한 부작용을 일으킬 것이란 우려 때문이다. 재평가는 3년에 걸쳐 진행된다. 1년차엔 위장관용약·고혈압치료제·항생제 6467개 품목, 2년차엔 고지혈증치료제·호흡기계용약·정신신경계용약·당뇨병용약·근골격계질환치료제 8076개 품목, 3년차엔 진통제·비뇨생식기관용제·항혈전제·피부질환용제·항암제 등 7972개 품목이 각각 대상이다. 3년차까지 일정이 완료되면 다시 1년차로 돌아가 재평가가 다시 진행된다. 매 3년마다 외국과의 비교를 통한 약가인하가 반복되는 구조다. 반복적인 재평가로 국내 약가 수준이 전반적으로 낮아지면 다국적제약사가 한국에 신약을 발매하지 않는 '코리아 패싱' 사례가 늘어날 수 있다는 전망이 나온다. 국내제약사의 경우도 낮아진 약가로 인해 신약 연구개발 동력이 저하될 것이란 우려가 제기된다.이재명 정부 약가정책 방향은?2025-07-04 06:20:04김진구 -
 PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대6편: 최초의 흡입형 PDE3/PDE4 이중 억제 COPD 치료제, 오투베어(Esifentrine) 오투베어(Ohtuvayre& 9415;, OH-too-vare 성분명 엔시펜트린 흡입 현탁액, Esifentrine& 9415;, Verona Pharma)는 최초의 흡입용 PDE3/PDE4 효소 선택적 이중 억제제로서, 2024년 6월 미국 FDA에서 '성인 만성폐쇄성폐질환(chronic obstructive pulmonary disease, COPD) 환자의 유지요법제'에 승인되었으며, 유럽에서는 아직 승인되지 않았다. 현재 이 약제와 유사한 PDE4 억제제인 '닥사스(roflumilast)'는 '중증 COPD 환자의 급성 악화 빈도를 감소'에 승인된 약제로 미국 FDA 및 국내에서 소개되어 있다. 이 약제는 기도와 폐 실질의 염증세포에서 cAMP 분해 효소인 PDE3 및 PDE4 효소를 선택적으로 억제함으로써, 기관지확장과 비스테로이드성 항염증 효과를 하나로 결합하여 높은 흡기 유속이나 복잡한 손-호흡 조정 없이 표준 제트 네블라이저를 통해 폐에 약물을 직접 전달되도록 설계되었다. 이 cAMP 경로는 COPD의 병태 생리를 조절하는 내재적 항염증 기전으로 중요하게 작용하며, 이를 조절하는 약물학적 접근은 기존의 기관지 확장제나 흡입 스테로이드 기반 치료를 보완할 수 있는 새로운 치료 전략으로 자리매김하고 있다. 오투베어의 미국 FDA 승인은 미국호흡기중환자 의학저널(American Journal of Respiratory and Critical Care Medicine)에 게재된 임상 3상 시험 ENHANCE의 결과를 포함한 광범위한 데이터를 기반으로 이뤄졌다. ENHANCE 임상시험에서 오투바이어는 단독요법으로 투여하거나 다른 유지요법과 함께 사용했을 때 폐 기능 개선을 포함한 임상적 이점을 제공한 것으로 입증되었다. 이는 중등도에서 중증의 COPD를 가지고 있는 광범위한 그룹에서 내약성이 우수하였다. 오투바이어는 COPD 외에도 비-낭성섬유증 기관지확장증, 낭성섬유증, 천식, 기타 호흡기질환에 대한 치료제로 평가되고 있다. 또한 오투바이어와 지속성 항콜린제(LAMA)인 glycopyrrolate의 고정용량 복합제를 COPD 유지요법으로 개발 중이다. 만성폐쇄성폐질환(Chronic obstructive pulmonary disease, COPD)은 어떤 질환인가? COPD는 기류 제한이 지속적으로 나타나는 진행성 호흡기 질환으로, 기도 및 폐 실질의 만성 염증과 그에 따른 폐기능 저하가 주요 병리학적 특징이다. 임상적으로는 호흡곤란, 만성 기침, 객담 등 다양한 증상이 발현되며, 반복적인 급성 악화는 삶의 질 저하뿐 아니라 사망률 증가와도 밀접하게 연관되어 있다. 전 세계적으로 COPD는 주요 사망 원인 중 하나로 보고되고 있으며, 고령화와 흡연율 증가에 따라 그 유병률은 지속적으로 상승하고 있다. COPD의 병태생리에는 대식세포(macrophages), 호중구(neutrophils), CD8+ T 림프구(cytotoxic T cells) 등 선천 및 후천 면역세포의 활성화가 중심적인 역할을 하며, 이들 면역세포는 다수의 염증 촉진성 사이토카인(IL-8, TNF-α 등), 프로테아제(matrix metalloproteinases), 그리고 활성산소종(reactive oxygen species)을 과도하게 분비한다. 이러한 염증 반응은 기도 리모델링, 점액 과분비, 폐포 구조의 파괴 및 폐 실질의 손상 등 병리적 변화를 유도하여 기류 제한을 지속시키는 주요 기전으로 작용한다. 이러한 만성 염증 반응을 조절하기 위한 내재적 조절 기전 중 하나로 주목받는 것이 cyclic adenosine monophosphate(cAMP) 신호 전달 경로이다. cAMP는 adenylyl cyclase에 의해 생성되는 대표적인 이차 전령(second messenger)으로, 세포 내에서 protein kinase A(PKA) 및 Epac(Exchange Protein directly Activated by cAMP) 등의 하위 효과기를 통해 다양한 생리학적 반응을 매개한다. 구체적으로, cAMP는 염증성 유전자 발현 억제, 항산화 반응 촉진, 섬모 운동 촉진, 점액 분비 감소 및 기관지 평활근의 이완 등을 유도함으로써 COPD 병태생리의 여러 측면을 동시에 조절할 수 있는 기능을 한다. 그러나 COPD 환자에서는 염증세포 내에서 phosphodiesterase-4(PDE4)의 과발현으로 인해 cAMP가 병태적으로 분해되고, 그 농도가 비정상적으로 낮아지는 현상이 관찰된다. 이러한 기전은 항염 및 기관지 보호 효과를 저해하며, 결과적으로 만성 염증을 악화시키는 데 기여한다. Cyclic nucleotides(고리형 뉴클레오타이드)란 무엇인가? Cyclic nucleotides는 세포 내 신호전달 경로에서 이차 전령으로 작용하는 분자군으로, 다양한 생리학적 자극에 대한 세포 반응을 매개하는 데 중심적인 역할을 수행한다. 이들은 주로 ATP(adenosine triphosphate) 또는 GTP(guanosine triphosphate)로부터 유도되어 생성되며, 대표적인 형태로 cAMP(cyclic adenosine monophosphate)와 cGMP(cyclic guanosine monophosphate)가 있다. cAMP는 adenylyl cyclase(AC)의 촉매 작용에 의해 ATP로부터 생성되며, 이는 G 단백질 연결 수용체(G protein-coupled receptor, GPCR)의 활성화에 의해 유도된다. 이는반면, cGMP는 guanylyl cyclase(GC)에 의해 GTP로부터 유도되며, 이는 나트륨이뇨펩타이드(natriuretic peptides) 또는 산화질소(nitric oxide, NO)와 같은 세포외 신호에 의해 활성화된다. 이 두 경로는 상이한 생리적 자극과 수용체를 통해 선택적으로 작용하면서 세포 특이적 반응을 조절한다(Figure 1). 생성된 cAMP는 주로 PKA와 EPAC(exchange protein directly activated by cAMP, cAMP에 의해 직접 활성화되는 교환 단백질)을 통해 세포 기능을 조절한다. PKA는 대사 조절, 세포 분화, 증식, 생존 등 광범위한 생물학적 과정에 관여하며, EPAC은 integrin 매개 세포 부착, 세포 간 접합 형성, 분비(exocytosis), 인슐린 분비 등 PKA-비의존성 경로를 통해 다양한 세포 기능을 조절한다. 특히, 세포 내 cAMP 농도가 상승하면 cAMP-의존성 PKA가 활성화된다. PKA는 두 개의 촉매 서브유닛(C)과 두 개의 조절 서브유닛(R)으로 이루어진 이종사량체(heterotetramer)로 구성되며, 평상시에는 비활성 상태로 존재한다. 그러다 cAMP가 R 서브유닛에 결합하면 촉매 서브유닛이 유리되어 다양한 표적 단백질을 인산화한다. 이 중 대표적인 인산화 표적은 CREB(cAMP response element binding protein)으로, 이는 대사 조절 및 세포 증식에 관여하는 유전자 발현을 조절하는 전사 인자이다. 반면, 생성된 cGMP는 주로 PKG를 활성화시키며, 이는 세포 내 여러 표적 단백질을 인산화하여 평활근 수축 조절, 세포자멸사, 염증 반응, 시각 신호전달, 혈소판 응집 등 생리적 반응을 유도한다. 이러한 cyclic nucleotide의 생물학적 활성을 종료시키는 주요 기전은 phosphodiesterase (PDE)에 의해 수행된다. PDE는 cAMP 및 cGMP를 각각 5’-AMP 또는 5’-GMP의 비고리형 형태로 분해함으로써 이차 전령 신호를 효과적으로 불활성화시킨다. cAMP 신호전달 경로는 어떤 역할을 하는가? cAMP는 1958년 Sutherland와 Rall에 의해 처음 발견된 이후, cAMP는 호르몬, 신경전달물질, 면역조절 인자 등 외부 자극에 의해 활성화되는 AC(adenyl cyclase)에 의해 ATP로부터 생성되는 고리형 뉴클레오타이드로 정의되었다. 세포는 외부 환경으로부터의 자극에 신속하고 정밀하게 반응하기 위해 다양한 신호전달 시스템을 갖추고 있으며, 이에는 cAMP를 생성하는 AC가 존재한다. AC는 세포막에 존재하는 효소로, ATP를 cAMP로 전환하는 반응을 촉매하며, 이 과정은 GPCR의 활성화에 의해 주로 조절된다. GPCR은 세포막을 7회 통과하는 구조의 수용체로, 외부의 호르몬, 신경전달물질, 생리활성 분자 등의 리간드를 인식하여 이질삼합체 G 단백질(heterotrimeric G protein)을 활성화시킨다. 이때 GPCR은 Gs 단백과 결합하여 AC를 활성화하고, 이를 통해 세포 내 cAMP 생성을 유도한다. 반면 Gi 단백을 통해서는 AC 활성을 억제하여 cAMP 생성을 저해한다. 기도 조직에서 cAMP 농도의 증가는 평활근 이완과 염증 반응 억제를 유도하여, 천식을 포함한 폐쇄성 기도 질환의 병태생리 조절에 기여하는 것으로 알려져 있다. 아울러, PKA는 세포 내 Ca²& 8314; 농도의 감소, Ca²& 8314;에 대한 민감도 저하, MLC 비의존 경로 조절 등 다양한 기전을 통해 기관지 확장 효과를 나타낸다. 또한, cAMP는 섬모 운동(ciliary motility)을 촉진하여 점액섬모 청소(mucociliary clearance)를 향상시키며, 이는 기도 내 분비물 제거와 염증 완화에 기여한다. 이러한 이중 조절 메커니즘은 세포가 자극의 종류와 강도에 따라 cAMP 농도를 정밀하게 조절할 수 있게 하며, 하위 효과기인 PKA, EPAC 등을 통해 궁극적인 생리학적 반응으로 이어진다. cAMP 신호전달 경로의 특이성 및 세포 내 농도는 PDE에 의해 조절되며, PDE는 cAMP를 5’-AMP로 분해하여 신호를 종료시킨다. 특히 PDE4, PDE7, PDE8은 cAMP를 선택적으로 분해하는 isoform으로, 면역세포와 염증세포에 풍부하게 발현되어 있어 염증성 질환에서 중요한 조절 인자로 작용한다. 이에 따라 PDE4 억제제인 닥사스(roflumilast)는 cAMP 농도를 증가시켜 항염증 작용을 유도한다. 따라서, cAMP 신호전달 경로는 외부 자극에 대한 세포의 신속하고 정밀한 반응을 유도하는 고차원적인 조절 기전이며, 그 구성 요소와 하위 경로를 표적으로 한 약리학적 개입은 염증성, 대사성, 심혈관성 질환을 포함한 다양한 병태에서 치료적 가능성을 제시한다. 최근 연구들은 cAMP 의존성 신호전달 경로의 복잡성과 생물학적 중요성을 더욱 강조하고 있으며, 특히 기도 평활근(airway smooth muscle, ASM) 세포에서 β₂-아드레날린 수용체(β₂-adrenergic receptor, β₂AR)와 같은 GPCR의 활성이 이러한 경로를 중심으로 작동함이 밝혀졌다. Phosphodiesterase(PDE)는 무엇인가? PDE는 세포 내에서 cyclic nucleotide(cAMP 및 cGMP)의 3’,5’-고리형 인산 결합을 가수분해하여 각각 AMP(adenosine monophosphate) 또는 GTP(guanosine momophosphate)로 전환함으로써 이차 전령의 신호를 종료시키는 역할을 수행한다. PDE는 신호 전달의 시간적 지속성과 공간적 국소화, 그리고 신호의 강도 조절에 주요 생화학적 조절자(gatekeeper)로 기능하며, 이에 따라 다양한 생리 및 병리 현상의 미세 조절자로 작용한다. 현재까지 확인된 PDE는 총 11개 계열(PDE1& 8211;PDE11)로 구성되며, 이들은 아미노산 서열, 기질 특이성, 약물 감수성, 조절 메커니즘 등의 차이에 따라 구분된다. 각 아형(family)은 서로 다른 조직 특이성 및 세포 내 소분획(localization)을 보이며, 동일한 기질(cAMP 또는 cGMP)에 작용하더라도 그 기능적 결과는 상이할 수 있다. 예를 들어, PDE4, PDE7, PDE8은 cAMP 특이적, PDE5, PDE6, PDE9는 cGMP 특이적, PDE1, PDE2, PDE3, PDE10, PDE11은 양쪽 기질 모두에 작용할 수 있다(Table 1). PDE의 활성 이상은 만성 염증성 질환, 심혈관 질환, 신경정신질환, 악성종양 등 다양한 질환의 병태생리와 밀접한 관련이 있으며, 특히 PDE3와 PDE4는 COPD와 같은 염증성 폐질환에서 병태생리학적 역할을 한다 . PDE3는 상대적으로 높은 cAMP 친화도를 가지며, PDE3A와 PDE3B의 두 아형으로 구분된다. PDE3A는 폐 상피세포, 혈관 내피세포, 기도 평활근세포(airway smooth muscle, ASM), 염증세포 등에서 발현되며, 특히 혈관 평활근세포에서 주요하게 존재하며 평활근 긴장도 조절에 관여한다. 반면, PDE3B는 지방세포, 간세포, 정자세포 등 대사 활성이 높은 조직뿐만 아니라 T세포 및 대식세포에서도 발현되어, 염증 반응 조절 및 대사 경로에 영향을 미친다. PDE4는 네 가지 유전자(PDE4A& 8211;D)와 다양한 스플라이싱 변이체로 구성되며, 호흡기계 조직을 포함한 다양한 기관에 광범위하게 분포한다. 특히 PDE4D는 인간 기도 평활근세포에서 cAMP 분해를 조절하는 주요 효소로 작용하며, PDE4 전체는 백혈구, 대식세포, 호중구 등 염증세포뿐 아니라 기도 상피세포 및 폐 신경계에도 발현되어 염증 반응의 조절자로 기능한다. 임상 및 전임상 연구에 따르면, COPD 환자, 특히 흡연자에서 PDE4 발현이 유의하게 증가되어 있음이 보고되었으며, PDE4 억제를 통해 cAMP 농도를 증가시키는 것은 염증 촉진성 사이토카인의 발현 감소, 염증세포의 조직 내 침윤 억제 등 광범위한 항염증 효과를 유도하는 것으로 나타났다. 이러한 기전을 기반으로 PDE4 억제제 닥사스(roflumilast)는 ‘기관지확장제의 부가요법제로서, 증상악화 병력이 있고, 만성기관지염을 수반한 중증의 만성폐쇄성폐질환의 유지요법제’로 승인되어 있다. COPD에는 어떤 약제들을 사용하는가? COPD에 대한 약물 치료의 목적은 증상의 완화, 급성 악화의 예방, 신체활동 능력 향상 및 장기적인 예후 개선에 있다. 이에는 주로 흡입제에 기반하며, 기관지 확장제가 치료의 핵심이다. 기관지확장제는 호흡기 질환에서 폐쇄된 기도를 확장시켜 기류를 개선하는 약제로, 천식과 COPD와 같은 기도 폐쇄성 질환에 사용된다. 이러한 약제는 기관지 평활근(bronchial smooth muscle)의 이완을 유도하여 기도 저항을 감소시키며, 환자의 증상을 완화하고 폐기능을 향상시키는 데 기여한다. 기관지확장제는 작용 기전에 따라 크게 β2-아드레날린 수용체 작용제(β2-agonists), 항콜린제(Anticholinergics) 또는 무스카린 수용체 길항제(Muscarinic antagonists), 메틸잔틴계(Methylxanthines)가 있다. 아울러 약물의 효과 및 부작용 등을 고려하여 흡입제를 주로 사용하며, 흡입기 종류는 크게 건조분말흡입기(dry power inhaler, DPI), 정량흡입기(metered dose inhaler, MDI)로 나뉘고, 다시 MDI는 가압 정량흡입기(pressurized metered dose inhaler, pMDI)와 연무형 흡입기(soft mist inhaler, SMI)로 나뉜다. pMDI는 다시 호흡 작동식 흡입기(breath-operated inhaler, BOI or breath-actuated inhale, BAI)와 비호흡 작동식 호흡기(Non-BOI)로 나뉘는데 호흡 작동식 흡입기는 아직 국내에 없다. 또한 분무기(nebulizer, 네불라이저)도 흡입제 치료에 속한다. 1) 베타-2 작용제(β2-agonists) β2-작용제는 기관지 평활근 세포에 발현된 β2-아드레날린 수용체에 선택적으로 결합하여 Gs 단백질을 통한 adenylyl cyclase 활성화, 이어지는 cAMP 농도 증가 및 PKA 활성화를 유도함으로써, 평활근 세포 내 칼슘 농도를 낮추고 근수축 관련 단백질들의 기능을 억제하여 기관지 확장을 유발한다. 또한 섬모운동 촉진 및 혈관 투과성 감소 등의 부수적 효과를 통해 기도 청소 기능 개선에도 기여할 수 있다. 임상적으로 β2-작용제는 작용 시간에 따라 단시간 작용제(short-acting β2-agonists, SABA)와 장시간 작용제(long-acting β2-agonists, LABA)로 구분된다. SABA는 증상 완화를 위한 구제 치료(reliever therapy)로 사용되며, 대표적으로 살부타몰(Salbutamol)과 테르부탈린(Terbutaline)이 있다. SABA의 사용은 FEV1의 호전과 증상을 개선시킬 수 있다. SABA는 4-6시간 지속되고, LABA는 12시간 이상 지속되며, 규칙적인 LABA 사용을 하는 환자에서도 필요시 SABA 사용은 증상 완화에 도움이 될 수 있다. 반면, LABA는 하루 12시간 이상 지속되는 작용시간을 가지며 천식의 유지 치료(controller therapy) 혹은 COPD의 증상 조절을 위한 병용 요법에 사용되며, 대표적으로 살메테롤(Salmeterol)과 포르모테롤(Formoterol)이 있다. 이들 약제는 폐기능과 삶의 질을 개선시키고 호흡곤란과 급성 악화와 입원의 빈도를 감소시키지만, 사망률이나 폐기능 감소 속도에는 영향을 주지 못한다. 이 외에도 24시간 작용 지속 시간을 가진 초장시간 작용제(ultra-LABA)인 인다카테롤(Indacaterol), 올로다테롤(Olodaterol) 등이 COPD 치료에 활용되고 있다. 이들 약제는 호흡곤란과 악화위험을 감소시키고 삶의 질을 개선시킨다. 이러한 β2-작용제는 그 효과의 빠른 발현과 우수한 증상 완화 효과로 인해 널리 사용되고 있으나, 단독 사용 시 특히 천식 환자에서 기도 염증을 충분히 조절하지 못하며 오히려 기전적 내성(tachyphylaxis)이나 염증 악화의 위험을 높일 수 있다는 우려도 제기되어 왔다. 이에 따라 ICS(흡입 스테로이드)와의 병용이 원칙이며, 한 기기 내 고정용량 복합제(FDC) 형태로 투여하는 방법이 표준화되고 있다. 2) 항콜린제((Anticholinergics) 항콜린제는 기관지 평활근, 점액선, 혈관 등에 존재하는 무스카린 수용체(muscarinic receptor) 중 특히 M3 수용체에 선택적으로 작용하여, 아세틸콜린이 이 수용체에 결합하는 것을 차단함으로써 평활근 수축 및 점액 분비를 억제한다. 이로 인해 기도 저항이 감소하고 호흡 증상이 완화되며, COPD 환자의 폐기능 개선과 급성 악화 빈도 감소에 기여한다. 항콜린제는 작용 지속 시간에 따라 단시간 작용 항무스카린제(short-acting muscarinic antagonists, SAMA)와 장시간 작용 항무스카린제(long-acting muscarinic antagonists, LAMA)로 분류된다. SAMA는 주로 단기 증상 완화에 사용되며, 대표적으로이프라트로피움(Ipratropium)와 옥시트로피움(Oxitropium)이 있다. 이들 약제는 M3 비선택적 억제로, 억제성 신경 수용체인 M2를 차단함으로써 잠재적으로 미주신경을 통해 기관지 수축을 유발시킬 수 있다. LAMA는 하루 1회 또는 2회 흡입으로 지속적인 기도 확장을 유지할 수 있어 COPD 유지 치료의 핵심 약제로 사용된다. 대표적으로 티오트로피움(Tiotropium), 글리코피로니움(Glycopyrronium), 우메클리디늄(Umeclidinium) 등이 있다. 이들 약제는 M3 선택적 억제로, M3 무스카린성 수용체에 대한 장시간의 결합 및 M2 무스카린성 수용체와의 빠른 해리를 통해 기관지 확장제의 효과 지속 시간을 연장시킨다. 항콜린제는 β2-작용제와 병용할 경우 상호 보완적인 기전으로 기관지 확장 효과가 증대되며, 특히 COPD 환자에서는 LAMA + LABA 병용요법이 임상적으로 우월한 효과를 보인다. 항콜린제는 흡입 제형으로 투여 시 전신 흡수가 거의 없어 안전성이 높고, 주요 부작용은 구강건조, 쓴맛, 드물게 요폐 등의 국소적 반응에 국한된다. 이로 인해 장기적인 유지 요법에 적합한 약제로 간주된다. 3) 흡입스테로이드제(Inhaled corticosteroid, ICS) ICS는 합성된 글루코코르티코이드 계열 약제로, 폐로 직접 흡입되어 작용함으로써 전신 노출을 최소화하면서 강력한 항염 작용을 발휘한다. 세포 내 글루코코르티코이드 수용체(glucocorticoid receptor, GR)와 결합한 후 전사조절인자(transcriptional regulator)로 기능하여, 염증 유전자 발현을 억제하고 항염증 단백질 생성을 유도한다. 특히 NF-κB, AP-1 등 주요 염증 촉진성 전사인자의 활성을 차단함으로써 IL-4, IL-5, IL-13 등 Th2 관련 사이토카인의 생성을 억제하며, 호산구(eosinophil) 및 비만세포(mast cell)의 기도 내 침윤과 활성을 감소시킨다. 이러한 작용기전은 기관지 평활근의 수축성을 저하시켜 기도 과민 반응을 감소시키고, 상피세포의 장벽 기능 회복과 점액선의 과활성 억제를 통해 전반적인 기도 염증 조절에 기여한다. ICS는 흡입제 형태로 국소적으로 투여되어 전신 부작용을 최소화하면서 장기간 안전하게 사용 가능하다는 점에서 ICS는 천식 치료에 있어 핵심적인 치료제로 간주된다. 이는 단독 사용뿐 아니라 LABA 또는 LAMA와의 병용 요법이 표준화되었다. 4) Phosphodiesterase-4(PDE4) 억제제 PDE4 억제제는 cAMP의 대사를 억제하여 세포내 cAMP 농도를 높이는데 이는 항 염증 효과를 나타내고 또한 호중구의 이동과 화학 주성을 억제하는 효과도 있다. 로플밀라스트(Roflumilast)는 선택적인 PDE4 억제제 중의 하나로 가래 호중구와 호산구를 감소키는 항염증 작용이 확인되어 PDE4억제제 중 COPD 치료제로 허가 받은 유일한 약제이다. 하루 한번 복용하는 경구용 약제로 기관지 확장제가 아니지만 FEV1과 삶의 질 향상효과가 있다. 따라서, 단기간 작용시간을 가지는 SABA와 SAMA는 주로 증상이 갑자기 악화될 때 사용되며, LABA와 LAMA는 유지 치료의 중심으로 사용된다. 5) 병용요법 이러한 약제들은 단독 혹은 병합 요법으로 사용되며, 특히 증상이 지속되거나 급성 악화가 반복되는 환자에서는 2제 요법(LABA + LAMA) 또는 ICS를 포함한 3제 요법(ICS + LABA + LAMA)이 권고된다. 6) PDE4 억제제 PDE4 억제제는 흡입 치료 외에도 일부 환자에서는 경구용 약제가 보조적으로 사용된다. PDE4 억제제인 로플루밀라스트(roflumilast)는 만성 기관지염 양상을 보이며 급성 악화가 잦은 중증 환자에게 효과적이다. 또한 급성 악화 시에는 경구 스테로이드 및 항생제가 단기간 사용되며, 병원성 감염의 가능성을 고려해 적절히 투여된다. 기관지 확장제는 어떤 약제인가? 기도 저항(Airway resistance)의 감소는 기도 자체의 내재적(intrinsic) 요인과 외재적(extrinsic) 요인 모두에 의해 조절되며, 그 주요 기전으로는 평활근 이완, 기관 및 세기관지 벽의 염증 감소, 기도 분비물의 감소 등이 있다. 이 중 기도 평활근의 이완은 기관지 확장을 유도하기 위한 핵심 기전으로, 이는 두 가지 주요 약리학적 접근법을 통해 달성될 수 있다. β2-아드레날린 수용체(β2-AR)를 자극하는 β2-작용제(β2-agonist)의 직접적인 작용과 무스카린 수용체를 차단하여 아세틸콜린 신호 전달을 억제하는 항콜린제(antimuscarinic)의 간접적인 작용이다(Figure 2). 먼저, β2-작용제는 기도 평활근 세포, 특히 소기도(small airway)에 존재하는 β2-AR에 직접 결합함으로써 작용한다. 이 결합은 평활근 세포 내에서 AC(adenyl cyclase)를 활성화시켜 ATP로부터 cAMP가 생성시킨다. 생성된 cAMP는 두 가지 주요 하위 효과기를 활성화시킨다. 이때 PKA는 평활근 긴장을 조절하는 단백질들을 인산화하여 이완을 유도하고, Epac는 PKA와는 독립적으로 평활근 이완을 유도한다. 또한, cAMP는 세포 내 칼슘을 격리(sequestration)함으로써 추가적으로 수축을 억제하고 평활근 이완을 촉진한다. 다음, 항콜린제는 수축 작용을 하는 아세틸콜린(ACh)의 수용체 결합을 경쟁적으로 차단함으로써 간접적으로 평활근 이완을 유도한다. 기도 내 부교감신경 활성은 주로 M1 및 M3 무스카린 수용체를 통해 매개되며, 이들 수용체는 평활근 수축, 점액 분비, 섬모운동 증가를 유도한다. 반면, M2 수용체는 시냅스 전 말단에서 ACh의 방출을 억제하여 음성 되먹임 조절을 수행한다. COPD에서는 특히 콜린성 기도 긴장(cholinergic bronchomotor tone)이 병태생리에 중요한 역할을 하며, 기도 수축 및 점액 과다분비를 통해 기도 폐쇄를 악화시킨다. β2-작용제는 모든 기도 수준, 특히 COPD에 관여하는 소기도의 평활근 세포 표면의 β2-AR에 결합하여 작용한다. 반면, 무스카린 수용체 길항제는 기도 평활근의 M3 수용체를 차단함으로써 수축을 방지한다. 비록 소기도에는 미주신경의 직접적인 분포가 부족하지만, COPD와 같은 질환에서는 비신경원성(non-neuronal) 아세틸콜린에 의해 무스카린 수용체가 활성화되는 것으로 알려져 있다. 따라서 항콜린제(무스카린 수용체 길항제)는 대기도와 소기도 모두에서 확장 효과를 나타낼 수 있다. 따라서, β2-작용제와 항콜린제와의 복합요법(combination therapy)은 단독요법보다 기도 전 구간에 걸쳐 더 강력한 기관지 확장 효과를 제공할 수 있으며, 각 약물에 대한 환자 간(inter-patient) 및 환자 내(intra-patient) 반응의 이질성을 극복하는 데도 도움을 줄 수 있다. 나아가, 두 기전이 결합된 병용요법은 단순한 약물 투여 방식과 함께 신체활동 내성 증가, 일상 활동 수행 능력 향상, 삶의 질 개선에도 긍정적인 영향을 미친다. PDE 억제제에는 어떤 약제들이 있는가? PDE 억제제는 세포 내 cAMP 및 cGMP의 분해를 억제함으로써 해당 이차 전령의 농도를 증가시키고, 다양한 하위 신호경로인 PKA, PKG, EPAC, 이온 채널 등을 활성화시켜 생리적 반응을 조절한다. 이러한 작용은 단일 경로에 국한되지 않고 염증, 혈류역학, 대사, 면역 및 신경전달 등 다양한 체계에 걸쳐 조절 효과를 나타내며, 이에 따라 PDE 억제제는 다기능성 치료 플랫폼으로 진화하고 있다. COPD에서는 PDE 억제를 통해 기도 평활근 이완 및 항염증 효과를 유도하는 치료 전략이 오래전부터 탐색되어 왔다. 대표적으로 methylxanthine 계의 테오필린(Theophylline)은 비선택적 PDE 억제제(non-selective phosphodiesterase inhibitor) 로 기관지 확장 작용 외에 횡격막 근력 강화, 기관지 섬모운동 개선과 심박출량을 증가시키는 효과가 있다. 이러한 작용으로 인해 천식 및 COPD 치료에 오랫동안 사용되었으나, 치료역이 좁고 심혈관계 및 중추신경계 부작용이 자주 동반되어 임상 활용에 제한이 있다. 따라서 기관지확장 효과가 약해 흡입 기관지확장제 약물을 사용할 수 없는 상황에서만 제한적으로 사용한다. 이에 따라 초기에 개발된 PDE4 선택적 억제제인 롤리프람(Rolipram)은 T 세포 및 대식세포에서의 cAMP 증가를 통해 염증성 사이토카인 분비를 억제하는 기전을 보였으나, 심각한 위장관계 부작용으로 인해 임상 개발이 중단되었다. 이후 개발된 로플루밀라스트(Roflumilast)는 위장관계 부작용을 줄인 개선된 PDE4 억제제로, 2010년 미국 FDA에서 “기관지확장제 병용요법으로서, 급성 악화 병력이 있고 만성 기관지염을 수반한 중증 COPD 환자의 유지 치료” 적응증으로 승인되었으며, 유럽 EMA와 국내에도 승인을 받았다. 전임상 연구에 따르면, 로플루밀라스트는 기관지 상피세포에서 글루코코르티코이드 수용체 α(GRα)의 전사활성을 증가시키고, 이는 덱사메타손(dexamethasone)의 항염 효과를 GRα 의존적으로 증강시키는 것으로 나타났다. 그러나 여전히 위장 불편감, 체중 감소 등의 부작용이 빈번히 보고되어, 국제 GOLD 가이드라인에서는 LABA, LAMA, ICS를 병용함에도 악화를 반복하는 환자에 한해 3차 치료제(third-line agent)로 제한적 사용을 권고하고 있다. 한편, PDE3 역시 평활근세포에서 발현되어 기관지 수축성 조절에 관여하는데, PDE3 억제는 기관지 이완 효과를 유도한다. 이에 따라 PDE3 및 PDE4를 동시에 억제함으로써 기관지 확장과 항염 작용을 동시에 달성하려는 전략이 제시되었다. 실제로 전임상 연구에서는 이중 억제제가 단일 억제제보다 더 우수하거나, 상가적 효과를 유도함을 입증한 바 있다. 이러한 기전을 기반으로 최근 개발된 엔시펜트린(Ensifentrine)은 PDE3와 PDE4를 모두 억제하는 이중 작용 흡입제로, 기도 평활근 이완과 염증 반응 억제를 병행하는 새로운 기전의 약제가 개발되었다. 엔시펜트린(Ensifentrine)는 어떤 약제인가? 엔시펜트린(Ensifentrine, 제품명 : 오투바이어 흡입 현탁액, Ohtuvayre& 9415;)은 PDE3/PDE4 이중 억제제로, 2024년 6월에 미국 FDA로부터 COPD 유지 치료제로 승인되었다. 이는 기관지 수축 및 염증 반응을 동시에 표적으로 삼는 새로운 치료 옵션으로, 기존의 PDE 억제제보다 내약성 및 효능 면에서 개선된 특성을 나타낸다. 엔시펜트린의 기본 구조(parent molecule)는 trequinsin으로, 이는 다른 PDE 억제제들에 비해 기도 평활근에서 지속적인 기관지 확장 효과를 나타내며, 중간 수준의 PDE3 억제력과 약한 PDE4 억제력을 가진다. 엔시펜트린은 흡입 현탁액(inhalation suspension) 제제로 Jet nebulizer를 ㅛㅏ용하는 기관지 확장제 및 항염증제이다. Jet nebulizer는 호흡기 약물 전달을 위한 대표적인 흡입 장치로, 압축 공기를 이용한 벤츄리(Venturi) 효과를 기반으로 액상 약물을 미세한 에어로졸 입자로 변환시키는 기전으로 작동한다. 이 장치는 폐 말단부위까지 약물을 직접 도달시키는 능력으로 인해 특히 COPD이나 급성 호흡곤란 환자에게 유용하며, 고령 환자, 소아, 또는 기도 협착 환자와 같이 흡입 조절이 어려운 대상군에게 효과적인 약물 전달 수단이라고 할 수 있다. 엔시펜트린의 기관지 확장과 항염증 효과는 알레르기성 기관지 수축이 유도된 기니피그 모델 연구에서 기관지 폐포 세척액 및 비강 내 염증세포 침윤을 유의하게 감소시키는 효과가 확인되었다. 또한 항원 유도로 인한 호산구 이동은 흡입형 엔시펜트린 전처리 시 80% 이상 억제되었다. 또한, 시험관 내 연구(in vitro)에서 낭성섬유증 전도 조절 단백(CFTR)을 자극하는 효과가 확인되었으며, 이는 기도의 점액섬모 청소 기능(mucociliary clearance)을 개선할 가능성을 보여주었다. 엔시트린 허가사항 중 WARNINGS AND PRECAUTIONS에서 다음과 같이 안내하고 있다. 엔시펜트린 투여를 시작하기 전에, 의료진은 우울증 및/또는 자살 생각 또는 행동의 병력이 있는 환자에게서 엔시펜트린 치료의 이점과 위험을 신중히 평가해야 한다. 환자, 보호자 및 가족에게는 불면, 불안, 우울감, 자살 충동 또는 기타 기분 변화의 발생 또는 악화 여부를 주의 깊게 관찰할 필요성이 있음을 안내하고, 이러한 변화가 나타날 경우 즉시 의료진에게 연락할 것을 권고해야 한다. 이와 같은 사건이 발생한 경우, 의료진은 엔시펜트린 치료의 지속 여부에 대해 신중히 재평가해야 한다. 엔시펜트린 치료는 정신과적 이상반응 증가와 관련이 있다. 임상시험에서 엔시펜트린를 투여받은 환자 중 자살 관련 이상반응이 보고되었으며, 그 중 자살 시도 1건 및 자살 사례 1건이 포함되었다. 또한, 통합된 24주 안전성 평가 인구집단에서 가장 흔하게 보고된 정신과적 이상반응은 다음과 같다: 불면증은 엔시펜트린 3mg 투여군 6명(0.6%), 위약군 2명(0.3%)이었고, 불안은 엔시펜트린 3mg 투여군 2명(0.2%), 위약군 1명(0.2%)이었다. 우울 관련 반응(우울증, 주요우울증, 우울 기분을 동반한 적응장애 포함)은 엔시펜트린를 투여받은 환자 4명(0.4%)에서 발생하였으며, 위약 투여군에서는 보고되지 않았다. 엔시펜트린의 약리 기전은? 엔시펜트린은 PDE3와 PDE4를 동시에 억제하는 이중 억제제로, 이러한 신호전달 경로의 조절을 통해 치료 효과를 유도하는 새로운 흡입형 저분자 약물이다. PDE3는 주로 cAMP를 가수분해하지만, cGMP도 기질로 사용할 수 있는 특성을 지니며, PDE4는 cAMP에 특이적으로 작용하는 효소이다. 따라서 두 PDE를 동시에 억제함으로써 세포 내 cAMP 및 cGMP 농도가 모두 상승하게 되고, 이는 기도 평활근 이완, 항염작용, 점액 분비 감소 및 섬모 기능 강화 등 복합적인 생리학적 효과를 유도한다(Figure 3). 특히 PDE3와 PDE4는 기도 평활근, 염증세포, 기관지 상피세포에 널리 발현되어 있어, 이들에 대한 동시 억제는 단일 PDE 억제보다 상승적 또는 시너지 효과를 유도할 수 있다. 이러한 작용 특성은 엔시펜트린이 기관지 확장, 기도 염증 조절, 점액섬모 청소 기능(mucociliary clearance)에 걸친 통합적 치료 효과를 발휘할 수 있다. 엔시펜트린(OHTUVAYRE& 9415;)의 허가 임상은 어떠한가? 엔시펜트의 유효성은 ENHANCE-1 및 ENHANCE-2의 24주간 무작위 배정, 이중눈가림, 위약 대조, 병렬군 임상시험을 통해 평가되었다. 이 두 연구에는 중등도에서 중증의 COPD를 가진 총 1,553명의 성인 환자가 등록되었다. ENHANCE-1에서는 763명의 환자가 등록되어 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 표준 제트 네불라이저를 통해 흡입하도록 배정되었다. 등록 시점에서 기관지 확장제 투여 후 예측 FEV1 평균은 52%(범위: 27~85%), FEV1/FVC 비율은 평균 0.52(범위: 0.22~0.71)였다. 또한, 전체 환자의 68%는 LAMA, LABA, 또는 LABA/ICS와 같은 병용 치료를 받고 있었으며, 각각 30%, 18%, 20%가 해당 약제를 사용하고 있었다. ENHANCE-2는 총 790명의 환자를 대상으로 동일한 방식으로 설계되었으며, 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 제트 네불라이저를 통해 하루 두 번 흡입하도록 배정하였다. 등록 시점의 평균 예측 FEV1은 51%(범위: 23~81%)였고, FEV1/FVC 비율은 평균 0.52(범위: 0.24~0.71)였다. 이 연구에서도 55%의 환자가 병용 치료를 받고 있었으며, LAMA, LABA , LABA/ICS와 같이 병용 치료를 받고 있었으며, 각각 33%, 7%, 15%가 해당 약제를 사용하고 있었다. 두 연구 모두에서 주요 평가변수였던 12주차 FEV₁의 시간-농도 곡선 면적(AUC& 8320;& 8211;12h)은 위약 대비 유의하게 개선되었다. ENHANCE-1 및 ENHANCE-2 연구에서는 모든 환자를 대상으로 베이스라인 시점과 12주차에 걸쳐 12시간 동안 연속 폐기능 검사(serial spirometry)가 수행되었다. ENHANCE-1의 12주차 연속 폐기능 검사 결과는 trough FEV1은 아침 투약 직전 마지막으로 측정된 FEV1 값으로 정의되었다. 12주차 시점에서 위약 대비 평균 아침 trough FEV1의 개선치는 ENHANCE-1에서 35mL (95% 신뢰구간: 14, 68), ENHANCE-2에서는 49 mL(95% 신뢰구간: 19, 80)로 나타났으며, 이는 ENHANCE-1에서 통계적으로 유의하였으나, ENHANCE-2에서는 분석 단계(hierarchical testing) 상위 단계의 실패로 인해 통계적 유의성이 확보되지 않았다. St. George’s 호흡기 설문지(SGRQ)를 통해 두 시험에서 시행되었으며, SGRQ 반응률은 점수가 4점 이상 개선된 경우로 정의되었다. ENHANCE-1에서 24주차 시점의 SGRQ 반응률은 OHTUVAYRE 투여군에서 58.2%, 위약군에서 45.9%로 나타났고, 이에 대한 Odds Ratio는 1.49(95% CI: 1.07, 2.07)로 통계적 유의성이 있었다. 반면, ENHANCE-2에서는 OHTUVAYRE 투여군의 반응률이 45.4%, 위약군이 50.3%였으며, Odds Ratio는 0.92(95% CI: 0.66, 1.29)로, 통계적 유의성은 나타나지 않았다. 엔시펜트린의 예상되는 쟁점은 무엇인가? 현재까지의 COPD 치료 전략은 주로 기관지 확장제 및 항염증 흡입제에 기반하였으며, 증상 완화와 급성 악화의 예방을 목표로 했다. 그러나 일부 환자에서는 기존 약물요법으로 충분한 치료 효과를 얻지 못하거나, 흡입기 사용에 대한 어려움으로 치료 순응도가 저하되는 문제가 지속적으로 제기되어 왔다. 엔시펜트린은 이러한 한계를 극복하기 위해 개발된 약제로, PDE 3와 PDE4를 동시에 억제하는 최초의 흡입형 치료제이다. PDE3 억제를 통해 기관지 평활근을 이완시켜 기관지 확장 효과를 유도하고, PDE4 억제를 통해 염증세포에서의 사이토카인 분비 및 염증 반응을 억제함으로써 항염 효과를 나타낸다. 이러한 이중 작용은 단일 기전 약물에 비해 증상 개선 및 염증 조절에 있어 시너지 효과를 기대할 수 있다. 엔시펜트린은 제트 네뷸라이저를 통해 투여되는 제형으로, 흡입기 사용이 어려운 고령 환자나 협조가 부족한 환자에게 유용한 대안이 될 수 있다. 또한 기존 유지 치료제(LABA, LAMA, ICS)와 병용 가능하며, 특히 기존 치료에 반응이 불충분한 환자에게 추가적인 임상적 혜택을 제공할 수 있다. 다만, 단시간 작용성 기관지 확장제(SABA/SAMA)에 비해 작용 발현 속도가 느리기 때문에 급성 증상 완화에는 적합하지 않으며, 휴대성과 투여 시간(약 5& 8211;7분) 측면에서도 일상 생활에서 제한점이 존재한다. 임상적으로는 두 건의 ENHANCE-1 및 ENHANCE-2 3상 무작위 위약 대조 시험을 통해 엔시펜트린의 유효성과 안전성이 평가되었다. ENHANCE-1에서는 폐기능 개선과 건강 관련 삶의 질 향상(예: SGRQ 점수)의 통계적 유의성이 입증되었으며, 탈락률도 낮아 근거 수준이 높은 연구로 간주된다. 반면 ENHANCE-2는 지역적 인구 구성의 차이 및 통계적 유의성 부족으로 인해 지원적 자료(supportive evidence)로 해석되었으며, 두 연구가 동일한 근거 수준으로 채택되지는 않았다. 현재 엔시펜트린은 미국 FDA로부터 승인을 받았으나, 유럽 EMA에서는 정식 승인을 획득하지 못한 상태이다. 이와 같은 규제 환경은 약물의 글로벌 접근성 및 보급에 있어 중요한 장애가 되고 있다. 결론적으로, 엔시펜트린은 기전적 이점을 바탕으로 기존 치료의 한계를 보완하고, 특정 환자군에서 치료 옵션의 다양성을 확대할 수 있는 약제로 평가된다. 향후 유럽 EMA 승인과 후속 임상 연구와 실제 임상에서의 사용 경험이 축적됨에 따라, 이중 PDE 억제제는 COPD 약물 치료의 새로운 전환점을 제시할 수 있을 것으로 기대해 본다. 참고문헌 1. Isaac Levy et al. “Phosphodiesterase function and endocrine cells: links to human disease and roles in tumor development and treatment” Curr Opin Pharmacol. 2011;11(6):689& 8211;697. 2. Nardini et al. “COPD: maximization of bronchodilationMultidisciplinary Respiratory Medicine” 2014, 9:50. 3. James F Donohue et al. “Ensifentrine as a Novel, Inhaled Treatment for Patients with COPD“ International Journal of Chronic Obstructive Pulmonary Disease 2023:18. 4. Rinzhin T et al. “Advancing Obstructive Airway Disease Treatment: Dual PDE3/4 Inhibition as a Therapeutic Strategy“ Cells 2025, 14, 659. 5. Nicola A. Hanania, Bartolom& 233; R. Celli, ”Phosphodiesterase Inhibition as a Therapeutic Strategy for Chronic Obstructive Pulmonary Disease: Where We Have Been and What Lies Ahead“ Chronic Obstr Pulm Dis. 2025; 12(1): 82-92. 6. COPD 진료지침 대한결핵 및 호흡기학회 2024 개정. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-06-27 06:00:46최병철 박사
PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대6편: 최초의 흡입형 PDE3/PDE4 이중 억제 COPD 치료제, 오투베어(Esifentrine) 오투베어(Ohtuvayre& 9415;, OH-too-vare 성분명 엔시펜트린 흡입 현탁액, Esifentrine& 9415;, Verona Pharma)는 최초의 흡입용 PDE3/PDE4 효소 선택적 이중 억제제로서, 2024년 6월 미국 FDA에서 '성인 만성폐쇄성폐질환(chronic obstructive pulmonary disease, COPD) 환자의 유지요법제'에 승인되었으며, 유럽에서는 아직 승인되지 않았다. 현재 이 약제와 유사한 PDE4 억제제인 '닥사스(roflumilast)'는 '중증 COPD 환자의 급성 악화 빈도를 감소'에 승인된 약제로 미국 FDA 및 국내에서 소개되어 있다. 이 약제는 기도와 폐 실질의 염증세포에서 cAMP 분해 효소인 PDE3 및 PDE4 효소를 선택적으로 억제함으로써, 기관지확장과 비스테로이드성 항염증 효과를 하나로 결합하여 높은 흡기 유속이나 복잡한 손-호흡 조정 없이 표준 제트 네블라이저를 통해 폐에 약물을 직접 전달되도록 설계되었다. 이 cAMP 경로는 COPD의 병태 생리를 조절하는 내재적 항염증 기전으로 중요하게 작용하며, 이를 조절하는 약물학적 접근은 기존의 기관지 확장제나 흡입 스테로이드 기반 치료를 보완할 수 있는 새로운 치료 전략으로 자리매김하고 있다. 오투베어의 미국 FDA 승인은 미국호흡기중환자 의학저널(American Journal of Respiratory and Critical Care Medicine)에 게재된 임상 3상 시험 ENHANCE의 결과를 포함한 광범위한 데이터를 기반으로 이뤄졌다. ENHANCE 임상시험에서 오투바이어는 단독요법으로 투여하거나 다른 유지요법과 함께 사용했을 때 폐 기능 개선을 포함한 임상적 이점을 제공한 것으로 입증되었다. 이는 중등도에서 중증의 COPD를 가지고 있는 광범위한 그룹에서 내약성이 우수하였다. 오투바이어는 COPD 외에도 비-낭성섬유증 기관지확장증, 낭성섬유증, 천식, 기타 호흡기질환에 대한 치료제로 평가되고 있다. 또한 오투바이어와 지속성 항콜린제(LAMA)인 glycopyrrolate의 고정용량 복합제를 COPD 유지요법으로 개발 중이다. 만성폐쇄성폐질환(Chronic obstructive pulmonary disease, COPD)은 어떤 질환인가? COPD는 기류 제한이 지속적으로 나타나는 진행성 호흡기 질환으로, 기도 및 폐 실질의 만성 염증과 그에 따른 폐기능 저하가 주요 병리학적 특징이다. 임상적으로는 호흡곤란, 만성 기침, 객담 등 다양한 증상이 발현되며, 반복적인 급성 악화는 삶의 질 저하뿐 아니라 사망률 증가와도 밀접하게 연관되어 있다. 전 세계적으로 COPD는 주요 사망 원인 중 하나로 보고되고 있으며, 고령화와 흡연율 증가에 따라 그 유병률은 지속적으로 상승하고 있다. COPD의 병태생리에는 대식세포(macrophages), 호중구(neutrophils), CD8+ T 림프구(cytotoxic T cells) 등 선천 및 후천 면역세포의 활성화가 중심적인 역할을 하며, 이들 면역세포는 다수의 염증 촉진성 사이토카인(IL-8, TNF-α 등), 프로테아제(matrix metalloproteinases), 그리고 활성산소종(reactive oxygen species)을 과도하게 분비한다. 이러한 염증 반응은 기도 리모델링, 점액 과분비, 폐포 구조의 파괴 및 폐 실질의 손상 등 병리적 변화를 유도하여 기류 제한을 지속시키는 주요 기전으로 작용한다. 이러한 만성 염증 반응을 조절하기 위한 내재적 조절 기전 중 하나로 주목받는 것이 cyclic adenosine monophosphate(cAMP) 신호 전달 경로이다. cAMP는 adenylyl cyclase에 의해 생성되는 대표적인 이차 전령(second messenger)으로, 세포 내에서 protein kinase A(PKA) 및 Epac(Exchange Protein directly Activated by cAMP) 등의 하위 효과기를 통해 다양한 생리학적 반응을 매개한다. 구체적으로, cAMP는 염증성 유전자 발현 억제, 항산화 반응 촉진, 섬모 운동 촉진, 점액 분비 감소 및 기관지 평활근의 이완 등을 유도함으로써 COPD 병태생리의 여러 측면을 동시에 조절할 수 있는 기능을 한다. 그러나 COPD 환자에서는 염증세포 내에서 phosphodiesterase-4(PDE4)의 과발현으로 인해 cAMP가 병태적으로 분해되고, 그 농도가 비정상적으로 낮아지는 현상이 관찰된다. 이러한 기전은 항염 및 기관지 보호 효과를 저해하며, 결과적으로 만성 염증을 악화시키는 데 기여한다. Cyclic nucleotides(고리형 뉴클레오타이드)란 무엇인가? Cyclic nucleotides는 세포 내 신호전달 경로에서 이차 전령으로 작용하는 분자군으로, 다양한 생리학적 자극에 대한 세포 반응을 매개하는 데 중심적인 역할을 수행한다. 이들은 주로 ATP(adenosine triphosphate) 또는 GTP(guanosine triphosphate)로부터 유도되어 생성되며, 대표적인 형태로 cAMP(cyclic adenosine monophosphate)와 cGMP(cyclic guanosine monophosphate)가 있다. cAMP는 adenylyl cyclase(AC)의 촉매 작용에 의해 ATP로부터 생성되며, 이는 G 단백질 연결 수용체(G protein-coupled receptor, GPCR)의 활성화에 의해 유도된다. 이는반면, cGMP는 guanylyl cyclase(GC)에 의해 GTP로부터 유도되며, 이는 나트륨이뇨펩타이드(natriuretic peptides) 또는 산화질소(nitric oxide, NO)와 같은 세포외 신호에 의해 활성화된다. 이 두 경로는 상이한 생리적 자극과 수용체를 통해 선택적으로 작용하면서 세포 특이적 반응을 조절한다(Figure 1). 생성된 cAMP는 주로 PKA와 EPAC(exchange protein directly activated by cAMP, cAMP에 의해 직접 활성화되는 교환 단백질)을 통해 세포 기능을 조절한다. PKA는 대사 조절, 세포 분화, 증식, 생존 등 광범위한 생물학적 과정에 관여하며, EPAC은 integrin 매개 세포 부착, 세포 간 접합 형성, 분비(exocytosis), 인슐린 분비 등 PKA-비의존성 경로를 통해 다양한 세포 기능을 조절한다. 특히, 세포 내 cAMP 농도가 상승하면 cAMP-의존성 PKA가 활성화된다. PKA는 두 개의 촉매 서브유닛(C)과 두 개의 조절 서브유닛(R)으로 이루어진 이종사량체(heterotetramer)로 구성되며, 평상시에는 비활성 상태로 존재한다. 그러다 cAMP가 R 서브유닛에 결합하면 촉매 서브유닛이 유리되어 다양한 표적 단백질을 인산화한다. 이 중 대표적인 인산화 표적은 CREB(cAMP response element binding protein)으로, 이는 대사 조절 및 세포 증식에 관여하는 유전자 발현을 조절하는 전사 인자이다. 반면, 생성된 cGMP는 주로 PKG를 활성화시키며, 이는 세포 내 여러 표적 단백질을 인산화하여 평활근 수축 조절, 세포자멸사, 염증 반응, 시각 신호전달, 혈소판 응집 등 생리적 반응을 유도한다. 이러한 cyclic nucleotide의 생물학적 활성을 종료시키는 주요 기전은 phosphodiesterase (PDE)에 의해 수행된다. PDE는 cAMP 및 cGMP를 각각 5’-AMP 또는 5’-GMP의 비고리형 형태로 분해함으로써 이차 전령 신호를 효과적으로 불활성화시킨다. cAMP 신호전달 경로는 어떤 역할을 하는가? cAMP는 1958년 Sutherland와 Rall에 의해 처음 발견된 이후, cAMP는 호르몬, 신경전달물질, 면역조절 인자 등 외부 자극에 의해 활성화되는 AC(adenyl cyclase)에 의해 ATP로부터 생성되는 고리형 뉴클레오타이드로 정의되었다. 세포는 외부 환경으로부터의 자극에 신속하고 정밀하게 반응하기 위해 다양한 신호전달 시스템을 갖추고 있으며, 이에는 cAMP를 생성하는 AC가 존재한다. AC는 세포막에 존재하는 효소로, ATP를 cAMP로 전환하는 반응을 촉매하며, 이 과정은 GPCR의 활성화에 의해 주로 조절된다. GPCR은 세포막을 7회 통과하는 구조의 수용체로, 외부의 호르몬, 신경전달물질, 생리활성 분자 등의 리간드를 인식하여 이질삼합체 G 단백질(heterotrimeric G protein)을 활성화시킨다. 이때 GPCR은 Gs 단백과 결합하여 AC를 활성화하고, 이를 통해 세포 내 cAMP 생성을 유도한다. 반면 Gi 단백을 통해서는 AC 활성을 억제하여 cAMP 생성을 저해한다. 기도 조직에서 cAMP 농도의 증가는 평활근 이완과 염증 반응 억제를 유도하여, 천식을 포함한 폐쇄성 기도 질환의 병태생리 조절에 기여하는 것으로 알려져 있다. 아울러, PKA는 세포 내 Ca²& 8314; 농도의 감소, Ca²& 8314;에 대한 민감도 저하, MLC 비의존 경로 조절 등 다양한 기전을 통해 기관지 확장 효과를 나타낸다. 또한, cAMP는 섬모 운동(ciliary motility)을 촉진하여 점액섬모 청소(mucociliary clearance)를 향상시키며, 이는 기도 내 분비물 제거와 염증 완화에 기여한다. 이러한 이중 조절 메커니즘은 세포가 자극의 종류와 강도에 따라 cAMP 농도를 정밀하게 조절할 수 있게 하며, 하위 효과기인 PKA, EPAC 등을 통해 궁극적인 생리학적 반응으로 이어진다. cAMP 신호전달 경로의 특이성 및 세포 내 농도는 PDE에 의해 조절되며, PDE는 cAMP를 5’-AMP로 분해하여 신호를 종료시킨다. 특히 PDE4, PDE7, PDE8은 cAMP를 선택적으로 분해하는 isoform으로, 면역세포와 염증세포에 풍부하게 발현되어 있어 염증성 질환에서 중요한 조절 인자로 작용한다. 이에 따라 PDE4 억제제인 닥사스(roflumilast)는 cAMP 농도를 증가시켜 항염증 작용을 유도한다. 따라서, cAMP 신호전달 경로는 외부 자극에 대한 세포의 신속하고 정밀한 반응을 유도하는 고차원적인 조절 기전이며, 그 구성 요소와 하위 경로를 표적으로 한 약리학적 개입은 염증성, 대사성, 심혈관성 질환을 포함한 다양한 병태에서 치료적 가능성을 제시한다. 최근 연구들은 cAMP 의존성 신호전달 경로의 복잡성과 생물학적 중요성을 더욱 강조하고 있으며, 특히 기도 평활근(airway smooth muscle, ASM) 세포에서 β₂-아드레날린 수용체(β₂-adrenergic receptor, β₂AR)와 같은 GPCR의 활성이 이러한 경로를 중심으로 작동함이 밝혀졌다. Phosphodiesterase(PDE)는 무엇인가? PDE는 세포 내에서 cyclic nucleotide(cAMP 및 cGMP)의 3’,5’-고리형 인산 결합을 가수분해하여 각각 AMP(adenosine monophosphate) 또는 GTP(guanosine momophosphate)로 전환함으로써 이차 전령의 신호를 종료시키는 역할을 수행한다. PDE는 신호 전달의 시간적 지속성과 공간적 국소화, 그리고 신호의 강도 조절에 주요 생화학적 조절자(gatekeeper)로 기능하며, 이에 따라 다양한 생리 및 병리 현상의 미세 조절자로 작용한다. 현재까지 확인된 PDE는 총 11개 계열(PDE1& 8211;PDE11)로 구성되며, 이들은 아미노산 서열, 기질 특이성, 약물 감수성, 조절 메커니즘 등의 차이에 따라 구분된다. 각 아형(family)은 서로 다른 조직 특이성 및 세포 내 소분획(localization)을 보이며, 동일한 기질(cAMP 또는 cGMP)에 작용하더라도 그 기능적 결과는 상이할 수 있다. 예를 들어, PDE4, PDE7, PDE8은 cAMP 특이적, PDE5, PDE6, PDE9는 cGMP 특이적, PDE1, PDE2, PDE3, PDE10, PDE11은 양쪽 기질 모두에 작용할 수 있다(Table 1). PDE의 활성 이상은 만성 염증성 질환, 심혈관 질환, 신경정신질환, 악성종양 등 다양한 질환의 병태생리와 밀접한 관련이 있으며, 특히 PDE3와 PDE4는 COPD와 같은 염증성 폐질환에서 병태생리학적 역할을 한다 . PDE3는 상대적으로 높은 cAMP 친화도를 가지며, PDE3A와 PDE3B의 두 아형으로 구분된다. PDE3A는 폐 상피세포, 혈관 내피세포, 기도 평활근세포(airway smooth muscle, ASM), 염증세포 등에서 발현되며, 특히 혈관 평활근세포에서 주요하게 존재하며 평활근 긴장도 조절에 관여한다. 반면, PDE3B는 지방세포, 간세포, 정자세포 등 대사 활성이 높은 조직뿐만 아니라 T세포 및 대식세포에서도 발현되어, 염증 반응 조절 및 대사 경로에 영향을 미친다. PDE4는 네 가지 유전자(PDE4A& 8211;D)와 다양한 스플라이싱 변이체로 구성되며, 호흡기계 조직을 포함한 다양한 기관에 광범위하게 분포한다. 특히 PDE4D는 인간 기도 평활근세포에서 cAMP 분해를 조절하는 주요 효소로 작용하며, PDE4 전체는 백혈구, 대식세포, 호중구 등 염증세포뿐 아니라 기도 상피세포 및 폐 신경계에도 발현되어 염증 반응의 조절자로 기능한다. 임상 및 전임상 연구에 따르면, COPD 환자, 특히 흡연자에서 PDE4 발현이 유의하게 증가되어 있음이 보고되었으며, PDE4 억제를 통해 cAMP 농도를 증가시키는 것은 염증 촉진성 사이토카인의 발현 감소, 염증세포의 조직 내 침윤 억제 등 광범위한 항염증 효과를 유도하는 것으로 나타났다. 이러한 기전을 기반으로 PDE4 억제제 닥사스(roflumilast)는 ‘기관지확장제의 부가요법제로서, 증상악화 병력이 있고, 만성기관지염을 수반한 중증의 만성폐쇄성폐질환의 유지요법제’로 승인되어 있다. COPD에는 어떤 약제들을 사용하는가? COPD에 대한 약물 치료의 목적은 증상의 완화, 급성 악화의 예방, 신체활동 능력 향상 및 장기적인 예후 개선에 있다. 이에는 주로 흡입제에 기반하며, 기관지 확장제가 치료의 핵심이다. 기관지확장제는 호흡기 질환에서 폐쇄된 기도를 확장시켜 기류를 개선하는 약제로, 천식과 COPD와 같은 기도 폐쇄성 질환에 사용된다. 이러한 약제는 기관지 평활근(bronchial smooth muscle)의 이완을 유도하여 기도 저항을 감소시키며, 환자의 증상을 완화하고 폐기능을 향상시키는 데 기여한다. 기관지확장제는 작용 기전에 따라 크게 β2-아드레날린 수용체 작용제(β2-agonists), 항콜린제(Anticholinergics) 또는 무스카린 수용체 길항제(Muscarinic antagonists), 메틸잔틴계(Methylxanthines)가 있다. 아울러 약물의 효과 및 부작용 등을 고려하여 흡입제를 주로 사용하며, 흡입기 종류는 크게 건조분말흡입기(dry power inhaler, DPI), 정량흡입기(metered dose inhaler, MDI)로 나뉘고, 다시 MDI는 가압 정량흡입기(pressurized metered dose inhaler, pMDI)와 연무형 흡입기(soft mist inhaler, SMI)로 나뉜다. pMDI는 다시 호흡 작동식 흡입기(breath-operated inhaler, BOI or breath-actuated inhale, BAI)와 비호흡 작동식 호흡기(Non-BOI)로 나뉘는데 호흡 작동식 흡입기는 아직 국내에 없다. 또한 분무기(nebulizer, 네불라이저)도 흡입제 치료에 속한다. 1) 베타-2 작용제(β2-agonists) β2-작용제는 기관지 평활근 세포에 발현된 β2-아드레날린 수용체에 선택적으로 결합하여 Gs 단백질을 통한 adenylyl cyclase 활성화, 이어지는 cAMP 농도 증가 및 PKA 활성화를 유도함으로써, 평활근 세포 내 칼슘 농도를 낮추고 근수축 관련 단백질들의 기능을 억제하여 기관지 확장을 유발한다. 또한 섬모운동 촉진 및 혈관 투과성 감소 등의 부수적 효과를 통해 기도 청소 기능 개선에도 기여할 수 있다. 임상적으로 β2-작용제는 작용 시간에 따라 단시간 작용제(short-acting β2-agonists, SABA)와 장시간 작용제(long-acting β2-agonists, LABA)로 구분된다. SABA는 증상 완화를 위한 구제 치료(reliever therapy)로 사용되며, 대표적으로 살부타몰(Salbutamol)과 테르부탈린(Terbutaline)이 있다. SABA의 사용은 FEV1의 호전과 증상을 개선시킬 수 있다. SABA는 4-6시간 지속되고, LABA는 12시간 이상 지속되며, 규칙적인 LABA 사용을 하는 환자에서도 필요시 SABA 사용은 증상 완화에 도움이 될 수 있다. 반면, LABA는 하루 12시간 이상 지속되는 작용시간을 가지며 천식의 유지 치료(controller therapy) 혹은 COPD의 증상 조절을 위한 병용 요법에 사용되며, 대표적으로 살메테롤(Salmeterol)과 포르모테롤(Formoterol)이 있다. 이들 약제는 폐기능과 삶의 질을 개선시키고 호흡곤란과 급성 악화와 입원의 빈도를 감소시키지만, 사망률이나 폐기능 감소 속도에는 영향을 주지 못한다. 이 외에도 24시간 작용 지속 시간을 가진 초장시간 작용제(ultra-LABA)인 인다카테롤(Indacaterol), 올로다테롤(Olodaterol) 등이 COPD 치료에 활용되고 있다. 이들 약제는 호흡곤란과 악화위험을 감소시키고 삶의 질을 개선시킨다. 이러한 β2-작용제는 그 효과의 빠른 발현과 우수한 증상 완화 효과로 인해 널리 사용되고 있으나, 단독 사용 시 특히 천식 환자에서 기도 염증을 충분히 조절하지 못하며 오히려 기전적 내성(tachyphylaxis)이나 염증 악화의 위험을 높일 수 있다는 우려도 제기되어 왔다. 이에 따라 ICS(흡입 스테로이드)와의 병용이 원칙이며, 한 기기 내 고정용량 복합제(FDC) 형태로 투여하는 방법이 표준화되고 있다. 2) 항콜린제((Anticholinergics) 항콜린제는 기관지 평활근, 점액선, 혈관 등에 존재하는 무스카린 수용체(muscarinic receptor) 중 특히 M3 수용체에 선택적으로 작용하여, 아세틸콜린이 이 수용체에 결합하는 것을 차단함으로써 평활근 수축 및 점액 분비를 억제한다. 이로 인해 기도 저항이 감소하고 호흡 증상이 완화되며, COPD 환자의 폐기능 개선과 급성 악화 빈도 감소에 기여한다. 항콜린제는 작용 지속 시간에 따라 단시간 작용 항무스카린제(short-acting muscarinic antagonists, SAMA)와 장시간 작용 항무스카린제(long-acting muscarinic antagonists, LAMA)로 분류된다. SAMA는 주로 단기 증상 완화에 사용되며, 대표적으로이프라트로피움(Ipratropium)와 옥시트로피움(Oxitropium)이 있다. 이들 약제는 M3 비선택적 억제로, 억제성 신경 수용체인 M2를 차단함으로써 잠재적으로 미주신경을 통해 기관지 수축을 유발시킬 수 있다. LAMA는 하루 1회 또는 2회 흡입으로 지속적인 기도 확장을 유지할 수 있어 COPD 유지 치료의 핵심 약제로 사용된다. 대표적으로 티오트로피움(Tiotropium), 글리코피로니움(Glycopyrronium), 우메클리디늄(Umeclidinium) 등이 있다. 이들 약제는 M3 선택적 억제로, M3 무스카린성 수용체에 대한 장시간의 결합 및 M2 무스카린성 수용체와의 빠른 해리를 통해 기관지 확장제의 효과 지속 시간을 연장시킨다. 항콜린제는 β2-작용제와 병용할 경우 상호 보완적인 기전으로 기관지 확장 효과가 증대되며, 특히 COPD 환자에서는 LAMA + LABA 병용요법이 임상적으로 우월한 효과를 보인다. 항콜린제는 흡입 제형으로 투여 시 전신 흡수가 거의 없어 안전성이 높고, 주요 부작용은 구강건조, 쓴맛, 드물게 요폐 등의 국소적 반응에 국한된다. 이로 인해 장기적인 유지 요법에 적합한 약제로 간주된다. 3) 흡입스테로이드제(Inhaled corticosteroid, ICS) ICS는 합성된 글루코코르티코이드 계열 약제로, 폐로 직접 흡입되어 작용함으로써 전신 노출을 최소화하면서 강력한 항염 작용을 발휘한다. 세포 내 글루코코르티코이드 수용체(glucocorticoid receptor, GR)와 결합한 후 전사조절인자(transcriptional regulator)로 기능하여, 염증 유전자 발현을 억제하고 항염증 단백질 생성을 유도한다. 특히 NF-κB, AP-1 등 주요 염증 촉진성 전사인자의 활성을 차단함으로써 IL-4, IL-5, IL-13 등 Th2 관련 사이토카인의 생성을 억제하며, 호산구(eosinophil) 및 비만세포(mast cell)의 기도 내 침윤과 활성을 감소시킨다. 이러한 작용기전은 기관지 평활근의 수축성을 저하시켜 기도 과민 반응을 감소시키고, 상피세포의 장벽 기능 회복과 점액선의 과활성 억제를 통해 전반적인 기도 염증 조절에 기여한다. ICS는 흡입제 형태로 국소적으로 투여되어 전신 부작용을 최소화하면서 장기간 안전하게 사용 가능하다는 점에서 ICS는 천식 치료에 있어 핵심적인 치료제로 간주된다. 이는 단독 사용뿐 아니라 LABA 또는 LAMA와의 병용 요법이 표준화되었다. 4) Phosphodiesterase-4(PDE4) 억제제 PDE4 억제제는 cAMP의 대사를 억제하여 세포내 cAMP 농도를 높이는데 이는 항 염증 효과를 나타내고 또한 호중구의 이동과 화학 주성을 억제하는 효과도 있다. 로플밀라스트(Roflumilast)는 선택적인 PDE4 억제제 중의 하나로 가래 호중구와 호산구를 감소키는 항염증 작용이 확인되어 PDE4억제제 중 COPD 치료제로 허가 받은 유일한 약제이다. 하루 한번 복용하는 경구용 약제로 기관지 확장제가 아니지만 FEV1과 삶의 질 향상효과가 있다. 따라서, 단기간 작용시간을 가지는 SABA와 SAMA는 주로 증상이 갑자기 악화될 때 사용되며, LABA와 LAMA는 유지 치료의 중심으로 사용된다. 5) 병용요법 이러한 약제들은 단독 혹은 병합 요법으로 사용되며, 특히 증상이 지속되거나 급성 악화가 반복되는 환자에서는 2제 요법(LABA + LAMA) 또는 ICS를 포함한 3제 요법(ICS + LABA + LAMA)이 권고된다. 6) PDE4 억제제 PDE4 억제제는 흡입 치료 외에도 일부 환자에서는 경구용 약제가 보조적으로 사용된다. PDE4 억제제인 로플루밀라스트(roflumilast)는 만성 기관지염 양상을 보이며 급성 악화가 잦은 중증 환자에게 효과적이다. 또한 급성 악화 시에는 경구 스테로이드 및 항생제가 단기간 사용되며, 병원성 감염의 가능성을 고려해 적절히 투여된다. 기관지 확장제는 어떤 약제인가? 기도 저항(Airway resistance)의 감소는 기도 자체의 내재적(intrinsic) 요인과 외재적(extrinsic) 요인 모두에 의해 조절되며, 그 주요 기전으로는 평활근 이완, 기관 및 세기관지 벽의 염증 감소, 기도 분비물의 감소 등이 있다. 이 중 기도 평활근의 이완은 기관지 확장을 유도하기 위한 핵심 기전으로, 이는 두 가지 주요 약리학적 접근법을 통해 달성될 수 있다. β2-아드레날린 수용체(β2-AR)를 자극하는 β2-작용제(β2-agonist)의 직접적인 작용과 무스카린 수용체를 차단하여 아세틸콜린 신호 전달을 억제하는 항콜린제(antimuscarinic)의 간접적인 작용이다(Figure 2). 먼저, β2-작용제는 기도 평활근 세포, 특히 소기도(small airway)에 존재하는 β2-AR에 직접 결합함으로써 작용한다. 이 결합은 평활근 세포 내에서 AC(adenyl cyclase)를 활성화시켜 ATP로부터 cAMP가 생성시킨다. 생성된 cAMP는 두 가지 주요 하위 효과기를 활성화시킨다. 이때 PKA는 평활근 긴장을 조절하는 단백질들을 인산화하여 이완을 유도하고, Epac는 PKA와는 독립적으로 평활근 이완을 유도한다. 또한, cAMP는 세포 내 칼슘을 격리(sequestration)함으로써 추가적으로 수축을 억제하고 평활근 이완을 촉진한다. 다음, 항콜린제는 수축 작용을 하는 아세틸콜린(ACh)의 수용체 결합을 경쟁적으로 차단함으로써 간접적으로 평활근 이완을 유도한다. 기도 내 부교감신경 활성은 주로 M1 및 M3 무스카린 수용체를 통해 매개되며, 이들 수용체는 평활근 수축, 점액 분비, 섬모운동 증가를 유도한다. 반면, M2 수용체는 시냅스 전 말단에서 ACh의 방출을 억제하여 음성 되먹임 조절을 수행한다. COPD에서는 특히 콜린성 기도 긴장(cholinergic bronchomotor tone)이 병태생리에 중요한 역할을 하며, 기도 수축 및 점액 과다분비를 통해 기도 폐쇄를 악화시킨다. β2-작용제는 모든 기도 수준, 특히 COPD에 관여하는 소기도의 평활근 세포 표면의 β2-AR에 결합하여 작용한다. 반면, 무스카린 수용체 길항제는 기도 평활근의 M3 수용체를 차단함으로써 수축을 방지한다. 비록 소기도에는 미주신경의 직접적인 분포가 부족하지만, COPD와 같은 질환에서는 비신경원성(non-neuronal) 아세틸콜린에 의해 무스카린 수용체가 활성화되는 것으로 알려져 있다. 따라서 항콜린제(무스카린 수용체 길항제)는 대기도와 소기도 모두에서 확장 효과를 나타낼 수 있다. 따라서, β2-작용제와 항콜린제와의 복합요법(combination therapy)은 단독요법보다 기도 전 구간에 걸쳐 더 강력한 기관지 확장 효과를 제공할 수 있으며, 각 약물에 대한 환자 간(inter-patient) 및 환자 내(intra-patient) 반응의 이질성을 극복하는 데도 도움을 줄 수 있다. 나아가, 두 기전이 결합된 병용요법은 단순한 약물 투여 방식과 함께 신체활동 내성 증가, 일상 활동 수행 능력 향상, 삶의 질 개선에도 긍정적인 영향을 미친다. PDE 억제제에는 어떤 약제들이 있는가? PDE 억제제는 세포 내 cAMP 및 cGMP의 분해를 억제함으로써 해당 이차 전령의 농도를 증가시키고, 다양한 하위 신호경로인 PKA, PKG, EPAC, 이온 채널 등을 활성화시켜 생리적 반응을 조절한다. 이러한 작용은 단일 경로에 국한되지 않고 염증, 혈류역학, 대사, 면역 및 신경전달 등 다양한 체계에 걸쳐 조절 효과를 나타내며, 이에 따라 PDE 억제제는 다기능성 치료 플랫폼으로 진화하고 있다. COPD에서는 PDE 억제를 통해 기도 평활근 이완 및 항염증 효과를 유도하는 치료 전략이 오래전부터 탐색되어 왔다. 대표적으로 methylxanthine 계의 테오필린(Theophylline)은 비선택적 PDE 억제제(non-selective phosphodiesterase inhibitor) 로 기관지 확장 작용 외에 횡격막 근력 강화, 기관지 섬모운동 개선과 심박출량을 증가시키는 효과가 있다. 이러한 작용으로 인해 천식 및 COPD 치료에 오랫동안 사용되었으나, 치료역이 좁고 심혈관계 및 중추신경계 부작용이 자주 동반되어 임상 활용에 제한이 있다. 따라서 기관지확장 효과가 약해 흡입 기관지확장제 약물을 사용할 수 없는 상황에서만 제한적으로 사용한다. 이에 따라 초기에 개발된 PDE4 선택적 억제제인 롤리프람(Rolipram)은 T 세포 및 대식세포에서의 cAMP 증가를 통해 염증성 사이토카인 분비를 억제하는 기전을 보였으나, 심각한 위장관계 부작용으로 인해 임상 개발이 중단되었다. 이후 개발된 로플루밀라스트(Roflumilast)는 위장관계 부작용을 줄인 개선된 PDE4 억제제로, 2010년 미국 FDA에서 “기관지확장제 병용요법으로서, 급성 악화 병력이 있고 만성 기관지염을 수반한 중증 COPD 환자의 유지 치료” 적응증으로 승인되었으며, 유럽 EMA와 국내에도 승인을 받았다. 전임상 연구에 따르면, 로플루밀라스트는 기관지 상피세포에서 글루코코르티코이드 수용체 α(GRα)의 전사활성을 증가시키고, 이는 덱사메타손(dexamethasone)의 항염 효과를 GRα 의존적으로 증강시키는 것으로 나타났다. 그러나 여전히 위장 불편감, 체중 감소 등의 부작용이 빈번히 보고되어, 국제 GOLD 가이드라인에서는 LABA, LAMA, ICS를 병용함에도 악화를 반복하는 환자에 한해 3차 치료제(third-line agent)로 제한적 사용을 권고하고 있다. 한편, PDE3 역시 평활근세포에서 발현되어 기관지 수축성 조절에 관여하는데, PDE3 억제는 기관지 이완 효과를 유도한다. 이에 따라 PDE3 및 PDE4를 동시에 억제함으로써 기관지 확장과 항염 작용을 동시에 달성하려는 전략이 제시되었다. 실제로 전임상 연구에서는 이중 억제제가 단일 억제제보다 더 우수하거나, 상가적 효과를 유도함을 입증한 바 있다. 이러한 기전을 기반으로 최근 개발된 엔시펜트린(Ensifentrine)은 PDE3와 PDE4를 모두 억제하는 이중 작용 흡입제로, 기도 평활근 이완과 염증 반응 억제를 병행하는 새로운 기전의 약제가 개발되었다. 엔시펜트린(Ensifentrine)는 어떤 약제인가? 엔시펜트린(Ensifentrine, 제품명 : 오투바이어 흡입 현탁액, Ohtuvayre& 9415;)은 PDE3/PDE4 이중 억제제로, 2024년 6월에 미국 FDA로부터 COPD 유지 치료제로 승인되었다. 이는 기관지 수축 및 염증 반응을 동시에 표적으로 삼는 새로운 치료 옵션으로, 기존의 PDE 억제제보다 내약성 및 효능 면에서 개선된 특성을 나타낸다. 엔시펜트린의 기본 구조(parent molecule)는 trequinsin으로, 이는 다른 PDE 억제제들에 비해 기도 평활근에서 지속적인 기관지 확장 효과를 나타내며, 중간 수준의 PDE3 억제력과 약한 PDE4 억제력을 가진다. 엔시펜트린은 흡입 현탁액(inhalation suspension) 제제로 Jet nebulizer를 ㅛㅏ용하는 기관지 확장제 및 항염증제이다. Jet nebulizer는 호흡기 약물 전달을 위한 대표적인 흡입 장치로, 압축 공기를 이용한 벤츄리(Venturi) 효과를 기반으로 액상 약물을 미세한 에어로졸 입자로 변환시키는 기전으로 작동한다. 이 장치는 폐 말단부위까지 약물을 직접 도달시키는 능력으로 인해 특히 COPD이나 급성 호흡곤란 환자에게 유용하며, 고령 환자, 소아, 또는 기도 협착 환자와 같이 흡입 조절이 어려운 대상군에게 효과적인 약물 전달 수단이라고 할 수 있다. 엔시펜트린의 기관지 확장과 항염증 효과는 알레르기성 기관지 수축이 유도된 기니피그 모델 연구에서 기관지 폐포 세척액 및 비강 내 염증세포 침윤을 유의하게 감소시키는 효과가 확인되었다. 또한 항원 유도로 인한 호산구 이동은 흡입형 엔시펜트린 전처리 시 80% 이상 억제되었다. 또한, 시험관 내 연구(in vitro)에서 낭성섬유증 전도 조절 단백(CFTR)을 자극하는 효과가 확인되었으며, 이는 기도의 점액섬모 청소 기능(mucociliary clearance)을 개선할 가능성을 보여주었다. 엔시트린 허가사항 중 WARNINGS AND PRECAUTIONS에서 다음과 같이 안내하고 있다. 엔시펜트린 투여를 시작하기 전에, 의료진은 우울증 및/또는 자살 생각 또는 행동의 병력이 있는 환자에게서 엔시펜트린 치료의 이점과 위험을 신중히 평가해야 한다. 환자, 보호자 및 가족에게는 불면, 불안, 우울감, 자살 충동 또는 기타 기분 변화의 발생 또는 악화 여부를 주의 깊게 관찰할 필요성이 있음을 안내하고, 이러한 변화가 나타날 경우 즉시 의료진에게 연락할 것을 권고해야 한다. 이와 같은 사건이 발생한 경우, 의료진은 엔시펜트린 치료의 지속 여부에 대해 신중히 재평가해야 한다. 엔시펜트린 치료는 정신과적 이상반응 증가와 관련이 있다. 임상시험에서 엔시펜트린를 투여받은 환자 중 자살 관련 이상반응이 보고되었으며, 그 중 자살 시도 1건 및 자살 사례 1건이 포함되었다. 또한, 통합된 24주 안전성 평가 인구집단에서 가장 흔하게 보고된 정신과적 이상반응은 다음과 같다: 불면증은 엔시펜트린 3mg 투여군 6명(0.6%), 위약군 2명(0.3%)이었고, 불안은 엔시펜트린 3mg 투여군 2명(0.2%), 위약군 1명(0.2%)이었다. 우울 관련 반응(우울증, 주요우울증, 우울 기분을 동반한 적응장애 포함)은 엔시펜트린를 투여받은 환자 4명(0.4%)에서 발생하였으며, 위약 투여군에서는 보고되지 않았다. 엔시펜트린의 약리 기전은? 엔시펜트린은 PDE3와 PDE4를 동시에 억제하는 이중 억제제로, 이러한 신호전달 경로의 조절을 통해 치료 효과를 유도하는 새로운 흡입형 저분자 약물이다. PDE3는 주로 cAMP를 가수분해하지만, cGMP도 기질로 사용할 수 있는 특성을 지니며, PDE4는 cAMP에 특이적으로 작용하는 효소이다. 따라서 두 PDE를 동시에 억제함으로써 세포 내 cAMP 및 cGMP 농도가 모두 상승하게 되고, 이는 기도 평활근 이완, 항염작용, 점액 분비 감소 및 섬모 기능 강화 등 복합적인 생리학적 효과를 유도한다(Figure 3). 특히 PDE3와 PDE4는 기도 평활근, 염증세포, 기관지 상피세포에 널리 발현되어 있어, 이들에 대한 동시 억제는 단일 PDE 억제보다 상승적 또는 시너지 효과를 유도할 수 있다. 이러한 작용 특성은 엔시펜트린이 기관지 확장, 기도 염증 조절, 점액섬모 청소 기능(mucociliary clearance)에 걸친 통합적 치료 효과를 발휘할 수 있다. 엔시펜트린(OHTUVAYRE& 9415;)의 허가 임상은 어떠한가? 엔시펜트의 유효성은 ENHANCE-1 및 ENHANCE-2의 24주간 무작위 배정, 이중눈가림, 위약 대조, 병렬군 임상시험을 통해 평가되었다. 이 두 연구에는 중등도에서 중증의 COPD를 가진 총 1,553명의 성인 환자가 등록되었다. ENHANCE-1에서는 763명의 환자가 등록되어 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 표준 제트 네불라이저를 통해 흡입하도록 배정되었다. 등록 시점에서 기관지 확장제 투여 후 예측 FEV1 평균은 52%(범위: 27~85%), FEV1/FVC 비율은 평균 0.52(범위: 0.22~0.71)였다. 또한, 전체 환자의 68%는 LAMA, LABA, 또는 LABA/ICS와 같은 병용 치료를 받고 있었으며, 각각 30%, 18%, 20%가 해당 약제를 사용하고 있었다. ENHANCE-2는 총 790명의 환자를 대상으로 동일한 방식으로 설계되었으며, 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 제트 네불라이저를 통해 하루 두 번 흡입하도록 배정하였다. 등록 시점의 평균 예측 FEV1은 51%(범위: 23~81%)였고, FEV1/FVC 비율은 평균 0.52(범위: 0.24~0.71)였다. 이 연구에서도 55%의 환자가 병용 치료를 받고 있었으며, LAMA, LABA , LABA/ICS와 같이 병용 치료를 받고 있었으며, 각각 33%, 7%, 15%가 해당 약제를 사용하고 있었다. 두 연구 모두에서 주요 평가변수였던 12주차 FEV₁의 시간-농도 곡선 면적(AUC& 8320;& 8211;12h)은 위약 대비 유의하게 개선되었다. ENHANCE-1 및 ENHANCE-2 연구에서는 모든 환자를 대상으로 베이스라인 시점과 12주차에 걸쳐 12시간 동안 연속 폐기능 검사(serial spirometry)가 수행되었다. ENHANCE-1의 12주차 연속 폐기능 검사 결과는 trough FEV1은 아침 투약 직전 마지막으로 측정된 FEV1 값으로 정의되었다. 12주차 시점에서 위약 대비 평균 아침 trough FEV1의 개선치는 ENHANCE-1에서 35mL (95% 신뢰구간: 14, 68), ENHANCE-2에서는 49 mL(95% 신뢰구간: 19, 80)로 나타났으며, 이는 ENHANCE-1에서 통계적으로 유의하였으나, ENHANCE-2에서는 분석 단계(hierarchical testing) 상위 단계의 실패로 인해 통계적 유의성이 확보되지 않았다. St. George’s 호흡기 설문지(SGRQ)를 통해 두 시험에서 시행되었으며, SGRQ 반응률은 점수가 4점 이상 개선된 경우로 정의되었다. ENHANCE-1에서 24주차 시점의 SGRQ 반응률은 OHTUVAYRE 투여군에서 58.2%, 위약군에서 45.9%로 나타났고, 이에 대한 Odds Ratio는 1.49(95% CI: 1.07, 2.07)로 통계적 유의성이 있었다. 반면, ENHANCE-2에서는 OHTUVAYRE 투여군의 반응률이 45.4%, 위약군이 50.3%였으며, Odds Ratio는 0.92(95% CI: 0.66, 1.29)로, 통계적 유의성은 나타나지 않았다. 엔시펜트린의 예상되는 쟁점은 무엇인가? 현재까지의 COPD 치료 전략은 주로 기관지 확장제 및 항염증 흡입제에 기반하였으며, 증상 완화와 급성 악화의 예방을 목표로 했다. 그러나 일부 환자에서는 기존 약물요법으로 충분한 치료 효과를 얻지 못하거나, 흡입기 사용에 대한 어려움으로 치료 순응도가 저하되는 문제가 지속적으로 제기되어 왔다. 엔시펜트린은 이러한 한계를 극복하기 위해 개발된 약제로, PDE 3와 PDE4를 동시에 억제하는 최초의 흡입형 치료제이다. PDE3 억제를 통해 기관지 평활근을 이완시켜 기관지 확장 효과를 유도하고, PDE4 억제를 통해 염증세포에서의 사이토카인 분비 및 염증 반응을 억제함으로써 항염 효과를 나타낸다. 이러한 이중 작용은 단일 기전 약물에 비해 증상 개선 및 염증 조절에 있어 시너지 효과를 기대할 수 있다. 엔시펜트린은 제트 네뷸라이저를 통해 투여되는 제형으로, 흡입기 사용이 어려운 고령 환자나 협조가 부족한 환자에게 유용한 대안이 될 수 있다. 또한 기존 유지 치료제(LABA, LAMA, ICS)와 병용 가능하며, 특히 기존 치료에 반응이 불충분한 환자에게 추가적인 임상적 혜택을 제공할 수 있다. 다만, 단시간 작용성 기관지 확장제(SABA/SAMA)에 비해 작용 발현 속도가 느리기 때문에 급성 증상 완화에는 적합하지 않으며, 휴대성과 투여 시간(약 5& 8211;7분) 측면에서도 일상 생활에서 제한점이 존재한다. 임상적으로는 두 건의 ENHANCE-1 및 ENHANCE-2 3상 무작위 위약 대조 시험을 통해 엔시펜트린의 유효성과 안전성이 평가되었다. ENHANCE-1에서는 폐기능 개선과 건강 관련 삶의 질 향상(예: SGRQ 점수)의 통계적 유의성이 입증되었으며, 탈락률도 낮아 근거 수준이 높은 연구로 간주된다. 반면 ENHANCE-2는 지역적 인구 구성의 차이 및 통계적 유의성 부족으로 인해 지원적 자료(supportive evidence)로 해석되었으며, 두 연구가 동일한 근거 수준으로 채택되지는 않았다. 현재 엔시펜트린은 미국 FDA로부터 승인을 받았으나, 유럽 EMA에서는 정식 승인을 획득하지 못한 상태이다. 이와 같은 규제 환경은 약물의 글로벌 접근성 및 보급에 있어 중요한 장애가 되고 있다. 결론적으로, 엔시펜트린은 기전적 이점을 바탕으로 기존 치료의 한계를 보완하고, 특정 환자군에서 치료 옵션의 다양성을 확대할 수 있는 약제로 평가된다. 향후 유럽 EMA 승인과 후속 임상 연구와 실제 임상에서의 사용 경험이 축적됨에 따라, 이중 PDE 억제제는 COPD 약물 치료의 새로운 전환점을 제시할 수 있을 것으로 기대해 본다. 참고문헌 1. Isaac Levy et al. “Phosphodiesterase function and endocrine cells: links to human disease and roles in tumor development and treatment” Curr Opin Pharmacol. 2011;11(6):689& 8211;697. 2. Nardini et al. “COPD: maximization of bronchodilationMultidisciplinary Respiratory Medicine” 2014, 9:50. 3. James F Donohue et al. “Ensifentrine as a Novel, Inhaled Treatment for Patients with COPD“ International Journal of Chronic Obstructive Pulmonary Disease 2023:18. 4. Rinzhin T et al. “Advancing Obstructive Airway Disease Treatment: Dual PDE3/4 Inhibition as a Therapeutic Strategy“ Cells 2025, 14, 659. 5. Nicola A. Hanania, Bartolom& 233; R. Celli, ”Phosphodiesterase Inhibition as a Therapeutic Strategy for Chronic Obstructive Pulmonary Disease: Where We Have Been and What Lies Ahead“ Chronic Obstr Pulm Dis. 2025; 12(1): 82-92. 6. COPD 진료지침 대한결핵 및 호흡기학회 2024 개정. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-06-27 06:00:46최병철 박사 -
 '속빈강정' 바이오 IPO 회복세…경쟁률·공모가 위축[데일리팜=차지현 기자] 제약바이오·헬스케어 기업공개(IPO) 시장이 회복세에 접어들었지만 여전히 냉기가 이어지는 분위기입니다. 작년과 비교했을 때 기관투자자 대상 수요예측 경쟁률이 눈에 띄게 식었고, 최종 공모가 역시 희망밴드 상단을 초과하는 사례가 자취를 감췄습니다. 14일 금융감독원에 따르면 올해 들어 IPO 수요예측을 진행한 제약바이오·헬스케어 업체는 총 8곳입니다. 동방메디컬, 동국생명과학, 오름테라퓨틱, 오가노이드사이언스, 로킷헬스케어, 이뮨온시아, 바이오비쥬, 인투셀 등이 해당합니다. 업체 수로 보면 IPO에 도전장을 내민 제약바이오·헬스케어 업체는 지난해 동기 대비 2배 이상 증가했습니다. 작년의 경우 상반기까지 코스닥에 입성한 제약바이오·헬스케어 업체는 4곳에 불과했습니다. 오상헬스케어, 엔젤로보틱스, 아이엠비디엑스, 디앤디파마텍 등입니다. 한국거래소에 상장 예비심사를 신청한 IPO 후발주자도 속속 나오고 있습니다. 지씨지놈, 프로티나, 지에프씨생명과학 등은 이미 한국거래소 상장 예비심사 문턱을 넘었고요. 예심 청구서를 접수하고 심사를 받고 있는 노벨티노빌리티, 지투지바이오, 뉴로핏, 젠바디, 큐리오시스, 명인제약, 리브스메드 등도 제약바이오·헬스케어 업체로 분류됩니다. 특히 올해에는 신약개발 바이오텍의 상장 건수가 눈에 띄게 증가했습니다. 이미 코스닥에 진입한 오름테라퓨틱을 포함해 이뮨온시아, 인투셀 등이 순수 신약개발 사업을 영위하는 업체로 꼽힙니다. 작년 한 해 상장한 제약바이오·헬스케어 기업을 통틀어 신약개발사가 디앤디파마텍과 온코닉테라퓨틱스 정도였다는 점을 고려하면 올해 신약개발 기업의 상장 도전이 뚜렷하게 증가했다는 걸 알 수 있습니다. IPO 도전 기업 수는 작년보다 늘었지만 제약바이오·헬스케어 업종 IPO 시장은 여전히 냉랭한 분위기입니다. 이를 가장 단적으로 드러내는 지표 중 하나가 수요예측 경쟁률과 공모가 산정 결과입니다. 올해와 작년의 IPO 시장 심리는 어떻게 다를까요. IPO 단계는 크게 ▲상장 심사 단계 ▲공모 절차 단계로 나뉩니다. 상장 심사는 거래소가 해당 회사를 상장시켜도 될지 여부를 판단하는 단계입니다. 예비 상장사는 주관사와 함께 작성한 청구서를 거래소에 제출해야 하고요. 특례상장 제도를 통해 상장하는 기업의 경우 기술성 평가를 통과해야 합니다. 공모 절차에 있어서는 해당 회사를 얼마에, 누구에게, 어떻게 팔 것인가를 결정하는 단계입니다. 예비 상장사는 회사 개요, 주요 사업, 공모 조건, 자금 사용 계획 등을 담은 증권신고서를 제출합니다. 금감원이 심사를 승인하면 증권신고서 효력이 본격적으로 발생합니다. 이후 주관사는 수요예측을 진행합니다. 수요예측은 말 그대로 '수요를 미리 파악'하는 과정입니다. 주관사는 기관투자자를 대상으로 일정 기간 동안 주문 접수를 받아 경쟁률, 가격 분포, 의무보유확약 비율 등을 수집합니다. 이를 통해 시장이 받아들일 수 있는 적정 공모가를 시장 기반으로 결정할 수 있게 됩니다. 수요예측은 주관사와 발행사와 산정한 기업가치가 시장에서 납득할만한 수준인지 확인하는 절차이기도 하죠. 최종 공모가는 이 같은 수요예측 결과 바탕으로 결정됩니다. 통상 희망 밴드 내에서 결정되지만 상단 또는 하단에서 결정되는 사례도 나옵니다. 공모가가 확정되면 기업은 일반 투자자를 대상으로 청약을 실시해 최종적으로 증시에 입성하게 됩니다. 작년과 올해 상장에 나선 제약바이오·헬스케어 업체의 수요예측 결과를 비교한 결과를 보면 시장 심리 온도차가 뚜렷하게 감지됩니다. 지난해에는 상반기 상장한 업체 4곳 모두 경쟁률 800~1000대 1 이상을 기록하며 모든 기업이 희망 공모가 범위 상단을 초과해 공모가를 확정지었습니다. 오상헬스케어와 엔젤로보틱스는 희망 밴드 상단보다 30% 이상 높은 가격에 최종 공모가가 결정됐습니다. 아이엠비디엑스도 희망 밴드 상단을 31% 웃도는 수준에서 최종 공모가를 책정했고요. 디앤디파마텍의 최종 공모가도 3만3000원으로 희망 밴드 상단 대비 27% 높았습니다. 반면 올해에는 일부 기업이 1000대 1 이상의 수요예측 경쟁률을 보였지만, 전체적으로는 투자자 수요가 뚜렷하게 위축된 모습입니다. 오름테라퓨틱은 16.93대 1의 경쟁률을 기록했고 동국생명과학도 경쟁률이 117.83대 1에 그쳤습니다. 로킷헬스케어의 경우 수요예측 경쟁률이 368.45대 1 수준이었습니다. 올해는 경쟁률이 1000대 1을 넘긴 기업조차 공모가를 조심스럽게 상단에만 맞추는 움직임도 나타났습니다. 작년만 해도 공모가가 희망가 상단을 넘어서며 흥행을 자랑하는 사례가 줄을 이었지만, 올해는 상단을 초과해 공모가를 결정한 업체가 전무합니다. 상단 초과는커녕 하단 미만에서 공모가가 결정된 기업도 적지 않고요. 구체적으로 동방메디컬, 오가노이드사이언스, 이뮨온시아, 바이오비쥬, 인투셀 등이 희망 공모가 범위 상단에서 최종 공모가를 확정했습니다. 로킷헬스케어는 공모가 하단에서 최종 공모가를 결정했고 동국생명과학과 오름테라퓨틱은 희망 공모 밴드 하단 미만에서 공모가가 정해졌습니다. 바이오 업종에 대한 신뢰도 저하, 고금리 기조의 장기화와 더불어, 도널드 트럼프 미국 대통령의 정책 기조 등이 투자 심리를 억누르는 변수로 작용하고 있다는 분석이 나옵니다. 트럼프 대통령이 최근 처방의약품 가격 인하 행정명령에 서명하면서 전 세계적으로 제약바이오 업종에 대한 수익성 압박 우려가 부각되고 있기도 하고요. 다만 최종 공모가가 희망 범위 아래서 결정됐다고 해서 IPO 실패로 단정하기는 어렵습니다. 기업가치는 상장 이후 시장에서 재평가 받을 수 있기 때문입니다. 실제 수요예측에서 높은 평가를 받았던 기업이 상장 이후 기대만큼 주가가 오르지 않는 경우도 많습니다. 반대로 공모가가 보수적으로 책정된 기업이 상장 후 우수한 기술력이나 실적 모멘텀을 바탕으로 시장에서 긍정적 재평가를 받는 사례도 적지 않습니다. 결국 IPO는 단기적인 '공모 흥행'만으로 성패를 가를 수 없는 구조라는 얘기입니다. 특히 신약개발 중심의 바이오 기업들은 상장 이후 임상 진척, 기술이전, 라이선스 아웃(L/O) 성과 등 사업의 실질적 진전이 향후 주가에 더 큰 영향을 미치는 경향이 큽니다. 상장 이후 얼마나 시장과의 신뢰를 이어가며 성과를 입증해나가느냐가 더 중요한 평가 기준이 되는 셈이죠. 단기 수급에 일희일비하기보다, 상장 이후 실제 성과가 시장에서 어떻게 평가받는지를 차분히 지켜볼 필요가 있습니다.2025-05-14 06:17:29차지현
'속빈강정' 바이오 IPO 회복세…경쟁률·공모가 위축[데일리팜=차지현 기자] 제약바이오·헬스케어 기업공개(IPO) 시장이 회복세에 접어들었지만 여전히 냉기가 이어지는 분위기입니다. 작년과 비교했을 때 기관투자자 대상 수요예측 경쟁률이 눈에 띄게 식었고, 최종 공모가 역시 희망밴드 상단을 초과하는 사례가 자취를 감췄습니다. 14일 금융감독원에 따르면 올해 들어 IPO 수요예측을 진행한 제약바이오·헬스케어 업체는 총 8곳입니다. 동방메디컬, 동국생명과학, 오름테라퓨틱, 오가노이드사이언스, 로킷헬스케어, 이뮨온시아, 바이오비쥬, 인투셀 등이 해당합니다. 업체 수로 보면 IPO에 도전장을 내민 제약바이오·헬스케어 업체는 지난해 동기 대비 2배 이상 증가했습니다. 작년의 경우 상반기까지 코스닥에 입성한 제약바이오·헬스케어 업체는 4곳에 불과했습니다. 오상헬스케어, 엔젤로보틱스, 아이엠비디엑스, 디앤디파마텍 등입니다. 한국거래소에 상장 예비심사를 신청한 IPO 후발주자도 속속 나오고 있습니다. 지씨지놈, 프로티나, 지에프씨생명과학 등은 이미 한국거래소 상장 예비심사 문턱을 넘었고요. 예심 청구서를 접수하고 심사를 받고 있는 노벨티노빌리티, 지투지바이오, 뉴로핏, 젠바디, 큐리오시스, 명인제약, 리브스메드 등도 제약바이오·헬스케어 업체로 분류됩니다. 특히 올해에는 신약개발 바이오텍의 상장 건수가 눈에 띄게 증가했습니다. 이미 코스닥에 진입한 오름테라퓨틱을 포함해 이뮨온시아, 인투셀 등이 순수 신약개발 사업을 영위하는 업체로 꼽힙니다. 작년 한 해 상장한 제약바이오·헬스케어 기업을 통틀어 신약개발사가 디앤디파마텍과 온코닉테라퓨틱스 정도였다는 점을 고려하면 올해 신약개발 기업의 상장 도전이 뚜렷하게 증가했다는 걸 알 수 있습니다. IPO 도전 기업 수는 작년보다 늘었지만 제약바이오·헬스케어 업종 IPO 시장은 여전히 냉랭한 분위기입니다. 이를 가장 단적으로 드러내는 지표 중 하나가 수요예측 경쟁률과 공모가 산정 결과입니다. 올해와 작년의 IPO 시장 심리는 어떻게 다를까요. IPO 단계는 크게 ▲상장 심사 단계 ▲공모 절차 단계로 나뉩니다. 상장 심사는 거래소가 해당 회사를 상장시켜도 될지 여부를 판단하는 단계입니다. 예비 상장사는 주관사와 함께 작성한 청구서를 거래소에 제출해야 하고요. 특례상장 제도를 통해 상장하는 기업의 경우 기술성 평가를 통과해야 합니다. 공모 절차에 있어서는 해당 회사를 얼마에, 누구에게, 어떻게 팔 것인가를 결정하는 단계입니다. 예비 상장사는 회사 개요, 주요 사업, 공모 조건, 자금 사용 계획 등을 담은 증권신고서를 제출합니다. 금감원이 심사를 승인하면 증권신고서 효력이 본격적으로 발생합니다. 이후 주관사는 수요예측을 진행합니다. 수요예측은 말 그대로 '수요를 미리 파악'하는 과정입니다. 주관사는 기관투자자를 대상으로 일정 기간 동안 주문 접수를 받아 경쟁률, 가격 분포, 의무보유확약 비율 등을 수집합니다. 이를 통해 시장이 받아들일 수 있는 적정 공모가를 시장 기반으로 결정할 수 있게 됩니다. 수요예측은 주관사와 발행사와 산정한 기업가치가 시장에서 납득할만한 수준인지 확인하는 절차이기도 하죠. 최종 공모가는 이 같은 수요예측 결과 바탕으로 결정됩니다. 통상 희망 밴드 내에서 결정되지만 상단 또는 하단에서 결정되는 사례도 나옵니다. 공모가가 확정되면 기업은 일반 투자자를 대상으로 청약을 실시해 최종적으로 증시에 입성하게 됩니다. 작년과 올해 상장에 나선 제약바이오·헬스케어 업체의 수요예측 결과를 비교한 결과를 보면 시장 심리 온도차가 뚜렷하게 감지됩니다. 지난해에는 상반기 상장한 업체 4곳 모두 경쟁률 800~1000대 1 이상을 기록하며 모든 기업이 희망 공모가 범위 상단을 초과해 공모가를 확정지었습니다. 오상헬스케어와 엔젤로보틱스는 희망 밴드 상단보다 30% 이상 높은 가격에 최종 공모가가 결정됐습니다. 아이엠비디엑스도 희망 밴드 상단을 31% 웃도는 수준에서 최종 공모가를 책정했고요. 디앤디파마텍의 최종 공모가도 3만3000원으로 희망 밴드 상단 대비 27% 높았습니다. 반면 올해에는 일부 기업이 1000대 1 이상의 수요예측 경쟁률을 보였지만, 전체적으로는 투자자 수요가 뚜렷하게 위축된 모습입니다. 오름테라퓨틱은 16.93대 1의 경쟁률을 기록했고 동국생명과학도 경쟁률이 117.83대 1에 그쳤습니다. 로킷헬스케어의 경우 수요예측 경쟁률이 368.45대 1 수준이었습니다. 올해는 경쟁률이 1000대 1을 넘긴 기업조차 공모가를 조심스럽게 상단에만 맞추는 움직임도 나타났습니다. 작년만 해도 공모가가 희망가 상단을 넘어서며 흥행을 자랑하는 사례가 줄을 이었지만, 올해는 상단을 초과해 공모가를 결정한 업체가 전무합니다. 상단 초과는커녕 하단 미만에서 공모가가 결정된 기업도 적지 않고요. 구체적으로 동방메디컬, 오가노이드사이언스, 이뮨온시아, 바이오비쥬, 인투셀 등이 희망 공모가 범위 상단에서 최종 공모가를 확정했습니다. 로킷헬스케어는 공모가 하단에서 최종 공모가를 결정했고 동국생명과학과 오름테라퓨틱은 희망 공모 밴드 하단 미만에서 공모가가 정해졌습니다. 바이오 업종에 대한 신뢰도 저하, 고금리 기조의 장기화와 더불어, 도널드 트럼프 미국 대통령의 정책 기조 등이 투자 심리를 억누르는 변수로 작용하고 있다는 분석이 나옵니다. 트럼프 대통령이 최근 처방의약품 가격 인하 행정명령에 서명하면서 전 세계적으로 제약바이오 업종에 대한 수익성 압박 우려가 부각되고 있기도 하고요. 다만 최종 공모가가 희망 범위 아래서 결정됐다고 해서 IPO 실패로 단정하기는 어렵습니다. 기업가치는 상장 이후 시장에서 재평가 받을 수 있기 때문입니다. 실제 수요예측에서 높은 평가를 받았던 기업이 상장 이후 기대만큼 주가가 오르지 않는 경우도 많습니다. 반대로 공모가가 보수적으로 책정된 기업이 상장 후 우수한 기술력이나 실적 모멘텀을 바탕으로 시장에서 긍정적 재평가를 받는 사례도 적지 않습니다. 결국 IPO는 단기적인 '공모 흥행'만으로 성패를 가를 수 없는 구조라는 얘기입니다. 특히 신약개발 중심의 바이오 기업들은 상장 이후 임상 진척, 기술이전, 라이선스 아웃(L/O) 성과 등 사업의 실질적 진전이 향후 주가에 더 큰 영향을 미치는 경향이 큽니다. 상장 이후 얼마나 시장과의 신뢰를 이어가며 성과를 입증해나가느냐가 더 중요한 평가 기준이 되는 셈이죠. 단기 수급에 일희일비하기보다, 상장 이후 실제 성과가 시장에서 어떻게 평가받는지를 차분히 지켜볼 필요가 있습니다.2025-05-14 06:17:29차지현 -
 식약처, 국가필수약 지정기준 개선 연구 착수[데일리팜=이혜경 기자] 식품의약품안전처가 국가필수의약품 지정기준 개선을 위한 연구를 진행한다. 지난 2017년 국필약 제도 시행 초기에는 정부 비축품목을 중심으로 지정됐지만, 이를 민간 의료현장 안정공급 필요 품목까지 확대가 필요하다는 의견이 지속적으로 제기되고 있기 때문이다. 23일 식품의약품안전처가 공고한 ' 국가필수의약품 분류 및 안정공급 협업 방안 마련 연구 제안요청서'를 보면 이 같은 내용이 담겼다. 식약처는 질병 관리, 방사능 방재 등 의료현장에 필수 사용돼 안정공급이 필요한 의약품을 국가필수의약품으로 지정·관리하고 있다. 그동안 지정 기준 개선, 재평가 제도 도입, 신속 허가 행정지원 및 법률 개정 등 국필약 안정공급을 위한 노력이 있어왔다. 이번 연구에서는 제외국 사례를 고려해 현행 제도 운영 개선 방안을 마련할 계획이다. 연구자 모집 이후 6개월 간 5000만원이 투입되며 ▲주요국 필수의약품 제도운영 및 활용 현황 조사·비교 ▲국필약 운영현황 분석 및 고도화 방향 모색 ▲국필약 안정공급 위한 활용현황 분석 및 고도화 방향 모색 등이 진행될 예정이다. 우선 외국에서의 필수의약품 운영목적, 유형분류 방식(품목성격, 용도 등), 선정기준·절차, 자문의견 수렴 등 제도운영 현황을 살펴보고, 안정공급을 위한 정책지원, 우대조치 등 활용 현황을 조사하게 된다. 또 품목별 특성을 반영해 국필약 품목 지정 시 고려해야 할 주요사항 도출하며, 이를 기반으로 한 국가필수의약품 지정기준 개선안을 마련한다. ‘WHO Model List of Essential Medicines ’의 운영사례를 참고해 국필약 용동별 분류방안 검토하고 목록을 개편할 계획이다. 목록개편은 국필약 지정 및 재평가 시 품목군 내 필요성 등을 종합검토해 이뤄진다. 여기에 국필약 제도운영 목적 및 유사 제도와의 구분 필요성 고려, 국가필수의약품 지정대상 및 제외범위를 검토하게 된다. 국필약 지정 및 안정공급 논의가 원활히 하기 위한 안정공급 협의회·분과협의회 개편 및 운영방안도 이번 연구에서 마련된다. 협의회를 통한 안정공급 정책이 결정·집행될 수 있도록 활용 가능한 정부 정책수단 및 관계부처·기관 협업 필요사항 도출하고, 국필약 안정공급을 위한 인적·물적 기반강화 방안 마련이 검토될 계획이다. 식약처는 "필수의약품 수급에 대한 현장애로 지속 이슈화되고 있으며, 이를 위해 다양한 분야에서 환경변화에 따른 국필약 제도개선 및 안정공급 노력을 위한 보다 강화된 국가 역할을 기대한다"고 밝혔다.2025-04-23 17:26:32이혜경
식약처, 국가필수약 지정기준 개선 연구 착수[데일리팜=이혜경 기자] 식품의약품안전처가 국가필수의약품 지정기준 개선을 위한 연구를 진행한다. 지난 2017년 국필약 제도 시행 초기에는 정부 비축품목을 중심으로 지정됐지만, 이를 민간 의료현장 안정공급 필요 품목까지 확대가 필요하다는 의견이 지속적으로 제기되고 있기 때문이다. 23일 식품의약품안전처가 공고한 ' 국가필수의약품 분류 및 안정공급 협업 방안 마련 연구 제안요청서'를 보면 이 같은 내용이 담겼다. 식약처는 질병 관리, 방사능 방재 등 의료현장에 필수 사용돼 안정공급이 필요한 의약품을 국가필수의약품으로 지정·관리하고 있다. 그동안 지정 기준 개선, 재평가 제도 도입, 신속 허가 행정지원 및 법률 개정 등 국필약 안정공급을 위한 노력이 있어왔다. 이번 연구에서는 제외국 사례를 고려해 현행 제도 운영 개선 방안을 마련할 계획이다. 연구자 모집 이후 6개월 간 5000만원이 투입되며 ▲주요국 필수의약품 제도운영 및 활용 현황 조사·비교 ▲국필약 운영현황 분석 및 고도화 방향 모색 ▲국필약 안정공급 위한 활용현황 분석 및 고도화 방향 모색 등이 진행될 예정이다. 우선 외국에서의 필수의약품 운영목적, 유형분류 방식(품목성격, 용도 등), 선정기준·절차, 자문의견 수렴 등 제도운영 현황을 살펴보고, 안정공급을 위한 정책지원, 우대조치 등 활용 현황을 조사하게 된다. 또 품목별 특성을 반영해 국필약 품목 지정 시 고려해야 할 주요사항 도출하며, 이를 기반으로 한 국가필수의약품 지정기준 개선안을 마련한다. ‘WHO Model List of Essential Medicines ’의 운영사례를 참고해 국필약 용동별 분류방안 검토하고 목록을 개편할 계획이다. 목록개편은 국필약 지정 및 재평가 시 품목군 내 필요성 등을 종합검토해 이뤄진다. 여기에 국필약 제도운영 목적 및 유사 제도와의 구분 필요성 고려, 국가필수의약품 지정대상 및 제외범위를 검토하게 된다. 국필약 지정 및 안정공급 논의가 원활히 하기 위한 안정공급 협의회·분과협의회 개편 및 운영방안도 이번 연구에서 마련된다. 협의회를 통한 안정공급 정책이 결정·집행될 수 있도록 활용 가능한 정부 정책수단 및 관계부처·기관 협업 필요사항 도출하고, 국필약 안정공급을 위한 인적·물적 기반강화 방안 마련이 검토될 계획이다. 식약처는 "필수의약품 수급에 대한 현장애로 지속 이슈화되고 있으며, 이를 위해 다양한 분야에서 환경변화에 따른 국필약 제도개선 및 안정공급 노력을 위한 보다 강화된 국가 역할을 기대한다"고 밝혔다.2025-04-23 17:26:32이혜경 -
 식약처, 국가필수약 분류 방안 개선·지원책 마련 추진[데일리팜=이혜경 기자] 식약당국이 제외국 사례 고려해 현행 국가필수의약품(국필약) 제도운영 개선 추진과 함께 국필약 안정공급을 위한 정부 역할 강화 방안 마련에 들어간다. 9일 식품의약품안전처는 '국가필수의약품 분류 및 안정공급 협업 방안 마련 연구' 용역 공고에 나섰다. 정부는 2017년부터 보건의료상 필수적이나 시장 기능만으로 안정적 공급이 어려운 의약품에 대해 '약사법' 제2조제19호, 제83조의4에 의거해 관계 중앙행정기관 간 협의를 거쳐 국필약으로 지정·관리하고 있다. 지난해 12월 기준, 총 473개 품목이 지정된 상태다. 하지만 국필약 수급에 대한 현장 애로가 지속적으로 이슈화되고 있으며, 이를 위해 다양한 분야에서 환경변화에 따른 국필약 제도개선 및 안정공급 노력을 위한 보다 강화된 국가 역할이 필요한 상태다. 식약처는 이번 연구를 통해 ▲주요국 필수의약품 제도운영 및 활용 현황 조사·비교 ▲국가필수의약품 운영현황 분석 및 고도화 방향 모색 ▲국가필수의약품 안정공급 위한 활용현황 분석 및 고도화 방향 모색 등을 진행한다. 우선 주요국에서 필수의약품 운영목적, 유형분류 방식(품목성격, 용도 등), 선정기준·절차, 자문의견 수렴 등 제도운영 현황을 조사하게 된다. 또 필수의약품 안정공급을 위한 정책지원, 우대조치 등 활용과 선정·자문을 위한 협의회·위원회 등 기구운영 현황을 살펴본다. 이를 바탕으로 품목별 특성 반영, 국가필수의약품 지정 시 고려해야 할 주요사항을 도출, 국필약 지정기준 개선안을 마련할 계획이다. 여기에 WHO Model List of Essential Medicines 등 용도별 분류방안 검토 및 그에 따른 국가필수의약품 지정 및 재평가 시 품목군 내 필요성 종합검토 등 목록개편방안 도출하며, 현장 적합성 지속유지 위한 운영방안을 마련한다. 식약처는 지난 2022년 2월 '제2차 국필 안정공급 종합대책'이 마련되면서 신규 지정 및 해제 근거가 마련됐으며 범정부 차원에서 국가필수의약품 안정공급 협의회를 운영하고 있다. 협의회에서 신규 지정 및 해제 품목이 결정된다. 식약처는 "국가필수의약품의 지정 및 안정공급 논의가 원활히 이루어지기 위한 안정공급 협의회·분과협의회 개편 및 운영방안 마련도 연구에 포함된다"며 "협의회를 통한 안정공급 정책이 결정·집행될 수 있도록 활용 가능한 정부 정책수단 및 관계부처·기관 협업 필요사항을 도출할 계획"이라고 밝혔다.2025-04-09 11:22:49이혜경
식약처, 국가필수약 분류 방안 개선·지원책 마련 추진[데일리팜=이혜경 기자] 식약당국이 제외국 사례 고려해 현행 국가필수의약품(국필약) 제도운영 개선 추진과 함께 국필약 안정공급을 위한 정부 역할 강화 방안 마련에 들어간다. 9일 식품의약품안전처는 '국가필수의약품 분류 및 안정공급 협업 방안 마련 연구' 용역 공고에 나섰다. 정부는 2017년부터 보건의료상 필수적이나 시장 기능만으로 안정적 공급이 어려운 의약품에 대해 '약사법' 제2조제19호, 제83조의4에 의거해 관계 중앙행정기관 간 협의를 거쳐 국필약으로 지정·관리하고 있다. 지난해 12월 기준, 총 473개 품목이 지정된 상태다. 하지만 국필약 수급에 대한 현장 애로가 지속적으로 이슈화되고 있으며, 이를 위해 다양한 분야에서 환경변화에 따른 국필약 제도개선 및 안정공급 노력을 위한 보다 강화된 국가 역할이 필요한 상태다. 식약처는 이번 연구를 통해 ▲주요국 필수의약품 제도운영 및 활용 현황 조사·비교 ▲국가필수의약품 운영현황 분석 및 고도화 방향 모색 ▲국가필수의약품 안정공급 위한 활용현황 분석 및 고도화 방향 모색 등을 진행한다. 우선 주요국에서 필수의약품 운영목적, 유형분류 방식(품목성격, 용도 등), 선정기준·절차, 자문의견 수렴 등 제도운영 현황을 조사하게 된다. 또 필수의약품 안정공급을 위한 정책지원, 우대조치 등 활용과 선정·자문을 위한 협의회·위원회 등 기구운영 현황을 살펴본다. 이를 바탕으로 품목별 특성 반영, 국가필수의약품 지정 시 고려해야 할 주요사항을 도출, 국필약 지정기준 개선안을 마련할 계획이다. 여기에 WHO Model List of Essential Medicines 등 용도별 분류방안 검토 및 그에 따른 국가필수의약품 지정 및 재평가 시 품목군 내 필요성 종합검토 등 목록개편방안 도출하며, 현장 적합성 지속유지 위한 운영방안을 마련한다. 식약처는 지난 2022년 2월 '제2차 국필 안정공급 종합대책'이 마련되면서 신규 지정 및 해제 근거가 마련됐으며 범정부 차원에서 국가필수의약품 안정공급 협의회를 운영하고 있다. 협의회에서 신규 지정 및 해제 품목이 결정된다. 식약처는 "국가필수의약품의 지정 및 안정공급 논의가 원활히 이루어지기 위한 안정공급 협의회·분과협의회 개편 및 운영방안 마련도 연구에 포함된다"며 "협의회를 통한 안정공급 정책이 결정·집행될 수 있도록 활용 가능한 정부 정책수단 및 관계부처·기관 협업 필요사항을 도출할 계획"이라고 밝혔다.2025-04-09 11:22:49이혜경 -
 "국가필수약 품절 차단"…정부, 정책·조직 체질개선 착수[데일리팜=이정환 기자] 정부가 코로나19 팬데믹 이후 빈발하고 있는 국가필수약 수급 불안정 사태 근절·완화를 위해 연내 개선책을 마련한다. 국가필수약 지정 방법과 관련 정부부처·기관 협의회 운영 방식, 안정공급을 위한 정부 정책지원·우대조치 등 관련 제도 전반을 뜯어 고치기 위한 밑 작업에 착수할 계획이다. 해외 주요국가의 필수의약품 제도 현황을 살피고, 우리나라 국가필수약 운영 현황 분석을 기반으로 안정공급 고도화 방향을 모색하는 방법을 통해서다. 6일 식품의약품안전처는 국가필수약 분류 및 안정공급 협업 방안 마련 연구에 나선다고 밝혔다. 코로나19 팬데믹 이후 세계 각국이 자국 중심 의약품 정책을 펴면서 보건안보 위기 위험성이 커지고 감기약 등 필수약 품절 빈도가 늘어난데 대한 대응책을 찾겠다는 의지다. 정부는 2017년부터 질병 관리, 방사능 방재 등 의료현장에 필수적으로 쓰여 안정적으로 공급해야 하는 약을 국가필수약으로 지정해 관리하고 있다. 보건복지부장관과 식약처장이 관계 중앙행정기관장과 협의해 지정하는 방식이다. 그러나 일선 약국가에서 필수약 수급 불안 사태를 꾸준히 겪으면서 시민들도 필요한 때 감기약, 해열제 등 필수약을 사지 못하는 일이 반복해 발생 중이다. 식약처는 해외 제약 선진국이 필수의약품 제도를 운영하는 목적을 살피고 품목성격, 용도 등 유형분류 방식을 조사한다. 선정기준이나 절차, 자문의견 수렴 등 제도 현황을 들여다 보고 필수약 안정공급을 위한 정책지원, 우대조치 등 활용 현황, 선정·자문 협의회·위원회 등 기구운영 현황까지 분석할 방침이다. 이를 토대로 우리나라 국가필수약 정책 고도화 방향을 모색한다. 정부 비축 품목 중심으로 지정됐던 국가필수약이 차츰 민간 의료현장에서 안정공급을 요구하는 품목까지 늘어난 만큼 국가필수약 품목별 특성을 반영한 개선책을 찾는게 큰 틀의 목표다. 이후 국가필수약 지정기준 개선안을 마련하고 용도별 분류방안 검토, 목록개편 방안을 도출하고 현장 적합성을 계속 유지할 수 있는 운영방안까지 마련한다. 국가필수약 지정·재평가 시 품목군 내 필요성을 종합검토하는 방안 등을 살피는 셈이다. 아울러 국가필수약 제도운영 목적과 비슷한 제도와 구분할 필요성을 고려하고 국가필수약 지정대상·제외범위를 검토한다. 종국에는 국가필수약 지정과 안정공급 논의를 지금보다 원활히 하기 위한 안정공급 협의회·분과협의회 개편·운영방안까지 수립한다. 식약처는 "협의회가 필수약 안정공급 정책을 결정·집행할 수 있게 활용 가능한 정부 정책수단과 관계부처·기관 협업 필요사항을 도출한다"며 "국가필수약 안정공급 지원역량 강화를 위한 개선 필요사항을 도출하고 이를 위한 인적·물적 기반강화 방안도 찾을 것"이라고 설명했다.2025-04-06 13:30:28이정환
"국가필수약 품절 차단"…정부, 정책·조직 체질개선 착수[데일리팜=이정환 기자] 정부가 코로나19 팬데믹 이후 빈발하고 있는 국가필수약 수급 불안정 사태 근절·완화를 위해 연내 개선책을 마련한다. 국가필수약 지정 방법과 관련 정부부처·기관 협의회 운영 방식, 안정공급을 위한 정부 정책지원·우대조치 등 관련 제도 전반을 뜯어 고치기 위한 밑 작업에 착수할 계획이다. 해외 주요국가의 필수의약품 제도 현황을 살피고, 우리나라 국가필수약 운영 현황 분석을 기반으로 안정공급 고도화 방향을 모색하는 방법을 통해서다. 6일 식품의약품안전처는 국가필수약 분류 및 안정공급 협업 방안 마련 연구에 나선다고 밝혔다. 코로나19 팬데믹 이후 세계 각국이 자국 중심 의약품 정책을 펴면서 보건안보 위기 위험성이 커지고 감기약 등 필수약 품절 빈도가 늘어난데 대한 대응책을 찾겠다는 의지다. 정부는 2017년부터 질병 관리, 방사능 방재 등 의료현장에 필수적으로 쓰여 안정적으로 공급해야 하는 약을 국가필수약으로 지정해 관리하고 있다. 보건복지부장관과 식약처장이 관계 중앙행정기관장과 협의해 지정하는 방식이다. 그러나 일선 약국가에서 필수약 수급 불안 사태를 꾸준히 겪으면서 시민들도 필요한 때 감기약, 해열제 등 필수약을 사지 못하는 일이 반복해 발생 중이다. 식약처는 해외 제약 선진국이 필수의약품 제도를 운영하는 목적을 살피고 품목성격, 용도 등 유형분류 방식을 조사한다. 선정기준이나 절차, 자문의견 수렴 등 제도 현황을 들여다 보고 필수약 안정공급을 위한 정책지원, 우대조치 등 활용 현황, 선정·자문 협의회·위원회 등 기구운영 현황까지 분석할 방침이다. 이를 토대로 우리나라 국가필수약 정책 고도화 방향을 모색한다. 정부 비축 품목 중심으로 지정됐던 국가필수약이 차츰 민간 의료현장에서 안정공급을 요구하는 품목까지 늘어난 만큼 국가필수약 품목별 특성을 반영한 개선책을 찾는게 큰 틀의 목표다. 이후 국가필수약 지정기준 개선안을 마련하고 용도별 분류방안 검토, 목록개편 방안을 도출하고 현장 적합성을 계속 유지할 수 있는 운영방안까지 마련한다. 국가필수약 지정·재평가 시 품목군 내 필요성을 종합검토하는 방안 등을 살피는 셈이다. 아울러 국가필수약 제도운영 목적과 비슷한 제도와 구분할 필요성을 고려하고 국가필수약 지정대상·제외범위를 검토한다. 종국에는 국가필수약 지정과 안정공급 논의를 지금보다 원활히 하기 위한 안정공급 협의회·분과협의회 개편·운영방안까지 수립한다. 식약처는 "협의회가 필수약 안정공급 정책을 결정·집행할 수 있게 활용 가능한 정부 정책수단과 관계부처·기관 협업 필요사항을 도출한다"며 "국가필수약 안정공급 지원역량 강화를 위한 개선 필요사항을 도출하고 이를 위한 인적·물적 기반강화 방안도 찾을 것"이라고 설명했다.2025-04-06 13:30:28이정환 -
 심평원 "콜린알포세레이트 선별집중심사 문제 없다"[데일리팜=이탁순 기자] 건강보험심사평가원이 콜린알포세레이트 제제의 선별집중심사 기준에 문제가 없다고 재확인했다. 2022년부터 매년 진행되고 있는 콜린알포세레이트 선별집중심사에 대해 의료 일각에서는 심사기준이 불합리하다고 토로하고 있다. 하지만 심평원은 허가사항에 따른 요양급여 인정 기준에 따라 심사하고 있다면서 시각의 문제일 뿐이라고 일축했다. 25일 심평원 원주 본원에서 열린 심사운영실 전문기자단 간담회에서 강중구 심평원장은 콜리알포세레이트 선별집중심사 기준이 타이트하다는 의료계 일각 주장에 대해 그렇지 않다고 부인했다. 강 원장은 "콜린알포세레이트 제제가 선별 급여 결정에 반발해 소송이 진행 중인데, 법리적 해석을 바탕으로 심사를 진행하고 있다"며 "치매 외 환자 사용에 대해서만 점검하고 있다"고 설명했다. 그러면서 심평원과 의료현장, 제약회사의 시각이 다를 뿐이라며 문제 없다는 입장을 재차 내비쳤다. 콜린알포세레이트 제제는 지난 2020년 급여 적정성 재평가를 통해 치매 외 질환에는 급여 적정성이 없다며 선별 급여하기로 했다. 하지만 제약사 반발에 따른 소송 제기로 급여기준은 그대로 유지 중이다. 다만, 식약처가 임상재평가를 추진하면서 일부 적응증이 삭제됐다. 2021년 7월부터는 기존 적응증이었던 '감정 및 행동변화 : 정서불안, 자극과민성, 주위무관심', '노인성 가성우울증'이 삭제됐다. 이에 따라 '뇌혈관 결손에 의한 2차 증상 및 변성 또는 퇴행성 뇌기질성 정신증후군' 적증증만 남았다. 심평원은 이를 토대로 허가 초과 범위 처방에 대해 2022년부터 선별집중 심사를 하고 있다. 허가사항에서 삭제된 '감정 및 행동변화', '노인성 가성우울증'은 허가사항 초과 범위 사용으로 요양급여를 인정하지 않고 있다. 하지만 일부 의료계에서는 심사기준이 명확하지 않고, 불합리하다고 지적한다. 예를 들어 기억력 저하와 착란 등의 증상을 호소하는 퇴행성 뇌기질성정신증후군 환자 처방에도 허가범위 내 사용 근거자료가 부족해 삭감하는 건 불합리하다는 것이다. 현장에서는 또 심평원의 삭감 조치로 처방 기피 현상이 생겼다면서 이의신청 조차 포기하는 의료진이 늘고 있다고 전한다. 해당 문제는 작년 국정감사에서도 제기된 바 있다. 백종헌 국민의힘 의원 문제제기에 심평원은 당시에도 별 문제 없다고 답변했다. 심평원은 "콜린알포세레이트 제제는 식품의약품안전처의 허가사항인 '뇌혈관 결손에 의한 2차 증상 및 변성 또는 퇴행성 뇌기질성 정신증후군'에 대해 요양급여를 인정하고 있다"며 "해당 약제의 이의신청 시 요양기관이 제출한 자료를 기반으로 의학적 타당성에 대해 전문가 자문을 거쳐 심사하고 있다"고 설명했다. 그러면서 " "해당약제의 허가사항 변경으로 '감정 및 행동변화, 노인성 가성우울증'이 삭제되어, 요양기관에 허가사항 범위를 초과해 사용하지 않도록 안내 및 정보제공 등을 실시했다"며 "이에, 이의신청 기관수는 2023년부터 감소해 2024년 상반기에는 67개소로 일부 요양기관에 집중돼 처리됐다"고 덧붙였다. 강 원장은 "약제 역시 급여 중단기준이 있다"면서 "재평가를 통해 효과가 없다고 판단되면 약을 교체해야지, 원칙을 무시한 판단이 있어선 안 된다"고 강조했다. 콜린알포세레이트 제제는 올해 선별집중심사 항목에도 포함돼 있다. 안유미 심사운영실장은 "선별집중심사의 취지는 요양기관이 자율적으로 진료를 개선할 수 있도록 기회를 제공하고 사전 예방하는 것"이라며 "2025년 선별집중심사 신규 항목은 ▲진료비가 지속적으로 증가하거나 ▲방사선 피폭 등 환자 안전과 직결되고 ▲오남용 가능성 등 적정 진료 유도가 필요한 항목으로 선정됐다"고 설명했다 한편, 심사운영실은 의료기관의 자료제출 부담을 완화하는 방안도 마련했다는 설명이다. 그 중 하나가 17개 성분 항암제의 2군 목록 삭제다. 심평원은 이달부터 급여 등재된 지 오래돼 임상적 경험이 충분하며 1군 항암제로 변경해도 급여기준에 변경이 없는 17개 성분(옥살프리틴, 벨로테칸, 레트로졸, 이리노테칸, 카페시타빈 등)의 항암제를 정비해 2군 목록에서 삭제했다. 보통 2군 항암제로 처방하고 요양급여를 신청하면 심사 청구 서류 작성이 복잡하고 번거롭다는 게 현장의 의견이다. 반면 1군 항암제는 급여기준대로 투여하면 문제가 없다. 안 실장은 "2군 목록에서 삭제된 17개 성분의 항암제는 1군 항암제로 공고 안에 명시된 항암요법 범위 내에서 진료의사의 의학적 판단 및 환자의 증상 등에 따라 필요·적절하게 투여를 바란다"면서 "다만, 심사과정에서 필요시 관련 자료를 요청할 수 있다"고 설명했다. 그러면서 "항암제 심사가 신속하게 처리될 수 있도록 요양기관에서는 명세서 특정내역에 각 암종별 '항암요법'에 명시된 투여대상, 투여단계, 투여요법을 명확하게 기재해 청구해 달라"고 주문했다. 특히 해당 특정내역란에 '암질환 Stage 분류', '암질환 TNM 분류', 투여요법 등에 대한 정확한 기재가 필요하다는 설명이다. 강 원장은 "굳이 2군 항암제를 많이 둘 필요가 없다"면서 "추가로 2군 목록 삭제가 더 있을 것"이라고 덧붙였다.2025-03-25 19:04:24이탁순
심평원 "콜린알포세레이트 선별집중심사 문제 없다"[데일리팜=이탁순 기자] 건강보험심사평가원이 콜린알포세레이트 제제의 선별집중심사 기준에 문제가 없다고 재확인했다. 2022년부터 매년 진행되고 있는 콜린알포세레이트 선별집중심사에 대해 의료 일각에서는 심사기준이 불합리하다고 토로하고 있다. 하지만 심평원은 허가사항에 따른 요양급여 인정 기준에 따라 심사하고 있다면서 시각의 문제일 뿐이라고 일축했다. 25일 심평원 원주 본원에서 열린 심사운영실 전문기자단 간담회에서 강중구 심평원장은 콜리알포세레이트 선별집중심사 기준이 타이트하다는 의료계 일각 주장에 대해 그렇지 않다고 부인했다. 강 원장은 "콜린알포세레이트 제제가 선별 급여 결정에 반발해 소송이 진행 중인데, 법리적 해석을 바탕으로 심사를 진행하고 있다"며 "치매 외 환자 사용에 대해서만 점검하고 있다"고 설명했다. 그러면서 심평원과 의료현장, 제약회사의 시각이 다를 뿐이라며 문제 없다는 입장을 재차 내비쳤다. 콜린알포세레이트 제제는 지난 2020년 급여 적정성 재평가를 통해 치매 외 질환에는 급여 적정성이 없다며 선별 급여하기로 했다. 하지만 제약사 반발에 따른 소송 제기로 급여기준은 그대로 유지 중이다. 다만, 식약처가 임상재평가를 추진하면서 일부 적응증이 삭제됐다. 2021년 7월부터는 기존 적응증이었던 '감정 및 행동변화 : 정서불안, 자극과민성, 주위무관심', '노인성 가성우울증'이 삭제됐다. 이에 따라 '뇌혈관 결손에 의한 2차 증상 및 변성 또는 퇴행성 뇌기질성 정신증후군' 적증증만 남았다. 심평원은 이를 토대로 허가 초과 범위 처방에 대해 2022년부터 선별집중 심사를 하고 있다. 허가사항에서 삭제된 '감정 및 행동변화', '노인성 가성우울증'은 허가사항 초과 범위 사용으로 요양급여를 인정하지 않고 있다. 하지만 일부 의료계에서는 심사기준이 명확하지 않고, 불합리하다고 지적한다. 예를 들어 기억력 저하와 착란 등의 증상을 호소하는 퇴행성 뇌기질성정신증후군 환자 처방에도 허가범위 내 사용 근거자료가 부족해 삭감하는 건 불합리하다는 것이다. 현장에서는 또 심평원의 삭감 조치로 처방 기피 현상이 생겼다면서 이의신청 조차 포기하는 의료진이 늘고 있다고 전한다. 해당 문제는 작년 국정감사에서도 제기된 바 있다. 백종헌 국민의힘 의원 문제제기에 심평원은 당시에도 별 문제 없다고 답변했다. 심평원은 "콜린알포세레이트 제제는 식품의약품안전처의 허가사항인 '뇌혈관 결손에 의한 2차 증상 및 변성 또는 퇴행성 뇌기질성 정신증후군'에 대해 요양급여를 인정하고 있다"며 "해당 약제의 이의신청 시 요양기관이 제출한 자료를 기반으로 의학적 타당성에 대해 전문가 자문을 거쳐 심사하고 있다"고 설명했다. 그러면서 " "해당약제의 허가사항 변경으로 '감정 및 행동변화, 노인성 가성우울증'이 삭제되어, 요양기관에 허가사항 범위를 초과해 사용하지 않도록 안내 및 정보제공 등을 실시했다"며 "이에, 이의신청 기관수는 2023년부터 감소해 2024년 상반기에는 67개소로 일부 요양기관에 집중돼 처리됐다"고 덧붙였다. 강 원장은 "약제 역시 급여 중단기준이 있다"면서 "재평가를 통해 효과가 없다고 판단되면 약을 교체해야지, 원칙을 무시한 판단이 있어선 안 된다"고 강조했다. 콜린알포세레이트 제제는 올해 선별집중심사 항목에도 포함돼 있다. 안유미 심사운영실장은 "선별집중심사의 취지는 요양기관이 자율적으로 진료를 개선할 수 있도록 기회를 제공하고 사전 예방하는 것"이라며 "2025년 선별집중심사 신규 항목은 ▲진료비가 지속적으로 증가하거나 ▲방사선 피폭 등 환자 안전과 직결되고 ▲오남용 가능성 등 적정 진료 유도가 필요한 항목으로 선정됐다"고 설명했다 한편, 심사운영실은 의료기관의 자료제출 부담을 완화하는 방안도 마련했다는 설명이다. 그 중 하나가 17개 성분 항암제의 2군 목록 삭제다. 심평원은 이달부터 급여 등재된 지 오래돼 임상적 경험이 충분하며 1군 항암제로 변경해도 급여기준에 변경이 없는 17개 성분(옥살프리틴, 벨로테칸, 레트로졸, 이리노테칸, 카페시타빈 등)의 항암제를 정비해 2군 목록에서 삭제했다. 보통 2군 항암제로 처방하고 요양급여를 신청하면 심사 청구 서류 작성이 복잡하고 번거롭다는 게 현장의 의견이다. 반면 1군 항암제는 급여기준대로 투여하면 문제가 없다. 안 실장은 "2군 목록에서 삭제된 17개 성분의 항암제는 1군 항암제로 공고 안에 명시된 항암요법 범위 내에서 진료의사의 의학적 판단 및 환자의 증상 등에 따라 필요·적절하게 투여를 바란다"면서 "다만, 심사과정에서 필요시 관련 자료를 요청할 수 있다"고 설명했다. 그러면서 "항암제 심사가 신속하게 처리될 수 있도록 요양기관에서는 명세서 특정내역에 각 암종별 '항암요법'에 명시된 투여대상, 투여단계, 투여요법을 명확하게 기재해 청구해 달라"고 주문했다. 특히 해당 특정내역란에 '암질환 Stage 분류', '암질환 TNM 분류', 투여요법 등에 대한 정확한 기재가 필요하다는 설명이다. 강 원장은 "굳이 2군 항암제를 많이 둘 필요가 없다"면서 "추가로 2군 목록 삭제가 더 있을 것"이라고 덧붙였다.2025-03-25 19:04:24이탁순
오늘의 TOP 10
- 1급여재평가 탈락 번복 첫 사례...실리마린 기사회생하나
- 2일동제약, 이재준 투톱 체제…비만 신약 사업화 검증대
- 3공공의대 의전원 형태로...15년 의무 복무 가닥
- 4'미국 FDA GRAS 등재'의 함정: 진짜를 가려내는 시각
- 5"멘쿼드피 등장…수막구균 예방의료의 중요한 진전"
- 6[서울 구로] 기형적약국·한약사·비대면진료, 공동 대응 결의
- 7알엑스미, 약국 대상 PDLLA ‘쥬베클’ 예약 판매 돌입
- 8정은경 "신규 증원 의사인력, 지역·필수의료 배치"
- 9약사법부터 민·형사 건도…서울시약, 약국 상담 사례집 발간
- 10식약처, 세르비에 희귀의약품 '보라니고정' 허가
-
상품명최고최저평균
-
게보린(10정)4,0003,0003,782
-
노스카나겔(20g)22,00018,00021,195
-
베나치오에프액(75ml)1,000800996
-
비코그린에스(20정)5,0004,5004,625
-
머시론정(21정)10,0008,5009,873





























![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)

![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202511/1763106585375.png)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)
![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/products/8eae7689-61be-4b71-9608-05364b05ea12.png)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[아워팜] 혈행건강 히어로, 혈행건강 초임계 rTG 오메가3 프리미엄](https://i.baropharm.com/products/f724f191-7052-4ad5-bc92-cda889cf13a6.png)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
