- LOGIN
- MemberShip
- 2025-12-23 05:17:53
- 19 K-biosimilar products sold in 11 markets after 12 yrs
- by Chon, Seung-Hyun | translator Kim, Jung-Ju | 2024-04-25 05:49:54
Domestic pharmaceutical and biotech companies have succeeded in commercializing biosimilars in 11 areas.
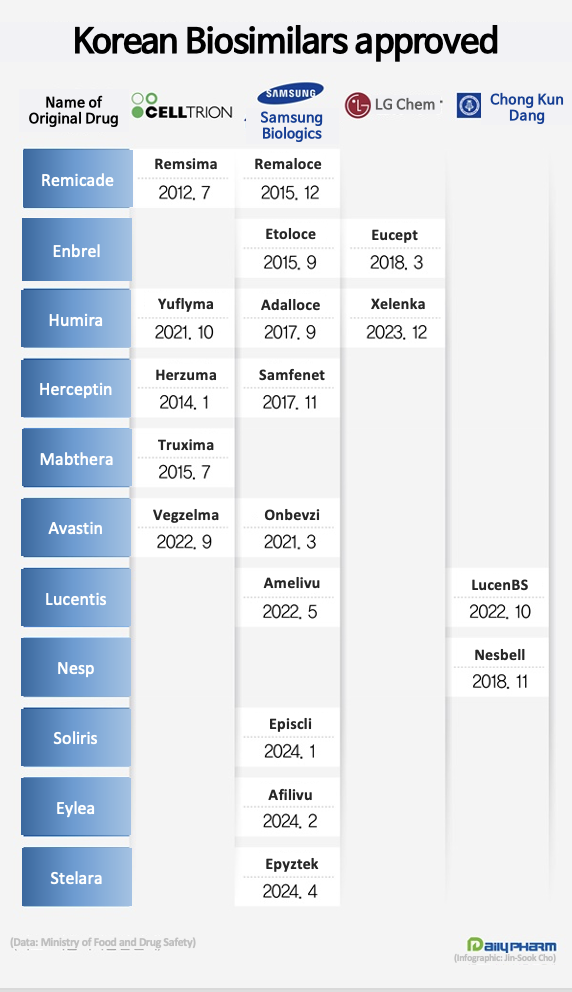
In the 12 years since Celltrion's Remsima was introduced, 19 biosimilars have received domestic approval.
Among the companies, Samsung Bioepis has entered 9 markets, the most among Korean companies.
According to the Ministry of Food and Drug Safety, Samsung Bioepis received approval for Stelara’s biosimilar Epyztek on November 11.
This is the first time Samsung Bioepis has received approval for a Stelara biosimilar in Korea.
Stelara, which was developed by Janssen, inhibits the activity of interleukin (IL)-12/23, a type of inflammatory cytokine related to autoimmune diseases, and is used to treat plaque psoriasis, psoriatic arthritis, Crohn's disease, and ulcerative colitis.
Annual global sales of the drug amount to approximately KRW 14 trillion.
In January, Samsung Bioepis obtained marketing authorization from the MFDS for Episcli, a Soliris biosimilar.
Soliris is a treatment for rare diseases such as paroxysmal nocturnal hemoglobinuria and atypical hemolytic uremic syndrome developed by Alexion, with global sales of approximately KRW 5 trillion.
Also, the company obtained marketing authorization for Eylea biosimilar Afilivu in February.
Eylea, which was developed by U.S.-based Regeneron, has indications for wet (neovascular) age-related macular degeneration.
Macular degeneration is an ocular disease caused by aging and inflammation of the retinal macula, the nerve tissue in the center of the retina of the eye.
In severe cases, it can cause blindness.
With Samsung Bioepis succeeding in commercializing the first biosimilars in three markets in Korea this year, domestic pharmaceutical and biotech companies have now received approval for biosimilars in a total of 11 areas.
Domestic companies first tapped into the biosimilar market in 2012 when Celltrion was granted approval for Remsima.
Remsima is a biosimilar product of Remicade, an autoimmune disease treatment.
Samsung Bioepis received MFDS approval for Remicade biosimilar Remaloce in 2015.
Korean pharma and biotech companies have been receiving approval for their biosimilar products in the Enbrel, Humira, Herceptin, Mabthera, Avastin, Lucentis, and Nesp markets.
In 2015, Samsung Bioepis received approval for its first biosimilar of Enbrel, Etoloce.
In the Enbrel market, LG Chem received approval for the second Enbrel biosimilar, Eucept in 2018.
Celltrion commercialized its second biosimilar, Herzuma, in 2014.
Herzuma is a Herceptin.
Herzuma was the first biosimilar of an anticancer drug that was released by a Korean company.
Samsung Bioepis entered the Herzuma market second in 2017 with the approval of its Samfenet.
In 2015, Celltrion received domestic approval for Truxima, a biosimilar of the anticancer drug Mabthera.
A total of 3 domestically developed biosimilars have been approved in the autoimmune treatment Humira market.
In July 2020, Samsung Bioepis received approval for Adalloce, the first Humira biosimilar, and Celltrion received approval for Yuflyma in June 2021.
LG Chem received approval for Xelenka in December of last year, which became the third new entrant into the Humira market.
Samsung Bioepis successfully commercialized its first biosimilar, Onbevzi, of the cancer drug Avastin in March 2021.
Avastin is an anticancer drug indicated for the treatment of metastatic colorectal and metastatic breast cancer, non-small cell lung cancer, advanced or metastatic renal cell carcinoma, glioblastoma, epithelial ovarian cancer, fallopian tube cancer, primary peritoneal cancer, and cervical cancer.
In September 2022, Celltrion received domestic approval for the second Avastin biosimilar, Vegzelma.
In 2022, 2 Lucentis biosimilars entered the domestic approval stage.
Lucentis is used to treat eye diseases such as macular degeneration and diabetic macular edema.
In May 2022, Samsung Bioepis received domestic approval for Amelivu, a biosimilar of Lucentis.
In October of the same year, Chong Kun Dang obtained a domestic license for Lucentis biosimilar LucenBS.
In 2018, Chong Kun Dang’s biosimilar Nesbell, a biosimilar of the anemia drug Nesp, reached the commercialization stage.
In total, 19 biosimilars from Korean companies have been approved as of now.
By company, Samsung Bioepis had the most biosimilars with 9, and Celltrion entered 6 markets.
LG Chem and Chong Kun Dang each released 2 biosimilars.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










