- LOGIN
- MemberShip
- 2025-12-23 01:58:23
- K-Bio speeds up novel drug development to treat MASH
- by Son, Hyung-Min | translator Kang, Shin-Kook | 2024-07-15 05:47:32
The biotech industry in South Korea has made notable achievements in treating MASH.
Many pharmaceutical companies have failed in clinical trials to develop a treatment for MASH due to its complex pathogenesis.
As the first treatment for MASH has been approved, the industry draws attention to the success of the commercialization of other new drug candidates of various pharmaceutical companies that entered clinical trials in South Korea.
On July 11th, the current trend in the MASH treatment development was discussed during the Bioplus-Interphex Korea 2024 (BIX 2024), sponsored by the Korea Biotechnology Industry Organization (Korea Bio) and RX Korea.
MASH was previously known as Non-Alcoholic Steatohepatitis (NASH).
International academic associations, such as the American Association for the Study of Liver Diseases (AASLD), agreed upon the use of the term Metabolic dysfunction-associated steatohepatitis (MASH).
Developing treatment for MASH has been challenging until now.
However, the first novel drug to treat MASH in March became available after the U.S.-based Madrigal Pharmaceuticals’ Rezdiffra was approved.
The late-comers eye on the opportunity to develop the second potential novel drug development through various mechanisms.

The company has recently received approval for its Investigational New Drug (IND) application from the U.S.
Food and Drug Administration (FDA).
DD01’s phase 2 trial will be conducted across 10 institutions in the United States, enrolling 68 patients with MASH-accompanying overweight and obesity.
DD01 is an agent targeting both GLP-1 and glucagon.
In preclinical trials, D&D pharmatech’s DD01, an agent targeting both GLP-1 and glucagon, has shown a significant decrease in liver fat and a weigh loss effect.
DD01’s effect has been maintained in a phase 1 trial.
The phase 1 trial evaluated the drug tolerance and safety of DD01 and placebo in patients with MASH accompanied by obesity instead of in healthy adults.
The clinical results demonstrated that a 4-week DD01 treatment reduced liver fat by 52%.
These results were similar to those of the 1-year treatment with semaglutide (57% reduction) or Tirzepatide (47% reduction).
High-dose (80 mg) DD01 treatment reduced liver fat by 30% in all patients.
In contrast, the placebo’s reduction effect was shown in 8% of all patients.
Lee Seul-ki, D&D pharmatech’s CEO, said, “We believe that glucagon plays an important role because many obesity patients also have MASH.
Clinical studies reported that glucagon therapy reduces liver fibrosis by 50-80%.” Lee added that “DD01 is formulated with GLP-1 and glucagon in a ratio of 10:1.
In a preclinical study, DD01 demonstrated to maintain the effect of GLP-1 as well as the effect of glucagon.” “We need a drug that effectively regulates blood glucose and weight to treat MASH.
GLP-1 drugs that can quickly elevate blood glucose have adverse reactions, such as dizziness and vomiting.
For DD01, we confirmed that it is more slowly released into the blood than other therapies.
Additionally, we received approval of an IND application for a new protein therapy targeting collagen synthesis and investigating the potential of various novel drugs,” Lee commented.
OliX Pharmaceuticals is developing a new drug candidate, OLX75016, to treat MASH.
OLX75016 works by inhibiting MARC1 expression, which is related to the pathogenesis of MASH and reducing liver fat.
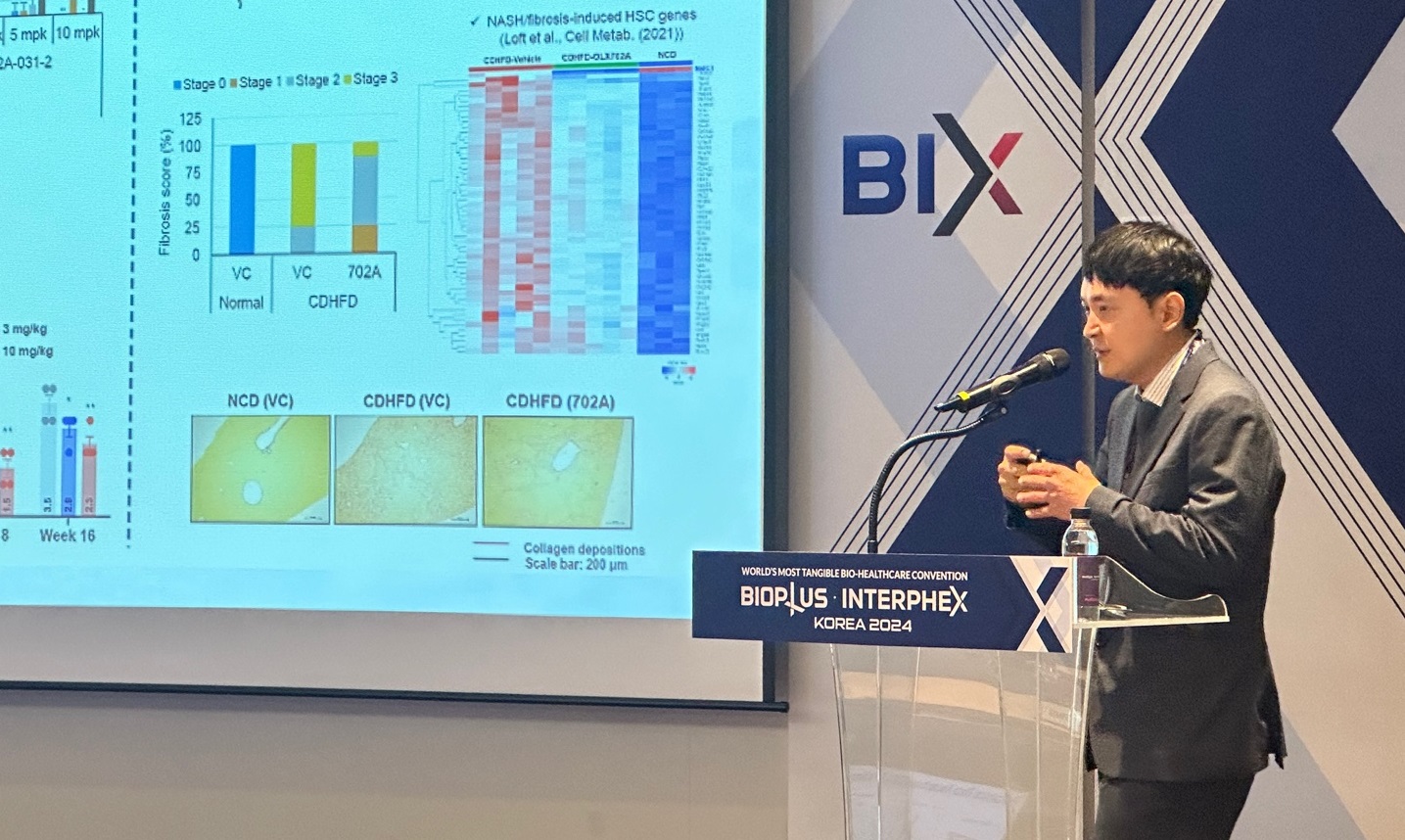
Notably, OliX Pharmaceuticals is investigating the possibility of using OLX75016 in combination with novel drugs targeting GLP-1 and glucagon.
Since most MASH treatments target GLP-1, OliX Pharmaceuticals plans to develop treatments that have distinguished mechanisms and improve synergistic effects with GLP-1 agents.
In a preclinical trial, OLX702A demonstrated effects in reducing liver fat and reversing liver fibrosis.
June Hyun Park, OliX Pharmaceuticals Director, said, “Fibrosis contributes to deaths associated with liver.
We are confirming the role of MARC1 in liver fibrosis.
As we confirm MARC1 as an important factor in fibrosis, we are exploring the potential of novel drug development.”
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










