- LOGIN
- MemberShip
- 2025-12-22 22:38:33
- Yuhan’s Leclaza enters US 6yrs after signing licensing deal
- by Chon, Seung-Hyun | translator Kang, Shin-Kook | 2024-08-22 05:50:37
Yuhan Corp’s new anticancer drug Leclaza has successfully entered the U.S.
market.
The drug has reached the commercialization stage 6 years after licensing out its technology to Janssen.
As a result, the company will receive USD 60 million as a milestone payment with Leclaza’s approval in the U.S.
The company has earned nearly KRW 300 billion in technology fees since licensing out Leclaza’s technology.

Food and Drug Administration (FDA) on the 20th.
The U.S.
Food and Drug Administration (FDA) has approved Yuhan Corporation’s Leclaza in combination with Johnson & Johnson’s Rybrevant for the first-line treatment of adult patients with locally advanced or metastatic NSCLC with epidermal growth factor receptor (EGFR) exon 19 deletions or exon 21 L858R substitution mutations, as detected by an FDA-approved test.
As a result, Leclaza became the first domestically developed cancer drug to receive U.S.
approval.
Leclaza, which was approved as the 31st domestically developed new drug in January 2021, is an NSCLC treatment.
The company succeeded in entering the U.S.
market 6 years after licensing out Leclaza to Janssen Biotech in November 2018.
With the FDA approval of Leclaza, Yuhan secured additional milestone payments.
The FDA approval milestone for Leclaza was set at USD 60 million (around KRW 80 billion).
This is more than the company's operating profit of KRW 56.8 billion last year.
In November 2018, the company received a USD 50 million upfront payment for Leclaza.
In April 2020, the company received a USD 35 million milestone payment from Janssen.
Johnson & Johnson paid the additional milestone to the company after initiating a clinical trial for the Rybrevant and Leclaza combination.
In November 2020, Johnson & Johnson paid an additional milestone of USD 65 million to Yuhan Corp as it began recruiting subjects for the trial.
Additional milestone payments followed upon successful completion of the trial and FDA approval.
In total, Yuhan Corp has earned a total of USD 210 million in technology fees since licensing out Leclaza’s technology.
Of the total technology fee revenue, 40% is to be paid to the original developer, Oscotec.
In 2016, the company acquired the rights to develop the preclinical drug Leclaza from Oscotec and its subsidiary Genosco.
The total value of the agreement had been KRW 1.5 billion.
Of the amount, KRW 1 billion was set to be paid within 30 days of the signing of the agreement and KRW 500 million was to be paid after the approval of Phase I clinical trials.
Since exporting Leclaza’s technology, the drug settled as Yuhan’s stable cash cow.
From 2020 to Q2 this year, the company has recognized a total of KRW 253.8 billion as technology fee revenue.
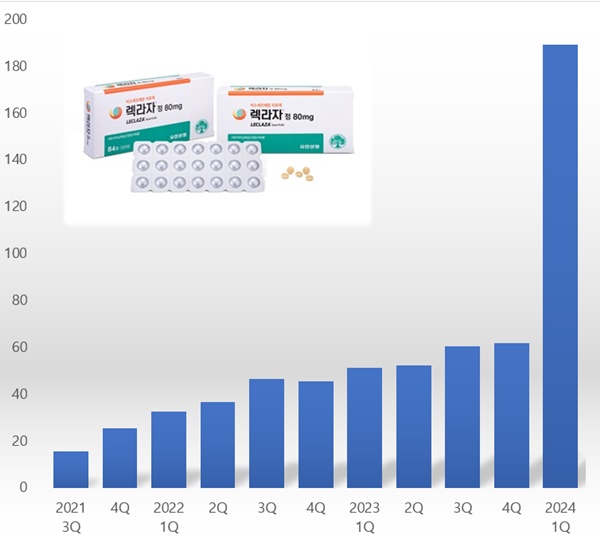
According to drug research institution IQVIA, sales of Leclaza reached KRW 22.6 billion last year, up 40.3% year-on-year.
The year after its launch, Leclaza’s sales surpassed the KRW 10 billion mark and recorded KRW 16.1 billion, then exceeded KRW 20 billion last year.
Demand in Korea has surged since the drug was granted first-line treatment status this year.
Initially, Leclaza was approved for the second-line treatment of locally advanced or metastatic NSCLC with a specific gene (T790M) resistance after receiving first- or second-generation epidermal growth factor receptor (EGFR) tyrosine kinase inhibitors (TKIs).
In June last year, the MFDS approved the marketing authorization expansion for Leclaza to ‘first-line treatment of NSCLC.’ The MOHW approved the drug’s reimbursement expansion to first-line this year.
In Q1, Leclaza reported sales of KRW 18.9 billion, up 269.9% year-on-year from the KRW 5.1 billion in Q1 the previous year.
Leclaza’s revenues more than tripled in the first quarter compared to the previous quarter.
Since its launch in South Korea, the company's cumulative sales of Leclaza through the first quarter totaled to KRW 61.7 billion.
Together with the technology fee revenue, the company earned more than KRW 300 billion with Leclaza alone.
According to MFDS, Leclaza's production performance was KRW 112.2 billion last year.
Leclaza generated its first production revenue of KRW 9.8 billion in 2021, which soared to KRW 39.3 billion in 2022.
Last year, the company's production scale exceeded KRW 100 billion for the first time.
The increase in domestic sales and the acceleration of global clinical trials led to a rise in production performance.
Leclaza, which is produced and supplied by Yuhan, is being used in global clinical trials.
Therefore, the faster the global clinical trials progresses, the more the production of Leclaza increases.
The MOHW analyzed that reimbursement of Lexarza as a first-line treatment will cost an additional KRW 88.1 billion.
Based on Q1 sales of Leclaza and the reimbursement expansion, Leclaza’s sales will likely exceed KRW 100 billion this year.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










