- LOGIN
- MemberShip
- 2025-12-22 22:34:16
- Generic companies lastly challenge Lixiana patent
- by Kim, Jin-Gu | translator Kang, Shin-Kook | 2024-09-04 05:48:47

This is due to the imminent expiry of the product's formulation patent, which is 2 years away.
The strategy of the patent challengers is to avoid the formulation patent and launch generics early upon the expiry of the product patent in November 2026.
According to industry sources on the 3rd, Dongkwang Pharmaceutical recently filed a trial to confirm the passive scope of Lixiana's formulation patent against Daiichi Sankyo.
Prior to Dongkwang Pharmaceutical, Theragen Etex also filed a challenge to avoid the same patent last month.
The interesting fact is that a series of such challenges had ended in the 2020-2021 season.
The challenge to the Lixiana formulation patent began in July 2018 when Boryung Pharmaceutical first filed a trial to avoid Lixiana’s patent.
Hanmi Pharmaceutical, Chong Kun Dang, Samjin Pharm, Kolmar Korea, Kolmar Pharma, HK.
Inno.N, Hutecs Korea followed to receive trial decisions for the same patent.
The companies won the first trial after May 2020.
In 2021, Dong-A ST and Shinnil Pharmaceutical filed for the same judgment and won the first trial.
The original manufacturer of Lixiana, dropped its appeal, and the first-instance victory was finalized as a ruling.
This ended the patent challenge, with 10 generic companies avoiding Lixiana's formulation patent once and for all.
Now, more than 3 years later, the challenge has resumed with Theragen Etex, Dongkwang Pharmaceutical filing the trials.
The analysis is that the companies made the move as the expiry of Lixiana's product patent is now just 2 years away.
There are 2 Lixiana patents listed on the MFDS’s green list: a product patent that expires in November 2026 and a formulation patent that expires in August 2028.
Generic companies plan to avoid the formulation patent and launch generics of Lixiana early to coincide with the expiration of the product patent.
If the companies that won the first trial won the invalidation trial, the patent itself would have been invalidated, rendering no need for latecomers to file separate challenges.
However, since the previous companies won the passive scope confirmation trial rather than the invalidation trial, the latecomers must also file individual challenges.
Of course, as other generic companies have already won, the chances of success for the latecomers are high.
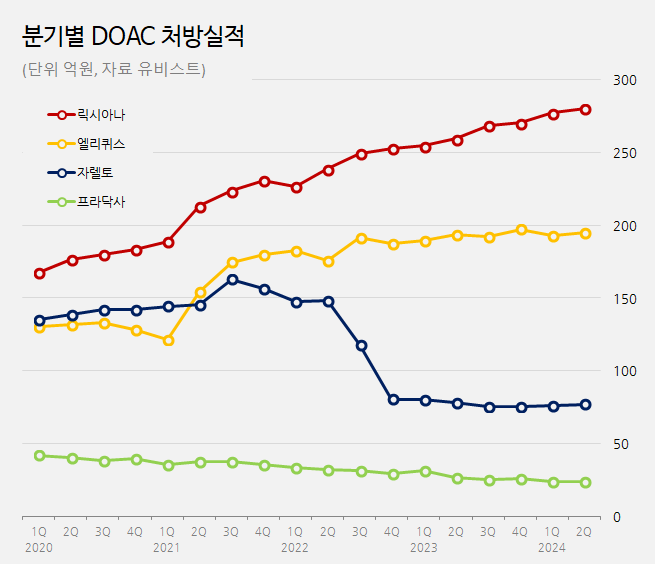
According to pharmaceutical market research institution UBIST, Lixiana’s prescription sales were KRW 105.3 billion last year.
That is up 9% from the KRW 96.7 billion in 2022.
In the first half of this year alone, the drug generated KRW 55.7 billion in prescription sales.
Lixiana first became the market leader in 2019 and has maintained its lead ever since.
The company attributed the rise in prescription sales to the copromotion synergy with Daewoong Pharmaceutical.
Moreover, the gap with the second-ranked drug has been widening upon the expiration of the substance patents of its rivals Xarelto (rivaroxaban) and Eliquis (apixaban).
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










