- LOGIN
- MemberShip
- 2025-12-22 19:06:02
- Jardiance generics prepare for final launch in Korea
- by Kim, Jin-Gu | translator Alice Kang | 2024-09-30 05:47:10
Generic companies are in the midst of last-minute preparations to enter the market for the SGLT inhibitor diabetes drug Jardiance (empagliflozin), which is set to expire in just about half a year.
With Forxiga’s market withdrawal expected to leave an annual sales gap of KRW 50 billion, the race to fill this gap is expected to intensify among the generic companies.
Generic companies seek to avoid Jardiance’s crystalline form patent 8 years later…are they eyeing Forxiga’s gap?

In the case of Hanmi Pharmaceutical, it succeeded in avoiding Jardiance’s crystalline patent a step later than other companies.
More than 50 companies, including Chong Kun Dang, have challenged Jardiance’s crystalline form patent since 2018 and won their first trial between 2019 to 2021.
Hanmi Pharmacuetical had also filed to invalidate the same Jardiance’s patent in 2015 but hadn’t made much action since losing the first trial the following year.
Even when the other companies filed a series of challenges to avoid the crystalline patent, Hanmi Pharmaceutical chose not to join in the race.
However, in March this year, the company changed its course and again filed to avoid the crystalline patent.
The company’s challenge comes 8 years later than the other companies.
Like the other companies, Hanmi Pharmaceutical plans to launch its generic early, when the patent for Jadian expires in March next year.
Some speculate that AstraZeneca’s decision to withdraw another SGLT-2 inhibitor, Forxiga, from South Korea, may have played a role in this.
AstraZeneca Korea decided to withdraw Forxiga from the Korean market last December.
Forxiga was the leading SGLT-2 inhibitor in the market until recently.
With the market leader withdrawing from the market, industry insiders believe that the generic companies are seeking to target this void created by the withdrawal.
In fact, prior to Hanmi Pharmaceutical, Daehwa Pharmaceutical, Medica Korea, Korea Prime Pharmaceutical, and Aprogen Biologics filed challenges to avoid the crystalline patent and launch their generic versions of Jardiance in March this year.
All of these challenges were filed after AstraZeneca decided to withdraw Forxiga from South Korea.
According to the market research institution UBIST, Forxiga’s prescription sales amounted to KRW 51 billion in 2022.
Last year, its prescriptions grew 9% to KRW 55.5 billion, despite the launch of its generics upon Forxiga’s patent expiry.
The rise in prescription sales was slightly slower this year, earning KRW 21.7 billion in the first half of the year.
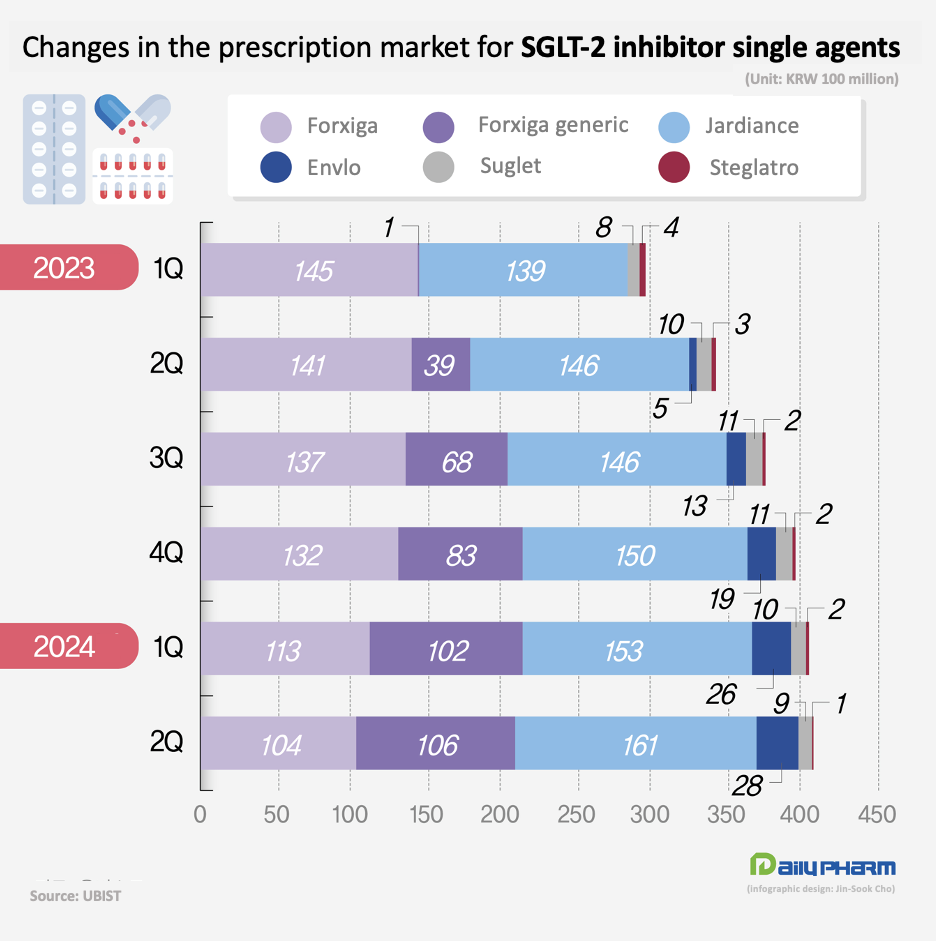
In Q2, the drug’s sales were overtaken by the combined prescription volume of its generics.
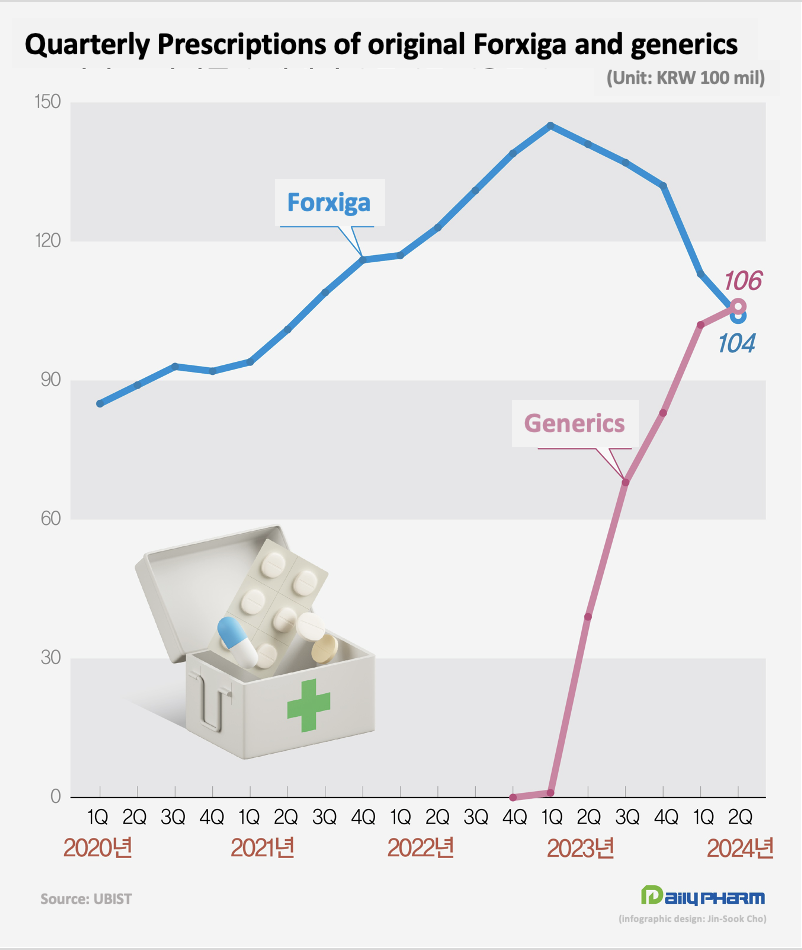
AstraZeneca Korea plans to supply Forxiga domestically only until the first half of this year, and then distribute only the stockpiled amount.
This means that from next year, a KRW 50 billion gap will remain unfilled in the market in earnest.
Last-minute generic approvals also in full swing...companies expected to push ahead with launch despite unregistered patent risk Due to such circumstances, the domestic pharmaceutical companies' expectations for Jardiance’s generic market have also been growing ahead of the expiration of the product patent.
Companies that have previously succeeded in avoiding Jardiance’s crystalline patent are in the midst of last-minute preparations, including receiving authorizations for their generics one after another.
Only this month, GC Cross and Dongkwang Pharm received approval for their generic versions of Jardiance and Jardiance Duo.
Including the two, there are now 53 companies that have authorized generic versions of Jardiance and Jardiance Duo.
If Hanmi Pharmaceutical and Daehwa Pharmaceutical, which succeeded in avoiding Jardiance’s crystalline patent, also receive approval for their respective generic versions, the number of approved generic companies is expected to increase to 60.
In other words, fierce competition among Jardiance generics is expected from March next year.
The product patent for Jardiance will expire in March next year.
Other than the product patent, the crystalline patent is the only patent registered in MFDS’s green list.
Generic companies plan to avoid the crystalline patent and release generics early in line with the date of Jardiance’s substance patent expiry.
Although there are still patents that have not been registered in Korea’s green list, most companies are expected to push ahead and launch their respective generics.
In the case of Trajenta generics, most companies pushed ahead with their generic launches without fully addressing the risk of its unlisted patents.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










