- LOGIN
- MemberShip
- 2025-12-22 16:46:59
- Reasonable compromise between industry-govt is key
- by Eo, Yun-Ho | translator Alice Kang | 2024-12-03 05:52:50

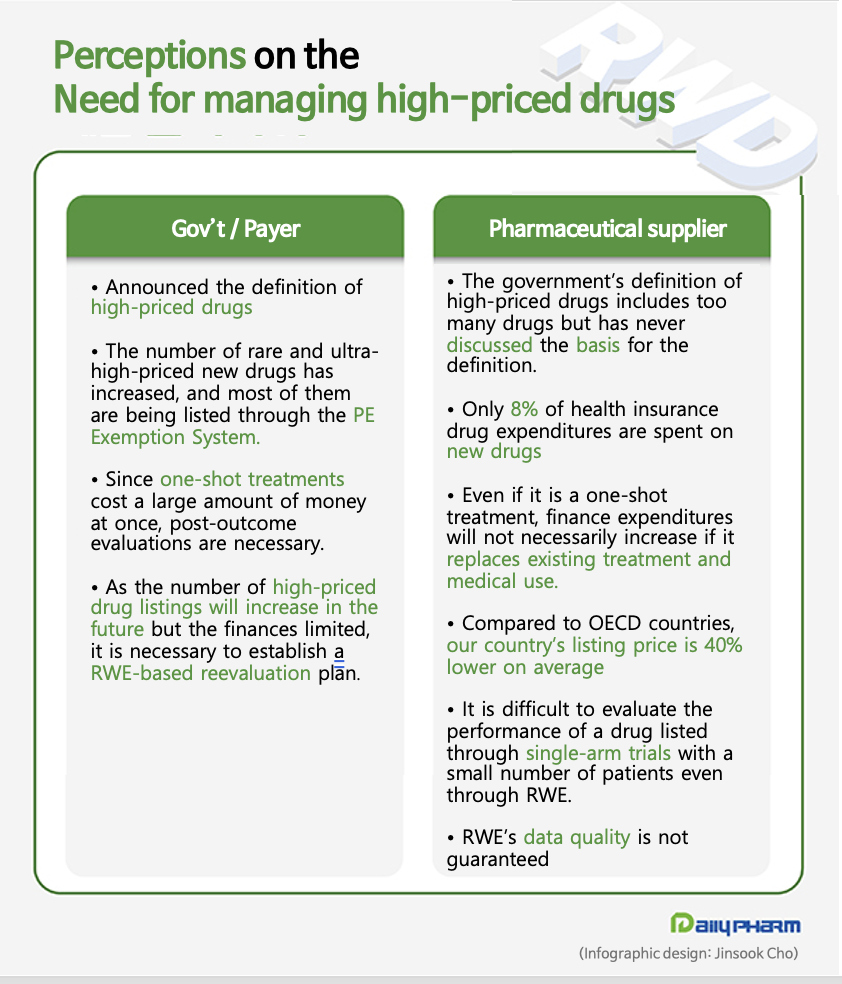
It is no wonder that the government has been gathering voices in support of its 'reduction' under the pretense of 'improvement'.
The PE exemption system is the only system in Korea's insurance policy landscape that helps patients with rare diseases and rare cancers get the treatments they need.
Applying double pricing through risk-sharing agreements (RSAs) and other measures has also contributed to reducing barriers and improving access to new drugs, but the PE exemption system has made otherwise impossible acceptance possible.
But always, the government has to work with a limited amount of finances.
This is why the government’s proposed plan to use RWD for reevaluations is also seen as a ‘reduction’ measure.
Of course, it's not a new concept, but the pharmaceutical industry is the one that has mentioned RWD and RWE.
As mentioned in the first part of the feature article (Is RWD needed for post-listing control of PE-exempt drugs?), the level of evidence for RWD is lower than that of randomized controlled trials (RCTs). As the KRPIA points out, the results can vary depending on the intentions of the entity collecting the data, and there is a high risk of bias. However, multinational pharmaceutical companies have been actively promoting RWD data of their new drugs whenever it is released.
Especially when the research results on Asians and Koreans were released, they were often covered in articles and discussed in interviews.
It is not uncommon to see comments from experts who highly regard the evidence level of RWD.
The RWD includes patients with higher disease severity than RCTs but the results are good, it is highlighted even more.
In other words, data with a low level of evidence is being used to promote the efficacy of a drug.
Re-evaluation of PE exemption drugs is a different story.
But it's worth asking whether the industry is really finding it difficult to collect the data and whether it could have been more proactive in discussing with the government to find a compromise.
As one MA (Market Access) representative at a multinational pharmaceutical company said, “I know that the industry has used RWD to its advantage.
However, we do not have RWD available for all of our drugs, and it is very costly to extract the data.
It is clearly unreasonable to unilaterally request RWD for the evaluation of PE exemption drugs.” “And even if the RWD results are better than RCTs, it is unlikely that they will increase the price of the drug.
It is more likely that they will raise the barrier and act as a mechanism for price reduction.”
In single-arm trials, uncertainty exists in the control group even for RWD, which makes it difficult to conduct PE evaluations that require a comparator-control analysis. The industry argued that the indirect comparison guideline should be revised to allow more drugs to be evaluated using meta-analysis of all available data, which would then increase pharmacoeconomic evaluations.
Various post-listing mechanisms have led to a 50% reduction from the initial listing price of drugs that have comparator drugs that were listed a long time ago or become off-patent.
For example, clinical reevaluation and the price ceiling amount reevaluations were conducted the previous year, and a reduction in the actual transaction price, a revision of the price-volume agreement system, and external reference pricing reevaluations were set to be conducted this year.
However, it is also clear that the number of high-priced anti-cancer drugs and orphan drugs is increasing rapidly, and there will be more drugs that would want to seek listing through the PE exemption system.
KRPIA emphasized, “To improve the system in practice, the government, along with researchers who have experience in building pharmacoeconomic evaluation data, and the pharmaceutical industry that is required to submit the data, should work together to come up with an improvement plan to ensure that innovative treatments are supplied promptly to patients.” “We are not saying that we will look at RWE unconditionally.
We prioritize RCTs or equivalent data and consider alternatives when this is not possible.
We are well aware that the level of data evidence is very important, as is the opinion of the industry.
We will continue to listen to the stakeholders' views on the burden of administrative costs on industry and the establishment of a national registry.”
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










