- LOGIN
- MemberShip
- 2025-12-21 12:33:30
- Fasenra's reimb application passes DREC review
- by Lee, Tak-Sun | translator Kim, Jung-Ju | 2024-03-11 05:55:12
Fasenra, the last of 3 antibody drugs used for severe asthma to apply for reimbursement in Korea, has now passed the Drug Reimbursement Evaluation Committee (DREC) stage, increasing the likelihood of its reimbursement.
The drug, like Nucala, is seeking reimbursement through the risk-sharing arrangement (RSA) scheme.
The industry is paying attention to Fasenra’s progress because its same-class drug Cinqair has been reimbursed through the general listing process and Fasenra is going through the RSA process Nucala went through.
The Health Insurance Review and Assessment Service announced on the 7th that it passed the applications for the reimbursement of new drugs such as Fasenra, Idelvion, and reimbursement extension of Brukinsa at the 3rd 2024 Drug Reimbursement Evaluation Committee.
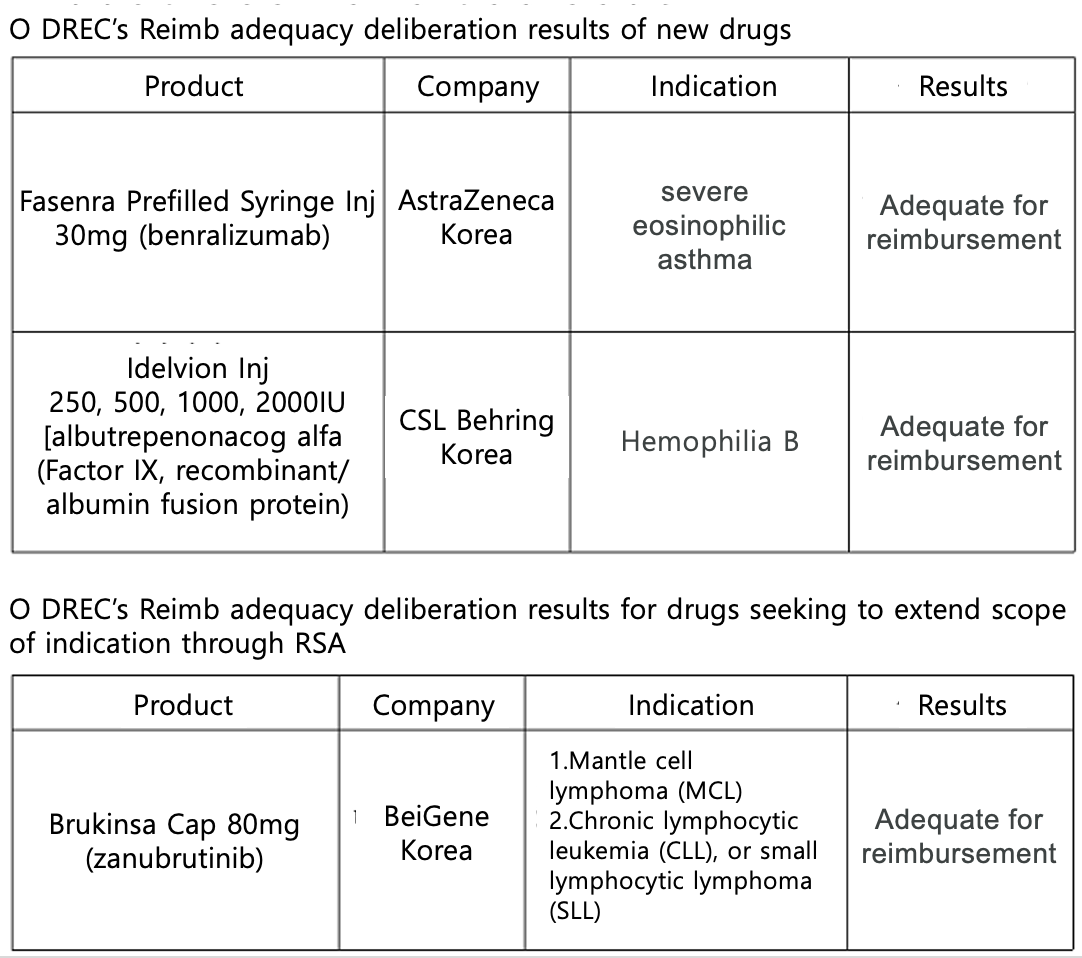

Fasenra had received a non-reimbursement decision at the previous DREC meeting that was held in September last year.
Therefore, the company passed HIRA’s review in its second attempt.
In particular, Fasenra is receiving attention for the fact that 2 other drugs with the same mechanism of action have already been approved.
In October last year, 2 interleukin (IL)-5 antagonists used for severe eosinophilic asthma, like Fasenra, were granted reimbursement.
The 2 other drugs are Cinqair (reslizumab, Teva-Handok) and Nucala (mepolizumab, GSK).
Cinqair was approved through the regular reimbursement process, and Nucala was approved through the RSA process.
This is the first time a drug in the same class has been approved through two different reimbursement schemes.
In this sense, DREC’s recognition of Fasenra's reimbursement adequacy is even more unusual.
The fact that the company is undergoing the reimbursement process through the RSA track is not exceptional, as latecomers can also apply for RSA since 2020, but no drug has attempted reimbursement listing through the RSA track after a same-class drug was listed through the general track.
This is because if a drug in the same class is listed through the general listing process, it is disadvantageous for the latecomer to apply for RSA.
However, since one of the drugs -Nucala – was listed through the RSA scheme, it is likely that the company referred to Nucala’s case when applying for Fasenra’s reimbursement through the RSA track.
Moreover, as RSA applications were limited to anticancer drugs and rare diseases, Fasenra and Nucala are regarded as exceptions because they are severe chronic diseases.
However, the Health Insurance Review and Assessment Service is expected to apply RSA to drugs for severe chronic diseases for which there are no alternatives and which irreversibly cause a significant deterioration in the quality of life, such as systemic pustular psoriasis, interstitial lung disease, hereditary angioedema, and severe asthma.
At the meeting, DREC also recognized the reimbursement adequacy of CSL Behring’s ‘Idelvion Inj,’ which is used to treat hemophilia B.
As it can extend the dosing cycle by up to 3 weeks, it is expected to be in high demand if it is approved for reimbursement.
BeiGene Korea's Brukinsa Cap, which also sought to expand reimbursement, has been deemed adequate for reimbursement in Mantle cell lymphoma (MCL), Chronic lymphocytic leukemia (CLL), or small lymphocytic lymphoma (SLL).
Burkinsa was first approved reimbursement as a treatment for Waldenström’s macroglobulinemia (WM) in May last year.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










